GAMP5及计算机化系统验证相关知识ppt课件
基于GAMP5的我国制药企业计算机化系统验证的应用研究

基于GAMP5的我国制药企业计算机化系统验证的应用研究我国2010版GMP第十四章附则第19条对计算机化系统的定义:用于报告或自动控制的集成系统,包括数据输入、电子处理和信息输出。
国际上对计算机化系统的定义绝大多数是引用了PIC/S检察指南PI011-3中的定义:计算机化系统是由计算机系统和被其控制的功能或流程组成。
从以上定义中可以看出,计算机化系统不仅仅包括计算机系统本身,还包括受控的功能和过程,甚至包括系统的运行环境。
图1为计算机化系统关系图。
计算机系统是一个媒介,连接着人员与设备,有资质的且经过培训的人员可以根据计算机系统得到相关设备或工艺的实时监控信息,从而根据操作规程对计算机系统进行操作,控制具体的工艺或设备,实现最终管理。
一、计算机化系统概述计算机化系统的组成在计算机化系统的所有组成部分中,计算机系统的硬件和软件是最重要的组成部分。
其中,把计算机系统软硬件分为标准化软硬件和定制类软硬件两类。
GAMP5中又将硬件分成两类,将软件分成四类,如图2所示。
硬件分为标准硬件与定制硬件。
目前,大部分公司所使用的硬件都属于标准硬件。
硬件具体说明如表1所示。
软件分为四种类别,这四种类别的分类是指导性的,其间并没有严格的分界线。
软件具体分类说明如表2所示。
制药企业计算机化系统的类型狭义的计算机化系统指的是自动化控制系统,但是除了自动化控制系统之外,广义的计算机化系统包括了整个自动化和信息化的系统,它涵盖了一切计算机设施,从简单的I/O设施、PLC可编程逻辑控制器到综合的计算机管理信息系统等,都属于计算机化系统。
据此,制药企业常用的计算机化系统的主要类型如图3所示。
制药企业计算机化系统验证制药企业计算机化系统验证是GMP管理的一个重要组成部分,根据GMP 的要求,制药企业计算机化系统验证是通过建立文件来证明计算机化系统能够提供满足用户需求的功能,并且能够稳定工作,包括应用程序的验证(软件方面的验证)和基础架构的确认(硬件方面的确认)。
GAMP5及计算机化系统验证相关知识课件

软件
硬件 固件
操作规程与人 员
设备
控制系统
受控的功能与流程
计算机化系统
Industry Regulators行业监管机构
- Regulate to ensure safety of drugs that any of us might take!
PART 820 QUALITY SYSTEM REGULATION
质量系统规则第820部分
EMEA
• Validation: The extent of validation necessary will depend on a number of factors including the use to which the system is to be put, whether the validation is to be prospective or retrospective and whether or not novel elements are incorporated. Validation should be considered as part of the complete life cycle of a computer system. This cycle includes the stages of planning, specification, programming, testing, commissioning, documentation, operation, monitoring and modifying. 验证:验证的范围基于一组包含应用于系统的因素,无论验证是预见 性的还是回顾性的,无论有无新元素的使用。验证应该被认为是计算 机系统完整生命周期的部分。这个周期包括设计,规范,编程,测 试,调试,文档,运行,监控和修改。
GAMP5的基本概念和内容

●生命周期方法也有利推动质量源于设计(QbD)方法的推广。 (▲从产品原始设计、研发开始)
●生命周期方法是可以分划为不同的阶段和活动的。 (▲不同阶段,内容要求和不同)
(3)可增减的生命周期活动的概念。 生命周期活动内容可以根据以下三个因素增加或减少:
●系统对患者安全、产品质量和数据完整性三大要素影响的风险性。 ●系统和过程的复杂性和新颖性 ●供应商的能力 (▲从 3“性”分析和供应商方面的保障情况,决定灵活性程度)
(8)质量管理系统 QMS 内的持续改进。 (▲持续性)
(9)注重关键质量属性(CQA) (▲质量重点关键因素)
(10)注重提高 GXP 合规性的效率 (▲效率, 避免重复性工作)
(11) 注重现有文件和知识的利用 (效率,避免重复性工作,)
(12)注重可配置系统与开发模式 (▲考虑到目前大多计算机化系统是基于可配置软件包,重点在第 4 类软
●质量风险管理主要针对可能对患者安全、产品质量和数据完整性密切 有影响的关键质量属性、关键过程参数进行识别、监控和追溯,至少确保使这些 风险最终能被降低到可接受的范围。
(▲风险管理主要是根据对与患者安全、产品质量和数据完整性关系密
切的关键质量属性、关键过程参数的影响。最低目标是使风险可降低到可接受的 范围。)
另外,应该注意的是,虽然在 GAMP 中也提供一些通常性方法上的参考, 但是面对各种类型的计算机化系统,实际是上还是需要我们认真研究和了解被 验证对象及其应用过程以后,才有可能形成真正合理的可操作的验证方案。所 以如何真正理解 GAMP 的概念,根据不同的计算机化系统的特点和要求,分门 别类建立真正科学、合理和可操作的验证模式,将是一个意义重大的课题。只 有这个问题解决好了,所谓的计算机化系统验证才有可能在我国制药行业合理 地普遍展开。
个人整理_GAMP5 在仪器上地分类
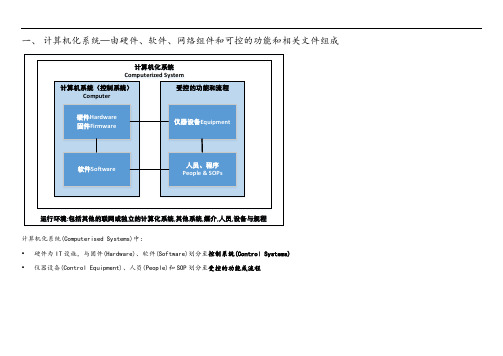
一、计算机化系统—由硬件、软件、网络组件和可控的功能和相关文件组成计算机化系统Computerized System计算机系统(控制系统)Computer受控的功能和流程硬件Hardware 固件Firmware软件Software 仪器设备Equipment人员、程序People & SOPs运行环境:包括其他的联网或独立的计算化系统,其他系统,媒介,人员,设备与规程计算机化系统(Computerised Systems)中:•硬件为IT设施,与固件(Hardware)、软件(Software)划分至控制系统(Control Systems)•仪器设备(Control Equipment)、人员(People)和SOP划分至受控的功能或流程二、GAMP5计算机系统硬件分类三、GAMP5计算机系统软件分类四、使用系统在整个生命周期实现合规与符合预定用途的通用方法1、计算机化系统生命周期●概念提出●项目实施●系统运行●系统退役2、规和验证规活动有对应的验证步骤以确认是否满足了所有的规要求。
对于大型的系统可能需要多层级的规文件,而小型的、简单的或低风险的系统则只需把几个规结合起来限可。
应该通过合适的验证步骤对规进行确认。
使用系统在整个生命周期实现合规与符合预定用途的通用方法五、USP 1058对实验仪器的分类六、GAMP5 在实验仪器里的应用及验证要求1软件不能进行配置:是指软件模块可根据需求进行配置,并不是指对仪器进行配置。
注意:有关计算机化系统确认术语的使用,特别是运行和性能确认之间的关系,在不同公司之间是不相同。
以上的比较仅仅提供一个一般的解释,而并不是强制性的。
八、 类别3:不可配置软件的方法规范基本职责供应商质量管理体系简称:QMS典型的测试包括: ● 正确的安装● 表明系统符合预定用途并按照规定的要求进行系统验收 ● 根据供应商评估和风险评估结果决定进一步测试通常由被监管公司负责必须的规和核实活动。
GMP计算机系统附录知识培训(CFDAGMP计算机化系统附录、EUGMP附录11、21PART11、GAMP5)2015.12

1
计算机化系统GMP法规要求
2 3 4
计算机化系统及数据完整性解析
基于风险评估计算机化系统验证
常见问题及讨论
1
计算机化系统GMP法规要求
1.1 计算机化系统相关法规和指南总览 1.2 CFDA《计算机化系统》附录、 EUGMP附 录11、联邦法规21章第11款电子记录;电子 签名框架结构 1.3 《计算机化系统》附录特点介绍 1.4 《计算机化系统》关键词 1.5 MHRA数据完整性定义和指南简介
1
计算机化系统GMP法规要求
(US FDA)工业指南 11部分 电子记录与电子签名‐ 范围和应用 (US FDA) 联邦法规第21篇第210 211部分,成品药 的现行生产质量管理规范 (ISPE)GAMP GPG 良好实践指南,GAMP架构下 的系列良好实践指南 (PIC/S)GMP指南,药用产品良好生产实践指南 (TGA)GMP,药用产品良好生产实践指南 (WHO)GMP 2003, Annex 4 (WHO Technical Repo rt Series, No. 908) (CFDA) GSP附录二附录三《药品经营企业计算机 系统》《温湿度自动监测》 (US FDA) 药品生产中计算机处理系统的验证指南 (February 1983)
本次培训还将结合国内外对计算机化系统
诸如EUGMP附录11,21CFRpart11,GAMP5, MHRA数据完整性指南等国际上有影响力, 有权威性的法规要求、行业标准及参考指 南进行对比介绍 由于能力、经验、水平的欠缺,一些不合 理甚至错误理解和解读的内容希望在座诸 位提出宝贵意见和建议,共同探讨合理的 解决方案,以待提高共同认知水平。
采用GMAP5方法的计算机化系统验证的生命周期文件及活动(课件)

科学技术进步
法规变更升版
实践指南生成 与应用
ISPE GAMP5 PIC/S PI011‐3检察指南 FDA Part11工业指南 CFDA 药品GMP指南
GAMP5旨在提供一种切合检察官、制药企业和供应商习惯的计算机化系统验证 及管理的方法平台,从而达到高效合规。
2/80
1
2014/6/24
目录
缩写 TM VSR ISPE GAMP QMS PLC DCS SCADA ERP LIMS MES BMS EMS CSV UPS
英文 Traceability Matrix Validation Summary Report International Society Of Pharmaceutical Engineering Good Automated Manufacturing Practice Quality Management System Programmable Logic Controller Distributed Control System Supervisory Control And Data Acquisition Enterprise Resource Planning Laboratory Information Management System Manufacturing Execution Systems Building Management System Environment Monitoring System Computer System Validation Uninterruptible Power Supply
7/80
CFDA GMP征求意见稿《计算机化系统》
第四条 应使用科学的风险评估方法来决定计算机化系统验证的范 围与程度。应当将验证看作计算机化系统“生命周期”的一个组 成部分。 第七条 软件是计算机化系统的重要组成部分。软件的使用者应当 根据风险评估的结果,对于所采用软件进行分级管理(如针对软 件供应商的审计),保证软件的编制过程符合质量保证系统的要 求。 第十条数据的输入或修改只能由经许可的人员进行。杜绝未经许 可的人员输入数据的手段有:使用钥匙、密码卡、个人密码和限 制对计算机终端的访问。
采用GMAP5方法的计算机化系统验证的生命周期文件及活动(课件)

16/80
8
2014/6/24
计算机化系统验证常见术语2
名称 可追溯矩阵 验证总结报告 国际制药工程协会 良好自动化生产实践指南 质量管理系统 可编程逻辑控制器 集散控制系统 数据采集与监视系统 企业资源计划 实验室信息管理系统 生产执行系统 楼宇管理系统 环境监视系统 计算机系统验证 不间断电源
系统是否控制不良事件或投诉的记录或报告?
系统是否支持药物安全监视?
关键系统做验证,非关键系统GEP调试即可
缩写 VMP QPP URS FS HDS SDS SMS DQ SCR SMT FAT SAT IQ OQ PQ
英文 Validation Master Plan Quality and Project Plan User Requirement Specification Function Specification Hardware Design Specification Software Design Specification Software Module Specification Design Qualification Source Code Review Software Module Test Factory Acceptance Test Site Acceptance Test Installation Qualification Operation Qualification Performance Qualification
Critical Process Parameter 关键工艺参数
Critical Quality Attribute 关键质量属性
Electronic Record; Electronic Signature 电子记录与电子签名
GAMP5:计算机化系统功能规格制定(FS)

1、功能规格(FS)通常由供应商来提供,在供应商收到URS后,对GAMP5 Ⅲ类或GAMP5Ⅳ类,供应商会从现有的产品目录中选择一款或几款可以满足URS的系统供客户选择;2、对于GAMP5 Ⅴ类软件来说,供应商会根据URS的要求开发系统,并将系统所能实现的功能写成书面文件,提交于客户审核。
3、客户审核完功能规格(FS)后,如果可以接受,对于GAMP5 Ⅲ类或GAMP5 Ⅳ类系统,供应商可以根据客户选定的型号交付系统,交付系统时应当随系统交付系统相关的文件,例如设计规格文件;4、对于GAMP5 Ⅴ类系统,需要参考下文的描述:功能规格包括系统系设计和开发文件、代码审核;4.1系统设计信息应当形成书面文件,描述如何实现“需求”。
设计信息和其他信息来源(例如用户使用手册)可以一起使用,以支持系统开发、使用和维护。
4.2设计信息和其他信息来源一起,需要保证能提供系统的概览,包括:•物理和逻辑安全措施的安排•数据流及与其他系统或其他业务流程的数据交互•软硬件的配置要求•系统开发过程需要形成书面文件•系统开发过程执行软件行业的标准流程•良好软件开发流程:系统架构和层级系统开发语言代码的使用和维护编码的标准或编码惯例系统命名惯例软件版本代码审核记录编程的程序代码开发过程形成的记录4.3对于客户订制的系统,设计信息文件和开发过程形成的文件,以及编程的程序代码构成验证交付的一部分。
5、客户开发的系统,如果会对产品质量、安全性和记录可靠性和隐私带来关键影响,应当进行代码审核,确保软件得到正确的设计和开发,可以达到使用目的。
5.1代码审核可以通过多种核实方法来实现、包括•同行复核•演练:通过模拟信号进行模拟测试•检测:由官方或第三方公司检查5.2对于客户订制的系统,同行复核、演练或IT代码SME的检测报告构成验证交付的一部分。
注:对于简单系统,可能没有专门的设计规格文件,其对应的内容可能会包含在系统手册或系统说明书中。
GMP计算机系统附录知识培训(CFDA GMP计算机化系统附录、EUGMP附录11、21PART11、GAMP5)2015.12

知识培训
(CFDA GMP计算机化系 统附录、EUGMP附录11、 21PART11、GAMP5)
质量管理部 梁强
2015.10
引言:主题说明
随着GMP意识的深入与提高,国内制药与国际 的接轨,越来越多的审计检查对制药企业使 用计算机系统有了更高、更为深入和更加专 业的检查,也逐渐变为了行业监管的重点和 缺陷整改项易发区域。 2015.05.26,CFDA正式颁布了作为GMP配套文 件—对计算机化系统专项规范的附录。该附 录要求自2015.12.01起施行。 《计算机化系统》附录明确了计算机化系统 的范围、原则、人员、验证、系统等要求。
ห้องสมุดไป่ตู้
1
计算机化系统GMP法规要求
一、原则:适用范围,系统应当验证,不增加风险 二、总则 1.风险管理 2. 人员 3.供应商与服务商 三、项目阶段 4.验证 四、运行阶段 5.数据 6.准确性检査 7.数据贮存 8.打印输出 1 计算机化系统GMP法规要求
1
计算机化系统GMP法规要求
1.2 CFDA《计算机化系统》附录明细
第一章 范围:规定了附录的应用范围 第二章 原则:提出了风险管理应当贯穿计算机 化系统的生命周期全过程 第三章 人员:使用和管理计算机化系统人员的 职责和权限 第四章 验证:针对计算机化系统的特殊性提出 了对于验证的原则要求 第五章 系统:针对计算机化系统安装、使用、 变更、备份等提出要求 第六章 术语:对附录中出现的术语进行说明
EUGMP附录11 目录
9.审计追踪(査账索引) 10.变更控制与配置管理 11.定期评价 12.安全性 13.突发事件管理 14.电子签名 15.批放行 16.业务连续性 17.归档 五、术语表
个人整理-GAMP5-在仪器上的分类资料

个人整理-G A M P5-在仪器上的分类一、计算机化系统—由硬件、软件、网络组件和可控的功能和相关文件组成计算机化系统Computerized System计算机系统(控制系统)Computer受控的功能和流程硬件Hardware 固件Firmware软件Software 仪器设备Equipment人员、程序People & SOPs运行环境:包括其他的联网或独立的计算化系统,其他系统,媒介,人员,设备与规程计算机化系统(Computerised Systems)中:•硬件为IT设施,与固件(Hardware)、软件(Software)划分至控制系统(Control Systems)•仪器设备(Control Equipment)、人员(People)和SOP划分至受控的功能或流程四、使用系统在整个生命周期实现合规与符合预定用途的通用方法1、计算机化系统生命周期●概念提出●项目实施●系统运行●系统退役2、规范和验证规范活动有对应的验证步骤以确认是否满足了所有的规范要求。
对于大型的系统可能需要多层级的规范文件,而小型的、简单的或低风险的系统则只需把几个规范结合起来限可。
应该通过合适的验证步骤对规范进行确认。
使用系统在整个生命周期实现合规与符合预定用途的通用方法五、USP 1058对实验仪器的分类六、GAMP5 在实验仪器里的应用及验证要求七、传统的确认语与GAMP5活动之间的关系1软件不能进行配置:是指软件模块可根据需求进行配置,并不是指对仪器进行配置。
注意:有关计算机化系统确认术语的使用,特别是运行和性能确认之间的关系,在不同公司之间是不相同。
以上的比较仅仅提供一个一般的解释,而并不是强制性的。
八、 类别3:不可配置软件的方法规范基本职责供应商质量管理体系简称:QMS典型的测试包括:● 正确的安装● 表明系统符合预定用途并按照规定的要求进行系统验收● 根据供应商评估和风险评估结果决定进一步测试 通常由被监管公司负责必须的规范和核实活动。
基于GAMP 5的计算机化系统生命周期管理实践

基于GAMP 5的计算机化系统生命周期管理实践摘要本文结合国内外制药行业计算机化系统相关规范和指南,从计算机化系统全生命周期管理的角度详细探讨了在计算机系统各生命周期的管理办法及控制措施,为制药企业真正实现计算机化系统管理和数据可靠性的落实提供参考。
本文将从计算机化系统的概念的提出、项目实施、系统运行和系统退役生命周期四个阶段来具体阐述如何对计算机化系统进行全生命周期管理,并保证数据的完整性于真实性。
关键词:计算机化系统生命周期管理数据完整性电子签名目录一、计算机化系统的相关定义 (2)1.计算机化系统 (2)2.计算机软件、硬件 (2)3.基础架构 (2)4.集成式控制系统 (3)5.独立系统 (3)6.电子数据与电子签名 (3)7.数据审计追踪 (3)二、计算机化系统质量风险管理 (3)三、计算机化系统的分类及其验证方法 (4)四、计算机化系统生命周期管理 (5)4.1供应商的管理 (5)4.2计算机化系统移交管理 (6)4.3计算机化系统安全管理 (7)4.4系统备份和恢复的管理 (8)4.5计算机化系统定期审查管理 (9)4.6计算机化系统退役管理 (9)六、旧系统计算机化系统的管控 (9)引言国家食品药品监督管理总局于2015年5月26日发布了《药品生产质量管理规范(2010年修订)》附录《计算机化系统》,并于2015年12月1日正式开始执行,附录的实施进一步的规范了制药行业计算机化管理及数据的管控,使用自控系统生产的药品具有更好的一致性和可靠性,使药品质量更加稳定和可靠。
附录虽然对药品生产质量管理中的计算机化系统有了基本的要求,但并未对各阶段如何进行具体实施进行描述,尤其是大多数企业存在大量老旧设备如何实现计算机化系统管理、对具有计算机化系统功能设备的供应商如何管理等问题没有明确的指导,使得大部分企业比较迷茫。
本文结合国际制药工程协会(ISPE)的GAMP5、美国联邦法规全书(CFR)-第21篇-食品药品等指南和规范,结合国内制药行业的基本现状,详细阐述了全生命周期的计算机化系统管理方法,能够指导药企在能够满足GMP的《计算机化系统》附录的同时,也能够与国际先进理念接轨。
GAMP5遵从GxP计算机化系统监管的风险管理方法

果
软硬件类别
2 4 大硬件 大软件
硬件 硬件类别1——标准硬件组件
• 实验室大部分的硬件组件属于标准硬件组件 • 制造商或者供应商的详细信息及版本号都应以文件形式存在 • 应验证组件的安装和连接方式的正确性 • 需记录组件模块、版本号和序列号 • 需对这类硬件进行配置管理和变更控制管理
5 大关键概念
基于科学的质量风险管理
依据以下方面选择合适的生命周期活动: • 基于明确的流程理解与系统对系统安全、产品质量和数据完整性的潜在影响来进行质量风险
管理 • 系统控制或监测关键生产过程参数应可以追溯至关键质量属性,并最终可追溯到制造系统相
关的法规条例 • 定性或定量的来识别和管理风险 • 制定风险控制措施将风险降低到可接受水平 • 在日常运行期间对所实施的风险控制措施进行监控以及确保措施有效性
指南文件结构解读
6 3 大关键术语 大关键人物
系统所有者
• 指对系统的有效性、系统的支持和维护,以及存储在系统上的数据安全性负最终责任的人 • 通常为负责系统支持和维护部门的领导 • 职责:根据适用的SOP来确保计算机化系统进行支持和维护
指南文件结构解读
6 3 大关键术语 大关键人物
主题专家(SME)
用户需求
URS 内容
操作需求 功能需求 数据需求 技术需求 界面需求 环境需求 性能去修 有效性需求 安全防护需求 维护需求 监管需求 电子数据迁移 应遵守的约束条件 生命周期需求
用户需求
URS 内容
质量关键需求 − 应具体说明适用的GxP监管条例,并且强调其中和患者安全、产品质量以及数据完整性相关的 方面。 − URS中不应该简单写 “符合21 CFR Part 11” 、“符合GMP”,而应明确说明URS要用系统中 什么功能来管理和患者安全、产品质量以及数据完整性相关的风险
GAMP5:计算机化系统验证--4Q

GAMP5:计算机化系统验证--OQ、PQ1、系统概览和数据系统完成交付后,需要辨别系统的软硬件组件,并创建系统软硬件列表,列表内的信息应当在IQ阶段进行核实;绘制系统软硬件组件和系统的数据流示意图,以及绘制不同权限集角色的权限清单,方便质量管理人员或监管部门查看,确保不同角色之间没有利益冲突;说明:为了有效完成上述任务,可以对系统进行预安装,预安装帮助我们在正式安装前了解系统;2、设计确认系统交付之后,根据URS、FS、DS的内容对系统进行设计确认或设计审核;设计确认对简单的GAMP5 Ⅲ类或GAMP5 Ⅳ类系统,如果系统是整体交付的,不需要根据设施条件再进行组装的,设计确认或设计审核实际上是没有多大帮助的,因为之前对FS的审核已经涵盖这些内容。
对于复杂的系统,不管是不是属于GAMP5 Ⅴ类系统,最好都要执行设计确认或设计审核,确保系统能够被正确的安装或组装,方便将来的使用和维护。
3、安装或组装在这个阶段执行正式的安装或组装。
为了确保系统能成功的安装或组装,推荐在之前的预安装的过程中起草一份安装和安装验收指南。
安装和安装验收指南用于详细描述系统安装或组装的步骤,如果供应商提供的安装或组装说明足够详细,就不需要再起草这份文件了。
记录安装过程是必要的,可以使用带有说明性文字的截屏、照片或图纸的形式来记录安装过程。
安装记录应当在IQ阶段进行核实。
注:本部分描述的任务也可以在IQ阶段执行,然而在实施安装确认前,推荐在之前的预安装过程中起草一份安装和安装验收指南。
4、配置设置为了确保系统能被正确的配置,推荐在之前的预安装过程中起草一份配置设置指南。
配置设置指南用于详细描述配置系统设置步骤,如果供应商提供的配置设置说明足够详细,就不需要在起草这份文件了。
记录系统的配置过程是良好的管理实践,可以使用带有说明性文字的截屏、照片或图纸的形式来记录配置设置过程。
配置设置记录应该在IQ阶段进行核实。
首次的配置设置记录或报告最迟应当在OQ报告签署前得到批准。
个人整理-GAMP5-在仪器上的分类

一、计算机化系统—由硬件、软件、网络组件和可控的功能和相关文件组成计算机化系统Computerized System计算机系统(控制系统)Computer受控的功能和流程硬件Hardware 固件Firmware软件Software 仪器设备Equipment人员、程序People & SOPs运行环境:包括其他的联网或独立的计算化系统,其他系统,媒介,人员,设备与规程计算机化系统(Computerised Systems)中:•硬件为IT设施,与固件(Hardware)、软件(Software)划分至控制系统(Control Systems)•仪器设备(Control Equipment)、人员(People)和SOP划分至受控的功能或流程二、GAMP5计算机系统硬件分类三、GAMP5计算机系统软件分类四、使用系统在整个生命周期实现合规与符合预定用途的通用方法1、计算机化系统生命周期●概念提出●项目实施●系统运行●系统退役2、规范和验证规范活动有对应的验证步骤以确认是否满足了所有的规范要求。
对于大型的系统可能需要多层级的规范文件,而小型的、简单的或低风险的系统则只需把几个规范结合起来限可。
应该通过合适的验证步骤对规范进行确认。
使用系统在整个生命周期实现合规与符合预定用途的通用方法五、USP 1058对实验仪器的分类六、GAMP5 在实验仪器里的应用及验证要求1软件不能进行配置:是指软件模块可根据需求进行配置,并不是指对仪器进行配置。
注意:有关计算机化系统确认术语的使用,特别是运行和性能确认之间的关系,在不同公司之间是不相同。
以上的比较仅仅提供一个一般的解释,而并不是强制性的。
八、 类别3:不可配置软件的方法规范基本职责供应商质量管理体系简称:QMS典型的测试包括: ● 正确的安装● 表明系统符合预定用途并按照规定的要求进行系统验收 ● 根据供应商评估和风险评估结果决定进一步测试通常由被监管公司负责必须的规范和核实活动。
GAMP5:计算机化系统的软硬件类别

1、目的对系统的软硬件组件进行分析和归类。
通过分类、风险评估及供应商评估结合起来,为系统确定一个合适的系统生命周期管理策略。
2、GAMP类别的使用一般来说,定制软硬件出现故障或存在缺陷的风险比标准软硬件高,这是因为定制软硬件标准软硬件复杂,且使用定海软硬件的用户缺乏经验。
当与风险评估和供应商评估结合起来时,软硬件分类可以是有效的质量风险管理方法的一部分。
各组件的被关注程度大小如下所示:定制>可配置>不可配置>基础架构软硬件分类有助于把精力集中在风险最大的地方:两种主要的使用类别的方法:整体系统评估在整体系统的层面上,可以根据主要组件的类别来确定对供应商评估的方法,以及系统生命周期可交付物的选择。
根据类别和对系统影响评估,可以确定是否需要对供应商进行现场审计。
详细的组件评估在组件层面上,在和其他的风险管理工具结合在一起使用时,以及考虑到系统的复杂性和规模时,软硬件类别也是非常有用的。
大多数计算机化系统由多种组件构成,对这些组件分类可以用来确定所需的系统生命周期活动。
例如:色谱系统管理系统可能包括计算机系统数据、在操作系统上运行的控制软件、数据库管理器,以及基于固件的子系统如泵控制器,自动注射器,和圆柱形加热器。
子系统的复杂程度可能远远低于计算机系统数据和在操作系统上运行的控制软件,因此,在计算机系统的应用上倾注比咋子系统上更多的投入是合适的。
一个可编程逻辑控制器或者其他控制器可能是整个工艺设备的一部分,而正确操作方式的验证可能是整体设备验证的一部分。
在这样的情形下,对各个组件类别的详细分析是不必要的。
3、软件类别3.1 类别1---基础设施软件基础设施中的元件组合在一起,形成一个运行与支持应用程序和服务的完整环境。
包括两种类型:1)成熟的或市场上可以买到的分层式软件:在此类软件的控制下开发出一系列应用程序,包括操作系统、数据库管理、编程语言、中间软件、梯状逻辑解释程序、统计编程工具和电子数据表包。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Different Terminology不同的术语
• Computerised Systems计算机系统 • Automation Systems自动化系统 • Control Systems控制系统 • Control Equipment控制设备 • Data Management systems 数据管理系统
PART 820 QUALITY SYSTEM REGULATION 质量系统规则第820部分
EMEA
• Validation: The extent of validation necessary will depend on a number of factors including the use to which the system is to be put, whether the validation is to be prospective or retrospective and whether or not novel elements are incorporated. Validation should be considered as part of the complete life cycle of a computer system. This cycle includes the stages of planning, specification, programming, testing, commissioning, documentation, operation, monitoring and modifying. 验证:验证的范围基于一组包含应用于系统的因素,无论验证是预见 性的还是回顾性的,无论有无新元素的使用。验证应该被认为是计算 机系统完整生命周期的部分。这个周期包括设计,规范,编程,测 试,调试,文档,运行,监控和修改。
SFDA:药品生产质量管理规范(征求意见稿)
Introduce 简介
GAMP5( Good Automated Manufacturing Practice -Rev5) GAMP是由国际制药工程协会(ISPE)主编的实践指南。自90年代以来,不断 改版的良好自动化生产实践指南被广泛使用并得到国际监管部门的公认。它是 计算机化系统验证的指导方针。GAMP5是GAMP的第5版本。
EU countries) (欧洲药品管理局‐包括 MHRA 英国药管局和其它 欧盟国家的对等机构)
NIHS (National Institute of Health
FDA (Food and Drug
Science)(国立环境健康科学 研究院)
Administration)
食品与药物监督管理局
MCC (Medicine Control Council) 药品控制委员会
- All have the power to refuse imports if their regulations are not met.
-如不符合管理规定,任何人都有权拒绝。
SFDA
MHRA
(Chinese
(Medicines and Healthcare Products Regulatory Agency ‐ was previously the MCA) (药品及保健产
计算机化系统 由硬件、软件、网络组件和可控的功能和相关文件组成
软件
硬件 固件
操作规程与人 员
设备
控制系统
受控的功能与流程
计算机化系统
Industry Regulators行业监管机构
- Regulate to ensure safety of drugs that any of us might take! -通过管理保证我们任何人都可能用到的药品的安全
Computerised System: A system including the input of data, electronic processing and the output of information to be used either for reporting or automatic control 计算机系统:系统中包括数据输入,电子化处理和用于报告或自控的信息输出 SFDA: Good Manufacturing Practice for pharmaceutical products (Draft for comment)
品管理局‐前身为药品监督局)
FDA中国的 FDA)
EMEA (European Medicines Evaluation Agency ‐includes MHRA and
HC‐SC (Health Canada – Sante Canada)加拿 大卫生部
equivalents from other
TGA (Therapeutic Goods
Administration) 治疗产品管理局
US FDA
• Automated processes. When computers or automated data processing systems are used as part of production or the quality system, the manufacturer shall validate computer software for its intended use according to an established protocol. All software changes shall be validated before approval and issuance. These validation activities and results shall be documented. 自动化过程。当计算机或自动数据处理系统做为生产或质 量系统的一部分时,制造商需要验证计算机软件系统是按 照预先设计使用的。所有软件变更在准许使用前是可验证 的。这些验证的活动和结果应该被文档记录。
GAMP5及计算机化系统验证相关知识
Austar Promotesod Automated Manufacturing Practice) 良好自动化生产实践指南
A Risk Based Approach to Compliant GxP Computerised System
