第一节元素周期表第二课时课件
合集下载
第一节元素周期表(共40张PPT)
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
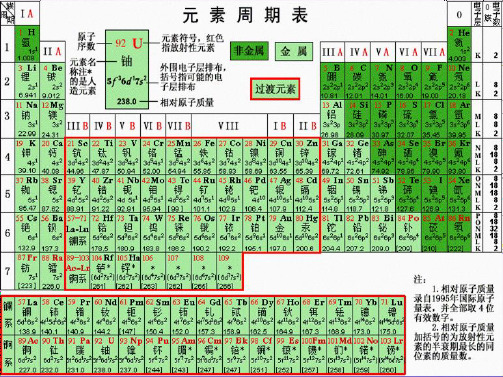
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
51元素周期表(精品课件 ppt--高中化学

o (3)表中能形成两性 氧化物的元素是 ________(填名称),分 写出 元素的 氧化物与⑥、⑨最高价氧化物的水化物反 的 化学方程式: _______________________
o (4) 一个 方案,比 ⑦、⑩ 氧化性的强弱:
o ____________________________
o (2) 跟水起 烈反 ,放出________色 气体,同 使滴有紫色石蕊 液的溶液 ________色,因 ____________________________ ___________(写出离子方程式)。
o (3)碳酸 的水溶液使酚 液 ________色,因 ____________________________ ____________________________ ________________(用离子方程式表示 )。
o 三、核素 o 1.原子 o (1)原子 构:
o (2)有关粒子 的关系 o ① 量数(A)=________+________; o ②中性原子: 子数=________=
________;
o ③阳离子: 子数=核外 子数+ ________;
o ④阴离子: 子数=核外 子数- ________。
o A. 子数、中子数 o B. 子数、最外 子数 o C.中子数、最外 子数 o D.最外 子数、 量数 o 答案:B
o 2.(2008·四· 川高考)下列叙述中正确的是 o ()
o A.除零族元素外,短周期元素的最高化合价 在数 上都等于 元素所属的族序数
o B.除短周期外,其他周期均有18种元素 o C.副族元素中没有非金属元素 o D.碱金属元素是指第ⅠA族的所有元素 o 答案:C
o ③元素:具有相同________的同一 ________的 称。
o (4) 一个 方案,比 ⑦、⑩ 氧化性的强弱:
o ____________________________
o (2) 跟水起 烈反 ,放出________色 气体,同 使滴有紫色石蕊 液的溶液 ________色,因 ____________________________ ___________(写出离子方程式)。
o (3)碳酸 的水溶液使酚 液 ________色,因 ____________________________ ____________________________ ________________(用离子方程式表示 )。
o 三、核素 o 1.原子 o (1)原子 构:
o (2)有关粒子 的关系 o ① 量数(A)=________+________; o ②中性原子: 子数=________=
________;
o ③阳离子: 子数=核外 子数+ ________;
o ④阴离子: 子数=核外 子数- ________。
o A. 子数、中子数 o B. 子数、最外 子数 o C.中子数、最外 子数 o D.最外 子数、 量数 o 答案:B
o 2.(2008·四· 川高考)下列叙述中正确的是 o ()
o A.除零族元素外,短周期元素的最高化合价 在数 上都等于 元素所属的族序数
o B.除短周期外,其他周期均有18种元素 o C.副族元素中没有非金属元素 o D.碱金属元素是指第ⅠA族的所有元素 o 答案:C
o ③元素:具有相同________的同一 ________的 称。
元素周期表课件.ppt

__一_种__原__子__。(符号: __ZA__X___)
A Z
Xmn+的含义:X_元__素_符__号__
A__质_量__数__
Z__质__子__数____ n_离__子__所_带__电_荷__数__
m__分__子_中__所__含_原__子_数__目____。
元素 符号
原子(即核 素)符号
原子 名称
电子层 K L
电子层上最多
容纳的电子数 2
8
M N…
18 32 …
2×12 2×22 2×32 2×42 …
2n2
(1)各电子层最多容纳_______个电子;
(2)最外层电子数不超过__8__个电子(K层 为最外层时不超过_____2个);
18
(3)次外层电子数不超过______个电子; (4)核外电子总是尽先排布在能量_较__低_ 的电子层,然后由里向外,依次排布在 能量逐步升_高____的电子层。
第一节 元素周期表 (第一课时)
原子的构成
核外电子 每个电子带一个单位负电荷
原子
质子 每个质子带一个单位
原子核
正电荷
பைடு நூலகம்
中子 不显电性
三、核素
1、质量数 原子的质量主要集中在_原__子__核__上,质子和
中子的相对质量都近似为_1__,如果忽略电子质 量,将核内所有_质__子__和__中_子__的__相__对__质_量__近__似__值__ 加起来所得的数值就是该原子的质量数。
随堂练习
3、以下互称为同位素的是( C )
A、金刚石和石墨 B、CO和CO2 C、D和T D、1H216O和2H218O
二、原子核外电子的排布
1、电子层的划分
A Z
Xmn+的含义:X_元__素_符__号__
A__质_量__数__
Z__质__子__数____ n_离__子__所_带__电_荷__数__
m__分__子_中__所__含_原__子_数__目____。
元素 符号
原子(即核 素)符号
原子 名称
电子层 K L
电子层上最多
容纳的电子数 2
8
M N…
18 32 …
2×12 2×22 2×32 2×42 …
2n2
(1)各电子层最多容纳_______个电子;
(2)最外层电子数不超过__8__个电子(K层 为最外层时不超过_____2个);
18
(3)次外层电子数不超过______个电子; (4)核外电子总是尽先排布在能量_较__低_ 的电子层,然后由里向外,依次排布在 能量逐步升_高____的电子层。
第一节 元素周期表 (第一课时)
原子的构成
核外电子 每个电子带一个单位负电荷
原子
质子 每个质子带一个单位
原子核
正电荷
பைடு நூலகம்
中子 不显电性
三、核素
1、质量数 原子的质量主要集中在_原__子__核__上,质子和
中子的相对质量都近似为_1__,如果忽略电子质 量,将核内所有_质__子__和__中_子__的__相__对__质_量__近__似__值__ 加起来所得的数值就是该原子的质量数。
随堂练习
3、以下互称为同位素的是( C )
A、金刚石和石墨 B、CO和CO2 C、D和T D、1H216O和2H218O
二、原子核外电子的排布
1、电子层的划分
《元素周期表》课件ppt课件

观察,可得 A是氮元素
B是 氧元素
C是
二、元素的性质与原子结构
1.碱金属元素
元素 元素 名称 符号
核电 荷数
最外层电子 电子
数
层数
原子结构
相同点
递变性
锂
碱
金 属
钠
元
素钾
铷
Li
3
Na
11
K
19
Rb
37
1
2
最
1
3
1
外 层 都 有
核电 原 电子 子 荷层 半 数数 径
1
4
个
逐逐 逐
电
渐渐 渐
子
增增 增
1
原子 序数
6
13 34 53 88
周期 2 3 4 5 7
族 IVA IIIA VIA VIIA IIA
课 堂 练
4.下列各表为周期表的一部分(表中为 原子序数),其中正确的是(D )
习 (A)
(B)
234
2
11
10 11
19
(C) 6
18 19
(D) 67
11 12 13
14
24
31 32
课 堂 5、元素X的原子获得3个电子或元素Y的原 练 子失去2个电子后,它们的电子层结构与 习 氖原子的电子层结构相同。X、Y两种元
H、Be 、 Al
。
族序数等于周期序数2倍的元素
有: C S
。
周期序数=族序数2倍的有: Li、Ca
。
课 堂 7. A、B、C是周期表中相邻的三种元素, 练 其中A、B是同周期,B、C是同主族。此三 习 种元素原子最外层电子数之和为17,质子数
元素周期表第二课时ppt课件

完整版ppt课件
21
2、卤素单质与氢气反应
H2+F2=2HF 暗处反应爆炸;HF很稳定 H2+Cl2=2HCl 光照或点燃;HCl较稳定
H2+Br2=2HBr 加热500℃ ,HBr不稳定
H2+I2 2HI 需不断加热,HI同时分解
F2 Cl2 Br2 I2
剧烈程度: 逐渐减弱
生成氢化物的稳定完整版性ppt课:件 逐渐减弱
22
3、卤素单质间的化学性质
P9 实验1-1
实验
现象
离子方程式
1、饱和氯水 与NaBr溶液
2、饱和氯水 与KI溶液
3、溴水与KI 溶液
溶液分上下两层, 下层变为橙红色
2Br-+Cl2= Br2+2Cl-
溶液分上下两层, 下层变为紫红色
2I-+ Cl2= I2+2Cl-
溶液分上下两层, 2I-+ Br2 =
锂 Li 3 银
钠 Na K
钾 Rb
11
19
37
白逐
色、 渐
柔
增 大
软
铷 Cs
55 略带 完金整版色ppt课件
逐 低逐 渐渐 降降 低
14
例:已知NaOH为强碱、Mg(OH)2为 中强碱、 Al(OH)3为两性氢氧化物,则 Na、Mg、Al的金属性强弱顺序如何?
金属性 Na〉Mg〉 Al
比较元素的金属性强弱有哪些方法?
1.相似性:
最外层上都只 有一个电子
化学性质相似
1) 都易失电子表现强还 原性
2) 化合物中均为+1价
核电荷数
2.递变性:
电子层数
原子半径
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钠
剧烈燃烧,黄色火焰
反应剧烈,轻微爆炸 反应剧烈,熔成小球
铷和铯与水反应有怎样的现象呢?
3.思考与交流: 通过回忆和观察钠和钾 的实验,思考并讨论钠和钾的性质有什么 相似性和不同。你认为元素的性质与它 们的原子结构有关系吗?
元素的化学性质主要决定于原子 核外最外层电子数,同时与原子半径 也有密切关系。
高一化学必修2多媒体教学课件
第一章 第一节《元素周期表》
★思考与交流: 元素周期表为什么把Li、Na、K等元素 编在一个族呢? 它们的原子结构和性质有什么联系呢?
★设计出探索方案:
探索方案: 理论探索(结构特点、规律) 实验探索(元素性质递变规律) 得出结论
二、元素的性质与原子结构
1.碱金属元素
113.5
184.4
0.029g
2、卤素单质与氢气反应
H2+F2=2HF 暗处反应爆炸;HF很稳定 H2+Cl2=2HCl 光照或点燃;HCl较稳定
H2+Br2=2HBr 加热500℃ ,HBr不稳定
H2+I2
2HI 需不断加热,HI同时分解
F2 Cl2 Br2 I2
剧烈程度: 逐渐减弱 生成氢化物的稳定性: 逐渐减弱
属
元
铷
Rb
37
+37 2 8 18 8 1
1
5
0.248
素
铯
Cs
55
+55 2 8 18 18 8 1
1
6
0.265
通过观察碱金属的原子结构示意图,你能发现碱金属 元素的原子结构有什么共同之处吗?
碱金属元素原子结构特点:
a.共同点: 最外层都只有 1 个电子。
b.递变性:随核电荷数递增,电子层数逐
g·㎝-3 ℃
℃
0.534 180.5 1347
Na
银白色,柔软
0.97 97.81 882.9
K
银白色,柔软
0.86 63.65 774
Rb
银白色,柔软
1.532 38.89 688
Cs 略带金属光泽,柔软 1.879 28.40 678.4
碱金属在物理性质上的相似性和规律性
Li Na K Rb Cs
上述反应的产物中,碱金属元素的化合价都是 +1 。
随着核电荷数的增加,碱金属元素原子的电 子层数逐渐 增多 ,原子半径逐渐 增大 , 原子核对最外层电子的引力逐渐 减弱 。
所以,碱金属元素的性质也有差异,从锂到 铯金属性逐渐 增强 ,如它们与氧气或水反 应时,钾比钠反应 剧烈 ,铷、铯的反 应 更剧烈 。
科学探究
1.查阅元素周期表有关信息,填写下表。
1.查阅元素周期表有关信息,填写下表
元素 名称
锂
元素符 核电 号 荷数
Li 3
原子结构示 最外层 电子
意图
电子数 层数
+3 2 1
12
原子半径 nm
0.152
钠 Na 11
+11 2 8 1
1
3
0.186
碱
金钾
K
19
+19 2 8 8 1
1
4
0.227
通过大量实验和研究,人们得出了如下结论:
碱金属元素原子的最外层都有1个电子,它们的化
学性质彼此 相似 ,它们都能与 氧气 等非金属单
质以及 水 反应。
试写出锂钠钾与氧气和水反应的化学方程式
2Li+O2 2Li2O 2Na+O2 Na2O2 k+O2 KO2 2Na+2H2O 2NaOH+H2↑ 2k+2H2O 2KOH+H2↑ 通式:2R + 2 H2O = 2 ROH + H2↑
小结:碱金属元素原子结构与性质的关系
Li Na K Rb Cs
相似性
最外层电子数为1,易失电 子,金属性、还原性强
核电荷数逐渐 增多 。 递
变
电子层数逐渐 增加 ,原子半径逐
规
渐 增大 。
律
金属单质的金属性逐渐 增强 。
碱金属的主要物理性质
碱金属 单质
颜色和状态
Li
银白色,柔软
密度 熔点 沸点
2、下列关于铯及其化合物的说法中,不 正确的是( C )
A、 氢氧化铯是一种强碱,易溶于水
B、 铯与水反应十分剧烈,甚至发生爆炸
C、碳酸铯用酒精灯加热可以生成氧化铯 和CO2 D、硫酸铯、碳酸铯、硝酸铯都是易溶于 水
2、卤族元素——F Cl Br I (VIIA族)
+9 2 7 +17 2 8 7 +35 2 8 18 7 +53 2 818 18 7
F
Cl
Br
I
根据结构推测它们在化学性质上 表现的相似性和递变性。
2.卤族元素
+9 2 7
+17 2 8 7 +35 2 8 18 7 +53 2 818 18 7
F
Cl
Br
I
原子结构 决定 性质
相同点: 最外层都有7个电子 易得一个电子
不同点: 核电荷数递增 电子层数递增 原子半径依次增大
得电子能力逐渐减弱 氧化性逐渐减弱
Cl2
逐 黄绿色
气体
渐 深棕色
加 Br2
液体
密1.69 度g/L 逐 3.124
g/L
渐 3.119 增 g/cm3
熔 -219.6 点 逐-101 渐 升7.2
沸 -188.1 点 逐 -34.6 渐 增 58.78
与水反应 226cm3 4.16g
I2
深 紫黑色
固体
大 高 大 4.93
g/cm3
3.卤素单质间的置换反应
实验1-1 完成下列实验,观察现象。写出有关反应的化学方程式。
实验
现象
1、将少量氯水分别加入 溶液分上下两
盛有NaBr溶液和KI溶液 层,下层前者
的试管中,用力振荡后 加入少量四氯化碳,振 荡,静置。
渐 增多 ,原子半径逐渐 增大 。
2.实验:
(1)Na、K与氧气反应进行对比
(2)Na、K与水反应进行对比
图1-3 钾在空气中燃烧
图1-4 钾与水反应
图1-4 钠与水反应
2.实验:
(1)Na、K与氧气反应进行对比
(2)Na、K与水反应进行对比
根据实验现象填写下表:
与氧气反应 与水反应
钾
更剧烈,紫色火焰
颜色 均为银白色(Cs略带金色)
相
硬度
似
密度
柔软 较小
性 熔沸点
较低
导电导热性
很好
递 变 性
密度变化 熔沸点变化
逐渐增大(K特殊) 单质的熔沸点逐渐降低
练习
1、下列叙述正确的是( BC ) A、 原子半径Li > Na > K > Rb > Cs B、 核电荷数Li < Na < K C、 电子层数Li < Na <K D、最外电子数都是1个,易得电子
结构上的相同 决定性质上的相似
(最外层均为7个电子) (回忆氯气的性质)
(1)都能与金属反应生成金属卤化物 (2)都能与氢气反应生成卤化氢(HX) (3)都能与水反应 (4)都能与碱反应
1、卤素单质的物理性质
单 颜色 密度 熔点 沸点 溶解度
质 和状态
℃
℃ (100g水)
F2
颜 淡黄绿色 色气体
