第23届全国高中学生化学竞赛理论(全)介绍
第23届全国高中学生化学竞赛(省级赛区)
侯跃平
098
李铮
本溪市第一中学
高三
王萍
099
曹思宇
辽河油田一高中
高三
王淑妍
100
郭鹏
沈阳东北育才学校
高三
郝俊刚
101
张芮
本溪市高级中学
高三
张丽达
102
丛小亮
大连八中
高三
姜峰
103
李尚泽
阜新市实验中学
高三
杨维秀
104
董非凡
阜新市实验中学
高三
杨维秀
105
邹婉悦
省实验中学
高三
丛丽萍
106
李海菡
朝阳一高
王远
沈阳东北育才学校科学高中部
高三
郝俊刚
081
王春然
抚顺市第二中学
高三
方正
082
海孟赫
阜新市实验中学
高三
杨维秀
083
包维宁
阜新市实验中学
高三
杨维秀
084
薛晨光
大连育明高中
高三
任长春
085
张兴旭
营口大石桥市高级中学
高三
纪艳新
086
杨裕茵
营口市高级中学
高三
韩力敏
087
辛庆利
本溪市高级中学
高三
翟娜
088
孙云龙
李晓文
沈阳东北育才学校
高三
郝俊刚
154
王仲祥
本溪桓仁县第一中学
高三
藏广清
155
尚秋年
本溪市第一中学
高三
刘惠玲
156
董彦辰
本溪市高级中学
高三
全国高中生化学竞赛大纲(理论部分)

全国高中学生化学竞赛基本要求说明:1。
全国高中学生化学竞赛分初赛(分赛区竞赛)和决赛(冬令营)两个阶段,加上冬令营后的国家队选手选拔赛共三个阶段。
本基本要求旨在明确全国初赛和决赛试题的水平,作为试题命题的依据。
国家队选手选拔赛需根据国际化学奥林匹克竞赛预备题确定,本基本要求不涉及。
2。
现行中学化学教学要求以及考试说明规定的内容均属初赛内容。
初赛基本要求在原理知识上大致与人民教育出版社《化学读本》的水平一致,但对某些化学原理的定量关系、物质结构、立体化学和有机化学上作适当补充,一般说来,补充的内容是中学化学内容的自然生长点。
初赛要求的描述化学知识以达到国际化学竞赛大纲一级水平为准,该大纲的二、三级知识均不要求在记忆基础上应用。
3。
决赛基本要求是在初赛基本要求的基础上作适当补充,描述化学知识原则上以达到国际化学竞赛二级知识水平为度,该大纲的三级知识均不要求在记忆基础上应用。
4。
本基本要求若有必要作出调整,在2001年8月中旬通告。
初赛基本要求1。
有效数字的概念。
在化学计算和化学实验中正确使用有效数字。
定量仪器(分析天平、量筒、移液管、滴定管、容量瓶等)的精度与测量数据有效数字。
运算结果的有效数字。
2。
理想气体标准状态。
理想气体状态方程。
气体密度。
气体相对分子质量测定。
气体溶解度。
3。
溶液浓度与固体溶解度及其计算。
溶液配制(浓度的不同精确度要求对仪器的选择)。
重结晶估量。
过滤与洗涤操作、洗涤液选择、洗涤方式选择。
溶剂(包括混合溶剂)与溶质的相似相溶规律。
4。
容量分析的基本概念——被测物、标准溶液、指示剂、滴定反应等。
分析结果计算。
滴定曲线与突跃的基本概念(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)不要求滴定曲线定量计算。
酸碱滴定指示剂选择的基本原则。
高锰酸钾、重铬酸钾、硫代硫酸钠为标准溶液的滴定基本反应与分析结果计算。
5。
原子结构——核外电子运动状态。
用s、p、d等来表示基态构型(包括中性原子、正离子和负离子),不要求对能级交错、排布规律作解释;不要求量子数;不要求带正负号的波函数角度分布图象。
中国化学会第23届全国高中学生化学竞赛(省级赛区) 全国通用

中国化学会第23届全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题 (20分)1-1 Lewis 酸和Lewis 碱可以形成酸碱复合物。
根据下列两个反应式判断反应中所涉及Lewis 酸的酸性强弱,并由强到弱排序。
F4Si -N(CH3)3 + BF3 → F3B -N(CH3)3 + SiF4 ; F3B -N(CH3)3 + BCl3 → Cl3B -N(CH3)3 + BF3BCl3 > BF3 > SiF4 顺序错误不给分 (2分) 1-2 (1) 分别画出BF3和N(CH3)3的分子构型,指出中心原子的杂化轨道类型。
BFFF分子构型为平面三角形,不画成平面形不给分 (0.5分) sp2(0.5分)H 3C33分子构型为三角锥形, 不画成三角锥形不给分 (0.5分) sp3(0.5分)(2) 分别画出F3B -N(CH3)3 和F4Si -N(CH3)3的分子构型,并指出分子中Si 和B 的杂化轨道类型。
CH 3H 3C H 3CFB FF B :sp3 (1分)+ (1分)CH 3H 3C H 3CFSi FFSi ,sp3d (1分)+ (1分)将BCl3分别通入吡啶和水中,会发生两种不同类型的反应。
写出这两种反应的化学方程式。
BCl3 + 3H2O = B(OH)3+ 3HCl 不配平不给分 (1分)BCl3 + C5H5N = Cl3B-NC5H5 或BCl3 + N= Cl 3N(1分)1-4 BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。
第23届全国高中学生化学竞赛暨冬令营活动纪要及试题分析

化学奥林匹克第23届全国高中学生化学竞赛暨冬令营活动纪要及试题分析王 春(中国人民大学附属中学 100080)2010年1月15日上午,由中国化学会主办、浙江省化学会与浙江大学承办的第23届全国高中学生化学竞赛暨冬令营在浙江大学隆重开营。
来自全国各省、市、自治区的194名参赛选手及各省代表队的领队、观察员、学会代表、列席代表共500余人参加了开营式。
特别值得一提的是,除香港、澳门特别行政区继续各派6名学生参加本项赛事外,西藏自治区也第一次派观察员和列席代表参加了本次盛会。
参加开幕式的领导和专家有中国化学会副理事长习复先生、浙江省人民政府副省长金德水先生、浙江省科技副主席鲁善增先生、浙江大学党委副书记郑强先生、浙江省化学会理事长郑小明先生、浙江省教育厅教研室主任刘宝剑先生等。
开幕式由浙江省化学会秘书长楼辉先生主持。
根据竞赛暨冬令营组委会安排,参赛选手于16日和17日先后参加化学理论考试、实验考试。
经过笔试成绩和实验成绩的综合计算,本届冬令营活动获奖情况最终揭晓,其中有59名同学荣获一等奖, 77名同学荣获二等奖,53名同学荣获三等奖。
另外,荣获一等奖成绩较为优秀的24位同学将进入国家集训队再次培训,并从中选拔出4位选手组成国家队,代表我国参加第42届国际化学奥林匹克竞赛。
2010年1月20日上午举行了本届活动的闭营式,在闭营式上,首先由中国化学会竞赛委员会主任、北京大学段连运教授对本届冬令营活动作了总结讲话,对此次冬令营的组织工作给予了充分的肯定,对参赛选手取得的成绩表示热烈的祝贺。
浙江省化学会秘书长楼辉宣布了竞赛获奖学生以及获奖单位名单。
参会的各位嘉宾为获奖选手和获得一等奖学校颁发了奖牌和证书。
中国化学会向本届冬令营承办单位浙江省化学会、浙江大学颁发了奖牌,另外,承办第24届全国高中学生化学竞赛暨冬令营活动的福建省化学会接受了冬令营营旗。
至此,为期6天的第23届全国高中学生化学竞赛暨冬令营鸣金收兵1 竞赛试题特点及考查知识分析试题1 无机化学 闪锌矿、软锰矿的综合利用试题特点本题以矿物综合利用的新工艺为背景,考查了考生运用基础知识理解、分析实际问题的能力。
第23届全国高中学生化学竞赛(省级赛区)
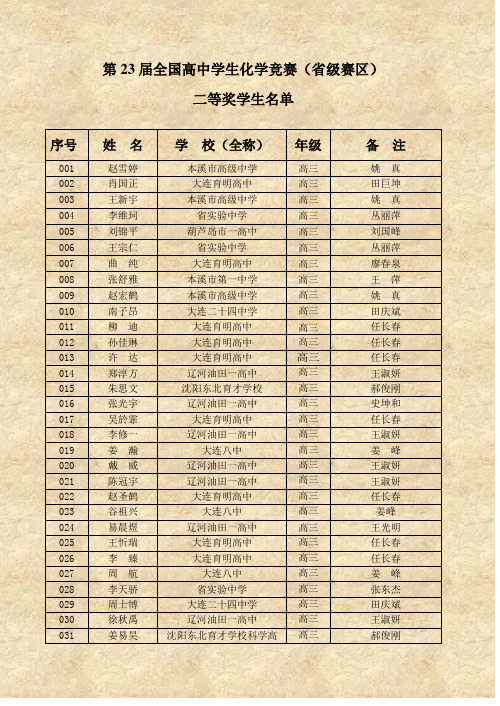
第23届全国高中学生化学竞赛(省级赛区)二等奖学生名单序号姓名学校(全称)年级备注001 赵雪婷本溪市高级中学高三姚真002 肖国正大连育明高中高三田巨坤003 王新宇本溪市高级中学高三姚真004 李维珂省实验中学高三丛丽萍005 刘锦平葫芦岛市一高中高三刘国峰006 王宗仁省实验中学高三丛丽萍007 曲纯大连育明高中高三廖春泉008 张舒雅本溪市第一中学高三王萍009 赵宏鹤本溪市高级中学高三姚真010 南子昂大连二十四中学高三田庆斌011 柳迪大连育明高中高三任长春012 孙佳琳大连育明高中高三任长春013 许达大连育明高中高三任长春014 郑淳方辽河油田一高中高三王淑妍015 朱思文沈阳东北育才学校高三郝俊刚016 张光宇辽河油田一高中高三史坤和017 吴於霏大连育明高中高三任长春018 李修一辽河油田一高中高三王淑妍019 姜瀚大连八中高三姜峰020 戴威辽河油田一高中高三王淑妍021 陈冠宇辽河油田一高中高三王淑妍022 赵圣鹤大连育明高中高三任长春023 谷祖兴大连八中高三姜峰024 易晨煜辽河油田一高中高三王光明025 王忻瑞大连育明高中高三任长春026 李臻大连育明高中高三任长春027 周航大连八中高三姜峰028 李天骄省实验中学高三张东杰029 周士博大连二十四中学高三田庆斌030 徐秋禹辽河油田一高中高三王淑妍031 姜易昊沈阳东北育才学校科学高高三郝俊刚中部032 李杨辽河油田一高中高三王淑妍033 王兆程沈阳东北育才学校高三郝俊刚035 梁宸沈阳东北育才学校高三郝俊刚035 吕文旭省实验中学高三张东杰036 周泓伊阜新市高级中学高三李吉库037 王中英大连二十四中学高三田庆斌038 孙渤钧大连二十四中学高三田庆斌039 王星翰辽河油田一高中高三王淑妍040 赵婕斯大连育明高中高三廖春泉041 姜宋阳大连八中高三姜峰042 潘长乐沈阳东北育才学校科学高中部高三郝俊刚043 邢超朝阳一高高三044 朱化雷沈阳二中高三李祥赫045 由鑫本溪市第一中学高三王萍046 冷逸民大连育明高中高三任长春047 王兴本溪市高级中学高三姚真048 耿旭辽河油田一高中高三吴英丽049 赵岩辽河油田一高中高三王淑妍050 赵雨薇辽河油田一高中高三贺桂红051 许家瑞本溪市第一中学高三刘惠玲052 孟繁昊锦州凌海一高中高三朱艳华053 金小路大连育明高中高三任长春054 张宇航锦州中学高三郭冰055 王铁胜大连二十四中学高三田庆斌056 夏成斌沈阳二中高三李祥赫057 马烈大连二十四中学高三田庆斌058 王阳省实验中学高三张东杰059 朱环本溪市高级中学高三翟娜060 宁宵大连八中高三姜峰061 郭广浩大连八中高三姜峰062 张丹阳本溪市高级中学高三翟娜063 何雨桐大连八中高三姜峰064 华思航辽河油田一高中高三王淑妍065 王婉洋本溪市高级中学高三姚真066 杨拓辽河油田一高中高三李明月067 薛康辽河油田一高中高三任秀玲068 郑洋辽阳市一高中高三069 张天博沈阳东北育才学校高三郝俊刚070 李嘉扬沈阳东北育才学校高三郝俊刚071 刁煜坤本溪市第一中学高三刘惠玲072 何天实本溪市高级中学高三姚真073 许来大连二十四中学高三王红074 金百堂鞍山一中高三邹海彬075 张晨曦本溪市高级中学高三张丽达076 于熠滔本溪市高级中学高三姚真077 刘小雨本溪市第一中学高三王萍078 杨帅大连二十四中学高三田庆斌079 李纪东阜新市实验中学高三杨维秀080 王远沈阳东北育才学校科学高中部高三郝俊刚081 王春然抚顺市第二中学高三方正082 海孟赫阜新市实验中学高三杨维秀083 包维宁阜新市实验中学高三杨维秀084 薛晨光大连育明高中高三任长春085 张兴旭营口大石桥市高级中学高三纪艳新086 杨裕茵营口市高级中学高三韩力敏087 辛庆利本溪市高级中学高三翟娜088 孙云龙本溪市高级中学高三袁慧娟089 张弘毅沈阳东北育才学校高三郝俊刚090 姜浩本溪市高级中学高三翟娜091 马梦冉大连八中高三姜峰092 党卓然阜新市高级中学高三李吉库093 杨天皓锦州中学高三宋文平094 白超本溪市第一中学高三王萍095 王羿敖葫芦岛市一高中高三刘国峰096 刘昌睿大连八中高三姜峰097 刘侃丹东二中高三侯跃平098 李铮本溪市第一中学高三王萍099 曹思宇辽河油田一高中高三王淑妍100 郭鹏沈阳东北育才学校高三郝俊刚101 张芮本溪市高级中学高三张丽达102 丛小亮大连八中高三姜峰103 李尚泽阜新市实验中学高三杨维秀104 董非凡阜新市实验中学高三杨维秀105 邹婉悦省实验中学高三丛丽萍106 李海菡朝阳一高高三107 刘鹏程本溪市高级中学高三姚真108 张广鞍山一中高三邹海彬109 李艺萌沈阳东北育才学校科学高中部高三王艳清110 崔晓彤丹东二中高三侯跃平111 魏明龙铁岭市西丰高中高三邸宝军112 庞焜元丹东二中高三侯跃平113 卢峻坤阜新市高级中学高三李吉库114 金珊沈阳东北育才学校高三宋晓友115 鲍方健本溪市第一中学高三王萍116 陈斯琦大连八中高三姜峰117 柴平一抚顺市第二中学高三方正118 袁野辽河油田一高中高三王淑妍119 徐强鞍山岫岩高中高三白日鸽120 王芃省实验中学高三张东杰121 纪军大连二十四中学高三田庆斌122 胡皓抚顺市第二中学高三方正123 史学琛省实验中学高三张东杰124 高旭鞍山岫岩高中高三白日鸽125 迟雨萌鞍山八中高三程文钰126 林楚红丹东二中高三侯跃平127 贾淳凯省实验中学高三王野128 王天野大连八中高三姜峰129 穆浩懿大连育明高中高三廖春泉130 龚桐桐阜新市实验中学高三孔艳杰131 杨子江锦州中学高三朱江132 王月鹏锦州北镇高中高三王辉133 吕俊锋沈阳二中高三李祥赫135 左云盛营口大石桥市高级中学高三纪艳新135 刘孝雷营口大石桥市高级中学高三纪艳新136 朱新宇抚顺市第二中学高三王东凯137 杨薇省实验中学高三张东杰138 夏英男省实验中学高三张东杰139 闵闯沈阳二中高三李祥赫140 吕肸沈阳二中高三李祥赫141 梁川丹东二中高三侯跃平142 卢力弛沈阳东北育才学校高三郝俊刚143 郝若诗本溪市高级中学高三翟娜144 赵傲男大连一中高三苗丽燕145 王艺博大连二十四中高三田庆斌146 隋妍本溪市高级中学高三谢新胜147 高欣本溪市第一中学高三王萍148 赵强盘锦市高中高三张娟149 陈寂华朝阳建平一高高三150 闵璨锦州北镇高中高三王辉151 孟子袁沈阳市第120中学高三宫晓娜152 刘宣辰沈阳东北育才学校高三郝俊刚153 李晓文沈阳东北育才学校高三郝俊刚154 王仲祥本溪桓仁县第一中学高三藏广清155 尚秋年本溪市第一中学高三刘惠玲156 董彦辰本溪市高级中学高三姚真157 李脊森大连庄河高中高三卢军158 黄政荣大连育明高中高三任长春159 郭辰瑶大连二十四中学高三田庆斌160 曹智大连八中高三姜峰161 张峻菲大连二十四中学高三田庆斌162刘雨祥大连辽宁师范大学附属高中高三徐彦彬163 徐泽慧大连育明高中高三于欣164 吴冠廷沈阳东北育才学校高三郝俊刚165 张诗林本溪市高级中学高三谢新胜166 李自超本溪市高级中学高三姚真167 于雪璐大连育明高中高三任长春168 孙启力大连瓦房店高中高三李淑英169 刘睿智大连八中高三姜峰170 张诗伟阜新市实验中学高三杨维秀171 王贯铁岭市昌图县第一高中高三赵学波172 周玉昭朝阳二高高三173 石国平鞍山一中高三邹海彬174 张策沈阳二中高三单智侠175 闫昊生沈阳二中高三单智侠176 陶兴源锦州中学高三朱江177 金炫佑沈阳市朝一中高三黄美兰178 潘宇省实验中学高三丛丽萍179 朱泓昱本溪市第一中学高三王萍180 刘畅本溪市高级中学高三翟娜181 滕全凯大连育明高中高三任长春182 杨佳琦阜新市高级中学高三李吉库183 田明昊阜新市高级中学高三李吉库184 杨阳沈阳市第一中学高三宋颜185 刘沈丰沈阳二中高三李祥赫186 王悦霖本溪市高级中学高三翟娜187 于多大连育明高中高三任长春188 杨琳琳大连育明高中高三任长春189 刘彦辰大连二十四中学高三田庆斌190 张子杭辽河油田一高中高三王光明191 王佳星阜新市高级中学高三李吉库192 刘松岩阜新市实验中学高三张东伟193 王放锦州北镇高中高三王辉194 宋雨萌丹东二中高三侯跃平195 李天一沈阳东北育才学校高三郝俊刚196 王昊铁岭市高级中学高三侯杰197 刘清一辽阳市一高中高一198 季旭东抚顺市第二中学高三方正199 邹光阳铁岭市西丰高中高三邸宝军200 李伯阳锦州中学高三李德刚201 匡野省实验中学高三张东杰202 司尚春葫芦岛市一高中高三203 邸赫拉锦州中学高三郭冰204 曹广谛葫芦岛市一高中高三刘国峰205 杨婧雯大连二十四中学高三田庆斌206 牛振盘锦市高中高三孙凤海207 刘新鑫大连一中高三苗丽燕208 刘嵩抚顺一中高三崔雪峰209 陈光大连庄河高中高三卢军210 殷学舟沈阳市第二十中学高三冉香彩211 汤泽宁沈阳二中高三王劲松212 谢思佳辽河油田一高中高三王淑妍213 郭安东葫芦岛市一高中高三刘国峰214 刘璇抚顺十中高三张百红215 孙敬超铁岭市调兵山第一高中高三张洪丽216 赵梓含大连育明高中高三任长春217 张洺赫营口大石桥市高级中学高三纪艳新218 于杰葫芦岛建昌县一高中高三李玉金219 从长庚大连庄河六高中高三李伟220 庄嘉漩阜新市实验中学高三杨维秀221 高超辽河油田一高中高三王淑妍222 陈东维朝阳一高高三223 张世博锦州北镇高中高三王辉224 丛庆丹东二中高三侯跃平225 盖一溦铁岭市高级中学高三关树伶226 李鸿霖丹东二中高三侯跃平227 林晗大连育明高中高三任长春228 王冀楠省实验中学高三杨宝臣229 刘正辉辽阳市一高中高三230 张晓宇葫芦岛市一高中高三李继峰231 徐梦扬大连二十四中学高三田庆斌232 洪妍盘锦市高中高三孙凤海233 傅大鹏阜新市高级中学李吉库234 曹英杰朝阳市凌源二高中高三235胥林岑沈阳市辽中县第一高级中学高三刘福全236 王清未沈阳二中高三李祥赫237 李宁锦州渤大附中高三陆喜江238 孙子晴葫芦岛市一高中高三林岩涛239 肖霄雨锦州凌海一高中高三朱艳华240 段雯瀚本溪市高级中学高三翟娜241 于振洋本溪市高级中学高三谢新胜242 颜小婷本溪市高级中学高三姚真243 赵晨大连育明高中高三任长春244 王珏大连瓦房店高中高三吴玉美徐长凤245 刘宇明抚顺一中高三崔雪峰246 赵岑辽河油田一高中高三王淑妍247 遆光宇铁岭市铁岭县高中高三宋春霞248 崔达铁岭市高级中学高三关树伶249 许杨朝阳喀左一高高三刘斌250 赵泽昊丹东东港二中高三刘斌251 高伊宁沈阳二中高三李祥赫252 代宇鑫丹东凤城一中于淑清253 李彦佐大连一中高三苗丽燕254 邓宇龙辽河油田一高中高三王淑妍255 郑心悦大连一中高三苗丽燕256 董明达葫芦岛市一高中高三刘国峰257 王天宇本溪市高级中学高三姚真258 王特本溪市第一中学高三刘惠玲259 尚宏伟本溪市第一中学高三刘惠玲260 蒋妍本溪市第一中学高三刘惠玲261 冯爱景本溪市高级中学高三翟娜262 刘浩葫芦岛市一高中高三刘国峰263 朱东旭阜新市实验中学高三杨维秀264 杨富方辽河油田一高中高三袁琳265 王云鹏辽河油田一高中高三王淑妍266 聂思闯铁岭市铁岭县高中高三宋春霞267 于浩洋省实验中学北校高三于长禄268 王璐朝阳建平实验高三269 孙笑予省实验中学高三张东杰270 张鼎森沈阳二中高三李祥赫271 阎续沈阳市第二十中学高三孙湘婕272 徐心怡沈阳二中高三单智侠273 王凡嵩锦州黑山一高中高三张翠芝274 王春阳锦州北镇高中高三王辉275 苏泽宇沈阳市第二十中学高三徐春玲276 李军锦州北镇高中高三王辉277 李梦晗辽河油田一高中高三王淑妍278 于若竹本溪市第一中学高三王萍279 王琪本溪市高级中学高三姚真280 王菲本溪市高级中学高三翟娜281 王元抚顺市第二中学高三方正282 宋捷大连二十四中学高三田庆斌283 赵景宇铁岭市高级中学高三关树伶284 杨任沈阳二中高三单智侠285 徐超丹东二中高三侯跃平286 乔俊沈阳二中高三单智侠287 陆可锦州北镇高中高三王辉288 李壮锦州凌海一高中高三朱艳华289 李想丹东二中高三侯跃平290 李弘杨锦州北镇高中高三王辉291 李达锦州北镇高中高三王辉292 高原丹东凤城一中高三赵志国293 宋晓宇大连二十四中学高三田庆斌294 吴云龙营口熊岳高级中学高三孙少杰295 雒佳铭葫芦岛建昌县一高中高三王学东296 高振羽盘锦市高中高三马也297 姜德辉抚顺一中高三崔雪峰298 黄庆宇大连金州高中高三陈向勇299 李丹阜新市实验中学高三杨维秀300 吴承晋朝阳喀左一高高三301 郭玉桐省实验中学高三杨宝臣302 郭鑫鹏省实验中学高三丛丽萍303 吴伟男沈阳二中高三单智侠304 王宏锦州北镇高中高三王辉305 孙兴凯沈阳同泽高中高三米宇琪306 戴宇泽沈阳第四中学高三姜浩307 李一澄铁岭市调兵山第二高中高三杨光明。
第23届全国高中生化学竞赛(省级赛区)试题及答案

评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题 (20分)1-1 Lewis 酸和Lewis 碱可以形成酸碱复合物。
根据下列两个反应式判断反应中所涉及Lewis酸的酸性强弱,并由强到弱排序。
F 4Si -N(CH 3)3 + BF 3 → F 3B -N(CH 3)3 + SiF 4 ;F 3B -N(CH 3)3 + BCl 3 → Cl 3B -N(CH 3)3 + BF 3BCl 3 > BF 3 > SiF 4 顺序错误不给分 (2分) 1-2 (1) 分别画出BF 3和N(CH 3)3的分子构型,指出中心原子的杂化轨道类型。
BFFF分子构型为平面三角形,不画成平面形不给分 (0.5分)sp 2(0.5分)H 3C33分子构型为三角锥形, 不画成三角锥形不给分 (0.5分)sp 3(0.5分)(2) 分别画出F 3B -N(CH 3)3 和F 4Si -N(CH 3)3的分子构型,并指出分子中Si 和B 的杂化轨道类型。
CH 3H 3C H 3CFB FF B :sp 3 (1分)+ (1分)CH 3H 3C H 3CFSi FFFSi ,sp 3d (1分)+ (1分)1-3 将BCl 3分别通入吡啶和水中,会发生两种不同类型的反应。
写出这两种反应的化学方程式。
BCl 3 + 3H 2O = B(OH)3+ 3HCl 不配平不给分 (1分) BCl 3 + C 5H 5N = Cl 3B-NC 5H 5或BCl 3 +N=Cl 3N(1分)1-4 BeCl 2是共价分子,可以以单体、二聚体和多聚体形式存在。
分别画出它们的结构简式,并指出Be 的杂化轨道类型。
第23届全国高中学生化学竞赛(省级赛区)

任长春
217
张洺赫
营口大石桥市高级中学
高三
纪艳新
218
于杰
葫芦岛建昌县一高中
高三
李玉金
219
从长庚
大连庄河六高中
高三
李伟
220
庄嘉漩
阜新市实验中学
高三
杨维秀
221
高超
辽河油田一高中
高三
王淑妍
222
陈东维
朝阳一高
高三
223
张世博
锦州北镇高中
高三
王辉
224
丛庆
丹东二中
高三
侯跃平
225
盖一溦
铁岭市高级中学
高三
王萍
116
陈斯琦
大连八中
高三
姜峰
117
柴平一
抚顺市第二中学
高三
方正
118
袁野
辽河油田一高中
高三
王淑妍
119
徐强
鞍山岫岩高中
高三
白日鸽
120
王芃
省实验中学
高三
张东杰
121
纪军
大连二十四中学
高三
田庆斌
122
胡皓
抚顺市第二中学
高三
方正
123
史学琛
省实验中学
高三
张东杰
124
高旭
鞍山岫岩高中
高三
白日鸽
125
丹东二中
高三
侯跃平
290
李弘杨
锦州北镇高中
高三
王辉
291
李达
锦州北镇高中
高三
王辉
292
高原
丹东凤城一中
第23届全国高中学生化学竞赛(省级赛区)
关树伶
226
李鸿霖
丹东二中
高三
侯跃平
227
林晗
大连育明高中
高三
任长春
228
王冀楠
省实验中学
高三
杨宝臣
229
刘正辉
辽阳市一高中
高三
230
张晓宇
葫芦岛市一高中
高三
李继峰
231
徐梦扬
大连二十四中学
高三
田庆斌
232
洪妍
盘锦市高中
高三
孙凤海
233
傅大鹏
阜新市高级中学
李吉库
234
曹英杰
朝阳市凌源二高中
高三
235
丹东二中
高三
侯跃平
290
李弘杨
锦州北镇高中
高三
王辉
291
李达
锦州北镇高中
高三
王辉
292
高原
丹东凤城一中
高三
赵志国
293
宋晓宇
大连二十四中学
高三
田庆斌
294
吴云龙
营口熊岳高级中学
高三
孙少杰
295
雒佳铭
葫芦岛建昌县一高中
高三
王学东
296
高振羽
盘锦市高中
高三
马也
297
姜德辉
抚顺一中
高三
崔雪峰
298
高三
任长春
244
王珏
大连瓦房店高中
高三
吴玉美徐长凤
245
刘宇明
抚顺一中
高三
崔雪峰
246
赵岑
辽河油田一高中
高三
王淑妍
247
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第23届全国高中学生化学竞赛理论试题第1题用传统的工艺方法从矿物中提取锰和锌存在能耗高、三废排放量大和工艺流程长等缺点。
2009年报道,采用1:1硫酸溶液同槽浸出锰结核矿[质量分数20.0)(2=MnO ϖ]和锌精矿[质量分数70.0)(=ZnS ϖ]的工艺方法提取锰和锌获得成功,对资源综合利用、节能减排和清洁生产生有重要的实际意义。
已知44.0)/(,77.0)/(223-==+++Fe Fe E V Fe Fe E θθ V ZnS S E V Mn MnO E V 265.0)/(,23.1)/(.22==+θθ。
1-1 锰结核矿和锌精矿单独酸浸结果很不理想。
请通过热力学计算,说明锰结核矿和锌精矿同槽酸浸时发生化学反应的可行性。
1-2 模拟实验发现,二氧化锰和硫化锌同槽酸浸时反应速率很慢,若在酸溶液中加入少量的铁屑则能明显使反应速率加快。
写出铁进入溶液后分别与二氧化锰和硫化锌发生化学反应的离子方程式,并简述反应速率加快的原因。
1-3 研究发现,2种矿物同槽酸浸4小时后,锰和锌的浸出率只有~80%,为了提高浸出率,在实际工艺中,须将过滤后的滤渣用四氯乙烷处理后再做二次酸浸,请简要说明四氯乙烷的作用。
1-4 锌精矿中常有部分铅共生,同槽酸浸工艺回收铅的方法之一是在浸渣中加入足量的食盐水使铅溶出,写出溶出铅的化学方程式。
第2题我国的稀土资源约占世界总量的80%,居世界第一位。
稀土元素的化学性质极其相似,分离十分困难,仅从1794年发现钇到1945年从铀裂变产物中得到钷就花了150年。
稀土萃取化学的研究为大规模分离和提纯稀土元素带来了新飞跃。
2008年国家最高科学技术奖授予化学家徐光宪,以表彰他在创立稀土串级萃取理论及其工艺方面的杰出贡献,该项成就使我国高纯稀土产品成本下降3/4,单一高纯稀土产品占世界产量的90%以上。
2-1 目前在稀土分离工业中广泛应用国产萃取剂P 507,它的化学名称为(2 乙基己基)膦酸(2 乙基己基)酯,画出其化学结构简式,写出萃取三价稀土离子的化学反应方程式(萃取剂用HA 表示,稀土离子用RE3+表示)。
2-2 设萃取反应平衡常数为Kex,HA 的解离常数为Ka,配合物在水相中的稳定常数为 n,配合物和萃取剂在有机相和水相间的分配常数分别为Dm 和Pn,试推导用诸常数表达Kex 的关系式。
2-3 图2.1是用酸性磷酸酯萃取镨离子(Pr3+)得到的配合物结构的一部分。
(1)2图的R 不同,若R 为CH3和C2H5,写出(a)和(b)的化学式。
(2)若烷酯基上碳链增大,萃合物将取(a)结构还是((b)结构?请简述理由。
(3)在稀土分离工业中,一般应保持萃取剂与稀土的比例在6:1以上以避免乳化现象,为什么?2-4 石油工业的副产品环烷酸是工业上分离稀土的另一重要萃取剂,其通式为RCOOH(R 为环烷基)。
(1)图2.2 示出环己基乙酸煤油溶液萃取分离镧(La)和钇(Y)的选择性关系。
图中Y la /β为分离系数,即镧的萃取分配比和钇的萃取分配比的比值,N 为平衡水相中镧和钇的物质的量之比。
请回答,当N 值增大或减小时何种元素容易被萃取(注:分配比D=c(O)/c(W),c 为被萃取物总浓度)(2)高纯氧化钇是彩色电视和三基色荧光灯的红色荧光粉基质材料,过去用两步萃取技术获得,后徐光宪等用环烷酸体系经一步萃取分离就可获得9999%的高纯氧化钇,创立了国际领先水平的新工艺。
该工艺需在煤油中添加15%~20%(体积分数)的混合醇,如正庚醇和正癸醇,请简要说明混合醇对改善萃取剂结构性能和萃取作业所起的作用。
第3题钒在生物医学、机械、催化等领域具有广泛的应用。
多钒酸盐阴离子具有生物活性。
溶液中五价钒的存在形体与溶液酸度和浓度有关,在弱酸性溶液中易形成多钒酸根阴离子,如十钒酸根-62810O V 、-52810O HV 和-428102O V H 等。
将34VO NH 溶于弱酸性介质中,加入乙醇可以得到橙色的十钒酸铵晶体O nH O xV xH NH 2281046)(⋅-(用A 表示)。
元素分析结果表明,A 中氢的质量分数为3.13%。
用下述实验对该化合物进行分析,以确定其组成。
[实验1]准确称取0.9291gA 于三颈瓶中,加入100mL 蒸馏水和150mL20%NaOH 溶液,加热煮沸,生成的氨气用50.00mL0.1000mol/LHCl 标准溶液吸收。
加入酸碱指示剂,用0.1000mol/LNaOH 标准溶液滴定剩余的HCl 标准溶液,终点时消耗19.88mLNaOH 标准溶液。
[实验2]准确称取0.3097gA 于锥形瓶中,加入40mL1.5mol/LH2SO4,微热使之溶解。
加入50mL 蒸馏水和1gNaHSO3,搅拌5分钟,使反应完全,五价钒被还原成四价。
加热煮沸15分钟,然后用0.02005mol/LKMnO4标准溶液滴定,终点时消耗25.10mLKMnO4标准溶液。
3-1 图3.1为滴定曲线图,请回答哪一个图为实验1的滴定曲线;请根据此滴定曲线选择一种最佳酸碱指示剂,并简述做出选择的理由。
有关指示剂的变色范围如下:甲基橙(pH3.1~4.4),溴甲酚绿(pH3.8~5.4),酚酞(pH8.0~10.0)。
3-2 在实验2中,加NaHSO3还原-62810O V ,反应完全后需要加热煮沸15分钟。
煮沸的目的是什么?写出KMnO4滴定反应的离子方程式。
3-3 根据实验结果,计算试样A 中+4NH (和-62810O V 的质量分数,确定A 的化学式(x 和n 取整数)。
第4题磁性材料广泛应用于航空航天高科技领域及电视、电脑、手机等日常生活用品。
据报道,苯并[18]冠-6(以X 表示,图4.1)与铯离子可形成一种夹心型的超分子阳离子,它与镍的配合物[Ni(dmit)2]-(以Y 表示,图4.2)结合后可形成复合物并产生独特的晶体结构,具有优越的磁学性能,是铁磁性和反铁磁性共存于同一晶体中的成功范例。
图4.3是X 、Y 与Cs+形成的复合物的晶体结构。
在此晶体结构图中,a)为沿b 轴看晶胞,b)为沿a 轴看晶胞,c)为在c=0的面上镍配合物的二维排列,d)为镍配合物的 二聚体链。
4-1 给出该晶体晶胞的组成,并写出该晶体结构基元的化学式(苯并[18]冠6用X表示,镍配合物用Y表示)。
4-2 指出镍离子的杂化轨道类型;图4.4是平面正方形晶体场d轨道能级分裂图,把基态镍离子的d电子填入该图。
4-3 已知该晶体的晶胞参数a(1278.99pm,b(1305.39pm,c=2717.03pm,=78.3394º, =77.0109º, =70.6358º,试计算该晶体的密度(g·cm-3)。
(相对分子质量:X 312.4;Y 451.4)4-4 (1)写出镍配合物Y的对称元素。
(2)指出超分子阳离子中Cs+的配位数,解释其配位数较大的可能原因。
第5题水是最常用的溶剂。
水分子间形成很强的氢键,与一般液体物质相比,常态水具有较大的密度、比热、蒸发热、表面张力和介电常数。
水的三相点温度001∃、压强610Pa;临界温度3742∃、临界压强221MPa 。
近年发现,近(超)临界水具备许多特有性质,以其为介质,可以有效实现许多重要的化学反应,应用前景广阔。
5-1 画出水的压强-温度(p-T)相图(示意图),标注气相、液相、固相和超临界水所在的区域。
5-2 计算液态水在90℃和0.1MPa 时的θw pK (θm r H ∆和θm r S ∆可视为常数,相关数据见表1)。
5-3 有人研究了乙酸乙酯在23~30MPa 、250~400∃和没有任何其他外加物的条件下的水解动力学,并提出2种可能的机理。
请推测乙酸乙酯在超临界温度时的水解反应按上述哪种机理进行。
为什么?相关热力学数据如下:请推测乙酸乙酯在超临界温度时的水解反应按上述哪种机理进行。
为什么?相关热力学数据如下:5-4 乙酸乙酯水解反应速率可表示为:其中k为速率常数,c0,CH3COOC2H5为乙酸乙酯的初始浓度。
请通过推导说明水解反应按哪种机理进行。
5-5 实验表明:近(超)临界水中酯类水解反应的表观活化能可降到常规条件下的1/2,水解反应速率大幅度提高。
请通过机理1分析原因。
第6题木犀草素(Luteolin)是有良好抗菌活性和抗氧化能力的黄酮类化合物,以从植物中提取的芦丁(Rutin)为原料制取木犀草素是比较实用的一条工艺路线:在微波辅助下,芦丁与Na2S2O4在NaOH溶液中回流1.5小时生成木犀草素,产率83%。
6-1 实验测得,40℃时木犀草素在乙醇(EtOH)中的溶解度(以物质的量分数x计)为2.68×10-3。
已知20~60℃木犀草素在乙醇中的溶解焓为20.28kJ·mol-1。
请估算25∃时木犀草素在乙醇中的溶解度。
6-2 40℃时,芦丁和木犀草素在乙醇&水混合溶剂中的溶解度曲线如图6.1。
根据图示,设计提纯木犀草素的具体方案。
6-3 木犀草素有和两种晶相,在热力学上,相比相稳定。
在恒压下,液态、相和相的摩尔Gibbs自由能Gm随温度T的变化关系如图6.2所示。
(1)请回答哪条线对应a相、β相,说明理由。
(2)在相同温度下,a相和β相哪个熵更大?简述理由。
第7题2005年诺贝尔化学奖授予在烯烃复分解反应研究方面做出杰出贡献的Chauvin、Grubbs 和Schrock3位化学家。
烯烃复分解反应已被广泛用于有机合成和化学工业,特别是药物和塑料的研发。
最近,这一反应在天然产物(+)-Angelmarin的全合成中得到应用。
(+)-Angelmarin 是中草药独活中的有效成分之一。
1971年Franke小组报道了它的关键中间体E的合成(见合成路线1)。
最近,Coster小组用廉价易得的烯丙基溴代替Franke方法中较贵的-3-甲基-3-氯-1-丁炔,合成出中间体G,再经烯烃复分解反应得到D,继而通过对映选择性环氧化等4步反应得到光学纯的(+)-An-gelmarin(见合成路线2)。
7-1 画出中间体B、C和F的结构式。
7-2 试为合成路线1中第二、三步反应和合成路线2中的第二步反应提出合理的反应条件和试剂。
7-3 试解释合成路线1中从D到E转化(即第四步反应)的历程(用反应式表示)。
7-4 在合成路线2的第二步反应(从F到G的转化)中还观察到了一种副产物,它是G的同分异构体,试画出这个副产物的结构式。
7-5 3-甲基-3-氯-1-丁炔是合成路线1中使用的原料之一。
用乙炔和必要的有机或无机试剂,用不超过3步反应的合成路线合成该化合物,写出反应式。
第8题20世纪70年代我国科学家从民间治疗疟疾草药黄花蒿中分离出一种含有过氧桥结构的倍半萜内酯化合物,称为青蒿素,它是我国自主研发并在国际上注册的药物,也是目前世界上最有效的抗疟疾药物之一。
