板青颗粒内控质量标准
板蓝根颗粒中间产品质量标准

依据:《板蓝根颗粒质量标准》,产品质量的稳定性考察。
内容:
1板蓝根颗粒稠膏
1.1性状:本品为棕褐色的稠膏。
1.2检查
1.2.1相对密度:1.25~1.30 (60℃±5℃测定,用比重计)。
1.2.2溶化性:搅拌5分钟,应全部溶化,且不得有焦屑等异物。
2 颗粒
2.1 性状:本品为浅棕黄色至棕褐色的颗粒;味甜、微苦或味微苦(无糖型)。
2.2 检查
2.2.1粒度:不得过7.0%。
2.2.2水分:不得过4.0%(快速水分测定法)。
2.2.3溶化性:搅拌5分钟,应全部溶化,且不得有焦屑等异物。
3 分装
3.1装量差异:(10g)±
4.5%,(5g)±6.5%,(无糖型)(3g)±6.5%。
10袋中,超出
限度的不得多于2袋,并不得有1袋超出限度一倍。
3.2封口质量:平整严密,无漏气,无皱折。
3.3印字质量:产品批号印字清晰无误。
3.4切割质量:准确,文字内容完整无误。
4包装:产品批号、生产日期、有效期印字清晰;装量准确,每件数量应为:10克×20袋×60包、10克×25袋×60包、10克×18袋×60包、5克×20袋×100包
或3克×20袋×100盒;封口严密,打包端正(打包上下偏差应不得过1cm),松
紧适度。
板青颗粒生产工艺规程

板青颗粒生产工艺规程目录1 产品概述2 处方依据3 工艺流程图4 中药材的前处理5 制剂工艺过程及工艺条件6 原辅材料质量标准和检查方法7 中间产品质量标准和检查方法8 成品质量标准和检查方法9 包装规格、包装材料质量标准10 说明书、产品文字说明和标志11 工艺要求12 设备一览表和重要设备生产能力13 技术安全与劳动保护14 劳动组织15 原辅料消耗定额16 包装材料消耗定额17 动力消耗定额18 综合利用与环境保护目的:制定本标准的目的是规范板青颗粒生产过程,对一定数量的成品所需的起始原辅料和包装材料,以及工艺、加工说明、技术参数、注意事项等进一步标准化。
适用范围:适用于板青颗粒生产全过程。
责任人:质量部部长、生产部部长、车间主任。
内容:1 产品概述1.1产品特点:1.1.1性状:本品为浅黄色或黄褐色的颗粒;味甜,微苦。
1.1.2功能主治:清肺解毒,凉血。
用于风热感冒,咽喉肿痛,热病发斑及温热性疾病。
1.1.3用法用量:马、牛50g;鸡0.5g。
1.1.4 包装规格:200g/袋×50袋/箱1.1.5 贮藏:密封,防潮。
1.1.6 有效期:二年。
1.2 处方来源:2 处方和依据2.1 处方板蓝根 600g 大青叶 900g 蔗糖 600g 糊精加至1500g2.2 处方依据:2.3 批量:批量为处方量的整数倍。
说明:根据生产计划及混合设备生产能力确定批量,每批批量为处方量的整数倍。
3工艺流程图4.1、板蓝根、大青叶为净选后中药饮片,不需炮制。
5、制剂操作过程及工艺条件5.1 总述按生产指令单领取已炮制好的板蓝根、大青叶二味中药饮片,加水煎煮两次,每次1小时,合并煎液,滤过,滤液浓缩至相对密度为1.35-1.40(50℃)的浸膏。
浸膏与糊精、蔗糖混合制成软材,制颗粒、干燥、整粒、分装、包装成规定规格即可。
5.2 分述5.2.1 提取:取板蓝根、大青叶加至提取罐中,第一次加8倍量水浸没药材2小时后,热回流提取1小时,第二次加6倍量水,热回流提取1小时,合并提出液浓缩至相对密度 1.35~1.40(50℃)稠膏,取样干燥成干膏测定水分。
板青颗粒说明书

板青颗粒说明书【板青颗粒说明书】【品名】板青颗粒【剂型规格】颗粒剂,每袋装6克【主要成分】断血流疏通颗粒经科学研制,主要由川芎、红花、丹参、全蝎等草药组成。
【性状】本品为黄棕色颗粒;有特殊的香气。
【适应症】用于治疗中风后遗症、痴呆、偏瘫、肢体麻木、失声、口眼歪斜等脑血管病后遗症,以及风湿性关节炎、痛风及小儿肺炎等症状。
【用法用量】口服。
成人一次6克,一日3次。
儿童酌情减量。
【不良反应】暂未见有明显的毒副作用,临床研究和长期应用均证明,少部分病人会有些胃纳不佳、头晕等症状,一般随用药时间较长便会好转。
偶见过敏症状如药疹、起疱、发热等,停药后症状消失。
【禁忌】孕妇禁用。
【注意事项】1.禁烟、喝酒、辛辣油腻等刺激性食物。
2.本品只适用于脑血管病遗留症状治疗,不能治愈基础病。
3.服药期间,应注意观察各项指标的变化,特别是血常规、肝功、肾功等。
4.对本品过敏者慎用,过敏体质者应在医生指导下使用。
5.按照使用说明正确使用,儿童应在成人监护下使用。
【药理作用】本品是由多种中药成分组成,具有活血祛瘀、通络止痛、消肿散结的药理作用,能够改善血液流动,缓解炎症症状。
【药代动力学】本品通过口服给药方式,药物成分迅速吸收,主要经肝脏代谢,药物代谢产物主要经尿液排除。
【贮藏】密封,避光,防潮。
【包装】铝塑装,装6、10 剂。
【有效期】36 个月。
【生产企业】XX公司【厂址】XX市【产品批准文号】国药准字ZXX号【生产日期】20XX年XX月XX日【批准日期】20XX年XX月XX日【使用说明】1.按建议剂量服用,一日3次,早、中、晚各一次。
2.建议服药前先饮用一杯温水,将药物倒入口中,含服,过十五分钟用温开水送服。
服用过程中,不能与咖啡、茶、牛奶等同时进食。
3.禁用含有致敏原的食物。
4.服药期间应避免生冷、油腻食物,多摄取新鲜蔬菜、水果。
坚持配合医生指导下进行适量的运动,遵循个人医嘱。
【不良反应】部分患者可能会出现口干、乏力、眼干、视力模糊等症状。
优劣板青颗粒快速辨别方法

养猪一点通EASY SKILL总体并不稳定,对养猪生产的危害有增无减,除经典毒株与高致病性变异株外,类NADC30毒株的流行也呈逐渐扩大的趋势,与高致病性猪蓝耳病毒减毒活疫苗免疫相关的临床问题依然存在,严重影响猪场的生产成绩和经济效益。
2.3 猪伪狂犬病猪伪狂犬病是由伪狂犬病病毒引起的一种急性传染病。
该病具有明显的年龄差异性,年龄较小的猪更容易感染,并出现特征性的神经症状,如共济失调、抽搐、突然死亡等;年龄较大的猪具有较强的抵抗力,主要表现呼吸道或亚临床症状;怀孕母猪可导致胎儿被吸收、木乃伊胎或者流产。
猪伪狂犬病毒感染后终身带毒,并不定期向外排毒。
加强免疫和抗体监测是降低野毒阳性猪排毒风险的关键。
公猪可通过精液排毒从而感染母猪。
近年来由于流行毒株发生变异,毒力增强,防控难度增加。
大多数猪场猪伪狂犬病得到控制,总体趋势良好。
但猪场存在大量伪狂犬野毒阳性猪,随时可能发病或排毒,潜在发病风险仍然较大,临床病例主要以散发为主。
2.4 猪圆环病毒病猪圆环病毒病是由猪圆环病毒(PCV)感染所引起的一系列疾病的统称,PCV2感染后会出现圆环病毒相关性疾病如:断奶仔猪多系统衰竭综合征、皮炎与肾病综合征、呼吸道综合征等。
猪圆环病毒感染后长期潜伏,导致免疫抑制,从而造成其他疾病的并发与继发。
一般来说,PCV2单独感染不会引起很严重的发病情况和死亡率。
共同感染后,患病猪的病情更加复杂,防控和治疗更加困难,最终造成病死率加大,给猪场造成严重经济损失。
猪圆环病毒2型是猪场常在的病原,猪群感染率很高。
近期由于PCV3的出现,可能使圆环病毒感染变得更加复杂。
2.5 猪流行性腹泻猪流行性腹泻是猪的一种肠道接触性传染疾病,病毒随粪便排出,能够污染饲料、饮水、环境等,进而传染给猪群中的其他猪。
主要发生于哺乳仔猪,一周龄以内的仔猪发病具有极高的死亡率,随日龄增长发病率迅速下降。
发病症状为病猪体温正常或稍高、呕吐、呈水样腹泻、脱水、精神沉郁、食欲减退等。
板青颗粒(成品)检验操作规程

GMP管理文件
一、目的:为规定板青颗粒生产过程中的质量控制和检验操作要求,特制定此操作规程。
二、适用范围:适用于板青颗粒成品的检验。
三、责任者:生产部经理、检验员、生产人员
四、正文:
【质量标准】见板青颗粒内控质量标准
【检验内容】
【性状】本品为浅黄色或黄褐色颗粒;味甜,微苦。
【鉴别】(1)取本品0.5 g,加水5ml,使溶解,静置,取上清液点于滤纸上,晾干,置紫外光灯(365nm)下观察,显蓝色荧光。
(2)取本品适量,研细,取细粉0.5 g,加稀乙醇20 ml,超声处理10分钟,滤过,滤液蒸干,残渣加稀乙醇1 ml使溶解,作为供试品溶液.另取精氨酸对照品,加稀乙醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各2ul,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以正丁醇-冰醋酸-水(15:7:7)为展开剂,展开,取出,热风吹干,喷以茚
三酮试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
【检查】应符合颗粒剂项下有关的各项规定。
板青颗粒生产工艺规程

制药有限公司板青颗粒生产工艺规程颁发单位:GMP办公室工艺规程批准程序目录1、剂型及规格 (3)2、处方和依据 (3)3、生产过程质控要点 (3)4、生产的工艺流程图 (4)5、操作过程及工艺条件 (5)6、工艺过程中所需SOP名称及要求 (9)7、工艺卫生及环境卫生 (9)8、工艺验证及具体要求 (10)9、设备一览表及主要设备生产能力 (10)10、物料平衡及经济技术指标计算 (10)11、技术安全及劳动保护 (11)12、劳动组织与岗位定员 (12)1.剂型及规格剂型:颗粒剂。
2.处方和依据2005版《中华人民共和国兽药典》第二部。
3.生产过程质控要点:4.生产的工艺流程图注:加粗部分为主要控制点5.操作过程及工艺条件5.1 生产前准备:5.1.1上一批次是否进行清场。
清场者、检查者是否签字,将“清场合格证”副件归入本批生产记录。
未取得清场合格证不得进行下一批次的生产。
5.1.2检查生产场所的环境、设施卫生是否符合该区域清洁卫生要求。
不得有上批生产遗留物。
5.1.3检查设备有“已清洁”标牌,并进行试运转,检查合格后,挂上“运行中”标牌后才能使用。
所有工具、容器、设备是否已按清洗规程完成并符合标准。
5.1.4对计量容器、衡器要进行检查、校正以后才能使用。
5.1.5检查与生产相适应的相关文件,记录等是否齐全。
5.1.6对所用物料、半成品核对品名、规格、批号、数量,准确无误后方可使用。
5.2 指令的下达:由生产部提前一天下达批生产指令单与批包装指令单,质管部审核后工艺员将批生产指令一份送中药原辅料仓库管理员,另一份送生产部颗粒剂车间班长,准备生产。
5.3 备料仓库管理员根据批生产指令,按《原辅料备料、称量岗位操作规程》准备所需原料、辅料,按包装指令和《标签、包装、使用说明书管理制度》准备规定数量的包装材料。
并由质量监督员复核品名、数量、规格、编号、检验报告单,复核无误后,通知生产部领料。
5.4 领料5.4.1由领料员接收物料,领料时严格按《领料岗位操作规程》操作,并由质量监督员进行监督复核,复核物料的品名、规格、编号、数量、供货单位及检验合格证明,核对无误后由领料员在领料单及批生产指令单上签字。
板青颗粒(半成品)内控质量标准
GMP管理文件
一.目的:制定板青颗粒(半成品)的内控标准,规范公司板青颗粒的生产。
二.适用范围:适用于板青颗粒的生产和质检。
三.责任者:生产部经理、质管部经理、检验员、各岗位操作人员。
四.正文:
【名称】板青颗粒
【处方】板蓝根600g大青叶900g
【制法】以上2味,加水煎液煮2次,每次1小时,合并煎液,滤过,滤液浓缩至稠膏状,
加蔗糖、糊精适量,混匀,制成颗粒,干燥,制成1500g(使
1g颗粒相当于1g生药)即得。
【性状】本品为浅黄色或黄褐色颗粒;味甜,微苦。
【鉴别】(1)取本品0.5g,加水5ml,使溶解,静置,取上清液点于滤纸上,晾干,置紫外光灯(365nm)下观察,显蓝色荧光。
(2)取本品适量,研细,取细粉0.5g,加稀乙醇20ml,超声处
理10分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试
品溶液.另取精氨酸对照品,加稀乙醇制成每1ml含0.5mg的溶
液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液
各2ul,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄
层板上,以正丁醇-冰醋酸-水(15:7:7)为展开剂,展开,
取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点显色
清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同
颜色的斑点。
【检查】应符合颗粒剂项下有关的各项规定。
中药配方颗粒质量控制与标准制定技术要求征求意见稿

中药配方颗粒质量控制与标准制定技术要求征求意见稿中药配方颗粒质量控制与标准制定技术要求(征求意见稿)为规范中药配方颗粒的质量控制与标准研究,体现中药配方颗粒质量控制的特点以及加强标准化工作,实现中药配方颗粒整体质量控制和有效监管,根据《中药配方颗粒管理办法》制定本技术要求。
一、基本要求中药配方颗粒需要建立的标准主要包括作为初始原料的中药材标准、作为提取用原料的饮片标准、作为制剂用原料的中间体标准和作为终产品的成品标准。
(一)具备汤剂的基本属性中药配方颗粒的制备,除成型工艺外,其余应与传统汤剂基本一致,即以水为溶媒提取,以物理方法固液分离、浓缩、干燥、颗粒成型等工艺生产。
中药配方颗粒药效物质应与中药饮片水煎汤剂保持基本一致。
(二)符合颗粒剂通则有关要求除另有规定外,中药配方颗粒应符合《中国药典》现行版制剂通则颗粒剂项下的有关规定。
根据各品种的性质,可使用颗粒成型必要的辅料,辅料用量以最少化为原则。
除另有规定外,辅料与中间体(以干燥品计)之比一般不超过1:1。
(三)符合质量一致性原则应按照质量一致性原则,建立从原料、生产到使用的全产业链质量控制体系,以标准汤剂为基准进行批与批之间质量一致性的合理评价,并建立生产工艺标准规程和相应控制方法。
作为原料的药材和饮片应符合国家药品标准的相关要求,为保证批间质量基本一致及可追溯,应在工艺规程中建立投料方案,规定原料混批调配投料方法。
原料、中间体、成品三者药效物质的指纹或特征图谱和含量测定的成分均应以标准汤剂为基准进行合理评价,并应有确定的量值传递相关性和转移率范围。
(四)符合品种适用性原则中药配方颗粒是对传统中药饮片的补充,对于不适宜制成中药配方颗粒的品种,原则上不应制备成中药配方颗粒。
二、研究用样品及对照物质的要求(一)研究用样品研究用样品应具有代表性,应覆盖品种上市拟采用药材的道地产地或主产区,每个药材产地不少于3批,并对样品批次数量从产地环境条件、质量水平等方面的代表性进行合理评价,至少应收集15批以上药材样品,依法制成饮片和标准汤剂。
板材加工内控标准
文件编号
GJ-NK007-08
版本
00
1范围
适用于本公司板材加工的过程检验。
2引用标准
本标准根据JG3035、JGJ102、YS/T429.2和Q/FY1等标准进行编制。
3检验内容
3.1开料
3.1.1原材料检查
开料组的操作人员在开料前,必须按100%的抽样几率对原材料的表面质量进行全面检查。装饰面必须光滑平整,不允许有腐蚀、砂眼、扩散斑点;板面不允许有明显的压坑、碰伤、擦伤和划伤等缺陷。并按板材的规格分类,对每种规格的板材依《质量检验规定及抽样表》中“3.2.1”规定的抽样方案按《铝合金板材进厂验收标准》中“3.1、3.2、3.3”进行厚度、长、宽尺寸检查。
如果装饰面有明显划伤、擦伤,则必须进行打磨。
3.5.3打磨的质量要求为表面平整、弧度一致,在同一方向上无明显的手感。
3.1.2开料后的几何尺寸必须符合表1的规定。表1见左下表(单位为mm):
项目
尺寸范围
允许误差
长、宽尺寸
≤2000
±2.0
>2000
±2.5
对角线尺寸
≤2000
2.5
>2000
3.0
项目
允许误差
挂孔
长宽尺寸
±2
孔位中心距
±1
孔的几何尺寸
+0.2
板面孔
孔位中心距
±1
孔的几何尺寸
±0.2
3.1.3开料后的其他尺寸
3.3.2点焊
点焊必须牢固且不允许有虚焊。点焊只能在非装饰面上进行,不能因点焊而使产品产生严重变形。点焊完毕后,产品的相关尺寸应满足表3、表4和表5的要求。
3.5打磨
3.5.1如果是需阳极氧化或不进行喷涂处理的产品,装饰面不允许有划伤,一般情况下,不要进行打磨(技术资料规定的除外)。
中药行业的中药颗粒制剂质量标准与评估

中药行业的中药颗粒制剂质量标准与评估中药颗粒制剂是中药行业中一种常见的制剂形式,具有方便服用、药效稳定、易于质量控制等优点。
为了确保中药颗粒制剂的质量和疗效,制定了一系列的质量标准和评估方法。
本文将介绍中药颗粒制剂的质量标准和评估方法,旨在提高中药颗粒制剂的质量和安全性。
一、中药颗粒制剂质量标准1. 外观要求中药颗粒制剂的外观要求主要包括颗粒的形状、颜色和气味。
颗粒应具有一定的形状规整度,颜色应与原料药相符,气味应符合相应的药材气味。
2. 含量测定中药颗粒制剂的含量测定是评估其有效成分含量的重要指标。
含量测定应依据中药颗粒制剂的具体成分要求,采用适当的仪器设备和分析方法进行测定。
3. 类别及残留量限度中药颗粒制剂中有些成分可能会对人体产生毒副作用,因此在质量标准中会对这些成分的类别及其残留量进行限度要求,以保证产品的安全性。
4. 质量控制指标中药颗粒制剂的质量控制指标包括干燥失重、水分含量、总灰分、酸不溶性灰分等指标。
这些指标可以反映颗粒制剂的稳定性、质量控制水平和适应性。
二、中药颗粒制剂质量评估方法1. 成分分析通过对中药颗粒制剂中有效成分的分析,评估其含量和纯度。
成分分析可以采用层析、光谱、色谱等不同的分析方法,确保有效成分的质量符合要求。
2. 特性评估中药颗粒制剂的特性评估是通过对其溶解度、稳定性、流动性等特性的测试,评价其品质。
这些测试可以通过仪器设备和药学实验等手段进行,全面评估颗粒制剂的特性。
3. 素材评估素材评估是对中药颗粒制剂原料药的来源和质量进行评估。
通过对原料药的采购渠道、质量控制和原料验证等方面的评估,确保中药颗粒制剂的素材符合标准要求。
4. 产品稳定性评估产品稳定性评估是通过对中药颗粒制剂在不同贮存条件下的稳定性测试,评估其保质期和贮存要求。
该评估可以通过加速试验、湿热试验和紫外光试验等方法进行。
三、质量标准与评估在中药颗粒制剂中的重要性中药颗粒制剂的质量标准与评估对产品质量和疗效具有重要影响。
板青颗原料检验操作规程
GMP管理文件
一.目的:为规范板青颗粒原料的检验标准和生产要求,特制定此标准。
二.适用范围:适用于板青颗粒原料的质量检验。
三.责任者:质量检验员
四.正文:
检品名称:板青颗粒原料
检验依据:《板青颗粒原料内控质量标准》
检验仪器:
操作内容:
性状本品为黄褐色的粘稠液体。
味甜、微苦。
鉴别(1)取本品0.5g加水5ml使溶解,静置,取上清液,点于滤纸上,晾干,置紫外光灯下观察,显蓝色荧光。
(2)取本品0.5g,加稀乙醇20ml,超声处理10分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶液,作为供试品溶液。
另取精氨酸对照品加稀乙醇制成每1ml中含0.5mg的溶液,作为对照品溶液,照薄层色谱法,试验,吸取上述三种溶液各2ul,分别点于同一以羧甲基
纤维素钠为粘合剂的硅胶G薄层板上,以正丁醇-冰醋酸-水(15:7:7)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
检查溶液的澄清度取本品适量,加水溶解,溶液应澄清透明。
板青颗粒原料
(2)供试品溶液色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
检查结果:
溶液的澄明度
取本品2g,加热水溶解并稀释至100ml,溶液应澄清。
检查结果:
复核人:检验人:
有限公司
原辅料检验记录报告单
原辅料名称
板青颗粒原料
检验单号
批 号
供货单位
供货数量
请验单位
原辅料库
取样数量
取 样 人
规 格
有限公司
原辅料检验记录首页
文件编号:00第1页共2页
原辅料名称
板青颗粒原料
检验单号
批 号
供货单位
供货数量
请验单位
原辅料库
取样数量
取 样 人
规 格
送ห้องสมุดไป่ตู้日期
年 月 日
报告日期
年 月 日
检验依据
<<板青颗粒原料内控质量标准>>
性
状
本品为黄褐色粘稠膏状;有引湿性。
检验结论:
鉴
别
(1)取本品适量,加10倍量的水溶解,静置,取上清液点于滤纸上,晾干,置紫外灯下观察,显蓝色荧光。
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<板青颗粒原料内控质量标准>>
检验项目 标准规定 检验结果 项目结论
(1)性状 应为黄褐色粘稠膏状规定
(2)鉴别 (1)应符合规定规定
(2)应符合规定规定
(3)检查:
溶液的澄明度 应澄清规定
检验结论: 本品按<<板青颗粒原料内控质量标准>>检验,结果
规定。
备注:
负责人:复核人:检验人:
山东 中药配方颗粒质量标准

山东中药配方颗粒质量标准
在山东省内,中药配方颗粒的生产、销售和使用需要符合国家药品标准或省级中药配方颗粒标准。
目前,山东省已经发布了2批共159个省级中药配方颗粒标准。
对于未列入省级标准的品种,管理细则列明了山东省标准申请相关程序及申报资料要求。
为了保障中药配方颗粒的质量,山东省实施了全过程管理,要求中药配方颗粒生产企业具备全过程追溯及风险管理能力。
企业应建立质量追溯体系和药物警戒制度,履行全生命周期管理的主体责任和相关义务。
此外,中药配方颗粒生产企业应具备的条件包括:
1. 具备中药炮制、水提、分离、浓缩、干燥、制粒等完整的生产能力。
2. 按照备案的生产工艺进行生产,并符合国家或省级标准。
3. 优先使用来源于中药材种植养殖基地的中药材,提倡使用道地药材。
生产过程质量管理的有关要求包括:
1. 除另有规定外,中药配方颗粒应符合《中国药典》现行版制剂通则颗粒剂项下的有关规定。
2. 根据各品种的性质,可使用颗粒成型必要的辅料,辅料用量以最少化为原则。
除另有规定外,辅料与中间体(浸膏或干膏粉,以干燥品计)之比一般不超过1:1。
3. 对于部分自然属性不适宜制成中药配方颗粒的品种,原则上不应制备成中药配方颗粒。
以上内容仅供参考,建议查阅《山东省中药配方颗粒管理细则》以获取最准确的信息。
原料质量内控标准

亚硝酸盐≤60。0mg/kg
霉菌总数<20×103个/g
六六六≤0.05mg/kg
滴滴涕≤0.02mg/kg
细菌总数<2×105个/g
三聚氰胺不得检出
血粉
暗红色或褐色,粉状,具血腥特殊味,无发酵、霉变、结块、无腐败变质气味,无掺杂。
水分≤12.0%
来货每批必检
感官不合格,卫生指标不合格
六六六≤0。05mg/kg
滴滴涕≤0.02mg/kg
三聚氰胺不得检出
花生粕
浅褐色,呈淡淡花生压榨香味,无发酵发霉或烧焦味,无不良气味,无掺假,结块等现象。
水分≤12.0%
来货每批必检
色泽不一致,有结块,霉变,及哈败味,掺杂掺假。不符合卫生标准
由于花生粕易感染黄曲霉,要求库存≤3个月
粗蛋白质≥48.0%
粗纤维≤9.0%
每月抽检一次
面粉
白色粉末,色泽一致,无发酵、霉变、结块及异味异嗅。
水份≤13。5%
来货每批必检
粗灰分≥2.0%
面粉加工厂副产品,质量介于食用面粉和次粉之间。要求库存不宜过6周,若水分≥13.5%,库存不超过3周
粗灰分≤1。0%
面筋质≥25
每月抽检一次
粗蛋白≥13。0%
43豆粕
淡黄色、金黄色或浅黄褐色不规则碎片,色泽一致,具有豆粕之新鲜香味、无发酵、霉变、结块、虫蛀及异味异嗅,无掺杂,无发热。杂质≤0。5%
粗脂肪≥6%
粗灰分≤5%
粗蛋白≥9%
黄曲霉毒素B1≤50μg/kg
要求供方每年至少提供一次检验报告或送外委托检验
玉米赤霉烯酮≤500μg/kg
小麦
籽粒饱满、整齐、均匀,黄白色或深红色或红褐色,回味甜。无虫、无发酵、霉变、虫蛀及异味异嗅
颗粒剂可利用物料质量标准
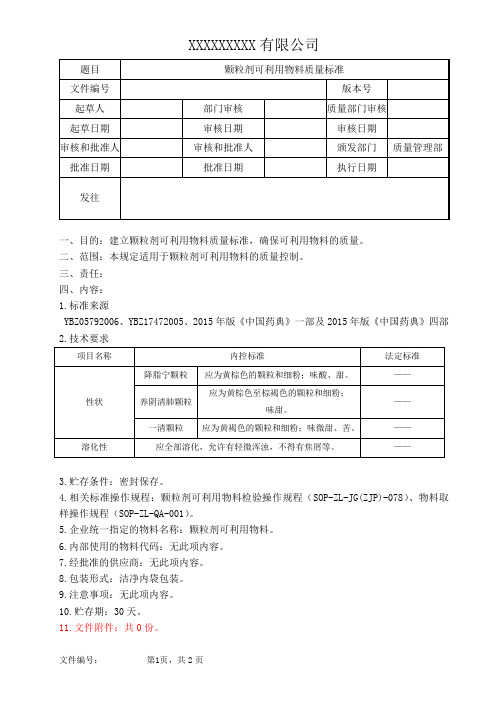
XXXXXXXXX有限公司
一、目的:建立颗粒剂可利用物料质量标准,确保可利用物料的质量。
二、范围:本规定适用于颗粒剂可利用物料的质量控制。
三、责任:
四、内容:
1.标准来源
YBZ05792006、YBZ17472005、2015年版《中国药典》一部及2015年版《中国药典》四部2.技术要求
3.贮存条件:密封保存。
4.相关标准操作规程:颗粒剂可利用物料检验操作规程(SOP-ZL-JG(ZJP)-078)、物料取样操作规程(SOP-ZL-QA-001)。
5.企业统一指定的物料名称:颗粒剂可利用物料。
6.内部使用的物料代码:无此项内容。
7.经批准的供应商:无此项内容。
8.包装形式:洁净内袋包装。
9.注意事项:无此项内容。
10.贮存期:30天。
11.文件附件:共0份。
颗粒剂可利用物料质量标准版本号:12.修订及变更历史:。
颗粒剂质量监控标准操作规程

颗粒剂质量监控标准操作规程1.目的:建立颗粒剂质量监控规程,保证产品质量。
2.范围:适用于颗粒剂生产的监控。
3。
责任:车间QA监控员,岗位操作人员对此规程的实施负责。
4。
内容:4.1 监控依据:产品工艺规程、岗位操作规程。
4.2环境监控:4。
2.1 沉降菌:4.2.1。
1 每月监控一次.4.2。
1.2 监控标准:4.2.2.1悬浮粒子每三个月监控一次。
4.2。
2。
2监控标准:4.2.3温湿度:4。
2.3。
1 QA监控员每天随机监控二次。
4.2.3。
2 监控标准:洁净室(区)的温度和湿度应与其生产及工艺要求相适应(温度控制在18℃~26℃,相对湿度控制在45%~65%).4.2.4压差:4.2.4.1QA监控员每天随机监控二次。
4.2.4.2监控标准:空气洁净度不同的洁净室(区)之间的压差应≥10Pa,空气洁净度要求高的洁净室(区)对相邻的空气洁净度级别低的洁净室(区)一般要求呈相对正压,产尘间保持相对负压.4.2.5纯化水:4.2.5.1QA监控员随时对纯化水进水口、出水口、总回水口进行酸碱度、电导率、氨、氯化物项目的检查,应符合标准要求。
4.2.5.2监控标准4。
2.5.2。
1 酸碱度:取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
4.2.5.2.2氯化物:取本品50ml,加硝酸5滴与硝酸银试液1ml,不得发生混浊.4.2.5.2.3氨:取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(含量≤0。
00003%).4。
2.5。
2.4 电导率:取本品适量,照“电导率检查标准操作规程"测定,应≤2。
0m/s。
4.3生产前监控:4。
3。
1.1 上批次或品种结束,是否进行清洁、清场。
是否有“清场合格证”。
4。
3。
1。
2 生产区设备是否有完好的状态标志及已清洁状态标志。
金板青颗粒中绿原酸的提取工艺和含量测定

金板青颗粒中绿原酸的提取工艺和含量测定钟英杰;徐福亮【摘要】建立金板青颗粒中绿原酸的提取工艺并对其有效成分含量进行测定.选择L9(34)正交表安排试验,用HPLC测定金板青颗粒中绿原酸的含量.结果表明,金板青颗粒中绿原酸的最佳提取工艺为12倍用量水提取3次,每次2.5 h.绿原酸线性范围在10.0~100 μg/mL,r=0.9999,平均回收率100.75%(RSD=1. 62%,n=6).试验结果说明,本工艺稳定可行、科学可靠,含量测定方法简便准确,重复性好,可用于控制该颗粒剂的质量.【期刊名称】《西北农业学报》【年(卷),期】2010(019)002【总页数】4页(P61-64)【关键词】金板青颗粒;绿原酸;提取工艺;含量测定;HPLC【作者】钟英杰;徐福亮【作者单位】青岛康地恩药业有限公司,山东青岛266111;青岛康地恩药业有限公司,山东青岛266111【正文语种】中文【中图分类】S859.3金板青颗粒是青岛康地恩药业有限公司自行研发的新兽药,以金银花、连翘、黄芩、板蓝根、桔梗、甘草等中药材为原料制备。
经临床初步验证该方对非免疫鸡人工感染传染性支气管炎病毒和法氏囊病毒均有良好的预防和治疗作用,可提高雏鸡的免疫力,增强细胞免疫功能,提高抗病能力。
为确保临床疗效,控制产品质量,用正交设计法研究其最佳提取工艺,并建立了高效液相色谱法测定颗粒剂中绿原酸含量的方法。
1 材料和方法1.1 试材美国Agilent1100高效液相色谱仪;G1313A自动进样器;G1315B DAD二极管阵列检测器;AG285型电子分析天平;岛津 UV-2450型紫外分光光度仪。
中药材饮片均符合《中国兽药典》(一部)有关规定,经青岛市药检所中药科吴爱英教授鉴定。
绿原酸标准品购自中国药品生物制品检定所(批号为110753-200413);乙腈、甲醇为色谱纯,蒸馏水为重蒸水,其他试剂均为分析纯;金板青颗粒为自制。
1.2 方法1.2.1 工艺优选为确定最佳的工艺路线,对金板青颗粒的提取工艺进行了研究。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GMP管理文件
一.目的:制定板青颗粒(成品)的内控标准,规范公司板青颗粒的生产。
二.适用范围:适用于板青颗粒的生产和质检。
三.责任者:生产部经理、质管部经理、检验员、各岗位操作人员。
四.正文:
【名称】板青颗粒
【处方】板蓝根600g大青叶900g
【制法】以上2味,加水煎液煮2次,每次1小时,合并煎液,滤过,滤液浓缩至稠膏状,加蔗糖、糊精适量,混匀,制成颗粒,干
燥,制成1500g(使1g颗粒相当于1g生药)即得。
【性状】本品为浅黄色或黄褐色颗粒;味甜,微苦。
【鉴别】(1)取本品0.5g,加水5ml,使溶解,静置,取上清液点于滤纸上,晾干,置紫外光灯(365nm)下观察,显蓝色荧光。
(2)取本品适量,研细,取细粉0.5g,加稀乙醇20ml,超声处
理10分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试
品溶液.另取精氨酸对照品,加稀乙醇制成每1ml含0.5mg的溶
液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各2ul,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以正丁醇-冰醋酸-水(15:7:7)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
【检查】应符合颗粒剂项下有关的各项规定。
