北京市2018年化工原理竞赛决赛题目-最终版
化工原理竞赛题目

化工原理竞赛题目题目背景:无水乙醇是一种重要的基本有机化工原料,其重要用途之一是无水乙醇与汽油混合形成汽油醇,可用作点燃式内燃机的燃料。
推广使用车用乙醇替代汽油,一方面缓解石油供需矛盾,另一方面还可有效降低汽车尾气中有害气体的排放,改善了环境和空气质量,经济效益和社会效益非常显著。
目前全世界消耗无水乙醇正稳步增加,其应用前途不可限量,无水乙醇的生产符合当前我国可持续发展的能源政策。
据所周知,乙醇和水会形成共沸物,其共沸组成乙醇含量约95.6%(质量分数),要想得到无水酒精,普通精馏就不再适用。
目前生产无水乙醇的方法大致有:萃取精馏法、分子筛脱水法、真空蒸馏法、淀粉吸附法、离子交换树脂脱水法、恒沸精馏法等。
其中萃取精馏法具有最大的工业意义,本次竞赛题目就是研究萃取精馏法制备无水乙醇。
题目内容:本次竞赛初赛题目包括工程设计和小试实验方案两部分,参赛者提交报告,筛选后决定复赛名单,复赛项目包括实验操作和答辩,最终评选出各类奖项。
(一)工程设计现欲用萃取精馏对乙醇水混合物进行分离,条件及要求如下:原料:乙醇水混合物,乙醇组成为50%(质量分数)产品要求:塔顶产品中乙醇组成为99.5%以上,乙醇回收率为98%以上,产品均需要冷却到40℃,萃取剂要求回收,可循环使用。
公用工程条件:冷公用工程为循环水(20℃→30℃)热公用工程为0.4MPa(表压)的饱和水蒸汽环境温度为20℃。
试根据以上条件,当处理量为200kg/h时,设计一个合理的工艺流程,进行工艺条件设计计算,绘制带有主要参数控制点的工艺流程图,对主要设备进行工艺参数的计算及选型。
提示:(1)查阅文献、手册等查出乙醇-水二元体系气液平衡数据,作出该物系的T-x-y图及y-x图。
(2)选用合适的萃取剂,并说明理由。
(3)拟定以乙二醇为萃取剂,通过计算,作出常压下萃取剂存在时乙醇-水的y’-x’图。
(4)根据题意,设计一合理的工艺流程,画出工艺流程图。
(5)进行物料衡算,能量衡算。
2018年北京理综化学高考试题文档版(含答案).doc

绝密★启封并使用完毕前试题类型: 2018年普通高等学校招生全国统一考试理科综合能力测试(化学)(北京卷)注意事项:1.本试卷分第I卷(选择题)和第n卷(非选才i题)两部分.2.答题前,考生务必将自己的姓名、准考证号填写在本试题相应的位置^3.全部答案在答题卡上完成,答在本试题上无效^4.考试结束后,将本试题和答题卡一并交回.第一部分(选择题共120分)本部分共20小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
6.我国科技创新成果斐然,下列成果中获得诺贝尔奖的是A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法7.下列中草药煎制步骤中,属于过滤操作的是A.冷水浸泡B.加热煎制C.算渣取液D.灌装保存8.下列食品添加剂中,其试用目的与反应速率有关的是A.抗氧化剂B.调味剂C.着色剂D.增稠剂9.在一定条件下,甲苯可生成二甲苯混合物和苯。
有关物质的沸点、熔点如下:下列说法不正确的是学.科.网A.该反应属于取代反应B.甲苯的沸点高于144 CC.用蒸储的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来10.K2C2O7溶液中存在平衡:Cr2O72-(橙色)+H2O- 2 CrO42-(黄色)+2H+。
用&52。
7溶液进行下列实验:结合实验,下列说法不正确的是A.①中溶液橙色加深,③中溶液变黄B.②中Cr2O72-被C2H50H还原学科.网C.对比②和④可知K2Cr2O7酸性溶液氧化性强D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色11.在两份相同的Ba(0H)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHS04溶液,其导电能力随滴入溶液体积变化的曲线如右图所示c 下列分析不正确.的是学.科.网A.①代表滴加H2 S04溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、0HC.c点,两溶液中含有相同量的0H「D.a、d两点对应的溶液均显中性12.用石墨电极完成下列电解实验现象a d处试纸变蓝;b处变红,局部褪色;两个石墨电极附近有气泡产c处无明显变化生;n处有气泡产生;下列对实验现象的解释或推测不合理..的是A、a、b 处:2H 2O 2e=H2 2OHB、b 处:2Cl 2e CI2…, 「一、一一_ 2C、c处发生了反应:Fe 2e FeD、根据实验一的原理,实验二中m处能析出铜第II卷25.(17 分)功能高分子P的合成路线如下:(1) A的分子式是C7 H8,其结构简式是。
2018 高职 化工生产技术 赛题

定时间进行处理和恢复正常运行,无论选手处理正确与否,扰动定时消
失,电脑随即记录成绩。
(3)冷态开车操作过程中,会随机出现 15 个提问对话框,需选手
作出回答。无论选手回答与否,对话框将定时消失,电脑随即记录成绩。
4. 丙烯酸甲酯事故库
表 2 丙烯酸甲酯事故库
序号
事故名称
序号
事故名称
事故 1 停电
事故 12 FV141 阀漏
事故 2 停蒸汽
事故 13 E112 冷却水压力低
事故 3 原料中断
事故 14 再沸器 E111 蒸汽压力变大
事故 4 T110 塔压增大
事故 15 T110 塔顶回流流量变小
事故 5 原料供应不足
事故 16 R101AA 进料流量过大
事故 6 P110A 泵故障
事故 17 R101 压力控制阀 PV101 阀卡
料至合适液位; (4)进料状态为常压,进料温度尽可能控制在泡点温度(自行控制),
进料量为≤60L/h,操作时进料位置自选,但需在进料前于 DCS 操作面板 上选择进料板后再进行进料操作;
(5)DCS 系统中的评分表经裁判员清零、复位且所有数据显示为零, 复位键呈绿色;
(6)设备供水至进水总管,选手需打开水表前进水总阀及回水总阀; (7)电已接至控制台; (8)所有工具、量具、标志牌、器具均已置于适当位置备用。 5.考核须知 (1)选手须在规定时间到检录处报到、检录,抽签确定竞赛工位; 若未按时报到、检录者,视为自动放弃参赛资格。 (2)检录后选手在候赛处候赛,提前 10 分钟进现场,熟悉装置流 程;自备并携带记录笔进入赛场。 (3)选手进入精馏赛场,须统一着工作服、戴安全帽,禁止穿钉子 鞋和高跟鞋,禁止携带火柴、打火机等火种和禁止携带手机等易产生静 电的物体,严禁在比赛现场抽烟。 (4)竞赛选手应分工确定本工位主、副操作岗位,并严格按照安全 操作规程协作操控装置,确保装置安全运行。 (5)选手开机操作前检查确定工艺阀门时,要挂红牌或绿牌以表示 阀门初起开关状态,考核结束后恢复至初始状态;对电磁阀、取样阀、 阻火器不作挂牌要求。 (6)竞赛选手须独立操控装置,安全运行;除设备、调控仪表故障
2018年北京化学竞赛试题答案
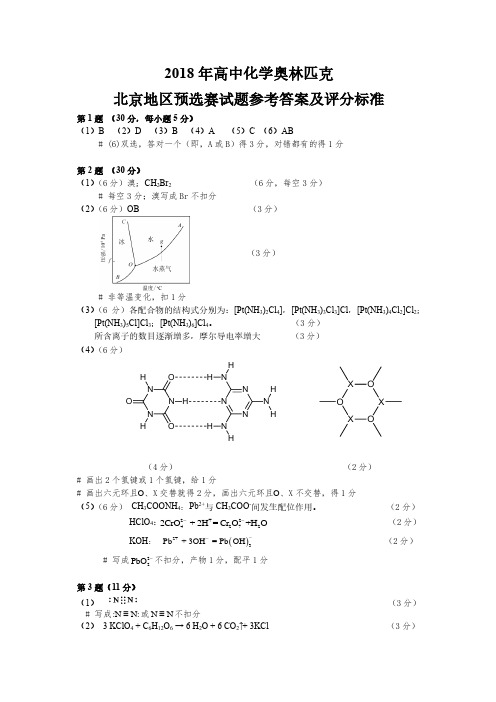
2018年高中化学奥林匹克北京地区预选赛试题参考答案及评分标准第1题 (30分,每小题5分)(1)B (2)D (3)B (4)A (5)C (6)AB# (6)双选,答对一个(即,A 或B )得3分,对错都有的得1分第2题 (30分) (1)(6分)溴;CH 2Br 2 (6分,每空3分)# 每空3分;溴写成Br 不扣分 (2)(6分)OB (3分)(3分)# 非等温变化,扣1分 (3)(6分)各配合物的结构式分别为:[Pt(NH 3)2Cl 4],[Pt(NH 3)3Cl 3]Cl ,[Pt(NH 3)4Cl 2]Cl 2;[Pt(NH 3)5Cl]Cl 3;[Pt(NH 3)6]Cl 4。
(3分) 所含离子的数目逐渐增多,摩尔导电率增大 (3分) (4)(6分)N N N OOOH HNNNNNN HH H HHO XOXO X(4分) (2分)# 画出2个氢键或1个氢键,给1分# 画出六元环且O 、X 交替就得2分,画出六元环且O 、X 不交替,得1分 (5)(6分) CH 3COONH 4:Pb 2+与CH 3COO -间发生配位作用。
(2分)HClO 4:2+242722CrO + 2H = Cr O +H O--(2分) KOH : ()2+3Pb + 3OH = Pb OH -- (2分)# 写成22PbO -不扣分,产物1分,配平1分第3题(11分)(1) (3分) # 写成:N N:≡或N N ≡不扣分(2) 3 KClO 4 + C 6H 12O 6 → 6 H 2O + 6 CO 2↑+ 3KCl (3分)# 产物2分,配平1分,不写↑不扣分 (3)Mg 或Al (3分) # 写出任何一个都得3分,写成汉字镁或铝得1分(4)电子跃迁,放出光的波长在可见光范围。
(2分)第4题(11分)(1)2SO 2 + O 2 + 2H 2O = 2H 2SO 4 (3分)(2)2FeS 2 + 7O 2 +2H 2O ======= 2FeSO 4 + 2H 2SO 4 (3分) (3)还原剂、提供能量 (2分) (4)Cu 2+ + ZnS = CuS + Zn 2+ (3分)第5题(9分)(1)I 2 + SO 2 + 2H 2O = H 2SO 4+ 2HI (3分)# 产物2分,配平1分(2)中和(1)中产生的酸,使其反应完全 (2分) (3)I 2 + SO 2 + H 2O + 3C 5H 5N + CH 3OH = C 5H 5NHSO 4CH 3+ 2C 5H 5NHI (2分) (4) m =ItM 96500n= 24.8×302×18.096500×2= 0.698 mg ; 34.9 mg·L –1 (2分)# 有效数字错误扣1分第6题(12分) (1)(50×4.2 + 33.5×0.84 )× 5.5 = 1310J = 1.3kJ (2分)1.3kJ ×160g·mol –1 ÷ 3.2g = 65 kJ·mol –1 (1分) 即,CuSO 4(s )= Cu 2+(aq ) + SO 42-(aq ) ∆H = -65 kJ·mol –1 (a ) (2分) 由(2)(50×4.2 + 33.5×0.84 )× 1.0 = 238J = 0.24 kJ (2分)0.24 kJ × 250 g·mol –1 ÷ 5.0g = 12 kJ·mol –1 (1分)即,CuSO 4·5H 2O (s )= Cu 2+(aq ) +SO 42-(aq )+ 5H 2O (l ) ∆H = 12 kJ·mol –1 (b )(2分)(a )-(b ):CuSO 4(s )+ 5H 2O (l )= CuSO 4·5H 2O (s ) ∆H = -77 kJ·mol –1 (2分)第7题(13分)(1)无色气体遇空气无明显变化。
7.北京化工大学化工原理历年真题

(Unit Operations of Chemical Engineering)
一、课程名称及对象
名称:化工原理(含实验) 对象:化工类专业硕士研究生入学考试用
二、理论部分 第一章 流体流动
1.流体流动概述与流体静力学 流体流动及输送问题;流体流动的考察方法;定态流动与非定态流动;流体流动的作用力;牛 顿粘性定律;流体的物性;压强特性及表示方法;静力学方程及应用;液柱压差计。 2. 流体流动的守恒原理 流量与流速的定义;流体流动的质量守恒;流体流动的机械能守恒;柏努利方程及应用;动量 守恒原理及应用。 3.流体流动的内部结构与阻力计算 雷诺实验;两种流动型态及判据;层流与湍流的特征;管流剪应力分布和速度分布;边界层概 念;边界层分离现象;直管阻力;层流阻力;摩擦系数;湍流阻力——量纲分析法;当量的概念(当 量直径,当量长度);局部阻力;流动总阻力计算。 4. 管路计算与流量测量 简单管路计算:管路设计型计算特点及方法、管路操作型计算特点及方法;复杂管路的特点及 计算方法;流动阻力对管内流动的影响;孔板流量计、文丘里流量计及转子流量计的测量原理和计 算方法。
第八章 气液传质设备
气液传质过程对塔设备的一般要求;塔设备类型及特点;板式塔的设计意图;板式塔的结构; 板上气液接触状态;塔板水力学性能和不正常操作现象;塔板负荷性能图;板式塔的效率;评价板 式塔的性能指标;常见塔板型式及特点;筛板塔工艺计算内容;填料塔结构;填料种类及特性;气 液两相在填料塔内的流动;填料塔压降与空塔气速的关系;最小喷淋密度;填料塔工艺计算方法; 填料塔内的传质。
第三章 流体通过颗粒层的流动
非均相分离概论;颗粒床层的特性;流体通过颗粒层的压降——数学模型法;过滤原理与设备; 过滤速率、推动力和阻力的概念——过滤速率工程处理方法;过滤基本方程及应用;过滤常数;恒 压过滤与恒速过滤;板框过滤机性能分析与计算;加压叶滤机性能分析与计算;回转真空过滤机性 能分析与计算;加快过滤速率的途径。
化工原理竞赛题及参考答案

化工原理竞赛题目及参考答案(总分120分,120分钟内完成)一.填空题(40分)1.(4分)当20℃的甘油(ρ=1261kg.m ,μ=1499厘泊)在内径为100mm的管内流动时,若流速为 1.5m.s 时,其雷诺准数Re为__________,其摩擦阻力系数λ为________. *****答案***** 126.2; 0.5072.(4分)流体在圆形直管中作层流流动,如果流量等不变,只是将管径增大一倍,则阻力损失为原来的________。
*****答案***** 1/163.(4分)牛顿粘性定律表达式为________,其粘性系数(粘度) 的大小与___________有关。
***答案***τ=F/A=μd.u/dy;物质种类及温度。
4.(4分) 用离心泵在两敞口容器间输液, 在同一管路中,若用离心泵输送ρ=1200kg.m 的某液体(该溶液的其它性质与水相同),与输送水相比,离心泵的流量___,扬程____,泵出口压力____,轴功率___。
(变大,变小,不变,不确定)***答案*** 不变不变变大变大5.(4分)水平放置的直角弯管如右图所示:已知:ρ水=1000kg.m ,ρ空气=1.29kg.m , R=51mm,则△p=p B-p A=_____ Pa,ξ=___(两测压点A.B间位差不计)*****答案*** -500;16.(2分)离心泵的性能曲线包括____,____和____,它们反映的是性能参数在____条件下的相互关系。
***答案***H-Q,η-Q,N-Q, n一定7.(2分)离心泵启动后旋转但不吸液,且伴有较大的杂音和振动,其原因很可能是____________。
*****答案***** 安装高度过高/气蚀8.(2分)悬浮液中加入助滤剂进行过滤的目的是___________________________________________。
****答案****在滤饼中形成骨架,使滤渣疏松,孔隙率加大,滤液得以畅流9.(3分)设离心机转鼓直径为1m,转速n=600 rpm,则在其中沉降的同一微粒,比在重力沉降器内沉降的速度快____________倍。
北京市2018年化工原理竞赛决赛题目-最终版

2018年北京市大学生化工原理竞赛决赛题目醋酸纤维素丝束生产过程会产生丙酮空气混合气,需要进行处理。
其处理方法包括吸收、吸附、渗透汽化等。
某公司拟采用吸收—精馏耦合工艺回收丙酮,请同学根据以下描述进行初步的工艺和设备设计。
丙酮空气混合气含丙酮1.5%(摩尔分数,下同),操作温度20℃,压力为1 atm,入塔混合气量为3000 m3/h,采用填料塔,用来自精馏塔的釜液作为吸收剂,吸收剂用量为最小用量的1.4 倍,要求尾气中丙酮的含量≤0.007%。
采用一连续板式精馏塔再生吸收富液。
精馏塔塔顶采用全凝器,泡点回流,塔釜采用间接水蒸汽加热,泡点进料,常压操作。
回流比取最小回流比的1.5倍。
要求塔顶产品中丙酮的组成为95%,塔釜产品中丙酮的组成为0.001%,返回填料吸收塔作为吸收剂。
近似满足恒摩尔流假定。
①设计工艺流程;②确定主要的操作参数和设备参数:吸收塔(流量组成,液气比,理论板数,高度,塔径),精馏塔(温度流量组成,回流比,理论板数,高度,进料位置,塔径);换热设备(冷热流股进出口温度,换热面积)(以精馏塔塔顶冷凝器为例);泵(流量,扬程,功率)(以吸收塔吸收剂进料泵,精馏塔进料泵为例)。
成果提交形式:1. 方案设计报告(WORD 文档)2. 汇报PPT所需要的数据可查阅《化工原理》教材及附录,其他未尽事宜,可咨询现场工作人员。
附录:(1)吸收相平衡关系为Y e=1.53X(摩尔比)。
(2)选用填料的等板高度为1m。
(3)塔板效率取40%,板间距取400mm。
(4)塔设备水平间距取10 m;管件当量长度取20 m;阻力系数λ取0.02。
(5)吸收塔和精馏塔的空塔气速均取1m/s。
不需要进行塔板和填料详细结构尺寸设计。
不考虑塔板和填料的压降。
(6)精馏塔塔顶冷凝器采用列管式换热器;总传热系数K如表1所示。
(7)丙酮-水的汽液平衡关系图(图1(a)和(b))及拟合关系式如下。
图1(a) 丙酮-水t-x-y图(1 atm)图1(b) 丙酮-水y-x图(1 atm)丙酮-水y-x拟合关系式如下:y = -62.097x6 + 208.66x5 - 274.37x4 + 179.07x3 - 60.455x2 + 9.9691x + 0.1996表1. 列管式换热器总传热系数K冷流体热流体总传热系数K W/(m2·℃)水空气50水610 有机质蒸汽1100水沸腾水蒸汽冷凝2500。
2018北京市化学竞赛试题及答案(4.15)

;
II. 夏天将衣服晾干,请在图中用虚线画出水的状态变化(g 点是湿衣服中水的起始状
态,此时空气中水的蒸气压为 f Pa)。
(3)已知:CuSO4·5H2O 的结构式为 Cu(H2O)4SO4·H2O。某同学测定下列配合物在水中的摩 尔电导率如下表所示。试从结构角度说明下列各配合物摩尔导电率变化的原因。
D.向盐酸中滴加氨水
滴加溶液的体积
(4)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所 1000 NaF
示。下列判断不.正.确.的是 A.TiF4 的熔点反常升高是由于氢键的作用 B.NaX 随 X–半径增大,离子键减弱 C.NaX 均为离子化合物
熔点 / oC
800
NaCl NaBr
TiF4
NaI
2018 年高中化学奥林匹克北京地区预选赛试卷 (共 7 页)
-2-
(3)溶液的导电性与溶液中离子的种类和浓度有关,下列 导
各组实验过程的被滴加溶液导电性变化与右图对应的是
电 能
A.向 Ba(OH)2 溶液中滴加 H2SO4 溶液
力
B.向醋酸溶液中滴加 NaOH 溶液
C.向糖水中滴加 NaCl 溶液
2018 年高中化学奥林匹克北京地区预选赛试卷 (共 7 页)
-1-
2018 年高中化学奥林匹克
北京地区预选赛试卷
(2018 年 4 月 15 日上午 9:00-11:00)
·姓名、准考证号和所属区、县、学校必须填写在答题纸指定位置,写在其他处者按废卷处理。 ·竞赛时间 2 小时。迟到超过 30 分钟者不得进场。开赛后 1 小时内不得离场。考试结束后,把试卷
(背面向上)放在桌面上,立即离场。 ·竞赛答案全部写在答题纸指定位置上,使用黑色或蓝色圆珠笔、签字笔、钢笔答题,使用红色笔或
2018年全国化学竞赛初赛试题答案与解析

题目:化学反应速率与化学计量数的关联
解析:化学反应速率与化学计量数呈正相关,即反应速率随着反应物浓度的增加而增加,随 着反应物浓度的减小而减小。
题目:化学平衡常数的计算
解析:化学平衡常数是描述化学反应平衡状态的重要参数,可以通过平衡时各组分的浓度计 算得出。
简述化学反应速率的影响因素。
解释酸碱指示剂的作用原理。
XX,aies
汇报人:XX
CONTENTS
PART ONE
PART TWO
考试时间:2018年5月19 日(星期六)上午9:0012:00
考试地点:各省市级重点中 学
考试形式:闭卷、笔试 试卷结构:单选题、填空题、简答题、计算题等题型 分值分布:各题型分值分布情况 考试时间:总时长及各部分用时
考试科目:化学 考试形式:笔试 考试时间:3小时 试题难度:中等
PART THREE
考查知识点:化学基础知识
注意事项:注意题目中的陷阱和易 错点,避免因疏忽而选错答案。
添加标题
添加标题
添加标题
添加标题
解题思路:根据题目给出的选项, 逐一分析每个选项的正确性或错误 性,并给出相应的解释。
示例:针对题目“下列哪个选项是正 确的?”给出四个选项,分别对每个 选项进行分析和解释,最终给出正确 答案。
答案:$17/22.4$
题目:在标准状况下,$11.2LCO_{2}$所含分子数为____个。 答案:$3.01 \times 10^{23}$
答案:$3.01 \times 10^{23}$
题目:在标准状况下,$11.2LSO_{2}$的质量是____$g$。 答案:$34$
答案:$34$
简答题1答案: B
提高解题速度,通过大量练习 来提高解题效率和准确性。
2018年九年级五科联赛化学试题含答案

2018年九年级竞赛化学试卷题 号一 二 三 四 五 总 分 得 分(理化考试时间150分钟 化学满分80分)可能用到的相对原子质量:H-1 C-12 O-16 N-14 S-32 Cl-35.5 Zn-65一、选择题(本大题包括12道小题,共16分。
每小题只有一个正确答案,1-8小题每小题1分,9-12小题每小题2分,请将正确答案前 的字母填入下表内) 题号 12 3 4 5 6 7 8 9 10 11 12答案1.日常生活中接触到的下列变化,其中属于化学变化的是A.瓷碗破碎B.牛奶变酸C.用活性炭净化水D.湿衣服晾干2.下列符号中,表示两个氢原子的是A. H 2B. 2H +C. 2HD. 2H 23.下列错误的实验操作中,可能引起安全事故的是4.市场上出售的消毒水中含有一种叫次氯酸钠的物质,其中氯元素的化合价是+1价, 则该物质的化学式是A.NaClO 3B.NaClO 2C.NaClOD.NaClO 45.下列物质分别加入适量水中充分搅拌,不能得到溶液的是A.酒精B.食盐C.蔗糖D.茶油6.同时进行以下实验,蜡烛火焰最先熄灭的是得分 评卷人7.关于分子、原子、离子的说法,其中正确的是A.原子是最小的粒子,不可再分B.钠原子的质子数大于钠离子的质子数C.当二氧化碳气体变成干冰时,二氧化碳分子间不存在间隔D.分子、原子、离子都可以直接构成物质8.下列分别是实验室制取、收集、检验二氧化碳并验证其性质的装置图.其中有错误的是A B C D9.下列做法不符合“节能减排”这一要求的是A.推广使用以氢氧燃料电池提供动力的客车B.综合利用化石能源C.在田野里大量焚烧秸秆D.随手关闭电源开关,关紧水龙头10.下列说法正确的是A.在化学反应中只有燃烧才能放热B.地壳中含量最多的金属元素是氧C.将石油分馏可以得到多种产品D.合金的各种性能都比纯金属好11.现有一杯20℃的硝酸钾饱和溶液,欲改变其溶质质量分数,下列方法可行的是A.加入一定量的硝酸钾B.恒温蒸发部分水C.升温到60℃D.加入一定质量的水12.50g10%的食盐溶液与30g10%的食盐溶液混合,混合后得到的溶质质量分数是A.5%B.10%C.20%D.无法计算二、填空题(本大题包括4道小题,每空1分.共16分)得分评卷人石蕊溶液——澄清的石灰水——稀盐酸和石灰石CO2→CO2→13.写出下列化学符号:5个二氧化硫分子____ m个铝原子____ 2个亚铁离子____氦气____ 饱和氯化钠溶液中,存在的微小粒子是_______________14.在家庭生活中,自来水经过处理后,用途更加广泛。
2018年化学真题及解析_2018年北京市高考化学试卷
2018年北京市高考化学试卷一、选择题(共7小题,每小题6分,共42分.每题只有一个正确选项)1.(6.00分)下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是()A.A B.B C.C D.D2.(6.00分)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH 的催化反应历程。
该历程示意图如下。
下列说法不正确的是()A.生成CH3COOH总反应的原子利用率为100%B.CH4→CH3COOH过程中,有C﹣H键发生断裂C.①→②放出能量并形成了C﹣C键D.该催化剂可有效提高反应物的平衡转化率3.(6.00分)下列化学用语对事实的表述不正确的是()A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218OB .常温时,0.1mol•L ﹣1氨水的pH=11.1:NH 3•H 2O ⇌NH 4++OH ﹣C .由Na 和Cl 形成离子键的过程:→D .电解精炼铜的阴极反应:Cu 2++2e ﹣═Cu4.(6.00分)下列实验中的颜色变化,与氧化还原反应无关的是( )A .AB .BC .CD .D 5.(6.00分)一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料,其结构片段如下图。
下列关于该高分子的说法正确的是( )A .完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境B .完全水解产物的单个分子中,含有官能团一COOH 或一NH 2C .氢键对该高分子的性能没有影响D .结构简式为:6.(6.00分)测定0.1mol•L ﹣1 Na 2SO 3溶液先升温再降温过程中的pH ,数据如下:实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl 2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是()A.Na2SO3溶液中存在水解平衡:SO32﹣+H2O⇌HSO3﹣+OH﹣B.④的pH与①不同,是由于SO32﹣浓度减小造成的C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致D.①与④的K W值相等7.(6.00分)验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaC1溶液)。
2018初中化学竞赛精彩试卷试题及问题详解

实用文档2021 年全国初中学生化学素质和实验能力竞赛第二十一届天原杯〕复赛试题题号一二三四总分得分试题说明:1.本试卷共8页,总分值100分。
<附加题供选用〕2.可能用到的相对原子质量:H:1C:12N:14O:16Na:23Mg:24S:32Cl:35.5K:39Ca:40Fe:56Cu:64Zn:65Ag:108 zWCAQpDeDO考试时间:2小时得分评卷人一、选择题(此题包括15个小题,每题2分,共30分。
每小题有1个或2个选项符合题意。
假设有两个答案的错1个不得分,漏选1个扣1分。
请将答案填在下表相应题号的空格内。
〕题号123456789101112131415答案1.联合国决定2021年为“国际化学年〞,以纪念化学所取得的成就以及对人类文明的贡献为宗旨。
以下提法不符合其宗旨的是<〕zWCAQpDeDO ...D.化学是一门创造新物质的科学,是自然科学中创造新物质最多的科学领域E.普及化学知识,宣传化学奉献,提高公众科学素质F.让公众更多地了解化学为满足社会需求所作出的奉献,鼓励人们尤其是青少年学习化G学的兴趣,激发他们创造未来化学的热情zWCAQpDeDOH.推广食用不含任何化学物质的绿色食品2.关于天然气的以下表达中不正确的是(>zWCAQpDeDO ....天然气和沼气的主要成分都是甲烷.液化石油气灶具改为天然气作燃料,燃烧时应减小进空气量或增大进天然气量C.天然气与空气混合点燃,不会发生爆炸D.与煤炭相比,天然气燃烧产生的废气中,SO2等污染物较少3.三甲基一氯硅[(CH3>3SiCl]是一种生产有机硅化合物的原料,遇明火或氧化剂会引起爆炸,在空气中燃烧生成一氧化碳、二氧化碳、二氧化硅和氯化氢,与水接触可产生雾状盐酸。
那么以下说法错误的是<〕zWCAQpDeDO ...保存三甲基一氯硅时应密封防水B.扑灭三甲基一氯硅引发的着火,应使用二氧化碳、干粉灭火剂,并用弱碱性水处理C.三甲基一氯硅水溶液pH一定小于7.三甲基一氯硅由碳、氢、硅、氯四个原子构成.根据“绿色化学〞的思想,某化学家设计了以下化学反响步骤:该方案的主要目的是为了制备<〕zWCAQpDeDOA.HBr B.CaO C.H2大全实用文档5.新型纳M材料MFe2O x(3<x<4>中M表示+2价的金属元素,在反响中化合价不发生变化。
化工原理竞赛题及参考答案

化工原理竞赛题目及参考答案(总分120分,120分钟内完成)一.填空题(40分)1.(4分)当20℃的甘油(ρ=1261kg.m ,μ=1499厘泊)在内径为100mm的管内流动时,若流速为 1.5m.s 时,其雷诺准数Re为__________,其摩擦阻力系数λ为________. *****答案***** 126.2; 0.5072.(4分)流体在圆形直管中作层流流动,如果流量等不变,只是将管径增大一倍,则阻力损失为原来的________。
*****答案***** 1/163.(4分)牛顿粘性定律表达式为________,其粘性系数(粘度) 的大小与___________有关。
***答案***τ=F/A=μd.u/dy;物质种类及温度。
4.(4分) 用离心泵在两敞口容器间输液, 在同一管路中,若用离心泵输送ρ=1200kg.m 的某液体(该溶液的其它性质与水相同),与输送水相比,离心泵的流量___,扬程____,泵出口压力____,轴功率___。
(变大,变小,不变,不确定)***答案*** 不变不变变大变大5.(4分)水平放置的直角弯管如右图所示:已知:ρ水=1000kg.m ,ρ空气=1.29kg.m , R=51mm,则△p=p B-p A=_____ Pa,ξ=___(两测压点A.B间位差不计)*****答案*** -500;16.(2分)离心泵的性能曲线包括____,____和____,它们反映的是性能参数在____条件下的相互关系。
***答案***H-Q,η-Q,N-Q, n一定7.(2分)离心泵启动后旋转但不吸液,且伴有较大的杂音和振动,其原因很可能是____________。
*****答案***** 安装高度过高/气蚀8.(2分)悬浮液中加入助滤剂进行过滤的目的是___________________________________________。
****答案****在滤饼中形成骨架,使滤渣疏松,孔隙率加大,滤液得以畅流9.(3分)设离心机转鼓直径为1m,转速n=600 rpm,则在其中沉降的同一微粒,比在重力沉降器内沉降的速度快____________倍。
化工原理下册考试题及答案市公开课一等奖省赛课微课金奖课件

传质单元高度: HOG=G/Kya=0.0382/0.0522=0.732m
传质单元数:
NOG
y1 y2 ym
0.03 0.001 2.46 103
11.79
• 所需塔高:
• H=HOGNOG=0.732×11.79=8.63m
9/19
欲回收二元理想混合物中易挥发组分A。流程图以下。 塔①和塔②回流比R都为3。加料回流均为饱和液体。已 知xF=0.5, xD=0.9, xB=0.2, xG=0.4(均为摩尔分数),F =100kmol/h。 整个流程可使易挥发组分A回收率达90%。试求: 塔②塔釜蒸发量(kmol/h); (2)写出塔①中间段(F和G之间)操作线方程。
• Y1=2.6X1
• 解得X1=0.03174
(3分)
• 第2级: 12×(0.03174-X2)=7.5Y2
• Y2=2.6X2
• 解得X1=0.01209
(3分)
•
(2分)
18/19
• 五:简答题(共1小题,共5分) • 工业吸附对吸附剂有哪些基本要求? • 答案关键点及评分标准:(每个关键点1
5/19
• 6. 伴随R减小,精馏段操作线愈靠近平衡线,到达一 定分离要求所需理论板数越少。( × )
• 7. 精馏设计时,若回流比R增加,则意味产品D减小。 (√)
• 8. 厢式干燥器传热方式是热传导。( × ) • 9. 在一定温度下,物料中结合水分与非结合水分划分
只与物料本身性质相关,而与空气状态无关。( √ ) • 10. 干燥过程中,若增大空气出口湿度H时,可降低空
答案涂黑即可
1.当温度增高时,溶质在气相中分子扩散系数将_增加__, 在液相中分子扩散系数将_增加___。 2.利用吸收操作分离气体混合物是以混合气中各组分在某 一液体吸收剂中_____溶解度____不一样作为依据。 3. 在y-x图中,以A组份标绘平衡曲线在对角线左上方,则表示 A组分比B组分挥发度___高___.平衡曲线若在对角线右下方, 则表示A组分比B组分挥发度___低__. 4.分离一些α靠近1物系时,可采取一些特殊精馏方法,如__ 萃取精馏_____,___恒沸精馏______. 5.在连续精馏操作中,普通将精馏塔中以加料板以上部分 称为_____精馏段___,加料板以下部分(包加料板)称为 _____提馏段_____。 6.工业生产中操作回流比普通是最小回流比_____ 1.1~ 2___倍。
2018年全国中学生化学竞赛预赛(北京地区)真题_201912022024571

2018年全国中学生化学竞赛预赛(北京地区)真题2018年高中化学奥林匹克北京地区预选赛试卷(2CH8年4月15日上午9:00-1丄:00)*兼堪.堆専遊量料折興医* JL卒技处靓專胃在尊後财》屋位置,菱在其■喰H享馨处耋.•!-h»t.堰露厦址M 斜kt不専3-齐春用1卓叶内不書書携.専械增東用,也读購《廿微旬上)漱在景■上,立即点考.*髭击等奏.鈿》埒在嘗塚旣指案上,遂舄赃成意色■*路、蚱字莖、軻蟾4MN,快其虹也義貌««*«#.读尊律康无JL•紛Ht同非(MS甘鼻握民直尺爺文共・,域意墮卷對蠹触座.可黄用到的元素相耐頂子质呻下;fi-8.314J.mG]1 K h ®Mr (J0 -273 +/ (t)Klfl选择圈(30分〉l単逸城事1臨每黑5分〉(1)下舛玻璃仪覇的渋海方法不項役箇化还璋及应的是A.障春银鏡的试皆用成禎酸済沌B.附有油脂的烧林用愁洗碱滔沼清必C.附有MnS的烧瓶用想的沌盐酸清洗D.附有篱旳燃烧迓用热的烧碱溶陂清洗T列渕钻止礙的是A.试音I中浅SL^fe气体为NO如由硝酷遥原生成B.等质量的备完全汚解眨- 1中消耗卽HH6更爭C.換成Fe.己后皇昱实验,恢芯是忒管U中反应夏剧钏0.试管1[中度应后溶液翱色与试电M中旳不同,是由于洛有HQj(3)溶液的导电性与溶液中离子的牌类和浓度有关,下列 各也实愈过程的核淄加溶液导电性变化与右图对应的是A. 向BKOHJi 溶液中淄如H£0<溶液B.向胎酸溶液中淄加MaOH 溶液C 向挺水中滴.如NaCl 溶液 D. 向盆酸中淄如氛水(4)卤化钠(MaZ )和四卤化保(Ti 幻)的培点纱图所 示.下列判断不正确的是A.価的培点反常升高是的于堑键的作用 B N 宓随Z-半径増大,寫子键綫弱 C N 畝均为离子化合物 D IlCL,为共价化合啲(5)钠-組化修电池是以F-AIQJAIQM&O 用为固住电解质拘成的一神新塑高能电池 (2Na + NiCl, =J= Ni* 2NaCl ),其蜻拘纱图所示. 下列关于该电池的所述做後的是A.放电8lNaCl 在培舫电解痰中生成 B 充电旳陽极反应:N a - + e -=NaC 编离于通过f-AbO 寺)ffi 两电扱冋移动 D.如果电池过度放电,A1C1:可能核还原(6)最近我国利学穿预测并裾此台成了新型砍射斜:T 碳.可以宕作金刖石结肉中的一个 砍原子极四个破原子物成一个正四面体结构单元苔代(如下图所示,所有小遂都代表破原子).下列说法正确的是T*A. T 」琰与石墨、金刖石互为同案异形体B. T 破晶体与金刖石晶体类似,属于原子晶体C. T 破晶体和金刖石晶体中舎有的化学锻不同D. T 礙与金刖石中的成原子采發的奈化方式不同导电NiCh/MaAlCLiCl) * _£-AlQ*5)NaQ) 金属外売(-)第2JK 回啓下列间•!《30分)(1) 质谱中同位黙帯来的特征燈可用来接定某些元京.某斜代烷或候代姪的质谱中分子离 子峰如左下图所示.絢和渙的天然同位寮丰度比分别^«C1:«C1«3:1; «Br:^'Brsl :1. 该有机物 _______ 弋烷:其分子式是 _____ .(2) 右上图是水的相图,每一条域表示两相共存,比如,OC 表示冰-水共存.I 冰-气共存线是 ______ ;II.复大将衣必晾干,诺在图中用质绒画出水的状态咬化(g 点是湿衣羅中水的起始狀 态,此时空气中水的蒸气压为fPa).(3) 已如:CuS04-5H,。
高一化学-2018年高一化学联赛测试试题及答案【北京市

I 卷一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)1.下列物质中既能导电又属于强电解质的是A .KCl(aq)B .KNO 3(l )C .HCl (l )D .Ba(OH)2(s ) 2.下列叙述正确的是 A .稀硝酸、稀硫酸均能将木炭氧化成二氧化碳B .Na 2O 2与水反应,红热的Fe 与水蒸气反应均能生成碱C .Li 、C 、P 分别在足量氧气中燃烧均生成一种相应氧化物D .NaHCO 3、Na 2CO 3、(NH 4)2CO 3三种固体受热后均能生成气体3.据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。
某种氢氧燃料电池的电解液为KOH 溶液。
下列有关该电池的叙述不正确的是 A .正极反应式为:O 2+2H 2O+4e -===4OH -B .工作一段时间后,电解液中KOH 的物质的量变小C .该燃料电池的总反应方程式为:2H 2+O 2===2H 2OD .用该电池电解CuCl 2溶液,产生2.24LCl 2(标准状况)时,有0.2mol 电子转移 4.对下列装置.不添加其他仪器无法检查气密性的是5.下列说法正确的是 A .难失电子的原子,得电子的能力一定强密 封 线 内 不 要 答 题B.易得电子的原子,失电子的能力一定弱C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大D.任何原子的原子核都是由质子和中子构成的6.下列化合物中,既含有极性键又含有非极性键的是A.Na2O2B.NH4Cl C.CH4D.C2H67.下列离子方程式中,只能表示一个化学反应的是①Fe+Cu2+===Fe2++Cu ②Ba2++2OH--+2H++SO42-===BaSO4↓+2H2O③Cl 2+H2O H++Cl-+HClO ④CO32-+2H+===CO2↑+H2O ⑤Ag++Cl-===AgCl↓A.③B.②③C.③⑤D.①④8.可以作为判断元素非金属性强弱的依据是A.元素最高价氧化物对应的水化物的碱性的强弱B.元素氧化物对应的水化物的酸性的强弱C.元素的单质与酸反应置换出氢的难易D.元素的单质与氢气生成气态氢化物的难易以及氢化物的稳定性9.1mol过氧化钠与1mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是A.Na2CO3B.Na2O2Na2CO3C.NaOH Na2CO3D.Na2O2NaOH Na2CO3 10.检验氯化氢气体中是否混有Cl2,可采用的方法是A.用干燥的蓝色石蕊试纸B.用干燥有色布条C.将气体通入硝酸银溶液D.用湿润的淀粉碘化钾试纸11.常温下,在溶液中可发生以下反应:①16H+ +10Z-+2XO4-=== 2X2+ +5Z2 +8H2O,②2M2++R2 ===2M3++ 2R-,③2 R-+Z2 ===R2 +2Z-,由此判断下列说法错误的是A.常温下反应2M2+ + Z2 === 2M3+ + 2Z-可以自发进行B.Z元素在反应①中被氧化,在③中被还原C.氧化性强弱顺序为:XO4-<Z2 <R2 <M3+D.还原性强弱顺序为:X2+ <Z-<R-<M2+12.向含有大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是A.K+、Br-、CO32-B.Al3+、H+、MnO4-C.NH4+、Fe3+、SO42-D.Ag+、Cu2+、NO3-13.下列叙述不正确的是A .金属与盐溶液的反应不一定都是置换反应B .简单阴离子都只有还原性C .与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物D .分子晶体中一定存在范德瓦耳斯力,不一定存在共价键14.铜粉放入稀硫酸溶液中,加热后无明显变化,但加入下列某试剂一段时间后,发现铜粉质量减少,溶液呈蓝色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018年北京市大学生化工原理竞赛
决赛题目
醋酸纤维素丝束生产过程会产生丙酮空气混合气,需要进行处理。
其处理方法包括吸收、吸附、渗透汽化等。
某公司拟采用吸收—精馏耦合工艺回收丙酮,请同学根据以下描述进行初步的工艺和设备设计。
丙酮空气混合气含丙酮1.5%(摩尔分数,下同),操作温度20℃,压力为1 atm,入塔混合气量为3000 m3/h,采用填料塔,用来自精馏塔的釜液作为吸收剂,吸收剂用量为最小用量的1.4 倍,要求尾气中丙酮的含量≤0.007%。
采用一连续板式精馏塔再生吸收富液。
精馏塔塔顶采用全凝器,泡点回流,塔釜采用间接水蒸汽加热,泡点进料,常压操作。
回流比取最小回流比的1.5倍。
要求塔顶产品中丙酮的组成为95%,塔釜产品中丙酮的组成为0.001%,返回填料吸收塔作为吸收剂。
近似满足恒摩尔流假定。
①设计工艺流程;
②确定主要的操作参数和设备参数:吸收塔(流量组成,液气比,
理论板数,高度,塔径),精馏塔(温度流量组成,回流比,
理论板数,高度,进料位置,塔径);换热设备(冷热流股进
出口温度,换热面积)(以精馏塔塔顶冷凝器为例);泵(流量,
扬程,功率)(以吸收塔吸收剂进料泵,精馏塔进料泵为例)。
成果提交形式:
1. 方案设计报告(WORD 文档)
2. 汇报PPT
所需要的数据可查阅《化工原理》教材及附录,其他未尽事宜,可咨
询现场工作人员。
附录:
(1)吸收相平衡关系为Y e=1.53X(摩尔比)。
(2)选用填料的等板高度为1m。
(3)塔板效率取40%,板间距取400mm。
(4)塔设备水平间距取10 m;管件当量长度取20 m;阻力系数λ取
0.02。
(5)吸收塔和精馏塔的空塔气速均取1m/s。
不需要进行塔板和填料详
细结构尺寸设计。
不考虑塔板和填料的压降。
(6)精馏塔塔顶冷凝器采用列管式换热器;总传热系数K如表1所示。
(7)丙酮-水的汽液平衡关系图(图1(a)和(b))及拟合关系式如下。
图1(a) 丙酮-水 t-x-y图(1 atm)
图1(b) 丙酮-水 y-x图(1 atm)
丙酮-水 y-x拟合关系式如下:
y = -62.097x6 + 208.66x5 - 274.37x4 + 179.07x3 - 60.455x2 + 9.9691x + 0.1996
表1. 列管式换热器总传热系数K
冷流体热流体总传热系数K W/(m2·℃)
空气50
水610 水
有机质蒸汽1100 水沸腾水蒸汽冷凝2500。
