磺胺醋酰钠的合成实验思考题
磺胺醋酰钠

磺胺醋酰钠的合成一、药物概述二、实验目的要求三、实验原理四、实验主要仪器和试剂及其物理目录常数五、本次实验方法和步骤六、其他合成线路和方法改进七、问题和讨论一、药物概述磺胺醋酰钠,又名磺胺乙酰钠,磺醋酰胺钠,化学名为N-[(4- 氨基苯基)- 磺酰基]- 乙酰胺钠,化学分子式:C 8H 9N 2O 3SNa ,本品为白色结晶性粉末,无臭、微苦、易溶于水,微溶于乙醇、丙酮。
遇光易变质,需避光保存。
[1]药理作用磺胺醋酰钠为短效磺胺类药物,具有广谱抑菌作用。
其对大多数革兰氏阳性和阴性菌有抑制作用,并对真菌有一定作用[2]。
因与对氨基苯甲酸竞争细菌的二氢叶酸合成酶,使细菌代谢受阻,无法获得所需嘌呤和核酸,导致细菌生长繁殖受抑制[3]。
磺胺醋酰钠制剂类型主要为滴眼液,在临床上主要应用于沙眼、结膜炎等眼科感染[4],也用于霉菌性角膜炎、沙眼和衣原体感染的辅助治疗,以及结膜、角膜和内眼手术的前、后预防感染[1]。
不良反应:有局部刺激性,如烧灼感、疼痛等;局部滴眼后可引起眼部过敏反应,如:眼睑红肿、结膜充血、流泪、接触性皮炎等。
二、实验目的1.通过本实验,掌握磺胺类药物的一般理化性质,并掌握如何利用其理化性质的特点来达到分离提纯产物的目的。
2.通过本实验操作,掌握乙酰化反应的原理。
三、实验原理以磺胺作为原料,以醋酐作为酰化剂,在碱性条件下进行合成反应,将磺酰氨基乙酰化后得到磺胺醋酰,再与NaOH反应制备磺胺醋酰钠。
1.醋酰的制备(乙酰化反应)醋酐磺胺磺胺醋酰2.磺胺醋酰钠的制备(成盐反应)磺胺醋酰钠副反应及除杂副反应及除杂四、实验主要仪器和试剂及其物理常数主要仪器三颈烧瓶,温度计,冷凝管,烧杯,布氏漏斗,抽滤瓶,恒温水浴锅,磁子,电子天平,吸量管,玻璃棒,表面皿,量筒,胶塞。
试剂磺胺,醋酐,22.5%氢氧化钠溶液,77%氢氧化钠溶液,40%氢氧化钠溶液,浓盐酸,10%盐酸。
实验装置图试剂名称分子式分子量熔点沸点性状溶解性磺胺C7H8N2O3S 172.21 165-166℃白色颗粒或粉末状结晶,无臭,味微苦。
方案一 磺胺醋酰钠的合成

实验五磺胺醋酰钠的合成一、实验目的1、加深对磺胺类药物一般理化性质的认识。
2、通过实验掌握乙酰化反应的原理及成盐反应。
3、通过磺胺醋酰钠的合成,掌握如何控制反应过程的pH、温度等条件及利用生成物与副产物不同的性质来分离副产物。
二、实验原理【1】磺胺醋酰钠在临床上主要制成滴眼液,用于沙眼、结膜炎等眼科感染。
磺胺的N1和N4均可被乙酰化,当N1成单钠盐离子型时,反应活性增强,可主要乙酰化于N1上,故可在氢氧化钠和醋酐交替加料,控制pH12~14,保持N1为钠盐时,来制取磺胺醋酰钠。
实验中常以药用磺胺为原料,醋酐为酰化剂,吡啶做催化剂,在pH12~14的碱性液中对N1进行选择性酰化来制备磺胺醋酰;精制得符合熔点要求的磺胺醋酰后,用5%NaOH乙醇液与其成盐来制备磺胺醋酰钠。
与课本方案相比:通过加吡啶做催化剂,提高了醋酐的酰化能力,用5%NaOH乙醇液代替40% NaOH水溶液与磺胺醋酰成盐,简化了操作,提高了磺胺醋酰钠的收率。
NH2SO2NH2(CH3CO)2ONaOHpH12-13+NH2SO2NCOCH3NapH7-8 NH2SO2NHCOCH3NH2SO2NCOCH3NaHClpH4-5NaOH三、实验试剂与仪器【2】1.原料规格及配比参数。
原料名称规格用量摩尔数摩尔比沸点(℃)溶点(℃)分子量磺胺Cp 17.2g 0.1 1.00 172.21 醋酐CP 13.6ml 0.142 1.42氢氧化钠22.5% 22ml 0.1125 1.13 1390 318.4 40氢氧化钠77% 12.5ml 0.1925 1.90 1390 318.4 40吡啶CP 5滴115.3 79.10 磺胺醋酰自制183 214.24 磺胺醋酰钠自制257 236.232.仪器与规格。
仪器规格或型号数量恒温水浴锅1只电热套100ml 1只圆底瓶100ml/24mmX1 2只球形冷凝管290ml/24mmX2 1只电动搅拌器1台烧杯100ml 1只玻璃漏斗80mm 1只温度计100℃1支直形冷凝管290mm/24mmX2 1支真空接受管24mmX2 1只滴液漏斗125ml/24mmX2 1只三颈瓶250ml/24mmX3 1只吸滤瓶250ml 1只布氏漏斗60mm 1只量筒10ml 1只量筒100ml 1只电动搅拌器I台;温度计100%1支;量杯lOml、lOOml各1只;球形冷凝管30cm 1支;三颈瓶250ml 1只;烧杯lOOml 1只;恒温水浴锅双孔1台;吸滤瓶250ml 1只;布氏漏斗60mm 1只三、实验步骤(一)磺胺醋酰的制备1、在装有搅拌棒、温度计和回流冷凝管的100 mL三颈瓶中,加入磺胺17.2 g,22.5%氢氧化钠22 mL,开动搅拌,于水浴上加热至50℃左右。
药化实验作业

磺胺醋酰钠的合成药学院黄腾2008302290084一、实验目的1.学习实验室合成磺胺醋酰钠的方法和操作步骤2.熟悉减压蒸馏的操作二、实验基本原理磺胺醋酰钠在实验室通常以磺胺为原料,与醋酐在碱性条件下发生乙酰化反应,生成主产物磺胺醋酰钠盐,及副产物磺胺钠盐和双乙酰磺胺钠盐。
根据三者酸性强弱的差别通过调pH值,而达到分离、提纯,最后得到本品。
反应如下:NH2SO2NH2(CH3CO)2ONaOHpH12-13+NH2SO2NCOCH3NapH7-8 NH2SO2NHCOCH3NH2SO2NCOCH3NaHClpH4-5NaOH三、实验试剂磺胺8.6g、22.5%氢氧化钠、43.5%氢氧化钠、醋酐3.6mL、36%盐酸四、实验步骤(一)磺胺醋酰的制备在装有搅拌棒及温度计的100 mL三颈瓶中,加入磺胺8.6 g,22.5%氢氧化钠11 mL,开动搅拌,于水浴上加热至50℃左右。
待磺胺溶解后,分次加入醋酐6.8 mL,43.5% 氢氧化钠6.3 mL(首先,加入醋酐1.8 mL,43.5% 氢氧化钠1.3 mL;随后,每次间隔5 min,将剩余的43.5% 氢氧化钠和醋酐分5次交替加入)。
加料期间反应温度维持在50~55℃;加料完毕继续保持此温度反应30 min。
反应完毕,停止搅拌,将反应液倾入250 mL烧杯中,加水10 mL稀释,于冷水浴中用30% 盐酸调至pH 7,放置10 min,并不时搅拌析出固体,抽滤除去。
滤液用30% 盐酸调至pH 4~5,抽滤,得白色粉末。
用3倍量(3 mL / g)10% 盐酸溶解得到的白色粉末,不时搅拌,尽量使单乙酰物成盐酸盐溶解,抽滤除不溶物。
滤液加少量活性碳室温脱色10 min,抽滤。
滤液用43% 氢氧化钠调至pH 5,析出磺胺醋酰,抽滤,压干。
干燥,测熔点(mp.179~184℃)。
若产品不和格,可用热水(1:5)精制。
(二)磺胺醋酰钠的制备将磺胺醋酰置于50 mL烧杯中,于90℃热水浴上滴加计算量的20%氢氧化钠至固体恰好溶解,放冷,析出结晶,抽滤(用丙酮转移),压干,干燥,计算收率。
磺胺醋酰钠的制备.
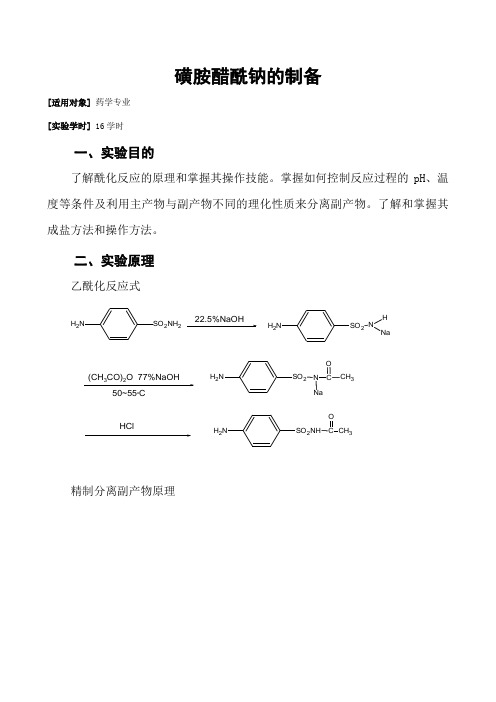
磺胺醋酰钠的制备[适用对象] 药学专业 [实验学时] 16学时一、实验目的了解酰化反应的原理和掌握其操作技能。
掌握如何控制反应过程的pH 、温度等条件及利用主产物与副产物不同的理化性质来分离副产物。
了解和掌握其成盐方法和操作方法。
二、实验原理乙酰化反应式SO 2NH 2NH 222.5%NaOHSO 2N H 2NH NaSO 2N H 2NH CH 3OCH 3OSO 2N H 2N50~55o CHCl(CH 3CO)2O 77%NaOH精制分离副产物原理NH 2SO 2NHNaPH=14N H 2SO 2NNaCOCHN H 2SO 2NHN aNHSO 2NHN aH 3COCNHSO 2NNaCOCHH 3COCN H 2SO 2NNaCOCH3NHSO 2NH 2H 3COCNHSO 2NNaCOCH3H 3COCNH 2SO 2NH 2HCL PH4NH 2SO 2NHCOCHNHSO 2NHCOCH3COC1O%HCLNHSO 2NHCOCHH 3COCNHSO 2NHCOCH3H 3COCH 3N+SO 2NHCOCH 3*CL-。
活性炭脱色。
NaOH 液PH=5三、仪器设备1、主要仪器:100ml 三口烧瓶 1个 调速搅拌器 1个、 100℃温度计 1个 球形冷凝管 1个 100ml 抽滤瓶 1个 自动电热套 1个 100ml 烧杯 1个 250V 调压器 1个 吸滤瓶 1个 布氏漏斗 1个表面皿 1个 b型熔点测定管1个铁架台 1个2、仪器与实验装置图回流装置熔点测试装置抽滤装置四、相关知识点本课程知识点综合:磺胺类药物为无臭、无味白色或微黄色的结晶粉末,难溶于水,可溶于丙酮或乙醇,它具有磺酰氨基和芳伯氨基的通性。
多课程知识点综合:酰化反应1 定义:有机物分子中O、N、C原字上导入酰基的反应,酰基RO 2 酰化剂强弱与种类O 'R+L HL HL+OCR<O C R ClOH结论:离去基团共轭酸的酸性越强,酰化剂的酰化能力越强酰化能力:RCOClO4> RCOBF4> RCOX >RCO OCOR> RCOOH >RCOOR'> RCONHR五、实验步骤(一)乙酰化1.原料规格及投药量2. 操作方法在装有搅拌、温度计和回流冷凝管的250ml三口瓶中投入0.10摩尔(17.2克)的磺胺和计算量的22.5%的氢氧化钠溶液(22ml),开搅拌,于水浴上加热至50~55℃左右,待物料溶解后加氢氧化钠NaOH3ml和醋酸酐4ml,因反应为放热反应,加料后温度会上升,加料期间反应温度控制在50~55℃,重复上述加料共5次,每次间隔不少于5分钟。
药物化学三个经典实验

药物化学三个经典实验实验一仪器的清洗、阿司匹林的合成在反应过程中,阿司匹林会自身缩合,形成一种聚合物。
在阿司匹林产品中的另—个主要的副产物是水杨酸。
三、实验方法:取2g(14mmol)水杨酸放入125ml的锥形瓶中,慢慢加入5ml(53mmol)乙酸酐,再滴加6滴浓硫酸,摇动使水杨酸溶解,水浴加热5-10min (控制温度85-90℃),冷至室温,即有乙酰水杨酸结晶析出。
若无晶体析出,可用玻璃棒摩擦瓶壁或置于冰水中冷却促使结晶。
晶体析出后再慢慢加入50ml水,继续在冰水中冷却,使晶体完全。
抽滤,用少许水洗涤晶体,抽滤,烘干,计算产率,熔点134-136℃。
[注意事项]1.由于乙酸酐易水解,所以所用仪器必须干燥。
水浴加热时,要注意不要让水蒸气进入三颈瓶中,以防止酸酐和生成的阿司匹林水解。
2.由于分子内氢键的作用,水杨酸和乙酸酐需在150-160°C才能生成乙酰水杨酸。
加入酸的目的主要是破坏氢键的存在,使反应在较低的温度(90℃)下就可以进行,而且大大减少副产物,因此实验中要注意控制温度。
四、思考题1.在阿司匹林的合成过程中,要加入少量的浓硫酸,其作用是什么除硫酸外,是否可以用其他酸代替?2.阿司匹林的合成过程中产生的主要副产物是什么简述其产生的途径及去除方法。
实验二扑热息痛的合成扑热息痛系常用的解热镇痛药,临床上用于发热、头痛、神经痛、痛经等。
化学名N-(4-羟基苯基)-乙酰胺[N-(4-Hydro某yphenyl)-acetamide],又称醋氨酚(Acetaminophen)化学结构本品为白色结晶或结晶性粉末,易溶于热水或乙醇,溶于丙酮,略溶于水。
一、目的要求1.通过本实验,掌握扑热息痛的性状、特点和化学性质。
2.掌握酰化反应的原理和分馏柱的作用及操作。
OHONHCH3二、实验原理扑热息痛以对氨基酚为原料经醋酐酰化或醋酸酰化反应制得。
本实验采用冰醋酸为酰化剂。
OHONH2+CH3COOHHONHCH3+H2O三、实验方法60ml(或100ml)圆底烧瓶中加入4g对氨基酚,10ml冰醋酸,装一短的刺形分馏柱,其上端装一温度计,支管通过尾接管与接收器(100ml 锥形瓶)相连,接收器外部用冷水浴冷却。
磺胺醋酰钠的合成

药物化学实验——12级18班实验二磺胺醋酰钠的合成指导老师:***小组成员:陆裕天:201240164赖春霞:201240171刘春燕: 201240172李艳霜: 201240173磺胺醋酰钠的合成一、药物概述基本信息:磺胺醋酰钠又名:磺胺乙酰钠,磺醋酰胺钠。
化学名: N-[(4-氨基苯基)-磺酰基]-乙酰胺钠-水合物。
本品为白色结晶性粉末;无臭味、微苦、易溶于水,微溶于乙醇、丙酮。
易遇光接触氧气变色分解,故需密封保存。
化学式为 SO 2NCOCH 3.H 2OH 2N Na磺胺醋酰钠分子量为254.24,CAS 号为127-56-0.药理作用:磺胺醋酰钠是一种短效磺胺类药物,具有广谱抑菌作用。
磺胺醋酰钠在临床上主要用于沙眼,结膜炎等眼科感染。
因与对氨基苯甲酸(PABA )结构相似,可以竞争细菌的二氢叶酸合成酶。
使细菌叶酸代谢受阻,无法获得所需嘌呤和核酸,致细菌生长繁殖受抑制,对大多数革兰氏阳性和阴性菌有抑制作用,尤其对溶血性链球菌、肺炎双球菌、痢疾杆菌敏感,对葡萄球菌、脑膜炎球菌及沙眼衣原体也有较好抑菌作用,并对真菌有一定作用。
[1]H 2NCOOH 对氨基苯甲酸 H 2N SO 2NH 2磺胺磺胺具有良好抗菌活性,但因其水溶性不好[2],参与机体代谢效果不理想。
本实验利用醋酐作为酰化剂,对磺胺药物上的磺酰胺基进行结构修饰,引入吸电子基团乙酰基,使其磺酰胺基的酸性增强[3],制成磺胺醋酰。
再将磺胺醋酰制成钠盐,增强其水溶性。
通过此方法对磺胺进行结构修饰制得的磺胺醋酰钠,结构与对氨基苯甲酸更为相似,且具有良好的水溶性,提高了其抗菌效果。
药品鉴别方法:1.磺胺醋酰钠磺酰胺基上的氢原子可被金属离子取代,可成盐析出,例如:往磺胺醋酰钠滴加硫酸铜试液可生成蓝绿色沉淀,久置颜色不变。
2.磺胺醋酰钠与芳醛产生缩合反应,生成有颜色的希夫碱。
二、实验目的1.通过磺胺醋酰钠的合成,了解用控制pH、温度等反应条件纯化产品的方法。
磺胺醋酰钠的合成
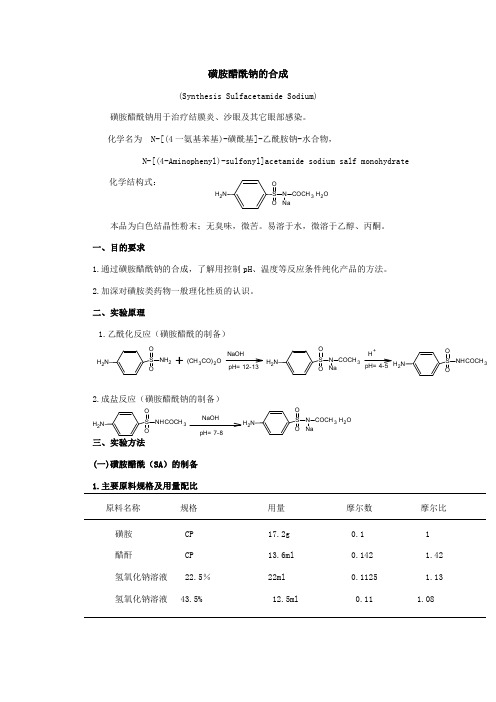
磺胺醋酰钠的合成(Synthesis Sulfacetamide Sodium)磺胺醋酰钠用于治疗结膜炎、沙眼及其它眼部感染。
化学名为N-[(4一氨基苯基)-磺酰基]-乙酰胺钠-水合物,N-[(4-Aminophenyl)-sulfonyl]acetamide sodium salf monohydrate化学结构式:本品为白色结晶性粉末;无臭味,微苦。
易溶于水,微溶于乙醇、丙酮。
一、目的要求1.通过磺胺醋酰钠的合成,了解用控制pH、温度等反应条件纯化产品的方法。
2.加深对磺胺类药物一般理化性质的认识。
二、实验原理1.乙酰化反应(磺胺醋酰的制备)2.成盐反应(磺胺醋酰钠的制备)三、实验方法(一)磺胺醋酰(SA)的制备1.主要原料规格及用量配比原料名称规格用量摩尔数摩尔比磺胺CP 17.2g 0.11醋酐CP 13.6ml 0.142 1.42氢氧化钠溶液22.5%22ml 0.1125 1.13氢氧化钠溶液43.5%12.5ml0.111.08NH 2S OO N COCH 3 H 2O H+pH= 4-5NH 2S OO N COCH 3NH 2S OONH 2+(CH 3CO)2ONaOH pH= 12-13N H 2S OONHCOCH 3NH 2S OO N COCH 3 H 2O NH 2S OONHCOCH 3 NaOH pH= 7-82.操作在装有搅拌子及温度计的100mL三颈瓶中,加入磺胺17.2g,22.5%氢氧化钠22mL,开动搅拌,并加热至50℃左右。
待磺胺溶解后,分次加入醋酐13.6mL,43.5%氢氧化钠12.5mL(首先,加入醋酐3.6mL,43.5%氢氧化钠2.5mL;随后,每次问隔5min,将剩余的43.5%氢氧化钠和醋酐分5次交替加入,每次各2ml,因为放热,加醋酐时用滴加法,2mlNaOH可一次加入)[1]。
加料期间反应温度维持在50~55℃;加料完毕继续保持此温度反成30min。
药物化学实验

药物化学实验教学讲义制药与生命科学学院药学教学研究室2008年9月药物化学实验内容计划教学目的和对学生要求:药物化学实验教学是药物化学课程的重要组成部分,是更好掌握药物合成的基本操作技能,提高学生分析和解决问题能力,使同学进一步理论联系实际,养成严密科学态度和良好工作作风必不可少的教学环节,为此,提出如下实验须如:1.遵守实验室制度,维护实验室安全。
不违章操作、严防爆炸、着火、中毒、触电、漏电等事故的发生。
若发生事故应立即报告指导教师。
2.实验前作好预习,明确实验内容,了解实验的基本原理和方法,安排好当天计划,争取准时结束,实验过程应养成及时记录的习惯,凡是观察到的现象和结果以及有关的重量、体积、温度或其它数据,应立即如实记录。
实验完毕后认真总结,写好报告,将精制所得产物包好,贴上标签(写下日期、样品名称、重量)交给老师。
3.实验室中保持安静,不许大声喧嚷,不许抽烟,不迟到不随便离开,实验台面保持清洁,使用过的仪器及时清洗干净后,存放实验柜内。
废弃的固体和滤纸等丢人废物缸内,绝不能丢人水槽和窗外,以免堵塞和影响环境卫生。
4.公用仪器及药品用完后立即归还原处,破损仪器应填写破损报告单、注明原因。
节约用水、用电、节约试剂,严格药品用量。
5.保持实验室内整洁,学生采取轮流值日,每次实验完毕,负责整理公用仪器。
将实验台、地面打扫干净、倒清废物缸,检查水、电(是否关闭水龙头、拉下总电闸刀,拔下电插头)。
关闭门窗。
实验一仪器设备的认识和使用学时:2一实验目的:让即将做该实验的学生初步认识所要接触的仪器设备,并且学会其使用和维护的方法。
二操作:1.认识每一个玻璃仪器,了解其用途2.掌握实验室每个设备的使用实验二阿司匹林(乙酰水杨酸)的合成学时:8一、目的要求1.通过本实验,掌握阿司匹林的性状、特点和化学性质。
2.熟悉和掌握酯化反应的原理和实验操作。
3.进一步巩固和熟悉重结晶的原理和实验方法。
4.了解阿司匹林中杂质的来源和鉴别。
实验三_磺胺醋酰钠的制备

安妥明铝盐的制备1、反应式Cl O 3CH 3COOH+NaOH Cl O 3CH 3COONa +H 2OCl O 3CH 3COONa+ALC L 3O 3CH 32ALOH+NaCL +H 2O2、原料规格及投料量3.操作步骤:1)测对氯苯氧异丁酸的熔点对氯苯氧异丁酸的熔点为120.52℃,否则重新精制。
对氯苯氧异丁酸铝的制备将3.0g 结晶氯化铝置于150ml 高型烧杯中,加水16.5ml ,搅拌溶解,备用。
如果溶液不澄清,浑浊,需过滤。
先用NaOH1.46g ,水38ml 配成为4%的NaOH 溶液,加入5.4g 对氯苯氧异丁酸,搅拌溶解,备用。
如果溶液不澄清,浑浊,需过滤,滤液备用。
将盛有氯化铝溶液的烧杯置水浴加热,开动搅拌,当内温70-80℃时,滴入对氯苯氧异丁酸碱性溶液,立即产生白色沉淀,控制反应液pH =3-4,加毕,搅拌保温反应半小时,趁热抽滤。
沉淀物、用水洗涤,压紧抽干,置红外灯下于80℃干燥,得安妥明铝,称重,计算收得率。
5.思考题(1)成铝盐时,规定将对氯苯氧异丁酸碱性溶液滴入氯化铝溶液中,反过来操作行不行?为什么?(2)成铝盐时控制反应液维持在pH =3-4,为什么?附注6.成铝盐时控制反应液维持在pH =3-4,酸性过大,会产生对氯苯氧异丁酸沉淀,酸性过小(碱性)又会产生氢氧化铝沉淀,所以加入时,一定是将对氯苯氧异丁酸碱性溶液滴入氯化铝溶液中,不能反过来操作。
而且加入速度必须由滴液漏斗缓缓滴加,如一次加入或加入太快,会使局部反应液碱度过大,也可造成局部氢氧化铝沉淀。
实验三 磺胺醋酰钠的制备学名:对氨基苯磺酰乙酰钠 ,用于治疗结膜炎、沙眼及其他眼部感染结构式: N H 2SO 2NNaCOCH 3一、乙酰化1.目的要求(1)通过磺胺醋酰钠的合成,了解酰化反应的原理和掌握其操作技能。
(2)加深对磺胺类药物一般理化性质的认识2.反应式SO 2N H 2NH 222.5%NaOH SO 2N H 2N HNa SO 2N H 2NH C CH 3OCH 3O SO 2N H 2N 50~55o C HCl (CH 3CO)2O 77%NaOH3 实验材料药品:磺胺、醋酐、22.5%氢氧化钠、77%氢氧化钠、95%乙醇、活性炭、10%盐酸、 盐酸、40% 氢氧化钠、20% 氢氧化钠仪器:搅拌器(标准口)、球形冷凝管(标准口)、三颈瓶(标准口)、减压过滤装置(水泵、吸滤瓶、布氏漏斗、滤纸、玻璃塞、剪刀、玻璃棒)、熔点测定仪、pH 试纸、100℃温度计(标准口)、50 ml 量筒、100 ml 量筒、50 ml 烧杯、100ml 烧杯、200ml 烧杯、天平、称量纸、滴管4. 操作方法在装有搅拌、温度计和回流冷凝管的250ml 三口瓶中投入0.10摩尔(17.2克)的磺胺和计算量的22.5%的氢氧化钠溶液(22ml ),开搅拌,于水浴上加热至50~55℃左右,待物料溶解后加77%NaOH 溶液3ml 和醋酸酐4ml ,因反应为放热反应,加料后温度会上升,加料期间反应温度控制在50-55℃,重复上述加料共5次,每次间隔不少于5分钟。
合成(二)磺胺醋酰合成

实验三磺胺醋酰的合成一、目的要求1. 通过磺胺醋酰的合成,了解用控制pH、温度等反应条件纯化产品的方法。
2. 加深对磺胺类药物一般理化性质的认识。
二、实验原理磺胺醋酰为白色结晶性粉末;无臭味,微苦。
易溶于水,微溶于乙醇、丙酮。
合成路线如下:NH2SO2NH2(CH3CO)2ONaOHpH12-13+NH2SO2NCOCH3NapH7-8 NH2SO2NHCOCH3NH2SO2NCOCH3NaHClpH4-5NaOH三、实验方法在装有搅拌棒及温度计的100 mL三颈瓶中,加入磺胺17.2 g,22.5%氢氧化钠22 mL,开动搅拌,于水浴上加热至50℃左右。
待磺胺溶解后,分次加入醋酐13.6 mL,77% 氢氧化钠12.5 mL(首先,加入醋酐3.6 mL,77% 氢氧化钠2.5 mL;随后,每次间隔5 min,将剩余的77% 氢氧化钠和醋酐分5次交替加入)。
加料期间反应温度维持在50~55℃;加料完毕继续保持此温度反应30 min。
反应完毕,停止搅拌,将反应液倾入250 mL烧杯中,加水20 mL稀释,于冷水浴中用36% 盐酸调至pH 7,放置30 min,并不时搅拌析出固体,抽滤除去。
滤液用36% 盐酸调至pH 4~5,抽滤,得白色粉末。
用3倍量(3 mL / g)10% 盐酸溶解得到的白色粉末,不时搅拌,尽量使单乙酰物成盐酸盐溶解,抽滤除不溶物。
滤液加少量活性碳室温脱色10 min,抽滤。
滤液用40% 氢氧化钠调至pH 5,析出磺胺醋酰,抽滤,压干。
干燥,测熔点(mp.179~184℃)。
若产品不和格,可用热水(1:5)精制。
注释:1. 在反应过程中交替加料很重要,以使反应液始终保持一定的pH值(pH 12~13)。
2. 按实验步骤严格控制每步反应的pH值,以利于除去杂质。
四、思考题:1. 酰化液处理的过程中,pH 7时析出的固体是什么?pH 5时析出的固体是什么?10% 盐酸中的不溶物是什么?2. 反应碱性过强其结果磺胺较多,磺胺醋酰次之,双乙酰物较少;碱性过弱其结果双乙酰物较多,磺胺醋酰次之,磺胺较少,为什么?。
磺胺醋酰钠药物的合成工艺研究

磺胺醋酰钠药物的合成工艺研究(一)已有的合成路线或相关合成路线1.2.改进后磺胺醋酰钠合成工艺.. 反应中保持pH 12~ 13, 必要时需补加碱液。
滴加醋酐的方法对反应影响较大, 慢滴快加搅拌是操作的关键, 有两种方法有利于磺胺醋酰的生成, 一是将交替滴加醋酐的时间由原来每次5 m in 延长至10 m in左右( 9~ 13 m in) , 或将原来交替滴加醋酐5 次(每次2m l)改为交替滴加4次(每次2. 5m l), 并保持每次滴加醋酐的时间为10 m in。
将反应温度提高到60~ 65 .. , 或延长反应时间至40~ 60 m in, 均可提高磺胺醋酰的产率。
3.将以上所得的磺胺醋酰投入50ml烧杯中,滴加少量水润湿(<0.5ml)(附注1)。
于水浴上加热至90 ℃,滴加40%氢氧化钠至恰好溶解,溶液pH为7~8,趁热抽滤,滤液转至小烧杯中放冷析出结晶(附注2),抽滤,干燥,得磺胺醋酰钠9g。
(二)确定合成路线及步骤1、磺胺醋酰的制备在装有搅拌棒及温度计的100 mL三颈瓶中,加入磺胺17.2 g,22.5%氢氧化钠22 mL,开动搅拌,于水浴上加热至50℃左右。
待磺胺溶解后,滴加醋酐3.6 mL,77% 氢氧化钠2.5 mL(首先,加入醋酐3.6 mL,77% 氢氧化钠2.5 mL;随后,每次间隔5 min,将剩余的77% 氢氧化钠和醋酐分5次交替加入,每次2 ml)。
加料期间反应温度维持在50~55℃及pH12~13;加料完毕继续保持此温度反应30 min。
反应完毕,停止搅拌,将反应液倾入100mL烧杯中,加水20 mL 稀释。
用36% 盐酸调至pH 7,于冰水浴中放置30 min,并不时搅拌析出固体,抽滤固体,用适量冰水洗涤。
洗液与滤液合并后用浓盐酸调至pH 4~5,抽滤,得白色粉末。
用3倍量(3 mL / g)10% 盐酸溶解得到的白色粉末,放置30min,不时搅拌,尽量使单乙酰物成盐酸盐溶解,抽滤除不溶物。
3个合成实验思考题答案整理.docx

苯妥英钠的合成1.安息香缩合反应的原理?(没做)2.制备苯妥英为什么在碱性条件下进行?苯妥英显弱酸性,儿乎不溶于水,与碱成盐改善其溶解性。
3.本品精制的原理是什么?苯妥英与钠盐反应生成苯妥英钠盐类,其盐类在水中的溶解度小于氯化钠,当不断加入氯化钠至形成饱和溶液,苯妥英钠优先析出,再用活性炭洗去浮色即可得到纯品。
4 •制备二苯乙二酮加入冰醋酸和水的作用是什么?这个反应是一个氧化还原反应,冰醋酸在这里既作为一个溶剂,也作为一个酸性介质提供者,三氯化铁在酸性介质中能够发挥最强的氧化性。
同时三氯化铁及其容易水解,如果不在酸性介质中,很快就会完全水解成氢氧化物,氢氧化物不溶于水,就无法发挥氧化剂的作用。
加水是为了降低体系的饱和度,使析出的晶体较大。
磺胺醋酰钠的合成1、磺胺类药物有哪些理化性质?在本实验中,是如何利用这些性质进行产品纯化的?答:磺胺类药物一般为白色或微黄色结晶性粉末;无臭,无味。
具有一定熔点。
难溶于水, 可溶于丙酮或乙醇。
①酸碱性因本类药物分子中有芳香第一胺,呈弱碱性;有磺酰氨基,显弱酸性,故本类药物呈酸碱两性,可与酸或碱成盐而溶于水②自动氧化反应本类药物含芳香第一胺,易被空气氧氧化。
③芳香第一胺反应磺胺类药物含芳香第一胺,在酸性溶液屮,与亚硝酸钠作用,可进行重氮化反应,利用此性质可测定磺胺类药物的含量。
生成的重氮盐在碱性条件下,生成橙红色偶氮化合物,可作本类药物的鉴别反应。
④与芳醛缩合反应芳香第一胺能与多种芳醛(如对二甲氨基苯甲醛、香草醛等)缩合成具有颜色的希夫碱.⑤铜盐反应磺酰氨基上的氢原子,可被金属离子(如铜、银、钻等)取代,生成不同颜色的难溶性沉淀,可用于鉴别。
2、酰化液处理的过程中,pH 7吋析出的固体是什么?pH 5吋析出的固体是什么?10%盐酸中的不溶物是什么?答:pH=7时候析出的固体是未反应的磺胺;5的时候析出的是磺胺醋酰。
在10%盐酸溶液中磺胺醋酰生成盐酸盐而溶解,而磺胺双醋酰由于结构中无游离的芳伯胺基,不能和盐酸成盐故析出。
个合成实验思考题答案

苯妥英钠的合成1.安息香缩合反应的原理?(没做)2. 制备苯妥英为什么在碱性条件下进行?苯妥英显弱酸性,几乎不溶于水,与碱成盐改善其溶解性。
3.本品精制的原理是什么?苯妥英与钠盐反应生成苯妥英钠盐类,其盐类在水中的溶解度小于氯化钠,当不断加入氯化钠至形成饱和溶液,苯妥英钠优先析出,再用活性炭洗去浮色即可得到纯品。
4.制备二苯乙二酮加入冰醋酸和水的作用是什么?这个反应是一个氧化还原反应,冰醋酸在这里既作为一个溶剂,也作为一个酸性介质提供者,三氯化铁在酸性介质中能够发挥最强的氧化性。
同时三氯化铁及其容易水解,如果不在酸性介质中,很快就会完全水解成氢氧化物,氢氧化物不溶于水,就无法发挥氧化剂的作用。
加水是为了降低体系的饱和度,使析出的晶体较大。
磺胺醋酰钠的合成1、磺胺类药物有哪些理化性质?在本实验中,是如何利用这些性质进行产品纯化的?答:磺胺类药物一般为白色或微黄色结晶性粉末;无臭,无味。
具有一定熔点。
难溶于水,可溶于丙酮或乙醇。
①酸碱性因本类药物分子中有芳香第一胺,呈弱碱性;有磺酰氨基,显弱酸性,故本类药物呈酸碱两性,可与酸或碱成盐而溶于水②自动氧化反应本类药物含芳香第一胺,易被空气氧氧化。
③芳香第一胺反应磺胺类药物含芳香第一胺,在酸性溶液中,与亚硝酸钠作用,可进行重氮化反应,利用此性质可测定磺胺类药物的含量。
生成的重氮盐在碱性条件下,生成橙红色偶氮化合物,可作本类药物的鉴别反应。
④与芳醛缩合反应芳香第一胺能与多种芳醛(如对二甲氨基苯甲醛、香草醛等)缩合成具有颜色的希夫碱.⑤铜盐反应磺酰氨基上的氢原子,可被金属离子(如铜、银、钴等)取代,生成不同颜色的难溶性沉淀,可用于鉴别。
2、酰化液处理的过程中,pH 7时析出的固体是什么?pH 5时析出的固体是什么?10% 盐酸中的不溶物是什么?答:pH=7时候析出的固体是未反应的磺胺;5的时候析出的是磺胺醋酰。
在10%盐酸溶液中磺胺醋酰生成盐酸盐而溶解,而磺胺双醋酰由于结构中无游离的芳伯胺基,不能和盐酸成盐故析出。
药物合成-案例—磺胺醋酰钠的合成

SO2NCOCH3 Na
X=2.3 g
实验目的
• 1.掌握磺胺醋酰钠的制备原理及方法 • 2.了解用控制pH、温度等反应条件纯化产品的方法 • 3.加深对磺胺类药物一般理化性质的认识
实验材料与设备
• 药品:1.磺胺17.2 g,2.22.5%氢氧化钠22 mL,3.醋酐13.6 mL,4.77% 氢氧化钠12.5 mL,5.36% 盐酸;10% 盐酸, 6.40% 氢氧化钠;20%氢氧化钠7. 活性碳
• 2. 按实验步骤严格控制每步反应的pH值,以利于除去杂质 。
• 仪器设备:1.熔点仪2.有机制备仪3.搅拌器 4.循环水泵5.干燥 箱
实验步骤
• (一)磺胺醋酰的制备
• 在装有搅拌棒及温度计的100 mL三颈瓶中,加入磺胺17.2 g ,22.5%氢氧化钠22 mL,开动搅拌,于水浴上加热至50℃左 右。待磺胺溶解后,分次加入醋酐13.6 mL,77% 氢氧化钠 12.5 mL(首先,加入醋酐3.6 mL,77% 氢氧化钠2.5 mL;随 后,每次间隔5 min,将剩余的77% 氢氧化钠和醋酐分5次交 替加入)。加料期间反应温度维持在50~55℃;加料完毕继 续保持此温度反应30 min。反应完毕,停止搅拌,将反应液 倾入250 mL烧杯中,加水20 mL稀释,于冷水浴中用36% 盐 酸调至pH 7,放置30 min,并不时搅拌析出固体,抽滤除去 。滤液用36% 盐酸调至pH 4~5,抽滤,得白色粉末。
4. 磺胺醋酰钠的合成路线:
NH2
+ (CH3CO)2O
SO2NH2
NaOH pH12-13
NH2
SO2NCOCH3 Na
HCl pH4-5
实验二 磺胺醋酰钠的合成

实验二磺胺醋酰钠的合成【药物概述】磺胺醋酰钠在临床上主要用于沙眼、结膜炎等眼科感染,其合成原料易得,反应步骤少,且疗效肯定,副反应小,是一种眼科常用药物.【1】本品为白色粉末,无臭.本品为短效磺胺类药物,具有广谱抑菌作用.因与对氨基苯甲酸竞争细菌的二氢叶酸合成酶,使细菌叶酸代谢受阻,无法获得所需嘌呤和核酸,致细菌生长繁殖受抑制.本品对大多数革兰氏阳性和阴性菌有抑制作用,尤其对溶血性链球菌、肺炎双球菌、痢疾杆菌敏感,对葡萄球菌、脑膜炎球菌及沙眼衣原体也有较好抑菌作用.对真菌有一定作用.而作为合成磺胺醋酰钠的原料——磺胺醋酰,可用于由敏感细菌引起的角膜炎、睑缘炎、结膜炎、泪囊炎等,也可用于沙眼衣原体感染的辅助治疗和眼外伤的治疗,还可在结膜、角膜及内眼手术前、后用于预防感染,非眼用制剂可用于细菌性阴道炎和寻常性痤疮.磺胺醋酰最初由K.A.Jense等以对硝基苯磺酰胺为原料制得.随后中国著名化学家黄鸣龙等用乙酸酐和乙酸对磺胺直接酰化,得二乙酰化物,经水解得磺胺醋酰,收率为77%.1949年日本学者以对乙酰氨基苯磺酰胺为原料,在NaOH存在下经醋酐酰化再水解,得到磺胺醋酰.1958年O.Leoveanu等提出了酸催化乙酰化方法.1989年Kravchenga N.A.提出选择性乙酰化制备磺胺醋酰的方法.【2】也有人提出用碱催化进行乙酰化的方法,收率为58.3%,尤启冬所编教材《药物化学实验指导》即采用此法.【3】2003年何黎琴等在文献方法基础上加入吡啶以提高醋酐的酰化能力,产率为63.5%.【4】2005年王淑月等通过相转移催化法合成了磺胺醋酰,产率为71.67%.【5】【目的和要求】1. 通过本实验,掌握磺胺类药物的一般理化性质,并掌握如何利用其理化性质的特点来达到分离提纯产品的目的.2. 通过本实验操作,掌握乙酰化反应的原理.【原理】【1】【仪器和试剂】仪器装置图2012~2013学年药物化学实验设计第2页试剂总览 原料名称 规格 用量 摩尔数 摩尔比 磺胺 CP 17.2g 0.1 1 醋酐 CP 13.6ml 0.142 1.42 氢氧化钠 22.5% 22ml 0.1125 1.13 氢氧化钠 77%12.5ml0.19251.9试剂主要性质 试剂名称 性质磺胺 白色颗粒或粉末状结晶,无臭.味微苦.微溶于冷水、乙醇、甲醇、乙醚和丙酮,易溶于沸水、甘油、盐酸、氢氧化钾及氢氧化钠溶液,不溶于氯仿、乙醚、苯、石油醚. 醋酐 无色易挥发液体,具有强烈刺激性气味和腐蚀性.溶于冷水,溶于氯仿、乙醚和苯. 氢氧化钠纯品是无色透明的晶体.易溶于水,同时强烈放热.并溶于乙醇和甘油;不溶于丙酮、乙醚.露放在空气中,最后会完全溶解成溶液.试剂主要理化常数 物质 分子量 熔点/℃ 性质磺胺 172.21溶于氢氧化钠水溶液磺胺醋酰 214.24 182-184 微溶于水(150:1),溶于无水乙醇(15:1) pK a1(芳伯氨基):1.8,pK a2(磺酰氨基):5.4 磺胺醋酰钠 236.23257易溶于水(1.5:1),微溶于96%乙醇【方法和步骤】【6】一、磺胺醋酰(SA )的制备1.在装有搅拌器、温度计和回流冷凝管的三颈瓶中投入磺胺17.2g 及22.5%氢氧化钠溶液22ml ,开始搅拌,于水浴上加热至50℃左右.2.待物料溶解后,滴加醋酐3.6 ml ,隔5min 后滴加77%氢氧化钠溶液2.5ml ,并保持反应液pH 在12~13之间.实验二 磺胺醋酰钠的合成第3页3.随后每隔5min 交替滴加醋酐及氢氧化钠溶液,每次2ml ,加料期间反应温度维持在50~55℃及pH12~13.4.加料毕,继续保持温度搅拌反应30min ,将反应液转入烧杯中,加水20ml 稀释.用浓盐酸调pH 至7,于水浴中放置1~2h ,冷却析出固体.5.抽滤固体,用适量冰水洗涤.洗液与滤液合并后用浓盐酸调pH 至4~5,滤取沉淀压干. 6.沉淀用3倍量的10%盐酸溶解,放置30min ,抽滤除去不溶物.滤液加少量活性炭室温脱色后,用40%氢氧化钠溶液调pH 至5,得磺胺醋酰,抽滤.7.于红外灯下干燥得产品,熔点179~184℃.如熔点不合格,可用热水(1:15)精制. 注:(1)本实验中使用氢氧化钠溶液有多种不同浓度.在试验中切勿用错,否则会导致实验失败. (2)滴加醋酐和氢氧化钠溶液是交替进行,每滴完一种溶液后,让其反应5min 后,再滴加另一种溶液.滴加是用玻璃管滴加,滴加速度不宜过快.(3)反应中保持反应pH 在12~13之间很重要,否则收率将会降低. (4)在pH7是析出的固体不是产物,应弃去,产物在滤液中. (5)在pH4~5析出的固体是产物.(6)本实验中,溶液pH 的调节是反应能否成功的关键,应小心注意,否则实验会失败或收率降低.二、磺胺醋酸钠的制备将上步所得的磺胺醋酰投入烧杯中,滴加少量(0.5ml )水润湿.于水浴上加热至90℃,滴加40%氢氧化钠溶液至恰好溶解,溶液pH 为7~8,趁热抽滤,滤液转至小烧杯中放冷析出晶体,抽滤,干燥,得磺胺醋酰钠. 注:(1)加入水的量以磺胺醋酰略湿即可.0.5ml 较难控制,可适当多加入一些,在析出晶体时在蒸发去一些水分.2012~2013学年药物化学实验设计(2)此步须趁热过滤漏斗应先预热.若滤液放置后较难析出晶体,可至电炉上略加热,使其挥发去一些水分,再放冷析晶.【其他合成路线和方法改进】1.用相转移催化法合成磺胺醋酰本实验改进方法以磺胺为原料以醋酐为酰化剂,以TEBA(三乙基卞基氯化铵)为相转移催化剂在氢氧化钠存在下进行反应,反应式如下:本实验改进方法学者通过正交实验探索出,保温温度过低,不利于乙酰化反应的进行,产率较低,故加料温度在30~50℃,保温温度应控制在50~55℃,加入相转移催化剂TEBA 0.2 g,ω(NaOH)为31%能明显增加磺胺醋酰的产率.(1)由于TEBA对水不稳定,故该路线加大了ω(NaOH),将TEBA和乙酸酐同时投入,减少了TEBA的分解.TEBA将磺胺阴离子带入底物——醋酐中,同时也将反应后的醋酸根阴离子带入水相,因此提高了产率,也加快了反应速率.(2)本路线对单、双乙酰化物的分离方法进行了改进,磺胺醋酰在体积分数为70%~75%的乙醇溶液中溶解度最大,而双乙酰化产物溶解度极小,故用乙醇溶解磺胺醋酰,分离出双乙酰化产物,然后蒸出乙醇和水,得到目标产物.其优点为不经过酸碱中和反应,直接利用待分离物的溶解性差异进行分离,减少了分离步骤,蒸出的乙醇可以套用,减少了对环境的污染,提高了产率.【5】2.以吡啶为催化剂;用NaOH乙醇液代替NaOH水溶液与磺胺醋酰成盐磺胺醋酰制备中,加少量吡啶做催化剂,可使醋酐酰化能力增强,磺胺利用率有明显提高,磺胺醋酰的收率也由原来的约50%提高到70%左右.在磺胺醋酰钠制备过程中,采用NaOH水溶液与磺胺醋酰成盐,操作繁琐,需要90%的水浴加热,调整到pH7~8后趁热过滤,在实验教学过程中,发现严格按上述步骤操作,仍很难得到产品,因磺胺醋酰钠易溶于水.根据磺胺醋酰钠略溶于乙醇的物理性质,用NaOH乙醇液取代NaOH 水溶液,并按计算量进行投料.通过实验验证,此步改进使操作简单化,避免了热水浴,只需在室温中进行,所用乙醇可通过蒸馏回收,重新利用,更为可贵的是,成盐一步收率可达98%以上,通过定性分析,与磺胺醋酰钠一致.【4】3.改变实验过程中的反应条件及投料方式反应中保持pH 12~13,必要时需补加碱液.滴加醋酐的方法对反应影响较大,慢滴快加搅拌是操作的关键,有两种方法有利于磺胺醋酰的生成:一是将交替滴加醋酐的时间由原来每次5min延长至10min左右(9~13min);二将原来交替滴加醋酐5次(每次2ml)改为交替滴加4次(每次2.5ml),并保持每次滴加醋酐的时间为10min.将反应温度提高到60~65℃,或延长反应时间至40~60min,均可提高磺胺醋酰的产率.【1】【问题和讨论】1.为什么在第一步反应中会生成副反应产物——磺胺双醋酰?答:因为磺胺中4-胺基的电子云密度大于1-磺酰胺基的电子云密度,1-磺酰胺基上的弱酸性加第4页实验二磺胺醋酰钠的合成入强碱可生成盐,使得1-磺酰胺基的电子云密度增大.磺酰胺基成盐后N原子上具有强电负性,然后另一分子中硫原子具有强正电性,于是两分子发生缩合反应,生成磺胺双醋酰.2.磺胺醋酰钠的合成中为什么乙酐和氢氧化钠交替滴加?答:磺胺和乙酐反应生成主产物是我们需要的,该反应为放热反应,多次少量加入是为了便于控制温度;加入氢氧化钠是为了保持pH值,因为碱性环境下副产物少主产物多,交替反应也利于pH值的控制.3.酰化液处理的过程中,pH 7时析出的固体是什么?pH 5时析出的固体是什么?10% 盐酸中的不溶物是什么?答:pH=7时候析出的固体是未反应的磺胺;pH=5的时候析出的是磺胺醋酰;10%盐酸中不溶物是杂质和未反应的磺胺.4.为什么在10%盐酸中有不溶物析出?答:因为在10%盐酸溶液中磺胺醋酰生成盐酸盐而溶解,而磺胺双醋酰由于结构中无游离的芳伯胺基,不能和盐酸成盐故析出.5.磺胺醋酰钠的合成为什么调pH 7~8?答:滴加40%氢氧化钠溶液调pH7~8时可见溶液澄明,显示磺胺醋酰已生成磺胺醋酰钠,若有微量不溶物,可能是未除尽的副产物.氢氧化钠溶液切勿过量,因磺胺醋酰钠在强碱性溶液中和受热情况下,易氧化水解而致产量和质量下降.6.反应过程中,调节pH在12~13是非常重要的.若碱性过强,其结果是磺胺较多,磺胺醋酰次之,双乙酰物较少;碱性过弱其结果双乙酰物较多,磺胺醋酰次之,磺胺较少,为什么?答:因碱度过大,磺胺双醋酰易水解成磺胺,且易引起磺胺醋酰水解成磺胺;而因碱度过小时,反应过程中易生成较多的N-乙酰磺胺,且磺胺双醋酰分子结构中的N-乙酰基不易水解下来,所以该反应必须控制好pH 值.7.将磺胺醋酰制成钠盐时,为什么要严格控制22.5%NaOH溶液的用量?答:将磺胺醋酰制成钠盐时,必须要严格控制22.5%NaOH溶液的用量.因磺胺醋酰钠水溶性大,由磺胺醋酰制备其钠盐时若22.5%NaOH的量多,则损失很大.必要时可加少量丙酮,使磺胺醋酰钠析出.8.磺胺类药物有哪些理化性质?答:(1)酸碱性因本类药物分子中有芳香第一胺,呈弱碱性;有磺酰氨基,显弱酸性,故本类药物呈酸碱两性,可与酸或碱成盐而溶于水.(2)自动氧化反应本类药物含芳香第一胺,易被空气氧氧化.(3)芳香第一胺反应磺胺类药物含芳香第一胺,在酸性溶液中,与亚硝酸钠作用,可进行重氮化反应,利用此性质可测定磺胺类药物的含量.生成的重氮盐在碱性条件下,生成橙红色偶氮化合物,可作本类药物的鉴别反应.(4)与芳醛缩合反应芳香第一胺能与多种芳醛(如对二甲氨基苯甲醛、香草醛等)缩合成具有颜色的希夫碱.(5)铜盐反应磺酰氨基上的氢原子,可被金属离子(如铜、银、钴等)取代,生成不同颜第5页2012~2013学年药物化学实验设计色的难溶性沉淀,可用于鉴别.9.如何利用磺胺类药物的理化性质进行产品纯化?答:利用主产物和副产物的解离常数不同,在不同pH条件下分别令主产物溶于溶剂而副产物不溶,过滤后弃去固体;或者主产物不溶而副产物溶,过滤后弃去溶液.10.【综上所述】为何不能通过利用第一步反应直接得到产物磺胺醋酰钠而要将其转变为磺胺醋酰后再与NaOH反应生成磺胺醋酰钠?答:首先必须明确,第一步反应中,作为反应物的醋酐、NaOH等均过量,这使得第一步生成的磺胺醋酰钠中含有醋酸钠等杂质,另外第一步反应也会产生副反应产物——磺胺双醋酰.那么,我们可以通过调节pH等方法将这些杂质等去除后再将磺胺醋酰与NaOH反应生成较纯的磺胺醋酰钠.【参考文献】1.李零,胡伦香.药学专业学生实验教学磺胺醋酰钠合成工艺的改进.贵阳医学院学报,2010,35(6):646~647.2.袁干军,黎岳南,任兆平,焦亮.培养学生科学思维的头脑——浅谈药物化学实验中磺胺醋酰钠的合成.中国科教创新导刊,2009,11:65.3.尤启东主编.药物化学实验与指导.中国医药科技出版社,2000年3月第1版:113~115.4.何黎琴,完茂林.磺胺醋酰钠合成路线改进.安徽化工,2003,2:16~17.5.王淑月,张二巧,袁志法.磺胺醋酰合成技术研究.河北科技大学学报,2005,26(2):124~126,145.6.天津大学等编.制药工程专业药物化学实验指导.化学工业出版社,2005年8月第1版:33~37.第6页。
磺胺醋酰钠的合成实验思考题

磺胺醋酰钠的合成实验思考题(2011-03-28 21:55:15)转载磺胺类药物有哪些理化性质?答:磺胺类药物一般为白色或微黄色结晶性粉末;无臭,无味。
具有一定熔点。
难溶于水,可溶于丙酮或乙醇。
1.酸碱性因本类药物分子中有芳香第一胺,呈弱碱性;有磺酰氨基,显弱酸性,故本类药物呈酸碱两性,可与酸或碱成盐而溶于水2.自动氧化反应本类药物含芳香第一胺,易被空气氧氧化。
3.芳香第一胺反应磺胺类药物含芳香第一胺,在酸性溶液中,与亚硝酸钠作用,可进行重氮化反应,利用此性质可测定磺胺类药物的含量。
生成的重氮盐在碱性条件下,生成橙红色偶氮化合物,可作本类药物的鉴别反应。
4.与芳醛缩合反应芳香第一胺能与多种芳醛(如对二甲氨基苯甲醛、香草醛等)缩合成具有颜色的希夫碱.5.铜盐反应磺酰氨基上的氢原子,可被金属离子(如铜、银、钴等)取代,生成不同颜色的难溶性沉淀,可用于鉴别。
二、反应液处理时,pH7时析出的固体是什么,pH5时析出的固体是什么?在10%盐酸中不能溶解的物质是什么?答:pH=7时候析出的固体是未反应的磺胺;5的时候析出的是磺胺醋酰。
在10%盐酸溶液中磺胺醋酰生成盐酸盐而溶解,而双乙酰磺胺由于结构中无游离的芳伯胺基,不能和盐酸成盐故析出。
三、反应过程中,若碱性过强,其结果是磺胺较多,磺胺醋酰次之,磺胺双醋酰较少;若碱性过弱,其结果是磺胺双醋酰较多,磺胺醋酰次之,磺胺较少,为什么?请解释原因。
答:因碱度过大磺胺双醋酰易水解成磺胺,且易引起磺胺醋酰水解成磺胺;而因碱度过小时,反应过程中易生成较多的N-乙酰磺胺,且磺胺双醋酰分子结构中的N-乙酰基不易水解下来,故之。
4、注意事项(1)本实验中使用氢氧化钠溶液浓度有差别,在实验中切勿用错,否则会影响实验结果,保持反应液最佳碱度是反应成功的关键之一。
(2)滴加乙酸酐和氢氧化钠溶液是交替进行的,每滴完一种溶液后,反应搅拌5分钟,再滴入另一种溶液,滴加速度以液滴一滴一滴加入为宜。
磺胺醋酰合成思考题

2.
阿片类:吗啡,可待因,哌替啶(杜冷丁),美沙酮,芬太尼及其同系物和阿片受体部分激动药喷他佐辛,丁丙诺啡,其他类曲马朵等。
阿片类镇痛药物,通过直接抑制源自脊髓背角的痛觉上行传入通路或激活源自中脑的痛觉下行控制环路来实现的。
激动脊髓胶质区、丘脑内侧、脑室、导水管周围的灰质等部位的阿片受体,主要是u受体,模拟内源性阿片肽对痛觉的调制功能从而发挥强大的镇痛作用。
喷他佐辛
1.疼痛发生的机制尚不完全清楚。
一般认为神经末梢(伤害性感受器)受到各种伤害性刺激(物理的或化学的)后,经过传导系统(脊髓)传至大脑,而引起疼痛感觉。
同时,中枢神经系统对疼痛的发生及发展具有调控作用。
.
3.。
药物化学实验

实验一、磺胺醋酰钠的制备磺胺是临床上应用最早的磺胺类抗菌药,但水溶性小,不便应用,磺胺分子中的磺酰氨基近乎中性。
虽可与NaOH成盐而水溶性增大,但极易水解,水溶液呈强碱性,也不能应用于临床,如果将磺酰氨基进一步酰化,酸性增强,成钠盐后,水解性减低,碱性减弱,能在临床上应用,乙酰化的产物为磺胺醋酰。
其钠盐近中性,可配成滴眼剂使用。
一、实验目的1.了解磺胺醋酰合成的基本路线.2.熟悉pH、温度等条件在药物合成中的重要性.3.掌握利用理化性质的差异来分离纯化产品的方法.二、实验内容磺胺醋酰的制备及产品的分离纯化。
三、实验原理在碱性条件下以磺胺为原料与乙酸酐反应,磺酰氨基乙酰化制备得到磺胺醋酰,再与氢氧化钠反应制备磺胺醋酰钠。
H2N SO2NH2NaOHH2N SO2NH(CH3CO)2ONaOHH2N SO2N COCH3H2N SO2NH COCH3NaOHH2N SO2N COCH3注:乙酐酰化时有副产物双乙酰化物产生。
N H SO2NH COCH3H3CO四、实验材料与设备1.实验设备、仪器圆底烧瓶(100 mL),球形冷凝管,布氏漏斗,抽滤瓶,温度计,恒温磁力搅拌器,三颈瓶,抽滤瓶,布氏漏斗。
2.实验材料、试剂NaOH(分析纯),磺胺(药用),醋酐(分析纯),盐酸(分析纯),活性碳(化学纯)。
五、实验步骤(一) 磺胺醋酰的制备在装有搅拌、温度计、回流冷凝管的250 mL三颈烧瓶中,加入26 g磺胺(SA)和22.5%的NaOH溶液(33 mL)。
搅拌,水浴逐渐升温至50~55℃,待物料溶解后,滴加Ac2O(7.5 mL),5 min后加入77%NaOH溶液4.5 mL(注1),并保持反应液pH在12~13之间,剩余13 mL醋酐与14.5 mL 77%NaOH溶液以每隔5 min每次2 mL(注2)交替加入。
加料期间的反应温度维持在50~55℃及pH在12~14(注3)。
加料完毕后,继续搅拌30 min。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
磺胺醋酰钠的合成实验思考题
(2011-03-28 21:55:15)
转载
磺胺类药物有哪些理化性质?
答:磺胺类药物一般为白色或微黄色结晶性粉末;无臭,无味。
具有一定熔点。
难溶于水,可溶于丙酮或乙醇。
1.酸碱性因本类药物分子中有芳香第一胺,呈弱碱性;有磺酰氨基,显弱酸性,故本类药物呈酸碱两性,可与酸或碱成盐而溶于水
2.自动氧化反应本类药物含芳香第一胺,易被空气氧氧化。
3.芳香第一胺反应磺胺类药物含芳香第一胺,在酸性溶液中,与亚硝酸钠作用,可进行重氮化反应,利用此性质可测定磺胺类药物的含量。
生成的重氮盐在碱性条件下,生成橙红色偶氮化合物,可作本类药物的鉴别反应。
4.与芳醛缩合反应芳香第一胺能与多种芳醛(如对二甲氨基苯甲醛、香草醛等)缩合成具有颜色的希夫碱.
5.铜盐反应磺酰氨基上的氢原子,可被金属离子(如铜、银、钴等)取代,生成不同颜色的难溶性沉淀,可用于鉴别。
二、反应液处理时,pH7时析出的固体是什么,pH5时析出的固体是什么?在10%盐酸中不能溶解的物质是什么?
答:pH=7时候析出的固体是未反应的磺胺;5的时候析出的是磺胺醋酰。
在10%盐酸溶液中磺胺醋酰生成盐酸盐而溶解,而双乙酰磺胺由于结构中无游离的芳伯胺基,不能和盐酸成盐故析出。
三、反应过程中,若碱性过强,其结果是磺胺较多,磺胺醋酰次之,磺胺双醋酰较少;若碱性过弱,其结果是磺胺双醋酰较多,磺胺醋酰次之,磺胺较少,为什么?请解释原因。
答:因碱度过大磺胺双醋酰易水解成磺胺,且易引起磺胺醋酰水解成磺胺;而因碱度过小时,反应过程中易生成较多的N-乙酰磺胺,且磺胺双醋酰分子结构中的N-乙酰基不易水解下来,故之。
4、注意事项
(1)本实验中使用氢氧化钠溶液浓度有差别,在实验中切勿用错,否则会影响实验结果,保持反应液最佳碱度是反应成功的关键之一。
(2)滴加乙酸酐和氢氧化钠溶液是交替进行的,每滴完一种溶液后,反应搅拌5分钟,再滴入另一种溶液,滴加速度以液滴一滴一滴加入为宜。
(3)利用主产物和副产物不同的理化性质在不同的pH下分别除去副产物。
本实验中溶液pH的调节应小心注意,否则实验会失败或收率降低。
