包装方案确认表
验证方案(纸塑包装单包装)

纸塑包装单包装确认方案版次:A/0版受控状态:目录目录 (2)1 ................................................................................................................................................... 目的32................................................................................................................................................... 范围33........................................................................................................................................... 依据文件34....................................................................................................................................确认小组成员45....................................................................................................................................................... I Q 46 .................................................................................................................................................... OQ 67...................................................................................................................................................... P Q10注:1、依据标准ISO11607-1.-2:2006参考GB/T19633-2005;2、本方案包含了IQ/OQ/PQ;3、依据文件部分务必形成文件,请确认,若没有,请完成。
包装评审表

长L 宽W 高H
空包装重量(kg) Empty appliance
weight
包装返空尺寸 (mm)Pack back
dimension
长L 宽W 高H
零件图片 Part picture
带内衬 Inner liner
内衬材质
内衬可循环 Inner is
Inner material
returnable
基地/包装签字:
基地/质量签字:
基地/现场工艺签字:
Signature and seal of supplier:
Signature of ME•PE:
Signature of Plant•PE:
Signature of Plant•SQE:
Signature of Plant•Launch:
包装基准 Pack factors
供应商包装方案 Supplier's packaging proposal
<运输包装-单包装>Packaging unit
<供线包装-整体图>Overall structure
<供线包装-零件放置效果图>Part placement
编制: Creator:
运输单元包装/图片张贴于此处 Transport unit/Picture is posted here (图片应清晰体现运输单元的出厂状态,包括包装捆扎状态、
① 综合考虑安全/品质/作业 Safety/Quality/Operation
③ 其他包装方式 Other packaging type
② 优先采用推荐包装 Recommend pack
④ 标准化尺寸链 Standardization(foot print)
初包装确认方案

初包装确认方案项目名称:编制:审核:批准:XXXXXXXXX有限公司XXXX年XX月XX日XXXXXXXXX初包装确认目录1、验证目的2、适用范围3、概述4、确认组织及职责5、确认说明6、确认内容7、再验证附件1:验证人员名单及确认记录附件2:验证所用主要设备确认记录附件3:验证相关文件审核记录附件4:包装材料微生物屏障确认记录附件5:包装材料灭菌前后理化指标确认记录附件6:包装材料与贮存运输过程的适应性确认记录1. 验证目的根据ISO11607-2006最终灭菌医疗器械的包装的要求,对PET/AL/PE复合膜进行确认,以保证包装系统在加工、运输、贮存和使用过程中不会对产品造成污染,能够保证医疗器械持续安全有效;2. 适用范围本方案适用于XXXXXXXXXXXXX初包装的确认;3. 概述我公司XXXXXXXXXXXXXX为最终灭菌医疗器械,本品初包装选用铝箔袋,其材料为PET/AL/PE复合膜,该包装具有高阻隔性、强密封性、材料强度大的优点;4. 确认组织及职责确认方案和确认报告的人员职责质量管理部验证管理员:质量管理部验证管理员负责文件的起草,评价验证报告并检查验证记录是否完整、是否符合规定,并管理确认过程中的偏差与变更,组织相关验证人员的培训;岗位操作人员:具有熟练操作相关设备的工作经验;质量管理部质检员:质量管理部质检员检验并根据检验结果填写记录,保证检验数据的准确性;质量管理部主任、生产车间主任:负责方案及报告的审核,监督验证过程的实施;管理者代表:负责验证方案及报告的审批;5. 确认说明记录填写要求所有验证记录、结果应按批准过的方案的相应记录表格填写,记录的填写、计算应审核并签字,QA应检查验证记录是否完整、是否符合规定;偏差的调查当检测结果异常时,或出现操作不符合SOP要求时,执行部门应通知QA,执行偏差调查,QA应在记录中清楚的描述该偏差的情况,对于偏差的影响做出评估并制定相应措施计划,经批准后,实施纠正预防措施并予以记录;方案变更的控制当方案在执行的过程中,出现实际执行情况与既定的要求或验证目的不一致时,需要对原批准方案进行更改,执行部门应按照文件控制程序的要求执行;6. 确认内容确认前检查验证人员资格确认参加验证人员应符合以下要求:①相关操作人员具有熟练操作包装机的工作经验;②相关检测人员具有熟练操作检测设备的能力;③参与验证的人员应从事过相关验证工作或接受过相关培训, 详见附表1;验证主要设备确认验证过程中使用的仪器、仪表、设备均应经过校验、合格后方可使用,详见附表2;验证所需文件确认详见附表3包装材料的确认包装材料供应商确认包装材料供应商应具有合法营业执照及相应资质,有PET/AL/PE 复合膜相关材料药包材注册证,至少在10万级以上环境生产,对生产过程有严格的控制,有完善的产品合格检验及放行管理文件;包装材料微生物屏障确认包装材料应具有对微生物的屏障作用,以确保维持灭菌后产品的无菌性;染色渗透试验一1试验设备小块海绵浅盘白色吸水纸平板玻璃甲苯胺蓝溶液2试验方法将与试验样品大小相同的吸水纸放置于平板玻璃上,让PET/AL/PE复合袋的内表面与吸水纸相接处;将染色溶液倒入浅盘后将海绵放入其内1min;取出海绵,吸干浅盘边缘上剩余的液体;将海绵置于试验样品上,确保海绵边缘离开试验样品边缘至少15mm,放置2min;取下海绵和试验样品,检查吸水纸是否因染色溶液透过试验样品而被染色;重复检测三组并记录,详见附表4;染菌渗透试验二1菌液制备取经30~35℃培养18~24h的枯草芽孢杆菌营养肉汤流体培养物1ml,加入至%无菌NaCl溶液中,10倍稀释至10-6约为小于100cfu/ml的菌悬液,备用;2试验方法取枯草芽孢杆菌菌悬液5滴,均匀滴在样品外表面,互不触碰,在20℃-25℃、相对湿度40%-50%条件下直至干燥,将染菌样品的内表面完全平铺于硫乙醇酸盐流体培养基表面,5s-6s后将染菌样品丢弃,做五个平行样,把硫乙醇酸盐流体培养基置于规定温度培养72h,检查是否染菌,详见附表4;包装材料毒理学确认包装材料在加工及灭菌过程中应不释放足以损害健康的物质;对包装并最终灭菌后的产品进行生物相容性试验,试验结果应符合要求;包装材料物理化学特性确认选用的包装材料应有适宜的物理化学特性,能满足产品包装、灭菌过程的要求;取30个复合袋,按YBB00172002 聚酯、铝、聚乙烯药品包装用复合膜、袋的要求对外观、溶出物、耐压性能、阻隔性能、跌落性能、机械性能、热合强度进行逐一检测,检测结果应该符合要求;包装材料与灭菌过程的适应性因XXXXXXXXXX采用辐照灭菌,铝箔袋在辐照后其理化特性有可能发生变化,其封口强度也有可能发生变化;另外铝箔可能会对辐照产生阻隔作用,因此必须对包装材料与灭菌过程的适应性进行确认;辐照前后理化性质确认取铝箔袋,25kGy辐照灭菌;检测,对比灭菌前后材料的外观、溶出物、耐压性能、阻隔性能、跌落性能、机械性能、热合强度,详见附表5;灭菌后产品的无菌性取3个铝箔袋放入枯草芽孢杆菌指示剂,并按正常工艺封口;将其与其他产品一起辐照灭菌,灭菌后取出生物指示剂在37±1℃恒温箱中培养7天,观察有无菌落生长;包装材料与标签系统的适应性取灭菌后100袋产品,在灯光下观察标签字迹是否完整,清晰,墨迹是否有发散现象;包装材料与贮存运输过程的适应性因包装材料在贮存和运输过程中对产品特性提供必要的保障,而包装材料极有可能在贮存过程中发生变化,为了确定贮存和运输可能对产品带来的影响,我们还需要对包装材料与贮存运输过程的适应性进行确认;包装运输破坏试验取一只装有200袋具有外包装产品的包装箱,将包装箱用胶带捆牢,将其从1米高度自由跌落到水泥地面;分别从1个角、三条边、六个面进行跌落试验,试验完毕后,检查密封袋有无破损,详见附表6. 加速老化试验1加速老化时间及条件预确认期望产品寿命为两年;依据ASTM F1980:2002无菌医疗器械包装的加速老化试验标准指南,加速老化等值为两年,用阿列纽斯公式,加速老化因子取Q10=,根据现有实际条件,储存环境温度在25±1℃,环境温度T25℃,被认为是保守值,设定加速老化温度TAA为60℃,将试样安置在加速老化箱中,持续时间由如下方程计算得出:AAF=Q10TAA-TRT/10当Q10=;环境温度T RT=25℃;加速老化实验温度T AA=60℃AAF=60-25/10=预期老化时间RTY为两年,现在按照730天来计算:加速老化时间AAT=RTY/AAF=730÷=天即实时等值AAT=天=24个月加速时间选择70天;2包装密封性检测抽取180个铝箔袋充氮气密封后放置于恒温恒湿箱进行加速实验,设定温度为60℃,保存70天,分别在加速开始前、一周、两周、三周、一个月、70天每次抽取30袋,检测其密封性是否合格,详见附表6;密封性检测项目及判定标准包装系统与使用过程的适应性本品为最终灭菌医疗器械,最终使用条件为非无菌环境,包装应确保在开启时不会产生新的污染源对产品造成污染;抽取十个样品,将双手食指伸向铝箔袋袋口内,两手均匀用力朝相反方向撕裂,检查其撕裂时封口发生变形情况以及是否有分层、碎屑脱落;7. 再验证质量管理部负责收集各项验证、实验结果记录,根据验证、实验结果出具验证报告,修订标准操作程序,维护保养程序,报验证小组;验证小组对验证结果进行综合评审,做出验证结论,发放验证证书,对验证结果的评审应包括:验证试验是否有遗漏、验证过程中对验证方案有无修改,修改原因、依据、以及是否经过批准,验证记录是否完整,验证试验结果是否符合标准要求,偏差及对偏差的说明是否合理,是否需要进一步补充实验,当包材供应商、生产工艺或设备发生改变后,需要进行再验证;验证人员名单及确认记录验证所用主要设备确认记录验证相关文件审核记录附表4包装材料微生物屏障确认记录附件5包装材料灭菌前后理化指标确认记录附件6包装材料与贮存运输过程的适应性确认记录。
包装验证方案sample20141127汇总

常熟市康宝医疗器械厂FSZ-980多功能薄膜封口机包装验证方案编制:案小日期:日期:2014-09-20审核:」也2猊日期:2014-09-20批准:总“工日期:2014-09-20目录1.概述2.验证目的3.验证小组成员名单4.确认范围5.验证依据及标准6.验证内容7.再验证8.最终评价及验证报告1.概述我公司生产的一次性使用集尿袋、一次性使用喂食袋、带扬克头吸引连接管、不带扬克头吸引连接管、一次性多用途灌肠袋产品,初包装采用纸塑袋包装袋,该包装袋由1059BTyvek 纸和PET/PE复合膜构成。
纸塑袋作为无菌医疗器械的初包装运用有30年的历史,纸塑袋具有高强度,高阻菌,寿命长,优异的抗微生物渗透能力,灭菌后撕口干净不带纸屑。
我公司现有安徽普天塑业有限公司生产的FSZ-980多功能薄膜封口机数台。
该封口机为操作方便,且使用状态良好。
封口机设备参数:封口温度:0〜300℃封口速度:0〜9档(可调,档数越高速度越快)2.目的根据EN ISO 13485:2012/AC:2012, ISO 11607-1:2006的要求,对包装袋封口进行有效性验证,以保证医疗器械的持续安全有效。
3.验证小组成员名单4.确认范围本确认方案仅适用于一次性使用集尿袋、一次性使用喂食袋、带扬克头吸引连接管、不带扬克头吸引连接管、一次性多用途灌肠袋初包装过程的确认,包装材料采用纸塑包装袋,封口设备采用FSZ-980多功能薄膜封口机。
5.验证依据及标准5.1ISO 11607-1:2006 Packaging for terminally sterilized medical devices Part 1: Requirements for materials, sterile barrier systems and packaging systems.5.2ISO 11607-2:2006 Packaging for terminally sterilized medical devices Part 2: Validation requirements for forming, sealing and assembly processes.5.3EN 868-5:2009 Packaging materials and systems for medical devices which are to be sterilizedPart 5: Heat and self-sealable pouches and reels of paper and plastic film construction—Requirement and test methods.5.4GB/T 15171-1994软包装件密封性能试验方法。
验证方案(纸塑包装单包装)
纸塑包装单包装确认方案目录目录 (2)1 目的 (3)2 范围 (3)3 依据文件 (3)4 确认小组成员 (4)5 IQ〔Installation Qualification〕 (5)6 OQ〔Operational Qualification〕 (6)7 PQ〔Performance Qualification〕 (10)注:1、依据标准ISO11607-1.-2:2019参考GB/T19633-2019;2、本方案包含了IQ/OQ/PQ;依据文件局部务必形成文件, 请确认, 假设没有, 请完成。
1目的本方案的目的在于对注射器的初包装设备吸塑包装机进展安装确认和操作确认, 以确保能提供适宜的包装设备和操作方法。
该设备放置于………。
2范围2.1设备: 本次验证确认的设备为吸塑包装机, **内部编号为*********。
2.2材料: 本次确认使用的材料为PET/PE复合薄膜和60g/m2医用涂胶透析纸。
材料的具体参数见供给商提供资料。
2.3重新确认条件设备相关变动, 与吸塑、热封部位的维护、改动。
产品包装材料的变更。
吸塑、热合模具的修理。
使用新的模具。
有严重产品相关质量事故的发生。
2.4OQ包括两局部组成: 1.确认设备的功能操作;2.确认当设备运行于常规条件、上限条件、下限条件时的封合过程, OQ过程需要对产品的实际封合过程和/或样品的封合过程进展评估, OQ的评估应包括产品在灭菌前和灭菌后性能的比拟结果。
2.5封口过程3注射器公司将生产不同型号的注射器。
公司外购的PET/PE薄膜和医用透析纸, 薄膜经吸塑包装机吸塑成型, 放入产品, 然后与透析纸进展热封。
然后由切断刀将已经热合的包装切割, 形成单个产品。
4依据文件4.1包装验证控制程序4.2吸塑包装工艺守那么4.3设备维修保养管理制度4.4医用透析纸质量标准4.5产品初始污染菌监视管理方法4.6吸塑包装机操作手册4.7过程确认指南-FDA推荐指南5确认小组成员6IQ承受标准当表一的要求都已满足并有完整的书面文件支持时, 可以认为安装确认顺利完毕。
《包装设计需求确认表》
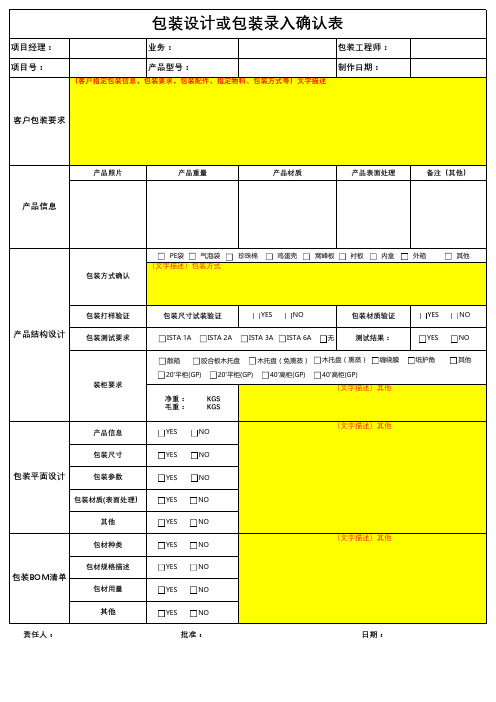
项目经理:业务:包装工程师:项目号:
产品型号:
制作日期:
产品照片产品重量产品材质产品表面处理备注(其他)
包装打样验证包装尺寸试装验证
包装材质验证
包装测试要求测试结果:
净重: KGS 毛重: KGS
产品信息包装尺寸
包装参数包装材质(表面处理)
其他包材种类包材规格描述
包材用量
其他
责任人:
批准:日期:
包装设计或包装录入确认表
包装方式确认
装柜要求
(客户指定包装信息,包装要求,包装配件,指定物料、包装方式等)文字描述
(文字描述)其他
(文字描述)其他
客户包装要求
产品信息
产品结构设计
包装平面设计
包装BOM清单
(文字描述)包装方式
(文字描述)其他
PE 袋ISTA 1A 20'平柜(GP)
40'高柜(GP)
珍珠棉鸡蛋壳窝峰板衬板内盒外箱气泡袋其他
ISTA 2A ISTA 3A ISTA 6A 无
YES NO YES NO
YES NO
YES NO YES
NO
YES NO YES NO 散箱
胶合板木托盘
木托盘(免熏蒸)
木托盘(熏蒸)20'平柜(GP)
40'高柜(GP)
缠绕膜
纸护角
其他
YES NO YES NO YES NO YES
NO
YES NO。
纸塑包装单包装检验确认方案

纸塑包装单包装检验确认方案1目的本方案的目的在于对注射器的初包装设备吸塑包装机进行安装确认和操作确认,以确保能提供合适的包装设备和操作方法。
2范围2.1设备:本次验证确认的设备为吸塑包装机,编号为DXC-601。
2.2材料:本次确认使用的材料为PET/PE复合薄膜和60g/m2医用涂胶透析纸。
材料的具体参数见供应商提供资料。
2.3重新确认条件2.3.1 设备相关变动,与吸塑、热封部位的维护、改动。
2.3.2产品包装材料的变更。
2.3.3吸塑、热合模具的修理。
2.3.4使用新的模具。
2.3.5有严重产品相关质量事故的发生。
2.4OQ包括两部分组成:1、确认设备的功能操作;2、确认当设备运行于常规条件、上限条件、下限条件时的封合过程,OQ过程需要对产品的实际封合过程和/或样品的封合过程进行评估,OQ的评估应包括产品在灭菌前和灭菌后性能的比较结果。
2.5封口过程注射器公司将生产不同型号的注射器。
公司外购的PET/PE薄膜和医用透析纸,薄膜经吸塑包装机吸塑成型,放入产品,然后与透析纸进行热封。
然后由切断刀将已经热合的包装切割,形成单个产品。
3依据文件3.1包装验证控制程序3.2吸塑包装工艺守则3.3设备维修保养管理制度3.4医用透析纸质量标准3.5产品初始污染菌监督管理办法3.6吸塑包装机操作手册3.7过程确认指南-FDA推荐指南4确认小组成员5IQ5.1接受标准当表一的要求都已满足并有完整的书面文件支持时,可以认为安装确认顺利结束。
表一吸塑包装机安装确认表Install validate sheet检查check/日期date:5.2操作工培训记录见表二表二操作工培训记录检查check/日期date:5.3设备校验表三仪表校验信息表Instrument Verify Info. Sheet6OQ6.1包装材料的选择评价包装材料的选择评价内容包括:·选用的包装材料的物理化学性能;·选用的包装材料的毒理学特性;·包装材料与成型和密封过程的适应性;·包装材料的微生物屏障特性;·包装材料与灭菌过程的相适应性;·包装材料与标签系统的相适应性;·包装材料与贮存运输过程的适合性。
产品包装确认表(1121表)

包装数据
1 2 3 4 5 6 7 8 9 10
包装容器类型 纸包装 □ 可回收标准容器 □ 专用产品架 □
内包装形式 散装□捆装□保护纸□保护膜□袋装□其他□
内包装容量
(件/个)
零件外形尺寸 高 ×宽 ×高 (mm)
外包装容量
(件/个)
单个零件重(kg)
包装容器颜色
包装容器自重 (kg)
总重(kg) 供货方式 包装是否可以堆垛
16
每层零件数量
17
每个货盘层数
18
单个纸箱尺寸(mm)
19
外包装尺寸
20
打包带材质
可回收标准容器(当包装容器为标准可回收容器时填写)
容器型号(标准塑料 周转箱)
21 A□
22 B□
23 C□
内径尺寸(长×宽× 高)
300×200×148 (mm) 400×300×148 (mm) 400×300×280 (mm)
其他特殊要求(是/否)
温度敏感(是/否)
包装评审签 名:
25
签名
姓名 (打印
日期
回执表:
回执地址:
传真
供应商 物流部
联系电话 备注:
防锈或防刮伤包装
最终包装 照片/图片
零件对洁净度敏感 (是/否)
江西省南昌县小蓝经济开发区汽车大道1199号
0791-85976596
13607085247
0791-83806666-8428
容器型号(标准塑料周 转箱)
D□
E□
H□
内径尺寸(长×宽×高) 600×400×280(mm) 900×800×730(mm) 600×400×148(mm)
PPAP案例模板-JLQC

内包装外
包
装标
签
样
式确
认
签
字 960/箱
供应商确认图片图片
瑞兴确认
图片图片80/袋 160/内箱
SQA会签工艺部批准说明:①单位 重量:kg 尺寸:mm
②若供货过程中包装有变化,供应商一定要提前通知瑞兴公司,在经批准后方可实施; ③瑞兴参与会签为采购部、SQE、物流管理科,由工艺部批准;
④本表一经签字确认,对包装推进具体时间节点即具约束力,未执行或未按时完成将严格进行考核。
审批陶彬日期2019/11/4
采购部会签
PMC会签内标签(若有)外包装标签
文字说明
文字说明编制
林水根日期2019/11/4毛 重0.4Kg 是否回收否含内包装数量包装材料包装尺寸(45×29×
27)毛 重0.6KG 是否回收
含零部件数量包装材料纸箱包装尺寸
(230**13*9CM)
单车用量
单件重量交付周期3周外包装形式□ 纸箱 □塑料箱 □专用器具 □其它零件号:
JP111-67零部件名称插针组件单件尺寸(L×W×H)运输单位联系人
电 话传 真邮 箱路程
运输方式□汽车 □火车 □轮船 □其它零部件包装方案确认书
供应商
供应商代码工厂地址。
初包装确认方案--

初包装确认方案项目名称:编制:审核:批准:XXXXXXXXX有限公司XXXX年XX月XX日XXXXXXXXX初包装确认目录1、验证目的2、适用范围3、概述4、确认组织及职责5、确认说明6、确认内容7、再验证附件1:验证人员名单及确认记录附件2:验证所用主要设备确认记录附件3:验证相关文件审核记录附件4:包装材料微生物屏障确认记录附件5:包装材料灭菌前后理化指标确认记录附件6:包装材料与贮存运输过程的适应性确认记录1. 验证目的根据ISO11607-2006最终灭菌医疗器械的包装的要求,对PET/AL/PE复合膜进行确认,以保证包装系统在加工、运输、贮存和使用过程中不会对产品造成污染,能够保证医疗器械持续安全有效。
2. 适用范围本方案适用于XXXXXXXXXXXXX初包装的确认。
3. 概述我公司XXXXXXXXXXXXXX为最终灭菌医疗器械,本品初包装选用铝箔袋,其材料为PET/AL/PE复合膜,该包装具有高阻隔性、强密封性、材料强度大的优点。
4. 确认组织及职责4.1确认方案和确认报告的人员职责4.1.1质量管理部验证管理员:质量管理部验证管理员负责文件的起草,评价验证报告并检查验证记录是否完整、是否符合规定,并管理确认过程中的偏差与变更,组织相关验证人员的培训;4.1.2岗位操作人员:具有熟练操作相关设备的工作经验;4.1.3质量管理部质检员:质量管理部质检员检验并根据检验结果填写记录,保证检验数据的准确性;4.1.4质量管理部主任、生产车间主任:负责方案及报告的审核,监督验证过程的实施;4.1.5管理者代表:负责验证方案及报告的审批。
5. 确认说明5.1记录填写要求所有验证记录、结果应按批准过的方案的相应记录表格填写,记录的填写、计算应审核并签字,QA应检查验证记录是否完整、是否符合规定。
5.2偏差的调查当检测结果异常时,或出现操作不符合SOP要求时,执行部门应通知QA,执行偏差调查,QA应在记录中清楚的描述该偏差的情况,对于偏差的影响做出评估并制定相应措施计划,经批准后,实施纠正预防措施并予以记录。
DOE-封口验证确认

龙脉医疗器械(北京)有限公司包装袋封口过程确认报告文件编号:DP/YZ-2016-B048版本号:A编制:日期:审核:日期:批准:日期:确认小组人员组长姓名职务/职称部门王海峰技术部门经理技术部组员陈鹏技术工程师技术部张亚宾质量工程师质管部赵玉雷检验员质管部何永秀生产主管生产部胡磊设备工程师生产部目录一、概述1. 确认目的2. 确认范围3. 确认计划二、安装确认三、运行确认四、性能确认五、日常监控与再验证六、分析及结论七、附件一、概述 1.1确认目的:由于供应商所使用的“特卫强”材料发生变化,所以对变化材质后的产品重新进行封口确认,确认在合理的工艺下,能够持续稳定地输出符合接受标准要求的产品。
1.2确认范围:设备:封口机 编号:DP-SC-47 原材料:1.3确认计划: 1.3.1确认项目:材质为“透析纸为TYVEK1073B ,薄膜面为SPE+Adhesive 复合胶水+ PET 聚酯”的单包装袋封口后的“外观”、“剥落力”及“穿透检测”。
1.3.2检验的方法以及可接受准则检测方法:外观:正常视力或矫正到正常视力下检查,距离被测物20~30 cm 目测;剥落力:在封口区域取两端测试条,宽为25.4mm ,长大于45mm ,用夹具将样品固定好; 在伺服控制仪上进行180°、速度200mm/min ,夹具间距离为40mm 状态下进行剥离测试。
并记录剥离拉力最大值。
穿透检测:参照“YY/T0681.4-2010”中条款“9程序”中的操作方法,使用0.05%的甲苯胺蓝溶液,滴入封口后的包装样品中,溶液深度约5mm ,保持时间在5S-20S 之间, 目测密封区。
接收标准:外观:单包装袋热封区域及自身三边封口区域:无开裂,无气泡,无褶皱,与单包装袋边缘平行无倾斜。
剥落力:≥9N (因封口边不为使用时开口方向,所以以拉力最小值为标准)。
穿透检测:染色体通过密封区域到达另一侧则密封不合格(注:毛细渗透不作为泄漏点存在)。
包装验证方案

实验记录: 热合温度(℃) 160 170 180 190 200 210 220
结论:
剥离实际值(N/15mm) 1.2 1.4 1.6 1.7 1.8 1.4 1.2
结果 不合格 不合格 合格 合格 合格 不合格 不合格
在厂家建议的 200℃热封后进行剥离力检验均在 1.5N/15mm 以上。 通过包装热拉力检验结果判断涂胶纸+透明复合膜这种材质的极限温度为 180℃~200℃,与 厂家所给的资料相符
验证人/日期:
审核人/日期:
包装完整性测试确认 验证目的:确认包装的完整密封性能够达到标准要求 验证要求:无明显贯穿热封面的溶液通道出现 验证依据:ISO11607-2:2006 EN868-1
批准人: 批准日期:
5
—— by 2Advanced czs_868@
xxx 有限公司
纸塑包装内包装过程 确认报告
1. 概述
1.1 无菌 xx 产品内包装热封过程安全有效,保证稳定的质量水平,公司依据《包装过程 确认管理程序》于 2009 年 9 月 05 号至 2009 年 11 月 19 日组织实施了该过程的确认工 作。 1.2 实施日期与人员:
一
二
三四
五
六
七
热封温度 (℃)
160 170 180 190 200 210 220
热封速度(m/min)
12
3 依据文件
EN868-1999《医用物品灭菌的包装材料和系统 通用要求和测试方法》 ISO11607-1:2006《最终灭菌医疗器械的包装第 1 部分:材料、无菌屏障系统、包装 系统的要求》
包装确认表确认书

姓名(打印)
JMCH使用单位 以下只给JMCH包 装工程师填写 包装工程师签名Stamp & Sign:
备注: 包装评审合格,实物到货时请包装工程师现场确认
日期
可回收包装容器使用寿命(/月)Shelf Life :
22. 运输方式Mode of Transport √汽运 □铁路运输 □海运 □空运
* 零
供应商资料 Supplier
供应商代码Supplier Code: 供应商名称Supplier Name:
地址Address:
包装工程师Contact Person:
电包话装Ph描one述Numbe: Photos
零件Part
防潮、防 尘、防锈
日期Date:
邮编Post NO: E-mail: 传真Fax Number::
回执表:
回执地址: 邮编:
Fax :
注意: 1.不提交此表格以及在1121表认可后有任 何背离的,供应商作业评定等级将会受到 影响. 2.完成填写本电子文档及发送原始签署的 正式文本
JMCH零件图号 Part No
前缀Prefix 零件图号Part No:
中缀Base
后缀AA
零件名称Part Name :
长 ×宽 (mm)
×高
6
外包装容量Secondary Qty 14
7
外包装尺寸Secondary
D
长 高
165 100
×宽 160 × ×折叠高度
8
零件尺寸Part
Dimension
长 148.5 ×高 36
×宽 40 (mm)
9
每个零件重量Part weight 0.9 (kg)
最终灭菌包装确认方案(已经过GMP和CE)【范本模板】

包装验证方案产品名称:一次性使用吸氧管一次性使用吸氧面罩编制:审核:批准:北京东方潮汐科技发展有限公司目录1.0 概述---—--————-—---———------————--—-———-——-—-------————-———----- P32.0 验证目的———-—----——-—--—-—-—----———-—----——--————-———-—-----—-—- P33。
0 文件验证小组成员及职责-——-—-——----———-—-—-—-——----——--------——-— P34。
0 确认范围——-——-———--———-——-———--—-----—-—------—-—------——-—--——- P35。
0验证依据及标准---———--———--——-———-—------——-——-——-——-——---—-————— P36。
0 确认项目-————--—-———-———---—---———--——--—-——-——-—-———————-———---- P46。
1 包装材料和系统的验证-—-——-—---—-———--——--———-—--—--—-—-————---——--—— P46.2 包装过程确认(所有试验包装袋中均装有产品进行试验)—--————-——----—-—---—- P77.0重新确认条件--————---————-—————-——----——————-—-—----——---—--——--- P128.0 最终评价及验证报告---——-—-—————-—--——--—-------——---—---—--—-—-—- P121。
0概述1。
1我公司最终灭菌医疗器械的包装采用中封袋,中封袋为PET和PE复合膜+透析纸热合而成,具有高透气性、灭菌效果好等优点。
根据GB/T 19633-2005/ISO 11607;2003最终灭菌医疗器械的包装要求.对我公司的灭菌医疗器械的包装进行确认.1.2确认过程:1.2。
吸塑包装验证方案

吸塑包装确认方案设备编号:模具编号:编制:日期:审核:日期:批准:日期:部门会签1目的本方案的目的在于对压力泵的初包装设备包装封口机进行安装确认、操作确认及设备性能确认,以确保能提供合适的包装设备和操作方法。
该设备放置于********有限公司净化车间组装间内。
验证依据:ISO11607-1.-2:20062范围2.1设备本次验证确认的设备为包装封口机,公司内部编号为***-***-05。
2.2材料本次确认使用的材料为PETE薄膜和64g/m2医用涂胶透析纸。
材料的具体参数见供应商提供资料。
吸塑膜:制造厂商,;型号规格。
透析纸:供应厂商DUPONT;型号规格Tyvek1059B。
2.3重新确认条件2.3.1会影响过程参数的原材料改变2.3.2安装新的设备部件2.3.3过程和/或设备从一个地点移向另一个地点2.3.4灭菌过程改变2.3.5质量或过程控制显示有下降趋势2.4OQ包括两部分组成:1)确认设备的功能操作;2)确认当设备运行于常规条件、上限条件、下限条件时的封合过程,OQ过程需要对产品的实际封合过程和/或样品的封合过程进行评估,OQ的评估应包括产品在灭菌前和灭菌后性能的比较结果。
2.5封口过程公司将生产两种型号的压力泵。
公司外购的PETE吸塑薄膜和医用透析纸放入产品后,经包装封口机进行热封。
3依据文件3.1压力泵企业标准3.2包装验证控制程序3.3设备维修保养管理制度3.4吸塑包装工艺守则3.5产品初始污染菌监督管理办法3.6包装封口机操作规程4确认小组成员5IQ5.1接受标准当表1的要求都已满足并有完整的书面文件支持时,可以认为安装确认顺利结束。
表1吸塑包装机安装确认表设备编号:DP-SC-05确认人:日期:5.2人员培训确认人:日期:5.3生产设备校验表3包装封口机校验信息表5.4检测设备校验表4力学试验机6OQ6.1包装材料的选择评价包装材料的选择评价内容包括:·包装系统的微生物屏障·包装材料的生物相容性(ISO10993-1)和毒理学特性;·包装材料的物理化学性能;·包装材料与成型和密封过程的适应性;·包装材料与灭菌过程的相适应性;·包装材料与标签系统的相适应性;·包装材料在灭菌前后贮存运输过程的适合性。
