《铁及其化合物》知识点总结归纳
铁及其化合物知识点总结

铁及其化合物知识点总结
铁(Fe)是一种常见的金属,是地壳中最常见的元素,也是地球上最常见的金属,占据了地壳总量的5.6%。
它在化学上属於非活性金属,并且具有坚韧、耐高温、高熔点、高强度和具有能量转换能力等特性。
与其他金属相比,铁的价格也更低廉,因此大量应用于工业生产,如炼钢、结构承重等领域。
铁的主要化合物有铁磁体、铁氧体、铁碳合金等,它们在能源转换、结构材料、动力机械等方面扮演着重要作用。
铁磁体是指铁元素及其混合物具有磁性的复合物,它们具有优良的热稳定性和高磁导率,在电子工业中有着重要应用,如电子电机、电磁炉等。
铁氧体是指铁元素及其混合物具有氧化物性质的复合物,具有优良的耐腐蚀性和良好的热稳定性,用于制造电容器、复合膜、热控元件等。
铁碳合金,也称为碳钢,是以铁为主合金元素,加入碳元素组成的合金,它具有较高的强度、硬度和热稳定性,用于制造机械零件、结构件、工具等。
此外,铁还是用于构建广厦的主要原材料,由于其坚韧、耐腐蚀性高,适合搭建大型建筑,因此铁的应用更加普遍,如钢筋混凝土桩、钢结构桥梁等。
另外,铁还可以制造各种器械,如机床、研磨机等。
铁及其化合物还可以用于制药,例如铁氯化钾,它是一种有效的血红细胞增生剂,可以补充血液中的红细胞,治疗体内缺铁性贫血症,有助于促进免疫系统的建立。
总之,铁及其化合物有着广泛的应用,它们在冶金业、建筑行业和制药行业中都有重要作用,改变着我们的生活。
只要按照对它们的正确使用,就可以让我们的生活更美好。
铁及其化合物知识点归纳

钢铁工业
钢铁工业是铁及其化合物的主要应用领域,铁元素是钢铁的主要成分,用于制造各 种钢材、铸件和机械零件等。
铁及其化合物在钢铁工业中发挥着重要作用,如铁矿石的开采、冶炼和轧制等过程 中都需要用到铁及其化合物。
铁及其化合物在钢铁工业中的具体应用包括炼铁原料、添加剂、催化剂和脱氧剂等。
医药领域
铁及其化合物在医药领域也有广 泛应用,如补铁剂、抗贫血药和
02
铁的重要化合物
铁的氧化物
铁的氧化物主要有两种,即FeO 和Fe2O3。
FeO在常温下为黑色固体,具有 金属光泽,不溶于水,但溶于酸。
Fe2O3是红棕色固体,难溶于水, 但能溶于酸。
铁的氢氧化物
铁的氢氧化物主要有两种,即 Fe(OH)2和Fe(OH)3。
Fe(OH)2是白色固体,不溶于 水,但能溶于酸。
Fe(OH)3是红棕色固体,难溶 于水,也不溶于酸。
铁的盐类
铁的盐类非常丰富,常见 的有FeCl2、FeCl3、 FeSO4、Fe2(SO4)3等。
FeCl3是黄色晶体,易溶 于水,溶液呈酸性。
FeCl2是浅绿色晶体,易 溶于水,溶液呈酸性。
FeSO4是浅绿色晶体,易 溶于水,溶液呈酸性。
03
铁及其化合物的应用
总结词
水解反应是铁及其化合物与水反应生成氢氧化物或水合物的反应。
详细描述
铁的化合物如硫酸铁、氯化铁等可以与水发生水解反应,生成相应的氢氧化铁或水合物。例如,硫酸 铁水解可以得到硫酸和氢氧化铁;氯化铁水解可以得到盐酸和氢氧化铁。水解反应在制备铁的氢氧化 物、处理含铁废水等方面有重要应用。
05
铁及其化合物的制备方法
氧化铁的制备
总结词
氧化铁的制备通常采用铁盐与碱反应,再经过热解或水解得到。
铁及其化合物知识点
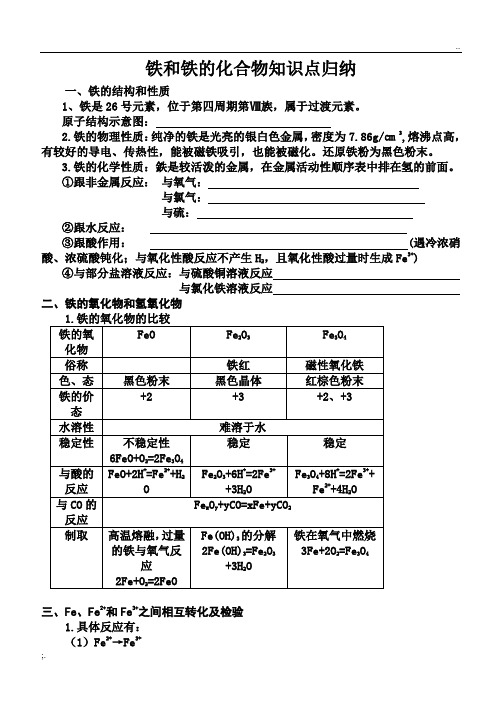
铁和铁的化合物知识点归纳一、铁的结构和性质1、铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:2.铁的物理性质:纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁的化学性质:鉄是较活泼的金属,在金属活动性顺序表中排在氢的前面。
①跟非金属反应:与氧气:与氯气:与硫:②跟水反应:③跟酸作用: (遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应不产生H,且氧化性酸过量时生成Fe3+)2④与部分盐溶液反应:与硫酸铜溶液反应与氯化铁溶液反应二、铁的氧化物和氢氧化物三、Fe、Fe2+和Fe3+之间相互转化及检验1.具体反应有:(1)Fe2+→Fe3+①2Fe2++Cl2=2Fe3++2Cl-(在亚铁盐溶液中通入氯气,溶液由浅绿色变为棕黄色)。
②3Fe2++NO3-+4H+=3Fe3++2H2O+NO↑③2Fe2++H2O2+2H+=2Fe3++2H2O(2)Fe3+→Fe2+①2Fe3++Fe=3Fe2+,在FeSO3溶液中往往要加铁的原因是可以防止Fe2+被氧化为Fe3+。
②2Fe3++Cu=2Fe2++Cu2+,电路板的制作是利用FeCl3溶液与裸露的铜反应。
③2Fe3++2I-=2Fe2++I22.Fe2+和Fe3+的检验(1)Fe2+的检验:方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色。
方法二:滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最后变为红褐色。
(2)Fe3+的检验:方法一:滴加KSCN溶液或NH4SCN溶液,溶液立即变为血红色。
方法二:滴加NaOH溶液,出现红褐色沉淀。
3.例题精讲例1.把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后,溶液中大量存在的金属阳离子是()A.只有Fe2+B.只有Fe3+C.有Fe2+和Cu2+D.有Fe3+和Cu2+例2.由FeO、Fe2O3和Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,,则这种混合物中FeO、Fe2O3和Fe3O4的物质的量之比是()。
化学铁及其化合物的知识点总结

化学铁及其化合物的知识点总结
铁是一种常见的金属元素,它在自然界中广泛存在,并且在人类历史上也扮演了非常重要的角色。
以下是关于化学铁及其化合物的知识点总结:
1. 铁的物理性质:铁是一种银灰色的金属,具有良好的延展性和导电性。
它的密度约为7.87克/立方厘米,熔点为1538℃,沸点为2862℃。
2. 铁的化学性质:铁可以与许多元素和化合物反应,包括氧气、水、酸、碱等。
与氧气反应生成的氧化铁是最常见的铁化合物之一。
3. 铁的同位素:铁具有多种同位素,其中最常见的是铁-56。
其他铁同位素包括铁-54、铁-57、铁-58等。
4. 铁的存在形式:铁可以以多种形式存在,包括天然铁矿石、铁合金、生铁等。
天然铁矿石包括赤铁矿、磁铁矿、菱铁矿等。
5. 铁的生产:铁的生产通常通过高炉冶炼来实现。
该过程涉及将铁矿石和焦炭一起加热,以将铁从矿石中分离出来。
6. 铁的化合物:铁可以形成多种化合物,包括氧化铁、氯化铁、硫酸铁、亚硫酸铁等。
这些化合物在生活和工业中都有广泛的应用。
7. 铁的生物学作用:铁是人体必需的元素之一,它在体内参与形成血红蛋白和肌红蛋白,帮助携带氧气。
铁还是许多酶的重要组成部分。
总之,化学铁及其化合物在我们的生活和工业中都具有重要的地位。
了解铁的性质和应用有助于我们更好地利用和保护这种资源。
铁及其化合物笔记

铁及其化合物笔记
一、铁单质的还原性
1.铁可以与铜离子发生置换反应,生成亚铁离子和铜单质。
2.铁在潮湿的空气中容易被氧化成铁氧化物。
二、铁盐的氧化性
1.铁离子具有氧化性,可以与碘离子发生氧化还原反应,生成亚铁离子和碘单质。
2.铁离子还可以与许多还原剂反应,表现出其氧化性。
三、亚铁盐的氧化性和还原性
1.亚铁离子具有还原性,可以与锌发生置换反应,生成锌离子和铁单质。
2.亚铁离子还具有氧化性,可以与强氧化剂如高锰酸钾反应,生成铁离子和其他产物。
四、铁离子的检验
1.铁离子可以与硫氰化钾(KSCN)溶液反应生成血红色的配合物,因此可以用KSCN溶液来检验铁离子的存在。
2.亚铁离子则不能与KSCN溶液反应生成血红色配合物,但可以通过加入氧化剂(如氯水)将其氧化为铁离子后再进行检验。
五、主要反应的化学方程式
1.铁与盐酸反应生成氯化亚铁和氢气。
2.铁与硫酸铜反应生成硫酸亚铁和铜单质(湿法炼铜)。
3.在氯化亚铁溶液中滴加氯水可以除去其中的氯化铁杂质。
4.氢氧化亚铁在空气中变质生成氢氧化铁。
5.在氯化铁溶液中加入铁粉可以生成氯化亚铁。
6.铜与氯化铁反应生成氯化亚铁和氯化铜。
铁及其化合物知识点总结

铁及其化合物知识点总结一、铁元素的概述铁是一种常见的金属元素,原子序数为 26,位于元素周期表的第四周期第Ⅷ族。
在自然界中,铁主要以化合态的形式存在,如赤铁矿(主要成分是 Fe₂O₃)、磁铁矿(主要成分是 Fe₃O₄)等。
铁具有良好的导电性、导热性和延展性。
其物理性质包括银白色金属光泽(纯铁),但在通常情况下,铁表面容易生锈而呈现出黑色。
二、铁的化学性质1、与氧气反应在常温下,铁在干燥的空气中不易与氧气反应,但在潮湿的空气中容易生锈,生成铁锈(主要成分是 Fe₂O₃·xH₂O)。
在点燃的条件下,铁能在氧气中剧烈燃烧,生成黑色的四氧化三铁(Fe₃O₄),化学方程式为:3Fe + 2O₂点燃=== Fe₃O₄。
2、与酸反应(1)与非氧化性酸(如稀盐酸、稀硫酸)反应,生成亚铁盐和氢气。
Fe + 2HCl === FeCl₂+ H₂↑Fe + H₂SO₄=== FeSO₄+ H₂↑(2)与氧化性酸(如浓硫酸、浓硝酸)在常温下发生钝化,但在加热条件下可以反应。
3、与盐溶液反应铁能与比它活动性弱的金属的盐溶液发生置换反应,将其金属离子置换出来。
例如:Fe + CuSO₄=== FeSO₄+ Cu三、铁的氧化物1、氧化亚铁(FeO)黑色粉末,不稳定,在空气中加热时迅速被氧化为四氧化三铁。
2、氧化铁(Fe₂O₃)红棕色粉末,俗名铁红,可用作红色颜料。
3、四氧化三铁(Fe₃O₄)黑色晶体,具有磁性,俗名磁性氧化铁。
它们的化学性质如下:(1)都能与酸反应生成相应的盐和水。
(2)在一定条件下可以被还原为铁。
四、铁的氢氧化物1、氢氧化亚铁 Fe(OH)₂白色絮状沉淀,在空气中迅速被氧化,最终变为红褐色的氢氧化铁。
4Fe(OH)₂+ O₂+ 2H₂O === 4Fe(OH)₃2、氢氧化铁 Fe(OH)₃红褐色沉淀,具有两性,但碱性强于酸性。
制备氢氧化亚铁时,要注意隔绝空气,通常采用在溶液中加入植物油或苯等方法。
高中化学铁及其化合物知识总结

高中化学铁及其化合物知识总结高中化学铁及其化合物知识如下:一、铁1、位置、结构:1FeVIII族过渡元素;2原子结构示意图:3+3常见离子: Fe强氧化性2+Fe强还原性。
3、物理性质:1纯铁抗蚀能力强2具有一般金属的物理通性。
3黑色金属铁铬锰4、化学性质:较活泼1与非金属单质:3Fe + 2O2 Fe3O4△Fe + S === FeS 点燃2Fe + 3Cl2 2FeCl3 棕黄色烟1 点燃2与H2O3Fe + 4H2Og3O4 + 4H23与酸①与非氧化性酸:如盐酸、稀硫酸+2+Fe + 2H = Fe + H2↑②与氧化性酸:如浓硫酸、浓硝酸、稀硝酸 Fe+4HNO3稀=FeNO33+NO↑+2H2O△FeSO +3SO↑+6HO 2Fe+6H2SO4浓===24322常温钝化△Fe+6HNO3浓===FeNO33+3NO2↑+3H2O常温钝化4与盐:2+2+Fe + Cu = Fe + Cu3+2+Fe + 2Fe = 3Fe二、铁的氧化物和氢氧化物1、氧化物2、铁的氢氧化物[注]制取FeOH2时,为什么要用新制的FeSO4溶液?为什么要将吸有NaOH溶液的胶头滴管插入液面以下?2+3+三、Fe和Fe的相互转化网络图:Fe2331判断离子共存2+3+-①Fe、Fe均水解,与HCO3、[AlOH4]-、CO32-等因水解相互促进在溶液中不能大量共存②Fe3+与S2-、I-、HS-、SO32-,Fe2+与NO3-H+、ClO-、MnO4-H+在溶液中因氧化还原反应不能大量共存。
2盐溶液的配制与保存①Fe2+的盐溶液:加少量铁粉,防止Fe2+被氧化;加少量相应的酸,防止Fe2+水解。
②Fe3+的盐溶液:加少量相应酸防止Fe3+水解。
2+3+四、Fe和Fe的检验:3+1、Fe的检验:1溶液呈2加NaOH溶液,现象有红褐色沉淀生成; 3+-Fe+3OH===FeOH3↓红褐色 3加KSCN溶液,现象 ;反应式 ; 3+-Fe+3SCN===FeSCN3红色4加苯酚,现象;5淀粉碘化钾试纸,现象3+-2+。
(完整版)铁及其化合物知识点+习题(带答案),推荐文档

铁及其化合物知识点1.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。
密度7.86 g/cm3,熔沸点较高。
能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
二.化学性质:1.与非金属反应1)Fe+S (I 2) FeS (FeI 2) 2)3Fe+2O 2 Fe 3O 4 3)2Fe+3Cl 2 2FeCl 3Fe 2+Fe 3+2.与水反应 3Fe + 4H 2O(g) Fe 3O 4 + 4 H 2 ↑(置换)3 与酸反应1)与非氧化性酸(盐酸、稀硫酸)反应 Fe +2H +== Fe 2+ + H 2↑2)与氧化性酸反应 :Fe+4HNO 3(稀)=Fe(NO 3)3+NO↑+2H 2O常温下,铁和冷浓硝酸、冷浓H 2SO 4发生钝化,但在加热条件下,钝化作用立即遭到破坏: Fe+6HNO 3(浓)Fe(NO 3)3+3NO 2↑+3H 2O Fe+6H 2SO 4(浓)Fe 2(SO 4)3+3SO 2↑+3H 2O4.与盐溶液反应:2Fe 3++ Cu = 2Fe 2++ Cu 2+ Fe + 2Fe 3+ = 3 Fe 2+ Fe + Cu 2+ = Fe 2+ + Cu三、铁的化合物1、铁的氧化物铁的氧化物的比较铁的氧化物FeO Fe 2O 3Fe 3O 4俗称铁红磁性氧化铁色、态黑色粉末红棕色粉末黑色晶体铁的价态+2+3+2、+3水溶性难溶于水稳定性不稳定性 6FeO+O 2=2Fe 3O 4稳定稳定与酸的反应FeO+2H +=Fe 2++H 2O Fe 2O 3+6H +=2Fe 3++3H 2O Fe 3O 4+8H +=2Fe 3++ Fe 2++4H 2O与CO 的反应Fe x O y +yCO=xFe+yCO 2制取高温熔融,过量的铁与氧气反应2Fe+O 2=2FeO Fe(OH)3的分解2Fe(OH)3=Fe 2O 3+3H 2O 铁在氧气中燃烧3Fe+2O 2=Fe 3O 42、铁的氢氧化物(1)Fe(OH)2的制备Fe(OH)2易被氧化,在制备时应注意(1)配制后的FeSO 4溶液中要加入少量铁粉;(2)配制溶液的蒸馏水以及所用NaOH 溶液均须煮沸以除去其中溶解的氧气;(3)Fe 2+容易被氧化,所以FeSO 4溶液要新配制. (4)为了防止滴加NaOH 时带入空气,可将吸收NaOH 的长滴管伸入FeSO 4溶液液面下,再挤出NaOH 溶液.(5)为了防止Fe 2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气.实验:FeSO 4溶液中加NaOH. 现象: 生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色化学方程式: FeSO 4 + 2NaOH = Fe(OH)2↓+Na 2SO 4 Fe 2++ 2OH -= Fe(OH)2↓(白色)4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3(红褐色) (白色→灰绿色→红褐色)(2)Fe(OH)3的制备实验:FeCl 3溶液中加NaOH 溶液. ①现象:生成红褐色沉淀②化学方程式:FeCl 3+3NaOH= Fe(OH)3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色)③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe 2O 3粉末.化学方程式: 2Fe(OH)3 Fe 2O 3 +3H 2O[小结]难溶性或微溶性的碱受热不稳定,容易分解。
铁及其化合物

铁及其化合物知识点复习重点1.铁单质的化学性质2.铁的重要化合物的氧化还原性;3.Fe(Ⅱ)、Fe(Ⅲ)的相互转化是高考的热点。
一、铁单质1、铁结构铁位于元素周期表中第4周期,第Ⅷ族,其原子结构示意图为:其失电子情况: Fe-2e-→Fe2+或Fe-3e-→Fe3+。
因而铁是中等活动性的金属,具有可变化合价(+2或+3)。
2、物理性质(1)物理性质:铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是银白色,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
(2)存在形态:铁分布很广,能稳定地与其他元素结合,常以氧化物的形式存在,有赤铁矿(主要成分是Fe2O3)、磁铁矿(主要成分是Fe3O4)、褐铁矿(主要成分是Fe2O3·3H2O)、菱铁矿(主要成分是FeCO3)、黄铁矿(主要成分是FeS2)、钛铁矿(主要成分是FeTiO3)等。
铁是活泼的过渡元素。
3、化学性质(1)与非金属单质反应3Fe+2O2Fe3O4 2Fe+3Cl22FeCl3 Fe+S FeS2Fe+3Br2 = 2FeBr3 Fe+I2=FeI2 3Fe+C Fe3C1、下列物质间的转化不能通过一步化合反应实现的是()A.Fe→FeCl3B.FeCl2→Fe(OH)2C.FeCl3→FeCl2D.Fe→Fe3O42、下列物质不能由单质与氯气直接反应制得的是()A. FeCl2B. NaClC. HClD. CuCl2(2)与水反应3Fe + 4H2O(g) Fe3O4 + 4 H2↑(置换)注意:铁在常温下不会和水发生反应,但在水和空气中O2和CO2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀)3、在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe 与水蒸气的反应实验”。
化学铁及其化合物的知识点总结

化学铁及其化合物的知识点总结铁是一种常见的化学元素,其化合物在生活和工业中具有重要的应用。
本文将从铁的性质、铁的化合物以及其应用领域等方面对铁及其化合物的知识进行总结。
一、铁的性质铁是一种化学元素,其化学符号为Fe,原子序数为26。
它是一种具有金属光泽的银白色固体,具有较高的密度和熔点。
铁在常温下具有良好的延展性和导电性,是一种重要的结构材料。
二、铁的化合物铁的化合物主要包括氧化铁、硫化铁、碳酸铁等。
其中,氧化铁是最常见的铁化合物之一。
氧化铁根据氧化态的不同可以分为三种类型,分别是亚铁氧化物(FeO)、三氧化二铁(Fe2O3)和四氧化三铁(Fe3O4)。
亚铁氧化物是一种黑色的固体,常用于陶瓷和颜料的制备。
三氧化二铁是一种红色的固体,被广泛应用于染料和磁性材料的制备。
四氧化三铁是一种黑色的固体,常用于磁性材料和催化剂的制备。
硫化铁是由铁和硫元素组成的化合物,化学式为FeS。
它是一种黑色的固体,常用于制备铁矿石和硫化铁矿。
碳酸铁是由铁、碳和氧元素组成的化合物,化学式为FeCO3。
它是一种白色的固体,常用于制备铁矿石和石灰石。
三、铁及其化合物的应用铁及其化合物在多个领域具有广泛的应用。
首先,铁是制备钢铁的主要原料,钢铁被广泛应用于建筑、交通工具、机械设备等领域。
其次,铁及其化合物在电子和电气领域也有重要的应用,例如电磁铁、变压器、电池等。
此外,铁的氧化物还可以用于催化剂的制备,如铁三氧化物在催化有机反应中具有重要的应用价值。
在生活中,铁及其化合物也有一些应用。
例如,铁饰品和装饰品常用于室内装饰,如吊灯、壁灯等。
此外,铁也可以用于制备烹饪用具,如铁锅和烧烤架等。
此外,铁的氧化物还可以用于制备颜料,如红色颜料和黑色颜料等。
总结:铁是一种常见的化学元素,其化合物具有重要的应用价值。
铁及其化合物在钢铁、电子、催化剂等领域有广泛的应用。
在生活中,铁及其化合物也被用于室内装饰、烹饪用具和颜料等方面。
铁的性质和化合物的应用使得它在各个领域都具有重要的地位。
铁及其化合物

铁及其化合物知识点复习重点1.铁单质的化学性质2.铁的重要化合物的氧化还原性;3.Fe(Ⅱ)、Fe(Ⅲ)的相互转化是高考的热点。
一、铁单质1、铁结构铁位于元素周期表中第4周期,第Ⅷ族,其原子结构示意图为:其失电子情况: Fe-2e-→Fe2+或Fe-3e-→Fe3+。
因而铁是中等活动性的金属,具有可变化合价(+2或+3)。
2、物理性质(1)物理性质:铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是银白色,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
(2)存在形态:铁分布很广,能稳定地与其他元素结合,常以氧化物的形式存在,有赤铁矿(主要成分是Fe2O3)、磁铁矿(主要成分是Fe3O4)、褐铁矿(主要成分是Fe2O3·3H2O)、菱铁矿(主要成分是FeCO3)、黄铁矿(主要成分是FeS2)、钛铁矿(主要成分是FeTiO3)等。
铁是活泼的过渡元素。
3、化学性质(1)与非金属单质反应3Fe+2O2Fe3O4 2Fe+3Cl22FeCl3 Fe+S FeS2Fe+3Br2 = 2FeBr3 Fe+I2=FeI2 3Fe+C Fe3C1、下列物质间的转化不能通过一步化合反应实现的是()A.Fe→FeCl3B.FeCl2→Fe(OH)2C.FeCl3→FeCl2D.Fe→Fe3O42、下列物质不能由单质与氯气直接反应制得的是()A. FeCl2B. NaClC. HClD. CuCl2(2)与水反应3Fe + 4H2O(g) Fe3O4 + 4 H2↑(置换)注意:铁在常温下不会和水发生反应,但在水和空气中O2和CO2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀)3、在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe 与水蒸气的反应实验”。
高一铁元素及其化合物知识点汇总

高一铁元素及其化合物知识点汇总铁是我们日常生活中常见的元素之一,它的化合物也有着广泛的应用。
下面将就高一铁元素及其化合物的相关知识点进行汇总。
1. 铁的基本性质铁是一种金属元素,具有蓝黑色的外观和良好的导电性和导热性。
它在常温下对空气有一定的活性,容易生锈。
铁的原子序数为26,原子量为55.85。
在元素周期表中,它位于第8族,第4周期。
2. 铁的同位素铁有多个同位素,其中最稳定的是铁-56,占自然界铁的约91.7%。
其他常见的同位素有铁-54、铁-57等。
3. 铁的化合价和阳离子形态铁可以形成两种常见的氧化态:+2和+3,分别对应亚铁离子(Fe2+)和铁离子(Fe3+)。
亚铁离子具有双电荷,它是一种淡绿色溶液,并且容易被氧气氧化生成铁离子。
4. 铁的常见化合物及其性质a. 氧化铁:氧化铁是铁与氧气反应生成的产物。
它有多种形态,包括FeO、Fe2O3和Fe3O4。
氧化铁在颜料、磁性材料等方面有广泛的应用。
b. 硫酸亚铁:化学式为FeSO4,是一种淡绿色固体,可以溶于水。
硫酸亚铁是一种重要的工业化学品,常用于农业中作为植物营养元素之一。
c. 硫酸铁:化学式为Fe2(SO4)3,是一种黄褐色固体,也可以溶于水。
硫酸铁常用于制备其他铁盐,如硫酸铁铵。
d. 氢氧化亚铁:化学式为Fe(OH)2,是一种淡绿色的沉淀。
它是一种较弱的碱性物质,可以中和酸,生成相应的盐。
e. 碳酸亚铁:化学式为FeCO3,是一种白色沉淀。
碳酸亚铁是一种较不稳定的化合物,在空气中很容易分解。
5. 铁的应用铁的应用非常广泛,从建筑结构到汽车制造,都离不开铁及其合金。
铁合金,如不锈钢、铸铁等,具有良好的强度和耐腐蚀性,广泛用于工业领域。
此外,铁还用于制造磁铁、电子产品、农业肥料等。
以上便是有关高一铁元素及其化合物的知识点的汇总。
通过了解铁的基本性质、化合价和常见化合物,我们可以更好地理解铁及其化合物在生活和工业中的应用。
同时,铁元素的研究和应用也是化学领域不可忽视的一部分。
铁及其化合物(知识点归纳总结+典例导析)
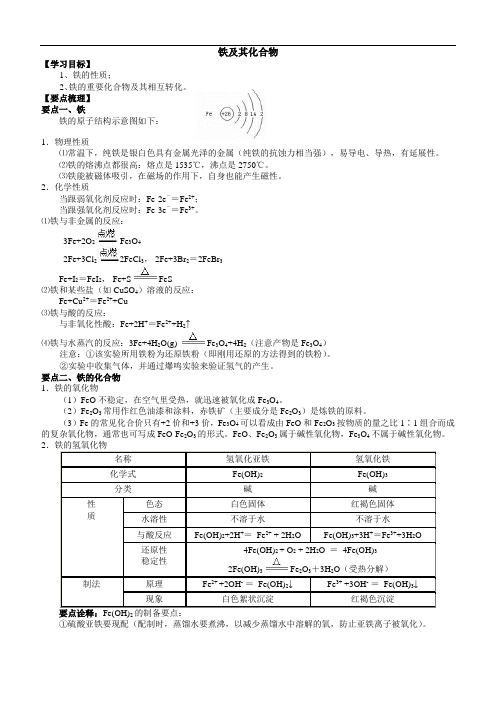
铁及其化合物【学习目标】1、铁的性质;2、铁的重要化合物及其相互转化。
【要点梳理】要点一、铁铁的原子结构示意图如下:1.物理性质⑴常温下,纯铁是银白色具有金属光泽的金属(纯铁的抗蚀力相当强),易导电、导热,有延展性。
⑵铁的熔沸点都很高:熔点是1535℃,沸点是2750℃。
⑶铁能被磁体吸引,在磁场的作用下,自身也能产生磁性。
2.化学性质当跟弱氧化剂反应时:Fe-2e-=Fe2+;当跟强氧化剂反应时:Fe-3e-=Fe3+。
⑴铁与非金属的反应:3Fe+2O2 Fe3O42Fe+3Cl22FeCl3, 2Fe+3Br2=2FeBr3Fe+I2=FeI2, Fe+S FeS⑵铁和某些盐(如CuSO4)溶液的反应:Fe+Cu2+=Fe2++Cu⑶铁与酸的反应:与非氧化性酸:Fe+2H+=Fe2++H2↑⑷铁与水蒸汽的反应:3Fe+4H2O(g) Fe3O4+4H2(注意产物是Fe3O4)注意:①该实验所用铁粉为还原铁粉(即刚用还原的方法得到的铁粉)。
②实验中收集气体,并通过爆鸣实验来验证氢气的产生。
要点二、铁的化合物1.铁的氧化物(1)FeO不稳定,在空气里受热,就迅速被氧化成Fe3O4。
(2)Fe2O3常用作红色油漆和涂料,赤铁矿(主要成分是Fe2O3)是炼铁的原料。
(3)Fe的常见化合价只有+2价和+3价,Fe3O4可以看成由FeO和Fe2O3按物质的量之比1∶1组合而成的复杂氧化物,通常也可写成FeO·Fe2O3的形式。
FeO、Fe2O3属于碱性氧化物,Fe3O4不属于碱性氧化物。
2.铁的氢氧化物名称氢氧化亚铁氢氧化铁化学式Fe(OH)2Fe(OH)3分类碱碱性质色态白色固体红褐色固体水溶性不溶于水不溶于水与酸反应Fe(OH)2+2H+=Fe2+ + 2H2O Fe(OH)3+3H+=Fe3++3H2O还原性稳定性4Fe(OH)2 + O2 + 2H2O =4Fe(OH)32Fe(OH)3Fe2O3+3H2O(受热分解)制法原理Fe2+ +2OH-=Fe(OH)2↓Fe3+ +3OH-=Fe(OH)3↓现象白色絮状沉淀红褐色沉淀2①硫酸亚铁要现配(配制时,蒸馏水要煮沸,以减少蒸馏水中溶解的氧,防止亚铁离子被氧化)。
铁及其化合物 高一基础知识复习

铁及其化合物【知识点一】铁1、铁在元素周期表中的位置:周期族。
2、单质铁的物理性质:。
3、单质铁的化学性质(1)铁与非金属的反应:①在氧气中燃烧:(现象:)②在氯气中燃烧:______________________________(现象:)③与硫粉混合加热_____________________________________________________(2)铁与水蒸气反应:(3)与非氧化性酸反应:Fe+2HCl=(4)与某些盐溶液反应: Fe+CuSO4=(5)与强氧化性酸的反应:常温下铝、铁遇浓硫酸或浓硝酸。
加热能反应但无氢气放出。
写出铁与稀硝酸反应的化学方程式:①少量铁粉溶于稀硝酸②过量铁粉溶于稀硝酸【知识点二】铁的重要化合物1、铁的氧化物2、铁的氢氧化物注意:Fe(OH)2在空气中极易被,实验制得的Fe(OH)2 色沉淀在空气中会迅速变为色,最后变为色。
所以实验室制取Fe(OH)2时,要用新制的Fe2+,并尽量避免与接触。
(思考一下可以采取哪些措施避免Fe(OH)2被氧化)①⑤③④⑥②下列各图示中________能较长时间看到Fe(OH)2白色沉淀。
3、Fe2+和Fe3+的性质离子Fe2+Fe3+溶液中的颜色主要化学性质Fe2++ Cl2—Fe3++ Fe —常用检验方法保存方法加铁粉防止加相应的酸防止水解【知识点三】含铁化合物间的相互转化(“铁三角”关系)Fe Fe2+Fe3+写出相应的离子方程式:①Fe→Fe2+:与弱氧化剂反应,如S、I2、H+、Cu2+、Fe3+等,;;②Fe2+✂Fe3+:与强氧化剂反应,如O2、Cl2、H2O2、HNO3、KMnO4等。
;。
③Fe✂Fe3+:与强氧化剂反应,如Cl2、Br2、HNO3、浓H2SO4等。
;。
④Fe3+✂Fe2+:与较强的还原剂反应,如I-、H2S、S 2-、Fe、Cu、SO2等。
;。
⑤Fe2+✂Fe:与强的还原剂反应,如Zn、H2等。
知识清单06铁及其重要化合物2025年高考化学一轮复习知识清单(新高考专用)

知识清单06 铁及其重要化合物知识点01 单质铁的结构和性质1.铁的原子结构(1)周期表中位置:第4周期第Ⅷ族(2)微粒结构示意图(3)电子排布式:1s 22s 22p 63s 23p 63d 64s 2(4)价层电子排布式:3d 64s 2(5)电子运动状态:26(6)空间运动状态:12①最高能级电子数6②最高能层电子数2③未成对电子数4④稳定性:Fe 2+<Fe 3+2.铁元素的存在游离态存在于陨铁中黄铁矿FeS 2赤铁矿Fe 2O3磁铁矿Fe 3O 4褐铁矿_2Fe 2O 3·3H 2O_自然界菱铁矿_FeCO 3铁单质铁锅的主要成分亚铁盐补铁保健品三氧化二铁粉剔红墙的涂料化合态社会生活四氧化三铁激光打印机的墨粉3.铁的物理性质(1)颜色:纯铁呈银白色,常见的铁呈灰黑色(2)熔、沸点高,抗腐蚀性强,具有金属的通性。
(3)特性:能够被磁铁吸引,可用于分离提纯4.铁的化学性质(1)与弱氧化剂反应:Fe ---------------------→S 、I 2、H +、Cu 2+Fe 2+①Fe+S FeS②Fe+I 2FeI 2③Fe+H + = Fe 2++H 2↑④Fe+Cu 2+= Fe 2++Cu(2)与强氧化剂反应:Fe -----------------------------------------→Cl 2、Br 2、浓硫(硝)酸、稀硝酸Fe 3+①Fe ---------→Cl 2点燃FeCl 3,生成棕红色烟②Fe ----------→浓硫酸常温钝化;Fe ----------→浓硫酸加热Fe 3+或Fe 2+③Fe ----------→浓硝酸常温钝化;Fe ----------→浓硝酸加热Fe 3+或Fe 2+④Fe -----------→稀硝酸过量Fe 2+;Fe -----------→稀硝酸少量Fe 3+(3)生成Fe 3O 4的反应①O 2:3Fe+2O 2Fe 3O 4②水蒸气:3Fe+4H 2O (g )Fe 3O 4+4H 25.铁单质的制备方法①工业上利用铁矿石在高炉中炼铁,以赤铁矿为例写出该反应的化学方程式_Fe 2O 3+3CO =====高温2Fe +3CO 2__。
铁及其化合物知识点总结
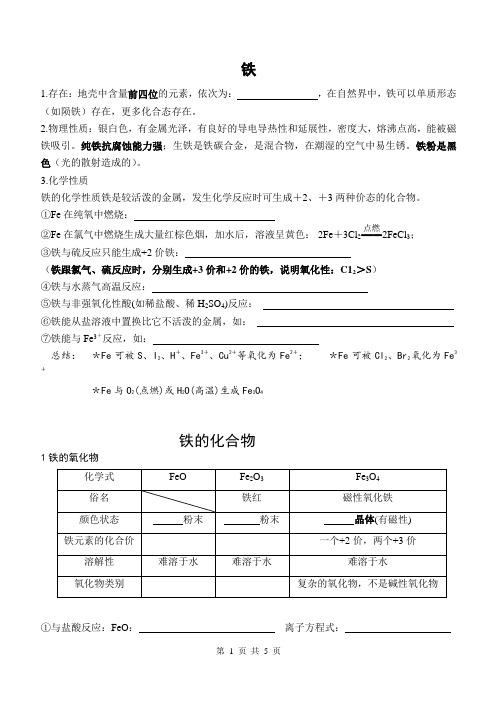
铁1.存在:地壳中含量前四位的元素,依次为: ,在自然界中,铁可以单质形态(如陨铁)存在,更多化合态存在。
2.物理性质:银白色,有金属光泽,有良好的导电导热性和延展性,密度大,熔沸点高,能被磁铁吸引。
纯铁抗腐蚀能力强;生铁是铁碳合金,是混合物,在潮湿的空气中易生锈。
铁粉是黑色(光的散射造成的)。
3.化学性质铁的化学性质铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。
①Fe 在纯氧中燃烧:②Fe 在氯气中燃烧生成大量红棕色烟,加水后,溶液呈黄色: 2Fe +3Cl 2=====点燃2FeCl 3; ③铁与硫反应只能生成+2价铁: (铁跟氯气、硫反应时,分别生成+3价和+2价的铁,说明氧化性:C12>S ) ④铁与水蒸气高温反应:⑤铁与非强氧化性酸(如稀盐酸、稀H 2SO 4)反应: ⑥铁能从盐溶液中置换比它不活泼的金属,如: ⑦铁能与Fe 3+反应,如:总结: *Fe 可被S 、I 2、H +、Fe 3+、Cu 2+等氧化为Fe 2+; *Fe 可被Cl 2、Br 2氧化为Fe3+*Fe 与O 2(点燃)或H 2O(高温)生成Fe 3O 4铁的化合物1铁的氧化物①与盐酸反应:FeO : 离子方程式:Fe2O3:离子方程式:Fe3O4:离子方程式:②被CO还原:FeO :Fe2O3:Fe3O4:2.铁的氢氧化物3.铁盐(1)Fe3+只有氧化性,溶液为黄色;Fe2+既有氧化性,又有还原性,主要表现还原性,溶液为浅绿色。
(2)Fe3+的检验的最佳方法:取少量待测液于试管中,滴加溶液,溶液呈血红色,则证明溶液中含Fe3+;对应的离子方程式:(3)Fe2+的检验方法:①沉淀法:取少量待测液于试管中,滴加,产生,则证明溶液中含Fe2+②颜色法:取少量待测液于试管中,先滴加溶液,无变化,再滴加,溶液显血红色,则证明溶液中含Fe2+。
③取少量待测液于试管中,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,则证明溶液中含Fe2+;3Fe2++ 2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(4)含Fe2+、Fe3+的混合溶液中分别检验Fe3+、Fe2+的存在4.铁三角转化及应用Fe→Fe2+:①Fe+I2:②Fe+Fe3+:Fe2+→Fe3+:①FeCl2 + Cl2:Fe→Fe3+:①Fe + C12:Fe3+→Fe2+:①Fe3++Fe:②Fe3++Cu:③Fe3++2I-:Fe2+→Fe:①Fe2++Zn:②FeO+H2:Fe3+→Fe:Fe2O3+CO:2制备原理:Fe2++2OH-===Fe(OH)2↓。
高考化学:铁及其化合物知识点汇总

高考化学:铁及其化合物知识点汇总01铁及其化合物一、铁的结构1. 铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:主要化合价:+2,+32. 铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
二、化学性质1. 与非金属反应:2. 与水反应:3. 与酸反应1)与非氧化性酸反应:2)与氧化性酸反应①常温下,铁在冷浓硫酸,浓硝酸中发生钝化②与浓硫酸反应:4. 与盐反应:,,三、铁的化合物1. 铁的氧化物2. 铁的氢氧化物(1)的制备易被氧化,在制备时应注意:①晶体中不能有;②配制后的溶液中要加入少量铁粉;③配制溶液的蒸馏水以及所用NaOH溶液均须煮沸以除去其中溶解的氧气。
实验:溶液中加NaOHa. 现象:生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色b. 为了防止滴加NaOH时带入空气,可将吸收NaOH的长滴管伸入溶液液面下,再挤出NaOH溶液。
c. 为了防止被氧化,还可以向盛有溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气。
化学方程式:(2)胶体的制备向加热沸腾的蒸馏水中加入溶液,待出现红褐色时,停止加热,便可得到胶体。
制备时要注意:①不可长时间加热,因为加热会使胶体凝聚;②不能用自来水,因为自来水中的电解质也可使胶体凝聚。
3. 铁的两种氢氧化物的比较四、铁盐和亚铁盐1. 、的检验:(1)的检验:①盐溶液中滴加KSCN溶液。
现象是溶液变红色,反应方程式:②向盐溶液中滴加NaOH溶液,现象是产生红褐色沉淀,反应方程式:(2)的检验:A. 向盐溶液中滴加KSCN溶液,再滴加氯水(硝酸、等)。
现象是先无现象,加氯水后溶液呈红色,反应方程式:B. 向盐溶液中滴加NaOH溶液,现象是产生白色沉淀迅速转变为灰绿色,最后变成红褐色沉淀,反应方程式:2. 的氧化性、的还原性(1)的氧化性:向溶液中加入铁粉,现象是溶液由棕黄色变为浅绿色对应离子方程式:还可以与HI、发生(2)的还原性:在较强的氧化剂的作用下会被氧化为向溶液中通入氯气,现象是溶液由浅绿色变为棕黄色对应离子方程式:除杂:滴加氯水,加入铁粉3. 亚铁盐、铁盐溶液的保存(1)、等亚铁盐溶液保存时,要加入少量铁屑(防止被氧化)和滴入少量相应的酸溶液 ( 抑制水解) 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《铁及其化合物》知识点总结归纳
【复习指导】
本部分内容为教材的第二自然节。
其主要考点是:
①铁的原子结构、位置和性质;
②铁的氧化物、氢氧化物的制备;
③Fe3+与Fe2+的相互转化及应用;
④Fe2+、Fe3+的检验;
⑤铜及其化合物的重要性质。
复习本部分内容时,在引导学生阅读理解“知识网络”的基础上,重点讲清:
1.根据铁在元素周期表中的位置和原子结构,指出铁是一种较活泼的过渡金属,有可变的化合价,指出铁三角关系,Fe、Fe3+、Fe2+三者之间相互转化规律,铁与哪些物质反应能生成+2价化合物?跟哪些物质反应能生成+3价铁的化合物?Fe2+和Fe3+通过哪些物质可以相互转化?并能让学生会写相关的化学方程式或离子方程式。
2.根据铁在金属活动顺序表中的位置,指出铁是一种活泼金属,由此属类理解铁能与非金属、水蒸气、酸、盐溶液的反应,写出有关的化学方程式或离子方程式。
分析判断铁的氧化物、氢氧化物的属类,推测应具有的性质写出有关的化学方程式或离子方程式。
从Fe2+的还原性、Fe2+和Fe3+易水解等知识角度理解亚铁盐和铁盐溶液的配制及保存方法。
结合离子的鉴别方法。
3.铜元素的有关知识在近几年来的高考
Fe2+和Fe3+的特性让学生掌握两种试题中经常涉及到,特别是2019年各类高考试题中,多次出现与铜有关的试题,而这部分内容却分散在初中高中四本教材中,复习时按照元素化合物知识规律,将铜及其化合物知识进行归纳总结,使之系统化。
