2021春科学版九年级化学下册课件 第7章 7.3.1 溶质的质量分数及其简单计算
【实用】九级化学下册课题溶质的质量分数ppt资料

⑵向100g该溶液中加入200g水,所得溶液的溶质质量分数 (2)10g此温度下的饱和溶液里溶质的质量分数
向10g硝酸钾不饱和溶液中加入10g硝酸钾固体
为______%(精确到0.
溶液中溶质质量的多少如何表示呢?
150kg×16%=24kg 需水的质量为:150kg-24kg= 126kg 答:配制150kg16%的氯化钠溶液,需要氯化钠24kg,需 要水126kg。
溶质的质量分数
人民教育出版社九年级下册第九单元第三课
讨
论
溶质质量分数与溶解度的区别
例:溶质的质量分数36%是指:100g溶液中含有36g溶质 溶质T℃时溶解度36g是指: 在T℃时,100g水最多溶解 该溶质36g。
九级化学下册课题溶质的质量分数PPT
溶质的质量分数
喷洒药水
人民教育出版社九年级下册第九单元第三课
飞机喷洒农药
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害 农作物或树木.
溶质的质量分数
人民教育出版社九年级下册第九单元第三课
是浓还是 稀?
溶液中溶质质量的多少如何表示呢?
溶质的质量分数
人民教育出版社九年级下册第九单元第三课
溶质的质量分数
我会做
人民教育出版社九年级下册第九单元第三课
已知50g氯化钠溶液中含5g氯化钠,计算该溶液中氯化钠
的质量分数。
解:该溶液中氯化钠的质量分数
=
5g 100%
=10% 50g
答:该溶液中氯化钠的质量分数为10%
溶质的质量分数
我会做
人民教育出版社九年级下册第九单元第三课
第1课时 溶质的质量分数 九年级化学下册课件(人教版)

当堂训练
4.(2021·罗湖区校级模拟)将80 g质量分数为20%的浓盐酸,
稀释成10%的稀盐酸,需加水的质量为 ( A )
A. 80 g
B. 100 g
C. 200 g
D. 280 g
当堂训练
5. (2021秋·高青县期中)对“20%的蔗糖溶液”含义的理解错误 的是 ( C ) A. 20 g蔗糖溶于水配成100 g溶液 B. 40 g水中溶解了10 g蔗糖 C. 将蔗糖和水按照1∶9质量比配成的溶液 D. 溶质和溶液的质量比为1∶5
水的质量 =溶液质量-溶质的质量 =150Kg-24Kg =126Kg
答:需要24Kg氯化钠和126Kg水。
交流与讨论 已知200C时,氯化钠的溶解度是36g。有人说:“200C时氯化钠 饱和溶液中溶质的质量分数为36%”这种说法对吗?为什么?
不对,质量分数= 36g × 100% =26.5% 100g+36g
单击此处输入你的正文,文字是您思想的提炼,为了最终演示发布的良好效果,请尽量言简意赅的阐述观点。单击此 处输入你的正文,文字是您思想的提炼
请添加标题 实验 9 – 7 配制三种浓稀不 同的硫酸铜溶液
添加小标题
单击此处输入你的正文,文字是您思想的提炼,为了最终演示发布的良好效果。
请添加标题
烧杯编号 溶液颜色比较 溶剂质量/g
例题3
化学实验室现在有98% 的浓硫酸,但在实验中 常需要用较稀的硫酸溶 液。要把50g质量分数 为98%的浓硫酸稀释为 质量分数为20%的硫酸 溶液,需要多少克水?
溶液稀释前后,溶质的质量不变。 稀释公式:m浓×c浓% = m稀×c稀%
=(m浓+m水)×c稀%
法一:
解:设稀释后溶液的质量为x 100g ×98% = x ×20% x = 245g
2021春科学版九年级化学下册课件 第7章 7.3.3 溶质质量分数的综合计算

科学版九年级下第七章溶液课题3溶液浓稀的表示第3课时溶质质量分数的综合计算提示:点击进入讲评答案呈现67123451.【中考·西宁】小红同学将未知浓度的过氧化氢溶液34 g,加入盛有0.5 g二氧化锰的烧杯中,待完全反应后,称得烧杯中剩余物质的质量为33.7 g。
计算该过氧化氢溶液中溶质的质量分数。
2.【2020·河北】某小组用粗锌测定某稀硫酸中溶质的质量分数。
取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。
请计算:(1)生成氢气的总质量为____0_.2___g。
(2)稀硫酸中溶质的质量分数。
3.【中考·岳阳】现有一含NaCl杂质的Na CO样品,23取13.9 g样品溶于水,配成104.4 g溶液。
此溶液与100 g某浓度的盐酸恰好完全反应,得到200 g溶液。
请计算:(1)生成二氧化碳的质量为___4_._4___g。
(2)所得溶液中NaCl的质量分数(写出计算步骤)。
【点拨】(1)根据质量守恒定律可知,生成二氧化碳的质量为104.4 g+100 g-200 g=4.4 g。
(2)根据碳酸钠与稀盐酸反应的化学方程式,由生成二氧化碳的质量可以计算出样品中碳酸钠的质量及生成的氯化钠的质量,溶液中氯化钠的质量为生成的氯化钠与样品中氯化钠的质量和,根据溶质质量分数的计算公式,可以计算所得溶液中氯化钠的质量分数。
4.【中考·宜昌】实验室常用石灰石和稀盐酸制取二氧化碳,现取含碳酸钙80%的石灰石12.5 g和94.4 g稀盐酸恰好完全反应(石灰石中的杂质不溶于水,也不与稀盐酸反应)。
求:(1)生成二氧化碳的质量。
(2)恰好完全反应后所得溶液中溶质的质量分数。
5.【中考·孝感】向盛有一定质量稀硫酸的烧杯中逐渐加入10 g 锌粒,产生气体质量与锌粒质量的关系如图所示。
充分反应后,称得烧杯中剩余物质总质量为109.8 g。
九年级化学下册_课题3溶质的质量分数课件_人教新课标版

10%
33.3%
50
100
• [思考题]
• 1.进行如下两个实验: • 实验1:称取10g白糖倒入一烧杯中,加入40g 水,搅拌,使白糖全部溶解。 • 实验2:称取12g白糖于另一烧杯中,加入48g 水,搅拌,使白糖全部溶解。 • 问题:实验1、2所得两份糖水,谁更甜? • 你的依据是什么?
已知溶液质量和溶质的质量分数,求溶质和溶剂 的质量。
解:设
一、溶质的质量分数 1、概念:溶质质量与溶液质量之比。 2、计算公式: 溶质质量 100% 溶质的质量分数
溶液质量 溶质质量
课题3
溶质的质量分数
溶质质量+溶剂质量 t℃时,某物质的溶解度为Sg,则t℃,该物质饱和溶液中 Sg 100% 溶质的质量分数 Sg +100g
100%
3、配制溶质质量分数一定的溶液
用A、B两个烧杯各取90克溶质的质量分数为10%的 硝酸钾溶液,再向A烧杯中加入10 g硝酸钾,向B 烧杯中加入10 g水,并用玻璃棒搅拌至全部溶解 。 [讨论]: 1.原溶液中溶质的质量是多少? 溶液的质量是多 少? 溶剂的质量是多少? 2.向原溶液中增加10克硝酸钾(全部溶解)或增加10 克水后,溶液中溶质质量、溶剂质量、溶液质量 各是多少? 3.上述形成的两种溶液中溶质的质量分数各是多少?
课题3
第一课时
• 比较三种CuSO4溶液的颜色。 • 在这三支试管中溶液的组成是否相同? • 判断溶液浓稀的根据是什么?
100mL中有 某物质多少 毫克(多见 于各种饮料)
酱油中某物质含 量6mg/100mL (见商标)
某物质含 量为X%
溶质的质量分数:表示溶液组成的一种方法 定义:溶质质量与溶液质量之比
2021春科学版九年级化学下册课件 第7章 7.3.1 溶质的质量分数及其简单计算

(2)为了对某车站候车室消毒,要配制一桶(15 kg)含 H2O2 2%的双氧水,需工业用双氧水(含H2O2 30%) ____1____kg。
(3)请你写出另一种防止新冠肺炎传播的有效方法 ___戴__口__罩__(_合__理__均__可__) ___。
【点拨】(1)根据题目信息,可知NaClO和HCl混合之后 会产生Cl2和两种常见化合物,根据质量守恒定律可知这 两种化合物是H2O、NaCl,据此书写化学方程式。(2)设 需用工业双氧水的质量为x,则有15 kg×2%=x×30%, 可解得x=1 kg。( 3 )预防新冠肺炎,除了对公共场所进 行杀菌消毒,也应从个人卫生习惯上预防,有效方法有: 勤洗手、戴口罩、多运动等。
【点拨】(1)10 ℃时,KNO3 的溶解度为 20.9 g,则 10 ℃ 时,100 g 水中最多可溶解 20.9 g KNO3;(2)20 ℃时 KNO3 的溶解度为 31.6 g,则 40 g 水中最多可溶解 12.64 g KNO3, 因此 20 ℃时 10 g KNO3 能完全溶于 40 g 水中,所得溶液 溶质质量分数为1500 gg×100%=20%。
(4)若使上述溶液中溶质的质量分数变为20%,则应加 入硝酸钠____1_0___g,或蒸发掉____4_0___g水。
(5)若使上述溶液中溶质的质量分数变为5%,则应加 水____8_0___g。
13.下列条件下的氢氧化钙溶液,溶质的质量分数最大的是
(A)
A.20 ℃时的饱和溶液
B.40 ℃时的饱和溶液
2.从100 g 10%的氢氧化钠溶液中取出10 g溶液,则
剩余溶液中溶质的质量分数为( A )
A.10%
B.9%
C.1%
D.11%
2021春科学版九年级化学下册课件 第7章 7.3.2 配制一定溶质质量分数的溶液

7.【中考·辽阳】在“一定溶质质量分数的氯化钠溶 液的配制”实验活动中,可能导致氯化钠溶液溶 质质量分数偏大的是( D ) A.量取水时量筒内事先有少量水 B.所用氯化钠固体不纯 C.称量时砝码和药品的位置放反 D.将量筒中的水倒入烧杯时有水溅出
8.【中考·滨州】某同学选用氢氧化钠固体与水配制20 g溶质质量
9.【中考·内江】实验室欲配制50 g溶质质量分数为15%的 氯化钠溶液,下列有关叙述正确的是( C ) A.配制该溶液的步骤是称量和溶解 B.配制过程中用到的仪器只有天平、烧杯和玻璃棒 C.溶解氯化钠固体时,玻璃棒的作用是加快溶解速率 D.转移溶液时,用蒸馏水洗涤烧杯2~3次,将洗涤液 一并倒入试剂瓶
(3)经检测,该同学配制的溶液溶质 质量分数偏小,可能的原因是 _称__量__N_a_C_l_时__,__砝__码__和__药__品__的__位__置__放__反__了__(_或__量__取__水__时__仰__视__量___ _筒__读__数__或__溶__解__固__体__的__烧__杯__不__干__燥__,__内__壁__有__水__等__)__。
第七章 溶液
课题3 溶液浓稀的表示 第2课时
配制一定溶质质量分数的溶液
提示:点击 进入讲评
1A 2A 3A 4D 5C
6 7D 8B 9C 10 B
答案呈现
11 12
1.【2020·德州】用氯化钠固体配制一定溶质质量分 数的氯化钠溶液,下列仪器中不需要的是( A )
【点拨】用氯化钠固体配制一定溶质质量分数的氯化钠 溶液的步骤是计算、称量、量取、溶解。据此可知,要 用到的仪器有托盘天平、药匙、量筒、胶头滴管、烧杯、 玻璃棒。不需用到的是漏斗。
10.【中考·无锡】泡菜具有独特的风味,适合制作泡菜的 食盐水浓度是4%。在配制4%的食盐水时,下列会导 致溶液浓度偏小的是( B ) ①称量好的食盐倒入烧杯时,有少许撒出 ②量取水 的体积时,俯视量筒 ③溶解食盐的烧杯内壁是潮湿 的 ④用4 g食盐和100 g水配制溶液 A.②③ B.①③④ C.①②③ D.①②③④
新人教版九年级化学下册:溶质的质量分数课件

= 150kg×16%=24kg
溶剂质量=溶液质量-溶质质量 = 150kg-24kg=126kg 答:配150kg质量分数为16%的氯化钠溶液需24kg 氯化钠和126kg的水。
9
溶质的质量分数
二、配制溶质质量分数一定的溶液
1、步骤:计算,称量,溶解,装瓶,贴标签
2、仪器: 称 量
称:托盘天平,药匙 量:量筒,胶头滴管
溶质质量 溶剂(水)质量/g 溶液中溶质的质量分数 10% 10 90 20 80 20%
7
溶质的质量分数
想一想:已知溶质和溶
剂的量,这样的溶液我们 会配制了。那么如果告诉 你一定量的一定溶质质量 分数的溶液,你会配制吗?
8
溶质的质量分数
【例题1】在农业生产上,常需要用质量分数为16%的 氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化 钠和水的质量各是多少? 溶质质量 ×100% 【解】 溶质的质量分数= 溶液质量 溶质质量= 溶液质量×溶质的质量分数
溶液质量
×100%
5
溶质的质量分数
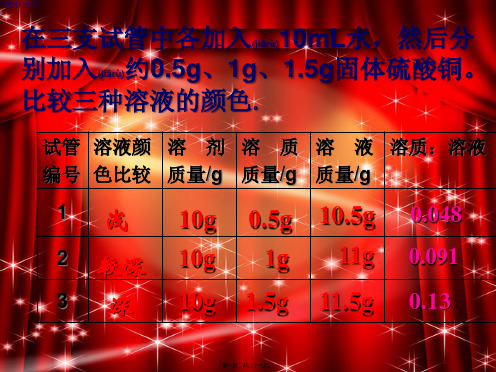
按下表所定的量配制氯化钠溶液?
试管 编号 溶液颜 溶剂质 溶质质 溶液质 溶质的 色比较 量/g 量/g 量/ 质量分数
1 2
3
浅 较深
深
10 10
10
0.5 1.0
1.5
10.5 11.0
11.5
4.8% 9.1% 13.0%
6
溶质的质量分数
按下表所定的量配制氯化钠溶液?
10
10
11.0
11.5
对于有色溶液来说,根据颜色的深浅可以区 分溶液是浓还是稀。但这种方法比较粗略,不能 准确地表明一定量的溶液里究竟含有多少溶质。
九年级化学下册 第九单元《溶质的质量分数》课件
用“挖水法”和“整体(zhěngtǐ)法”求生成物溶液 的质量
第二十五页,共三十六页。
62021/12/3
用量筒量取所需的水的体积,倒入盛有NaCl 的烧杯中
3、溶解:用玻璃棒搅拌烧杯中的溶液,使NaCl溶解
4、把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(标签上应包括药品名称和溶液中溶质的质量分数)
第十页,共三十六页。
2021/12/3
用固体配制一定(yīdìng)溶质质量分数的溶液
主要(zhǔyào)仪器托:盘(tuōpán)天平、烧杯、量筒、玻璃棒
解:设需要98%硫酸(liú suān)的体积为V
V1.84g/mL 98% = 98g 10%
98g10%
V=
5.4mL
1.84g/mL98%
答:需98%硫酸(liú suān)5.4mL
第十九页,共三十六页。
02021/12/3
小试牛刀 : (xiǎo shì niú dāo)
1、配制100mL密度(mìdù)为1.1g/mL的20%的NaCl溶液 需要多少克NaCl和多少mL水?
的氯化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各多少?
解:所需氯化钠的质量(zhìliàng)为:
150kg 16% = 24kg
需要(xūyào)水的质量为:150kg - 24kg = 126kg
答:配150kg质量分数为16%的氯化钠溶液 需24kg 氯化钠和126kg水
(科粤版)九年级化学下册:7.3.1 溶质的质量分数及其简单计算 课件(共33张PPT)

80
溶液质量/g 溶质质量分数
200
5%
100
4%
150
16%
100
20%
质量分数与溶解度的区别与联系: 溶解度
溶质质量分数
条件
在一定的温度下
溶剂量要求
100g
溶液是否饱和 一定达到饱和
单位
克(g)
不受外界条件的影响 无要求 不一定
是一个比值,单位为1
有关溶解度与溶质质量分数的相互转化:
例1.在20ºC时,CuSO4的溶解度为25g,求20ºC时CuSO4饱和 溶液溶质的质量分数。
2.有关溶液稀释的计算 计算依据:稀释前后__溶__质____的质量不变。
例3.配制铅蓄电池用的28%硫酸溶液460g,问需要 98%的浓硫酸的体积是多少?已知98%浓硫酸的密度 为1.84g/cm3
解:设需要98%的浓硫酸的质量为X。
460g × 28%= X × 98% X= 460g × 28% =131.948g%
【实验7-7】 1.在三支试管A、B、C中分别加入10ml水,再分别加入0.5g、 1g和1.5g硫酸铜溶液,试猜测三支试管中溶液颜色的深浅顺 序是 C>B>A 。
0.5gCuSO41gCuSO41.5 NhomakorabeaCuSO4
A
B
C
观察并比较三支试管中溶液颜色的深浅顺序是 C>B>A 。
2.在三支试管D、E、F中分别加入20ml、10ml、5ml水,再分 别加入2g、0.5g、1g硫酸铜溶液,试猜测三支试管中溶液颜 色的深浅顺序是 F>D>E ;你的依据是溶质与溶剂的质量比。 观察并比较三支试管中溶液颜色的深浅顺序是 F>D>E 。
九年级化学下册第七章溶质质量分数课件

浓 98% m
V = 10 g/1.84g/mL=5.43mL
稀 10% 98g
m水 = 98g-10g=88g
答:略。
13
01 基 础 题 考点 1 溶质质量分数 1.对于“10%的食盐溶液”的含义解释不正确的是( A ) A.100 g 水中溶解了 10 g 食盐 B.食盐溶液中溶质和溶剂的质量比是 1∶9 C.将 10 g 食盐溶解于 90 g 水中得到的溶液 D.100 g 食盐溶液中溶有 10 g 食盐
第二步 称量和量取:用_托__盘__天__平___称量所需的氯化钠质量, 倒入烧杯中。用_____量量筒取所需水的水,倒入盛有 氯化钠的烧杯中。
实验步骤
第三步 溶解:将量筒里的水注入盛有氯化钠的烧杯里, 并用_玻__璃__棒_搅拌,使氯化钠充分溶解。
实验步骤
第四步 装瓶:配好后的溶液装入试剂瓶中,盖好瓶 塞并贴上标签,放入试剂柜中。标签向外
3.误差分析:
(2)质量分数偏高的因素
①溶解时水洒出一些 ②用俯视方法量取水。 ③砝码生锈
有一种过氧乙酸消毒液,广泛用于室内外进行 消毒。现要配制10kg0.4%的过氧乙酸消毒液,请计 算需用含过氧乙酸40%的市售原液的质量是多少? 所需稀释用水的质量为多少?
四、用浓溶液配制一定浓度的稀溶液 1.步骤: ①计算;②量取;
溶质的质量分数=
溶质质量 溶液质量
×100%
类型四:方程式与溶质质量分数的综合计算 4、 32.5g锌粉与245g稀硫酸溶液恰好完全反应,求:
(1)生成氢气的质量
H2SO4 H2O
(2)所用硫酸的溶质质量分数
(3)最后所得溶液的溶质质量分数
Zn+H2SO4=ZnSO4+H2↑ 注意:溶液是混合物,必须换算成溶质的质量才能代入
九年级化学下册 课题3 溶质的质量分数教学课件

Zn + H2SO4 == ZnSO4 + H2 ↑
65 98
161
2
6.5g y
z
x
65
y=69..5g8g
98
161
yz=16.1gz
(1)生成氢气的质量为0.2g。
2
x=x 0.2g
2021/12/11
第十七页,共二十页。
(2)所用稀硫酸中溶质质量分数为
H2SO4%=
9.8g×100%= 9.8%
钠溶液所需氯化钠和水的质量
氯化钠: 50g × 6% = 3g
水:
50g - 3g =47g
2、用托盘(tuōpán)天平称量氯化钠的质量 (水的密度为1g/cm3,计算出水的体积,
用量筒量取水的体积)
3、溶解 烧杯、玻璃棒
4、装瓶贴签
2021/12/11
第十三页,共二十页。
计算 称量 (或量取)溶解 一般(yībān)步骤:
再见
(zàijiàn)
2021/12/11
第十九页,共二十页。
内容(nèiróng)总结
课题3、溶质的质量分数。S=(m质/ m剂)×100克。三.溶解度与溶质的质量分数的比较。公式能解决的问题 (wèntí):已知溶质和溶剂的质量,求溶解度。思考:(1)某KNO3溶液的溶质的质量分数20%。例1、20g食盐溶液中含有 2g食盐,求:溶质的质量分数。例5、20g 10%的盐水中倒出一半,求:溶质的质量分数。要把50g质量分数为98%的
质的质量(zhìliàng)分数。
(20g×10%)
20g+2g
=9.1%
例4、20g 10%的盐水中放入 2g食盐,
求:溶质的质量(zhìliàng)分数。
2021年九年级化学下册第1课时 溶质的质量分数课件

和溶剂的质量。
练习 下列几种硝酸钾溶液中溶质的质
量分数最大的是( D )
A.150g水溶解30g硝酸钾; A.1503g0g30g 100%
B.15g硝酸钾溶解在85g水中;
B.
15
15g g 85
(2)饱和溶液变为不饱和溶液,溶质的质量分数 不一定变小,不饱和溶液变为饱和溶液,溶 质的质量分数不一定变大。
练习 有100g10%的盐酸溶液,要使其溶质质量 分数增大一倍,应采取的方法是( C ) ×A.把溶液的量倒掉一半 不变 ×B.溶质的质量增大一倍 不到一倍 C√.将100g10%的盐酸与200g25%的盐酸混合 ×D.蒸发掉溶剂的质量是原溶液质量的一半
100%
课堂教学展示.已知溶质、溶剂的质量,求溶质的质量分数。
2.已知溶液的质量分数和溶液的质量,求溶质、
溶剂的质量。
3.一定温度下的饱和溶液中:
溶质的质量分数
溶解度 100g 溶解度
100%
课后反馈总结 课后作业
1.从课后习题中选取; 2.完成练习册本课时的习题。
2.某温度时,蒸干35 g氯化钾溶液,得到7 g氯化 钾,求该溶液中溶质的质量分数。
解:该溶液中溶质的质量分数= 7g 100%=20%
35g
7.某食品加工厂生产的酱油中氯化钠的质量分数为 15%~18%,该厂日产酱油15 t。试计算该厂每月 (按30天计)消耗氯化钠的质量。 解:15t×30×15%=67.5t, 15t×30×18%=81t。 故该厂每月消耗67.5t~81t氯化钠。
g
100%
C.85g硝酸钾溶液中含有15g硝酸钾;C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章溶液课题3溶液浓稀的表示
第1课时
溶质的质量分数及其简单计算
提示:点击进入讲评答案呈现628.6%11B 16171A
2D A 7D 8C 912
13
3B 4
A 14D 5D 10
B 15
C
1.【中考·江西】下列关于“10%的硝酸钾溶液”含义的说法中,错误的是(ꢀꢀ)A
A.100 g水中溶解了10 g硝酸钾
B.100 g硝酸钾溶液中有10 g硝酸钾
C.将10 g硝酸钾溶于90 g水中所得的溶液
D.将硝酸钾与水按1∶9的质量比配制的溶液
2.从100 g 10%的氢氧化钠溶液中取出10 g溶液,则剩余溶液中溶质的质量分数为(ꢀꢀ)A
A.10% C.1%B.9% D.11%
3.常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为(ꢀꢀ)B
A.15% C.25%B.20% D.33.3%
4.【中考·海南】为防控非洲猪瘟,海南省防疫部门使用二氯异氰脲酸钠(化学式为C Cl N O Na)杀菌消毒。
请计算(直接
3233
写出结果即可):
(1)二氯异氰脲酸钠中氯元素和氧元素的质量比为__7_1_:_4_8_。
ꢀ
(2)现配制溶质的质量分数为0.1%的二氯异氰脲酸钠溶液5
000 g,需要二氯异氰脲酸钠的质量是多少?
需要二氯异氰脲酸钠的质量为5 000 g×0.1%=5 g。
答:需要二氯异氰脲酸钠的质量是5 g。
5.【中考·广州】某温度时,将20 g KNO3溶解在100 g水中恰好饱和,下列关于该饱和溶液的叙述正确的是(ꢀꢀ)D A.m∶m=20∶120
(溶质)(溶剂)
B.溶质的质量分数为20%
C.升温后,溶质的质量分数增大
D.降温后,有固体析出
6.【中考·德州】已知氯化钾在40 ℃时的溶解度为
40 g,则该温度下氯化钾饱和溶液的溶质质量分
数是__2_8_.6_%___(计算结果精确至0.1%)。
7.【中考·重庆】甲、乙的溶解度曲线如图所示(不考虑水的变化)。
下列说法正确的是(ꢀDꢀ)
A.根据溶解度曲线可判断,甲的溶解度比乙的大
B.t2 ℃时,甲的饱和溶液中溶质质量分数为40%
C.t2 ℃时,将甲、乙饱和溶液分
℃,析出甲的质量大
别降温至t
1
D.t1 ℃时,将甲、乙饱和溶液分
℃,两溶液中溶质质量分数相等
别升温至t
2
8.【中考·衡阳】将80 g溶质质量分数为35%的浓盐酸稀释成10%的稀盐酸,需加水的质量为(ꢀꢀ)C
A.80 g B.100 g C.200 g D.280 g
【点拨】根据稀释前后溶质的质量不变进行
计算。
设需加水的质量为x,则80 g×35%=
(80 g+x)×10%,解得x=200 g。
9.【2020·湘西】2020年全球出现了罕见的新冠肺炎疫情。
疫情期间,需要经常对公共场所消毒,常用的消毒剂有84消毒液、双氧水等。
(1)84消毒液(含NaClO)与洁厕灵(含盐酸)不能混用,
否则会产生有毒的氯气和两种常见的化合物,写
出该反应的化学方程式
NaClO+2HCl===NaCl+H O+Cl↑
22
_______________________________________。
(2)为了对某车站候车室消毒,要配制一桶(15 kg)含
H O2%的双氧水,需工业用双氧水(含H O30%)
2222
____1____kg。
(3)请你写出另一种防止新冠肺炎传播的有效方法
戴口罩(合理均可)
_____________________。
【点拨】(1)根据题目信息,可知NaClO和HCl混合之后
会产生Cl
和两种常见化合物,根据质量守恒定律可知这
2
O、NaCl,据此书写化学方程式。
(2)设
两种化合物是H
2
需用工业双氧水的质量为x,则有15 kg×2%=x×30%,
可解得x=1 kg。
( 3 )预防新冠肺炎,除了对公共场所进
行杀菌消毒,也应从个人卫生习惯上预防,有效方法有:勤洗手、戴口罩、多运动等。
10.某温度下把100 g KNO3溶液的溶质质量分数由10%增加到20%,可采用的方法是(ꢀBꢀ)
A.保持温度不变,蒸发掉45 g水
B.保持温度不变,蒸发掉50 g水
C.加入10 g KNO3固体
D.加入15 g KNO3固体
【点拨】此题最易出现的错误就是把溶质
质量增加一倍或将溶剂蒸发掉一半。
11.用溶质质量分数为98%(密度为1.84 g/cm3)的浓硫酸来配制500 mL溶质质量分数为20%的稀硫酸(密度为
1.14 g/cm3),稀释时需用的水的体积约为(ꢀBꢀ)
A.436.8 mL C.456.0 mL B.453.7 mL D.458.3 mL
12.现有80 g溶质质量分数为10%的硝酸钠溶液,试回答下列问题:
(1)上述溶液中含溶质的质量为_____8___g,溶剂
的质量为____7_2___g。
(2)若向上述溶液中加入20 g水,则所得溶液中溶
质的质量分数为___8_%____。
(3)若向上述溶液中加入20 g硝酸钠,完全溶解后所得
溶液中溶质的质量分数为___2_8_%___。
(4)若使上述溶液中溶质的质量分数变为20%,则应加
入硝酸钠____1_0___g,或蒸发掉____4_0___g水。
(5)若使上述溶液中溶质的质量分数变为5%,则应加
水____8_0___g。
13.下列条件下的氢氧化钙溶液,溶质的质量分数最大的是(ꢀAꢀ)
A.20 ℃时的饱和溶液C.20 ℃时的不饱和溶液B.40 ℃时的饱和溶液D.40 ℃时的不饱和溶液
【方法规律】本题采用比较法解答。
氢氧化钙的溶解度随温度升高反而减小,因此20 ℃时的饱和溶液比40 ℃时的饱和溶液溶质质量分数大,而20 ℃时的氢氧化钙的饱和溶液比不饱和溶液溶质质量分数大。
14.【2020·北京】不同温度下KNO3的溶解度如下表所示。
下列说法正确的是(ꢀꢀD)
温度/℃203040
溶解度/g31.645.863.9
A.20 ℃时,100 g KNO3饱和溶液中溶质质量为31.6 g
B.30 ℃时,100 g KNO3饱和溶液的溶质质量分数为45.8%
C.30 ℃时,将50 g KNO3放入100 g水中,得到150 g溶液
D.40 ℃时,100 g水最多溶解63.9 g KNO3
15.【中考·广州】某温度下,在100 g 质量分数为20%的KNO不饱和溶液甲中加入10 g KNO固体,恰好得33
到饱和溶液乙,下列说法正确的是(ꢀꢀ)C
A.该温度下,KNO3 的溶解度为30 g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
【点拨】固体物质的溶解度是指在一定温度下,某物质在100 g溶剂中达到饱和状态时所溶解的溶质的质量,题目中的100 g是指溶液质量,故A项错;乙溶
的溶解度随温度的液质量是110 g,故B项错;KNO
3
升高而增大,故升温后甲、乙两溶液的质量分数都不变,故D项错。
16.【中考·绍兴】下表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。
(1)10 ℃时,100 g水中
最多可溶解硝酸钾
的质量为___2_0_._9__g。
(2)20 ℃时,将10 g硝酸钾加入到40 g水中,所得溶液溶质
质量分数为___2_0_%___。
(3)如图是硝酸钾溶液的变化情况,请写出一种可采用的操
作方法。
(写出计算过程)
17.【中考·泰安】下图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。
下列叙述正确的是(ꢀDꢀ)
A.t1 ℃时,a、c两种物质饱和溶液的溶质质量分数为20%
B.将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法
C.将a、b、c三种物质的饱和溶液从
t℃降温至t℃,所得溶液中溶质
21
质量分数的大小关系为b>a=c
D.将150 g a物质的饱和溶液从t3 ℃降
温至t
℃,可析出30 g a物质
1。
