九年级化学推断题、物质鉴别、离子共存专题突破(最新整理)
初三化学物质鉴别、除杂、离子共存问题

初中化学常有实验题型解题技法总结 (除杂、分别、鉴别、判定、推测)知识重点:1. 除杂题:解答除杂质一类的题目时,要注意三原则;三要领;五种常用的方法。
三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分别。
三要领: ①依据物理性质或化学性质的差异; ②确立除杂质方法; ③选择适合试剂。
除杂质思路解析方法 :(1)积淀法:加入一种试剂将被除去的杂质变成积淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变成气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变成提纯的物质。
(5)汲取法:常用于气体的提纯。
在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,解析理顺思路且与题目要求切合,才能正确解题。
2. 混杂物的分别:(1)可溶性与难溶性物质的混杂物——常用溶解、过滤、蒸发三步操作加以分别,分别获得纯净物。
如:粗盐的提纯;BaSO 和 Na SO 的混杂物。
424(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时, 可考虑——结晶法。
即冷却热饱和溶液的方法加以分别。
如:NaCl 和 KNO 3 的混杂物。
(3)两种物质均溶于水时,可考虑用化学方法分别。
如 BaCl 2 和 NaCl 的混合物。
可将混杂物先溶于水, 加入适当 Na 23 溶液,获得3 和NaCl 溶液。
COBaCO BaCl 2+ Na 2CO 3=BaCO 3↓+2NaCl 。
将积淀过滤出, 洗净后在积淀中加入适当盐酸溶液,又获得 BaCl 2 溶液,CO 2 逸出。
BaCO 3+2HCl =BaCl 2+H 2O+CO 2↑。
最后分别将 NaCl 溶液和 BaCl 2 溶液蒸发,分别获得纯净的 NaCl 固体和 BaCl 2 固体。
注意:用化学方法或用物理方法进行混杂物分别时, 要差异除杂质与分别物质 的不一样点是:除杂质时只要求把杂质除去、 保留原物质即可; 而混杂物分别是几种物质用必定的方法分开,原混杂物中各成分都一定保留。
九年级化学推断题_物质鉴别_离子共存专题突破(1)

九年级化学推断、鉴别、除杂 专项练习、推断题“突破口” 1•从物质的特征入手 (1 )有色固体① 黑色:黑色单质 C 、Fe 粉、 黑色混合物CuO 、Fe 3O 4、MnO 2② 红色:Cu (紫红色)、Fe 2O 3 (红棕色)③ 蓝色沉淀:Cu (OH ) 2 ;红褐色沉淀:Fe (OH )3 ④ KMnO 4 (暗紫色或紫黑色)、红磷(暗红色)(2) 有色溶液:Cu 2+(蓝色)、F0 (浅绿色)、Fe 3+(黄色) (3) 无色气体: 2、CO 2、CO 、O 2、H 2、CH 4(4) 有刺激性气味的气体: NH 3(此气体可使湿润 pH 试纸变蓝色卜SO 2 2•从化学之最入手地壳中含量最多的金属元素是铝;最常见的金属是铁;密度最小的气体是氢气; 相对分子质量最小的氧化物是水;最常见的有机物是甲烷 CH 4 3•物质的用途(1 )改良酸性土壤的物质: Ca (OH )2、CaO ; (2) 配置农药波尔多液的物质: CuSO 4、Ca (OH )2 (3) 胃酸的主要成分:HCI ; ( 4)常用的调味品:NaCI ;(5)发酵粉的主要成分: NaHCO s4、常见一些变化的判断:① 白色沉淀且不溶于稀硝酸或酸的物质有: BaSO 4、AgCI (就这两种物质)② 蓝色沉淀:Cu (OH )2、 CuSO 4 + 2NaOH = Cu (OH ) 2 J+ 2NaCI③ 红褐色沉淀:Fe (OH )3FeCI3 + 3NaOH = Fe (OH )3j+ 3NaCI ;Fe (OH )2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成 Fe (OH )3红褐色沉淀④ 沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐 ⑤ 沉淀能溶于酸但没气体放出的:不溶的碱 ⑥ 与血红蛋白结合,有毒的是 CO ;⑦ 能溶于盐酸或稀 HNO3的白色沉淀有 CaCO3、BaCO3;不溶于稀 HNO3的白色沉淀有 AgCI 、BaSO4。
初三化学专题复习推断题、除杂、离子共存

初三化学专题复习专题一推断题1.A~H为初中化学常见的物质,它们之间的转化关系如下图所示(部分生成物已略去),已知A、B是组成元素相同的两种物质,D是一种固体单质,H是蓝色沉淀。
请按要求回答下列问题:(1)A的化学式是()(2)写出反应⑤的化学方程式:。
(3)写出D的一种用途。
2.下列A~H 都是初中化学中常见的物质。
已知A 是沼气、可燃冰的重要成分,F 可用于改良酸性土壤,它们之间的转化关系如下图所示。
(1)A的化学式为。
G俗称。
(2)大气中D的含量过高会产生。
从而导致全球气候变暖。
(3)反应③的化学方程式为。
(4)反应④的化学方程式为:,其基本反应类型为反应。
3.初中化学常见物质的转化关系如下图,部分反应物、生成物和反应条件未标出。
其中D与E的组成元素相同,B、D、E在通常状况下是气体,F可用来改良酸性土壤,G是石灰石的主要成分,M是一种黑色固体粉末。
(1)写出物质A的化学式。
(2)物质M在反应①中所起的作用是。
(3)反应③中伴随着(填“放热”或“吸热”)现象。
(4)写出反应②的化学方程式:。
(5)写出实验室制取气体E的化学方程式:。
4.A~H是初中化学常见的物质,各物质反应关系如下图所示。
A和B能发生中和反应,G、H为金属单质,X、Y是金属氧化物,部分反应条件和生成物已略去。
图中“→”表示转化关系,“—”表示反应关系。
请回答下列问题:(1)A物质的俗称,F物质的化学式。
(2)反应②属于反应(填基本反应类型)。
(3)写出G与蓝色溶液反应的化学方程式:。
5.如图表示某些物质间转化关系(反应条件和部分产物已省略).其中A、E为固体氧化物,且A为黑色粉末;B、D是由相同元素组成的无色液体,且B具有消毒杀菌作用;C、Y、Z 为无色气体,其中Y有毒;X是最常见的金属.请回答下列问题:(1)反应①中A物质的作用是________;(2)反应③、④的化学方程式为:③___________________________;④_____________________________.(3)在日常生活中为防止反应②的发生,可采取的措施是________(写一点即可);(4)在自然界中普遍存在反应⑤,其名称为________.6. A~G是初中化学常见的物质,其转化关系如下图所示。
《离子共存 离子的检验和推断》知识完全归纳与典题分析(解析版)

《离子共存 离子的检验和推断》知识完全归纳与典题分析【核心素养分析】宏观辨识与微观探析:能从宏观和微观相结合的视角理解化学反应和离子反应,并运用离子反应解决实际问题。
证据推理与模型认知:知道可以通过分析、推理等方法认识研究对象的本质特征;能运用正确的模型理解离子的检验与推断的规律。
【重点知识梳理】 知识点一 离子共存所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
发生下列反应而不能大量共存的情况:1、发生复分解反应。
(1)生成难溶物或微溶物:如:Ba 2+与CO 2-3,Ag +与Br -,Ca 2+与SO 2-4等不能大量共存。
(2)生成气体或挥发性物质:如:NH +4与OH -,H +与CO 2-3、HCO -3、S 2-、HS -、SO 2-3、HSO -3 等不能大量共存。
(3)生成难电离物质:如:H +与CH 3COO -、CO 2-3、S 2-、SO 2-3等因生成弱酸不能大量共存;OH -与NH +4因生成的弱碱不能大量共存;H +与OH -生成水不能大量共存。
2、发生氧化还原反应:氧化性离子(如Fe 3+、NO -3、ClO -、MnO -4 (H +)等)与还原性离子(如S 2-、I -、Fe 2+、SO 2-3等)不能大量共存。
3、离子间发生水解相互促进不能共存:弱酸对应的阴离子和弱碱对应的阳离子相互促进双水解进行到底。
如Al 3+、Fe 3+、NH +4与CO 2-3、HCO -3、S 2-、HS -、AlO -2等。
4、络合反应:如Fe3+和SCN-。
【知识拓展】多种离子能否大量共存于同一溶液中,归纳起来就是一句话:一色、二性、三特殊、四反应。
1、一色。
即溶液颜色。
若限定无色溶液,则Cu2+、Fe3+、Fe2+、MnO-4、Co2+、Cr2O2-7、CrO42-、Cr3+等有色离子不能存在。
2、二性。
即溶液的酸性和碱性。
初中化学离子共存-物质鉴别分离-化学推断专题训练

初中化学物质推断、鉴别、除杂专题训练一、推断题“突破口”1.从物质的特征入手(1)有色固体①黑色:黑色单质C、Fe粉、黑色混合物CuO、Fe3O4、MnO2②红色:Cu(紫红色)、Fe2O3(红棕色)③蓝色沉淀:Cu(OH)2 ;红褐色沉淀:Fe(OH)3④KMnO4(暗紫色或紫黑色)、红磷(暗红色)(2)有色溶液:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)(3)无色气体:N2、CO2、CO、O2、H2、CH4(4)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO22.从化学之最入手地壳中含量最多的金属元素是铝;最常见的金属是铁;密度最小的气体是氢气;相对分子质量最小的氧化物是水;最常见的有机物是甲烷CH43.物质的用途(1)改良酸性土壤的物质:Ca(OH)2、CaO;(2)配置农药波尔多液的物质:CuSO4、Ca(OH)2(3)胃酸的主要成分:HCl;(4)常用的调味品:NaCl;(5)发酵粉的主要成分:NaHCO34、常见一些变化的判断:①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)②蓝色沉淀:Cu(OH)2、CuSO4+2NaOH = Cu(OH)2↓+2NaCl③红褐色沉淀:Fe(OH)3FeCl3 +3NaOH = Fe(OH)3↓+3NaCl;Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐⑤沉淀能溶于酸但没气体放出的:不溶的碱⑥与血红蛋白结合,有毒的是CO;⑦能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
二、化学推断题解题技巧和思路1.审题:认真审读原理,弄清文意和图意,理出题给条件,深挖细找,反复推敲。
2.分析:抓住关键,找准解题的突破口,突破口也称为“题眼”,指的是关键词、特殊现象、物质都特征等等,然后从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果。
最新中考化学复习专题:离子共存+ 化学推断题练习

中考化学复习专题:离子共存离子共存题是中考中重现率较高的题,题型新颖、灵活。
但是虽然每年的考题在形式上常有所改变,但考查内容却变化不大。
下面小编结合近年中考试题,对离子共存题常见题型进行归纳分析:一、常见题型1.“无色透明”条件型若题目限定溶液“无色”,则不含有色离子,即Fe2+(浅绿色)、Fe3+(棕黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子。
若“透明”,则溶液不形成混浊或沉淀(与溶液有无颜色无关)。
如Ag+与Cl-、SO42-;Ca2+与CO32-;Ba2+与CO32-、SO42-;Fe3+、Cu2+、Mg2+与OH-等在水溶液中会发生反应,有浑浊或明显的沉淀生成,它们不能大量共存。
例1 某无色透明的溶液中,下列各组离子能大量共存的是()。
A.H+、Cl-、Ba2+、CO32-B.Ag+、Cl-、K+、NO3-C.K+、OH-、Cl-、Na+D.Fe3+、Cl-、NO3-、Na+解析:正确选项应满足无色透明、能大量共存两个条件。
答案为C项。
2.“酸性”条件型常见的叙述有酸性溶液、pH=1的溶液、能使pH试纸变红的溶液、紫色石蕊试液呈红色的溶液、加入镁粉能放出氢气的溶液等。
若题目中限定溶液呈酸性,则溶液中有H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-等)以及弱酸的酸式根离子(如HCO3-等)。
例2 在pH=1的溶液中,可以大量共存的离子是()。
A.K+、Na+、SO42-、CO32-B.NH4+、Mg2+、SO42-、Cl-C.Na+、K+、OH-、Cl-D.K+、Na+、HCO3-、NO3-解析:正确选项应满足pH=1(有H+存在)、可以大量共存两个条件。
答案为B项。
3.“碱性”条件型常见的叙述有碱性溶液、pH=14的溶液、能使pH试纸变蓝的溶液等。
若题目中限定溶液呈碱性,则溶液中有OH-存在,其中不能大量含有H+、如NH4+、Mg2+、Ag+、Al3+、Zn2+、Cu2+、F e2+、Fe3+等阳离子。
离子共存、物质鉴别、物质分离(除杂)、物质推断专题练习(有答案)

专题练习一、离子共存1.某溶液能使紫色石蕊溶液变蓝,下列各组离子能大量共存的是()A.SO42-、NO3-、Ba2+、Cl-B. Cu2+、Na+、NO3-、K+C. K+、CO32-、NO3-、Cl-D. H+、Ba2+、K+、NO3-2.将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是()A.FeCl2、NaCl、KNO3B. CaCl2、HCl 、NaNO3C. K2CO3、Mg(NO3)2、NaOHD. KOH、NaCl、(NH4)2SO43.溶质能大量共存于水溶液中的是()A.HNO3、Ca(OH)2、NaClB.KNO3、CuCl2、Na2SO4C. NaOH 、MgSO4、BaCl2D. HCl 、Na2CO3、Ca(NO3)24.下列各组物质,能在pH=1.5的溶液中大量共存,且形成无色溶液的是()A. NaCl 、BaCl2、Na2SO4B. Na2CO3、NaCl 、Na2SO4C. CuSO4、NaCl 、NaNO3D. Na2SO4、HCl 、KCl5.下列物质能在pH=13的无色溶液中大量共存的是()A. CuSO4、FeCl3、NaNO3、MgSO4B. H2SO4、HCl、AgNO3、KMnO4C. NaNO3、NaCl、K2CO3、K2SO4D. BaCl2、KNO3、(NH4)2SO4、NaOH6.下列各组物质能在pH=1的无色溶液中大量共存的是( )A. K2SO4、Ba(OH)2、KClB. Cu(NO3)2、NaCl、KNO3C. Na2CO3、KNO3、NH4ClD. MgSO4、NaNO3、KCl7.下列各组物质在pH=1的溶液中能大量共存且无色的是()A. K2SO4Ba(OH)2KClB. Cu(NO3)2NaCl KNO3C. Na2CO3 KNO3NH4ClD. MgSO4NaNO3KCl8.将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是( )A. FeCl3、NaCl、KNO3B. CaCl2、 HCl 、NaNO3C. K2CO3、Ca(NO3)2、NaOHD. KOH 、 NaOH、(NH4)2SO49.下列各组离子,在溶液中能大量共存的是()A. Ca2+ Cl- Na+ CO32-B. H+ K+NO3-OH-C. SO42- CO32- Na+ H+D. K+ Na+ NO3-SO42-10.下列各组物质在水溶液中能大量共存,而且加入无色酚酞溶液后显红色的是()A. NaOH、NaCl、CuSO4、HClB. KNO3、Na2SO4、NaOH、KClC. KCl、Ba(NO3)2、HCl、CaCl2D. Na2CO3、Ba(OH)2、KNO3、Na2SO4 11.能在PH=9的溶液中大量共存,且溶液为无色透明的一组物质是()A. AlCl3、Fe2(SO4)3、NaClB. BaCl2、Na2SO4、NaClC. MgCl2、NaNO3、Ba(NO3)2D. K2SO4、NaNO3、CaCl212.将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是()A. FeCl2、NaCl、KNO3B. CaCl2、HCl、NaNO3C. K2CO3、Mg(NO3)2、NaOHD. KOH、NaCl、(NH4)2SO413.将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是( )A. FeCl3、NaCl、KNO3B. CaCl2、 HCl 、NaNO3C. K2CO3、Ca(NO3)2、NaOHD. KOH 、 NaOH、(NH4)2SO414.下列各组物质在给定条件下能大量共存的是()A.在pH=1的溶液中:NaCl、Na2CO3、Na2SO4B. 在pH=2的溶液中:KCl、Na2SO4、HNO3C. 在pH=13的溶液中:BaCl2、Na2CO3、NaOHD. 在pH=14的溶液中:FeCl3、Ba(NO3)2、CaCl215.现有一混合物的水溶液,已知溶液中可能含有以下离子中的若干种:NH4+、Na+、Ba2+、Cl-、CO32-、SO42-。
初三化学物质的鉴别、除杂、离子共存问题

初中化学常有实验题型解题技法总结(除杂、分别、鉴识、判定、推测)知识重点:1. 除杂题:解答除杂质一类的题目时,要注意三原则;三要领;五种常用的方法。
三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分别。
三要领: ①依据物理性质或化学性质的差别; ②确立除杂质方法; ③选择适合试剂。
除杂质思路剖析方法 :(1)积淀法:加入一种试剂将被除掉的杂质变成积淀,再用过滤法除掉。
(2)化气法:加热或加入一种试剂将杂质变成气体逸出。
(3)置换法:利用置换反响的原理将杂质除掉。
(4)转纯法:将被除掉的杂质变成提纯的物质。
(5)汲取法:常用于气体的提纯。
在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,剖析理顺思路且与题目要求符合,才能正确解题。
2. 混淆物的分别:(1)可溶性与难溶性物质的混淆物——常用溶解、过滤、蒸发三步操作加以分别,分别获得纯净物。
如:粗盐的提纯;BaSO 和 Na SO 的混淆物。
424(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时, 可考虑——结晶法。
即冷却热饱和溶液的方法加以分别。
如:NaCl 和 KNO 3 的混淆物。
(3)两种物质均溶于水时,可考虑用化学方法分别。
如 BaCl 2 和 NaCl 的混合物。
可将混淆物先溶于水, 加入适当 Na 23 溶液,获得3 和NaCl 溶液。
COBaCO BaCl 2+ Na 2CO 3=BaCO 3↓+2NaCl 。
将积淀过滤出, 洗净后在积淀中加入适当盐酸溶液,又获得 BaCl 2 溶液,CO 2 逸出。
BaCO 3+2HCl =BaCl 2+H 2O+CO 2↑。
最后分别将 NaCl 溶液和 BaCl 2 溶液蒸发,分别获得纯净的 NaCl 固体和 BaCl 2 固体。
注意:用化学方法或用物理方法进行混淆物分别时, 要差别除杂质与分别物质 的不一样点是:除杂质时只需求把杂质除掉、 保存原物质即可; 而混淆物分别是几种物质用必定的方法分开,原混淆物中各成分都一定保存。
(完整word)九年级化学物质检验和除杂、离子共存专题答案(修)
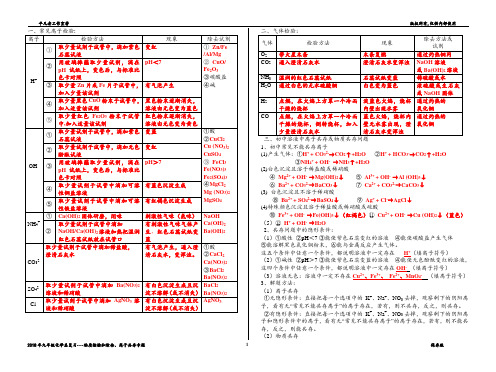
(1)氧气(水)浓H2SO4或生石灰或NaOH固体、硫酸铜固体、氯化钙固体
(2)二氧化碳(水)浓H2SO4
(3)氨气(水)生石灰或NaOH固体
(4)二氧化碳(氧气)灼热铜网
(5)一氧化碳(二氧化碳)NaOH溶液或饱和石灰水或Ba(OH)2溶液
七、初中化学中化学反应优先原则:
1、混合金属都能与酸反应:先发生最活泼金属与酸反应
2、①混合盐溶液都能与同一种金属反应:先发生金属与最不活泼金属的盐反应
②混合金属都能与同一种盐溶液反应:先发生盐与最活泼金属反应
3、①酸与盐溶液混合,加入碱溶液先发生酸碱中和反应,后发生酸盐
②碱与盐溶液混合,加入酸溶液:先发生酸碱中和反应,后碱盐反应
(3)溶液无色:溶液中一定不存在Cu2+、Fe3+、Fe2+、MnO4-(填离子符号)
3、解题方法:
(1)离子共存
①无隐形条件:直接把每一个选项中的K+、Na+、NO3-去掉,观察剩下的阴阳离子,看有无“常见不能共存离子”的离子存在,若有,则不共存,反之,则共存。
②有隐形条件:直接把每一个选项中的K+、Na+、NO3-去掉,观察剩下的阴阳离子和隐形条件中的离子,看有无“常见不能共存离子”的离子存在,若有,则不能共存,反之,则能共存。
通过灼热的
氧化铜
三、初中溶液中离子共存或物质共存问题
1、初中常见不能共存离子
(1)产生气体:①H++ CO32-→CO2↑+H2O②H++ HCO3-→CO2↑+H2O
③NH4++OH-→NH3↑+H2O
初中化学物质推断题、物质共存鉴别题

初中化学专项练习一、物质共存、离子共存题1、下列各组物质,能够在溶液中大量共存的是()A、NaNO3、Na2CO3、NaClB、Ca(OH)2、K2CO3、NaNO3C、NaOH、(NH4)2CO3、HClD、BaCl2、Na2SO4、NaOH2、下列各组物质能在pH=1的溶液中大量共存且得到无色透明溶液的是()A、BaCl2、NaNO3、KOH、MgCl2B、Cu(NO3)2、NaCl、H2SO4、KNO3C、Na2CO3、NaCl、KNO3、NH4ClD、ZnSO4、Mg(NO3)2、NaNO3、KCl3、在鉴定某无色溶液时,四位实验者对该溶液的组成得出了不同的结论,其中可能正确的是()A、Na2CO3、NaCl、HClB、NaOH、KCl、Ba(NO3)2C、AgNO3、NaCl、HNO3D、H2SO4、NaNO3、FeCl34、下列各组物质在pH=14的某无色溶液中,能大量共存的是()A、FeCl3、NaCl、KNO3B、NaCl、NaOH、NaNO3C、CaCl2、NaNO3、Na2CO3D、KNO3、H2SO4、NaCl5、下列各组内的离子,在溶液中不能大量共存的是()A、H+、SO2━4、Ba2+、NO3—B、Ca2+、H+、NO3—、Cl━C、Mg2+、K+、NO━3、Cl━D、K+、Na+、Mg2+、SO2━46、下列各组离子中,能大量共存的是()A、H+、SO2━4、OH━、Ba2+B、K+、Mg2+、NO3—、OH━C、Na+、H+、NO3——、CO2━3D、Na+、K+、H+、SO2━4二、物质鉴别题1、能将Na2CO3、NaNO3、Ba(NO3)2三种溶液一次性鉴别出来的试剂是()A、石蕊试液B、稀盐酸C、稀硫酸D、氯化钙溶液2、有四瓶失去标签的溶液,它们分别是①Ba(OH)2溶液②K2CO3溶液③KCl溶液④FeCl3溶液。
不用其他任何试剂将它们鉴别开来的合理顺序是()A、④①②③B、②③①④C、④②①③D、③②④①3、下列各组物质中,中用稀H2SO4一种试剂就可以鉴别的是()。
初中化学离子共存物质鉴别分离化学推断专题训练

初中化学物质推断、鉴别、除杂专题训练一、推断题“突破口”1、从物质得特征入手(1)有色固体①黑色:黑色单质C、Fe粉、黑色混合物CuO、Fe3O4、MnO2②红色:Cu(紫红色)、Fe2O3(红棕色)③蓝色沉淀:Cu(OH)2;红褐色沉淀:Fe(OH)3④KMnO4(暗紫色或紫黑色)、红磷(暗红色)(2)有色溶液:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)(3)无色气体:N2、CO2、CO、O2、H2、CH4(4)有刺激性气味得气体:NH3(此气体可使湿润pH试纸变蓝色)、SO22。
从化学之最入手地壳中含量最多得金属元素就是铝;最常见得金属就是铁;密度最小得气体就是氢气;相对分子质量最小得氧化物就是水;最常见得有机物就是甲烷CH43。
物质得用途(1)改良酸性土壤得物质:Ca(OH)2、CaO;(2)配置农药波尔多液得物质:CuSO4、Ca(OH)2(3)胃酸得主要成分:HCl; (4)常用得调味品:NaCl; (5)发酵粉得主要成分:NaHCO34、常见一些变化得判断:①白色沉淀且不溶于稀硝酸或酸得物质有:BaSO4、AgCl(就这两种物质)②蓝色沉淀:Cu(OH)2、CuSO4+2NaOH=Cu(OH)2↓+2NaCl③红褐色沉淀:Fe(OH)3FeCl3+ 3NaOH =Fe(OH)3↓+3NaCl;Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀④沉淀能溶于酸并且有气体(CO2)放出得:不溶得碳酸盐⑤沉淀能溶于酸但没气体放出得:不溶得碱⑥与血红蛋白结合,有毒得就是CO;⑦能溶于盐酸或稀HNO3得白色沉淀有CaCO3、BaCO3;不溶于稀HNO3得白色沉淀有AgCl、BaSO4。
二、化学推断题解题技巧与思路1。
审题:认真审读原理,弄清文意与图意,理出题给条件,深挖细找,反复推敲。
ﻫ2、分析:抓住关键,找准解题得突破口,突破口也称为“题眼",指得就是关键词、特殊现象、物质都特征等等,然后从突破口出发,探求知识间得内在联系,应用多种思维方式,进行严密得分析与逻辑推理,推出符合题意得结果。
九年级化学共存、除杂、鉴别、推断专题复习配套练习

除杂、共存、鉴别、鉴定、推断题型解题技法总结知识要点:一、除杂题:、1三原则;三要领;五种常用的方法解答除杂质一类的题目时,要注意。
三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
除杂质思路分析方法:(1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变为气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变为提纯的物质。
(5)吸收法:常用于气体的提纯。
在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,分析理顺思路且与题目要求吻合,才能准确解题。
2. 混合物的分离:(1)可溶性与难溶性物质的混合物——常用溶解、过滤、蒸发三步操作加以分离,分别得到纯净物。
如:粗盐的提纯;BaSO4和Na2SO4的混合物。
(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时,可考虑——结晶法。
即冷却热饱和溶液的方法加以分离。
如:NaCl和KNO3的混合物。
(3)两种物质均溶于水时,可考虑用化学方法分离。
如BaCl2和NaCl的混合物。
可将混合物先溶于水,加入适量Na2CO3溶液,得到BaCO3和NaCl溶液。
BaCl2+ Na2CO3=BaCO3↓+2NaCl。
将沉淀过滤出,洗净后在沉淀中加入适量盐酸溶液,又得到BaCl2溶液,CO2逸出。
BaCO3+2HCl =BaCl2+H2O+CO2↑。
最后分别将NaCl 溶液和BaCl2溶液蒸发,分别得到纯净的NaCl固体和BaCl2固体。
注意:用化学方法或用物理方法进行混合物分离时,要区别除杂质与分离物质的不同点是:除杂质时只要求把杂质除掉、保留原物质即可;而混合物分离是几种物质用一定的方法分开,原混合物中各成分都必须保留。
二、共存的问题(相互间不能发生复分解反应的离子间能共存)1、在溶液中不能共存的:a.能反应的酸碱盐b.活泼的金属和酸c.活泼的金属和不活泼的金属的盐溶液2、加隐含条件的应用规律:生成难溶物或微溶物:如SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+;Ag+与Cl-、CO32-、SO32-、S2-;Mg2+、Ba2+、Ca2+与CO32-、SO32-、PO43-等不能大量共存生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-等不能大量共存。
(2021年整理)初中化学离子共存_物质鉴别分离_化学推断专题训练

初中化学离子共存_物质鉴别分离_化学推断专题训练(推荐完整)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(初中化学离子共存_物质鉴别分离_化学推断专题训练(推荐完整))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为初中化学离子共存_物质鉴别分离_化学推断专题训练(推荐完整)的全部内容。
初中化学离子共存_物质鉴别分离_化学推断专题训练(推荐完整)编辑整理:张嬗雒老师尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布到文库,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是我们任然希望初中化学离子共存_物质鉴别分离_化学推断专题训练(推荐完整) 这篇文档能够给您的工作和学习带来便利。
同时我们也真诚的希望收到您的建议和反馈到下面的留言区,这将是我们进步的源泉,前进的动力.本文可编辑可修改,如果觉得对您有帮助请下载收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为〈初中化学离子共存_物质鉴别分离_化学推断专题训练(推荐完整)〉这篇文档的全部内容.初中化学物质推断、鉴别、除杂专题训练一、推断题“突破口”1.从物质的特征入手(1)有色固体①黑色:黑色单质C、Fe粉、黑色混合物CuO、Fe3O4、MnO2②红色:Cu(紫红色)、Fe2O3(红棕色)③蓝色沉淀:Cu(OH)2 ;红褐色沉淀:Fe(OH)3④KMnO4(暗紫色或紫黑色)、红磷(暗红色)(2)有色溶液:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)(3)无色气体:N2、CO2、CO、O2、H2、CH4(4)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO22。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学推断、鉴别、除杂专项练习一、推断题“突破口”1.从物质的特征入手(1)有色固体①黑色:黑色单质C、Fe粉、黑色混合物CuO、Fe3O4、MnO2②红色:Cu(紫红色)、Fe2O3(红棕色)③蓝色沉淀:Cu(OH)2 ;红褐色沉淀:Fe(OH)3④KMnO4(暗紫色或紫黑色)、红磷(暗红色)(2)有色溶液:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)(3)无色气体:N2、CO2、CO、O2、H2、CH4(4)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO22.从化学之最入手地壳中含量最多的金属元素是铝;最常见的金属是铁;密度最小的气体是氢气;相对分子质量最小的氧化物是水;最常见的有机物是甲烷CH43.物质的用途(1)改良酸性土壤的物质:Ca(OH)2、CaO;(2)配置农药波尔多液的物质:CuSO4、Ca(OH)2(3)胃酸的主要成分:HCl;(4)常用的调味品:NaCl;(5)发酵粉的主要成分:NaHCO34、常见一些变化的判断:①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)②蓝色沉淀:Cu(OH)2、CuSO4+2NaOH = Cu(OH)2↓+2NaCl③红褐色沉淀:Fe(OH)3FeCl3 +3NaOH = Fe(OH)3↓+3NaCl;Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐⑤沉淀能溶于酸但没气体放出的:不溶的碱⑥与血红蛋白结合,有毒的是CO;⑦能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
二、化学推断题解题技巧和思路1.审题:认真审读原理,弄清文意和图意,理出题给条件,深挖细找,反复推敲。
2.分析:抓住关键,找准解题的突破口,突破口也称为“题眼”,指的是关键词、特殊现象、物质都特征等等,然后从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果。
3.解答:根据题目的要求,按照分析和推理的结果,认真而全面地解答。
4.检验:得出结论后切勿忘记验证。
其方法是将所得答案放回原题中检验,若完全符合,则说明答案正确。
若出现不符,则说明答案有误,需要另行思考,推出正确答案。
三、常见物质及溶液的颜色———推断题的题眼1.通电条件电解水【反应物——水,生成物——氢气和氧气。
2H2O通电2H2↑+O2↑】2.高温条件一物变二物——CaCO3高温CaO+CO2↑;二物变二物——C+2CuO高温2Cu+CO2;Fe2O3+3CO高温2Fe+3CO2二物变一物——C+CO2高温2CO解题方法:解决框图型推断题关键是找到题眼(突破口),所谓题眼就是能根据这个信息确定该物质是什么,然后从这种物质出发,根据题目所给信息逐一猜测判断其他物质,然后后把判断出的物质逐一放入框图中综合检验,最后得出正确结论。
【变式演练1】:A~H 是初中化学常见的物质,其中A 为发酵粉的主要成分之一,B 是常用调味品,E 、F 的俗称分别为熟石灰、纯碱。
它们之间的相互转化关系如下图:(1)(2)在物质的分类中,D 属于_____________(填“酸”、“碱”、“盐”或“氧化物”)(3)图中反应②的化学方程式:____________________________________(4)图中反应④的化学方程式:____________________________________【变式演练2】:(2008年临沂市)已知,A 、B 、C 、D 四种物质之间存在以下转化关系。
其中C 是单质,D 是相对分子质量最小的氧化物。
试回答(1)写出A 、C、D 三种物质的化学式:A________、C_________、D_________。
浅绿色溶液B 中溶质的化学式_______________。
(2)写出C →D 的化学方程式_________________________________。
【变式演练4】:现有A 、B 、C 、D 、E 、F 、G 七种物质,C 、F 是最常见的金属,B 是气体单质,D 为浅绿色溶液,C 为蓝色溶液,它们之间存在如下关系:(1)推测下列物质的化学式:B ,D ,F ;(2)写出C→A 转化的化学方程式: 。
【变式演练4】:A 为含三种元素的钠盐,C 为相对分子质量为100白色不溶物,请填空:1 A 、B 、C。
2)D 中一定含有的溶质是。
理由是(用化学方程式表示) 。
3)D 还可能含有溶质是 。
【变式演练5】:A 是一种白色难溶于水的钙盐,由三种元素组成,其式量为100。
(1(2)写出A 与盐酸反应的化学方程式:______________________________________【变式演练6】:有一无色液体A ,在通电条件下,可以产生B 和H 两种单质气体。
其它关系如图所示,请完(1)写出反应②的基本反应类型__________________。
(2)写出有关物质的化学式:A 是________________,G 是_______________。
(3)写出反应④的化学方程式_________________________________________。
【变式演练7】图4中A 、B 、C 、D 、E 、F 、G 、H 分别代表相关反应的一种物质。
已知:X 、H 为黑色固体单质,D 是大理石的主要成分,Y 为红棕色粉末。
常温下C 、E 、F 、G 均为无色气体,图中有部分生成物未标出。
请填写以下空白:(1)写出下列两种物质的化学式: E_____, X______。
(2)写出下列反应的化学方程式:① D C 的反应:__________________。
② C D 的反应:___ _ ______。
③ F 与H 的反应:_______________________④ G 与Y 的反应: 。
【变式演练8】A ~H 都是初中化学中的常见物质,它们之间的转化关系如图6所示。
A 是天然气的主要成分,E 是一种常见的食品干燥剂。
请回答:(1)A 的化学式为 ;(2)反应③的基本反应类型是 ;(3)反应②的化学方程式为 ;反应④的化学方程式为 。
【变式演练9】已知,A 、B 、C 、D 四种物质之间存在以下转化关系。
其中C 是单质,D 是相对分子质量最小的氧化物。
试回答 (1)写出A 、C 、D 三种物质的化学式:A________、C_________、D_________。
浅绿色溶液B 中溶质的化学式_______________。
(2)写出C →D 的化学方程式_________________________________。
【变式演练10】X 是常见固态化合物,可发生图4所示的变化。
高温碱图4图6(1)X的化学式是________。
(2)写出图中①,②反应的化学方程式:①②类型二、方程式叙述型推断题解题方法:对于这类题主要是认真分析化学方程式中各物质的转化关系,在根据所学的物质的性质及方程式中已知的物质加以推测,最后把推测结果带入方程式,经验证正确后,即可确定答案。
【变式演练11】有属于酸、碱、盐的5种常见物质A、B、C、D、E,它们之间可以发生如下反应:(1)A+B→C+H2O (2)C+H2SO4→D↓+A (3)E+AgNO3→AgCl↓+C 根据上述反应,推断下列各物质的化学式:A________;B________;C_______;D________;E________。
【变式演练12】已知A、B、C、D、E、F六种物质的转化关系如下:(1)A+B→C+H2O (2)C+KOH→D↓(蓝色)+E (3)B+D→C+H2O (4)E+BaCl2→F↓(白色,不溶于稀硝酸)+KCl根据上述变化关系,推断有关物质的化学式: A ________;B_______;C_______;D________;E________;F________。
【变式演练13】A,B,C,D,E分别是酸、碱、盐中的五种物质,其中A是酸,另一种是碱,还有三种是盐,D 在医院用作诊断胃部疾病的药品,它们之间可以发生以下反应:(1)A+B→C+H2O(2)C+H2SO4→D↓+A(3)E+AgNO3→AgCl↓+C 根据上述反应,推断下列物质的化学式是:A________,B________,C________。
类型三、文字叙述型推断题解题方法:对于这类推断题确定混合物的成分一般常用“分层推断法”,先根据所给信息分层推理出每一层的分结论,再进行综合整理得出总结论。
【变式演练14】某固体混合物可能含有氯化镁、碳酸钙、硫酸铜、碳酸钾和硝酸钠中的一种或几种。
现进行以下实验:(1)将该混合物放入足量水中,得无色透明溶液;(2)向(1)的溶液中加入氢氧化钠溶液无明显现象;(3)在上述(1)的溶液中加入盐酸,有气泡产生。
据上可推断原混合物中肯定有__________,肯定没有__________,可能有___________。
用化学方程式表示上述实验中肯定发生的反应:______________。
【变式演练15】有一包固体粉末, 可能含有炭粉、氧化铜、氧化铁、碳酸钙中的一种或几种。
进行如下实验:①取样,加热至高温产生一种气体,该气体能使澄清的石灰水变浑浊。
②把适量稀盐酸滴入冷却后的固体残渣中, 残存固体全部溶解,同时产生一种可燃性气体。
试推断: (1) 该固体粉末中一定含有____________ ,一定没有____________。
(2) 该固体粉末中可能含有__________,为证实该物质是否存在,可选用的试剂是____________。
【变式演练16】有一包固体粉末,可能由碳酸钙、硫酸钾、硝酸钠、氯化铁、氯化钡中的一种或几种组成,做实验得到以下结论:(1)将此固体粉末加到水中,得到白色沉淀,上层溶液为无色。
(2)该白色沉淀部分溶于稀硝酸,且有气体放出。
结论:从实验可判断出,该粉末中一定含有___,一定不含有___,可能含有____。
类型四、表格型推断题解决方法:表格型推断题,常采用“分组法”:就是两两结合,判断现象,然后对照所给现象,综合分析,对号入座,得出答案。
这种方法直观明快。
【变式演练17】五瓶溶液:HCl、Na2CO3、Ba(NO3) 2、Na2SO4、NaNO3任意编号,两两混合实 验A+D A+B B+C A、B、C、D分别与E现 象气体沉淀沉淀无现象判断A_________,B_________,C_________,D_________,E_________。
五、除杂、鉴别、分离知识要点1. 除杂题:解答除杂质一类的题目时,要注意三原则;三要领;五种常用的方法。
