溶液=溶质+溶剂 溶质=浓度×溶液讲解学习
小学奥数之浓度问题入门和专题内容掌握(一)
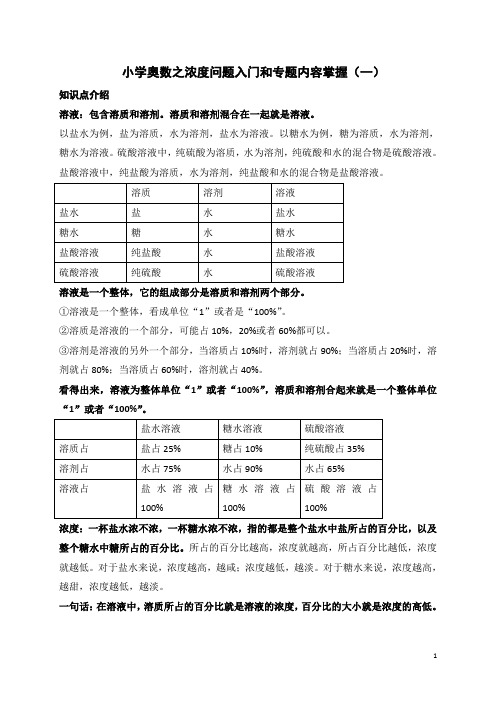
小学奥数之浓度问题入门和专题内容掌握(一)知识点介绍溶液:包含溶质和溶剂。
溶质和溶剂混合在一起就是溶液。
以盐水为例,盐为溶质,水为溶剂,盐水为溶液。
以糖水为例,糖为溶质,水为溶剂,糖水为溶液。
硫酸溶液中,纯硫酸为溶质,水为溶剂,纯硫酸和水的混合物是硫酸溶液。
盐酸溶液中,纯盐酸为溶质,水为溶剂,纯盐酸和水的混合物是盐酸溶液。
溶液是一个整体,它的组成部分是溶质和溶剂两个部分。
①溶液是一个整体,看成单位“1”或者是“100%”。
②溶质是溶液的一个部分,可能占10%,20%或者60%都可以。
③溶剂是溶液的另外一个部分,当溶质占10%时,溶剂就占90%;当溶质占20%时,溶剂就占80%;当溶质占60%时,溶剂就占40%。
看得出来,溶液为整体单位“1”或者“100%”,溶质和溶剂合起来就是一个整体单位“1”或者“100%”。
浓度:一杯盐水浓不浓,一杯糖水浓不浓,指的都是整个盐水中盐所占的百分比,以及整个糖水中糖所占的百分比。
所占的百分比越高,浓度就越高,所占百分比越低,浓度就越低。
对于盐水来说,浓度越高,越咸;浓度越低,越淡。
对于糖水来说,浓度越高,越甜,浓度越低,越淡。
一句话:在溶液中,溶质所占的百分比就是溶液的浓度,百分比的大小就是浓度的高低。
浓度=%100 溶液的质量溶质的质量比如:20克盐水与80克水混合后变成盐水,问此盐水的浓度是多少?解:浓度=盐质量÷盐水质量×100%=20÷(20+80)×100%=20% 。
填写下列表格中的空白处得到浓度公式为:知道溶液质量和浓度,怎么求溶质的质量?溶质质量=溶液质量×浓度知道溶液质量和浓度,怎么求溶剂的质量?溶剂质量=溶液质量×(1-浓度)规律:知道整体和浓度,求部分,用乘法。
溶液是整体,溶质和溶剂都是部分。
知道溶质,溶剂,溶液中的两个,怎么求第三个?溶液质量=溶质质量+溶剂质量溶质质量=溶液质量-溶剂质量溶剂质量=溶液质量-溶质质量知道溶质和浓度,怎么求溶液?溶液质量=溶质质量÷浓度知道溶剂和浓度,怎么求溶液?溶液质量=溶剂质量÷(1-浓度)规律:知道部分和浓度,求整体,用除法。
中考化学——第九单元溶液基本知识点以及学习方法

中考化学——第九单元溶液基本知识点以及学习方法第9单元溶液1.一定溶质质量分数的溶液的配制【知识点的认识】一定溶质质量分数的溶液的配制是这样的,所用仪器有托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒;操作步骤是:计算→称量→溶解→装瓶→贴签→入柜.其注意事项有以下六条:1.计算时,溶质的质量=溶液质量×溶质的质量分数,溶液质量=溶液体积×溶液密度,溶剂的质量=溶液质量﹣溶质的质量;由于溶剂一般是水,且密度为1g/cm3,所以溶剂的体积和质量在数值是相等的.2.称量,称量包括称取溶质的质量和量取溶剂的体积;首先,用托盘天平(配用药匙)称量所需的溶质,倒入烧杯中;然后,用量筒(配用胶头滴管)量取所需的水,倒入盛有溶质的烧杯中.3.用玻璃棒不断搅拌,使溶质加速溶解.4.把配好的溶液装入细口瓶中,盖好瓶塞.5.标签上要注明溶液的名称和其中溶质的质量分数.6.放入试剂柜时,要注意标签向外.【命题方向】该考点的命题方向通过设置实验情景,让学生根据所学计算出溶质和溶剂的质量,选用适当的仪器,配制一定溶质质量分数的溶液,或者是对某一配制过程和操作图示进行探究分析,并找出其中的错误、误差等等.并且,常以实验操作考试的形式来考查.当然,笔答题中也少不了他的身影,题型有选择题、填空题和实验探究题.中考的重点主要是考查一定溶质质量分数的溶液的配制的前三步、仪器的选用、实验操作及误差分析等等;另外,有时还会考查到将配好的溶液装入什么容器,所贴的标签上都包含什么信息等等.【解题方法点拨】要想操作或者解答好这类题目,就必须熟记配制的步骤、所用仪器、有关的误差分析和上面所列的六条注意事项等等.对于图文并茂的题目来说,既要阅读并理解好文意,又要仔细观察和分析图示信息;然后,根据所学的相关知识,将二者结合起来思考推断,即可得出正确的答案.2.结晶的原理、方法及其应用【知识点的认识】如图所示:结晶是分离可溶性固体和水(或者两种可溶性且溶解度变化差别大的固体)的一种混合物分离的方法;它是根据固体物质从溶液里析出晶体的原理,通过蒸发或者降温的方法将其中的固体物质分离出来;因此,结晶方法分为蒸发结晶和降温结晶两种.蒸发结晶是指蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出;它使用于分离可溶性固体和水的混合物.而降温结晶是指先加热溶液,蒸发溶剂成饱和溶液,再降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出;它使用于分离两种可溶性且溶解度随温度变化差别大(即一种是溶解度随温度变化大,另一种是溶解度受温度变化影响小)的固体混合物.此时,需要注意固体物质的溶解度随温度变化的规律.其具体内容有如下三条:1.大多数物质的溶解度随温度的升高而增大,如硝酸钾等.2.少数物质的溶解度受温度的影响不大,如氯化钠等.3.极少数的物质的溶解度随温度的升高而减小,如氢氧化钙等.【命题方向】该考点的命题方向是通过设置相关的实验、问题情景或图表信息等,来考查学生对结晶的原理、方法及其应用的理解和掌握情况,以及对晶体和结晶现象等相关问题的分析、推断、表达的能力和对知识的迁移能力等.并且,经常它与'物质的溶解性及影响溶解性的因素'、'固体溶解度曲线及其变化的规律'等关联起来考查.当然,有时也单独考查之.题型有选择题、填空题.中考重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对结晶的原理、方法及其应用和固体溶解度曲线及其变化的规律等相关知识的理解和掌握情况,以及运用它们来解决实际问题的能力等.特别是,对结晶方法及其选用和固体溶解度曲线及其变化的规律的考查,是近几年中考的重中之重.【解题方法点拨】要想解答好这类题目,首先,要熟记结晶的方法、原理等,以及固体溶解度曲线及其变化的规律等相关知识;然后,结合所给的实验、问题情景或图表信息等,联系溶解度曲线及其变化的规律等,根据所学的相关知识和技能,细致地阅读、分析题意等,联系着生活实际,细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可.3.常用仪器的名称和选用【知识点的认识】常用仪器的名称和选用,就是指填写常用仪器的名称,根据仪器用途和实验选用常用仪器,以供实验所用.相对来说,这是比较简单的.例如,称量物质时,选用托盘天平(附助器材有药匙或镊子);量取一定量的液体时,选用量筒(附助器材是胶头滴管);等等.【命题方向】该考点的命题方向是通过设置实验、问题情景,让学生思考探究后,填写所用的仪器名称,或根据仪器用途和实验选用合适的仪器,以供实验所用.题型有选择题、填空题和实验探究题.中考的重点是考查学生阅读、分析实验、问题情景的能力,以及书写仪器名称、判断对错或根据仪器用途和实验选用仪器的能力.【解题方法点拨】要想解答好这类题目,首先,要熟记常用仪器的名称和用途.然后,根据实验、问题情景信息,细致地分析题意或实验图示等,细心地进行填写、选用或判断对错等.特别注意的是:在填写仪器名称时,书写要规范、工整,切不可使用错别字、不规范的字,等等.4.溶液的概念、组成及其特点溶液的概念、组成及其特点【知识点的认识】溶液的概念是一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物.由此可见,溶液是由一种或几种物质(即溶质)和另一种物质(即溶剂)两部分组成.但是,溶液不一定是由两种物质组成的,应该说是至少由两种物质组成;因为其中的溶剂虽然是一种,而溶质可以是多种的.溶液的特点是均一性和稳定性.其中,均一性是指溶液中各部分的性质和成分均相同(如一瓶溶液中,上下左右等各部分的密度都是一样的);稳定性是指在条件不变(即温度、压强等不改变,溶剂不蒸发等)的情况下,溶液中的溶质永远不会析出(即溶质与溶剂永不分离).【命题方向】该考点的命题方向主要是通过设置实验、问题情景或图表信息等,来考查学生对溶液的概念、组成及其特点的理解和掌握情况;以及对溶液、溶质和溶剂的判定等相关问题的分析、推断能力和对知识的迁移能力等.这类题目常与'物质的溶解和结晶'、'溶液、溶质和溶剂的判定'、'常见的溶剂'、'乳化现象与乳化作用'、'溶液、悬浊液或乳浊液'等联系起来考查.当然,有时也单独考查之.题型有选择题、填空题.中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对溶液的概念、组成及其特点的理解和掌握情况,以及运用它们来解决实际问题的能力等.特别是,对溶液、溶质和溶剂的判定,以及溶液、悬浊液或乳浊液的区分是近几年中考的重中之重.【解题方法点拨】要想解答好这类题目,首先,要熟记和理解溶液的概念、组成及其特点,以及常见的溶剂,溶解现象、原理和溶解过程,溶液、悬浊液或乳浊液等相关知识;然后,根据实验、问题情景或图表信息等,细致地阅读、分析题意等,联系着生活实际,细心地进行探究解答即可.值得注意的是,对于溶液的判定主要看其是否是均一、稳定的混合物.对于溶液组成(即溶质、溶剂)的判定可以参考下面的口诀:'气固溶液液为剂,液液相溶多为剂.水多水少总为剂,不指溶剂水为剂'.其含义为:'气体、固体溶于液体中,液体是溶剂,气体、固体为溶质;液体和液体相溶时,量多的为溶剂,量少的为溶质;有水时,不管量多量少,一般把水看作溶剂;没有指明溶剂时,常把水记作溶剂.'5.溶液、溶质和溶剂的相互关系与判断溶液、溶质和溶剂的相互关系与判断【知识点的认识】溶液、溶质和溶剂的相互关系是溶液是由溶质和溶剂组成,溶液质量是溶质质量与溶剂质量之和.类推之得:溶质质量是溶液质量与溶剂质量之差,而溶剂质量是溶液质量与溶质质量之差.但是,溶液的体积等于溶液的质量除以溶液的密度,却不等于溶质的体积与溶剂的体积之和.对于溶液的判断,主要看其是否是均一、稳定的混合物.对于溶液组成(即溶质、溶剂)的判断,可以参考下面的口诀:'气固溶液液为剂,液液相溶多为剂.水多水少总为剂,不指溶剂水为剂'.其含义为:'气体、固体溶于液体中,液体是溶剂,气体、固体为溶质;液体和液体相溶时,量多的为溶剂,量少的为溶质;有水时,不管量多量少,一般把水看作溶剂;没有指明溶剂时,常把水记作溶剂.'【命题方向】该考点的命题方向主要是通过设置实验、问题情景或图表信息等,来考查学生对溶液、溶质和溶剂的相互关系与判断的理解和掌握情况;以及对溶液的概念、组成及其特点等相关问题的分析、推断能力和对知识的迁移能力等.这类题目常与'物质的溶解和结晶'、'溶液的概念、组成及其特点'、'常见的溶剂'、'乳化现象与乳化作用'、'溶液、悬浊液或乳浊液'等联系起来考查.当然,有时也单独考查之.题型有选择题、填空题.中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对溶液的概念、组成及其特点的理解和掌握情况,以及运用它们来解决实际问题的能力等.特别是,对溶液、溶质和溶剂的判定,以及溶液、悬浊液或乳浊液的区分是近几年中考的重中之重.【解题方法点拨】要想解答好这类题目,首先,要熟记和理解溶液、溶质和溶剂的相互关系与判断方法,以及溶液的概念、组成及其特点,常见的溶剂,溶解现象、原理和溶解过程,溶液、悬浊液或乳浊液等相关知识;然后,根据实验、问题情景或图表信息等,细致地阅读、分析题意等,联系着生活实际,细心地进行探究解答即可.另外,对于溶质、溶剂的判断来说,还可以根据溶液的名称来判定其中的溶质、溶剂.如果表达溶液的名称里含有两种物质的名称时,前者就是溶质,后者则为溶剂;如果表达溶液的名称里只含有一种物质的名称(即某某溶液)时,某某就是溶质,溶剂默认为是水(因为大多数溶液里溶剂一般都是水没有什么区别,但是溶质是不同的,所以为了区分开溶液,就把用溶质的名称来称呼溶液了).6.乳化现象与乳化作用乳化现象与乳化作用【知识点的认识】乳化现象与乳化作用如图所示:具体地说,乳化现象就是当两种不相溶的液体混合时,其中一种在表面活性剂(即乳化剂﹣﹣具有乳化作用,能使乳浊液稳定的物质;如洗涤剂、洗发精等)的作用下,以极小的液滴均匀悬浮在另一种液体中形成乳浊液的现象.其中的乳化剂所起的作用就叫乳化作用.【命题方向】该考点的命题方向主要是通过设置实验、问题情景或图表信息等,来考查学生对乳化现象或乳化作用的理解和掌握情况,以及区分溶解现象、原理和溶解过程的分析、推断能力和对知识的迁移能力等.这类题目常与'物质的溶解'、'溶解现象、原理和溶解过程'等联系起来考查.当然,有时也单独考查之.题型有选择题、填空题.中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对乳化现象或乳化作用的理解和掌握情况,以及运用它们来解决实际问题的能力等.特别是,对它与溶解现象、原理和溶解过程的区分方法和技巧的考查,是近几年中考的重中之重.【解题方法点拨】要想解答好这类题目,首先,要熟记和理解乳化现象或乳化作用,以及溶解现象、原理和溶解过程等相关知识;然后,根据所给的实验、问题情景或图表信息等,细致地阅读、分析题意等,联系着生活实际,细心地进行探究解答即可.值得注意的是,经乳化作用形成的乳浊液,虽然稳定,且不再分层,但不是溶液.7.饱和溶液和不饱和溶液饱和溶液和不饱和溶液【知识点的认识】饱和溶液是指在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液;还能继续溶解某种溶质的溶液叫做这种溶质的不饱和溶液.它们区别就是在一定温度下,一定量的溶剂里能否继续溶解某种溶质.其特点除具有溶液的基本特性(即均一性、稳定性)外,还具有针对性(即它们只有针对某种溶质来说,才有意义;否则,就说不准是饱和溶液还是不饱和溶液了);例如,一定温度下,一定量的溶剂里的硝酸钾饱和溶液是针对硝酸钾来说,它是饱和溶液,而针对氯化钠等其它可溶性的物质来说,它可能是不饱和溶液.也就是说,在一定温度下,一定量的溶剂里的硝酸钾饱和溶液中,加入硝酸钾是不能再溶解的;但是,加入氯化钠等其它可溶性的物质是能够继续溶解的.【命题方向】该考点的命题方向主要是通过设置实验、问题情景或图表信息等,来考查学生对饱和溶液和不饱和溶液的概念、特点和区分方法的理解和掌握情况,以及区分饱和溶液和不饱和溶液的分析、推断能力和对知识的迁移能力等.这类题目常与'物质的溶解和结晶'、'溶液的概念、组成和特点'、'溶解现象、原理和溶解过程'、'固体溶解度曲线及其使用'等联系起来考查.当然,有时也单独考查之.题型有选择题、填空题;并且,常在选择题中以判断对错的形式出现.中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对饱和溶液和不饱和溶液的概念、特点和区分方法的理解和掌握情况,以及运用它们来解决实际问题的能力等.特别是,对饱和溶液和不饱和溶液的针对性、区分方法和技巧,以及固体溶解度曲线及其使用的综合考查,是近几年中考的重中之重.【解题方法点拨】要想解答好这类题目,首先,要熟记和理解饱和溶液和不饱和溶液的概念、特点和区分方法,以及饱和溶液和不饱和溶液的针对性,溶解现象、原理和溶解过程,固体溶解度曲线及其使用等相关知识;然后,根据所给的实验、问题情景或图表信息等,细致地阅读、分析题意等,联系着生活实际,细心地进行探究解答即可.值得注意的是,不管是说饱和溶液,还是不饱和溶液,都一定要指明'在一定温度下,一定量的溶剂里',并且,要针对某种溶质来说才可;否则,谈论溶液的'饱和'和'不饱和'是没有意义的.8.饱和溶液和不饱和溶液相互转变的方法饱和溶液和不饱和溶液相互转变的方法【知识点的认识】饱和溶液和不饱和溶液相互转变的方法如图所示:但是,还需要注意的以下4点:1.当采用上述相互转变方法中的改变温度的方法,来实现饱和溶液和不饱和溶液的相互转变时,是针对溶解度随着温度的升高而增大的固体(如硝酸钾、氯化铵等)来说的.如果针对溶解度随着温度的升高而减小的固体(如氢氧化钙等)来说,上述相互转变方法中的升、降温度正好相反(即将上述相互转变方法中的升温改为降温,降温改为升温),才能实现相应的饱和溶液和不饱和溶液的相互转变.2.当需要增加溶剂的量,来实现饱和溶液转变为不饱和溶液时,一定要按照需要的量来加,切不可过多(为了保护水资源和节约用水).3.当需要蒸发溶剂的量,来实现不饱和溶液转变为饱和溶液时,一定要注意只是蒸发掉多余的溶剂,并且要求是恒温蒸发之.4当需要加入溶质的量,来实现不饱和溶液转变为饱和溶液变时,一定要注意加入的溶质应该和原来的不饱和溶液中的溶质保持一致,切不可加入其它的和原来的不饱和溶液中的溶质不一样的溶质.【命题方向】该考点的命题方向主要是通过设置实验、问题情景或图表信息等,来考查学生对饱和溶液和不饱和溶液相互转变方法的理解和掌握情况,以及对物质的溶解度随温度的变化情况的分析、推断能力和对知识的迁移能力等.这类题目常与'饱和溶液和不饱和溶液的概念、特点及其针对性'、'物质的溶解和结晶'、'溶解现象、原理和溶解过程'、'影响溶解快慢的因素'、'物质的溶解度随温度的变化规律'、'固体溶解度曲线及其使用'等联系起来考查.当然,有时也单独考查之.题型有选择题、填空题;并且,常在选择题中以判断对错的形式出现,还经常在填空题的里出现.中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对饱和溶液和不饱和溶液的概念、特点和相互转变方法的理解和掌握情况,以及运用它们来解决实际问题的能力等.特别是,对饱和溶液和不饱和溶液的转变方法和技巧,以及物质的溶解度随温度的变化情况、固体溶解度曲线及其使用的综合考查,是近几年中考的重中之重.【解题方法点拨】要想解答好这类题目,首先,要熟记和理解饱和溶液和不饱和溶液相互转变方法,以及饱和溶液和不饱和溶液的概念、特点及其针对性,溶解现象、原理和溶解过程,物质的溶解度随温度的变化规律,固体溶解度曲线及其使用等相关知识;然后,根据所给的实验、问题情景或图表信息等,细致地阅读、分析题意等,联系着生活实际,细心地进行探究解答即可.但是,一定要时刻关注'知识点的认识'中所强调的4点注意事项,以及物质的溶解度随温度的变化规律(特别是,经常会考查特殊溶质氢氧化钙的溶解度随温度的变化情况).9.浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系【知识点的认识】所谓溶液的浓和稀、溶液的饱和和不饱和是从两个不同角度来认识溶液的性质.要想弄清浓溶液和稀溶液跟饱和溶液和不饱和溶液的关系,首先要明确它们各自含义或概念等.其中,溶液的浓稀是指一定质量的溶液中含溶质的多少,多的则浓,少的则稀;而溶液的饱和和不饱和是指一定温度下,一定量溶剂里能否再溶解某种溶质,能溶的为其不饱和溶液,不能溶的为其饱和溶液.例如,20℃时,100g水中溶解31.6g硝酸钾,所得溶液既是饱和溶液,又是较浓溶液;若将30g硝酸钾在此温度下溶解在100g水中,所得溶液是不饱和溶液但仍为较浓溶液.再如,在20℃时,100g水中最多能溶解0.00024gBaSO4,此时所得溶液显然很稀,但它却是饱和溶液;若取0.0002gBaSO4在此温度下溶于100g水中,所得溶液既是不饱和溶液,也是稀溶液.另外,对溶解度随温度的升高而增大的固体物质来说,其高温时的不饱和溶液有可能比其低温时的饱和溶液的浓度要高;而对特殊溶质氢氧化钙等溶解度随温度的升高而减小的固体物质来说,其低温的不饱和溶液有可能比其高温时的饱和溶液的浓度要高.由此可见,浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液.当然,若同一温度下,同一种溶质溶解在同一种溶剂中,其饱和溶液一定比其不饱和溶液的浓度要高.【命题方向】该考点的命题方向主要是通过设置问题情景或图表信息等,来考查学生对浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系的理解和掌握情况,以及从两个不同角度来认识溶液性质的能力和对知识的迁移能力等.这类题目常与'饱和溶液和不饱和溶液的概念、特点及其针对性'、'物质的溶解和结晶'、'溶解现象、原理和溶解过程'、'物质的溶解性及影响溶解性的因素'、'物质的溶解度随温度的变化规律'、'固体溶解度曲线及其使用'等联系起来考查.当然,有时也单独考查之.题型有选择题、填空题;并且,常在选择题中以判断对错的形式出现,还经常常在填空题的里出现.中考的重点是考查学生阅读、分析问题情景或图表信息的能力,对浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系,饱和溶液和不饱和溶液的概念、特点,物质的溶解度随温度的变化规律等相关知识的理解和掌握情况,以及运用它们来解决实际问题的能力等.特别是,对溶液的浓和稀、溶液的饱和和不饱和辨析、判断和相互关系,以及物质的溶解度随温度的变化情况和固体溶解度曲线及其使用的综合考查,是近几年中考的重中之重.【解题方法点拨】要想解答好这类题目,首先,要熟记和理解浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系,以及饱和溶液和不饱和溶液的概念、特点及其针对性,溶解现象、原理和溶解过程,物质的溶解度随温度的变化规律和固体溶解度曲线及其使用等相关知识;然后,根据所给的问题情景或图表信息等,细致地阅读、分析题意等,联系着生活实际,细心地进行探究解答即可.爱心提示:如果能根据具体的实例(如'知识点的认识'中所举的)来理解浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系,以及物质的溶解度随温度的变化规律(特别是,经常会考查氢氧化钙的溶解度随温度的变化情况);那么就会事半功倍了.10.固体溶解度的概念固体溶解度的概念【知识点的认识】固体溶解度的概念是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量.一般用字母s表示,其单位是克(符号为g).在未注明溶剂的情况下,通常溶解度指的是物质在水里的溶解度.例如:在20℃时,100g水里最多能溶36g 氯化钠(这时溶液达到饱和状态),我们就说在20℃时,氯化钠在水。
行测数学运算:浓度相关问题

行测数学运算:浓度相关问题第三节工程相关问题溶液=溶质+溶剂;浓度=溶质÷溶液;溶质=溶液×浓度;溶液=溶质÷浓度【例1】(山西2009-97)在一杯清水中放入10克盐,然后再加入浓度为5%的盐水200克,这时配成了浓度为2.5%的盐水,问原来杯中有清水多少克?()A. 460克B. 490克 C. 570克 D. 590克[答案]D[解析]假设原有清水质量为x克,根据题意列方程:10+200×5%x+10+200=2.5% x=590(克)【例2】(安徽2009-11)当含盐30%的60千克盐水蒸发为含盐40%的盐水时,盐水重量为多少千克?()A. 45B. 50C. 55D. 60[答案]A[解析]假设最后盐水重量为x千克,根据“溶质不变”列方程:60×30%=x×40% x=45(千克)【例3】(北京应届2008-14)甲杯中有浓度为17%的溶液400克,乙杯中有浓度为23%的溶液600克。
现在从甲、乙两杯中取出相同总量的溶液,把从甲杯中取出的倒入乙杯中,把从乙杯中取出的倒入甲杯中,使甲、乙两杯溶液的浓度相同。
现在两杯溶液的浓度是()A. 20%B. 20.6%C. 21.2%D. 21.4%[答案]B[解析]无论怎样混合,根据最后溶液状态可知,整个过程相当于将甲、乙两杯溶液混合在一起,因此最终两杯溶液的浓度为:400×17%+600×23%400+600=20.6%。
【例4】(浙江2007B类-19)浓度为70%的酒精溶液100克与浓度为20%的酒精溶液400克混合后得到的酒精溶液的浓度是多少?()A. 30%B. 32%C. 40%D. 45%[答案]A[解析]根据公式:浓度=100×70%+400×20%100+400=30%。
【例5】(浙江2005-19)甲容器中有浓度为4%的盐水250克,乙容器中有某种浓度的盐水若干克。
六年级寒假第二讲:(溶液浓度问题)附答案

六年级数学寒假第二讲:典型应用题精练(溶液浓度问题)浓度问题的内容与我们实际的生活联系很紧密,就知识点而言它包括小学所学2个重点知识:百分数,比例。
一、浓度问题中的基本量溶质:通常为盐水中的“盐”,糖水中的“糖”,酒精溶液中的“酒精”等溶剂:一般为水,部分题目中也会出现煤油等溶液:溶质和溶液的混合液体。
浓度:溶质质量与溶液质量的比值。
二、几个基本量之间的运算关系1、溶液=溶质+溶剂2、浓度=溶质质量溶液质量 ×100%=溶质质量溶质质量+溶剂质量 ×100%溶质重量=溶液重量×浓度溶液重量=溶质重量÷浓度溶剂质量=溶液质量-溶质质量=溶液质量×(1-浓度)三、解浓度问题的一般方法1、寻找溶液配比前后的不变量,依靠不变量建立等量关系列方程2、十字交叉法:(甲溶液浓度大于乙溶液浓度) 形象表达:A B =甲溶液质量乙溶液质量B A =甲溶液与混合溶液的浓度差混合溶液与乙溶液的浓度差注:十字交叉法在浓度问题中的运用也称之为浓度三角,浓度三角与十字交叉法实质上是相同的.浓度三角的表示方法如下:::乙溶液质量甲溶液质量z-y x-zy %浓度x 混合浓度z%3、列方程解应用题也是解决浓度问题的重要方法.【例1】有含盐16%的盐水40千克,要使盐水的浓度变为20%,需加盐多少千克?【分析与解答】加盐前后盐水中水的重量不变。
原来盐水中水的重量:40×(1-16%)=33.6(千克)现在盐水的重量:33.6÷(1-20%)=42(千克)加入盐的重量:42-40=2(千克)答:需加盐2千克。
【试一试1】有含糖10%的糖水40千克,要使糖水含糖量达到28%,需加糖多少千克?【例2】把浓度为8%的500克盐水稀释成5%的盐水,需加水多少克?【分析与解答】稀释前后盐水中的盐重量不变。
盐水中盐的重量:500×8%=40(克)稀释后盐水重量:40÷5%=800(克)加入水的重量:800-500=300(克)答:需加水300克。
六年级奥数培训第10讲 浓度问题

第10讲 浓度问题在百分数应用题中有一类叫溶液配比问题。
我们都知道,将糖溶于水就得到了糖水,其中糖叫溶质,水叫溶剂,糖水叫溶液。
如果水的量不变,那么糖加得越多,糖水就越甜,也就是说,糖水甜的程度是由糖(溶质)与糖水(溶液=糖+水)二者重量的比值决定的,这个比值就叫糖水的含糖量或糖含量。
类似地,酒精溶于水中,纯酒精与酒精溶液二者重量的比值就叫酒精含量,我们统一称为浓度。
溶质、溶剂、溶液及浓度有如下基本关系:溶液=溶质+溶剂,浓度=溶质÷溶液,溶液=溶质÷浓度,溶质=溶液×浓度。
浓度通常用百分数表示。
例如,10克白糖溶于90克水中,浓度﹙含糖量,溶例1 浓度为10%,重量为80克的糖水中,加入多少克水就能得到浓度为8%的糖水?解:浓度10%,含糖 80×10%= 8(克),有水80-8=72(克).如果要变成浓度为8%,含糖8克,糖和水的总重量是8÷8%=100(克),其中有水100-8=92(克).还要加入水 92- 72= 20(克).例2 浓度为20%的糖水40克,要把它变成浓度为40%的糖水,需加多少克糖?解:浓度为20%,含糖40×20%=8(克),有水40-8=32(克).32÷﹙1-0.4﹚=3153千克,3153-40=3113千克。
用方程解 设要加糖x 克,就有x ∶32=40%∶(1-40%),例3 有一堆含水量14.5%的煤,经过一段时间的风干,含水量降为10%,现在这堆煤的重量是原来的百分之几?解:设原有100吨煤,则有水份14.5吨,煤100-14.5=85.5吨。
则现在这堆煤的重量是85.5÷﹙1-10%﹚=95吨。
用方程解 设风干掉水份x 吨,则由含现在煤的重量为100-5=95(吨),是原来的95%。
例4 20%的食盐水与5%的食盐水混合,要配成15%的食盐水900克.问:20%与5%食盐水各需要多少克?解: 20%比15%多(20%-15%), 5%比15%少(15%-5%),多的含盐量(20%-15%)×20%所需数量要恰好能弥补少的含盐量(15%-5%)×5%所需数量.也就是画出示意图:相差的百分数之比与所需数量之比恰好是反比例关系.答:需要浓度 20%的 600克,浓度 5%的 300克.这一例题的方法极为重要,在解许多配比问题时都要用到.现在用这一方法来解几个配比的问题.例5 甲容器中有8%的食盐水300克,乙容器中有12.5%的食盐水 120克.往甲、乙两个容器分别倒入等量的水,使两个容器的食盐水浓度一样.问倒入多少克水?解:要使两个容器中食盐水浓度一样,两容器中食盐水重量之比,要与所含的食盐重量之比一样.甲中含盐量:乙中含盐量= 300×8%∶120×12.5%= 8∶5.现在要使(300克+倒入水)∶(120克+倒入水)=8∶5.把“300克+ 倒入水”算作8份,“120克+ 倒入水”算作5份,每份是(300-120)÷(8-5)= 60(克).倒入水量是 60×8-300= 180(克).例6甲容器有浓度为2%的盐水 180克,乙容器中有浓度为 9%的盐水若干克,从乙取出 240克盐水倒入甲.再往乙倒入水,使两个容器中有一样多同样浓度的盐水.问:(1)现在甲容器中食盐水浓度是多少?(2)再往乙容器倒入水多少克?解:(1)现在甲容器中盐水含盐量是180×2%+ 240×9%= 25.2(克).浓度是25.2÷(180 + 240)× 100%= 6%.(2)“两个容器中有一样多同样浓度的盐水”,也就是两个容器中含盐量一样多.在乙中也含有25.2克盐.因为后来倒入的是水,所以盐只在原有的盐水中.在倒出盐水 240克后,乙的浓度仍是 9%,要含有 25.2克盐,乙容器还剩下盐水25.2÷9%=280(克),还要倒入水420-280=140(克).例7甲、乙两种含金样品熔成合金.如甲的重量是乙的一半,得到含乙两种含金样品中含金的百分数.解:因为甲重量增加,合金中含金百分数下降,所以甲比乙含金少.画出如下示意图.因为甲与乙的数量之比是1∶2,所以(68%-甲百分数)∶(乙百分数-68%)=2∶1= 6∶3.注意:6+3=2+7=9.那么每段是因此乙的含金百分数是甲的含金百分数是用这种方法解题,一定要先弄清楚,甲和乙分别在示意图线段上哪一端,也就是甲和乙哪个含金百分数大.练习101.纯酒精含量为72%的甲种酒精200克,纯酒精含量为58%的乙种酒精150克,混合后纯酒精含量是多少?2.浓度为60%的酒精溶液200g,与浓度为30%的酒精溶液300g,混合后所得到的酒精溶液的浓度是多少?3. 有含糖量为7%的糖水600克,要使其含糖量加大到10%,需要再加入多少克糖?4.仓库运来含水量为90%的一种水果100千克,一星期后再测,发现含水量降低到80%。
溶液及溶解度知识点总结

中考化学溶液知识点总结【考点1】溶液的概念和基本特征一、溶液的概念1。
溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
2.溶液的组成:溶液是混合物,由溶质和溶剂组成。
溶液的质量=溶质的质量+溶剂的质量;溶液的体积≠溶质体积+溶剂体积溶质:被溶解的物质.可以是固体、液体或气体。
一种溶液中的溶质可以是一种或多种物质。
溶剂:能溶解其他物质的物质。
水是最常见的溶剂。
汽油、酒精也可以作为溶剂。
二、溶液的基本特征①均一性:指溶液形成以后,溶液各部分的组成、性质完全相同。
如溶液中部分的浓度、密度和颜色完全一样。
②稳定性:外界条件不变是溶液长期放置,溶质不会从溶液中分离出来.③是混合物。
【规律】溶液的判别(1)澄清透明不代表是无色的。
(2)均一稳定的液体不一定是溶液,如水。
【举例】硬水、空气、纯净水属于溶液;泥水,油水,蒸馏水不是溶液.【技巧】溶质、溶剂的判定①通常不指明溶剂的溶液,一般是水溶液。
②当固体、气体溶于液体时,固体、气体做溶剂,液体做溶剂。
③当两种液体互相溶解时,量多的叫做溶剂,量少的叫做溶质。
④当物质溶解发生化学变化时,一定要正确判断溶质。
⑤溶质和溶剂是溶液所特有的概念,悬浊液和乳浊液不存在溶质和溶剂.⑥溶质质量是指溶液中已溶解溶质的质量。
【拓展】影响物质溶解能力的因素:1、相似相容,溶质和溶剂的性质相似,溶解能力越强.如:氯化钠易溶于水,难溶于油,碘易溶于汽油,那溶于水。
1、大部分物质稳定越高,溶解能力越强.对于气体,压强越大溶解能力越强。
【考点2】溶液和浊液1、浊液:包括乳浊液和悬浊液。
2、乳浊液:小液滴分散到液体里形成不均一的、不稳定的混合物叫乳浊液。
悬浊液:固体颗粒分散到液体里形成不均一的、不稳定的混合物叫悬浊液。
3、溶液和浊液的区别【考点3】乳化现象1.乳浊液:小液滴分散到液体里形成不均一的、不稳定的混合物叫乳浊液。
2.乳化现象:使植物油分散成无数细小的液滴,而不聚集成大的油珠,这些细小的液滴能随着水流走,这个现象叫乳化现象。
06浓度问题

浓度问题【知识点】1、溶液=溶质+溶剂;浓度=溶质÷溶液;溶质=溶液×浓度;溶液=溶质÷浓度【多次混合核心公式】1、假设杯中溶液质量为M ,每次操作先倒出N 克溶液,再倒入N 克清水,n 为操作次数,则:n n )MN 1(r r -⨯=(r 为原溶液浓度,n r 为操作后的新浓度) 2、、假设杯中溶液质量为M ,每次操作先倒入N 克清水,再倒出N 克溶液,n 为操作次数,则:n n )N M M (r r +⨯=(r 为原溶液浓度,n r 为操作后的新浓度) 浓度=溶液溶质,先加入N 克清水,相等于溶液变为原来的MN M +倍,整体变为原来的NM M +倍。
核心公式演绎: 如果把MN 看成一个整体的话,则有: 3、溶液倒出比例为a 的溶液,再加入相同的溶剂,则浓度变为原来的1-a ;4、溶液加入比例为a 的溶剂,在倒出相同的溶液,则浓度变为原来的a11+。
【例 1】当含盐 30%的 60 千克盐水蒸发为含盐 40%的盐水时,盐水重量为多少千克?( ) (安徽 2009-11)A. 45B. 50C. 55D. 60【解】A溶质不变时本体关键:60×30%=40%X【例 2】将 10 克盐和 200 克浓度为 5%的盐水一起加入一杯水中,可得浓度为 2.5%的盐水,则原来杯中水的克数是( )。
(江苏 2010C-31,山西 2009-97)A. 570B. 580C. 590D. 600【解】D总共的溶质为:10+200×5%=20克,根据条件可得%5.220010x 20=++,x=590 【例 3】一满杯纯牛奶,喝去 20%后用水加满,再喝去 60%。
此时杯中的纯牛奶占杯子容积的百分数为( )。
(安徽 2011-10)A. 52%B. 48%C. 42%D. 32%【解】D假设牛奶100可,第一次喝完剩80克,第二次喝去60%,剩余80×(1-60%)=32.【例 2】瓶子里装有 20%的酒精 1 千克,现分别倒入 100 克和 500 克的甲、乙两种酒精,此时瓶子里的酒精浓度变为 13%。
第3讲浓度问题(十字相乘法)

第三讲 浓 度 问 题(十字交叉相乘)浓度问题常用公式:溶液=溶质+溶剂 ,浓度=溶剂溶质×100%2、浓度三角形:3、常用方法:十字相乘法,浓度三角形,列方程十字交叉相乘法与浓度三角形在本质上是相同的,本质上都是比例。
(一) 补充练习。
1、 (2007年第五届“希望杯”一试六年级)一杯盐水,第一次加入一定量的水后,盐水的含盐百分比为15%,第二次又加入同样多的水,盐水的含盐百分比变为12%;第三次再加入同样多的水,盐水的含盐百分比将变为多少?解法⑴抓住题目中的不变量——盐的数量。
设这杯盐水中有盐60克。
第一次加水后盐水的总量变为60÷15%=400克。
第二次加水后盐水的总量变为60÷12%=500克。
每次加入的水量为500-400=100克。
第三次加入同样多的水后盐水的含盐百分比将变为:60÷(500+100)=10%解法⑵ 设第一次加水后盐水的重量变为α千克。
盐的重量是α×15%=0.15α。
第二次加水后盐水的总重量为0.15α÷12%=1.25α每次加入的水量为1.25α-α=0.25α第三次加入同样多的水后盐水的浓度为0.15α÷(1.25α+0.25α)=10%答:第三次加入同样多的水后盐水的浓度为10%。
2、 (人大附中选拔入学考试题)有两包糖,第一包糖由奶糖和水果糖组成,其中41为奶糖;第二包糖由酥糖和水果糖组成,其中51为酥糖。
将两包糖混合后,水果糖占78%,那么奶糖与酥糖的比例是多少?⑴本题是一道简单的浓度问题。
我们以水果糖为突破口:第一包奶糖占41;水果糖占43。
第二包酥糖占51;水果糖占54。
将两包糖混合后,水果糖占78%,(相当于混合溶液)根据浓度三角形,列出等式:第一包×(78%-43)=第二包×(54-78%) 第一包︰第二包 = (54-78%)︰(78%-43)=2︰3, ⑵ 把第一包糖的数量看作2份,第二包3份。
溶液=溶质+溶剂 溶质=浓度×溶液

溶液=溶质+溶剂溶质=浓度×溶液浓度问题等量关系:混合前溶液的和=混合后的溶液混合前溶质的和=混合后的溶质1、两种酒精,甲种含水15%,乙种含水5%,现在要配成含水12%的酒精500克.每种酒精各需多少克?2、两种药水,甲种浓度为60%,乙种浓度为90%,现要配置浓度是70%的药水300克,问两种药水各取多少克?3、有两种酒精,一种浓度是60%,另一种浓度是90%,现在要配制成浓度为70%的酒精300克,问:两种酒精各取多少克?4、用含药30%和75%的两种防腐药水,配制含药50%的防腐药水18kg,两种药水各需取多少5、现有两种酒精溶液,甲种酒精溶液中纯酒精和水的质量比为3:7 ,乙种酒精溶液中纯酒精和水的质量比为4:1 ,今要得到纯酒精与水的质量比是3:2的酒精溶液50千克,问甲、乙两种酒精溶液各取多少千克?6、H1N1流感期间,某学校用两种消毒液配制药水消毒教室,一种浓度是60%,另一种浓度是90%,现在要配制成70%的溶液300克,则这两种消毒液各要取多少克?7、要配浓度是45%的盐水12千克,现有10%的盐水与85%的盐水,这两种盐水各需多少?8、据研究,当洗衣机中洗衣粉的含量在0.2%~0.5%之间时,衣服的洗涤效果较好,因为这时表面活性较大.现将4.94kg的衣服放入最大容量为15kg的洗衣机中,欲使洗衣机中洗衣粉的含量达到0.4%,那么洗衣机中需要加入多少千克水,多少匙洗衣粉?(1匙洗衣粉约0.02kg,假设洗衣机以最大容量洗涤)9、要配制浓度为15%的硫酸500公斤,已有60%的硫酸100公斤,问还需要加水和加浓度为80 %的硫酸各多少公斤?四行程问题1、一条公路,第一天修了全程的8分之一多5米;第二天修了全程的5分之一少14米,还剩63米,求这条公路有多长?2、某老翁将一根长草绳剪成前、中、后三段,中段长等于前段长加后段长,后段长等于前段长加中段长的一半,现只知道前段长5m,则该草绳的中段,后段各长多少米?.3、甲以5km/h的速度进行有氧体育锻炼,2h后,乙骑自行车从同地出发沿同一条路追赶甲。
溶液的浓度计算.(学习课资)

解:可采用蒸发水的方法
设:需蒸发掉x克水
1200×10% 1200-x ×100%=20% X=510(0克(克) )
答:需蒸发掉510克 0克水水
公开课资
17
一.溶质的质量分数:
5.影响溶质质量分数的因素是: 溶质质量与溶剂质量
则20 ℃时NaCl饱和溶液中溶质的质
量分数为多少?
解:NaCl饱和溶液的溶质质量分数
=
S 100+S
×100%
36
=
×100% =26.5%
136
答:20 ℃NaCl饱和溶液中溶质的质量分数为26.5%
公开课资
23
练习6:
已知20 ℃时NaCl饱和溶液中溶质的
质量分数为26.5% ,
求:20℃时, NaCl的溶解度
已知:20℃时,氯化钠的溶解度为36克/100克水
5克氯化钠
10克氯化钠
10克氯化钠
60克水
A
B
C
在氯化钠能全部溶解的情况下:A、B两烧杯哪个咸?
氯化钠加的越多,溶液越咸,
即:氯化钠溶液的浓度越大。
B、C两烧杯哪个浓度大? 公开课资
1
从微观分析:
溶液的浓度: 一定量的溶液中溶质含量的多少 溶质含量越多,溶液的浓度赿大
结论2: (1) 要使溶液中溶质的质量分数减小一半,
加入水的质量应等于原溶液质量
(2) 要使溶液中溶质的质量分数增大一倍, 蒸发掉水的质量应等于原溶液质量的一半
公开课资
18
练习.有一定量的12%的食盐溶液,当蒸发掉120克水后,
溶质的质量分数增大一倍,则原溶液的( A )克,
溶液问题

溶液问题的公式主要有两个:溶液=溶质+溶剂,浓度=溶质/溶液。
还是比较好理解的,属于初中化学的知识范围,也可称之为浓度问题。
常考我们的有三种题型:简单溶液问题、赋值不变量和重复操作类。
下面我们依次来看下:【例1】当含盐30%的60千克盐水蒸发为含盐40%的盐水时,盐水重量为多少千克?()A.45B.50C.55D.60【答案】A【解析】此题为简单溶液问题,主要是对溶液问题公式的考察,找准对应量代入公式即可。
题干中的40%代表的是浓度,问的盐水重量指的是溶液,那么代入浓度=溶质/溶液即可,40%=30%×60/x,解得x=45,由此可知选择A。
【例2】浓度为15%的盐水若干克,加入一些水后浓度变为10%,再加入同样多的水后,浓度为多少?()A.9%B.7.5%C.6%D.4.5%【答案】B【解析】此题属于赋值不变量的问题,主要是抓住在不断加水时,这里的溶质质量是一直没有发生变化的,也就是说是个定值。
题中的15%和10%表示的是浓度,我们知道浓度=溶质/溶液,即可表示为15%=15/100,10%=10/100,分子部分应该转化为一个定值才符合题意,那么可以考虑将分子统一转变为15和10的最小公倍数30,分母随之扩大同样的倍数,即表示为15%=30/200,10%=30/300。
此时200代表之前的溶液量,300表示加水后的溶液量,它们的差值100即为加水量。
所以再加入100的水后,浓度为30÷400=7.5%。
因此选择B选项。
【例3】三个容积相同的瓶子里装满了酒精溶液,酒精与水的比分别是2:1,3:1,4:1。
当把三瓶酒精溶液混和后,酒精与水的比是多少?()A.133:47B.131:49C.33:12D.3:1【答案】A【解析】此题也属于赋值不变量的问题,主要是找到这三者间的关联量进行统一。
题中是三个容积相同的瓶子,也就是说装满溶液的总量是相同的一个定值。
第一个酒精与水的比为2:1,也就是2份酒精、1份水,总计3份,同理可知后两个分别为4份和5份。
溶液配比浓度问题总结

溶液配比浓度问题总结1、溶液重量(盐水)=溶质重量(盐)+溶剂重量(水)溶质重量(盐)=溶液重量(盐水)×浓度2、溶液问题:浓度=溶质/溶液溶液= 溶质+溶剂溶液重量 = 溶质重量+溶剂重量!浓度=(溶质重量)/溶液重量溶液重量=(溶质重量)/浓度溶质重量= 溶液重量×浓度3、“稀释”问题-------特点是加“溶剂”,解题关键是找到始终不变的量(溶质)。
例:要把30克含盐16%的盐水稀释成含盐0.15%的盐水,须加水多少克?分析:设须加水x克,列表分析等量关系:解:设须加水x 克,由题设得:30×16%=(30+x )·0.15%x ⇒=3170,。
∴须加水3170克。
浓度应用题只要抓住“不变”量或“变化量”之间的联系即可准确迅速推出解法。
4、“浓缩”问题-----特点是减少“溶剂”的量或者增加“溶质”的量,解题关键是紧紧抓住不变的量,构建等量关系。
例:在含盐0.5%的盐水中蒸去了236千克水,就变成了含盐30%的盐水,问原来的盐水是多少千克?解:设原来的盐水是x 千克,列表分析等量关系:、⇒=240,解:设原来的盐水是x千克,由题设:x×0.5%=(x-236) ·30%x∴原来的盐水是240千克。
※不变的量是溶质,围绕这一点构建等量关系从而解题。
例:有含盐8%的盐水40千克,要配制成含盐20%的盐水,须加盐多少千克?分析:设须加盐x千克,列表分析等量关系:解:设须加盐x千克,由题设:40(100%-8%)=(40+x)·(100%-20%)6⇒=x {∴须加盐6千克。
※不变的量是溶剂,围绕这一点构建等量关系从而解题。
5、先“稀释”后“浓缩”-----将整个的过程分为两个阶段,抓住每个阶段的不变量,从而解决问题。
例:在浓度为30%的酒精溶液中加入5千克水,浓度变为20%,再加入多少千克酒精,浓度变为50%?6:配制问题---是指两种或者两种以上的不同浓度的溶液混合配制成新溶液,解题关键是分析所取原溶液的溶质与成品溶质不变及溶液前后质量不变,找到两个等量关系。
六年级奥数 浓度问题

课题 教学目标 教学重点 教学难点 板书课题
浓度问题(教师版)
浓度问题
1、掌握浓度的实质。 2、浓度问题最基本的三个量溶质、溶剂和溶液之间的关系。 3、掌握解决浓度问题的基本解题思路。 4、掌握常用的解题方法方程和抓住不变量来解题。 掌握在稀释、加浓、混合三种情况下如何寻找不变量 让学生掌握解决浓度问题的基本解题思路 教学过程 浓度问题
课堂小结:
1、“稀释”问题:特点是加“溶剂”,解题关键是找到始终不变的量(溶质)。 2、“浓缩”问题:特点是减少溶剂,解题关键是找到始终不变的量(溶质)。 3、“加浓”问题:特点是增加溶质,解题关键是找到始终不变的量(溶剂)。 4、“混合”问题:是指两种或两种以上的不同浓度的溶液混合配制成新溶液(成品),解题关键是分析 所取原溶液的溶质与成品溶质不变及溶液前后质量不变,找到两个等量关系。
练习3
有两种硫酸,一种浓度为60%,另一种浓度为90%,现在要配制浓度为70%的硫酸 300克,问每种硫酸各取多少克?
课后作业: 1、将 10克盐放入40克水中,制成盐水,这种盐水浓度是多少? 2、在一桶 含盐率为6%的盐水中,加入50克盐溶解后,桶中盐水的浓度增加到15.4%,桶中原有多少克 盐水?(____问题) 3、在1000千克15%的 药水中,含纯药多少千克?含水多少千克? 4、将20%的盐水与5%的盐 水混合,配成15%的盐水600克,需要20%的盐水和5%的盐水各多少克?(____问题) 5、现有浓度为10%的盐水20千克。再加入多少千克浓度为30%的盐水,可以得到浓度为 22%的盐水?(____问题) 6、要配制 一种糖水浓度为10%,12克糖需加水多少克?有180克水需加糖多少克? 7、有一杯重 300克的盐水,含盐率为20%,要使含盐率下降为l0%,需要加水多少克?(____问题) 8、1000千克葡萄干在新疆测的含水99%,运抵南京后测的含水98%,问葡萄干运抵南京后还 剩多少千克? 9、一个容 器正好装满10升纯酒精,倒出3升后用水加满,再倒出4.5升后,再用水加满,这时容器中 溶液的浓度时多少?(____问题)
溶液密度公式知识点总结

溶液密度公式知识点总结一、溶液密度公式的基本原理1.1 溶液的质量溶液的质量可以由溶质的质量和溶剂的质量组成。
溶质质量可以用溶质的质量分数与溶液的总质量相乘得到,即m(溶质) = w(溶质)×M(溶液),其中w(溶质) 表示溶质的质量分数,M(溶液) 表示溶液的总质量。
溶剂的质量则是总质量减去溶质的质量,即 m(溶剂) = M(溶液) - m(溶质)。
1.2 溶液的体积溶液的体积可以用所含溶质和溶剂的体积之和得到。
对于溶质和溶剂不可混合的液体,可以简单相加,即 V(溶液) = V(溶质) + V(溶剂),而对于溶质和溶剂可互溶的情况,溶液的体积则需要考虑由于互溶引起的体积变化。
1.3 密度的定义溶液密度定义为单位体积内所含溶质和溶剂的总质量,即ρ = m(溶质) + m(溶剂) / V(溶液)。
在一定温度和压力下,溶液密度是一个常数,可以用于描述溶液的物理性质。
二、理想溶液的密度公式对于理想溶液来说,溶质和溶剂之间没有相互作用,因此溶液的密度公式相对简单。
对于单一溶质溶解于溶剂中的情况,密度公式可以简单地表示为ρ = (m(溶质) + m(溶剂)) /(V(溶质) + V(溶剂)) = ρ(溶质)w(溶质) + ρ(溶剂)(1-w(溶质)),其中ρ(溶质) 和ρ(溶剂) 分别代表溶质和溶剂的密度,w(溶质) 代表溶质的质量分数。
对于多组分理想溶液,密度公式可类似地计算得出。
三、非理想溶液的密度公式对于非理想溶液来说,溶质和溶剂之间存在相互作用,因此密度公式相对复杂。
在实际计算中,可以采用不同的模型来描述非理想溶液的密度,如活度系数模型、准绝对作用模型等。
其中,活度系数模型认为溶质和溶剂之间的相互作用可以通过活度系数来描述,即ρ = ∑(niρi) / V,其中 ni 为各个组分的物质的量,ρi 为各个组分的纯物质的密度,V 为溶液的体积。
四、影响溶液密度的因素4.1 温度随着温度的升高,液体的体积会增大,因此溶液的密度会随着温度的升高而减小。
溶质质量与溶液浓度的计算关系

溶质质量与溶液浓度的计算关系溶液是由溶质和溶剂组成的一种均匀混合物。
溶质是指能够溶解在溶剂中的物质,而溶剂则是能够溶解其他物质的介质。
溶液的浓度是指溶液中溶质的含量,通常用质量或体积比例来表示。
在化学实验和工业生产中,准确计算溶质质量与溶液浓度的关系是非常重要的。
一、质量浓度的计算质量浓度是指溶液中溶质的质量与溶液总质量的比值。
它可以用以下公式来计算:质量浓度(C)= 溶质质量(m)/ 溶液总质量(M)其中,质量浓度的单位通常是克/升(g/L)或克/毫升(g/mL)。
溶质质量的单位是克(g),溶液总质量的单位是升(L)或毫升(mL)。
例如,如果有100克的氯化钠(NaCl)溶解在500毫升的水中,那么溶液的质量浓度可以通过以下计算得出:质量浓度(C)= 100克 / 500毫升 = 0.2克/毫升 = 200克/升这意味着溶液中每升含有200克的氯化钠。
二、溶质质量与溶液浓度的关系溶质质量与溶液浓度之间存在着密切的关系。
当溶质的质量增加时,溶液的浓度也会增加;而当溶质的质量减少时,溶液的浓度也会减少。
这是因为溶质的质量是影响溶液浓度的主要因素之一。
例如,如果我们有100克的蔗糖(C12H22O11)溶解在500毫升的水中,那么溶液的质量浓度为:质量浓度(C)= 100克 / 500毫升 = 0.2克/毫升 = 200克/升现在,如果我们再向这个溶液中加入50克的蔗糖,那么溶液的质量浓度将变为:质量浓度(C)= (100克 + 50克)/ 500毫升 = 0.3克/毫升 = 300克/升可以看到,溶液的浓度随着溶质质量的增加而增加。
三、浓度的应用浓度是化学实验和工业生产中常用的重要参数之一。
它可以用来控制反应的速率、调整溶液的性质以及计算物质的含量等。
在化学实验中,我们经常需要制备一定浓度的溶液。
通过计算溶质质量与溶液总质量的比值,我们可以准确地配制出所需浓度的溶液。
这对于实验的成功和结果的准确性非常重要。
溶质浓度与溶液浓度

溶质浓度与溶液浓度溶液是由溶质溶解在溶剂中形成的可均匀混合的混合物。
在一个溶液中,溶质的浓度是指溶质的质量或摩尔量与溶液总质量或总体积的比值。
而溶液的浓度是指溶质的质量或摩尔量与溶液体积的比值。
溶质浓度与溶液浓度的关系在化学和物理学中有着重要的意义,对于溶液的性质和应用有着深远的影响。
一、溶质浓度的计算方法在溶质浓度的计算中,我们通常使用质量浓度和摩尔浓度两种方法。
1. 质量浓度质量浓度是指单位体积溶液中溶质的质量。
它的计算公式为:质量浓度 = 溶质质量 / 溶液体积质量浓度通常用单位为g/L表示。
例如,如果有100g的盐溶解在1L的水中,则质量浓度为100g/L。
2. 摩尔浓度摩尔浓度是指单位体积溶液中溶质的摩尔量。
它的计算公式为:摩尔浓度 = 溶质的摩尔数 / 溶液体积摩尔浓度通常用单位为mol/L表示。
例如,如果有0.1mol的氢氧化钠(NaOH)溶解在1L的水中,则摩尔浓度为0.1mol/L。
二、溶液浓度的计算方法溶液浓度可以通过溶质的质量、溶质的摩尔量或溶液体积来计算。
1. 质量浓度质量浓度是指溶液中溶质的质量与溶液总质量之比。
它的计算公式为:质量浓度 = 溶质质量 / 溶液总质量质量浓度通常用单位为g/g或%表示。
例如,如果有50g的盐溶解在150g的溶液中,则质量浓度为(50g / (50g + 150g)) × 100% = 25%。
2. 摩尔浓度摩尔浓度是指溶液中溶质的摩尔量与溶液体积之比。
它的计算公式为:摩尔浓度 = 溶质的摩尔数 / 溶液体积摩尔浓度通常用单位为mol/L表示。
例如,如果有0.1mol的氢氧化钠(NaOH)溶解在1L的溶液中,则摩尔浓度为0.1mol/L。
三、溶质浓度与溶液浓度的关系溶质浓度和溶液浓度之间存在着重要的关系。
在给定溶液温度下,溶质浓度和溶液浓度之间可以通过溶质物质的相对分子质量和溶液的相对密度来换算。
1. 由溶质浓度换算到溶液浓度当已知溶质浓度时,可以通过溶质的相对分子质量和溶液的相对密度来计算溶液浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液=溶质+溶剂溶质=浓度×溶液
浓度问题等量关系:
混合前溶液的和=混合后的溶液
混合前溶质的和=混合后的溶质
1、两种酒精,甲种含水15%,乙种含水5%,现在要配成含水12%的酒精500克.每种酒精各需多少克?
2、两种药水,甲种浓度为60%,乙种浓度为90%,现要配置浓度是70%的药水300克,问两种药水各取多少克?
3、有两种酒精,一种浓度是60%,另一种浓度是90%,现在要配制成浓度为70%的酒精300克,问:两种酒精各取多少克?
4、用含药30%和75%的两种防腐药水,配制含药50%的防腐药水18kg,两种药水各需取多少
5、现有两种酒精溶液,甲种酒精溶液中纯酒精和水的质量比为3:7 ,乙种酒精溶液中纯酒精和水的质量比为4:1 ,今要得到纯酒精与水的质量比是3:2的酒精溶液50千克,问甲、乙两种酒精溶液各取多少千克?
6、H1N1流感期间,某学校用两种消毒液配制药水消毒教室,一种浓度是60%,另一种浓度是90%,现在要配制成70%的溶液300克,则这两种消毒液各要取多少克?
7、要配浓度是45%的盐水12千克,现有10%的盐水与85%的盐水,这两种盐水各需多少?
8、据研究,当洗衣机中洗衣粉的含量在0.2%~0.5%之间时,衣服的洗涤效果较好,因为这时表面活性较大.现将4.94kg的衣服放入最大容量为15kg的洗衣机中,欲使洗衣机中洗衣粉的含量达到0.4%,那么洗衣机中需要加入多少千克水,多少匙洗衣粉?(1匙洗衣粉约0.02kg,假设洗衣机以最大容量洗涤)
9、要配制浓度为15%的硫酸500公斤,已有60%的硫酸100公斤,问还需要加水和加浓度为80 %的硫酸各多少公斤?
四行程问题
1、一条公路,第一天修了全程的8分之一多5米;第二天修了全程的5分之一少14米,还剩63米,求这条公路有多长?
2、某老翁将一根长草绳剪成前、中、后三段,中段长等于前段长加后段长,后段长等于前段长加中段长的一半,现只知道前段长5m,则该草绳的中段,后段各长多少米?
.
3、甲以5km/h的速度进行有氧体育锻炼,2h后,乙骑自行车从同地出发沿同一条路追赶甲。
根据他们两人的约定,乙最快不早于1h追上甲,最慢不晚于1h15min追上甲,则乙骑车的速度应当控制在什么范围?
4、从甲地到乙地的路有一段上坡、一段平路与一段3千米长的下坡,如果保持上坡每小时走3千米,平路每小时走4千米,下坡每小时走5千米,那么从甲到乙地90分,从乙地到甲地需102分。
甲地到乙地全程是多少?
5、某班同学去18千米的北山郊游。
只有一辆汽车,需分两组,甲组先乘车、乙组步行。
车行至A处,甲组下车步行,汽车返回接乙组,最后两组同时到达北山站。
已知车速度是6 0千米/时,步行速度是4千米/时,求A点距北山的距离。
6、甲、乙两地相距80千米,一艘轮船从甲地出发顺水航行4小时到达乙地,而从乙地出发逆水航行需5小时到达甲地.求船在静水中的速度和水流的速度.
7、某列火车通过450米的铁桥,从车头上桥到车尾下桥,共33秒,同一列火车以同样的速度穿过760米长的隧道时,整列火车都在隧道里的时间是22秒,问这列火车的长度和速度分别是多少?
8、某跑道一圈长400米,若甲、乙两运动员从起点同时出发,相背而行,25秒之后相遇;若甲从起点先跑2秒,乙从该点同向出发追甲,再过3秒之后乙追上甲,求甲、乙两人的速度。
9、一艘轮船顺流航行45千米需要3小时,逆流航行65千米需要5小时,求船在静水中的速度和水流速度。
