药食同源政策法及申报、目录(20201101083056)
210种药食同源目录大全【2021版】(按功能分类)

210种药食同源目录大全【2021版】(按功能分类)中医学自古以来就有“药食同源”(又称为“医食同源”)理论——这一理论认为:许多食物既是食物也是药物,食物和药物一样同样能够防治疾病。
唐朝时期的《黄帝内经太素》一书曾写道:“空腹食之为食物,患者食之为药物”,反映出“药食同源”的思想。
《黄帝内经》中也有“大毒治病,十去其六;常毒治病,十去其七;小毒治病,十去其八;无毒治病,十去其九。
谷肉果菜,食养尽之。
”说的就是食疗对于疾病的祛除作用。
截止目前,药食同源类中药材有20种,具体品种如下:历代本草文献所载具有保健作用的食物名单:聪耳(增强或改善听力)类食物:莲子、山药、荸荠、蒲菜、芥菜、蜂蜜。
明目(增强或改善视力)类食物:山药、枸杞子、蒲菜、猪肝、羊肝、野鸭肉、青鱼、鲍鱼、螺蛳、蚌。
生发(促进头发生长)类食物:白芝麻、韭菜子、核桃仁。
润发(使头发滋润、光泽)类食物:鲍鱼。
乌须发(使须发变黑)类食物:黑芝麻、核桃仁、大麦。
长胡须(有益于不生胡须的男性)类食物:鳖肉。
美容颜(使肌肤红润、光泽)类食物:枸杞子、樱桃、荔枝、黑芝麻、山药、松子、牛奶、荷蕊。
健齿(使牙齿坚固、洁白)类食物:花椒、蒲菜、莴笋。
轻身(消肥胖)类食物:菱角、大枣、榧子、龙眼、荷叶、燕麦、青粱米。
肥人(改善瘦人体质,强身壮体)类食物:小麦、粳米、酸枣、葡萄、藕、山药、黑芝麻、牛肉。
增智(益智、健脑等)类食物:粳米、荞麦、核桃、葡萄、菠萝、荔枝、龙眼、大枣、百合、山药、茶、黑芝麻、黑木耳、乌贼鱼。
益志(增强志气)类食物:百合、山药。
安神(使精神安静、利睡眠等)类食物:莲子、酸枣、百合、梅子、荔枝、龙眼、山药、鹌鹑、牡蛎肉、黄花鱼。
增神(增强精神,减少疲倦)类食物:茶、荞麦、核桃。
增力(健力,善走等)类食物:荞麦、大麦、桑葚、榛子。
强筋骨(强健体质,包括筋骨、肌肉以及体力)类食物:栗子、酸枣、黄鳝、食盐。
耐饥(使人耐受饥饿,推迟进食时间)类食物:荞麦、松子、菱角、香菇、葡萄。
药食同源名单(卫生部)

卫生部公布药食同源物品、可用于保健食品物品名单卫生部公布《关于进一步规范保健食品原料管理的通知》中,对药食同源物品、可用于保健食品的物品和保健食品禁用物品做出具体规定。
三种物品名单如下:既是食品又是药品的87物品名单(按笔划顺序排列)丁香、八角茴香、刀豆、小茴香、小蓟、山药、山楂、马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、佛手、杏仁(甜、苦)、沙棘、牡蛎、芡实、花椒、赤小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、酸枣、黑枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、枳椇子、枸杞子、栀子、砂仁、胖大海、茯苓、香橼、香(艹下加需)、桃仁、桑叶、桑(木右加甚)、桔红、桔梗、益智仁、荷叶、莱(艹下加服)子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。
可用于保健食品的物品名单113(按笔划顺序排列)人参、人参叶、人参果、三七、土茯苓、大蓟、女贞子、山茱萸、川牛膝、川贝母、川芎、马鹿胎、马鹿茸、马鹿骨、丹参、五加皮、五味子、升麻、天门冬、天麻、太子参、巴戟天、木香、木贼、牛蒡子、牛蒡根、车前子、车前草、北沙参、平贝母、玄参、生地黄、生何首乌、白及、白术、白芍、白豆蔻、石决明、石斛(需提供可使用证明)、地骨皮、当归、竹茹、红花、红景天、西洋参、吴茱萸、怀牛膝、杜仲、杜仲叶、沙苑子、牡丹皮、芦荟、苍术、补骨脂、诃子、赤芍、远志、麦门冬、龟甲、佩兰、侧柏叶、制大黄、制何首乌、刺五加、刺玫果、泽兰、泽泻、玫瑰花、玫瑰茄、知母、罗布麻、苦丁茶、金荞麦、金樱子、青皮、厚朴、厚朴花、姜黄、枳壳、枳实、柏子仁、珍珠、绞股蓝、胡芦巴、茜草、荜茇、韭菜子、首乌藤、香附、骨碎补、党参、桑白皮、桑枝、浙贝母、益母草、积雪草、淫羊藿、菟丝子、野菊花、银杏叶、黄芪、湖北贝母、番泻叶、蛤蚧、越橘、槐实、蒲黄、蒺藜、蜂胶、酸角、墨旱莲、熟大黄、熟地黄、鳖甲。
药食同源目录大全(2022年最新版)

药食同源目录大全(2022年最新版)2020年1月2日,国家卫健委、国家市场监督管理总局发布《关于对党参等9种物质开展按照传统既是食品又是中药材的物质管理试点工作的通知》。
通知显示,根据《食品安全法》规定,经安全性评估并广泛公开征求意见,将对党参、肉苁蓉、铁皮石斛、西洋参、黄芪、灵芝、山茱萸、天麻、杜仲叶等9种物质开展按照传统既是食品又是中药材的物质(以下简称食药物质)生产经营试点工作。
根据各地试点实施情况,国家卫健委将会同国家市场监管总局,研究论证将上述物质纳入食药物质目录管理的可行性。
中医学自古以来就有“药食同源”(又称为“医食同源”)理论——这一理论认为:许多食物既是食物也是药物,食物和药物一样同样能够防治疾病。
唐朝时期的《黄帝内经太素》一书曾写道:“空腹食之为食物,患者食之为药物”,反映出“药食同源”的思想。
《黄帝内经》中也有“大毒治病,十去其六;常毒治病,十去其七;小毒治病,十去其八;无毒治病,十去其九。
谷肉果菜,食养尽之。
”说的就是食疗对于疾病的祛除作用。
此前,原卫生部公布《关于进一步规范保健食品原料管理的通知》,对药食同源物品、可用于保健食品的物品和保健食品禁用物品做出具体规定。
三种物品名单如下:卫健委公布的既是食品又是药品的中药名单:丁香、八角、茴香、刀豆、小茴香、小蓟、山药、山楂、马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、佛手、杏仁、沙棘、芡实、花椒、红小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、黑枣、酸枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、枳子、枸杞子、栀子、砂仁、胖大海、茯苓、香橼、香薷、桃仁、桑叶、桑葚、桔红、桔梗、益智仁、荷叶、莱菔子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。
药食同源目录大全(2020年最新版)

药食同源目录大全(2020年最新版)2020年1月2日,国家卫健委、国家市场监督管理总局发布《关于对党参等9种物质开展按照传统既是食品又是中药材的物质管理试点工作的通知》。
通知显示,根据《食品安全法》规定,经安全性评估并广泛公开征求意见,将对党参、肉苁蓉、铁皮石斛、西洋参、黄芪、灵芝、山茱萸、天麻、杜仲叶等9种物质开展按照传统既是食品又是中药材的物质(以下简称食药物质)生产经营试点工作。
根据各地试点实施情况,国家卫健委将会同国家市场监管总局,研究论证将上述物质纳入食药物质目录管理的可行性。
中医学自古以来就有“药食同源”(又称为“医食同源”)理论——这一理论认为:许多食物既是食物也是药物,食物和药物一样同样能够防治疾病。
唐朝时期的《黄帝内经太素》一书曾写道:“空腹食之为食物,患者食之为药物”,反映出“药食同源”的思想。
《黄帝内经》中也有“大毒治病,十去其六;常毒治病,十去其七;小毒治病,十去其八;无毒治病,十去其九。
谷肉果菜,食养尽之。
”说的就是食疗对于疾病的祛除作用。
此前,原卫生部公布《关于进一步规范保健食品原料管理的通知》,对药食同源物品、可用于保健食品的物品和保健食品禁用物品做出具体规定。
三种物品名单如下:卫健委公布的既是食品又是药品的中药名单:丁香、八角、茴香、刀豆、小茴香、小蓟、山药、山楂、马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、佛手、杏仁、沙棘、芡实、花椒、红小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、黑枣、酸枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、枳子、枸杞子、栀子、砂仁、胖大海、茯苓、香橼、香薷、桃仁、桑叶、桑葚、桔红、桔梗、益智仁、荷叶、莱菔子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。
药食同源目录表

药食同源品种名称既是食品又是药品的物品名单(按拼音顺序排列)87种B 八角茴香、白芷、白果、白扁豆、白扁豆花、百合、薄荷。
C 赤小豆。
D 丁香、刀豆、代代花、淡竹叶、淡豆豉。
E 阿胶。
F 佛手、茯苓、蜂蜜、榧子、蝮蛇、覆盆子。
G 甘草、枸杞子、高良姜、葛根。
H 花椒、荷叶、黄芥子、黄精、黑芝麻、黑胡椒、槐米、槐花、藿香。
J 决明子、鸡内金、金银花、姜(生姜、干姜)、桔红、桔梗、菊花、菊苣、橘皮。
K 昆布。
L 龙眼肉(桂圆)、罗汉果、莱菔子、莲子。
M 马齿苋、木瓜、火麻仁、牡蛎、麦芽。
P 胖大海、蒲公英。
Q 芡实、青果。
R 肉豆蔻、肉桂。
S 山药、山楂、沙棘、砂仁、桑叶、桑椹、酸枣仁。
T 桃仁。
W 乌梢蛇、乌梅。
X 小茴香、小蓟、杏仁(甜、苦)、香橼、香薷、鲜白茅根、鲜芦根、薤白。
Y 玉竹、余甘子、郁李仁、鱼腥草、益智仁、薏苡仁。
Z 枣(大枣、酸枣、黑枣)、枳椇子、栀子、紫苏、紫苏籽。
可用于保健食品的物品名单(按拼音顺序排列)114种B 巴戟天、北沙参、白及、白术、白芍、白豆蔻、补骨脂、柏子仁、荜茇、鳖甲。
C 川牛膝、川贝母、川芎、车前子、车前草、苍术、赤芍、侧柏叶、刺五加、刺玫果。
D 大蓟、丹参、地骨皮、当归、杜仲、杜仲叶、党参。
F 番泻叶、蜂胶。
G 龟甲、骨碎补、蛤蚧。
H 红花、红景天、怀牛膝、厚朴、厚朴花、胡芦巴、黄芪、湖北贝母、槐实。
J 金荞麦、金樱子、姜黄、绞股蓝、韭菜子、积雪草、蒺藜。
K 诃子、苦丁茶。
L 罗布麻、芦荟。
M 马鹿胎、马鹿茸、马鹿骨、木香、木贼、牡丹皮、麦门冬、玫瑰花、玫瑰茄、墨旱莲。
N 女贞子、牛蒡子、牛蒡根。
P 平贝母、佩兰、蒲黄。
Q 青皮、茜草、R 人参、人参叶、人参果。
S 三七、山茱萸、升麻、生地黄、生何首乌、石决明、石斛(需提供可使用证明)、沙苑子、首乌藤、桑白皮、桑枝、酸角、熟大黄、熟地黄。
T 土茯苓、天门冬、天麻、太子参、菟丝子。
W 五加皮、五味子、吴茱萸。
201种药食同源目录表.pdf

201种药食同源目录表一、既是食品又是药品的物品名单(按拼音顺序排列)87种1.八角茴香:八角茴香的果实主治寒疝腹痛、腰膝冷痛、胃寒呕吐、脘腹疼痛、寒湿脚气等。
对于治疗小肠气坠、疝气偏坠、腰重刺胀、腰病如刺、大小便皆秘,腹胀如鼓,气促、风毒湿气,攻疰成疮,皮肉紫破脓坏,行步无力,皮肉燥热等有显著效果。
①八角茴香的主要成分是茴香油,它能刺激胃肠神经血管,促进消化液分泌,增加胃肠蠕动,有健胃、行气的功效,有助于缓解痉挛、减轻疼痛的作用;②茴香烯能促进骨髓细胞成熟并释放入外周血液,有明显的升高白细胞的作用,主要是升高中性粒细胞,可用于白细胞减少症的作用。
2.白芷:根入药,有祛病除湿、排脓生肌、活血止痛等功能。
主治风寒感冒、头痛、鼻炎、牙痛。
赤白带下、痛疖肿毒等症3.白果:1、中医认为,白果能敛肺气、定痰喘、止带浊、止泻泄、解毒、缩小便,主治哮喘痰嗽、带下白浊、小便频数、遗尿等。
2、白果具有通畅血管、保护肝脏、改善大脑功能、润皮肤、抗衰老、治疗老年痴呆症和脑供血不足等功效。
3、白果含有多种营养元素,除蛋白质、脂肪、糖类之外,还含有维生素C、维生素B2、胡萝卜素、钙、磷、铁、钾、镁等微量元素,以及银杏酸、白果酚、多糖等成分。
4、白果可治疗座疮,其中所含的苦内脂等对脑血栓、高血压、冠心病等有特殊的疗效。
适用分量每次10克左右。
一般人均可食用,特别适合尿频者,体虚白带的女生。
有实邪者忌服。
生食或炒食过量可致中毒,小儿误服中毒尤为常见。
5、白果可以滋阴养颜抗衰老,使人肌肤、面部红润。
4.白扁豆:健脾化湿,和中消暑。
用于脾胃虚弱,食欲不振,大便溏泻,白带过多,暑湿吐泻,胸闷腹胀。
炒白扁豆健脾化湿。
用于脾虚泄泻,白带过多。
5.白扁豆花:健脾和胃,消暑化湿。
6.百合:百合除含有蛋白质21.29%、脂肪12.43%、还原糖11.47%、淀粉 1.61%,及钙、磷、铁、每百克含 1.443毫克维生素B、21.2毫克维生素C等营养素外,还含有一些特殊的营养成分,如秋水仙碱等多种生物碱。
药食同源目录大全(2020年最新版)

药食同源目录大全(2020年最新版)《药食同源名单》(新增6种物质2020年最新版)1、藿香2、覆盆子3、薤白4、薏苡仁5、薄荷6、橘皮7、蝮蛇8、鲜芦根9、槐米10、鲜白茅根11、酸枣仁12、榧子13、蜂蜜14、蒲公英15、槐花16、黑胡椒17、黑芝麻18、葛根19、紫苏籽20、紫苏21、黄精22、黄芥子23、菊苣24、菊花25、淡豆豉26、淡竹叶27、高良姜28、莲子29、莱菔子30、荷叶31、益智仁32、桔梗33、桔红34、桑椹35、香薷36、香橼37、桃仁38、茯苓39、胖大海40、砂仁41、栀子42、枸杞子43、枳椇子44、姜(生姜、干姜)45、鱼腥草46、青果47、金银花48、郁李仁49、罗汉果50、枣(大枣、酸枣、黑枣)51、昆布52、麦芽53、鸡内金54、阿胶55、赤小豆56、花椒57、芡实58、桑叶59、牡蛎60、沙棘61、杏仁(甜、苦)62、佛手63、余甘子64、肉桂65、肉豆蔻66、百合67、决明子68、龙眼肉(桂圆)69、白扁豆花70、白扁豆71、白果72、白芷73、甘草74、玉竹75、代代花76、火麻仁77、木瓜78、乌梅79、乌梢蛇80、马齿苋81、山楂82、山药83、小蓟84、小茴香85、刀豆86、八角茴香87、丁香关于当归等6种新增按照传统既是食品又是中药材的物质公告(2019年第8号)备注:列入按照传统既是食品又是中药材的物质目录的物质,作为食品生产经营,应当符合《食品安全法》的规定。
关于对党参等9种物质开展按照传统既是食品又是中药材的物质管理试点工作的通知 (国卫食品函〔2019〕311号)各省、自治区、直辖市及新疆生产建设兵团卫生健康委、市场监管局(厅、委):根据《食品安全法》规定,经安全性评估并广泛公开征求意见,将对党参、肉苁蓉、铁皮石斛、西洋参、黄芪、灵芝、山茱萸、天麻、杜仲叶等9种物质开展按照传统既是食品又是中药材的物质(以下简称食药物质)生产经营试点工作。
国家卫健委发布药食同源目录管理规定.docx

国家卫健委发布药食同源目录管理规定11月15日,卫健委印发《按照传统既是食品乂是中药材的物质目录管理规定》的通知。
本规定自发布之日起实施。
主要内容:食药物质的定义范围。
食药物质是指传统作为食品,且列入《中华人民共和国药典》的物质。
食药物质除了平安性评价证明其平安之外,还要符合全国人大常委会关于全面禁止非法野生动物交易、革除滥食野生动物陋习决定的精神,符合中药材资源保护、野生动植物保护、生态保护等相关法律法规规定。
平安性评价程序和要求。
省级卫生健康行政部门提出扩增或调整食药物质目录的建议,同时应提供具有传统食用历史的证明、食用平安性评价资料等材料。
国家技术机构对地方扩增或调整食药物质目录的建议材料进行技术审查,结合各方意见、社会稳定性风险评估等提出综合审评意见和建议。
风险监测和动态管理制度。
为做好对新纳入目录物质的跟踪管理,要求地方对新纳入食药物质目录的物质开展食品平安风险监测,及时报告发现的不应反响等信息。
结合风险监测结果,以及具体规定的3种需要研究修订目录的情形,必要时对食药物质目录进行调整,实施动态管理。
按照传统既是食品又是中药材的物质目录管理规定第一条根据《中华人民共和国食品平安法》及其实施条例,为规范按照传统既是食品又是中药材的物质(以下简称食药物质)目录管理,制定本规定。
第二条以保障食品平安和维护公众健康为宗旨,遵循依法、科学、公开的原那么制定食药物质目录并适时更新。
第三条食药物质是指传统作为食品,且列入《中华人民共和国药典》(以下简称《中国药典》)的物质。
第四条国家卫生健康委会同市场监管总局制定、公布食药物质目录,对目录实施动态管理。
第五条纳入食药物质目录的物质应当符合以下要求:(一)有传统上作为食品食用的习惯;(二)已经列入《中国药典》;(三)平安性评估未发现食品平安问题;(四)符合中药材资源保护、野生动植物保护、生态保护等相关法律法规规定。
第六条省级卫生健康行政部门结合本辖区情况,向国家卫生健康委提出修订或增补食药物质目录的建议,同时提供以下材料:(-)物质的基本信息(中文名、拉丁学名、所属科名、食用部位等);(-)传统作为食品的证明材料(证明己有30年以上作为食品食用的历史);(三)加工和食用方法等资料;(四)平安性评估资料;(五)执行的质量规格和食品平安指标。
关于药食同源的所有相关目录大全

关于药食同源的所有相关目录大全药食同源中药目录卫健委公布的既是食品又是药品的中药名单:卫健委公布的既是食品又是药品的中丁香、八角、茴香、刀豆、小茴香、小蓟、山药、山楂、马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、佛手、杏仁、沙棘、芡实、花椒、红小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、黑枣、酸枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、枳子、枸杞子、栀子、砂仁、胖大海、茯苓、香橼、香薷、桃仁、桑叶、桑葚、桔红、桔梗、益智仁、荷叶、莱菔子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。
(以上为2012年公示的86种)2014新增15种中药材物质:人参、山银花、芫荽、玫瑰花、松花粉、粉葛、布渣叶、夏枯草、当归、山奈、西红花、草果、姜黄、荜茇,在限定使用范围和剂量内作为药食两用。
2018新增9种中药材物质作为按照传统既是食品又是中药材物名单:党参、肉苁蓉、铁皮石斛、西洋参、黄芪、灵芝、天麻、山茱萸、杜仲叶,在限定使用范围和剂量内作为药食两用。
卫健委公布的可用于保健食品的中药名单:人参、人参叶、人参果、三七、土茯苓、大蓟、女贞子、山茱萸、川牛膝、川贝母、川芎、马鹿胎、马鹿茸、马鹿骨、丹参、五加皮、五味子、升麻、天门冬、天麻、太子参、巴戟天、木香、木贼、牛蒡子、牛蒡根、车前子、车前草、北沙参、平贝母、玄参、生地黄、生何首乌、白及、白术、白芍、白豆蔻、石决明、石斛、地骨皮、当归、竹茹、红花、红景天、西洋参、吴茱萸、怀牛膝、杜仲、杜仲叶、沙苑子、牡丹皮、芦荟、苍术、补骨脂、坷子、赤芍、远志、麦冬、龟甲、佩兰、侧柏叶、制大黄、制何首乌、刺五加、刺玫果、泽兰、泽泻、玫瑰花、玫瑰茄、知母、罗布麻、苦丁茶、金荞麦、金缨子、青皮、厚朴花、姜黄、枳壳、枳实、柏子仁、珍珠、绞股蓝、葫芦巴、茜草、筚茇、韭菜子、首乌藤、香附、骨碎补、党参、桑白皮、桑枝、浙贝母、益母草、积雪草、淫羊藿、菟丝子、野菊花、银杏叶、黄芪、湖北贝母、番泻叶、蛤蚧、越橘、槐实、蒲黄、蒺藜、蜂胶、酸角、墨旱莲、熟大黄、熟地黄、鳖甲。
药食同源目录

药食同源目录2007-2-27 12:20:00卫生部公布《关于进一步规范保健食品原料管理的通知》中,对药食同源物品、可用于保健食品的物品和保健食品禁用物品做出具体规定。
三种物品名单如下:既是食品又是药品的物品名单(按笔划顺序排列)丁香、八角茴香、刀豆、小茴香、小蓟、山药、山楂、马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、佛手、杏仁(甜、苦)、沙棘、牡蛎、芡实、花椒、赤小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、酸枣、黑枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、枳椇子、枸杞子、栀子、砂仁、胖大海、茯苓、香橼、香薷、桃仁、桑叶、桑葚、桔红、桔梗、益智仁、荷叶、莱菔子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。
可用于保健食品的物品名单(按笔划顺序排列)人参、人参叶、人参果、三七、土茯苓、大蓟、女贞子、山茱萸、川牛膝、川贝母、川芎、马鹿胎、马鹿茸、马鹿骨、丹参、五加皮、五味子、升麻、天门冬、天麻、太子参、巴戟天、木香、木贼、牛蒡子、牛蒡根、车前子、车前草、北沙参、平贝母、玄参、生地黄、生何首乌、白及、白术、白芍、白豆蔻、石决明、石斛(需提供可使用证明)、地骨皮、当归、竹茹、红花、红景天、西洋参、吴茱萸、怀牛膝、杜仲、杜仲叶、沙苑子、牡丹皮、芦荟、苍术、补骨脂、诃子、赤芍、远志、麦门冬、龟甲、佩兰、侧柏叶、制大黄、制何首乌、刺五加、刺玫果、泽兰、泽泻、玫瑰花、玫瑰茄、知母、罗布麻、苦丁茶、金荞麦、金樱子、青皮、厚朴、厚朴花、姜黄、枳壳、枳实、柏子仁、珍珠、绞股蓝、胡芦巴、茜草、荜茇、韭菜子、首乌藤、香附、骨碎补、党参、桑白皮、桑枝、浙贝母、益母草、积雪草、淫羊藿、菟丝子、野菊花、银杏叶、黄芪、湖北贝母、番泻叶、蛤蚧、越橘、槐实、蒲黄、蒺藜、蜂胶、酸角、墨旱莲、熟大黄、熟地黄、鳖甲。
卫生部最新的药食同源的目录

卫生部最新的药食同源的目录
(1)中草药和其他植物
人参、党参、西洋参、黄芪、首乌、大黄、芦荟、枸杞子、巴戟天、荷叶、菊花、五味子、桑椹、薏苡仁、茯苓、广木香、银杏、白芷、百合、山苍籽油、山药、鱼腥草、绞股蓝、红景天、莼菜、松花粉、草珊瑚、山茱萸汁、甜味藤、芦根、生地、麦芽、麦胚、桦树汁、韭菜籽、黑豆、黑芝麻、白芍、竹笋、益智仁
(2)果品类
大枣、山楂、猕猴桃、罗汉果、沙棘、火棘果、野苹果
(3)茶类
金银花茶、草木咖啡、红豆茶、白马蓝茶、北芪茶、五味参茶、金花茶、胖大海、凉茶、罗汉果苦丁茶、南参茶、参杞茶、牛蒡健身茶
(4)菌藻类
乳酸菌、脆弱拟杆菌(BF-839)、螺旋藻、酵母、冬虫夏草、紫红曲、灵芝、香菇
(5)畜禽类
熊胆、乌骨鸡
(6)海产品类
海参、牡蛎、海马、海窝
(7)昆虫爬虫类
蚂蚁、蜂花粉、蜂花乳、地龙、蝎子、壁虎、蜻蜒、昆虫蛋白、蛇胆、蛇精
(8)矿物质与微量元素类
珍珠、钟乳石、玛瑙、龙骨、龙齿、金箔、硒、碘、氟、倍半氧化羧乙基锗(Ge-132)、赖氨酸锗
(9)其它类
牛磺酸、SOD、变性脂肪、磷酸果糖、左旋肉碱。
卫生部药食同源目录

卫生部药食同源目录卫生部药食同源目录(备忘)卫生部今天公布《关于进一步规范保健食品原料管理的通知》中,对药食同源物品、可用于保健食品的物品和保健食品禁用物品做出具体规定。
三种物品名单如下:既是食品又是药品的物品名单(按笔划顺序排列)丁香、八角茴香、刀豆、小茴香、小蓟、山药、山楂、马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、佛手、杏仁(甜、苦)、沙棘、牡蛎、芡实、花椒、赤小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、酸枣、黑枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、枳椇子、枸杞子、栀子、砂仁、胖大海、茯苓、香橼、香(艹下加需)、桃仁、桑叶、桑(木右加甚)、桔红、桔梗、益智仁、荷叶、莱(艹下加服)子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。
可用于保健食品的物品名单(按笔划顺序排列)人参、人参叶、人参果、三七、土茯苓、大蓟、女贞子、山茱萸、川牛膝、川贝母、川芎、马鹿胎、马鹿茸、马鹿骨、丹参、五加皮、五味子、升麻、天门冬、天麻、太子参、巴戟天、木香、木贼、牛蒡子、牛蒡根、车前子、车前草、北沙参、平贝母、玄参、生地黄、生何首乌、白及、白术、白芍、白豆蔻、石决明、石斛(需提供可使用证明)、地骨皮、当归、竹茹、红花、红景天、西洋参、吴茱萸、怀牛膝、杜仲、杜仲叶、沙苑子、牡丹皮、芦荟、苍术、补骨脂、诃子、赤芍、远志、麦门冬、龟甲、佩兰、侧柏叶、制大黄、制何首乌、刺五加、刺玫果、泽兰、泽泻、玫瑰花、玫瑰茄、知母、罗布麻、苦丁茶、金荞麦、金樱子、青皮、厚朴、厚朴花、姜黄、枳壳、枳实、柏子仁、珍珠、绞股蓝、胡芦巴、茜草、荜茇、韭菜子、首乌藤、香附、骨碎补、党参、桑白皮、桑枝、浙贝母、益母草、积雪草、淫羊藿、菟丝子、野菊花、银杏叶、黄芪、湖北贝母、番泻叶、蛤蚧、越橘、槐实、蒲黄、蒺藜、蜂胶、酸角、墨旱莲、熟大黄、熟地黄、鳖甲。
药食同源、保健品、食品禁用目录表

既是食品又是药品的物品名单(按拼音顺序排列) 87既是食品又是药品的物品名单B八角茴香、白芷、白果、白扁豆、白扁豆花、百合、薄荷。
C赤小豆。
D丁香、刀豆、代代花、淡竹叶、淡豆豉。
E阿胶。
F佛手、茯苓、蜂蜜、榧子、蝮蛇、覆盆子。
G甘草、枸杞子、高良姜、葛根。
H花椒、荷叶、黄芥子、黄精、黑芝麻、黑胡椒、槐米、槐花、藿香。
J决明子、鸡内金、金银花、姜(生姜、干姜)、桔红、桔梗、菊花、菊苣、橘皮。
K昆布。
L龙眼肉(桂圆)、罗汉果、莱菔子、莲子。
M马齿苋、木瓜、火麻仁、牡蛎、麦芽。
P胖大海、蒲公英。
Q芡实、青果。
R肉豆蔻、肉桂。
S山药、山楂、沙棘、砂仁、桑叶、桑椹、酸枣仁。
T桃仁。
W 乌梢蛇、乌梅。
X 小茴香、小蓟、杏仁(甜、苦)、香橼、香薷、鲜白茅根、鲜芦根、薤白。
Y玉竹、余甘子、郁李仁、鱼腥草、益智仁、薏苡仁。
Z枣(大枣、酸枣、黑枣)、枳椇子、栀子、紫苏、紫苏籽。
可用于保健食品的物品名单(按拼音顺序排列) 114 B巴戟天、北沙参、白及、白术、白芍、白豆蔻、补骨脂、柏子仁、荜茇、鳖甲。
C川牛膝、川贝母、川芎、车前子、车前草、苍术、赤芍、侧柏叶、刺五加、刺玫果。
D大蓟、丹参、地骨皮、当归、杜仲、杜仲叶、党参。
F番泻叶、蜂胶。
G龟甲、骨碎补、蛤蚧。
H红花、红景天、怀牛膝、厚朴、厚朴花、胡芦巴、黄芪、湖北贝母、槐实。
J金荞麦、金樱子、姜黄、绞股蓝、韭菜子、积雪草、蒺藜。
K诃子、苦丁茶。
L罗布麻、芦荟。
M马鹿胎、马鹿茸、马鹿骨、木香、木贼、牡丹皮、麦门冬、玫瑰花、玫瑰茄、墨旱莲。
N女贞子、牛蒡子、牛蒡根。
P平贝母、佩兰、蒲黄。
Q青皮、茜草、R人参、人参叶、人参果。
S三七、山茱萸、升麻、生地黄、生何首乌、石决明、石斛(需提供可使用证明)、沙苑子、首乌藤、桑白皮、桑枝、酸角、熟大黄、熟地黄。
T土茯苓、天门冬、天麻、太子参、菟丝子。
W五加皮、五味子、吴茱萸。
X玄参、西洋参、香附。
Y远志、益母草、淫羊藿、野菊花、银杏叶、越橘。
药食同源目录大全(2020年最新版)
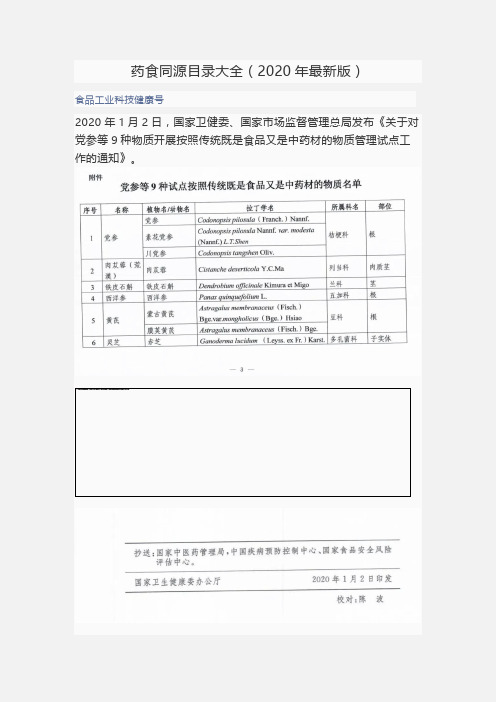
药食同源目录大全(2020年最新版)食品工业科技健康号2020年1月2日,国家卫健委、国家市场监督管理总局发布《关于对党参等9种物质开展按照传统既是食品又是中药材的物质管理试点工作的通知》。
通知显示,根据《食品安全法》规定,经安全性评估并广泛公开征求意见,将对党参、肉苁蓉、铁皮石斛、西洋参、黄芪、灵芝、山茱萸、天麻、杜仲叶等9种物质开展按照传统既是食品又是中药材的物质(以下简称食药物质)生产经营试点工作。
根据各地试点实施情况,国家卫健委将会同国家市场监管总局,研究论证将上述物质纳入食药物质目录管理的可行性。
中医学自古以来就有“药食同源”(又称为“医食同源”)理论——这一理论认为:许多食物既是食物也是药物,食物和药物一样同样能够防治疾病。
唐朝时期的《黄帝内经太素》一书曾写道:“空腹食之为食物,患者食之为药物”,反映出“药食同源”的思想。
《黄帝内经》中也有“大毒治病,十去其六;常毒治病,十去其七;小毒治病,十去其八;无毒治病,十去其九。
谷肉果菜,食养尽之。
”说的就是食疗对于疾病的祛除作用。
此前,原卫生部公布《关于进一步规范保健食品原料管理的通知》,对药食同源物品、可用于保健食品的物品和保健食品禁用物品做出具体规定。
三种物品名单如下:卫健委公布的既是食品又是药品的中药名单:丁香、八角、茴香、刀豆、小茴香、小蓟、山药、山楂、马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、佛手、杏仁、沙棘、芡实、花椒、红小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、黑枣、酸枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、枳子、枸杞子、栀子、砂仁、胖大海、茯苓、香橼、香薷、桃仁、桑叶、桑葚、桔红、桔梗、益智仁、荷叶、莱菔子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。
卫计委最新公布了101种药食同源名单(保健食品药品)

卫计委最新公布了101种药食同源名单(保健食品药品)卫计委最新公布了101种药食同源名单2020-01-05共有86种药品被列入了药食同源名单,此次新增加了15种,包括人参、山银花、玫瑰花、夏枯草等。
其中,《原卫生部2012年第17号公告》批准人参(人工种植)为新资源食品,此次也被列为药食同源食品。
序号物质名称植物名/动物名南方医科大学南方医院放疗科张耀伟1 丁香丁香2八角茴香八角茴香3 刀豆刀豆4 小茴香茴香5 小蓟刺儿菜6 山药薯蓣7 山楂山里红8 马齿苋马齿苋9 乌梅梅10 木瓜贴梗海棠11 火麻仁大麻12 代代花代代花13 玉竹玉竹14 甘草甘草胀果甘草光果甘草15 白芷白芷杭白芷16 白果银杏17 白扁豆扁豆18 白扁豆花扁豆19 龙眼肉(桂圆)龙眼20 决明子决明子小决明21 百合卷丹百合细叶百合22 肉豆蔻肉豆蔻23 肉桂肉桂24 余甘子余甘子25 佛手佛手26 杏仁(苦、甜)山杏西伯利亚杏东北杏杏27 沙棘沙棘28 芡实芡29 花椒青椒花椒30 赤小豆赤小豆赤豆31 麦芽大麦32 昆布海带昆布33 枣(大枣、黑枣)枣34 罗汉果罗汉果35 郁李仁欧李郁李长柄扁桃36 金银花忍冬37 青果橄榄38 鱼腥草蕺菜39 姜(生姜、干姜)姜40 枳椇子枳椇41 枸杞子宁夏枸杞42 栀子栀子43 砂仁阳春砂绿壳砂海南砂44 胖大海胖大海45 茯苓茯苓46 香橼枸橼香圆47 香薷石香薷江香薷48 桃仁桃山桃49 桑叶桑50 桑椹桑51 桔红(橘红)橘及其栽培变种52 桔梗桔梗53 益智仁益智54 荷叶莲55 莱菔子萝卜56 莲子莲57 高良姜高良姜58 淡竹叶淡竹叶59 淡豆豉大豆60 菊花菊61 菊苣毛菊苣菊苣62 黄芥子芥63 黄精滇黄精黄精多花黄精64 紫苏紫苏65 紫苏子(籽)紫苏66 葛根野葛67 黑芝麻脂麻68 黑胡椒胡椒69 槐花、槐米槐70 蒲公英蒲公英碱地蒲公英同属数种植物71 榧子榧72 酸枣、酸枣仁酸枣73 鲜白茅根(或干白茅根)白茅74 鲜芦根(或干芦根)芦苇75 橘皮(或陈皮)橘及其栽培变种76 薄荷薄荷薄荷77 薏苡仁薏苡78 薤白小根蒜薤79 覆盆子华东覆盆子80 藿香广藿香81 乌梢蛇乌梢蛇82 牡蛎长牡蛎大连湾牡蛎近江牡蛎83 阿胶驴84 鸡内金家鸡85 蜂蜜中华蜜蜂意大利蜂86 蝮蛇(蕲蛇)五步蛇新增中药材物质新增中药材物质1 人参人参2 山银花华南忍冬红腺忍冬灰毡毛忍冬黄褐毛忍冬3 芫荽芫荽4 玫瑰花玫瑰5 松花粉马尾松6 油松同属种植物7 粉葛甘葛藤8 布渣叶破布叶9 夏枯草夏枯草10 当归当归11 山奈山奈12 西红花藏红花13 草果草果14 姜黄姜黄15 荜茇荜茇。
2021年卫生部药食同源药物目录

卫生部对药食同源物品的界定欧阳光明(2021.03.07)卫生部公布的《关于进一步规范保健食品原料管理的通知》中,对药食同源物品、可用于保健食品的物品和保健食品禁用物品做出具体规定。
三种物品名单如下:既是食品又是药品的物品名单(按笔划顺序排列)丁香、八角茴香、刀豆、小茴香、小蓟、山药、山楂、马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、佛手、杏仁(甜、苦)、沙棘、牡蛎、芡实、花椒、赤小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、酸枣、黑枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、枳椇子、枸杞子、栀子、砂仁、胖大海、茯苓、香橼、香薷、桃仁、桑叶、桑椹、桔红、桔梗、益智仁、荷叶、莱菔子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。
可用于保健食品的物品名单(按笔划顺序排列)人参、人参叶、人参果、三七、土茯苓、大蓟、女贞子、山茱萸、川牛膝、川贝母、川芎、马鹿胎、马鹿茸、马鹿骨、丹参、五加皮、五味子、升麻、天门冬、天麻、太子参、巴戟天、木香、木贼、牛蒡子、牛蒡根、车前子、车前草、北沙参、平贝母、玄参、生地黄、生何首乌、白及、白术、白芍、白豆蔻、石决明、石斛(需提供可使用证明)、地骨皮、当归、竹茹、红花、红景天、西洋参、吴茱萸、怀牛膝、杜仲、杜仲叶、沙苑子、牡丹皮、芦荟、苍术、补骨脂、诃子、赤芍、远志、麦门冬、龟甲、佩兰、侧柏叶、制大黄、制何首乌、刺五加、刺玫果、泽兰、泽泻、玫瑰花、玫瑰茄、知母、罗布麻、苦丁茶、金荞麦、金樱子、青皮、厚朴、厚朴花、姜黄、枳壳、枳实、柏子仁、珍珠、绞股蓝、胡芦巴、茜草、荜茇、韭菜子、首乌藤、香附、骨碎补、党参、桑白皮、桑枝、浙贝母、益母草、积雪草、淫羊藿、菟丝子、野菊花、银杏叶、黄芪、湖北贝母、番泻叶、蛤蚧、越橘、槐实、蒲黄、蒺藜、蜂胶、酸角、墨旱莲、熟大黄、熟地黄、鳖甲。
卫生部公布的药食同源

卫生部公布的《关于进一步规范保健食品原料管理的通知》中,对药食同源物品、可用于保健食品的物品和保健食品禁用物品做出具体规定。
三种物品名单如下:既是食品又是药品的物品名单(按笔划顺序排列)丁香、八角茴香、刀豆、小茴香、小蓟、山药、山楂、马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、佛手、杏仁(甜、苦)、沙棘、牡蛎、芡实、花椒、赤小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、酸枣、黑枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、枳椇子、枸杞子、栀子、砂仁、胖大海、茯苓、香橼、香薷、桃仁、桑叶、桑椹、桔红、桔梗、益智仁、荷叶、菜菔子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。
可用于保健食品的物品名单(按笔划顺序排列)人参、人参叶、人参果、三七、土茯苓、大蓟、女贞子、山茱萸、川牛膝、川贝母、川芎、马鹿胎、马鹿茸、马鹿骨、丹参、五加皮、五味子、升麻、天门冬、天麻、太子参、巴戟天、木香、木贼、牛蒡子、牛蒡根、车前子、车前草、北沙参、平贝母、玄参、生地黄、生何首乌、白及、白术、白芍、白豆蔻、石决明、石斛(需提供可使用证明)、地骨皮、当归、竹茹、红花、红景天、西洋参、吴茱萸、怀牛膝、杜仲、杜仲叶、沙苑子、牡丹皮、芦荟、苍术、补骨脂、诃子、赤芍、远志、麦门冬、龟甲、佩兰、侧柏叶、制大黄、制何首乌、刺五加、刺玫果、泽兰、泽泻、玫瑰花、玫瑰茄、知母、罗布麻、苦丁茶、金荞麦、金樱子、青皮、厚朴、厚朴花、姜黄、枳壳、枳实、柏子仁、珍珠、绞股蓝、胡芦巴、茜草、荜茇、韭菜子、首乌藤、香附、骨碎补、党参、桑白皮、桑枝、浙贝母、益母草、积雪草、淫羊藿、菟丝子、野菊花、银杏叶、黄芪、湖北贝母、番泻叶、蛤蚧、越橘、槐实、蒲黄、蒺藜、蜂胶、酸角、墨旱莲、熟大黄、熟地黄、鳖甲。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
我国药食同源政策法规及申报要求一、药食同源的概念中国中医自古以来就有“药食同源”又称“医食同源”的理论。
这一理论认为许多食物既是食物又是药物。
食物和药物一样,同样能防治疾病。
在原始社会中,人们在寻找食物的过程中发现了各种食物和药物的性味和功效,认识到许多食物可以药用,许多药物也可以食用,这两者之间很难严格区分的。
卫生部于2000 年规范《既是食品又是药品的物品名单》共87 种,《可用于保健食品的物品名单》共114 种,由此可见,从古至今都有“药食同源”的理论,也是食物疗法的实践与理论基础。
现在人们理解的“药食同源”即指进入卫生部于2000 年公布的《既是食品又是药品的物品名单》的传统中药材。
二、与食品相关的法律法规目前我国已经颁布实施的涉及到食品、保健食品、新资源食品的法律法规有:国务院颁布的《中华人民共和国食品安全法》(2009年6月1日起施行);卫生部颁布的《新资源食品管理办法》(2007 年12 月1 日起施行);《卫生部关于进一步规范保健食品原料管理的通知》(卫法监发[2002 ] 51 号);《禁止食品加药卫生管理办法》(1987 年10 月22 日);中华人民共和国国家标准《食品安全性毒理学评价程序》(GB15193.1-1994 );国家食品药品监督管理局颁布的《保健食品注册管理办法(试行)》(局令第19 号)(2005 年4 月30 日)等一系列相关法规,建立了比较完善的法律法规体系。
三、如何申报药食同源目录1、我国《既是食品又是药品的物品名单》由卫生部发布,按动态管理。
没有相关的申报要求,一般应该由省级卫生部门向国家卫生部提出申请。
提交资料一般应该包括食用历史、食品安全性毒理学评价(急性毒性试验、蓄积毒性和致突变试验、亚慢性毒性和代谢试验)、接触人群流行病学调查等研究资料。
2 、新资源食品申报有企业按卫生部颁布的《新资源食品管理办法》要求向国家卫生部申报。
按照国家卫生部《禁止食品加药卫生管理办法》第六条规定“利用中药材作食品新资源者,报请审批时除《食品新资源卫生管理办法》第三条要求的资料外,还应提供其药理作用的特殊针对性指标的试验资料。
其安全性毒理学评价资料要求如下:(1)在古代医籍中有两部以上食疗本草记载无毒性、无服用禁忌(包括不宜久食)的品种,提供《食品安全性毒理学评价程序》第一、第二阶段的试验资料。
(2 )在古代医籍中无食疗记载的属于生物性原料的品种,提供《食品安全性毒理学评价程序》第一、第二、第三阶段的试验资料。
3、按照国家卫生部《禁止食品加药卫生管理办法》第七条规定,“在《食品卫生法》(1995 年10 月30 日发布实施)生效以前,传统上把药物作为添加成份加入,不宣传疗效并有三十年以上连续生产历史的定型包装食品品种,经所在地省、自治区、直辖市卫生行政部门批准并向卫生部备案,可以销售,销售地区不限。
”文山三七相关食品可以根据此条款由相关企业向省生卫生厅申请批准并报国家卫生部备案。
文山州食品药品监督管理局二00 九年十二月十五日中华人民共和国卫生部令第56 号《新资源食品管理办法》已于自2006 年12 月26 日经卫生部部务会议讨论通过,现予以发布,2007 年12 月1 日起施行。
部长陈竺二OO七年七月二日新资源食品管理办法第一章总则第一条为加强对新资源食品的监督管理,保障消费者身体健康,根据《中华人民共和国食品卫生法》(以下简称《食品卫生法》),制定本办法。
第二条本办法规定的新资源食品包括:(一)在我国无食用习惯的动物、植物和微生物;(二)从动物、植物、微生物中分离的在我国无食用习惯的食品原料;(三)在食品加工过程中使用的微生物新品种;(四)因采用新工艺生产导致原有成分或者结构发生改变的食品原料。
第三条新资源食品应当符合《食品卫生法》及有关法规、规章、标准的规定,对人体不得产生任何急性、亚急性、慢性或其他潜在性健康危害。
第四条国家鼓励对新资源食品的科学研究和开发。
第五条卫生部主管全国新资源食品卫生监督管理工作。
县级以上地方人民政府卫生行政部门负责本行政区域内新资源食品卫生监督管理工作。
第二章新资源食品的申请第六条生产经营或者使用新资源食品的单位或者个人,在产品首次上市前应当报卫生部审核批准。
第七条申请新资源食品的,应当向卫生部提交下列材料:(一)新资源食品卫生行政许可申请表;(二)研制报告和安全性研究报告;(三)生产工艺简述和流程图;(四)产品质量标准;(五)国内外的研究利用情况和相关的安全性资料;(六)产品标签及说明书;(七)有助于评审的其它资料。
另附未启封的产品样品1 件或者原料30 克。
申请进口新资源食品,还应当提交生产国(地区)相关部门或者机构出具的允许在本国(地区)生产(或者销售)的证明或者该食品在生产国(地区)的传统食用历史证明资料。
第三章安全性评价和审批第八条卫生部建立新资源食品安全性评价制度。
新资源食品安全性评价采用危险性评估、实质等同等原则。
卫生部制定和颁布新资源食品安全性评价规程、技术规范和标准。
第九条卫生部新资源食品专家评估委员会(以下简称评估委员会)负责新资源食品安全性评价工作。
评估委员会由食品卫生、毒理、营养、微生物、工艺和化学等方面的专家组成第十条评估委员会根据以下资料和数据进行安全性评价:新资源食品来源、传统食用历史、生产工艺、质量标准、主要成分及含量、估计摄入量、用途和使用范围、毒理学;微生物产品的菌株生物学特征、遗传稳定性、致病性或者毒力等资料及其它科学数据。
第十一条卫生部受理新资源食品申请后,在技术审查中需要补正有关资料的,申请人应当予以配合。
对需要进行验证试验的,评估委员会确定新资源食品安全性验证的检验项目、检验批次、检验方法和检验机构,以及是否进行现场审查和采样封样,并告知申请人。
安全性验证检验一般在卫生部认定的检验机构进行。
需要进行现场审查和采样封样的,由省级卫生行政部门组织实施。
第十二条卫生部根据评估委员会的技术审查结论、现场审查结果等进行行政审查,做出是否批准作为新资源食品的决定。
在评审过程中,如审核确定申报产品为普通食品的,应当告知申请人,并做出终止审批的决定。
第十三条新资源食品审批的具体程序按照《卫生行政许可管理办法》和《健康相关产品卫生行政许可程序》等有关规定进行。
第十四条卫生部对批准的新资源食品以名单形式公告。
根据不同新资源食品的特点,公告内容一般包括名称(包括拉丁名)、种属、来源、生物学特征、采用工艺、主要成分、食用部位、使用量、使用范围、食用人群、食用量和质量标准等内容;对微生物类,同时公告其菌株号。
第十五条根据新资源食品使用情况,卫生部适时公布新资源食品转为普通食品的名单。
第十六条有下列情形之一的,卫生部可以组织评估委员会对已经批准的新资源食品进行再评价:(一)随着科学技术的发展,对已批准的新资源食品在食用安全性和营养学认识上发生改变的;(二)对新资源食品的食用安全性和营养学质量产生质疑的;(三)新资源食品监督和监测工作需要。
经再评价审核不合格的,卫生部可以公告禁止其生产经营和使用。
第四章生产经营管理第十七条食品生产经营企业应当保证所生产经营和使用的新资源食品食用安全性。
符合本法第二条规定的,未经卫生部批准并公布作为新资源食品的,不得作为食品或者食品原料生产经营和使用。
第十八条生产新资源食品的企业必须符合有关法律、法规、技术规范的规定和要求。
新资源食品生产企业应当向省级卫生行政部门申请卫生许可证,取得卫生许可证后方可生产。
第十九条食品生产企业在生产或者使用新资源食品前,应当与卫生部公告的内容进行核实,保证该产品为卫生部公告的新资源食品或者与卫生部公告的新资源食品具有实质等同性。
第二十条生产新资源食品的企业或者使用新资源食品生产其它食品的企业,应当建立新资源食品食用安全信息收集报告制度,每年向当地卫生行政部门报告新资源食品食用安全信息。
发现新资源食品存在食用安全问题,应当及时报告当地卫生行政部门。
第二十一条新资源食品以及食品产品中含有新资源食品的,其产品标签应当符合国家有关规定,标签标示的新资源食品名称应当与卫生部公告的内容一致。
第二十二条生产经营新资源食品,不得宣称或者暗示其具有疗效及特定保健功能。
第五章卫生监督第二十三条县级以上人民政府卫生行政部门应当按照《食品卫生法》及有关规定,对新资源食品的生产经营和使用情况进行监督抽查和日常卫生监督管理。
第二十四条县级以上地方人民政府卫生行政部门应当定期对新资源食品食用安全信息收集报告情况进行检查,及时向上级卫生行政部门报告辖区内新资源食品食用安全信息。
省级卫生行政部门对报告的食用安全信息进行调查、确认和处理后及时向卫生部报告。
卫生部及时研究分析新资源食品食用安全信息,并向社会公布。
生产经营或者使用新资源食品的企业应当配合卫生行政部门对食用安全问题的调查处理工作,对食用安全信息隐瞒不报的,卫生行政部门可以给予通报批评。
第二十五条生产经营未经卫生部批准的新资源食品,或者将未经卫生部批准的新资源食品作为原料生产加工食品的,由县级以上地方人民政府卫生行政部门按照《食品卫生法》第四十二条的规定予以处罚。
第六章附则第二十六条本办法下列用语的含义:危险性评估,是指对人体摄入含有危害物质的食品所产生的健康不良作用可能性的科学评价,括危害识别、危害特征的描述、暴露评估、危险性特征的描述四个步骤。
实质等同,是指如某个新资源食品与传统食品或食品原料或已批准的新资源食品在种属、来源、生物学特征、主要成分、食用部位、使用量、使用范围和应用人群等方面比较大体相同,所采用工艺和质量标准基本一致,可视为它们是同等安全的,具有实质等同性。
第二十七条转基因食品和食品添加剂的管理依照国家有关法规执行。
第二十八条本办法自2007 年12 月1 日起施行,1990 年7 月28 日由卫生部颁布的食品卫生新资源管理办法》和2002 年4 月8 日由卫生部颁布的《转基因食品卫生管理办法》同时废止卫生部关于进一步规范保健食品原料管理的通知卫法监发[2002]51 号各省、自治区、直辖市卫生厅局、卫生部卫生监督中心:现印发《既是食品又是为进一步规范保健食品原料管理,根据《中华人民共和国食品卫生法》,药品的物品名单》、《可用于保健食品的物品名单》和《保健食品禁用物品名单》(见附件),并规定如下:一、申报保健食品中涉及的物品(或原料)是我国新研制、新发现、新引进的无食用习惯或仅在个别地区有食用习惯的,按照《新资源食品卫生管理办法》的有关规定执行。
二、申报保健食品中涉及食品添加剂的,按照《食品添加剂卫生管理办法》的有关规定执行。
三、申报保健食品中涉及真菌、益生菌等物品(或原料)的,按照我部印发的《卫生部关于印发真菌类和益生菌类保健食品评审规定的通知》(卫法监发[2001]84 号)执行。
