(江苏专版)2020版高考化学一轮复习 专题二 第九讲 铁、铜及其化合物
高三化学一轮复习——铁铜及其重要化合物
(5)向硫酸亚铁溶液中滴加 NaOH 溶液,边加边搅拌,即可制得白色的氢氧化亚 铁。( ) )
(6)Fe2O3 是红棕色粉末,俗称铁红,常用作红色油漆和涂料。( (7)氧化铁能与酸反应,所以可用于制作红色染料。( ) )
(8)铁表面自然形成的氧化层能保护内层金属不被空气氧化。(
答案:(1)× (2)× (3)× (4)× (5)× (6)√ (7)× (8)×
△ △
Cu(OH)2=CuO+H2O Cu(OH)2+4NH3· H2O= [Cu(NH3)4](OH)2+4H2O
Cu2++2OH-=Cu(OH)2↓
Cu2++2OH-=Cu(OH)2↓
注意:(1)溶液中的Cu2+常为蓝色(浓CuCl2为绿色, 稀CuCl2为蓝色),可作为Cu2+的判断依据。
(2) Cu2+与碱反应生成蓝色沉淀Cu(OH)2, Cu(OH)2溶于氨水形成深蓝色溶液,这是鉴定 Cu2+的原理之一。无水CuSO4遇水变为蓝色, 生成CuSO4· 5H2O,可作为水的检验依据。
4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3
思考: 1、实验中为什么要用新制的 硫酸亚铁溶液? 2、实验中为什么滴入经煮沸 的NaOH溶液? 3、实验中为什么要将滴管尖 端插入试管里溶液底部,慢慢 挤出NaOH溶液? 4、还可以采用什么方法和措 施以保证制得氢氧化亚铁?
3.制备 Fe(OH)2 常用的 3 种方法
反思归纳 防止 Fe(OH)2 氧化的方法 (1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。 (2)将盛有 NaOH 溶液的胶头滴管尖端插入试管中的亚铁盐溶液底部,并慢慢挤 出 NaOH 溶液。 (3)在亚铁盐溶液上面充入保护气,如 H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。
2020届高三高考化学一轮复习专题专练:铁、铜及其化合物

铁、铜及其化合物1.玻璃制造行业需要消耗大量硼酸(H 3BO 3)。
工业上以铁硼矿(主要成分为2MgO·B 2O 3·H 2O 和Fe 3O 4,还含有少量Fe 2O 3、FeO 、CaCO 3、Al 2O 3和SiO 2等)为原料生产硼酸的工艺流程如下:资料:(1)H 3BO 3的溶解度在20 ℃、40 ℃、60 ℃、100 ℃时分别为5.0 g 、8.7 g 、14.8 g 、40.2 g ; (2)Fe 3O 4是一种铁氧体磁性物质,不溶于水和酸;(3)Fe 3+、Al 3+、Fe 2+和Mg 2+以氢氧化物形式完全沉淀时,溶液的pH 分别为3.2、5.2、9.7和12.4;(4)母液呈酸性。
则下列推断不正确的是( ) A .浸出渣中只含SiO 2B .热过滤的目的是防止温度降低时H 3BO 3从溶液中析出C .除杂时需向浸出液中依次加入H 2O 2和MgO ,以除去Fe 2+、Fe 3+、Al 3+等杂质离子D .回收母液可以制得硫酸镁晶体2.化学反应中,反应物用量、浓度或反应条件不同可能对生成物产生影响。
下列反应的生成物不受上述因素影响的是( )A .铜与硝酸反应B .钠与氧气反应C .氢气与氯气反应D .氯化铝与氢氧化钠溶液反应3.已知下列转化关系中,M 、N 均为单质,则M 可能是( ) M +N ――→点燃 Q ――→溶于水 Q 溶液――――――→惰性电极电解 M +N A .Na B .Al C .FeD .Cu4.下列常见金属的冶炼原理中不合理的是( )532A .Cu ――――→浓HNO 3Cu(NO 3)2 B .Cu ――――→稀HNO 3Cu(NO 3)2C .Cu ――→O 2空气△CuO ――→稀HNO 3△Cu(NO 3)2D .Cu ――→Cl 2△CuCl 2―――――→硝酸银溶液 Cu(NO 3)26.下列关于Fe 3+、Fe 2+性质实验的说法错误的是( )A .用如图装置可以制备Fe(OH)2B .配制FeCl 3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度C .向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe 2+D .向FeCl 2溶液中加入少量铁粉是为了防止Fe 2+被氧化7.粗制的CuSO 4·5H 2O 晶体中含有Fe 2+。
高三一轮复习课件--铁铜及其化合物

(3)简述生成Fe(OH)2的操作过程_____________________。 (4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应 为_________________。
(5)下列各图示中________能较长时间看到Fe(OH)2白色沉淀。
①②③④
项目活动三:科学制备补铁剂的主要成分
(1)写出符合Ⅰ的离子方程式
①将 H2S 气体通入 FeCl3 溶液中产生淡黄色沉淀:
H2S+2Fe3+===S↓+2Fe2++2H+
。
②向 FeCl3 溶液滴入 KI-淀粉溶液,溶液变蓝:
2I-+2Fe3+===I2+2Fe2+ 。
③FeCl3 可溶解铁片: 2Fe3++Fe===3Fe2+ 。
请写出上述关系的有关反应方程式。
铁与水蒸气反应:
高温
3Fe +4H2O(g)=====Fe3O4+4H2(g)
课本实验的拓展:证明生成的气体是氢气
明白:原理、装置用途、现象等 思考:如何证明生成的固体物质是Fe3O4?
Fe2+
Fe3+
Fe2+和强氧化剂作用例如:O2、 Cl2、Br2、HNO3 等
反应结束关闭恒 压滴液漏斗活塞
加入 药品
打开分液漏斗 塞子和旋塞
2020年高考化学二轮专题复习讲义:《铁、铜及其重要化合物》
高考化学二轮复习铁、铜及其重要化合物1.了解铁单质及化合物的颜色.状态及性质。
2.通过合金材料了解铜及化合物的性质。
3.能用氧化还原反应的规律探究铁的化合物之间的相互转化。
4.能掌握氢氧化铁胶体制备,能列举合金材料的应用。
(1)NO3-与Fe2+在酸性条件下,不能共存。
(2)过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+=3Fe2+。
(3)注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别。
FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体。
但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体。
考点解读知识体系(4)注意亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。
如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+。
(5)注意铁单质与强氧化性物质反应时,也有生成二价铁化合物的可能性。
反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+。
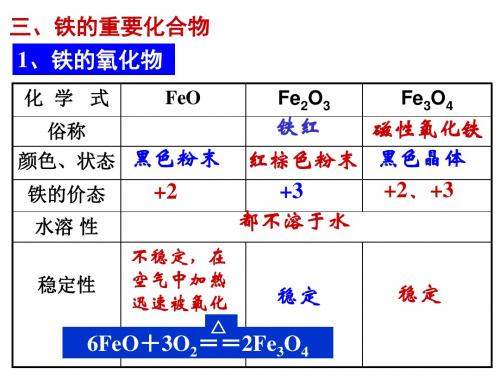
铁和“铁三角”1.铁的氧化物的比较化学式FeO Fe2O3Fe3O4俗称—铁红磁性氧化铁色态黑色粉末红棕色粉末黑色晶体价态+2 +3 1/3正2价,2/3正3价水溶性不溶不溶不溶与酸的反应FeO+2H+===Fe2++H2O遇氧化性酸生成Fe3+盐Fe2O3+6H+===2Fe3++3H2OFe3O4+8H+===Fe2++2Fe3++4H2O与CO的反应高温FexOy+yCO===xFe+yCO2基础考点2.Fe2+和Fe3+ 的比较Fe2+Fe3+水合离子颜色浅绿色棕黄色氧化还原性既有氧化性,又有还原性只有氧化性水解性Fe2+ +2H2O←→Fe(OH)2+2H+Fe3+ +3H2O←→Fe(OH)3+3H+与碱的反应Fe2+ +2OH—=== Fe(OH)2↓Fe3+ +3OH—=== Fe(OH)3↓3.Fe(OH)2与Fe(OH)3的比较Fe(OH)2Fe(OH)3颜色状态白色固体红褐色固体水溶性不溶不溶稳定性易氧化为Fe(OH)3,空气中加热得不到FeO 较稳定:∆Fe(OH)3== Fe2O3+3H2O与酸的反应Fe(OH)2+2H+=== Fe2+ +3H2O Fe(OH)3+3H+=== Fe3+ +3H2O制法在隔绝O2的条件下Fe2+与碱反应Fe3+与碱反应点燃 4.铁三角:注:(1)一般是指Zn .Al .CO. H 2. 等还原剂。
高考化学二轮专题复习:铁、铜及其化合物课件

科学探究 2 如何检验溶液中的Fe3+?
实验方法
实验现象 检验效果
在两支试管中分别滴加一滴 0.1mol/L FeCl3溶液,加入1/3 试管水稀释,视察
在上述一支试管中滴加1滴 1mol/L NaOH溶液
在上述另一支试管中滴加1滴 1mol/L 硫氰化钾(KSCN)溶液
物质的检验要具备:
①现象明显; ②反应灵敏; ③用量少。
实验结论: 检验溶液中的Fe3+用KSCN溶液 。
据世界卫生组织调查报告,全世界约有 10%~30%的人群有不同程度的缺铁。缺
铁性贫血是我国,也是世界上最常见的贫 血。
头晕、头痛
指甲变形
葡萄糖酸亚铁
琥珀酸亚铁
市售补血剂
Fe2+是血红蛋白的重要组成,所 【【药 成以品分名】亚称硫铁】 酸硫 亚盐酸 铁亚片是铁每一片片。含种主常要成用分的硫酸补亚铁血0.剂3克。
请同学们根据铁元素的化合价,写出铁的不 同化合物。
铁元素的化合价
+2
+3
氧化物 氢氧化物
盐
科学探究1:如溶液中 滴加NaOH溶液
实验现象 红褐色沉淀
化学方程式
FeCl3+3NaOH= Fe(OH)3↓+3NaCl
向FeCl2溶液中 滴加NaOH溶液
专题复习:
铁、铜及其化合物的应用
铁熨斗 铁灯
铁镢头 铁弯锄
铜钱
铜镜
司母戊鼎
银 白 色 的 纯 铁
1.铁丝在氯气中燃烧 2.铁丝在氧气中燃烧 3.铁粉与硫粉混合加热 4.铁与盐酸反应离子方程式 5.铁与稀硫酸反应离子方程式 6.铁与硫酸铜溶液反应
注意思考铁在各个反应产物中呈现的化合价。
苏教版高中化学高三一轮复习-铁及化合物的应用 课件(共10张PPT)

特性
不稳定, 用作油漆 易被氧化 的颜料等
具有磁性
四、铁的氢氧化物
化学式 色态
Fe(OH)2
白色固体
Fe(OH)3
红褐色固体
溶解性
难溶于水
难溶与水
与酸反应 Fe(OH) 2+ 2H+ = Fe2+ + 2H2OFe(OH)3+3H+= Fe3++3H2O
不稳定,空气中易被氧化 受热易分解
稳定性
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(硝酸、氯气、溴、浓硫酸等)
Fe
Fe(III)
(与氧气、水蒸汽)
Fe(II)
Fe(III)
三、铁的氧化物性质
名称
氧化亚铁 氧化铁 四氧化三铁
化学式
FeO
Fe2O3
Fe3O4
价态 俗名
+2
+3
+2、+3
铁红
磁性氧化铁
色态
黑色粉末 红棕色粉末 黑色晶体
与HCl反应
Fe2+
Fe3+
Fe2+ 、Fe3+
与CO、Al反应 生成Fe和CO2 、生成Fe和Al2O3 、
白色 灰绿色 红褐色
2Fe(OH)3 = Fe2O3 + 3H2O
制 法 Fe2+ + 2OH- = Fe(OH)2 Fe3++3OH-=Fe(OH)3
关 系 在空气中Fe(OH)2易被氧化成Fe(OH)3
【思考1】
怎样实现Fe、Fe2+、 Fe3+之间的相互转化?
高考第一轮复习——铁、铜的性质(学案含答案)

年级高三学科化学版本苏教版内容标题高三第一轮复习:铁、铜的性质【本讲教化信息】一. 教学内容:铁、铜的性质二. 教学目标相识铁是一种较活泼的金属,了解铁的物理性质,驾驭铁的化学性质;驾驭铁的有关性质试验以及对试验现象的分析;通过演绎法去分析铜及其重要化合物的化学性质。
三. 教学重点、难点铁的性质及有关性质试验和试验现象的分析四、教学过程:(一)铁及其化合物的性质1、铁在周期表中的位置及结构铁位于第四周期第Ⅷ族,电子排布式为:1s22s22p63s23p63d64s2原子结构示意图为在化学反应中易失去两个或三个电子形成+2或+3价:Fe―2e―=Fe2+;Fe―3e―=Fe3+2、纯铁具有银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
纯铁的抗腐蚀实力很强,通常我们所见的铁中由于含有碳等物质,抗腐蚀实力较弱,易发生电化腐蚀。
在酸性介质中发生:析氢腐蚀:负极:Fe-2e-=Fe2+;正极反应为:2H++2e-=H2;在中性或碱性介质中发生:吸氧腐蚀:负极:Fe-2e-=Fe2+;正极反应为:2H2O+O2+4e-=4OH-3、化学性质:铁是较活泼的金属,易失去最外层和次外层的电子,常显+2、+3价,且Fe3+比Fe2+稳定。
(1)与非金属反应:铁与强氧化剂反应生成+3价铁的化合物,与弱氧化剂反应生成+2价铁的化合物。
如:3Fe+2O2Fe3O4;2Fe+3Cl22FeCl3;Fe+S FeS(2)与水反应:铁在加热至红热时能与水蒸气发生反应。
3Fe+4H2O(g)Fe3O4+4H2常温下,铁与水不起反应,但在水和空气里O2、CO2等共同作用下,铁易被腐蚀。
(3)与酸反应:非氧化性酸:Fe+2H+=Fe2++H2↑氧化性酸:常温下,铁遇浓硫酸、浓硝酸会钝化,加热条件下可发生氧化还原反应。
Fe+4HNO3(过量)=Fe(NO3)3+NO↑+2H2O3Fe(过量)+8HNO3=3Fe(NO3)2+2NO↑+4H2OFe+6HNO3(浓)Fe(NO3)3+3NO2↑+3H2O(4)与盐溶液反应:Fe+Cu2+=Fe2++Cu;Fe+2Fe3+=3Fe2+4、铁的重要化合物:名称氧化亚铁氧化铁四氧化三铁化学式FeO Fe2O3Fe3O4价态+2 +3 +2、+3俗名铁红磁性氧化铁名称氧化亚铁氧化铁四氧化三铁色态黑色粉末红棕色粉末黑色晶体①FeO+2H+==Fe2++H2O ②Fe2O3+6H+==2Fe3+ + 3H2O③Fe3O4+8H+==Fe2+ +2Fe3+ +4H2O ④3FeO+10HNO3==3Fe(NO3)3+NO↑+5H2O⑤Fe2O3+6H+==2Fe3+ + 3H2O ⑥3Fe3O4+28HNO3==9Fe(NO3)3+NO↑+14H2O⑦FeO+2H+==Fe2++H2O ⑧Fe2O3+6HI==2FeI2+I2+3H2O⑨Fe3O4+8HI==3FeI2+I2+4H2O说明:1、铁在化学反应中不仅可失去最外层的电子显+2价,还可以失去部分次外层的电子显+3价,当失去d能级中1个电子时,形成3d5的半充溢状态,比较稳定,因此,铁的+3价化合物较稳定。
(江苏专用)2020版高考化学大一轮复习专题二第3讲铁、铜及其重要化合物课件

A.2.25 mol/L B.2 mol/L
C.4 mol/L
D.0.6 mol/L
2.(2019南京月考)Fe和Fe2O3 的混合物共13.6 g,加入150 mL稀H2SO4, 在标准状况下收集到1.12 L H2,Fe和Fe2O3 均无剩余。为了中和过量的 H2SO4,并使铁元素全部转化为Fe(OH)2 沉淀,消耗了200 mL 3 mol/L的 NaOH溶液,则该稀H2SO4 的物质的量浓度为( B )
第3讲 铁、铜及其重要化合物
考点一 铁及其重要化合物
总 考点二 铜及其重要化合物 纲 目 考点三 Fe2+、Fe3+的相互转化及检验 录
高考演练
考点一 铁及其重要化合物
一、铁 1.物质的组成 纯铁具有金属的共性,如具有① 银白色 金属光泽和良好的延展性, 是电和热的良导体,具有能被② 磁铁 吸引的特性,纯铁有很强的抗 腐蚀能力。
。 。
。 。
答案 (1)3Fe+8H++2N O3 3Fe2++2NO↑+4H2O (2)3FeO+N O3 +10H+ 3Fe3++NO↑+5H2O (3)3Fe(OH)2+N O3 +10H+ 3Fe3++NO↑+8H2O (4)2Fe(OH)3+2I-+6H+ 2Fe2++I2+6H2O
2.铁的化学性质 (1)与非金属单质的反应 a.与O2的反应: 常温下:铁被腐蚀生成铁锈,其主要成分为③ Fe2O3 。
点燃时:④ 3Fe+2O2 Fe3O4 。
b.与Cl2的反应:⑤ 2Fe+3Cl2 2FeCl3 。
高三化学一轮复习——铁铜及其重要化合物39页PPT

45、自己的饭量自己知道。——苏联
文 家 。汉 族 ,东 晋 浔阳 柴桑 人 (今 江西 九江 ) 。曾 做过 几 年小 官, 后辞 官 回家 ,从 此 隐居 ,田 园生 活 是陶 渊明 诗 的主 要题 材, 相 关作 品有 《饮 酒 》 、 《 归 园 田 居 》 、 《 桃花 源 记 》 、 《 五 柳先 生 传 》 、 《 归 去来 兮 辞 》 等 。
高三化学一轮复习——铁铜及其重要 化合物
6
、
露
凝
无
游
氛
,
天
高
风
景
澈
。
7、翩翩新 来燕,双双入我庐 ,先巢故尚在,相 将还旧居。
8
、
吁
嗟
身
后
名
,
于
我
若
浮
烟
。
9、 陶渊 明( 约 365年 —427年 ),字 元亮, (又 一说名 潜,字 渊明 )号五 柳先生 ,私 谥“靖 节”, 东晋 末期南 朝宋初 期诗 人、文 学家、 辞赋 家、散
1
0
、
倚
南
窗
以
寄
傲
,
审
容
膝之易来自安。41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
高三一轮复习_铁、铜及其化合物.ppt

Ⅲ.写出铁与浓硫酸加热时,可能发生的有关反应方程式: 。
【提出猜想】 Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种; Ⅱ.所得气体中可能含有 SO2、H2 中的一种或两种。
【实验探究】
实验操作 预期现象 结论
目的
验证猜想 Ⅰ
取少量溶液A, 滴入酸性KMnO4溶液 另取少量溶液A, 滴入KSCN溶液
(2)分别将FeCl2、 FeCl3溶液加热蒸干、灼烧最后剩下什么固体?
(3)分别往FeCl2、 FeCl3溶液滴加氨水,现象是否相同? (4)分别往FeCl2、 FeCl3溶液滴加KSCN溶液,现象是否相同?
2. Fe2+、Fe3+在水溶液中的相互转化 思考:
从氧化还原反应的角度分析:下列试剂:
反应不能大量共存。 (2)盐溶液的配制与保存
①Fe2+的盐溶液:加少量铁粉,防止Fe2+被氧
化;加少量相应的酸,防止Fe2+水解。
②Fe3+的盐溶液:加少量相应的酸防止Fe3+水解。
(3)制取Fe(OH)3胶体
Fe3++3H2O(沸水) +3H+ FeCl3·6H2O (6)除杂方法 ①Fe2+(Fe3+): (4)制备无水FeCl3
(3)Fe2O3和Cu2O
Fe2O3+6H+ Cu2O+2H+ 2Fe3++Cu 2Fe3++3H2O, Cu+Cu2++H2O, 2Fe2++Cu2+
向一定量的Fe、FeO和Fe2O3的混合物投入100 ml 1 mol/L
的盐酸,恰好使混合物完全溶解,放出224 ml(标准状况)
高考化学一轮复习 专题3.4 铁、铜及其化合物(讲)(含解

专题3.4 铁、铜及其化合物1、掌握铁及其化合物的物理、化学性质及应用。
2、掌握Fe2+、Fe3+的相互转化,能鉴别溶液中的Fe2+、Fe3+。
3、掌握Fe(OH)2、FeCl3的制备方法。
4、了解铜及其重要化合物的主要性质及其应用一、铁及其化合物1、铁的存在2、铁的性质(1)物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
(2)化学性质:铁是较活泼的金属,有较强的还原性,发生化学反应时可生成+2、+3两种价态的化合物。
用化学方程式或离子方程式表示下列变化Fe +⎩⎪⎨⎪⎧—O 2――→① ①3Fe+2O 2=====点燃Fe 3O 4—Cl 2――→② ②2Fe+3Cl 2=====点燃2FeCl 3—S ――→③ ③Fe+S=====△FeSFe +H 2O(g)――→④④3Fe+4H 2O(g)=====高温Fe 3O 4+4H 2 Fe —⎩⎪⎨⎪⎧――→⑤Fe 2+⑤Fe+2H +===Fe 2++H 2↑、 Fe +Cu 2+===Cu +Fe2+――→⑥Fe 3+⑥Fe+4H ++NO -3===Fe 3++N O↑+2H 2O3、铁的氧化物的比较4、Fe 2+和Fe 3+的比较5、Fe(OH)2与Fe(OH)3的比较受热分解2Fe(OH)3=====△Fe2O3+3H2O制法可溶性亚铁盐与碱溶液反应Fe2++2OH-===Fe(OH)2↓可溶性铁盐与碱溶液反应Fe3++3OH-===Fe(OH)3↓二者的关系在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3【典型例题1】铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是()A.Fe(OH)3 Fe2O3B.Fe(OH)2 Fe2O3C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4【答案】B【解析】铁与稀硫酸生成FeSO4,再与过量氨水反应生成白色沉淀Fe(OH)2,在空气中加热Fe(OH)2,铁元素被氧化为+3,最后所得红棕色残渣为Fe2O3。
名师一号高考化学苏教一轮复习考点突破:铁铜的获取及应用

重 点 突 破锁定高考热点 探究规律方法考点1 铁及其化合物的相互转化-或3e -而变成Fe 2+或Fe 3+。
铁元素的原子在化学反应中,当遇弱氧化剂(如S 、H +、Cu 2+、I 2等)时,铁只能失去最外层的两个电子,而生成+2价铁的化合物,当遇到强氧化剂(如Cl 2、Br 2、HNO 3等)时,铁原子可以再失去次外层上的一个电子而生成+3价铁的化合物。
1.Fe 、Fe 2+、Fe 3+形成三角关系2.Fe 、Fe 2+、Fe 3+相互转化(1)Fe ―→Fe 3+和Fe 2+―→Fe 3+需要较强的氧化剂。
如O 2、Cl 2、HNO 3(浓、稀)、H 2SO 4(浓)、KMnO 4(H +)溶液等。
2Fe +3Cl 2=====△2FeCl 3;Fe +4HNO 3(稀)===Fe(NO 3)3+NO ↑+2H 2O ;4Fe(OH)2+2H 2O +O 2===4Fe(OH)3;2FeCl 2+Cl 2===2FeCl 3。
(2)Fe ―→Fe 2+需要较弱的氧化剂,如S 、Cu 2+(CuSO 4)、H +(稀H 2SO 4、盐酸)等。
Fe +CuSO 4===FeSO 4+Cu ;Fe +2HCl===FeCl 2+H 2↑Fe +S=====△FeS ;Fe +I 2=====△FeI 2(3)Fe 2+―→Fe ,在金属活动性顺序表中排在Fe 前的金属,如Zn 、Al 等,可以将Fe 2+还原成Fe 。
Zn +FeSO 4===ZnSO 4+Fe注意 K 、Ca 、Na 等活泼金属,由于它们在水溶液中先跟水反应,所以不能作为还原剂来完成Fe 2+―→Fe 的转化。
(4)Fe 3+―→Fe 2+需要较强的还原剂。
如Fe 、Zn 、H 2S(S 2-)、KI(I -)、Na 2SO 3(SO 2-3)等,Cu 虽不是强还原剂,但因Fe 3+具有较强的氧化性,可被Cu 还原成Fe 2+。
高三一轮复习课件--铁铜及其化合物

2、铁的化学性质:
Cl2、 Br2、 稀HNO3(足量) 强氧+
Fe3O4 (Fe2+/Fe3+) Fe2+ 钝化
I2 、 S 、H+、CuSO4 弱氧化剂
常温,浓硫酸、浓硝酸
重点注意: 铁和稀硝酸的反应
铁粉不足:
Fe+4HNO3=Fe(NO3)3+NO+2H2O n (Fe) :n( HNO3 )= (3∶12) 铁粉过量:
2011高考综合实验模拟
PAFC—[AlFe(OH)nCl6-n]m 是高效净水剂 。( 1 )以废料 (金属铁、铝及其氧化物)为原料制取PAFC 设计生产流程如下: ①所得酸性溶液中,不能确定是否存在的阳离子是( ) A.Al3+ B.Fe2+ C.Fe3+ D.H+ 为证明该离子确实存在,可采用的操作是(必须指明所 采用的试剂及观察到的现象)_______________________ ②往酸性溶液中加入试剂X的目的是_______________
Zn、H2、Al、C、CO等
Fe
6)Fe3+
Zn(过量)、CO、Al等
Fe
二、铁的重要化合物
(1)铁的氧化物
FeO 俗名
色态 价态 稳定性 与稀酸 反应 黑色粉末 +2 不稳定
Fe2O3 铁红
红棕色粉末 +3 稳定
Fe3O4 磁性氧化铁
黑色晶体 +2,+3 稳定
FeO+2H+= Fe2O3+6H+= Fe2++H2O 2Fe3++3H2O
答案(1)固体完全溶解,溶液呈红色
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
可溶性铁盐与碱(如 NaOH 溶 液)反应:F__e_3+_+__3_O__H_-_=_=_=__ _F_e_(_O__H_)_3↓___
二者 的关系
空气中,Fe(OH)2 能够迅速地被氧气氧化成 Fe(OH)3,现象是白色沉淀迅速变成_灰__绿__色,最后 变成_红__褐___色,化学方程式为
===Fe2++H2O _3_H_2_O___
_F_e_3O__4_+__8_H_+_=_=_=__ _F_e_2+_+__2__F_e_3+_+____ _4_H__2O____
3.铁的氢氧化物
化学式 色态
Fe(OH)2 _白__色__固__体___
Fe(OH)3 _红__褐__色__固__体___
Cl2
_2_F_e_+__3_C__l2_=点_=_=燃_=_=_2_F_e_C_l_3__
S
_F_e_+__S_=_=_△=_=_=_F_e_S___
②与水的反应
常温下铁与水不反应,在高温条件下与水蒸气反应: _3_F_e_+__4_H__2O__(g_)_=_高=_=_温=_=_F_e_3_O_4_+__4_H_2_。
_4_F_e_(_O__H_)_2+___O_2_+__2_H_2_O__=_=_=_4_F_e_(_O_H__)3___
知能深化—扫盲点
提能点 一
Fe与稀HNO3反应产物的判断
(1)当稀 HNO3 过量时 反应原理:_F_e_+__4_H_N__O_3_=_=_=_F_e_(N__O_3_)_3+__N__O_↑__+__2_H__2O__,铁 元素的存在形式为 Fe3+,铁元素的价态为+3 价。 (2)当 Fe 过量时 反应原理:Fe 与稀 HNO3 反应生成 Fe(NO3)3,生成的 Fe(NO3)3 与 Fe 反应生成 Fe(NO3)2。 Fe+4HNO3===Fe(NO3)3+NO↑+2H2O, 2Fe(NO3)3+Fe===3Fe(NO3)2。 总反应:_3_F_e_+__8_H__N_O_3_=_=_=_3_F_e_(_N_O_3_)_2+__2_N__O_↑__+__4_H__2O__,铁 元素的存在形式为 Fe2+,铁元素的价态为+2 价。
③与酸的反应
酸
化学方程式或现象
稀 H2SO4
Fe+H2SO4===FeSO4+H2↑
稀 HNO3
Fe 不足
_F_e_+__4_H_N__O_3_=_=_=_F_e_(_N_O__3_)3___ __+__N_O__↑__+__2_H_2_O__
_3_F_e_+__8_H_N__O_3_=_=_=_3_F_e_(_N_O__3_)2_+___
Fe 过量
___2_N_O__↑__+__4_H__2O__
浓 HNO3、浓 H2SO4
常温下_钝__化___
④与某些盐溶液 CuSO4、FeCl3 的反应 与 CuSO4 溶液反应的离子方程式:_F_e_+__C__u_2+_=_=_=_F__e2_+_+__C__u_。 与 FeCl3 溶液反应的离子方程式:2_F__e_3+_+__F_e_=_=_=_3_F_e_2_+_。
2.铁的氧化物
化学式
FeO
俗名
—
Fe2O3 铁红
Fe3O4 磁性氧化铁
颜色状态
_黑__色粉末 _红__棕__色粉末 _黑_色晶体(有磁性)
溶解性
不溶于水
铁的化合价
_+__2_
_+__3_
_+__2_、__+__3_
与 H+反应的 离子方程式
FeO+2H+ _F_e_2_O_3_+__6_H__+ _=_=_=_2_F_e_3_+_+__
与盐酸反应
F_e_(_O__H_)_2_+__2_H_+_=_=_=_ F__e_2+_+__2_H__2_O___
Fe(OH)3+3H+===Fe3++3H2O
受热分解
△
—
_2_F_e_(_O_H__)_3=_=_=_=_=_F_e_2_O__3+__3_H__2_O_
制法可溶性ຫໍສະໝຸດ 铁盐与碱(如 NaOH 溶液)反
02 铁盐、亚铁盐的化学性质 铁及其化合物的综合应用
03 04
铜及其化合物
金属材料与金属矿物的 开发利用
05
本讲达标检测
06
课下能力测评—查缺漏
考点1
铁的单质、氧化 物及氢氧化物
教材基础—自热身
1.铁的单质 (1)原子结构 铁位于元素周期表中_第__四__周__期__、__第__Ⅷ__族__。
江苏考纲要求
1.理解并能应用常见金属的活动顺序。 2.了解常见金属铁、铜及其重要化合物的主要性质和重要
应用。 3.认识化学在金属矿物等自然资源综合利用和实现物质间
转化等方面的实际应用。 4.了解金属材料在生产和生活中的重要应用。认识常见
无机物在生产中的应用和对生态环境的影响。
目 录
01 铁的单质、氧化物及氢氧化物
(2)物理性质 铁是银白色金属,熔、沸点高,抗腐蚀性_强__,能被_磁__铁__ 吸引,具有金属的通性。
(3)化学性质
铁元素性质活泼,有较强的还原性,主要化合价为+2 价
和+3 价。
①与非金属单质的反应
常温下:铁被腐蚀生成铁锈,其主要成分为F__e_2O__3 _
O2
点燃
点燃时:_3_F_e_+__2_O__2=_=_=_=_=_F_e_3_O_4___
(3)当
1 nFe 3 4<nHNO3<8
时
铁元素的存在形式为 Fe2+和 Fe3+,铁元素的价态为+2、
+3 价。
可以用数轴表示:
总之,Fe 与 HNO3、Cl2、Br2 等强氧化剂反应时,氧化 剂的量不管是否过量,总是先生成 Fe3+,然后 Fe3+再与 Fe 反应生成 Fe2+。
对点练
1.在一定量的稀 HNO3 中慢慢加入铁粉,得 到的 Fe2+的物质的量(纵坐标)与所加铁粉 的物质的量(横坐标)的关系如图所示。请 将正确答案的序号填在相应的横线上。 ①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+ (1)AB 段铁元素以______①______形式存在。 (2)BC 段铁元素以_____④_______形式存在。 (3)CD 段铁元素以____③______形式存在。 解析:向稀 HNO3 中加入铁粉,开始时稀 HNO3 过量应生成 Fe3+,随加入铁粉量的增加,HNO3 反应完全后,发生反应 2Fe3++Fe===3Fe2+,最后全部转化为 Fe2+。
