地西他滨杂质汇总分享
丁苯那嗪杂质经验总结分享

丁苯那嗪杂质总结分享
序号
名称
CAS
分子式
规格
用途
结构式
1
Tetrabenazine Impurity 1
19328-35-9C19H27NO3
10mg 25mg 50mg 100mg
研发申报
2
Tetrabenazine Impurity 2
164106-49-8C19H29NO3
10mg 25mg 50mg 100mg
研发申报
3
Tetrabenazine Impurity 3
862377-29-5C19H29NO3
10mg 25mg 50mg 100mg
研发申报
4
Tetrabenazine Impurity 4
862377-31-9C19H29NO3
10mg 25mg 50mg 100mg
研发申报
5
Tetrabenazine Impurity 5
85081-18-1C19H29NO3
10mg 25mg 50mg 100mg
研发申报
湖北瑞诺医药---专注杂质对照品、标准品:①伏立康唑杂质②尼莫地平杂质③阿立哌唑杂质④瑞格列奈杂质⑤培美曲塞杂质q:300-
⑥氟维司群杂质⑦地西他滨杂质⑧佐匹克隆杂质⑨长春瑞滨杂质⑩恩杂鲁胺杂质-8058-⑪醋丁洛尔杂质⑫倍他米松杂质
⑬塞来昔布杂质
⑭西酞普兰杂质
⑮氯吡格雷杂质
-303
⑯硫酸益康唑杂质......等更多项目品种
并代理:CP/EP/USP/TRC/TLC/MC/LGC/RHINO 等品牌。
MDS治疗新药Dacspace3clinicaltrials090601D0007

4.8个月 (范围 0.03 – 17.6个月) 15.4个月
•对于治疗中受益的所有患者来说,任何病情的改善都是有临床意义的, •因此临床有效被定义为CR+PR+HI。
**PCH 95-11. A phase II, multi-center trial of decitabine (5-aza-2'-deoxycytidine) in patients with myelodysplastic syndromes (MDS). September 17, 2004. 23. PCH 97-19. Compassionate use of decitabine (5-aza-2'-deoxycytidine) in patients with myelodysplastic syndrome (MDS). September 17, 2004.
MDACC II study
II期:PCH95-11和PCH97-19 研究结果**
95-11和97-19临床研究受试者的临床有效率*
参数
PCH95-11 N=66 PCH97-19 N=98 未复发(n=87) 复发(n=11) 0 1(9) 1(9) 3(27) 4(36)
CR (%) PR (%) 反应率(CR + PR) (%) HI (%)
II期:PCH95-11和PCH97-19 研究设计
均为无对照、开放性、多中心研究,用来评价地西他滨 对于MDS患者的有效性和安全性。
两项研究采用同样的剂量方案,15mg/m2静脉输注4小时 以上,每8小时一次,连续3天,6周一个疗程。 主要终点是血液学缓解率、缓解持续时间和生存期。 次要终点是ECOG体能状态评分的改变和输血依赖情况
地西他滨

地西他滨一、 基本信息【类 型】:抗肿瘤药【剂 型】: 冻干粉针【规 格】:50mg /瓶【适 应 症】:用于骨髓发育不良综合症,包括所有符合法-美-英分类各型及国际预后评分系统为中-1、中-2和高风险组的已经治疗、未经治疗、复发性和继发性脊髓发育不良综合症的患者。
【用法用量】:推荐剂量15mg/m 2二、 国内注册情况(截止2009.9.14),连续输注3h ,每8小时输注1次,连续3天。
以上治疗每6周重复一次,推荐至少循环4个治疗周期,直至患者受益。
【原 研 厂】: SuperGen 公司研发并由MGIPHARMA 公司上市。
【注册分类】: 6类【制剂工艺】: 制备工艺可行性高,不需要特殊生产设备;上市销售进口药品销售 1家国产药品销售 0申请注册申请进口注册 0申请国产国产首家申请注册 年 月 日(国产如无上市,填写这一项);在中国上市和注册情况列表三、 立项分析【英文名】【化学名】: 4-氨基-1-(2-脱氧-β-赤式-顺-呋喃核糖)-1,3,5-三嗪-2(氢)-1-酮4-Amino-1-(2-deoxy-β-D-erythro-pentofuranosyl)-1,3,5-triazin-2(1H) -one【分子式】:C 8H 12N 4O 【CAS 号】:4【分子量】:228.21 2353-33-5【结构式】:本品为目前已知最强的DNA 甲基化特异性抑制剂,阻断DNA 甲基化可致基因激活与诱导细胞分化。
其对L1210的细胞毒作用可为胸苷所加强,是因胸苷可使本品掺入DNA 的量增加,从而增加本品对DNA 甲基化的抑制作用。
本品为S 期细胞周期特异性药物。
市场情况骨髓增生异常综合征是起源于骨髓造血干细胞的一组高度异质性疾病,过去俗称“白血病前期”,目前世界卫生组织(WHO )将其归类于髓系造血细胞肿瘤。
其特点为外周血三系血细胞减少、骨髓增生活跃伴造血细胞形态异常(病态造血)及高白血病转化倾向;临床上主要表现为不同程度骨髓造血功能衰竭导致的难治性贫血,不易控制的感染及出血,有些患者可合并多种自身免疫现象。
阿托伐他汀杂质研究总结
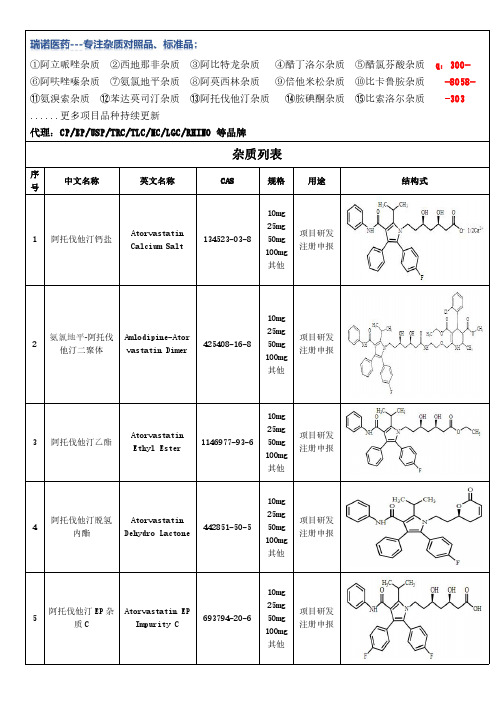
Atorvastatin Impurity 1
2165770-84-1
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
阿托伐他汀杂质 11
2
Atorvastatin Impurity 2
1116118-82-1
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
阿托伐他汀杂质 12
内酯
Dehydro Lactone
注册申报
100mg
其他
阿托伐他汀 EP 杂 Atorvastatin EP
5
质C
Impurity C
693794-20-6
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
10mg
25mg
阿托伐他汀 EP 杂 Atorvastatin EP
项目研发
6
项目研发 注册申报
项目研发 注册申报
125988-01-4
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
阿托伐他汀杂质 25
16
Atorvastatin Impurity 16
134395-00-9
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
阿托伐他汀杂质 26
项目研发 注册申报
阿托伐他汀杂质 36
27
Atorvastatin Impurity 27
10mg
25mg
项目研发
N/A
50mg
注册申报
100mg
其他
阿托伐他汀杂质 37
28
Atorvastatin Impurity 28
地西他滨decitabine说明书 欧盟

Dacogen administration must be initiated under the supervision of physicians experienced in the use of chemotherapeutic agents. Posology In a treatment cycle, Dacogen is administered at a dose of 20 mg/m2 body surface area by intravenous infusion over 1 hour repeated daily for 5 consecutive days (i.e., a total of 5 doses per treatment cycle). The total daily dose must not exceed 20 mg/m2 and the total dose per treatment cycle must not exceed 100 mg/m2. If a dose is missed, treatment should be resumed as soon as possible. The cycle should be repeated every 4 weeks depending on the patient's clinical response and observed toxicity. It is recommended that patients be treated for a minimum of 4 cycles; however, a complete or partial remission may take longer than 4 cycles to be obtained. Treatment may be continued as long as the patient shows response, continues to benefit or exhibits stable disease, i.e., in the absence of overt progression. If after 4 cycles, the patient’s haematological values (e.g., platelet counts or absolute neutrophil count), have not returned to pre-treatment levels or if disease progression occurs (peripheral blast counts are
西地那非杂质汇总

中文名称
英文名称
CAS
规格
西地那非杂质1
Sildenafil Impurity 1 (Sildenafil EP 1391053-95-4 Impurity A)
10mg 25mg 50mg 100mg 更大规格请咨询
用途
项目报批 纯度高于98%
结构式
西地那非杂质2
Sildenafil Impurity 2 (Sildenafil EP 1094598-75-0 Impurity B)
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
西地那ቤተ መጻሕፍቲ ባይዱ杂质3
Sildenafil Impurity 3(Sildenafil EP Impurity C)
139755-91-2
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
西地那非杂质4
杂质等;并提供COA、NMR、HPLC、MS等结构确证图谱;详情请点 用户名 ,谢谢! 手机(微信同号):
专业<杂质对照品>解决方案,代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD等品牌。 1814+064+3157
Sildenafil Impurity 4(Sildenafil EP 1357931-55-5 Impurity D)
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
西地那非杂质5
Sildenafil Impurity 5(Sildenafil EP Impurity E)
288-32-4
地西他滨质量标准

地西他滨质量标准
一、纯度检测
1. 方法:高效液相色谱法(HPLC)
2. 条件:流动相为甲醇-水(70:30),流速为1.0ml/min,检测波长为254nm,柱温为室温。
3. 纯度要求:地西他滨的纯度应不低于98.0%。
二、含量测定
1. 方法:高效液相色谱法(HPLC)
2. 条件:同纯度检测。
3. 含量要求:地西他滨的含量应符合规定。
三、有关物质
1. 方法:高效液相色谱法(HPLC)
2. 条件:同纯度检测。
3. 有关物质要求:地西他滨的有关物质应符合规定。
四、溶剂残留
1. 方法:气相色谱法(GC)
2. 条件:采用顶空进样方式,进样口温度为200℃,检测器温度为250℃,柱温为60℃。
3. 溶剂残留要求:地西他滨的溶剂残留应符合规定。
五、细菌内毒素
1. 方法:凝胶法或终点法。
2. 条件:同有关物质检测方法。
3. 细菌内毒素要求:地西他滨的细菌内毒素应符合规定。
六、无菌检查
1. 方法:无菌操作法。
2. 条件:将地西他滨溶解于适当溶剂中,按照《中国药典》规定进行无菌检查。
3. 无菌要求:地西他滨应符合无菌要求。
七、渗透压摩尔浓度
1. 方法:根据《中国药典》规定进行渗透压摩尔浓度的测定。
2. 渗透压摩尔浓度要求:地西他滨的渗透压摩尔浓度应符合规定。
八、可见异物
1. 方法:通过视觉和/或显微镜进行观察。
2. 可见异物要求:地西他滨的可见异物应符合规定。
康玲分子资料

地西他滨:地西他滨在1964年由Pliml和Sorm首次合成。
文献报道的合成方法的主要反应过程是三甲基硅烷保护的二氢-s-三嗪与氯代脱氧核糖在SnCl4的催化作用下缩合得到。
新药地西他滨是治疗骨髓增生异常综合征症很有效的一种新药,就此,专家对其进行了理化性质和作用机制作出了分析:首先,地西他滨理化性质。
地西他滨外观为白色至类白色细微粉末,化学名称:4氨基-1 -(2-脱氧-B-D-赤式-呋喃核糖)-1,3,5-嗪-2(1H)酮,分子式:C8H12 N4O4,相对分子质量:228、21。
微溶于乙醇/水(50/50)、甲醇/水(50/50)、甲醇,略溶于水,溶于二甲基亚砜(DMSO)。
应置于25℃下保存,允许范围15℃~30℃。
其次,专家分析地西他滨的作用机制。
它的作用机制主要是通过磷酸化,然后直接掺入DNA,从而抑制DNA甲基化转移酶,那么,这就可以引起DNA低甲基化和细胞分化或凋亡来发挥抗肿瘤作用。
再次,通过对其进行体外试验的结果显示,地西他滨可抑制DNA甲基化,并且在产生该作用的浓度下不会明显抑制DNA的合成。
地西他滨诱导肿瘤细胞的低甲基化,从而恢复控制细胞分化增殖基因的正常功能。
在快速分裂的细胞中,掺入DNA的地西他滨可与DNA甲基转移酶共价结合从而产生细胞毒性作用,而非增殖期细胞则对地西他滨相对不敏感。
地西他滨是S周期特异性药物。
端粒是线状染色体末端的DNA重复序列,是真核染色体两臂末端由特定的DNA重复序列构成的结构,使正常染色体端部间不发生融合,保证每条染色体的完整性。
端粒是短的多重复的非转录序列(TTAGGG)及一些结合蛋白组成特殊结构,除了提供非转录DNA的缓冲物外,它还能保护染色体末端免于融合和退化,在染色体定位、复制、保护和控制细胞生长及寿命方面具有重要作用,并与细胞凋亡、细胞转化和永生化密切相关。
当细胞分裂一次,每条染色体的端粒就会逐次变短一些,构成端粒的一部分基因约50~200个核苷酸会因多次细胞分裂而不能达到完全复制(丢失),以至细胞终止其功能不再分裂。
地西他滨方案

地西他滨方案地西他滨(Docetaxel)是一种广泛应用于治疗多种癌症的药物。
它属于紫杉醇类抗肿瘤药物,通过抑制细胞有丝分裂,阻断肿瘤细胞的生长和分裂而起到抗癌作用。
地西他滨方案是一种将地西他滨与其他药物组合应用的治疗方案,能够提高治疗效果,并减少一些副作用。
地西他滨的适应症地西他滨可以用于多种癌症的治疗,包括乳腺癌、非小细胞肺癌、胃癌、卵巢癌、前列腺癌等。
在这些癌症中,地西他滨方案常被使用来进行辅助治疗或姑息性治疗。
此外,地西他滨也可在其他恶性肿瘤的治疗中应用。
地西他滨方案的组成地西他滨方案常常是结合其他抗肿瘤药物使用的,如环磷酰胺(Cyclophosphamide)、替加氟(Trastuzumab)等。
具体方案的选择通常根据患者的病情、癌症类型和癌症分期来确定。
作为一种典型的方案,地西他滨与环磷酰胺方案(TC方案)常在乳腺癌的治疗中使用。
该方案的给药周期通常为每21天一轮,每轮的给药剂量根据患者的体重和耐受性来确定。
在治疗过程中,地西他滨和环磷酰胺会交替使用,既能够提高治疗效果,又能够减少药物的副作用程度。
除了与其他药物的结合使用外,地西他滨方案还可以与放疗、内分泌治疗等综合应用,以实现更好的治疗效果。
地西他滨方案的疗效和副作用地西他滨方案在临床实践中已经证明了其良好的治疗效果。
在乳腺癌的治疗中,地西他滨与环磷酰胺方案比单药治疗能够显著提高患者的生存期和生活质量。
然而,地西他滨方案也存在一些副作用。
常见的副作用包括恶心、呕吐、脱发、乏力、食欲不振等。
此外,地西他滨可能还会对造血系统和神经系统产生一定的不良影响。
因此,在使用地西他滨方案前,应充分了解患者的身体状况,进行全面的评估和监测。
使用地西他滨方案的注意事项在应用地西他滨方案时,需注意以下几个方面:1.用药时间和剂量:地西他滨方案通常需要按照一定的剂量和周期进行治疗,患者应准确遵守医生的嘱托,不可随意停药或改变剂量。
2.肝肾功能:地西他滨通过肝肾代谢,因此患者使用地西他滨方案前需进行肝肾功能检查,以确保患者肝肾功能正常。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专业<杂质对照品>解决方案,代理中检所/EP/BP/USP/TRC/TLC/MC/STD等品牌。
以下优势品种杂质大量现货供应:
青霉素V、硫酸庆大霉素、紫苏霉素、强力霉素、阿霉素、卡那霉素碱、地红霉素、柔红霉素、非达霉素、达托霉素、
土霉素、表阿霉素、格尔德霉素、两性霉素B、硫酸新霉素、雷帕霉素、利福霉素、盐酸壮观霉素(盐酸壮大霉素)等;q:300-头孢系列:头孢丙烯,头孢西丁 ,头孢唑林,头孢呋辛,头孢克肟,氟氧头孢,头孢特仑新戊酯,头孢哌酮,头孢硫脒,-3438-头孢地尼,头孢克洛,头孢地嗪,头孢拉宗,头孢唑肟,头孢噻肟酸,头孢罗林酯,头孢吡肟,头孢拉定,头孢他美酯,
-021
杂质品种齐全未能一一陈述——欢迎咨询!!!。
