石德珂材料科学简答题
石德珂《材料科学基础》考点精讲1

空间点阵 ———晶体中的等同点在空间有规则的周期性重复排列的阵列。 晶 格 ———连接晶体点阵中阵点的几组相交平行线构成的空间格架。 晶 胞———构成晶格的最小单元。 基元 结构基元的选择 满足四个相同条件 化学成分相同 空间结构相同 排列取向相同 周围环境相同 结构基元选择举例 (a)直线上等间距排列的原子。许多单质晶体中在某一方向上原子常按此排列。例如金属铜中 原子密排列的方向就是这样排列
全国硕士研究生入学考试
石德柯《材料科学基础》
考点精讲及复习思路
目 录
第一章 材料结构和晶体结构 1 第二章 晶体缺陷 50 第三章 相图 77 第四章 凝固 119 第五章 扩散与固态相变 148 第六章 塑性变形 165 第七章 固体材料的电子结构 224
— 1—
类型 离子键 共价键
金属键
二次键
键强 最强 强
较强
弱
作用力来源
键的特点
正负离子间的库仑力
相邻原子的价电子各处于相反 方向性
的自间 的 库 无方向性、无饱和性
仑力
固溶能力
原子与 分 子 间 由 诱 导 或 永 久 电
偶极子相互作用
形成晶体的力学性能特点 硬度高、强度大,脆性大 硬度高、强度大,脆性大
— 2—
考点二:晶体与非晶体(重要等级 ★★★☆☆)
[复习思路]掌握
概念 主要差别 概念 1.晶体———原子(分子或离子)在空间按照一定规律周期性重复排列的固体. 2.非晶体———内部原子的排列是无序的,或不存在长程有序排列的固体. [例 2-1] 名词解释:晶体(2008年 西南交通大学) [例 2-2] 填空:晶体宏观对称的要素是:(1)对称中心,(2)对称轴,(3)对称面,(4)旋转反伸 轴,(5)旋转反映轴(2007年 北京工业大学) 晶体与非晶体性能的主要区别 晶体:有确定熔点 单晶体各向异性 多晶体各向同性 非晶体:无确定熔点 各向同性 非晶体的本质是过冷液体 [例 2-3] 判断:在熔化过程中,非晶态材料不同于晶态材料的最主要特点是其没有一个固定 的熔点(2009年 北京工业大学) 答案:正确
石德珂《材料科学基础》(第2版)配套题库【名校考研真题】第7章~第10章【圣才出品】

第7章扩散与固态相变一、选择题1.离子化合物中,阳离子比阴离子扩散能力强的原因在于()。
[上海交通大学2005研]A.阴离子的半径较大B.阳离子更容易形成电荷缺陷C.阳离子的原子价与阴离子不同【答案】A2.材料中能发生扩散的根本原因是()。
[华中科技大学2006研]A.温度的变化B.存在浓度梯度C.存在化学势梯度【答案】C3.在低温下,一般固体材料中发生的扩散是()。
[南京工业大学2009研]A.本征扩散B.非本征扩散C.无序扩散【答案】B【解析】固体材料在温度较高时,发生本征扩散;在低温下,则发生非本征扩散。
二、填空题1.固态金属中原子扩散的驱动力是______,其扩散方向是向关______的方向进行,其扩散机制主要有______和______;前者是原子通过______进行迁移,后者是原子通过______进行迁移,因此前者的扩散激活能比后者______;扩散系数比后者______。
[合肥工业大学2006研]【答案】化学势梯度;化学位降低;空位扩散机制;间隙机制;空位扩散;晶格间隙;小;大2.上坡扩散是指______。
扩散的驱动力是______。
[江苏大学2005研]【答案】由低浓度向高浓度方向的扩散;化学势的改变3.扩散系数越______,结构缺陷越多,扩散速度越______。
[沈阳大学2009研]【答案】小;快4.马氏体相变具有以下的一些特征:、、和等。
[南京工业大学2009研]【答案】存在习性平面;取向关系;无扩散性;速度快(或没有特定的相变温度)【解析】马氏体相变具有热效应和体积效应,相变过程是形成核心和长大的过程。
马氏体相变是无扩散相变之一,相变时没有穿越界面的原子无规行走或顺序跳跃,因而新相(马氏体)承袭了母相的化学成分、原子序态和晶体缺陷。
惯习(析)面是指马氏体相变时在一定的母相面上形成新相马氏体。
三、简答题1.解释名词扩散系数。
[东北大学2004研]答:根据菲克第一定律,在单位时间内通过垂直于扩散方向的单位截面积的扩散物质流量(称为扩散通量,用J 表示)与该截面处的浓度梯度成正比,也就是说,浓度梯度越大,扩散通量越大,相应的数学表达式为:d d C J D x=-式中,D 为扩散系数,m 2/s;C 为扩散物质(组元)的体积浓度,原子数/m 或kg/m;d C /d x 为浓度梯度;“-”号表示扩散方向为浓度梯度的反方向,即扩散组元由高浓度区向低浓度区扩散;J 为扩散通量,kg/m 2·s。
材料科学基础课后习题答案-西安交通大学-石德珂主编

2.26g
/ cm3
14-17不用看 18自己看
第四章
1.850 0C : C1 Aexp(EV kT1) 20 0C :C2 Aexp(EV kT2 )
C1 C2
exp EV k
1 ( T2
1 T1
)
exp
1.5 1018 1.38 1023
( 1 1 ) 293 1123
exp 274
ne N
Aexp EV kT
ln
3.6 1023 106 / cm3 5.351022 / cm3
8.31J
EV / mol 1073K
EV 106192J / mol
(110),(111),(121),(2 21),(210),[100],[111],[231],[120],[211]
2.11 0.77 6.69 0.77
100%
22.6%
Fe3CⅡ%(由 初中析出) 初 % 22.6%
59.36% 22.6% 13.41%
P% 初 % Fe3CⅡ% 59.36% 13.41% 45.95%
相组成物: Fe3C % 6.69 3.0 100% 55.17%
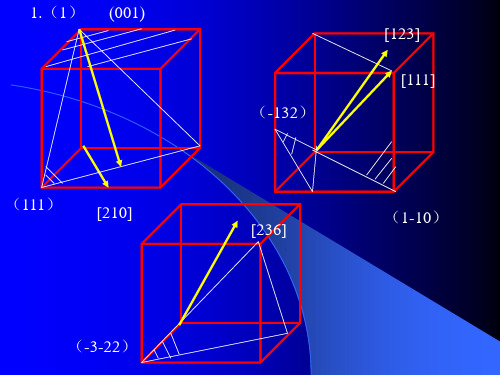
1.(1) (001) (111) [210]
(-3-22)
(-132)
[123] [111]
[236]
(1-10)
(2)
(3)
(-110)
2.
(2 6 3)
3.{111}
111
111
111
111
3.
N hk l
4 3! 2m n!
24 2m n!
{110}
110
101
011
110
《材料科学基础》考研石德珂版2021考研名校考研真题

《材料科学基础》考研石德珂版2021考研名校考研真题第一部分名校考研真题导论1.试举例分析材料加工过程对材料使用性能的影响。
[中南大学2007研]答:材料加工过程对材料使用性能有重要而复杂的影响,材料也必须通过合理的工艺流程才能制备出具有实用价值的材料来。
通过合理和经济的合成和加工方法,可以不断创制出许多新材料或改变和精确控制许多传统材料的成分和结构,可以进一步发掘和提高材料的性能。
材料的制备/合成和加工不仅赋予材料一定的尺寸和形状,而且是控制材料成分和结构的必要手段。
如钢材可以通过退火、淬火、回火等热处理来改变它们内部的结构而达到预期的性能,冷轧硅钢片经过复杂的加工工序能使晶粒按一定取向排列而大大减少铁损。
2.任意选择一种材料,说明其可能的用途和加工过程。
[中南大学2007研] 答:如Al-Mg合金。
作为一种可加工、不可热处理强化的结构材料,由于具有良好的焊接性能、优良的耐蚀性能和塑性,在飞机、轻质船用结构材料、运输工业的承力零件和化工用焊接容器等方面得到了广泛的应用。
根据材料使用目的,设计合金成分,考虑烧损等情况进行配料,如A15Mg合金板材,实验室条件下可在电阻坩埚炉中750℃左右进行合金熔炼,精炼除气、除渣后720℃金属型铸造,430~470℃均匀化退火10~20h后,在380~450℃热轧,再冷轧至要求厚度,在电阻炉中进行稳定化处理,剪切成需要的尺寸或机加工成标准试样,进行各种组织、性能测试。
3.说说你对材料的成分、组织、工艺与性能之间关系的理解。
[中南大学2007研] 答:材料的成分、组织、工艺与性能之间的关系非常紧密,互相影响。
材料的性能与它们的化学成分和组织结构密切相关,材料的力学性能往往对结构十分敏感,结构的任何微小变化,都会使性能发生明显变化。
如钢中存在的碳原子对钢的性能起着关键作用,许多金属材料中一些极微量的合金元素也足以严重影响其性能。
然而由同一元素碳构成的不同材料如石墨和金刚石,也有着不同的性能,有些高分子的化学成分完全相同而性能却大不一样,其原因是它们有着不同的内部结构。
石德珂《材料科学基础》配套题库-章节题库(材料的相结构及相图)【圣才出品】

第5章材料的相结构及相图一、选择题三元系统相图中,若存在有n条界线,则此系统相图中能连接出()条连线。
A.3B.n-1C.nD.n+1【答案】C【解析】三元系统相图中,存在几条界线就能在相图中连接出几条连线。
二、填空题1.Fe-Fe3C相图中含碳量小于______为钢,大于______为铸铁;铁碳合金室温平衡组织均由______和______两个基本相组成;奥氏体其晶体结构是______,合金平衡结晶时,奥氏体的最大含碳量是______;珠光体的含碳量是______;莱氏体的含碳量为______;在常温下,亚共析钢的平衡组织是______,过共析钢的平衡组织是______;Fe3CⅠ是从______中析出的,Fe3CⅡ是从______中析出的,Fe3CⅢ是从______中析出的,它们的含碳量为______。
【答案】2.11%C;2.11%C;铁素体(a);渗碳体(Fe3C);FCC;2.11%;0.77%;4.3%;铁素体和珠光体;珠光体和Fe3CⅡ;液相;奥氏体;铁素体;6.69%2.置换固溶体的溶解度与原子尺寸因素、______、电子浓度因素和______有关。
【答案】电负性;晶体结构三、判断题1.中间相只是包括那些位于相图中间且可以用一个分子式表示的化合物相。
()【答案】×【解析】凡是位于相图中间的各种合金相结构都统称为中间相,这其中当然包括一个分子式表示的化合物相以及一些固溶体相。
2.三元相图中的三元无变量点都有可能成为析晶结束点。
()【答案】×【解析】三元相图中三条界线的交点是三元无变量点,也是低共熔点,它的液相同时对三种晶相饱和。
低共熔点也是存在液相的最低温度点。
通过低共熔点平行于底面的平面称为固相面或结晶结束面。
固相面之下全部是固相。
四、名词解释1.中间相答:中间相是指合金中组元之间形成的、与纯组元结构不同的相。
在相图的中间区域。
2.间隙固溶体答:间隙固溶体是指若溶质原子比较小时可以进入溶剂晶格的间隙位置之中而不改变溶剂的晶格类型所形成的固溶体。
石德珂《材料科学基础》(第2版)配套题库【名校考研真题】第4章~第6章【圣才出品】

圣才电子书 十万种考研考证电子书、题库视频学习平台
②柯垂尔提出了溶质原子与位错之间的交互作用,在间隙固溶体中,由于间隙原子的半 径比晶体间隙的半径大,与位错进行弹性交互作用,结果间隙原子将在位错附近聚集,形成 小原子集团,称为柯垂尔气团。柯垂尔气团的存在,使位错运动困难,这是因为位错只有从 气团中挣脱或者抱着气团一起前进才能继续运动,这需要外力作更多的功,这就是固溶强化 效应;
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 4 章 晶体缺陷
一、选择题
1应力分量全为零 B.刃型位错的应力场中正应力分量全为零 C.刃型位错的应力场中切应力分量全为零 【答案】A
)。[上海交通大学 2005 研]
4.简述位错、位错线和柏氏矢量( b )的概念,并论述柏氏矢量和位错线的相对关系。 [吉林大学 2009 研] 答:(1)位错是晶体材料的一种内部微观缺陷,指原子的局部不规则排列(晶体学缺 陷)。从几何角度看,位错属于一种线缺陷,可视为晶体中已滑移部分与未滑移部分的分界 线,其存在对材料的物理性能,尤其是力学性能,具有极大的影响。 位错线是指晶体或晶格内滑移面上已滑动区的边界线称。位错线的形成和发展可用 Frank Read 源的原理解释:当应力超过临界剪应力时,位错线扩张,形成内外两部分,外 部位错逐渐扩大,内部位错线恢复原状,在外力作用下,不断产生新位错环,因而得到很大 的滑移量。 柏氏矢量是描述位错实质的重要物理量,反映出柏氏回路包含的位错所引起点阵畸变的 总积累。通常将柏氏矢量称为位错强度,位错的许多性质如位错的能量、所受的力、应力场、 位错反应等均与其有关。它也表示出晶体滑移时原子移动的大小和方向。 (2)柏氏矢量和位错线的相对关系: ①一条位错线具有唯一的柏氏矢量。它与柏氏回路的大小和回路在位错线上的位置无 关,位错在晶体中运动或改变方向时,其柏氏矢量不变; ②根据柏氏矢量与位错线的关系可以确定位错的类型。当柏氏矢量垂直于位错线时是刃 位错;当柏氏矢量平行于位错线时是螺位错;当柏氏矢量与位错线成任意角度时是混合位错。
石德珂《材料科学基础》配套题库-章节题库(材料概论)【圣才出品】

第10章材料概论
一、判断题
金属材料是晶体,即金属原子在整个空间都是按一定的几何规律成周期性重复排列的。
()
【答案】×
【解析】金属在固态下一般都是晶体。
二、简答题
1.何谓塑料?何谓橡胶?两者在室温时的力学性能有何显著差别?
答:塑料是指室温下处于玻璃态的高分子材料。
橡胶是指室温下处于高弹态的高分子材料。
室温下,塑料的硬度较高,但其脆性较大,容易脆性断裂,弹性较低;橡胶的硬度较低,但脆性较小,不易断裂,弹性较高容易发生弹性变形。
2.何谓陶瓷?从组织结构的角度解释其主要性能特点。
答:陶瓷主要是由无机非金属作为基体组分组成的。
以共价键或离子键为主,在共价键结合的陶瓷中,原子之间是通过共用电子对形式进行键合的,具有方向性和饱和性,且键能相当高,陶瓷主要是由高硬度高脆性的特殊氧化物、碳化物、氮化物等化合物为主要组成相的一类材料。
由于这些化合物中的结合键以共价键或离子键为主,键合力稳定并且很强,故陶瓷材料具有熔点高,热膨胀系数小,硬度高,抗氧化、耐腐蚀,高温强度高,良好的光学特性和绝缘性等特性;但由于烧结及制备工艺等原因,陶瓷材料中难免存在气孔或微裂纹,故陶瓷材料的脆性大,强度低且易存在缺陷。
三、计算题
1 / 2
在制造Al2O3陶瓷材料时,原料粉末的粒度为2μm。
在烧结温度下保温30分钟,测得晶粒尺寸为10μm,则在同一烧结温度下保温2小时后,晶粒尺寸为多少μm?为抑制晶粒生长在原料粉末中加入0.2%MgO,并在同样的烧结温度下保温2小时,则晶粒尺寸为多少μm?
解:d1=20μm(D2=kt);d2=16μm(D3=kt)。
2 / 2。
石德珂《材料科学基础》配套题库-章节题库(固体材料的电子结构与物理性能)【圣才出品】

第9章固体材料的电子结构与物理性能一、简答题1.简明解释为什么晶格中两个电子可以由吸引作用而形成库柏对。
答:电子间通过交换格波声子而产生间接的相互作用,例如波矢为的电子发射一个波矢为的声子被散射到波矢为的状态,第二个电子本来的波矢为,吸收了第一个电子发射的声子进入波矢为的状态。
另一过程是第一个电子吸收一个由第二个电子发射的波矢为的声子而由k1散射到第二个电子则从散射到,按照量子理论,如果能量差是声子角频率),则相互作用能为负,即电子间具有净的吸引作用而形成库柏对。
显然,只有在费密面附近的是德拜角频率)范围内的电子才能满足上述条件。
2.(1)写出固体热导率的定义和公式。
(2)指出传导热流的元激发。
(3)指出在低温和高温下热导率对温度的依赖关系,并描述在这两个区间内的主要物理过程。
答:(1)固体热导率的定义为:单位温度梯度所引起的热量流密度,即式中的系数k,在非金属固体热导率的表示式为式中,c为固体热容;为声子的平均速度;l为声子的平均自由程。
(2)传导热流的元激发为声子。
(3)对于金属,其热导率通常由晶格热导率k a(由声子贡献)及电子热导率k e(由自由电子贡献)两部分所组成,即式中,以典型值代入后得因此,典型金属的热导率主要由自由电子贡献,即式中,le为电子平均自由程,依赖于电子-声子散射过程。
所以式中,为温度为T时的平均声子数。
在高温区:,则,所以,,与温度无关。
在低温区:,则,所以,在极低温区:声子数很少,主要是杂质散射,是杂质密度)与t无关,所以3.示意画出n型半导体电导率随温度的变化曲线,并用能带理论定性解释上述曲线。
答:(1)如图9-1所示。
图9-1(2)n型半导体中的载流子包括掺杂的施主电子及本征半导体固有的电子和空穴,但施主电子跃迁所需克服的能垒E d小于本征电子和空穴跃迁所需克服的能垒E g/2。
①温度较低时,本征电子和空穴的热激活跃迁几率很小,而施主电子跃迁几率较大且随温度升高而呈指数增大,此时电导率主要由掺杂的施主电子提供。
石德珂《材料科学基础》(第2版)配套题库【章节题库】第4章~第6章【圣才出品】

几何条件: 能量条件:
b
b
a [111]
前
后
b
2
2 a2
3b2 1 a2
前3
后3
几何条件和能量条件均满足。
7.一个 b=a/2
的螺位错在(111)面上运动。若在运动过程中遇到障碍物而发
生交滑移,请写出交滑移系统。
答:所有包含螺位错方向的面都是滑移面,对于 FCC 晶体滑移面(111)来说,只有
a)位错环及所受应力状况;b)位错环的平衡形状 图 4-2
答:位错环的平衡形状如图 4-2(b)所示。
6.若面心立方晶体中有 b= a [101]的单位位错及 b= a [121]的不全位错,此二位
2
6
错相遇能否进行位错反应?为什么?
答:能够发生反应。
4 / 69
圣才电子书 十万种考研考证电子书、题库视频学习平台
4.请说明什么是全位错和不全位错,并请写出 FCC、BCC 和 HCP 晶体中的最短单位 位错的柏氏矢量。
3 / 69
圣才电子书 十万种考研考证电子书、题库视频学习平台
答:全位错是指柏氏矢量等于点阵矢量的整数倍。 不全位错是指柏氏矢量不等于点阵矢量的滑移面上,正方形的两 边分别沿 x 和 y 轴,柏氏矢量沿 z 轴。如果位错环只能滑移,示意画出在以下两种应力分布 情况下位错环的平衡形状:
【答案】√
十万种考研考证电子书、题库视频学习平台
【解析】书写缺陷方程时要注意:(1)缺陷所带电荷的确定;(2)保持位置关系比例
不变。
2.非化学计量化合物结构缺陷也是一种杂质缺陷。( ) 【答案】× 【解析】非化学计量化合物是指有些化合物,其化学组成会明显的随着周围气氛的性质 和压力的大小的变化而发生组成偏离化学计量的现象,而非化学计量化合物结构缺陷正是由 此而产生的缺陷。
石德珂材料科学填空题

《材料科学基础》填空题第一章材料结构的基本知识1.原子核外电子的分布与四个量子数有关,且服从下述两个基本原理:泡利不相容原理和最低能量原理2.原子结合键中一次键(强健)有离子键、共价键、金属键:二次键(弱健)有范德瓦尔斯键、氢键、离子晶体和原子晶体硬度高,脆性大,熔点高、导电性差。
3.金属晶体导电性、导热性、延展性好,熔点较高。
4.能量最低的结构称为稳态结构或平衡态结构,能量相对较高的结构则称为亚稳态结构;5.材料的稳态结构与亚稳态结构由热力学条件和动力学条件共同决定;第二章材料的晶体结构1、晶体结构中基元就是化学组成相同、空间结构相同、排列取向相同、周围环境相同的基本单元2、简单立方晶胞中(100)、(110)、(111)晶面中,面间距最小的是(111)面,最大的是(100)面;3、晶面族{100}包含(100)(010)(001)及平行(100K010K001)等晶面;4、(100),(210),(110),⑵0)等构成以[001]为晶带轴的晶带;(010,(011),(101),(110)等构成以[111]为晶带轴的晶带;5、晶体宏观对称元素只有1,2, 3, 4, 6, 1,m,等8种是基本的6、金属中常见的晶体结构有面心立方、体心立方、密排六方三种;7、金属密堆积结构中的间隙有四面体间隙和八面体间隙两种类型8、面心立方晶体中1个晶胞内有生个八面体间隙,E个四面体间隙。
9、陶瓷材料是以离子键、共价键以及离子键和共价键的混合键结合在一起;10、硅酸盐的基本结构单元是硅酸根四面体:11、SiO2中主要化学键为共价键与离子与:12、硅酸盐几种主要结构单元是岛状结构单元、双四面体结构单元、环状结构单元以及链状结构单元、层状结构单元;13、离子晶体中决定正负离子堆积方式的两因数是:电荷大小,满足电中性;正负离子的相对大小;14、陶瓷材料的组成相有玻璃相、气相和结晶相(a) (b>15、上图为离子晶体中稳定和不稳定的配位图形,—为不稳定配位图形第三章高分子材料的结构1. 1.按照聚合物热行为可将聚合物分为热固性塑料和一热塑性塑料一两类。
石德珂《材料科学基础》(第2版)配套题库【章节题库】第1章~第3章【圣才出品】

3.原子的结合键有哪几种?各有什么特点? 答:原子的结合键有: (1)离子键。其特点是:正负离子相互吸引;键合很强,无饱和性,无方向性;熔点、
2 / 47
圣才电子书 十万种考研考证电子书、题库视频学习平台
硬度高,固态不导电,导热性差。 (2)共价键。其特点是:相邻原子通过共用电子对结合;键合强,有饱和性,有方向
一、简答题 1.在元素周期表中,同一周期或同一主族元素原子结构有什么共同特点?从左到右或 从上到下元素结构有什么区别?它的性质如何递变? 答:同一周期元素具有相同原子核外电子层数,但从左→右,核电荷依次增多,原子半 径逐渐减小,电离能增加,失电子能力降低,得电子能力增加,金属性减弱,非金属性增强; 同一主族元素最外层电子数相同,但从上→下,电子层数增多,原子半径增大,电离能降低, 失电子能力增加,得电子能力降低,金属性增加,非金属性降低。
2.金属的加工硬化特性对金属材料的使用带来哪些利弊? 答:有利方面:作为提高金属材料强度的一种手段;便于金属材料塑性成形;使金属零 件得以抵抗偶然过载。不利方面:使金属难以进一步冷塑性变形。
1 / 47
圣才电子书 十万种考研考证电子书、题库视频学习平台
第 1 章 材料结构的基础知识
圣才电子书
十万种考研.什么是金属的加工硬化现象? 答:金属材料在塑性变形过程中,所施加的流变应力随应变量的增大而不断增大的现象, 称为加工硬化。或金属材料经冷塑性变形后,其强度、硬度升高,塑性、韧性下降的现象, 称为加工硬化。
2.与(211)和(101)同属一晶带的有( )。 A. (0 11) B. (121) C. (010) D. (221) 【答案】A
3.两晶体的空间点阵相同,则( )。 A.它们的晶体结构相同 B.它们的对称性相同 C.它们所属的晶系相同 D.它们所属的空间群相同 【答案】C
石德珂材料科学简答题

《材料科学基础》简答题第一章材料结构的基本知识1、说明结构转变的热力学条件与动力学条件的意义。
答:结构转变的热力学条件决定转变是否可行,是结构转变的推动力,是转变的必要条件;动力学条件决定转变速度的大小,反映转变过程中阻力的大小。
2、说明稳态结构与亚稳态结构之间的关系。
答:稳态结构与亚稳态结构之间的关系:两种状态都是物质存在的状态,材料得到的结构是稳态或亚稳态,取决于转交过程的推动力和阻力(即热力学条件和动力学条件),阻力小时得到稳态结构,阻力很大时则得到亚稳态结构。
稳态结构能量最低,热力学上最稳定,亚稳态结构能量高,热力学上不稳定,但向稳定结构转变速度慢,能保持相对稳定甚至长期存在。
但在一定条件下,亚稳态结构向稳态结构转变。
3、说明离子键、共价键、分子键和金属键的特点。
答:离子键、共价键、分子键和金属键都是指固体中原子(离子或分子)间结合方式或作用力。
离子键是由电离能很小、易失去电子的金属原子与电子亲合能大的非金属原于相互作用时,产生电子得失而形成的离子固体的结合方式。
共价键是由相邻原子共有其价电子来获得稳态电子结构的结合方式。
分子键是由分子(或原子)中电荷的极化现象所产生的弱引力结合的结合方式。
当大量金属原子的价电子脱离所属原子而形成自由电子时,由金属的正离子与自由电子间的静电引力使金属原子结合起来的方式为金属键。
4、原子中的电子按照什么规律排列答:原子核周围的电子按照四个量子数的规定从低能到高能依次排列在不同的量于状态下,同一原子中电子的四个量子数不可能完全相等。
第二章材料的晶体结构1、在一个立方晶胞中确定6个表面面心位置的坐标。
6个面心构成一个正八面体,指出这个八面体各个表面的晶面指数、各个棱边和对角线的晶向指数。
解八面体中的晶面和晶向指数如图所示。
图中A、B、C、D、E、F为立方晶胞中6个表面的面心,由它们构成的正八面体其表面和棱边两两互相平行。
ABF面平行CDE面,其晶面指数为(111);ABE面平行CDF面,其晶面指数为(111);ADF面平行BCE面,其晶面指数为(111);ADE 面平行BCF 面,其晶面指数为(111)。
石德珂计算题.

《材料科学基础》计算题第一章 材料结构的基本知识1、计算下列晶体的离于键与共价键的相对比例(1)NaF (2)CaO (3)ZnS 。
已知 Na 、F 、Ca 、O 、Zn 、S 的电负性依次为0.93、3.98、1.00、3.44、1.65、2.58。
解:1、查表得:X Na =0.93,X F =3.98根据鲍林公式可得NaF 中离子键比例为:21(0.93 3.98)4[1]100%90.2%e ---⨯=共价键比例为:1-90.2%=9.8% 2、同理,CaO 中离子键比例为:21(1.00 3.44)4[1]100%77.4%e---⨯=共价键比例为:1-77.4%=22.6%3、ZnS 中离子键比例为:21/4(2.581.65)[1]100%19.44%ZnS e --=-⨯=中离子键含量共价键比例为:1-19.44%=80.56%第二章 材料的晶体结构1、标出图2中ABCD 面的晶面指数,并标出AB 、BC 、AC 、BD 线的晶向指数。
解:晶面指数:ABCD 面在三个坐标轴上的截距分别为3/2a,3a,a, 截距倒数比为3:1:21:31:32= ∴ABCD 面的晶面指数为 (213) 4分晶向指数:AB 的晶向指数:A 、B 两点的坐标为 A (0,0,1),B (0,1,2/3) (以a 为单位) 则 )31,1,0(-=,化简即得AB 的晶向指数]103[ 二(2)图 同理:BC 、AC 、BD 线的晶向指数分别为]230[,]111[,]133[。
各2分2、计算面心立方、体心立方和密排六方晶胞的致密度。
解:面心立方晶胞致密度: η=V a /V=33344ar π⨯ =0.74 6分 体心立方晶胞致密度: η=V a /V =33342ar π⨯ =0.68 6分 密排六方晶胞致密度: η=V a /V =ca r ⨯⨯⨯60sin 334623π(理想情况下) 8分 3、用密勒指数表示出体心立方、面心立方和密排六方结构中的原子密排面和原子密排方向,并分别计算这些晶面和晶向上的原子密度。
复旦大学材料科学导论课后习题答案(搭配_石德珂《材料科学基础》教材)

复旦⼤学材料科学导论课后习题答案(搭配_⽯德珂《材料科学基础》教材)材料科学导论课后习题答案第⼀章材料科学概论1.氧化铝既牢固⼜坚硬且耐磨,但为什么不能⽤来制造榔头?答:氧化铝脆性较⾼,且抗震性不佳。
2.将下列材料按⾦属、陶瓷、聚合物和复合材料进⾏分类:黄铜、环氧树脂、混泥⼟、镁合⾦、玻璃钢、沥青、碳化硅、铅锡焊料、橡胶、纸杯答:⾦属:黄铜、镁合⾦、铅锡焊料;陶瓷:碳化硅;聚合物:环氧树脂、沥青、橡胶、纸杯;复合材料:混泥⼟、玻璃钢3.下列⽤品选材时,哪些性能特别重要?答:汽车曲柄:强度,耐冲击韧度,耐磨性,抗疲劳强度;电灯泡灯丝:熔点⾼,耐⾼温,电阻⼤;剪⼑:硬度和⾼耐磨性,⾜够的强度和冲击韧性;汽车挡风玻璃:透光性,硬度;电视机荧光屏:光学特性,⾜够的发光亮度。
第⼆章材料结构的基础知识1.下列电⼦排列⽅式中,哪⼀个是惰性元素、卤族元素、碱族、碱⼟族元素及过渡⾦属?(1) 1s2 2s2 2p6 3s2 3p6 3d7 4s2(2) 1s2 2s2 2p6 3s2 3p6(3) 1s2 2s2 2p5(4) 1s2 2s2 2p6 3s2(5) 1s2 2s2 2p6 3s2 3p6 3d2 4s2(6) 1s2 2s2 2p6 3s2 3p6 4s1答:惰性元素:(2);卤族元素:(3);碱族:(6);碱⼟族:(4);过渡⾦属:(1),(5)2.稀⼟族元素电⼦排列的特点是什么?为什么它们处于周期表的同⼀空格内?答:稀⼟族元素的电⼦在填满6s态后,先依次填⼊远离外壳层的4f、5d层,在此过程中,由于电⼦层最外层和次外层的电⼦分布没有变化,这些元素具有⼏乎相同的化学性质,故处于周期表的同⼀空格内。
3.描述氢键的本质,什么情况下容易形成氢键?答:氢键本质上与范德华键⼀样,是靠分⼦间的偶极吸引⼒结合在⼀起。
它是氢原⼦同时与两个电负性很强、原⼦半径较⼩的原⼦(或原⼦团)之间的结合所形成的物理键。
当氢原⼦与⼀个电负性很强的原⼦(或原⼦团)X结合成分⼦时,氢原⼦的⼀个电⼦转移⾄该原⼦壳层上;分⼦的氢变成⼀个裸露的质⼦,对另外⼀个电负性较⼤的原⼦Y表现出较强的吸引⼒,与Y之间形成氢键。
《材料科学基础》考研石德珂版2021考研名校考研真题

《材料科学基础》考研石德珂版2021考研名校考研真题《材料科学基础》考研石德珂版2021考研名校考研真题第一部分名校考研真题导论1.试举例分析材料加工过程对材料使用性能的影响。
[中南大学2007研]答:材料加工过程对材料使用性能有重要而复杂的影响,材料也必须通过合理的工艺流程才能制备出具有实用价值的材料来。
通过合理和经济的合成和加工方法,可以不断创制出许多新材料或改变和精确控制许多传统材料的成分和结构,可以进一步发掘和提高材料的性能。
材料的制备/合成和加工不仅赋予材料一定的尺寸和形状,而且是控制材料成分和结构的必要手段。
如钢材可以通过退火、淬火、回火等热处理来改变它们内部的结构而达到预期的性能,冷轧硅钢片经过复杂的加工工序能使晶粒按一定取向排列而大大减少铁损。
2.任意选择一种材料,说明其可能的用途和加工过程。
[中南大学2007研] 答:如Al-Mg合金。
作为一种可加工、不可热处理强化的结构材料,由于具有良好的焊接性能、优良的耐蚀性能和塑性,在飞机、轻质船用结构材料、运输工业的承力零件和化工用焊接容器等方面得到了广泛的应用。
根据材料使用目的,设计合金成分,考虑烧损等情况进行配料,如A15Mg合金板材,实验室条件下可在电阻坩埚炉中750℃左右进行合金熔炼,精炼除气、除渣后720℃金属型铸造,430~470℃均匀化退火10~20h后,在380~450℃热轧,再冷轧至要求厚度,在电阻炉中进行稳定化处理,剪切成需要的尺寸或机加工成标准试样,进行各种组织、性能测试。
3.说说你对材料的成分、组织、工艺与性能之间关系的理解。
[中南大学2007研] 答:材料的成分、组织、工艺与性能之间的关系非常紧密,互相影响。
材料的性能与它们的化学成分和组织结构密切相关,材料的力学性能往往对结构十分敏感,结构的任何微小变化,都会使性能发生明显变化。
如钢中存在的碳原子对钢的性能起着关键作用,许多金属材料中一些极微量的合金元素也足以严重影响其性能。
石德珂材料科学选择题

《材料科学基础》选择题第一章 材料结构的基本知识1、原子结合健中 B 的键的本质是相同的A 、金属键与离子键B 、氢键与范德瓦尔斯键C 、离子键与共价键2、钨、钼熔点很高,其结合键是 A 的混合键A 、金属键和离子键B 、金属键和共价键C 、离子键和共价键3、MgO 、Al2O3等的结合键是 C 的混合键A 、金属键和离子键B 、金属键和共价键C 、离子键和共价键4、工程材料的强度与结合键有一定的联系,结合键能高的其强度也 A 些。
A 、高B 、低5、激活能反应材料结构转变 B 的大小;A 、动力B 、阻力6、材料处于能量最低状态称为 A ;A 、稳态结构B 、亚稳态结构7、一般而言,晶态结构的能量比非晶态要 B ;A 、高B 、低C 、相等第二章 材料的晶体结构1. 氯化铯(CsCl )为有序体心立方结构,它属于 CA 、体心立方B 、面心立方C 、简单立方点阵;2. 理想密排六方结构金属的c/a 为 BA 、1.6B 、2(2/3)1/2; C 、2/33. 对面心立方晶体而言,表面能最低的晶面是 cA 、 (100);B 、(110),C 、(111);D 、(121)4. 下列四个六方晶系的晶面指数中,哪一个是错误的: CA 、(1322);B 、(0112);C 、(0312) ;D 、(3122)5. 面心立方结构的铝中,每个铝原子在本层(111)面上的原子配位数为 BA 、12;B 、6;C 、4;D 、36. 简单立方晶体的致密度为 CA 、100%B 、65%C 、52%D 、58%7. 立方晶体中(110)和(211)面同属 D 晶带A 、[110]B 、[100]C 、[211]D 、[111]8. 立方晶体中(111)和(101)面同属 D 晶带A 、[111]B 、[010]C 、[011]D 、]011[9.原子排列最密的一族晶面其面间距A、最小B、最大10.六方晶系中和(1121)晶面等同的晶面是 AA、(1211)面;B、(1112)面;C、(1211)面;D、(2111)面11.配位数是指晶体结构中: BA、每个原子周围的原子数;B、每个原子周围最邻近的原子数;C、每个原子周围的相同原子数;D、每个原子周围最邻近的和次近邻的原子数之和12.密排六方与面心立方均属密排结构,他们的不同点是: DA、晶胞选取方式不同;B、原子配位数不同;C、密排面上,原子排列方式不同;D、原子密排面的堆垛方式不同13.在立方晶系中,与(101)、(111)同属一晶带的晶面是: dA、(110); Bb、(011); C、(110); D、(010)14.TiC与NaCl具有相同的晶体结构,但它们不属于同一类中间相,这是因为: DA、TiC是陶瓷,NaCl是盐;B、NaCl符合正常化合价规律,TiC不符合正常化合价规律;C、TiC中电子浓度高,D、NaCl的致密度高15.立方晶体中(110)和(310)面同属 D 晶带A、[110]B、[100]C、[310]D、[001]16.14种布拉菲点阵: AA、按其对称性分类,可归结为七大晶系;B、按其点阵常数分类,可归结为七大晶系;C、按阵点所在位置分类,可归结为七大晶系D;、按其几何形状分类,可归结为七大晶系17.与(113)和(112)同属一晶带的有: CA、(112),B、(221)C、(110)D、(211)18.引入空间点阵概念是为了: CA、描述原子在晶胞中的位置,B、描述晶体的对称性,C、描述晶体结构周期性,D、同时描述晶体结构周期性和对称性19.有A、B两晶体,下面几种说法中正确的是 C ;A、所属空间点阵相同,则此两晶体的结构相同;B、晶体结构相同,它们所属空间点阵可能不同;C、晶体结构不同,它们所属空间点阵必然不同;D、所属空间点阵不同,晶体结构可能相同20.体心立方晶体中间隙半径比面心立方中的小,但BCC的致密度却比FCC低,这是因为: DA、BCC中原子半径小,B、BCC中的密排方向<111>上原子排列比FCC密排方向上的原子排列松散,C、BCC中的原子密排面{110}的数量太少,D、BCC中的原子配位数比FCC中原子配位数低21.组成固溶体的两组元完全互溶的必要条件是: BA、两组元的电子浓度相同,B、两组元的晶体结构相同,C、两组元的原子半径相同,D、两组元的电负性相同,22.晶体结构和空间点阵的相互关系 CA、空间点阵的每一阵点代表晶体中的一个原子;B、每一种空间点阵代表唯一的一种晶体结构;C、晶体结构一定,它所属的空间点阵也唯一地被确定;D、每一种晶体结构可以用不同的空间点阵表示23.晶体中配位数和致密度之间地关系是 AA、配位数越大,致密度越大;B、配位数越小,致密度越大;C、配位数越大,致密度越小,D、两者之间无直接联系24.离子晶体和纯金属晶体各有配位数的概念,两者的含义: CA、完全相同,B、不同,离子晶体的配位数是指最近邻的同号离子数,而纯金属晶体的配位数是指最近邻的原子数,C、不同,离子晶体的配位数是指最近邻的异号离子数,而纯金属晶体的配位数是指最近邻的原子数,D、不同,离子晶体的配位数是指最近邻的异号离子数,而纯金属晶体的配位数是指最近临和次近邻的原子数之和25.在离子晶体中 BA、阳离子半径大于阴离子半径;B、阴离子半径大于阳离子半径;C、阳离子半径与阴离子半径相等;D、阳离子半径可以大于阴离子半径;也可以小于阴离子半径;26.硅酸根四面体中的氧离子 CA、只属于一个硅酸根四面体;B、可以被多个硅酸根四面体共用;C、只能被两个硅酸根四面体共用;D、可以被四个硅酸根四面体共用第三章高分子材料的结构1.已知聚氯乙烯的平均相对分子质量是27500,则其平均聚合度是(A )。
石德珂《材料科学基础》(第2版)配套题库【章节题库】第7章~第10章【圣才出品】

C.浓度趋于均匀
【答案】C;A
4.(多选)在石英的相变中,属于重建型相变的是( )。 A.α-石英 α-鳞石英 B.α-石英 β-石英 C.α-鳞石英 α-方石英 D.α-方石英 β-方石英 【答案】A;C
二、填空题 1.马氏体相变具有以下的一些特征:______、______、______和______等。 【答案】存在习性平面;取向关系;无扩散性;速度快
3.马氏体相变的结晶学特征表现为:______、______和______等。 【答案】存在习性平面;严格的取向关系;维持共格关系
4.本征扩散是由______而引起的质点迁移,本征扩散的活化能由______和______两部分
组成,扩散系数与温度的关系式为:______。
3.在扩散系数的热力ຫໍສະໝຸດ 关系中,()称为扩散系数的热力学因子。在非理想混
合体系中:
当扩散系数的热力学因子>0 时,扩散结果使溶质( );
当扩散系数的热力学因子<0 时,扩散结果使溶质( )。
1 / 54
圣才电子书
A.发生偏聚
十万种考研考证电子书、题库视频学习平台
B.浓度不改变
2.上坡扩散 答:上坡扩散是指原子从低浓度向高浓度处的扩散,扩散的驱动力是化学位梯度。
3.非稳态扩散 答:非稳态扩散是指在扩散过程中任何一点的浓度都随时间不同而变化的扩散。
五、简答题 1.固相烧结与液相烧结的主要传质方式?固相烧结与液相烧结之间有何相同与不同之 处? 答:(1)固相烧结有蒸发-凝聚传质和扩散传质;液相烧结有流动传质和溶解.沉淀传 质; (2)相同点:①烧结推动力,②烧结过程; 不同点:①烧结速率,②致密化过程,③影响因素。
5.马氏体相变时的自由焓-成分曲线如图 7-2 所示。
材料科学基础(石德珂)重点

固溶体:以合金中某一组元作为溶剂,其他组元作为溶质,所形成的与溶剂有相同的晶体结构、晶格常数稍有变化的固相称为固溶体无限固溶:溶质能以任何比例溶入溶剂中,形成完全互溶的固溶体小角度晶界:晶界两侧晶粒位相差角小于10°的晶界,基本上由位错组成大角度晶界:相邻两晶粒的位相差大于10度的晶界珠光体:铁碳平衡相图的共析反应产物,是铁素体与渗碳体的共析混合物超点阵:溶质原子呈完全有序分布的固溶体为有序固溶体,或称超点阵全位错:柏氏矢量等于点阵矢量的位错称为全位错共晶转变:由一定成分的液相同时结晶出两个一定成分固相的转变多晶型转变:当外界条件改变时,元素的晶体结构可以发生转变,把金属的这种转变称为多晶型转变离子晶体:由正负离子通过离子键按一定方式堆积起来而形成的晶体置换固溶体:溶质原子占据了溶剂晶格某些结点位置所形成的固溶体间隙固溶体:溶质原子进入溶剂晶格的间隙所形成的固溶体不全位错:柏氏矢量小于点阵矢量的称为不全位错包晶转变: 由一个特定成分的固相和液相生成另一个特点成分固相的转变固溶强化:由于溶质原子的固溶而引起的强化叫固溶强化堆垛层错: 实际晶体结构中,密排面的正常堆垛顺序有可能遭到破坏而错排位错密度:单位体积晶体中所包含的位错线的总长度柯氏气团:溶质原子与位错交互作用后,在周围偏聚的现象称为柯氏气团比基体小的置换式原子和空位被吸引到刃位错周围的压缩区,而比基体间隙大的间隙原子和置换原子被吸引到刃位错的扩张区,这种溶质原子偏聚与刃位错产生的弹性交互作用称为Cottrell气团。
超离子导电性:一部分离子晶体的扩散激活能很低,在室温下有较高的导电率螺位错:柏氏矢量平行于位错线的位错刃位错:柏氏矢量与位错线垂直的位错扩展位错:两个不全位错中间夹一层错的位错组态全位错:位错的柏氏矢量等于点阵矢量的整数倍的位错不全位错:柏氏矢量小于单位点阵矢量的位错一次键:结合力较强,在分子内起键合作用的强键。
包括离子键共价键和金属键二次键:结合力较弱,分子之间的相互作用大都为弱键包括范德瓦耳斯键和氢键相:结构相同,物理和化学性质完全均匀的部分交滑移:螺位错在滑移面上滑移受阻后,绕到与此滑移面相交的另一个滑移面上滑移组元:材料中基本的、独立的物质,可以是纯元素、也可以是化合物,及金属和非金属元素合金:由两种或两种以上的金属和非金属组成的、具有金属特性的物质相变:相与相之间的转变成为相变吉布斯相律:处于热力学平衡状态的系统中,自由度与组元和相数之间的关系伪共晶:在不平衡结晶的条件下,不在共晶成分点处的合金,也能全部转变成共晶组织共析反应:一个特定成分的固相生成另外两个特定成分的固相过饱和点缺陷:晶体中的点缺陷数量超过了其平衡浓度位错反应:位错除相互作用外,还可能发生分解或合成均匀形核:在均一的液相中靠自身的结构起伏和能量起伏形成新相核心的过程非均匀形核:形核依附于液相中某种固体表面(外来杂质表面或容器壁)上形成的过程形核率:单位时间、单位体积内液相中形成的晶核数目平均分配系数:合金平衡凝固时,固相的成分与液相成分的比值渗碳体:Fe3C,是铁与碳的间隙化合物,其含碳量为6.69%,是铁碳合金中的重要基本相滑移:在切应力作用下,晶体的一部分相对于另一部分沿着一定的晶面(滑移面)和晶向(滑移方向)产生相对位移,且不破坏晶体内部原子排列规律性的塑变方式派-拉力:在理想晶体中位错在点阵周期场中运动时所需克服的阻力孪生:晶体在切应力作用下,沿一定的晶面(孪晶面)和晶向(孪晶方向),在一个区域内发生连续的切变,使已变形的晶体部分与未变形的晶体部分保持镜面对称的关系,即产生孪晶的过程临界切应力:单晶体受拉伸,当拉伸轴沿一定晶向,只有当外应力在某个滑移面的滑移方向上的分切应力达到某一临界值时,晶体开始滑移,产生变形,这一临界应力值就称临界切分应力形变织构:在塑性变形中,随着变形量的增加,多晶体中原来为向互不相同的晶粒在空间位向上呈现一定程度的一致组织:各相晶粒的相对含量、尺寸大小、形状分布等形貌特征,有多相组织、单相组织间隙化合物:半径较小的非金属原子(C、N、B、O等),处于过渡族金属晶体的间隙中,形成的化合物称为间隙化合物固溶强化:由于溶质原子进入溶剂晶格的间隙或结点,使晶格发生畸变,使固溶体硬度和强度升高一次固溶体:溶剂原子为单质(纯元素)的固溶体称为一次固溶体二次固溶体:溶剂为化合物的固溶体为二次固溶体同素异构:同种组分金属在不同的温度和压力下具有不同的晶体结构的现象攀移:刃位错在垂直于滑移面是方向上的运动有序化:有序固溶体在某一温度以上可以转变成无序固溶体,重新冷却到该温度以下时又转变成有序固溶体,这一转变过程为有序化辨析题相的特点:相与相之间存在有明显的界面;界面两端,物质性质有飞跃性的改变;一个体系中可以存在一个或多个相。
材料科学基础习题答案西安交通大学石德珂主编
2
2
41
4
221
11
2
0
1
2
1
0
6.
晶面及 {100} {110} {111} 〈100〉 〈110〉 〈111〉 晶向
bcc
1
2
31
2 23
a2
a2
3a 2
a
2a 3a
fcc
2
2 43 1
2
3
a2
a 2 3a2
a
a
3a
密排面指数 密排面原子密度 密排方向指数 密排方向原 子密度
bcc (110)
13.
m V
(35.453 22.99) 4 6.021023 (0.278 2)3 1021
2.26g
/ cm3
14-17不用看 18自己看
第四章
1.850 0C : C1 Aexp(EV kT1) 20 0C :C2 Aexp(EV kT2 )
C1 C2
exp EV k
1 ( T2
8.(1)AB和CD位错线的形状都不变, 但AB的长度缩短b2,CD的长度加b1
(2)AB位错上形成右螺型扭折,EF上 形成左螺型扭折。
9.半径为r1的位错环。10.自己看
11.(1)能,因为能量降低
(2)
b
a 3
111 ,
Frank不全位错
15.
在
111
面内:a 2
110
a 6
211
(2)在上述切应力作用下,位错线de将 向左(或向右)移动,即沿着与位错线 de垂直的方向(且在滑移面上)移动。 当位错线沿滑移面旋转360度后。在晶体 表面沿柏氏矢量方向产生宽度为一个b的 台阶
石德珂《材料科学基础》配套题库-章节题库(材料结构的基础知识)【圣才出品】

第1章材料结构的基础知识一、简答题1.在元素周期表中,同一周期或同一主族元素原子结构有什么共同特点?从左到右或从上到下元素结构有什么区别?它的性质如何递变?答:同一周期元素具有相同原子核外电子层数,但从左→右,核电荷依次增多,原子半径逐渐减小,电离能增加,失电子能力降低,得电子能力增加,金属性减弱,非金属性增强;同一主族元素最外层电子数相同,但从上→下,电子层数增多,原子半径增大,电离能降低,失电子能力增加,得电子能力降低,金属性增加,非金属性降低。
2.试写出原子序数为11的钠与原子序数为20的钙原子的电子排列方式。
解:钠原子的原子序数为11,有11个电子。
电子首先进入能量最低的第一壳层,它只有s态一个亚壳层,可容纳2个电子,电子状态计作1s2。
然后逐渐填入能量较高的2s、2p,分别容纳2个和6个电子,电子状态计作2s2和2p6。
第11个电子进入第三壳层的s 态。
所以,钠原子的电子排列为:钙原子有20个电子,填入第一壳层和第一壳层电子的状态与钠原子相似。
当电子填入第三壳层s态和p态后仍有2个剩余电子。
因为4s态能量低于3d态,所以这两个剩余电子不是填入3d态,而是进入新的外壳层上的4s态。
所以,钙原子的电子排列为:。
答:原子的结合键有: (1)离子键。
其特点是:正负离子相互吸引;键合很强,无饱和性,无方向性;熔点、硬度高,固态不导电,导热性差。
(2)共价键。
其特点是:相邻原子通过共用电子对结合;键合强,有饱和性,有方向性;熔点、硬度高,不导电,导热性有好有差。
(3)金属键。
其特点是:金属正离子与自由电子相互吸引;键合较强,无饱和性,无方向性;熔点、硬度有高有低,导热导电性好。
(4)分子键。
其特点是:分子或分子团显弱电性,相互吸引;键合很弱,无方向性;熔点、硬度低,不导电,导热性差。
(5)氢键。
其特点是:类似分子键,但氢原子起关键作用;键合弱,有方向性;熔点、硬度低,不导电,导热性好。
二、计算题有铀和硼两种材料,若已知铀的密度为19.05g/cm 3,原子量为235.03,硼的密度为2.3g/cm 3,原子量为10.81,阿伏伽德罗常数为236.0210⨯,试分别计算这两种材料单位体积内的原子数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《材料科学基础》简答题第一章材料结构的基本知识1、说明结构转变的热力学条件与动力学条件的意义。
答:结构转变的热力学条件决定转变是否可行,是结构转变的推动力,是转变的必要条件;动力学条件决定转变速度的大小,反映转变过程中阻力的大小。
2、说明稳态结构与亚稳态结构之间的关系。
答:稳态结构与亚稳态结构之间的关系:两种状态都是物质存在的状态,材料得到的结构是稳态或亚稳态,取决于转交过程的推动力和阻力(即热力学条件和动力学条件),阻力小时得到稳态结构,阻力很大时则得到亚稳态结构。
稳态结构能量最低,热力学上最稳定,亚稳态结构能量高,热力学上不稳定,但向稳定结构转变速度慢,能保持相对稳定甚至长期存在。
但在一定条件下,亚稳态结构向稳态结构转变。
3、说明离子键、共价键、分子键和金属键的特点。
答:离子键、共价键、分子键和金属键都是指固体中原子(离子或分子)间结合方式或作用力。
离子键是由电离能很小、易失去电子的金属原子与电子亲合能大的非金属原于相互作用时,产生电子得失而形成的离子固体的结合方式。
共价键是由相邻原子共有其价电子来获得稳态电子结构的结合方式。
分子键是由分子(或原子)中电荷的极化现象所产生的弱引力结合的结合方式。
当大量金属原子的价电子脱离所属原子而形成自由电子时,由金属的正离子与自由电子间的静电引力使金属原子结合起来的方式为金属键。
4、原子中的电子按照什么规律排列答:原子核周围的电子按照四个量子数的规定从低能到高能依次排列在不同的量于状态下,同一原子中电子的四个量子数不可能完全相等。
第二章材料的晶体结构1、在一个立方晶胞中确定6个表面面心位置的坐标。
6个面心构成一个正八面体,指出这个八面体各个表面的晶面指数、各个棱边和对角线的晶向指数。
解八面体中的晶面和晶向指数如图所示。
图中A、B、C、D、E、F为立方晶胞中6个表面的面心,由它们构成的正八面体其表面和棱边两两互相平行。
ABF面平行CDE面,其晶面指数为(111);ABE面平行CDF面,其晶面指数为(111);ADF面平行BCE面,其晶面指数为(111);ADE 面平行BCF 面,其晶面指数为(111)。
棱边DC AB //,BC AD //,ED BF //,EC AF //,CF EA // ,DF EB // ,其晶向指数分别为[110],],101[]011[,[011],]110[,[101]。
对角线分别为EF AC DB ,,,其晶向指数分别为[100],[010],[001]图 八面体中的晶面和晶向指数2、标出图2中ABCD 面的晶面指数,并标出AB 、BC 、AC 、BD 线的晶向指数。
解:晶面指数:ABCD 面在三个坐标轴上的截距分别为3/2a,3a,a,截距倒数比为 3:1:21:31:32= ∴ABCD 面的晶面指数为 (213) 4分晶向指数:AB 的晶向指数:A 、B 两点的坐标为A (0,0,1),B (0,1,2/3) (以a 为单位)则 )31,1,0(-=AB ,化简即得AB 的晶向指数]103[ 二(2)图同理:BC 、AC 、BD 线的晶向指数分别为]230[,]111[,]133[。
各2分3、如图所示立方晶胞晶格常数为a ,AO 的长度为2/3a , BD 的长度为1/2a ,CF 的长度为1/3a ,标出图中ABC 面的晶面指数,并标出AB 、BC 、AC 的晶向指数。
解:ABC 面的晶面指数:ABC 面在x 、y 、z 三个坐标轴上的截距分别为4,2,2/3,(1分)截距倒数比为 113::1:2:6422= (1分) ∴ABC 面的晶面指数为 (126) (1分)晶向指数:AB 的晶向指数:A 、B 、C 点的坐标为A (0,0,2/3),B (1,0,1/2),C (0,1,1/3) (以a 为单位)则AB 的晶向指数[601]或[601] (1分) {1(1,0,)6AB =- } BC 的晶向指数[661]或[661] (1分) {1(1,1,)6BC =- }AC 的晶向指数[031]或[031] (1分) {1(0,1,)3AC =- }4、求图中所示立方晶胞中ABCD面的指数;并求该晶面与晶胞所交的四边形四条边和对角线的晶向指数。
解:晶面指数:ABCD 面在三个坐标轴上的截距分别为2a,a,2a截距倒数比为 1:2:121:11:21= ∴ABCD 面的晶面指数为 (121) 2分晶向指数:AB 的晶向指数:A 、B 两点的坐标为A (1,1/2,0),B (0,1,0) (以a 为单位)则 j i AB 211+-=, AB 的晶向指数]102[ 2分 同理:BC 、AC 、BD 线的晶向指数分别为]210[,]011[,]111[。
各2分回答下列问题:(1)在立方晶系的晶胞内画出具有下列密勒指数的晶面和晶向:(001)与[210],(111)与[112],(110)与 [111],(132)与[123],(322)与[236](2)在立方晶系的一个晶胞中画出(111)和 (112)晶面,并写出两晶面交线的晶向指数。
(3)在立方晶系的一个晶胞中画出同时位于(101). (011)和(112)晶面上的[111]晶向。
解:1、(132)(111)[112](110)[111][123][236](112)(111)(322)(101)(112)[111](001)[210][110](101)(011)(101)[111](011)(112)(101)[111](112)面心立方结构和体心立方结构中有几种间隙,各有几个答:面心立方结构包含4个正八面体间隙和8个正四面体间隙;体心立方结构包含6个正八面体间隙和12个正四面体间隙。
(数目:每个2分,类型:每个1分)5、简述同素异构产生原因。
答:与该类原子的电子层结构的变化有关,即在不同的温度或压力下,通过参与键和的外层数分布状态的改变,而引起原子间结合能以致点阵的形式发生改变,过渡族金属多型性倾向较大,与此结构中的s能级和d能级十分接近有关性能:发生多型性转变,由于晶体点阵致密度不同,伴随热涨,6、在离子(陶瓷)晶体中正、负离子的堆积方式取决于哪些因素答:(1)正、负离子的电荷大小——晶体必须保持电的中性,即所有正离子的正电荷应等于所有负离子的负电荷。
(2)正、负离子的相对大小——由于正、负离子的外层电子形成闭合的壳层,因此可以把离子看成具有一定半径的刚性圆球。
在离子晶体中,一些原子失去其外层电子而成为正离子另一些则得到外层电子而成为负离子。
(答对(1)、(2)中的任一点5分)7、简要说明硅酸盐的几种结构单元的主要特点。
答:第三章高分子材料的结构1.简要说明加聚反应和缩聚反应的区别答:加聚反应是由不饱和的单体聚合成高分子的反应,其产物只有—种高分子化合物。
参加缩聚反应的单体一般含有两种或两种以上能相互作用的官能团(两个或两个以上易断裂的共价键)的化合物,产物中除一种高分子化合物外,还生成有小分子。
如H2O、HCl、NH3等。
产物的组成与参加反应的任何一种单体均不相同。
从反应机理上看,加聚反应是不饱和分子中的双键或叁键发生的,实质还是加成反应。
所以,双键、叁键是发生加聚反应的内因。
缩聚反应是通过单体中的官能团相互作用经缩合生成小分子,同时又聚合成大分子的双线反应。
发生缩聚反应的内因是相互能作用的官能团(或较活动的原子)。
发生加聚反应的单体不一定是一种物质,也可以是两种或两种以上。
如丁苯橡胶就是由单体1,3-丁二烯和苯乙烯加聚而成,缩聚反应的单体不一定就是两种,也有一种的,如单糖缩聚成多糖、氨基酸缩聚成多肽,也可以是两种以上的。
2.写出下列化合物的链节结构,并指出有无氢键,若有,是分子内还是分子间的(1)聚氯乙烯;(2)聚乙烯醇;(3)尼龙-6;(4)涤纶;(5)纤维素答:(1)-CH2CHCl- 、分子间氢键(2)-CH2CHOH-、分子间氢键(3)-HN(CH)5CO-、分子间氢键(4)分子间氢键(5)分子内和分子间都有氢键3.聚合物的分子结构对主链的柔顺性有什么影响答:主链结构对高分子链的柔顺性的影响(1)主链杂原子使柔性增大,其中按照Si—O、C—O、C—C键的顺序柔性递减;(2)主链芳环使柔性下降;(3)共轭双键使柔性大为下降;(4)孤立双键使柔性大为增加。
当主链结构相同时,可根据侧基情况来比较或判断链柔性大小。
侧基对高分子链的柔顺性的影响(1)侧基极性越大柔性越小;(2)侧基对称取代会使柔性大大增加;(3)侧基不对称取代时的柔性会显著下降;(4)一般来说,侧基体积较大,柔性下降。
但柔性侧基随着侧基增长,柔性增加。
4.试解释下列实验现象:将一个砝码系于聚乙烯醇纤维的一端,把砝码和部分纤维浸入盛有沸水的烧杯中。
如果砝码悬浮在水中,则体系是稳定的;如果砝码挨着烧杯底部,则纤维被溶解了答:当砝码悬在水中时,聚乙烯醇纤维被拉伸取向,耐热性提高,纤维不被溶解,如果砝码挨着烧杯的底部,聚乙烯醇纤维未被拉伸取向,耐热性未提高,因此在沸水中溶解了。
5.高聚物主要有哪几种聚集态什么样的聚集状态是高聚物独有的答:高聚物的聚集态有:液态、高弹态、玻璃态、取向态、结晶态、液晶态。
其中高弹态是高分子所特有的。
6.提高高分子材料强度的方法有哪些答:提高高分子材料强度的方法有:1.改变高分子材料的结晶度,结晶度增加,则高分子材料的强度提高;2.改变侧基的性质,侧基体积越大、极性越大则高分子材料的强度提高;3.改变主链结构,主链刚性越大,则高分子材料的强度提高;4.共聚,与其他高强度高分子材料单体共聚,可提高高分子材料的强度;5.拉拔强化,一些高分子材料在Tg温度附近冷拉,可提高其强度。
7.为什么聚乙烯容易结晶,而聚氯乙烯则难以结晶为什么在热塑性塑料中完全结晶不大可能答:因为聚乙烯高分子链结构简单、对称所以容易结晶,而聚氯乙烯分子的对称结构被打乱,而且CHCl 体积比CH2大,因此结晶能力下降。
由于高聚物分子链很长,不能象小分子化合物那样可以实现整个分子都进入“结晶区”而达到完全结晶。
因此在热塑性塑料中完全结晶不太可能。
8.说明交联的作用,它如何改变聚合物的结构和性能答:交联作用是分子链之间生成化学键,形成网状结构。
线型聚合物经适度交联后,其力学强度、弹性、尺寸稳定性、耐溶剂性等均有改善。
第四章晶体缺陷1、为什么位错没有平衡浓度答:自由能分析:位错是由大量点缺陷串成线,混乱程度受到限制,熵的作用大减,主要考虑内能,位错总是增加内能,位错越多,越不稳定,热力学要求位错越少越好,故位错没有平衡浓度。
虽然热力学不稳定,但因其呈网状分布,故力学上是稳定的。
2、简述大角晶界特点;答:1.过渡层厚度仅2~3个原子直径;2.原子排列混乱;3.相对稀疏。
