复旦有机化学课件6-烯烃
合集下载
有机化学第六章烯烃

CH3
CH2CH3
CC
H
H
顺-2-戊烯
H
CH2CH3
CC
CH3
H
反-2-戊烯
Z式:双键碳原子上两个较优基团或原子处于双键同侧。
E式:双键碳原子上两个较优基团或原子处于双键异侧。
(优)CH3 C
H
CH2CH3(优)
CH3
C
C
CH3
(优)CH3CH2
CH(CH3)2(优) C
CH2CH2CH3
(Z)- 3-甲基-2-戊烯 (E)- 3-甲基-4-异丙基-3-庚烯
68% 17%
Br + C6H5CH CHCH3
-Br 环正离子
C6H5CH=CHCH3 Cl2
+ Cl C6H5CH CHCH3 Cl-
*
碳正离子
Cl- Cl
+
C6H5CH CHCH3
离子对
一般情况,加溴通过环正离子中间体 进行。
加氯通过环正离子中间体、碳正离子 或离子对进行。
立体选择性反应(stereoselective reaction)
0.33 0 /10-30 c.m 4oC -138.9oC
反式异构体对称性较高,熔点高于顺式异构体。 顺式异构体极性较强,沸点高于反式异构体。
第五节 化学反应
(一)催化氢化 (二)亲电加成反应 (三)自由基加成反应 (四)硼氢化反应 (五)氧化反应 (六) -氢卤代反应 (七) 聚合反应
(一) 催化氢化
顺式烯烃
H
H
C C Br2
CH3
CH3
H
H
Br
CH3
a Br-
CH3 b
Br
有机化学课件-6烯烃
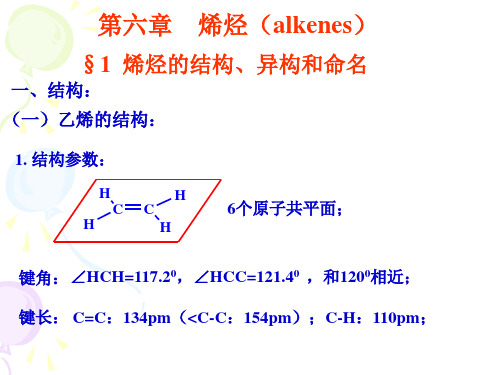
三、烯烃的命名(CCS系统命名法): (一)命名原则:
1. 主链选择:含碳碳双键(官能团)在内的最长碳链作为主链;
如:CH3CH2CH2CH2C=CH2 (√) CH2CH2CH(3 没有把碳碳双键都包含在内)
2-丙基-1-己烯 或2-丙基己烯(官能团处于1位时可省略去位次)
2. 主链编号:使碳碳双键处于尽量小的编号;
2×7 +2 - 8
,C7H8 ,Ω=
=4; 三个C=C和一个环
2
CH3CH2OH ,C2H6O ,Ω=
O
CH3C NH2,C2H5ON ,Ω=
2×2 +2 - 6
=0
2 2×2 +2 - 5 +1
=1
2
二、烯烃的同分异构: (一)构造异构:
如分子式为 C4H8 的烯烃的构造异构体有: CH3 CH3CH2CH=CH2 ,CH3CH=CHCH3 ,CH3C=CH2
CH3 CH
CH3
CH2CH3
C H
(E)-2,3-二甲基-3-己烯
和顺反命名法相比较,顺式的可能是Z构型的,也可能是E构型;
§2 烯烃的相对稳定性
一、燃烧热:
燃烧热kJ/mol
稳定性
例: CH3CH2CH=CH2
2718
H3C
CH3
CC
2711
HH
H3C
H
CC
2708
H
CH3
高
烯烃中碳碳双键上的烷基越多,稳定性越高;
6 CH3 如:CH3CH2CH=CHCH2CHCHCH3
1 2 3 4 5 CH37 8
6,7-二甲基-3-辛烯
3. 标明双键的位次;只写双键两个碳原子中位次较小的一个,放
有机化学课件烯烃

a) 醇脱水——分子内脱水
CH3CH2OH H2SO4 CH2=CH2 + H2O 170℃
CH3CH2OH Al2O3 CH2=CH2 + H2O 350-360℃
条件:浓酸或氧化铝催化 常用的酸性催化剂:H2SO4, KHSO4 , H3PO4 , P2O5 .
烯烃的实验室制法 b) 卤代烷脱卤化氢
CH3CH H
CHCH2CH3 + KOH CH3CH2OH CH3CH=CHCH2CH3 + KBr + H2O Br
条件:强碱的醇溶液
§3 烯烃的物理性质
物态:
2~4碳为气态;5~18碳为液态。
异构体的沸点:
沸点与分子极性有 关,熔点与分子对
称性有关。
末端烯烃沸点低; 支链烯烃沸点低; 反式异构体沸点低,熔点高。
➢ 烯基:烯烃分子去掉C=C键上连接的一个氢原子后的基团
H2C CH
按
系
H3C HC CH CH2
统
命
H2C C(CH3)
名 法
H3C HC CH
来
H2C CH CH2
乙烯基 vinyl 或 ethenyl 丁-2-烯基 1- 甲 基 乙 烯 基 ( 异 丙 烯 基 ) 丙烯基 烯丙基
➢ 亚基:烃去掉两个氢后,剩下的基团
CCH HH
较优基团: 次序大的基团
92023/8/9
烯烃的命名
➢ IUPAC命名法
① 选母体:选择最长的碳链为主链。如果C=C包含在主链中,按主链中所
含碳原子数命名为某烯,否则命名为某烷,主链上的支链作为取代基。
② 编号:如果C=C包含在主链中,从靠近C=C的一端开始,使双键碳原子 的编号较小,并且由最靠近端点碳的那个双键碳原子所得的编号来命名, 其编号写在烯的前面,否则根据链烷烃命名规则对主链进行编号,含双 键部分作为取代基。
《有机化学之烯烃》课件

生物有机化学中的烯烃
如生物脂质中的不饱和脂肪酸和植物类胡萝 卜素等。
同分异构体和立体化学
烯烃存在同分异构体,其中不同的同分异构体具有相同的分子式但不同的结构式,具有不同的性质和用 途。烯烃分子中双键的立体构型也会影响其化学性质和应用领域。
π-电子的共振现象
烯烃分子中的π电子可以发生共振现象,形成多重键而强化分子的稳定性和化学性质。共振对烯烃的光 学、电学和磁学性质起着重要的作用,如合成染料、光伏材料等领域。
烃类脱氢
利用催化剂促进烃类脱去氢,形成双 键结构的烯烃。
烷基汞试剂法
烷基汞试剂能和烯烃反应形成稳定的 Hg化合物,再通过还原去除Hg,得 到烯烃。
烯烃的特性和性质
分子结构
烯烃分子中有一个含有双键的可以引起分子的极性,使烯烃 表现出亲水性。
碳水化合物
烯烃的应用领域和未来发展趋 势
烯烃广泛应用于工业、医药、化妆品和生物领域,如生产橡胶、塑料、医药 中间体、清洁工业等。未来研究将继续扩展其应用领域,提高生产技术,并 探索更加环保和可持续的烯烃生产方式。
烯烃的工业生产和环境影响
烯烃是许多工业化学制品的基础原料,如塑料和橡胶。然而,烯烃的生产和 使用也会带来环境问题,如大气污染、废水处理、垃圾处理等。工业和社会 需要更加环保和可持续的生产方法和使用方式。
有机化学之烯烃
烯烃是有机物质中一种重要的类别,其分子中有C=C双键。烯烃被广泛应用 于生物、工业和其他领域。本课件将介绍烯烃的定义、结构和性质,以及相 关的反应和应用。
烯烃的制备与分类
1
烃类卤代反应
2
通过卤素与烃类反应形成卤代烃,再 发生消除反应去掉卤素即可得到烯烃。
3
加成反应与大环反应
大学有机化学第三章烯烃ppt课件

c
(E)-构型
Entgegen(相反)
3.3.2 次序规则 (1)将双键碳原子所连接的原子或基团按其原子序数的大
小排列,把大的排在前面,小的排在后面,同位素则按 原子量大小次序排列。
I, Br, Cl,, S, P, O, N, C, D, H
13
(2)如果与双键碳原子连接的基团第一个原子相 同而无法确定次序时,则应看基团的第二个 原子的原子序数,依次类推。按照次序规则 (Sequence rule)先后排列。
例如:-CH(CH3)3 > -CH2CH3 > -CH3 又例如:
Cl
O
C H> C O
Cl
C O>
Cl CC
H
C
H
C
14
(3)含有双键和叁健基团,可认为连有二个或三个 相同原子
HC CH2
HH 12
C C (C)
(C) H
C1(C,C,H) C2(C,H,H)
H 12
C CH3
CH3
C1(C,C,H) C2(H,H,H)
32
CH2=CH2
98% H2SO4
H2O
C H3C H2O H
CH3CH=CH2
80 % H2SO4
H2O
OH
65 %
H2O
H2SO4
OH
33
(3)与水的的加成: 在酸催化下,烯烃与水作用得醇,副产物多, 实验室无制备价值。 工业上乙烯水解制备乙醇(p54)
(4)与卤素的加成: a)卤素的活泼性:F2>Cl2>Br2>I2 b)Br2/CCl4溶液可鉴定烯烃(黄棕色退为无色) e)反应历程也为亲电加成*
+ HBr
课件有机化学第3章 烯烃

第三章烯烃Alkenes12烯烃的结构烯烃的顺反异构烯烃的命名烯烃的物理性质CONTENT1234烯烃的化学性质烯烃的制备56SP杂化轨道C C C C7乙烯键长和键角乙烷键长和键角134 pm 烯烃的键长和键角烯烃的结构特征•sp2杂化•π-键•C=C键长比C-C短•π键电子云流动性较大•存在顺反异构——相同基团在双键同侧为顺式,不同侧为反式83.3 烯烃的命名•主链应含双键称“某碳烯”•C10•主官能团的位号尽可能小•如烯烃存在位置异构,母体名称前要加官能团位号•取代基的位置、数目、名称按“次序规则”顺序写在母体前面•Z或E加圆括号,写在化合物名称最前面123.5 烯烃的化学性质1. 烯烃的亲电加成2. 烯烃的自由基加成3. 硼氢化反应4. 催化氢化5. 烯烃的氧化6. 烯烃的α−卤化7. 聚合反应21烯烃亲电加成的原则当不对称烯烃与极性试剂加成时:试剂中的正离子(或带有部分正电荷的部分)加到带有部分负电荷的双键碳原子上试剂中的负离子(或带有部分负电荷的部分)加到带有部分正电荷的双键碳原子上24可能发生重排反应重排反应( rearrangement)——在化学键的断裂和形成过程中,组成分子的原子配置方式发生了改变,从而形成组成相同,结构不同的新分子。
31结论•反应是亲电加成反应•反应是分步进行的•立体化学上表现为反式加成38反应特点•Br2, Cl2对烯烃的加成主要为环正离子过渡态的反式加成•碘加成一般不发生,但ICl, IBr可与烯键发生定量加成反应,用来监测油脂中双键的含量40。
有机化学——烯烃的反应ppt课件

.
第二节 烯烃的同分异构和命名
一、烯烃的同分异构现象
除了碳干异构外,还有双键的位置异构以及由双
键引起的顺反异构。所以,烯烃的异构现象比烷 烃多。
CH2==CHCH2CH2CH3
CH2==CCH2CH3 CH2==CHCHCH3
CH3
CH3
CH3CH==CCH3 CH3
CH3
CH2CH3
C==C
CH3 C==C
室温
Hα
δ-
C
δ
C
+
Cα
CH2CH=CH2 Cl
CH3CH-C2H Cl Cl
δ-
δ+
XX
X·
.
六.a-氢的自由基卤代反应
C 为H 3 什C H 么2 C H 会= = 有C H 这2样C 的l 2 结5 0 果06 ?0 0 o CC H 3 C C H l C H = = C H 2
可以用下面的结果来解释:
H 2 H H H H C = C H H H H H H C = C H H H C H 2C H 2H
.
三、催化氢化(或称催化加氢)反应和氢化热
2.氢化热及烯烃的稳定性 氢化反应是放热反应,1mol不饱和化合物氢化时放出 的热量称为氢化热. 每个双键的氢化热约125kJ/mol。
氢化热的大小可以得知烯烃的稳定性。氢化热越小, 稳定性越大。 例: 顺—2—丁烯氢化热:119.7kJ/mol 反—2—丁烯氢化热:115.5kJ/mol; 1—丁烯氢化热:126.8kJ∕mol。
此反应不是亲电加成反应而是自由基加成 反应.
.
二、自由基加成反应
反应机理: 1、链引发:
O
O
C6H5C O O CC 6H5
第二节 烯烃的同分异构和命名
一、烯烃的同分异构现象
除了碳干异构外,还有双键的位置异构以及由双
键引起的顺反异构。所以,烯烃的异构现象比烷 烃多。
CH2==CHCH2CH2CH3
CH2==CCH2CH3 CH2==CHCHCH3
CH3
CH3
CH3CH==CCH3 CH3
CH3
CH2CH3
C==C
CH3 C==C
室温
Hα
δ-
C
δ
C
+
Cα
CH2CH=CH2 Cl
CH3CH-C2H Cl Cl
δ-
δ+
XX
X·
.
六.a-氢的自由基卤代反应
C 为H 3 什C H 么2 C H 会= = 有C H 这2样C 的l 2 结5 0 果06 ?0 0 o CC H 3 C C H l C H = = C H 2
可以用下面的结果来解释:
H 2 H H H H C = C H H H H H H C = C H H H C H 2C H 2H
.
三、催化氢化(或称催化加氢)反应和氢化热
2.氢化热及烯烃的稳定性 氢化反应是放热反应,1mol不饱和化合物氢化时放出 的热量称为氢化热. 每个双键的氢化热约125kJ/mol。
氢化热的大小可以得知烯烃的稳定性。氢化热越小, 稳定性越大。 例: 顺—2—丁烯氢化热:119.7kJ/mol 反—2—丁烯氢化热:115.5kJ/mol; 1—丁烯氢化热:126.8kJ∕mol。
此反应不是亲电加成反应而是自由基加成 反应.
.
二、自由基加成反应
反应机理: 1、链引发:
O
O
C6H5C O O CC 6H5
最新3、有机化学:烯烃和炔烃(6H)解析(共85张PPT)精品课件

12 3 4 5
H3CCH=C CH2CH3 CH2CH3
12 3 4 5 6
H3CCHCH=CCH2CH3 CH3 CH3
2.3 写出名称,标明(biāomíng)双键位次,其他命名原则与烷 烃相同。十一个碳原子以上的烯烃,其母体叫做“某某碳 烯”。例如:
第十四页,共八十五页。
H3CCH=C CH2CH3 CH2CH3
第二十四页,共八十五页。
顺序(或次序(cìxù))规则
原子序数大的原子较优先(yōuxiān);同位素则按原子质量大
的为优;孤电子对则最次。例如:
I > Br > Cl > S > F > O > N > C > D > H > :
若与双键直接相连的原子相同时,则以该原子起向外比较,
依次类推,直到排出(pái chū)优先次序。例如:
第八页,共八十五页。
图3-2 乙炔(yǐ quē)分子成键轨道示意图
第九页,共八十五页。
杂化碳原子的比较(bǐjiào)
化合物
杂化方式 键角
碳碳键长
电负性
甲烷(jiǎ wán)
乙烯
乙炔
sp3
sp2
sp
109.5o
~120o
180o
单键(dān jiàn) 双键 叁
键
Csp3 Csp2 Csp
3、有机化学 :烯烃和炔烃 (yǒu jī huà xué) (6H)解析
第一页,共八十五页。
分子(fēnzǐ)中含有碳碳不饱和键且具有脂肪烃性质的碳 氢化合物,统称为不饱和脂肪烃。
一般把仅含有一个碳碳双键的不饱和开链烃,叫做单 烯烃,习惯上简称烯烃。其通式为:CnH2n(n≥2的自然数), C=C是烯烃的官能团。
【有机化学】第四章烯烃【课件PPT】

下列物种中的亲电试剂是: A) H+ B) NH3 C) H2O D) ROH
2、烯烃的亲电加成反应
(a)与HX 加成
C C + HX
X
CC
H
HX与烯烃反应的活性
酸性:HI > HBr > HCl 反应活性:HI>HBr>HCl(HCl需催化)
反应历程:经碳正离子的加成机理
① 亲电试剂的进攻,生成带正电的中间体—碳正离子
② 产物的生成:
第一步反应速率慢,第二步快。第一步是速度决定步骤
CH3 + HBr
H3C C
H3C
CH2 + HCl
CH3 Br
CH3
CH3 C CH3 Cl
Markovnikov经验规律(马氏规则): 当HX和烯烃加成时,氢总加在含氢 较多的双键碳原子上。
与H2SO4 的加成机理
CC
0oC + H OSO3H
机理与HX相似:
CC H OSO3H
CC H OSO3H
CC H
OSO3H
CC H OSO3H
应用:通过与硫酸反应可除去烯烃
分离、提纯、鉴别烯烃。 例:用化学方法区别下列化合物。
(c)烯烃在H+催化下与H2O的水合反应
CC
+ H OH
在水中则发生HO-Br加成
CC
XX (X = Cl, Br)
(2)烯烃的硼氢化氧化反应
H BH3中B原子的外层只有6个
甲硼烷:H
B
价电子,有一个空轨道, 缺电子,Lewis 酸,可接
H 受一对电子。是亲电试剂
乙硼烷(B2H6)是甲硼烷的二聚体,有毒,能自燃。
高中化学有机课件:烯烃

3.β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(只 考虑位置异构)理论上最多有( C )
A.2种 C.4种
B.3种 D.6种
【解析】因分子存在三种不同的碳碳双键,如图所示
;1分子该物质与2
分子Br2加成时,可以在①②的位置上发生加成,也可以在①③位置上发生加成 或在②③位置上发生加成,还可以1分子Br2在①②发生1,4-加成反应,另1分子 Br2在③上加成,故所得产物共有4种。
3.苯丙烯(C9H10)具有A、B两种直链位置异构体,其中A具有顺式C和反式D两 种异构体,请写出它们的结构简式。
A______________;B________________; C_____________;D_____________。
当堂检测
1.既可以用来鉴别乙烯和甲烷,又可用来除去甲烷中混有的乙烯的方法是( A ) A.通入足量溴水中 B.与足量的液溴反应 C.通入酸性高锰酸钾溶液中 D.一定条件下与H2反应
4.烷烃存在顺反异构现象吗?试总结产生顺反异构现象的条件是什么? 提示:烷烃不存在顺反异构现象;产生顺反异构现象的条件是分子中存在碳碳 双键,且碳碳双键的同一碳原子上连有不同的原子或原子团。
归纳总结 二、烯烃的立体异构
1.顺反异构的概念 通过碳碳双键连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同, 产生顺反异构现象。 (1)顺式结构:相同的原子或原子团位于双键同一侧的顺式结构,如顺-2-丁烯:
3.已知
的键线式可写作 ,某有机化合物的键线式为
,
其正确名称是( D ) A.5-乙基-2-己烯 C.3-甲基-5-庚烯
B.2-甲基庚烯 D.5-甲基-2-庚烯
【解析】有机化合物的键线式是将碳原子和氢原子省略,用线段的端点和拐点
有机化学【烯烃】全面.ppt

;.;
15
例:
反-3-甲基-6-乙基-4-辛烯
;.;
16
(2)Z,E-命名法:
采用Z,E-命名法时,根据次序规则比较出 两个双键碳原子上所连接的两个原子或基团的优 先次序。当两个双键碳原子上的“较优”原子或 基团都处于双键的同侧时,称为Z式(Z是德文 Zusammen的字首,同一侧之意);如果两个双 键碳原子上的“较优”原子或基团处于双键两侧, 则称为E式(E是德文Entgegen的字首,相反之 意)。然后将Z或E加括号放在烯烃名称之前,同 时用半字线与烯烃名称相连。
;.;
11
CH2 = CH2 CH3CH=CH2
乙烯 ethylene 丙烯 propene
CH3CH2CH=CH2 (CH3) 2C=CH2
丁烯 butene 异丁烯 iso-butene
;.;
12
例:
H3C H
C=C
CH2CH3 H
顺-2-戊烯或(Z)-2-戊烯
H C=C CH2CH3
H3C
当烯烃主链的碳原子数多于十个时,命名时 汉字数字与烯字之间应加一个“碳”字(烷烃不 加碳字),称为“某碳烯”,例如:
CH3(CH2)3CH=CH(CH2)4CH3 5-十一碳烯
;.;
14
烯烃顺反异构体的命名
烯烃顺反异构体的命名可采用两种方法 ——顺反命名法和Z,E-命名法 (1)顺反命名法:
两个双键碳原子中的两个相同原子 或基团处于双键同一侧的,称为顺式 (cis-),反之称为反式(trans-)。书写 时分别冠以顺、反,并用半字线与化合 物名称相连。
H
反-2-戊烯或(E)-2-戊烯
H3C C=C CH2CH3
H
CH3
有机化学-烯烃

乙醇(伯醇)
CH3CH CH2H2SO4(80%) CH3CHCH3 H2O CH3CHCH3
OSO3H
CH3
CH3
CH3C CH2 H2SO4(63%) CH3CCH3 H2O
OH
2-丙醇(仲醇)
CH3
CH3CCH3
OSO3H
OH
2-甲基-2-丙醇(叔醇)
本法制得的醇(除乙醇)都是仲醇和叔醇。此类反 应常有重排产物产生,选择性差。
A C
B
D C
F
A C
B
(A>B, D>F)
F
C D
Z-型( 大基团 在同侧) E-型(大基 团 在异侧)
基团大小次序法则
(1)比原子序数:连接双键碳的原子, 原子序数高为大基团;若为同位素,质量 重的优先。
例如:I > Br > Cl > F > O> N> C > H
(2)延伸法:若与双键碳相连的原子相
CH3CH CHCH3
H3C C CH2 CH3
位置异构 碳架异构
(二)、顺反异构
H3C C
H
CH3 C
H
H3C C
H
H C
CH3
顺-2-丁烯 Cis-2-butene
反-2-丁烯 Trans-2-butene
顺反异构的概念:P78
顺反异构形成的条件 1. 分子中存在限制碳原子自由旋转的因素。 如双键或环(如脂环)的结构。 2. 不自由旋转的碳原子连接不同的基团。
CH3 C CH3 > CH3 C C2H5 > CH3 C H > CH3 C Cl
CH3
H
H
H
CH3CH CH2H2SO4(80%) CH3CHCH3 H2O CH3CHCH3
OSO3H
CH3
CH3
CH3C CH2 H2SO4(63%) CH3CCH3 H2O
OH
2-丙醇(仲醇)
CH3
CH3CCH3
OSO3H
OH
2-甲基-2-丙醇(叔醇)
本法制得的醇(除乙醇)都是仲醇和叔醇。此类反 应常有重排产物产生,选择性差。
A C
B
D C
F
A C
B
(A>B, D>F)
F
C D
Z-型( 大基团 在同侧) E-型(大基 团 在异侧)
基团大小次序法则
(1)比原子序数:连接双键碳的原子, 原子序数高为大基团;若为同位素,质量 重的优先。
例如:I > Br > Cl > F > O> N> C > H
(2)延伸法:若与双键碳相连的原子相
CH3CH CHCH3
H3C C CH2 CH3
位置异构 碳架异构
(二)、顺反异构
H3C C
H
CH3 C
H
H3C C
H
H C
CH3
顺-2-丁烯 Cis-2-butene
反-2-丁烯 Trans-2-butene
顺反异构的概念:P78
顺反异构形成的条件 1. 分子中存在限制碳原子自由旋转的因素。 如双键或环(如脂环)的结构。 2. 不自由旋转的碳原子连接不同的基团。
CH3 C CH3 > CH3 C C2H5 > CH3 C H > CH3 C Cl
CH3
H
H
H
烯烃(0002)ppt课件

第五章
烯烃
本章提纲
▪ 第一节 烯烃的结构特征 ▪ 第二节 烯烃的命名 ▪ 第三节 烯烃的物理性质 ▪ 第四节 烯烃的化学性质 ▪ 第五节 烯烃的制备
第一节 烯烃的结构特征
▪ 双键碳是sp2杂化。 ▪ π键是由p轨道侧面重叠形成 ▪ 由于室温下双键不能自由旋转,所以有Z,E
异构体
C=C 1.346Å
= =
==
O
O
制
CH3COH
30% H2O2, H+ CH3COOH
OO
=
备
C6H5COOCC6H5 + CH3ONa CHCl3,、-5o-0oC
O
O
=
=
C6H5COCH3 + C6H5COONa
H+
O C6H5COOH
实验室常用过氧化 物来制备过酸。
过氧化物易分解爆炸,使 用时要注意温度和浓度。
1-甲基环己烯的加溴反应
Br2 Br2
Br
+
-Br -Br
+
Br
Br
Br Br Br
2. 加成时,溴取两个直立键,遵循构象最小改变原 理
构象最小改变原理:当加成反应发生时,要使碳 架的构象改变最小 3. 双键旁有取代基时,要考虑碳正离子的稳定性。
(S)-3-甲基环己烯的加溴反应
*
H3C
*
Br2 H3C
CH3
C2H5
CH3COOH
CH3 C2H5
CC C2H5
H
30% H2O2
O
CH3COO CH3 C2H5
C2H5 H
OH
H2O, H+ or -OH
HO CH3 C2H5
烯烃
本章提纲
▪ 第一节 烯烃的结构特征 ▪ 第二节 烯烃的命名 ▪ 第三节 烯烃的物理性质 ▪ 第四节 烯烃的化学性质 ▪ 第五节 烯烃的制备
第一节 烯烃的结构特征
▪ 双键碳是sp2杂化。 ▪ π键是由p轨道侧面重叠形成 ▪ 由于室温下双键不能自由旋转,所以有Z,E
异构体
C=C 1.346Å
= =
==
O
O
制
CH3COH
30% H2O2, H+ CH3COOH
OO
=
备
C6H5COOCC6H5 + CH3ONa CHCl3,、-5o-0oC
O
O
=
=
C6H5COCH3 + C6H5COONa
H+
O C6H5COOH
实验室常用过氧化 物来制备过酸。
过氧化物易分解爆炸,使 用时要注意温度和浓度。
1-甲基环己烯的加溴反应
Br2 Br2
Br
+
-Br -Br
+
Br
Br
Br Br Br
2. 加成时,溴取两个直立键,遵循构象最小改变原 理
构象最小改变原理:当加成反应发生时,要使碳 架的构象改变最小 3. 双键旁有取代基时,要考虑碳正离子的稳定性。
(S)-3-甲基环己烯的加溴反应
*
H3C
*
Br2 H3C
CH3
C2H5
CH3COOH
CH3 C2H5
CC C2H5
H
30% H2O2
O
CH3COO CH3 C2H5
C2H5 H
OH
H2O, H+ or -OH
HO CH3 C2H5
2019有机化学PPT课件第三章 烯烃.ppt

4. 控制氧化
Ag CH2 CH2 + O2 200--300oC CH2 O 环氧乙烷 CH2 CH2 + 1/ 2 O2 PdCl2---CuCl2 100--125oC PdCl2---CuCl2 100--125oC CH3 CHO CH2
CH3 CH
CH2 +
1/ 2 O2
CH3
C O
CH3
CH2X + X
.
α - 卤代产物
按途径(1):生成的 稀丙基游离基极稳定, 一旦生成便最终生成 α-卤代丙烯
双键加成产物
按途径(2):生成的 2o游离基高温下不稳定, 分解而重新回到 丙烯。
游离基稳定性: 烯丙游离基 > 3o
CH3 CH (CH3)3C CH2
.CH2
(CH3)3C
CH
CH2
_ D = 368 kJ / mol _ D = 380 kJ / mol
1.卤代
C δ- δ+ X X
2
C
C H X.
高温,游离基型进攻 α -取代反应
低温,离子型进攻
1
加成反应
高温下,
X2
(1)
2X . 可与丙烯按两种途径反应:
H CH2
X CH
.
CH2 (2) . X CH3 CH . X2 CH2X
HX +
.CH2
X2
CH
CH2
X
.+
X
CH2
CH
CH2
CH3
CHX
三、聚合反应(自身加成)
TiCl4-- Al(C2 H5)3 CH2 1--10atm, 60--75oC 单体 ( CH2
烯烃ppt课件

例3: Br
Cl
C=C
(Z)-1,2-二氯-1-溴乙烯
Cl
H
注意: 顺式不一定是Z构型;反式不一定是E构型.
19
3.4 烯烃的来源和制法
3.4.1 烯烃的工业来源和制法
•石油裂解(乙烯):
C6H14 CH4 + CH2=CH2 + CH3-CH=CH2 + 其它
15% 40%
20%
25%
3.4.2 烯烃的实验室制法
26
3.6.2 亲电加成反应
3.6.2.1 烯烃与 H-X 的加成
C C +HX
例:CH2 CH2 + HCl
150 - 250 oC AlCl3 or FeCl3
CC HX
CH3CH2Cl
CH3CH2
CH2CH3
CC
+ HBr
H
H
KI H3PO4, 80 oC
30 oC CHCl3
I
CH3CH2CH2CHCH2CH3 Br 76 %
83%
36
HCl CH3 CH CH=CH2
CH3
H
Cl
+
CH3 C CH
CH3
Cl-
CH3 CH CH CH3
CH3
CH3 (40%)
-H- 迁移 Cl
CH3
+
C CH2 CH3
Cl-
CH3
C CH2 CH3
CH3
CH3 (60%)
37
3.6.2.2 烯烃与H2SO4的加成
与浓硫酸反应,生成烷基硫酸(或叫酸性硫酸酯) CH2=CH2 + HO-SO2-OH CH3-CH2-OSO3H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
itself and destroy it——addition and oxidation. (b) Reactions that take place at certain positions
having special relationships to the double bond ——substitution.
Chapter 6 Alkenes
The carbon-carbon double bond (C=C) is the functional group of alkenes. General formula: CnH2n Unsaturated hydrocarbons
Alkenes contain less than the maximum quantity of hydrogen.
Propene
1-Butene
CH3 H2C C CH3
2-Methylpropene
CH3
H2C
C H
C CH3 CH3
3,3-Dimethyl-1-butene
2-Butene (cis- or trans-)
CH3 CH3 CH CH C CH3
H
4-Methyl-2-pentene (cis- or trans-)
Addition reaction: A reaction in which two molecules combine
3. Indicate by numbers the positions of the alkyl groups attached to the parent chain.
4. Each name is derived by changing the ending –ane of the corresponding alkane name to –ene.
A methyl group is an electron-donating substituent on the double bond.
CH3 H HH
C2H5 H HH
µ= 0.35 D
µ= 0.37 D
CH3 H CH3 H
b.p. +4 oC m.p. -139 oC
CH3 H
H CH3 µ= 0 b.p. +1 oC m.p. -106 oC
§6-1 Structure of alkenes
§6-2
Carbon skeletons Position of the double bond Geometric isomerism
Stability?
ac CC
bd
a≠b and c≠d, geometric isomerism a=b or c=d, no geometric isomerism
CH3CH2C CH2
CH3CHCH2CCH2CH2CH3
CH2CH2CH3
CH3 CH2
2-乙基-1-戊烯
4-甲基-2-丙基-1-戊烯
CH3CH2CHCH CH(CH2)2CH3 CH3
3-甲基-4-辛烯
CH3 CH2CH2CH3 CC
H CH2CH3
(Z)-3-乙基-2-己烯
CH3 CH(CH3)2 CC
CH3CH2CH2 CH2CH3
(E)-2,4-二甲基-3-乙基-3-庚烯
Br Cl CC
Cl H
(Z)-1,2-二氯溴乙烯 trans-1,2-二氯溴乙烯
§6-4 Physical properties
• Similar with the physical properties of alkanes. • Insoluble in water, but quite soluble in non-polar solvents. • Less dense than water. • Boiling point (b.p.) • Melting point (m.p.) • Dipole moment: very small, but larger than ~ of alkanes.
§6-5 Chemical properties
The functional group determines the characteristic reactions of organic compound. Reactions of alkenes are of two kinds: (a) Reactions that take place at the double bond
Geometric isomers have different physical properties.
H3C CH3 CC
HH
cis-2-Butene
M.p.(oC) B.p.(oC) Relative density (at 20oC)
Dipole moment(C· m)
-139
3.5
0.667 1.1× 10-30
H3C H CC
H CH3 trans-2-Butene
-106 0.9 0.649 0
Their chemical properties are similar but not identical; they react with the same reagents, but at different rates (especially in biological systems).
HO HO
1.45 nm
H O
1.45 nm
H O
H O
H O
§6-3 Nomenclature
1. Select as the parent structure the longest continuous chain that contains the C=C bond.
2. Indicate by a number the position of the double bond in the parent chain.
5. When a geometric isomer is to be specified, a prefix is added: cis- or trans-, or (Z)- or (E)-.
H2C CH2
CH3CH CH2
H2C CHCH2CH3 CH3CH CHCH3
Ethene Ethylene
having special relationships to the double bond ——substitution.
Chapter 6 Alkenes
The carbon-carbon double bond (C=C) is the functional group of alkenes. General formula: CnH2n Unsaturated hydrocarbons
Alkenes contain less than the maximum quantity of hydrogen.
Propene
1-Butene
CH3 H2C C CH3
2-Methylpropene
CH3
H2C
C H
C CH3 CH3
3,3-Dimethyl-1-butene
2-Butene (cis- or trans-)
CH3 CH3 CH CH C CH3
H
4-Methyl-2-pentene (cis- or trans-)
Addition reaction: A reaction in which two molecules combine
3. Indicate by numbers the positions of the alkyl groups attached to the parent chain.
4. Each name is derived by changing the ending –ane of the corresponding alkane name to –ene.
A methyl group is an electron-donating substituent on the double bond.
CH3 H HH
C2H5 H HH
µ= 0.35 D
µ= 0.37 D
CH3 H CH3 H
b.p. +4 oC m.p. -139 oC
CH3 H
H CH3 µ= 0 b.p. +1 oC m.p. -106 oC
§6-1 Structure of alkenes
§6-2
Carbon skeletons Position of the double bond Geometric isomerism
Stability?
ac CC
bd
a≠b and c≠d, geometric isomerism a=b or c=d, no geometric isomerism
CH3CH2C CH2
CH3CHCH2CCH2CH2CH3
CH2CH2CH3
CH3 CH2
2-乙基-1-戊烯
4-甲基-2-丙基-1-戊烯
CH3CH2CHCH CH(CH2)2CH3 CH3
3-甲基-4-辛烯
CH3 CH2CH2CH3 CC
H CH2CH3
(Z)-3-乙基-2-己烯
CH3 CH(CH3)2 CC
CH3CH2CH2 CH2CH3
(E)-2,4-二甲基-3-乙基-3-庚烯
Br Cl CC
Cl H
(Z)-1,2-二氯溴乙烯 trans-1,2-二氯溴乙烯
§6-4 Physical properties
• Similar with the physical properties of alkanes. • Insoluble in water, but quite soluble in non-polar solvents. • Less dense than water. • Boiling point (b.p.) • Melting point (m.p.) • Dipole moment: very small, but larger than ~ of alkanes.
§6-5 Chemical properties
The functional group determines the characteristic reactions of organic compound. Reactions of alkenes are of two kinds: (a) Reactions that take place at the double bond
Geometric isomers have different physical properties.
H3C CH3 CC
HH
cis-2-Butene
M.p.(oC) B.p.(oC) Relative density (at 20oC)
Dipole moment(C· m)
-139
3.5
0.667 1.1× 10-30
H3C H CC
H CH3 trans-2-Butene
-106 0.9 0.649 0
Their chemical properties are similar but not identical; they react with the same reagents, but at different rates (especially in biological systems).
HO HO
1.45 nm
H O
1.45 nm
H O
H O
H O
§6-3 Nomenclature
1. Select as the parent structure the longest continuous chain that contains the C=C bond.
2. Indicate by a number the position of the double bond in the parent chain.
5. When a geometric isomer is to be specified, a prefix is added: cis- or trans-, or (Z)- or (E)-.
H2C CH2
CH3CH CH2
H2C CHCH2CH3 CH3CH CHCH3
Ethene Ethylene
