第十四章 化学药品和中间体
《药物中间体合成》课程教学大纲

《药物中间体合成》课程教学大纲英文名称:Synthesis of Pharmaceutical Intermediates课程类型:专业课课程要求:任选学时/学分:32/2适用专业:应用化学一、课程性质与任务药物中间体主要是指医药、农药、兽药合成及制造过程中成药前的所有化合物,对于其合成机理和工艺路线的研究是精细化学品工业的重要组成部分,所以,药物中间体化学的发展水平是一个国家精细化工现代化水平的重要标志。
本课程是为应用化学专业(精细化工方向)学生开设的一门专业任选课,在对药物中间体整体性质介绍的基础上,从药物中间体的主要功能分类,系统地介绍了药物中间体结构与功能间的关系。
通过对中间体结构合成、分离提纯和性质研究方法的学习,使学生能够熟练掌握各类单元反应(如卤化、磺化、硝化、氨基化、烷化、酰化、还原、加成、缩合、环合及手性合成等)在药物开发和生产过程中的应用,并将其理论分析应用于实际问题的解决,同时通过对药物中间体逆向合成路线理论和技巧及典型药物中间体合成工艺的学习,使学生具备进行药物中间体合成路线的设计、合成方法筛选等研究的初步能力。
二、课程与其他课程的联系本课程是在《无机化学》、《有机化学》、《精细化学品合成原理》、《精细化工工艺设计》等课的基础上开课。
三、课程教学目标1.通过学习药物中间体的概念、特点、分类,了解药物中间体的国内外发展现状及其在国民经济中的地位,使学生具有初步分析和选用药物中间体的工程实践能力;2.通过对麻醉类、镇定类、解热镇痛及抗炎类、镇痛及及镇咳祛痰类、解痉挛及肌肉松弛类、抗组织胺类、甾类、诊断用及解毒类等医药中间体的结构、性质、合成路线及作用机理的学习,使学生具有对新型医药中间体设计/开发的能力。
3.通过对杀虫类、杀螨、线虫及杀鼠类、杀菌类、除草类、植物生长调节类等农药中间体等农药中间体的含义、分类、合成路线及作用机理的学习,使学生具有对新型农药中间体设计/开发的能力。
什么是化学制药化学制药的特点

什么是化学制药化学制药的特点化学药品的生产过程,由原料药生产和药物制剂生产两部分组成。
那么你对化学制药了解多少呢?以下是由店铺整理关于什么是化学制药的内容,希望大家喜欢!化学制药的类型化学药品根据其原料来源和生产方法的不同,可分为植物化学药、化学合成药、抗生素、半合成抗生素、生物化学药等。
大多数国家将生物制品如血清、疫苗、血液制品等也列入制药工业范畴。
此外,兽药也属于制药工业的产品。
化学药品通常按治疗用途和药理作用分类,约有30个大类,如抗感染药、抗寄生虫病药、解热镇痛药、麻醉药、心血管系统用药、激素类和计划生育用药等。
化学制药的生产特点原料药品种众多,其生产方法各不相同,有全合成法,有发酵法兼用提炼技术,有合成法兼用生物技术,有发酵产品再进行化学加工,也有主要采用分离提纯方法。
原料药生产的一般特点是:①生产流程长、工艺复杂。
②每一产品所需的原辅材料种类多,许多原料和生产过程中的中间体是易燃、易爆、有毒或腐蚀性很强的物质,对防火、防爆、劳动保护以及工艺和设备等方面有严格的要求。
③产品质量标准高(纯度高、杂质可允许的含量极微),对原料和中间体要严格控制其质量。
④物料净收率很低,往往几吨至上百吨的原料才生产一吨产品,因而副产品多,三废也多。
⑤药物品种多、更新快、新药开发工作的要求高、难度大、代价高、周期长。
制剂生产则需要有适合条件的人员、厂房、设备、检验仪器和良好的卫生环境以及各种必需的制剂辅料和适用的内、外包装材料相配合。
为了保证药品的安全性和有效性,世界卫生组织提出了一个原则性实施方案——《药品生产和质量管理规范》。
核心课程:无机与分析化学、有机化学、物理化学、化工单元操作、药物合成反应、药物化学、制药工艺学、制药车间设计与设备、药物分析。
专业培养面向医药制药行业及药物研究机构或其它工业部门,从事药物中间体、药物的化学合成的生产、管理及新技术消化和吸收的高等技术应用性人才。
化学制药的发展阶段其发展经历了如下5个重要阶段:①有机砷制剂的发明。
药物化学药品的合成

药物化学药品的合成药物化学药品的合成是药物研发过程中的重要环节,它涉及到药物的结构设计、合成路线的确定以及合成方法的优化等方面。
本文将介绍药物化学药品合成的基本原理和方法,并以某一具体药物为例进行详细阐述。
一、药物化学药品合成的基本原理药物化学药品合成的基本原理是根据药物的目标结构,通过有机合成化学的方法,将原料化合物经过一系列反应转化为目标药物。
合成药物的过程中,需要考虑以下几个方面的因素:1. 结构活性关系:药物的结构与其生物活性之间存在着密切的关系。
合成药物时,需要根据药物的目标结构,合理设计合成路线,确保合成的化合物具有期望的生物活性。
2. 反应选择性:在药物合成过程中,需要选择适当的反应条件和反应试剂,以实现所需的化学转化。
反应的选择性对于合成药物的纯度和产率有着重要影响。
3. 反应条件的优化:药物合成过程中,需要对反应条件进行优化,以提高反应的效率和产率。
反应条件的优化包括温度、溶剂、催化剂等方面的选择。
二、药物化学药品合成的方法药物化学药品合成的方法主要包括有机合成化学的基本反应和合成策略的设计。
常用的有机合成反应包括酯化反应、醚化反应、氨基化反应、烷基化反应等。
合成策略的设计包括直接合成、中间体合成、合成路线的优化等。
以某一具体药物为例,介绍其合成过程:某药物的目标结构为A,合成路线如下:1. 合成中间体B:通过酯化反应将化合物C与化合物D反应得到中间体B。
2. 合成中间体E:通过醚化反应将中间体B与化合物F反应得到中间体E。
3. 合成目标药物A:通过氨基化反应将中间体E与化合物G反应得到目标药物A。
在合成过程中,需要对反应条件进行优化,以提高反应的效率和产率。
例如,可以选择适当的温度、溶剂和催化剂,以促进反应的进行。
三、总结药物化学药品的合成是药物研发过程中的重要环节。
合成药物的过程中,需要考虑结构活性关系、反应选择性和反应条件的优化等因素。
常用的合成方法包括有机合成化学的基本反应和合成策略的设计。
医药及中间体PPT课件

O
R'
N NO
R= H R'= C4H9
R= OH R'= C4H9
R= H
R'= H2C H2C S
保泰松 羟基保泰松 苯磺唑酮
R
O
第21页,共75页。
6.3 解热镇痛药及中间体
6.3.4 2-芳基丙酸类非甾体类消炎药
2-芳基丙酸类非甾体类消炎药布洛芬(ibuprofen 1)、酮基布洛芬( ketoprofen 2)、非诺洛芬(fenoprofen 3)、氟比洛芬(flurbiprofen 4)、萘普 生(naproxen 5)等是常见的止痛和非甾体消炎药
(1)替卡西林钠的合成:
S
COONa
H
HO
N
H COONa
N
CH3
O
S HH
CH3
第7页,共75页。
6.2 抗生素类药物及中间体
2-噻吩-2-苄氧羰基乙酰氯对6-APA的苄酯进行酰氨化反应,得到的产物再 氢解脱去两个苄基保护基,然后用碳酸氢钠中和即可得到替卡西林钠。
H2N
S CH3 CH3
N
+
O
COOCH2C6H5
氯霉素的合成过程如下:
O2N
Br2, C6H5Cl
COCH3
25~28 ℃
O2N
(CH2)6N4, C6H5Cl
COCH2Br
33~36 ℃
(1)
(2)
O2N
COCH2Br(CH2)6N4
(3)
C2H5OH, HCl 33~35 ℃
O2N
COCH2NH2HCl
(4)
(CH3CO)2O, NaOAc O2N
含氟医药中间体用途

含氟医药中间体用途含氟医药中间体是指通过在有机合成过程中引入氟原子,来合成含氟医药物质的中间体。
氟化学在药物研发领域发挥着重要的作用,因为氟原子具有一些独特的化学性质,如强电负性、小离子半径、稳定的键能以及特殊的电子亲和力等。
这些特性使得含氟医药物具有更好的生物活性、药代动力学和药学特性,因此在药物研究领域广泛应用。
含氟医药中间体用途广泛,涉及多个领域,如抗癌、抗炎、抗感染、中枢神经系统疾病治疗等。
以下是一些典型的含氟医药中间体及其用途。
1. 氟喹诺酮类抗生素的合成中间体:氟喹诺酮类抗生素是目前临床上广泛使用的抗生素,对多种细菌感染具有较强的抗菌活性。
而氟喹诺酮类抗生素的合成离不开含氟医药中间体的应用,这些中间体在合成过程中引入氟原子,通过特定的反应路径获得目标化合物。
2. 拉氟沙星:拉氟沙星是一种第二代氟喹诺酮类抗生素,广泛应用于临床治疗各种细菌感染,如泌尿系感染、呼吸道感染、皮肤软组织感染等。
拉氟沙星的合成依赖于含氟医药中间体来引入氟原子,通过适当的化学反应得到目标化合物。
3. 氟替卡松:氟替卡松是一种强效的肾上腺皮质激素类药物,被广泛应用于治疗变态反应性疾病、炎症性疾病以及肿瘤等。
氟替卡松的合成中引入了氟原子,通过含氟医药中间体的合成路径得到目标化合物。
4. 氟罗替卡松:氟罗替卡松是一种舒张支气管,抗过敏药物,适用于治疗哮喘、慢性阻塞性肺病等呼吸系统疾病。
氟罗替卡松在合成过程中引入了氟原子,通过合成中间体得到目标化合物。
5. 氟美罗定:氟美罗定是一种治疗焦虑症、抑郁症的药物,广泛应用于临床。
氟美罗定的合成过程中,需要含氟医药中间体的参与,以引入氟原子并构建目标分子。
除了以上介绍的几种药物,还有一些含氟医药中间体被用于合成其他药物,如含氟化合物被作为化学药品进行研究开发,被广泛应用于药物研发。
总之,含氟医药中间体在药物研制过程中起着至关重要的作用,有助于提高药物的活性、选择性和药代动力学性质,提高药物的疗效,并减少副作用的发生。
化学药品的相关知识点总结

化学药品的相关知识点总结化学药品的分类根据其作用方式和化学结构,化学药品通常可以分为以下几类:1. 生化药物:生化药物是通过调节生物体内的生化过程来达到治疗目的的药物。
例如,激素类药物、酶类药物等都属于生化药物。
2. 化学合成药物:化学合成药物是通过化学合成方法合成的药物,它们通常是合成有机分子化合物。
比如常见的头孢菌素类、抗生素类、抗癌药等都属于化学合成药物。
3. 天然药物:天然药物是来源于动植物的天然产物,它们通常是一些具有特定生物活性的化合物。
比如阿司匹林、金霉素等都属于天然药物。
4. 合成生物制剂:这是一类由生物技术合成的药物,通常使用基因工程技术将结构基因插入其他细胞中合成,这类药物包括重组蛋白类药物、基因治疗药物等。
化学药品的作用机制化学药品的作用机制是指药物在人体内的作用方式和生物学效应。
不同的药物有不同的作用机制,常见的作用机制包括:1. 拮抗作用:一些化学药品通过拮抗某些生物体内活性物质的作用来达到治疗目的。
例如,β-受体阻滞剂通过拮抗β-受体而起到降压作用。
2. 拮抗作用:一些药物通过拮抗受体或途径的作用来产生生物学效应。
例如,受体拮抗剂通过阻断神经递质的合成和释放而产生镇痛作用。
3. 激动作用:一些化学药品通过激动某些受体或途径来产生生物学效应。
例如,激动胰岛素受体的药物能够促进葡萄糖的吸收从而降低血糖。
4. 阻断作用:一些药物通过阻断某些代谢途径或生物合成途径来产生生物学效应。
例如,抗生素通过阻断微生物生物合成途径达到抑制微生物生长的作用。
化学药品的副作用和安全性化学药品的副作用是指在治疗疾病的过程中产生的不良反应。
药物的副作用通常是由于药物的作用机制、药物的代谢途径以及个体的差异等因素引起的。
常见的化学药品副作用包括:1. 肝肾毒性:一些化学药品在肝脏或肾脏中代谢失衡引起毒性反应,例如一些抗生素、抗癌药等。
2. 神经毒性:一些化学药品能够引起神经系统的毒性反应,例如一些抗癫痫药、镇痛药等。
有机化学课后答案14~19章(徐寿昌)
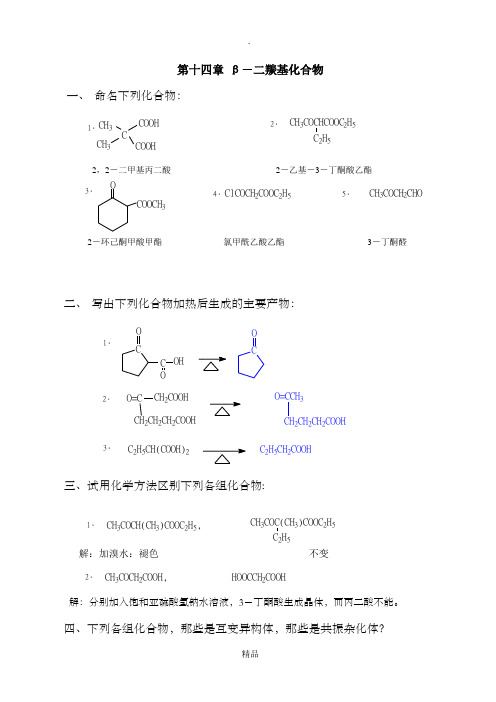
第十四章 β-二羰基化合物一、 命名下列化合物:1.CH 3CH 3C COOH COOH2.CH 3COCHCOOC 2H 5C 2H 5二、 写出下列化合物加热后生成的主要产物:1.CO CO C OOH 2.O=CCH 2CH 2CH 2COOHCH 2COOH O=CCH 3CH 2CH 2CH 2COOH 3.C 2H 5CH(COOH)2C 2H 5CH 2COOH三、试用化学方法区别下列各组化合物:1.CH 3COCH(CH 3)COOC 2H 5,CH 3COC(CH 3)COOC 2H 52.CH 3COCH 2COOH,HOOCCH 2COOH解:分别加入饱和亚硫酸氢钠水溶液,3-丁酮酸生成晶体,而丙二酸不能。
四、下列各组化合物,那些是互变异构体,那些是共振杂化体?1.CO OOC 2H 5OOC 2H 5OH,2.CH 3C O O -,CH 3C OO-3.C OOH,五、完成下列缩合反应:1.2CH 3CH 2COOC 2H 51.NaOC H 2.HCH 3CH 2COCHCOOC 2H 5CH 3+C 2H 5OH 2.CH 3CH 2COOC 2H 5+COOC 2H 51.NaOC H 2.HCOCHCOOC 2H 5CH 3CH 3CH 2COCHCOOC 2H 5CH 3+3.CH 3CH 2COOC 2H 5+COOC 2H 5COOC 2H 51.NaOC H 2.HO=C O=C CHCOOC 2H 5CH 3CHCOOC 2H 5CH 34.CH 2CH 2CH 2COOC 2H 5CH 2CH 2COOC 2H 51.NaOC H 2.HCOCOOC 2H 55.COCO+HCOOC 2H 51.NaOC H 2.HCHO六、完成下列反应式:1.CHO1.O 32.Zn,HCHO CH 2CH 2CHO5%NaOHOHC 2H 5C 2H 5CCH 3COCH 2H 3O +2.C H MgBr 1.2OO CH 2COOC 2H 5CCH 3HOCH 2CH 2OH,H +CH 3COCH 2COOC 2H 53.CH 3CH 3COCH 2CHCOOC 2H 5NaOH%5CHCOOC 2H 53CH 3COCHCOOC 2H 5CH 3ClCHCOOC H NaCH 3COCHCOOC 2H 5NaOC H CH 3COCH 2COOC 2H 52.CH 3COCH 2H +CH 2CHCH 2CH 2CHCH 3OHNaBH 4COOH2CHCH 2CH 2COCH 3KOC(CH 3)3CH 2=CHCOCH 3CH 2CH(COOC 2H 5)2NaCH(COOC 2H 5)2NaOC 2H 5CH 2Cl4.CH 2CCH 2CH 2COCH 3COOC 2H 5COOC 2H 5COOHO七、写出下列反历程:C 6H 5CH 22C 6H 5O+CH 2=CHCOCH 3NaOCH 3CH 3OHC 6H 5C=O C 6H 5CH 3C 6H 5CH 2CCH 2C 6H 5ONaOCH C 6H 5CH 26H 5OCH 2=CHCOCH 3C 6H 5CH 2CCHC 6H 5OCH 2CH 2COCH 3NaOCH C 6H 5O 3C 6H 5CH CHC 6H 5OCHOCH 3CH 2CH 2H 2OC=OCH 3C 6H 5C 6H 5八、以甲醇,乙醇为原料,用丙二酸酯法合成下列化合物: 1.α-甲基丁酸CH 3OH3CH 3ClC 2H 5OH3CH 3CH 2Cl C 2H 5OOCCH 2COOC 2H 5NaOC H CH ClC 2H 5OOCHCOOC 2H 5CH 3NaOC 2H 5CH 3CH 2ClC 2H 5OOCCCOOC 2H 5CH 3CH 2CH 312-2.H 3O+HOOCCCOOH 2CH 3CH 3CH 3CH 3CH2CHCOOHCH 3CH 2OH CH 3CHO5%NaOHaqCH 3CH=CHCHO2CH 3CH 2CH 2CH 2OHPCl 3CH 3CH 2CH 2CH 2Cl COOC 2H 5CHNa COOC 2H5CH 3CH 2CH 2CH 2ClCOOC 2H 5CHCH 2CH 2CH 2CH 3COOC 2H 51.H 2O,-OH2.H 3O+CH 3CH 2CH 2CH 2CH 2COOH3. 3-甲基己二酸CH 3CH 2ClMg,(C 2H 5)2O CH 3CH 2MgClCH 2OH 3O +CH 3CH 2CH 2OHH 3PO 4CH 3CH=CH 2Br BrCH 3CHCH 2Br2C 2H 5OOCCHCOOC 2H 5NaBrCH 3CHCH 2BrCH 31.H 2O,-OH2.H 3O+CH 3HOOCCH 2CHCH 2CH 2COOH(C 2H 5OOCCHCHCH 2CH(COOC 2H 5)24. 1,4-环己烷二甲酸CH 3CH 2OH H 2SO 4CH 2=CH 2Br 2BrCH 2CH 2Br2CH 2(COOC 2H 5)22NaOC 2H 55.环丙烷甲酸九、以甲醇、乙醇以及无机试剂为原料,经乙酰乙酸乙酯合成下列化合物:(1) 3-乙基-2-戊酮CH 3CH 2OHPCl CH 3CH 2Cl CH 3COCH 2COOC 2H 5NaOC H CH 3COCHCOOC 2H 5Na 32C 2H 5CH 32H 5NaOC H 32CH 3COCCOOC 2H 5CH 2CH 3CH 2CH 3H O +CH 3COCHCH 2CH 3CH 2CH 3(2) α-甲基丙酸PCl CH 3COCH 2COOC 2H 5NaOC H CH 3COCHCOOC 2H 5Na CH 32H 5NaOC H CH 3COCCOOC 2H 5H O+CH 3OHCH 3Cl CH 3Cl CH 33CH 3CH 340%CH 3CHCOOHCH 3(3)γ-戊酮酸CH3COCH2COOC2H5NaOC HCH3COCHCOOC2H5NaCH32H5HO+CH3CH2OH[O]CH3COOH2ClCH2COOHC H OH,H+ClCH2COOC2H5ClCH2COOC2H5CH2COOC2H55%CH3COCH2CH2COOH(4)2,7-辛二酮CH3COCH2COOC2H5NaOC HCH3COCHCOOC2H5NaCH3CH2OH CH2=CH2ClCH2CH2ClCl22ClCH2CH2ClCH3COCHCH2CH2CHCOCH3COOC2H5COOC2H5H O+5%CH3COCH2CH2CH2CH2COCH3(5)甲基环丁基甲酮CH3COCH2COOC2H5NaOC HCH3COCHCOOC2H5NaH O+5%CH3CH=CH22ClCH2CH=CH2HBrClCH2CH2CH2BrClCH2CH2CH2BrCH3COCHCOOC2H5CH2CH2CH2ClNaOC HCH2CH2CH2ClCH3COCCOOC2H5NaCH3COCCOOC2H5COCH3十、某酮酸经硼氢化钠还原后,依次用溴化氢,碳酸钠和氰化钾处理后,生成腈。
临床药理学第十四章不良反应

n 5.病理状态:
PPT文档演模板
临床药理学第十四章不良反应
n 药效学:机体功能状态的改变会明显影响药物敏感性, n 如巴比妥类药物中毒时,能耐受较高剂量的中枢兴奋药,
暴发性痢疾时能耐受较高剂量的阿托品
n 药动学: n (1)胃肠道疾病:影响药物的吸收; n (2)心血管疾病:影响药物吸收、分布、代谢排泄; n (3)肝脏损害:可影响药物的活化或代谢消除; n (4)肾功能损害:有些药物排泄明显减慢、半衰期延长
PPT文档演模板
临床药理学第十四章不良反应
n Ⅱ型变态反应 (溶细胞型变态反应)
n 特点:①参与该反应的抗体是IgG(少有IgM、IgA)。 ②补体参与反应过程,故常导致血细胞溶解现象发生。
n 在Ⅱ型变态反应中,细胞表面抗原或吸附在细胞表面的抗原与相应 抗体结合,在补体参与下使细胞溶解或损伤,或由巨噬细胞将其吞 噬裂解,最常累及的是红细胞(如溶血性贫血、新生儿溶血症等); 其次是粒细胞或血小板(如氨基比林引起的粒细胞减少症等)。
PPT文档演模板
临床药理学第十四章不良反应
严重药品不良反应 (或不良事件) 指因服用药品引起以下损害情形之一的反应
n 引起死亡 n 致癌、致畸、致出生缺陷 n 对生命有危险并能够导致人体永久的或显著
的伤残
n 对器官功能产生永久损伤 n 导致住院或住院时间延长
PPT文档演模板
临床药理学第十四章不良反应
n Ⅳ型变态反应从实质上讲,是机体为了消灭再次侵入的病原微生物及 其他变应原而采取的防御措施,但由于反应过于强烈,造成了组织损 伤。一般说来,具有传染性变态反应的人都具有细胞免疫的能力。
演示文稿5精细化工产品导论 药物与中间体

普鲁卡因胺具有抗心律失常活性,
可用于室上性和室性心率失常。
O 2N
CH3
[O]
O 2N
COOH
制 法
SOCl2
H2NCH2CH2N(C2H5)2 O 2N COCl NaOH
O 2N
CONHCH2CH2N(C2H5)2 H2/Ni
H 2N
CONHCH2CH2N(C2H5)2
恩屈嗪
N N NHNH 2
NHNH 2 N N NHNH 2
阱屈嗪
双阱屈嗪
N N NHNHCOOC 2H5
N N CH 3 NHNH C CH C(CH 3)2
托屈嗪
P hCO N N N
布屈嗪
CH 3 NHNH C CH C(CH 3)2
恩屈嗪
其中双肼屈嗪、布屈嗪在作用时间和副作用方面优
于肼屈嗪。托屈嗪在体内代谢产生肼屈嗪而起作用,
吸收快,起效快。 本类药物主要包括硝酸酯类的硝酸甘油和硝酸异山 梨醇酯及硝酸异戊四醇酯,亚硝酸类的亚硝酸异戊 酯等
CH2ONO2 CHONO 2 CH2ONO2
CH2ONO2 CHONO 2 CHONO 2 CH2ONO2 四硝酸赤藓醇酯
H3C
CH3 CH CH2 CH2ONO
硝酸甘油
O2NO H
医学和生理学奖。
药物分类
根据药物的作用,我们可以将药物分为心血管类 药物、抗肿瘤类药物、抗生素类药物、解热镇痛 类药物、激素类药物、利尿药及降血糖药物等。 从生产吨位角度看,化学合成法是主要的药物来 源。本章主要从心血管药、抗肿瘤药、抗生素类 及解热镇痛类药物等方面来阐述从医药中间体合 成临床药物的思想及方法。
化学药品制造的生产流程

化学药品制造的生产流程化学药品制造的生产流程化学药品制造是一个复杂而精细的过程,需要严格遵守安全操作规程和质量标准。
下面将介绍一般化学药品制造的生产流程。
首先,化学药品的制造通常从原材料的采购开始。
制造药品所需的原材料包括化学物质、试剂、溶剂等,这些原材料必须符合国家和行业的质量标准。
生产厂家通过与供应商签订合同,确定所需原材料的数量和质量,然后由采购部门进行采购。
采购完成后,原材料将被送到生产车间进行储存和配料。
为了确保质量和安全,原材料需要进行严格的检验和检测。
一般来说,每一批原材料都需要进行外观、纯度、水分、重金属等方面的检测。
只有符合要求的原材料才能被接受,否则需要退回供应商或者废弃处理。
配料是化学药品制造中的关键步骤之一。
根据药品的配方,将准确的比例的原材料称取并加入到反应容器中。
在配料的过程中,必须保持严格的环境控制,避免杂质、微生物等的污染。
同时,一些易燃、易爆、有毒的物质需要特别注意安全操作,防止事故发生。
完成配料后,开始进行药品的反应。
反应过程中,需要控制反应时间、温度、压力等参数,以确保反应达到预期效果。
一般来说,反应完成后,将进行产物的分离和纯化。
分离通常通过离心、蒸馏、过滤等方式进行,纯化则需要采用各种物理、化学方法来除去杂质和不需要的组分。
完成分离和纯化后,得到的药品将进行质量控制。
质量控制包括外观、含量、纯度、微生物等方面的检测。
只有符合药典或公司的标准的药品才能被接受。
一般来说,质量控制部门会进行全面的检测和评估,确保产品的质量稳定和符合要求。
最后,药品将进行包装和贮存。
包装和贮存需要符合相关的法律法规和行业标准。
包装应保证药品的安全性、稳定性和易于使用。
贮存时要注意温度、湿度等环境条件,避免药品受到影响。
药品的包装和贮存完成后,即可发往销售渠道或者储存仓库。
总之,化学药品制造是一个复杂而严谨的过程,需要严格控制各个环节的质量和安全。
从原材料采购到最终产品的包装贮存,都需要仔细操作和严格控制。
《化学药品常识课件》

药品的销售和处方管理
药店销售
讲解药品的销售流程和药店的规 范操作,以确保提供安全合规的 药品。
处方管理
线上销售与递送
介绍处方药品的管理和使用方式, 包括处方填写、审核和记录等。
探讨药品的在线销售模式和递送 流程,以满足现代消费者的需求。
常见不良反应
列举一些常见药品的不良反应, 并介绍如何应对和处理。
不良反应报告
强调重要性,鼓励及时报告药 品的不良反应,以便维护公众 的用药安全。
药品的储存和保管
1
,以防止误食、
滥用或不当使用。
3
储存环境
解释药品的储存要求,包括温湿度、避 光和通风等方面。
过期药品处理
药品的未来发展趋势
先进技术应用
展望科技在药品研发、生产 和治疗领域的应用前景,如 基因编辑和人工智能等。
个性化治疗
介绍个体化治疗的概念和方 法,以适应患者的个体差异 和需求。
绿色制药
探讨环保和可持续发展对药 品生产和使用的影响,以及 可持续制药的未来方向。
药品质量控制
1 化学和物理检验
介绍常用的化学和物理检验 方法,以确保药品符合质量 标准。
2 微生物检验
讲解微生物检验的重要性, 以保证药品在使用过程中不 会引起感染。
3 稳定性和保存性
探索药品的稳定性和保存性要求,以确保药品在有效期内依然具备疗 效。
药品的使用安全性和不良反应
安全使用指南
提供使用药品时应注意的安全 事项,如用量、服用方式和交 互作用。
化学药品常识课件
通过本课件深入了解化学药品的定义、分类以及其工艺流程,探讨药品质量 控制、使用安全性和不良反应,介绍药品的储存和保管,以及销售和处方管 理的重点。
化学药品和中间体

第一节 模拟式显示仪表
3.自动电子电位差计的测量桥路
图4-3 电位差计测量桥路原理图
图4-2 电子电位差计原理图
(1)冷端温度补偿问题
举例
用镍铬-镍硅热电偶测量温度,其热端温度不变, 而冷端温度从0℃升高到25℃,这时热电势将降 低1mV,仪表指针会指示偏低。
5
第一节 模拟式显示仪表
如果把R2做成随温度变化的电阻,且在温度从0℃升高到 25℃时,其阻值变化量ΔR2=0.5Ω,这时,电阻R2上的电压 降UDB也增大,ΔUDB=ΔR2·I2=1mV。为了统一规格,上支 路的电流规定为4mA(或2mA),下支路电流规定2mA(或 1mA ) 。 因 为 测 量 桥 路 的 补 偿 电 压 UCD = UCB - UDB , 现 在 UDB增加了1mV,那么UCD就会减少1mV,此时滑动触点C的 平衡位置不需变化。由于UCD的变化与热电势的变化相等, 故能起到温度补偿作用,使仪表的指示值基本不受冷端温度 变化的影响。
R2—冷端补偿铜电阻;RM—量程 电阻;RB—工艺电阻;RP—滑线 电阻;R4—终端电阻(限流电 阻);R3—限流电阻;RG—始端 电阻;E—稳压电源1V;I1—上 支路电流4mA;I2—下支路电流
2mA
的优劣有关。
⑤量下限)电阻RG 大小取决于
测量下限的高低。
7
第一节 模拟式显示仪➢表测量桥路
4.自动电子电位差计的结构
➢放大器
➢可逆电机
➢指示机构
➢记录机构
图4-5 电子电位差计方框原理图
8
第一节 模拟式显示仪表
二、自动电子平衡电桥
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学药品和中间体
三、实验原理 肉桂酸的合成方法大体上有三种。 1.苯基二氯甲烷法 苯基二氯甲烷和无水醋酸钠在180~200℃反应生成肉桂 酸。
CHCl2 + CH3COONa 180~200℃
CH CHCOCH3 + NaCl
肉桂酸
该法合成路线较短,苯基二氯甲烷价廉易得,反应条件 温和,但转化率低,副产物多,产物中易含氯离子,影响在 香料工业中的应用。
化学药品和中间体
二、化学药品和中间体的应用 医药向来是人们抵抗疾病的武器,特别是化学药品,在 人们预防和治疗疾病中起到了无法替代的作用。 中间体作为化学药品的原料,对保证化学药品的开发、 生产具有重要意义。 因此,化学药品及中间体工业已经成为了精细化工及医 药化工的重要方面。 但是,应用化学药品必须注意其可能带来的副作用。 三、化学药品和中间体的发展概况
化学药品和中间体
六、实验记录与数据处理
1.实验记录表
表14-3 乙酰水杨酸制备的实验记录表
产品名称
粗品乙酰水杨酸 精制产品乙酰水杨酸
性状
熔程/℃
水溶液的颜色
加入1%三氯化铁 溶液后颜色
产量/g
2.数据记录表
乙酰水杨酸的粗品和精制产品的收率计算方法可参照
《实验一 杀虫剂甲氧氯的制备》中相关内容,将所得数据
葡萄糖酸锌
化学药品和中间体
实验二十七 乙酰水杨酸的制备
一、实验目标 1.理解酚羟基酰化反应的原理; 2.掌握乙酰水杨酸的制备方法; 3.掌握利用重结晶精制固体产品的操作技术。 二、产品特性与用途
乙酰水杨酸英文名称:Acetylsalicylic acid,化学式:
C9H8O4,相对分子质量:180.16;俗称阿司匹林。是白色针 状或片状晶体,熔点135~136℃,微溶于水,易溶于乙醇、 乙醚、氯仿等有机溶剂。它在干燥的空气中较稳定,遇潮则 缓缓水解成水杨酸与乙酸。口服具有解热镇痛作用,是一种 常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿 酸的排泄。近年来还发现阿司匹林能抑制血小板凝聚,可防 止血栓的生成。
催化剂
Ca(C6H11O7)2 + H2SO4
CaSO4
+ 2 HOCH2(CHOH)4COOH
2 HOCH2(CHOH)4COOH
纯化
ZnO
结晶
[HOCH2(CHOH)4COO]2Zn
葡萄糖酸锌
化学药品和中间体
四、主要仪器与药品 1.主要仪器 001×7型阳离子交换树脂的交换柱及201×7型阴离子交 换树脂的交换柱等。 2.主要药品 224g葡萄糖酸钙、4.1g氧化锌、27mL浓硫酸及l0mL 95 %乙醇(均为化学纯)等。
本实验采用此法。反应产物中少量未反应的苯甲醛可通 过水蒸气蒸馏除去。
化学药品和中间体
四、主要仪器与药品 1.主要仪器 电加热套、电动搅拌器及水蒸气蒸馏装置等。 2.主要药品 3mL苯甲醛、5.5mL乙酸酐、3g无水醋酸钾、饱和碳酸钠 溶液、浓盐酸及活性炭等。
化学药品和中间体
五、实验内容与操作步骤
化学药品和中间体
六、实验记录与数据处理 1.实验记录表
表14-1 葡萄糖酸锌的制备的实验记录表
产品名称
性状
熔程/℃
葡萄糖酸锌
产量/g
2.数据记录表 产品的收率计算方法可参照《实验一 杀虫剂甲氧氯的 制备》中相关内容,将所得数据记录在表14-2中。
表14-2 葡萄糖酸锌的制备的数据记录表
产品名称
收率/%
肉桂酸又称β-苯丙烯酸,英文名称:Cinnamic acid;
化学式:C9H8O2;相对分子质量:148.16。有顺式和反式两 种异构体,通常以反式形式存在,为无色晶体,熔点133℃, 沸点300℃。它不溶于冷水,溶于热水、乙醇、乙醚、丙酮 和冰醋酸。它存在于妥卢香脂、苏合香脂、秘鲁香脂中。
化学药品和中间体
化学药品和中间体
3.珀金(Perkin)法
苯甲醛和醋酸酐在无水醋酸 (CH3CO)2O
CH3COOK
CH CHCOOH + CH3COOH
该法具有原料易得、反应条件温和、分离简单、产率高、 副产物少、产物纯度高、不含氯离子、成本低等优点,缺点 是操作步骤较多。
化学药品和中间体
3.结晶
将粗产品放入500mL烧杯中,在搅拌下加入225mL饱和碳 酸氢钠水溶液。乙酰水杨酸与碳酸氢钠反应生成水溶性钠盐, 而副产聚合物则不能溶于碳酸氢钠水溶液。加完后继续搅拌 几分钟,直至无二氧化碳产生。抽滤,滤出副产物聚合物, 并用5~10mL水冲洗漏斗,合并滤液,倒入预先盛有42mL浓 盐酸和90mL水的烧杯中,搅拌均匀,即有乙酰水杨酸晶体析 出,将烧杯用冰水浴冷却使结晶完全。抽滤,用少量冷水洗 涤结晶。将结晶移至表面皿,自然晾干。称重,计算收率。 测量熔程。乙酰水杨酸受热易分解,因此熔点不很明显,它 的分解点为128~135℃,测定熔点时,应先将热载体加热至 120℃左右,然后放入样品测定。
化学药品和中间体
葡萄糖酸锌的英文名称:Zinc gluconate;化学式:
C12H22O14Zn;相对分子质量:455.68。 它是白色结晶或颗粒状粉末,无臭,味微涩。它在沸水
中极易溶解,在水中易溶,在无水乙醇、氯仿或乙醚中不溶。
三、实验原理
以葡萄糖酸钙、浓硫酸、氧化锌等为原料合成葡萄糖酸 锌,合成路线如下:
化学药品和中间体
三、实验原理
本实验采用乙酸酐作酰基化试剂在浓硫酸作用下与水杨 酸发生酰化反应得乙酰水杨酸。
1.主反应:
COOH
O
O
OH + H3C C O C CH3
乙酰水杨酸
浓 H2SO4 80℃
COOH O
O C CH3 + CH3COOH
2.副反应:
OH
+
COOH + HO
H
△
HOOC
OCOCH3
化学药品和中间体
五、实验内容与操作步骤 1.葡萄糖酸的制备 在250mL四口烧瓶中加入125mL蒸馏水,再缓慢加入6.75mL (0.125mol)浓硫酸,搅拌下分批加入56g(0.125mol)葡萄糖酸钙,在 90℃恒温水浴中加热反应1.5h,趁热滤去析出的硫酸钙沉淀,得到淡黄 色液体。滤液冷却后,以每分钟相当于树脂体积的流量,流过装有等量 的阴离子交换树脂交换柱和阳离子交换树脂交换柱,进行纯化,得到无 色透明高纯度的葡萄糖酸溶液,其中溶质葡萄糖酸约0.23mol。 2.葡萄糖酸锌的制备 取0.1mol葡萄糖酸溶液,分批加入4.1g(0.05mol)氧化锌,在60℃ 水浴中,滴加葡萄糖酸溶液调节溶液的pH值 至5.8,搅拌反应2h,此时 溶液呈透明状态。过滤,滤液经减压蒸发,浓缩至原体积的1/3,之后加 入l0mL 95%乙醇,放置8h使之充分结晶。然后真空干燥,得白色结晶状 葡萄糖酸锌粉末。
化学药品和中间体
五、实验内容与操作步骤 1.乙酰化反应 在带有球型冷凝管、250mL干燥的四口烧瓶中,加入 25.8mL(0.264mol)新蒸的乙酸酐,开动搅拌,投入18g (0.1332mol)水杨酸,再缓慢滴加24滴浓硫酸,烧瓶口用 玻璃塞塞紧,在水浴中加热。反应温度控制在80~85℃,保 温30min。然后撤去水浴。 2.结晶、抽滤 稍冷后,拆下装置。把反应液倒入盛有150mL冷水的烧 杯中,并用冰水浴冷却。待结晶完全析出后,进行减压抽滤。 用少量冷水洗涤结晶两次,压紧抽干,移至表面皿上,晾干、 称量。留少量(绿豆大小)的粗制产品于试管中待用。
1.缩合
将9g(0.09mol)刚融熔并研细的无水醋酸钾、9 mL(0.09mol)刚 蒸馏过的苯甲醛、16.5mL(0.18mol)刚蒸馏过的乙酸酐,分别放入带有 回流装置、250mL干燥的四口烧瓶中,开动搅拌混合均匀。无水醋酸钾必 须是新熔融的。它的吸水性很强,操作时要快。无水醋酸钾的干燥程度, 对反应能否进行和产率的提高都有较明显的影响。久制的苯甲醛易自动 氧化生成苯甲酸,这不但影响产率,而且苯甲酸混在产物中不易除尽, 影响产物的纯度,所以需蒸馏除去杂质,接收176~180℃的馏分。乙酸 酐久置后因吸潮水解会生成乙酸,故实验前需蒸馏乙酸酐,接收137~ 140℃的馏分。然后加热,使溶液保持150~170℃微微沸腾状态约l h。 停止搅拌和加热,拆开装置。向四口烧瓶内倒入25mL水去除未反应的乙 酸酐。然后用饱和碳酸钠水溶液中和,使溶液呈弱碱性。此处不能用氢 氧化钠代替。因反应混合液中含有未转化的苯甲醛,它在强碱作用下会 发生坎尼扎罗(Cannizzaro)反应,生成的苯甲酸难于分离出去,影响 产物的质量。
精细化工试验技术
第十四章 化学药品和中间体
一、化学药品和中间体及其类型 二、化学药品和中间体的应用 三、化学药品和中间体的发展概况 实验二十六 葡萄糖酸锌的制备 实验二十七 乙酰水杨酸的制备 实验二十八 肉桂酸的制备
化学药品和中间体
一、化学药品和中间体及其类型 1.化学药品及其类型 化学药品是指具有防治疾病功能的化学品的总称。包括原料 药和制剂。原料药按来源可分为天然药物和化学药物,按生产方 式可分为天然提取药物、生物合成药物和化学合成药物三大类。 天然提取药物是指从动物、植物、微生物或矿物中提取分离 得到的医药原料;生物合成药主要是利用微生物发酵获得,也可 通过动物体内生物代谢途径、利用细胞培养途径、或通过对发酵 原药的分子进行化学改造途径获得;化学合成药按药理作用不同 可分为抗感染药物、抗寄生虫药物、抗溃疡病药物、抗心绞痛药 物、抗肿瘤药物等。 2.药物中间体及其类型 药物中间体是各种合成药的中间原料。
2.肉桂酸的用途 肉桂酸是重要的有机合成工业中间体之一。在医药工业 中,用来制造“心可安”、局部麻醉剂、杀菌剂、止血药等; 在农药工业中作为生长促进剂和长效杀菌剂用于果蔬的防腐; 肉桂酸是负片型感光树脂主要的合成原料;它具有很好的保 香作用,通常被用作配香原料和香料中的定香剂。肉桂酸在 食品、化妆品 、食用香精等领域都有广泛的应用。
