DB34_T 3768-2020超导回旋加速器 旋转治疗室技术管理要求
医疗器械检测资格认可范围及限制要求(广州所)
附件
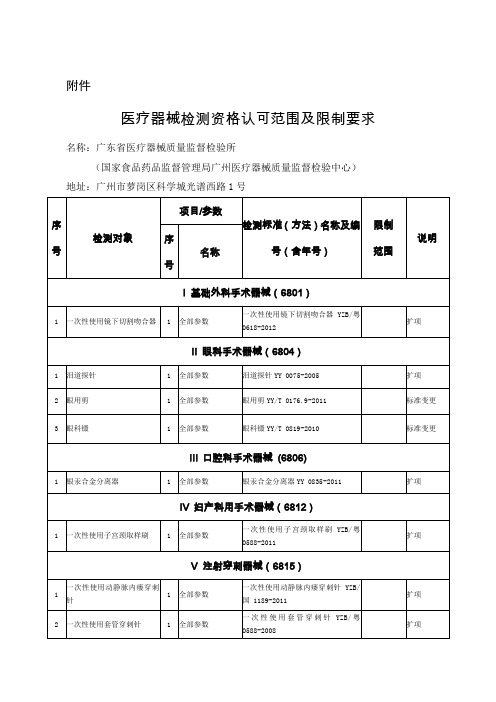
医疗器械检测资格认可范围及限制要求名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)
地址:广州市萝岗区科学城光谱西路1号
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)地址:广东省东莞市东城区樟村工业区(东莞生物性能检验室)
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)机构地址:广东省佛山市三水区乐平工业园东南路2号(三水检验室)
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)
机构地址:深圳市南山区科技园南区高新南一道013赋安科技大楼西侧106室(深圳检验室)
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)机构地址:广东省湛江市霞山区椹川大道60号(湛江检验室)。
回旋加速器的执行标准

回旋加速器的执行标准
回旋加速器是一种重要的医疗设备,用于治疗癌症等疾病。
为确保回旋加速器的安全运行和治疗效果,制定了回旋加速器的执行标准,主要包括以下几个方面:
1. 设备安全:对回旋加速器的安全性能指标进行规定,包括设
备使用寿命、电磁兼容性、机械结构等,以确保设备在使用过程中不会对患者造成安全威胁。
2. 治疗效果:规定了回旋加速器的辐射能量、剂量、照射方向等,以保证治疗效果的准确性和有效性。
3. 操作规范:对回旋加速器的操作人员进行规定,包括相关岗
位的资格要求、培训要求、操作流程等,以确保设备的正确使用和操作人员的安全。
4. 质量管理:对回旋加速器的质量管理进行规定,包括质量保证、质量控制、设备校准等,以保证设备的稳定性和治疗效果的准确性。
以上是回旋加速器的执行标准的主要内容,这些标准的执行可以有效地保障回旋加速器的安全运行和治疗效果。
- 1 -。
低温气体灭菌器注册技术审查指导原则-征求意见稿 -山东审评中心(1)

低温气体灭菌器注册技术审查指导原则本指导原则旨在指导注册申请人对低温气体灭菌器注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对低温气体灭菌器的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围根据《医疗器械分类目录》(国家食品药品监督管理总局公告2017年第104号)(以下简称《目录》),本指导原则适用于《目录》中分类编码为11(医疗器械消毒灭菌器械)-03(化学消毒灭菌器械)-03(环氧乙烷灭菌器)、04(甲醛灭菌器)、05(过氧化氢灭菌器)中所述的产品。
过氧乙酸灭菌器、含高压蒸汽灭菌程序的甲醛灭菌器等不在本指导原则适用范围内,但可以参照执行。
—1 —二、技术审查要点(一)产品名称要求产品的名称应符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号),采用《分类目录》或国家标准、行业标准上的通用名称。
如环氧乙烷灭菌器、过氧化氢灭菌器、过氧化氢等离子灭菌器、甲醛灭菌器、低温蒸汽甲醛灭菌器等。
(二)产品的结构和组成低温气体灭菌器采用化学蒸汽或化学气体为灭菌因子杀灭负载微生物,压力、温度、时间等灭菌的主要技术参数由程序设定并控制,可具备预真空或脉动真空功能;灭菌器一般由灭菌室、加注系统、气化系统、真空系统、控制系统、解析系统等组成。
图1:低温气体灭菌器结构示意图不同生产企业的产品,在结构上存在一定差异,可以与本部分描述不完全一致。
医疗器械技术审评咨询管理规范-医疗器械技术审评中心

医疗器械技术审评咨询管理规范(2016年10月12日,食药监械审发〔2016〕20号)第一章总则第一条为提高医疗器械注册技术审评咨询工作的质量和效率,规范医疗器械技术审评中心对外咨询工作,结合中心技术审评工作实际情况,制定本规范。
第二条医疗器械技术审评咨询包括现场咨询、网上咨询、电话咨询和共性问题解答。
第三条咨询范围:主要针对提出注册申请及处于发补状态的医疗器械注册项目,申请人或注册人收到我中心发出的补正资料通知单后,在补回资料前,针对通知单相关内容进行沟通和答疑。
咨询中不对申请人或注册人拟提交的补充资料具体内容进行确认。
注册申请的技术审评结论以申请人或注册人正式提交的补充资料为依据.第四条质量管理处负责咨询工作的综合管理,各审评部负责本部门咨询的管理,办公室负责中心网站咨询平台的技术保障工作。
第二章现场咨询第五条申请人或注册人通过中心网站咨询平台进行现场咨询的预约申请,按要求填写《咨询申请单》(附件1),明确具体咨询问题。
每个符合要求的受理号申请现场咨询的机会原则上不超过3次.第六条主审人接到现场咨询预约申请后,应及时通过中心网站咨询平台对现场咨询时间进行确认,并提前3个工作日电话通知预约申请人,原则上应在收到预约申请之日起20个工作日内完成现场咨询。
第七条预约申请人可以通过中心网站咨询平台查询预约结果,预约成功后打印《医疗器械技术审评现场咨询确认单》(附件2)一式两份,作为现场咨询凭证。
第八条现场咨询原则上安排在周四9:00—11:30、13:30—16:30进行.主审人应根据咨询问题预估现场答疑所需时间,原则上针对每个咨询申请的答疑时间不超过半小时。
同一主审人的现场答疑应尽可能安排在同一时段内进行。
现场咨询完成后,咨询双方应在《医疗器械技术审评现场咨询确认单》上签字并各留一份.第九条主审人遇特殊情况无法在预约时间到场答疑,原则上应提前2个工作日与预约申请人进行沟通,重新确认现场咨询时段。
第十条主审人因病假、调岗等原因长时间无法进行现场答疑的,审评部负责人应做好相应的调整工作。
2020年医疗器械产品技术要求的法规

随着医学科技的不断进步,医疗器械产品的技术要求也在不断提高。
为了保障患者的安全和健康,各国纷纷出台了一系列法规和标准,规范医疗器械产品的生产、销售和使用。
本文将就2020年医疗器械产品技术要求的法规进行详细介绍,希望能够对相关行业人士有所帮助。
一、医疗器械产品技术要求的法规概述1.1 国内法规在我国,医疗器械产品技术要求的法规主要包括《医疗器械监督管理条例》、《医疗器械注册管理办法》和《医疗器械生产质量管理规范》等。
这些法规从医疗器械的生产、注册、销售等方面规定了详细的技术要求,确保医疗器械产品符合国家标准,保障患者的安全和权益。
1.2 国际法规除了国内法规外,国际上也有一些法规和标准对医疗器械产品的技术要求进行了规范。
美国FDA(Food and Drug Administration)发布的《医疗器械监督管理条例》、欧盟CE认证、ISO国际标准等,这些法规和标准在一定程度上也影响着我国医疗器械产品的生产和销售。
2.1 医疗器械产品分类医疗器械产品根据其用途、风险等级等不同特征进行了分类,每类医疗器械产品都有相应的技术要求。
国内法规和标准通常会根据医疗器械产品的不同分类制定相应的技术要求。
2.2 医疗器械产品质量管理医疗器械产品的质量管理是保障产品安全和有效性的关键。
医疗器械生产企业应建立健全的质量管理体系,包括原材料的采购、生产过程的控制、成品检验等各个环节,严格执行相关的质量管理法规和标准。
2.3 医疗器械产品注册和备案医疗器械产品的注册和备案是保障产品质量和安全的重要环节。
医疗器械产品在上市销售前需要经过相关部门的注册或备案审批,符合相应的技术要求和标准。
2.4 医疗器械产品标识和说明书医疗器械产品的标识和说明书应当清晰准确地反映产品的名称、型号、规格、性能、使用方法、注意事项等信息,以满足用户对产品的识别和正确使用的需求。
2.5 医疗器械产品监督管理医疗器械产品的监督管理是保障产品质量和安全的重要手段。
细胞制备中心建设与管理规范

2016 - 06 - 14 发布 深圳市市场监督管理局
2016 - 07 - 01 实施 发布
SZDB/Z 188-2016
目次
前言 ................................................................................ II 1 范围 .............................................................................. 1 2 规范性引用文件 .................................................................... 1 3 术语和定义 ........................................................................ 1 4 建设要求 .......................................................................... 2 4.1 总体原则 ........................................................................ 3 4.2 功能分区 ........................................................................ 3 4.3 建筑要求 ........................................................................ 3 4.4 环境要求 ........................................................................ 4 4.5 装修装饰要求 .................................................................... 4 4.6 设施设备要求 .................................................................... 4 4.7 细胞储存区要求 .................................................................. 6 5 中心设置和人员要求 ................................................................ 6 5.1 设置原则及要求 .................................................................. 6 5.2 关键人员职责及能力要求 .......................................................... 6 6 管理要求 .......................................................................... 7 6.1 人员管理 ........................................................................ 7 6.2 设备管理 ........................................................................ 8 6.3 物料管理 ........................................................................ 9 6.4 过程控制 ....................................................................... 10 6.5 标签与编码管理 ................................................................. 11 6.6 细胞产品管理 ................................................................... 11 6.7 运输和转运 ..................................................................... 12 6.8 不合格细胞产品的处理和废弃 ..................................................... 13 6.9 安全管理 ....................................................................... 13 6.10 信息化管理 .................................................................... 14 附录 A(资料性附录) 中心设施设备配置 ............................................... 15 附录 B(规范性附录) 仪器设备的技术特征及要求 ....................................... 17
国家药监局综合司关于印发2020年医疗器械行业标准制修订计划项目的通知-药监综械注〔2020〕48号

国家药监局综合司关于印发2020年医疗器械行业标准制修订计划项目的通知正文:----------------------------------------------------------------------------------------------------------------------------------------------------国家药监局综合司关于印发2020年医疗器械行业标准制修订计划项目的通知药监综械注〔2020〕48号北京、天津、辽宁、上海、浙江、山东、湖北、广东省(市)药品监督管理局,中检院(国家药监局医疗器械标准管理中心),北京大学口腔医学院口腔医疗器械检测中心:为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,按照《“十三五”国家药品安全规划》有关医疗器械行业标准制修订工作要求,现将2020年医疗器械行业标准制修订计划项目印发给你们,有关要求通知如下:一、各相关省(市)局要高度重视,认真组织本行政区域标准承担单位开展标准制修订工作,加强监督管理,确保按要求完成各项工作任务。
二、国家药监局医疗器械标准管理中心要认真组织协调各医疗器械标准化技术委员会及技术归口单位,严格按照《医疗器械标准制修订工作管理规范》开展标准制修订工作,加强业务管理和检查指导,保证标准质量和水平。
三、承担标准制修订任务的医疗器械标准化技术委员会及技术归口单位要做好标准的组织起草、验证、征求意见和技术审查等工作,广泛听取意见,加强与有关方面的沟通协调,确保标准技术内容的科学性、合理性、适用性以及与相关政策要求的符合性。
附件:2020年医疗器械行业标准制修订计划项目国家药监局综合司2020年5月15日附件2020年医疗器械行业标准制修订计划项目序号项目名称制修订标准性质建议归口单位项目承担单位项目编号1组织工程医疗器械产品胶原蛋白第2部分:I型胶原蛋白分子量检测-十二烷基硫酸钠聚丙烯酰胺凝胶电泳法制定推荐性全国外科植入物和矫形器械标准化技术委员会组织工程医疗器械产品分技术委员会中国食品药品检定研究院N2020002-T-ZJY2组织工程医疗产品用以评价软骨形成的硫酸糖胺聚糖(sGAG)的定量检测制定推荐性全国外科植入物和矫形器械标准化技术委员会组织工程医疗器械产品分技术委员会中国食品药品检定研究院N2020003-T-ZJY3人工智能医疗器械质量要求和评价第1部分:术语制定推荐性中国食品药品检定研究院中国食品药品检定研究院A2020004-T-ZJY4人工智能医疗器械质量要求和评价第2部分:数据集通用要求制定推荐性中国食品药品检定研究院中国食品药品检定研究院A2020005-T-ZJY5医用增材制造粉末床熔融成型工艺金属粉末清洗及清洗效果验证方法制定推荐性中国食品药品检定研究院中国食品药品检定研究院N2020006-T-ZJY6抗人球蛋白检测卡(柱凝集法)制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会中国食品药品检定研究院I2020007-T-ZJY7梅毒螺旋体抗体检测试剂盒(免疫层析法)制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会中国食品药品检定研究院I2020008-T-ZJY8EB病毒核酸检测试剂盒(荧光PCR法)制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会中国食品药品检定研究院I2020009-T-ZJY9呼吸道病毒多重核酸检测试剂盒制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会中国食品药品检定研究院I2020010-T-ZJY10B族链球菌核酸检测试剂盒(荧光PCR法)制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会中国食品药品检定研究院I2020011-T-ZJY11人乳头瘤病毒核酸(分型)检测试剂(盒)修订推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会中国食品药品检定研究院I2020012-T-ZJY12总胆汁酸测定试剂盒(酶循环法)修订推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会中国食品药品检定研究院I2020013-T-ZJY13乳腺正电子发射断层成像装置性能和试验方法制定推荐性全国医用电器标准化技术委员会放射治疗、核医学和放射剂量学设备分技术委员会北京市医疗器械检验所A2020014-T-BJ14抗缪勒管激素测定试剂盒(化学发光免疫分析法)制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会北京市医疗器械检验所I2020015-T-BJ15补体4测定试剂盒(免疫比浊法)制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会北京市医疗器械检验所I2020016-T-BJ抗核抗体谱IgG检测试剂盒(免疫印迹法)制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会北京市医疗器械检验所I2020017-T-BJ17甲状腺球蛋白测定试剂盒(化学发光免疫分析法)制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会北京市医疗器械检验所I2020018-T-BJ18体外诊断检验系统性能评价方法第4部分:线性区间与可报告区间制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会北京市医疗器械检验所I2020019-T-BJ19红细胞计数和白细胞计数参考测量程序测量不确定度评定指南制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会北京市医疗器械检验所I2020020-T-BJ20癌胚抗原(CEA)定量标记免疫分析试剂盒推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会北京市医疗器械检验所I2020021-T-BJ21人绒毛膜促性腺激素(HCG)检测试纸(胶体金免疫层析法)修订推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会北京市医疗器械检验所I2020022-T-BJ22人类白细胞抗原(HLA)基因分型检测试剂盒修订推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会北京市医疗器械检验所I2020023-T-BJ23体外诊断检验系统性能评价方法第3部分:检出限与定量限制定推荐性全国医用临床检验实验室和体外诊断系统标准化技术委员会北京市医疗器械检验所I2020024-T-BJ24外科植入物涂层第3部分:贻贝粘蛋白涂层通用要求制定推荐性全国外科植入物和矫形器械标准化技术委员会天津市医疗器械质量监督检验中心N2020025-T-TJ25外科植入物运动医学植入物缝线拉伸试验方法制定推荐性全国外科植入物和矫形器械标准化技术委员会天津市医疗器械质量监督检验中心N2020026-T-TJ26无源外科植入物乳房植入物的专用要求修订强制性全国外科植入物和矫形器械标准化技术委员会天津市医疗器械质量监督检验中心N2020027-Q-TJ27骨接合植入物金属股骨颈固定钉修订推荐性全国外科植入物和矫形器械标准化技术委员会骨科植入物分技术委员会天津市医疗器械质量监督检验中心N2020028-T-TJ28外科植入物部分和全髋关节假体第10部分:组合式股骨头抗静载力测定修订推荐性全国外科植入物和矫形器械标准化技术委员会骨科植入物分技术委员会天津市医疗器械质量监督检验中心N2020029-T-TJ29心血管植入器械镍钛合金镍离子释放测试方法制定推荐性全国外科植入物和矫形器械标准化技术委员会心血管植入物分技术委员会天津市医疗器械质量监督检验中心N2020030-T-TJ30肝脏射频消融治疗设备修订强制性全国医用电器标准化技术委员会物理治疗设备分技术委员会天津市医疗器械质量监督检验中心A2020031-Q-TJ31X射线血液辐照设备制定推荐性全国医用电器标准化技术委员会医用X射线设备及用具分技术委员会辽宁省检验检测认证中心(辽宁省医疗器械检验检测院)A2020032-T-SY32X射线计算机体层摄影设备体型特异性剂量估算值计算方法制定推荐性全国医用电器标准化技术委员会医用X射线设备及用具分技术委员会辽宁省检验检测认证中心(辽宁省医疗器械检验检测院)A2020033-T-SY33医用普通摄影数字化X射线影像探测器修订推荐性全国医用电器标准化技术委员会医用X射线设备及用具分技术委员会辽宁省检验检测认证中心(辽宁省医疗器械检验检测院)A2020034-T-SY34医用动态数字化X射线影像探测器修订推荐性全国医用电器标准化技术委员会医用X射线设备及用具分技术委员会辽宁省检验检测认证中心(辽宁省医疗器械检验检测院)A2020035-T-SY35聚氨酯男用避孕套技术要求与试验方法制定推荐性全国计划生育器械标准化技术委员会上海市医疗器械检测所N2020036-T-SH36医用电气设备第2-80部分:用于呼吸功能不全的呼吸支持设备的基本安全和基本性能专用要求制定强制性全国麻醉和呼吸设备标准化技术委员会上海市医疗器械检测所A2020037-Q-SH37医用电气设备第2-79部分:用于呼吸功能障碍的呼吸支持设备的基本安全和基本性能专用要求制定强制性全国麻醉和呼吸设备标准化技术委员会上海市医疗器械检测所A2020038-Q-SH38麻醉和呼吸设备导气管和相关设备的通用要求制定推荐性全国麻醉和呼吸设备标准化技术委员会上海市医疗器械检测所A2020039-T-SH39封堵拦截导管制定推荐性全国外科器械标准化技术委员会上海市医疗器械检测所N2020040-T-SH40内镜手术器械重复性使用腹部冲吸器制定推荐性全国外科器械标准化技术委员会上海市医疗器械检测所N2020041-T-SH41医用电气设备网络安全基本要求制定推荐性全国医用电器标准化技术委员会上海市医疗器械检测所A2020042-T-SH42医用电气设备使用可靠性信息收集与评估方法制定推荐性全国医用电器标准化技术委员会上海市医疗器械检测所A2020043-T-SH43医用电气设备可靠性技术通用要求制定推荐性全国医用电器标准化技术委员会上海市医疗器械检测所A2020044-T-SH44医用电气设备第2-77部分:采用机器人技术的辅助手术设备的基本安全和基本性能专用要求制定强制性全国医用电器标准化技术委员会上海市医疗器械检测所A2020045-Q-SH45医用电气设备第2-78部分:康复、评估、补偿或缓解医用机器人基本安全和基本性能的专用要求制定强制性全国医用电器标准化技术委员会上海市医疗器械检测所A2020046-Q-SH电动手术台修订推荐性全国医用电器标准化技术委员会医用电子仪器标准化分技术委员会上海市医疗器械检测所A2020047-T-SH47电动气压止血仪制定推荐性全国医用电器标准化技术委员会医用电子仪器标准化分技术委员会上海市医疗器械检测所A2020048-T-SH48电动骨组织手术设备刀具第3部分:钻头制定推荐性全国医用电器标准化技术委员会医用电子仪器标准化分技术委员会上海市医疗器械检测所A2020049-T-SH49电动骨组织手术设备刀具第6部分:锉刀制定推荐性全国医用电器标准化技术委员会医用电子仪器标准化分技术委员会上海市医疗器械检测所A2020050-T-SH50医用成像磁共振设备主要图像质量参数的测定推荐性全国医用电器标准化技术委员会医用电子仪器标准化分技术委员会上海市医疗器械检测所A2020051-T-SH51医用电气设备第2-56部分:用于体温测量的临床体温计的基本安全和基本性能专用要求修订强制性全国医用电器标准化技术委员会医用电子仪器标准化分技术委员会上海市医疗器械检测所A2020052-Q-SH52一次性使用注射针识别色标修订推荐性全国医用注射器(针)标准化技术委员会上海市医疗器械检测所N2020053-T-SH53手术植入物有源植入式医疗器械第5部分:循环支持器械制定强制性全国外科植入物和矫形器械标准化技术委员会有源植入物分技术委员会上海市医疗器械检测所A2020054-Q-SH54眼科光学人工晶状体第8部分:基本要求修订强制性全国医用光学和仪器标准化分技术委员会浙江省医疗器械检验研究院N2020055-Q-HZ55眼科光学人工晶状体第4部分:标签和资料修订推荐性全国医用光学和仪器标准化分技术委员会浙江省医疗器械检验研究院N2020056-T-HZ56眼科仪器眼底照相机修订推荐性全国医用光学和仪器标准化分技术委员会浙江省医疗器械检验研究院A2020057-T-HZ57眼科光学接触镜护理产品第5部分:接触镜与接触镜护理产品物理相容性的测定修订推荐性全国医用光学和仪器标准化分技术委员会浙江省医疗器械检验研究院N2020058-T-HZ58眼科光学接触镜多患者试戴接触镜的卫生处理修订推荐性全国医用光学和仪器标准化分技术委员会浙江省医疗器械检验研究院N2020059-T-HZ59生物医用材料体外降解性能评价方法第1部分:可降解聚酯类制定推荐性全国医疗器械生物学评价标准化技术委员会山东省医疗器械产品质量检验中心N2020060-T-JN60生物医用材料体外降解性能评价方法第2部分:贻贝粘蛋白制定推荐性全国医疗器械生物学评价标准化技术委员会山东省医疗器械产品质量检验中心N2020061-T-JN61医疗器械生物学评价应用毒理学关注阈值(TTC)评定医疗器械组分的生物相容性制定推荐性全国医疗器械生物学评价标准化技术委员会山东省医疗器械产品质量检验中心N2020062-T-JN62可降解生物医用金属材料理化特性表征制定推荐性全国医疗器械生物学评价标准化技术委员会山东省医疗器械产品质量检验中心N2020063-T-JN63医疗器械体外皮肤刺激试验制定推荐性全国医疗器械生物学评价标准化技术委员会山东省医疗器械产品质量检验中心N2020064-T-JN64医疗器械医用贮液容器输送系统用连接件第1部分:通用要求和通用试验方法制定推荐性全国医用输液器具标准化技术委员会山东省医疗器械产品质量检验中心N2020065-T-JN65一次性使用人体动脉血样采集器(动脉血气针)修订推荐性全国医用输液器具标准化技术委员会山东省医疗器械产品质量检验中心N2020066-T-JN66末梢采血装置第1部分:一次性使用采血针制定推荐性全国医用输液器具标准化技术委员会山东省医疗器械产品质量检验中心N2020067-T-JN67医疗器械医用贮液容器输送系统用连接件第8部分:与枸橼酸盐抗凝剂连接的单采应用连接件制定推荐性全国医用输液器具标准化技术委员会山东省医疗器械产品质量检验中心N2020068-T-JN68无菌医疗器械包装试验方法第12部分:软性屏障膜抗揉搓性修订推荐性全国医用输液器具标准化技术委员会山东省医疗器械产品质量检验中心N2020069-T-JN69一次性使用静脉留置针修订推荐性全国医用输液器具标准化技术委员会山东省医疗器械产品质量检验中心N2020070-T-JN70聚乙烯醇止血海绵制定推荐性全国医用卫生材料及敷料标准化技术归口单位山东省医疗器械产品质量检验中心N2020071-T-JN71医用超声耦合剂修订推荐性全国医用电器标准化技术委员会医用超声设备分技术委员会湖北省医疗器械质量监督检验研究院A2020072-T-WH72超声经颅多普勒血流分析仪修订推荐性全国医用电器标准化技术委员会医用超声设备分技术委员会湖北省医疗器械质量监督检验研究院A2020073-T-WH73超声仿组织体模的技术要求修订推荐性全国医用电器标准化技术委员会医用超声设备分技术委员会湖北省医疗器械质量监督检验研究院A2020074-T-WH74牙科学旋转和震荡器械的杆修订推荐性全国口腔材料和器械设备标准化技术委员会齿科设备与器械分技术委员会广东省医疗器械质量监督检验所A2020075-T-GZ75牙科学根管器械第1部分:通用要求修订推荐性全国口腔材料和器械设备标准化技术委员会齿科设备与器械分技术委员会广东省医疗器械质量监督检验所A2020076-T-GZ76牙科学牙科银汞调和器修订推荐性全国口腔材料和器械设备标准化技术委员会齿科设备与器械分技术委员会广东省医疗器械质量监督检验所A2020077-T-GZ77牙科学旋转器械的公称直径和标号修订推荐性全国口腔材料和器械设备标准化技术委员会齿科设备与器械分技术委员会广东省医疗器械质量监督检验所A2020078-T-GZ78小型压力蒸汽灭菌器修订推荐性全国消毒技术与设备标准化技术委员会广东省医疗器械质量监督检验所A2020079-T-GZ79环氧乙烷灭菌的产品追加和过程等效修订推荐性全国消毒技术与设备标准化技术委员会广东省医疗器械质量监督检验所A2020080-T-GZ80心肺转流系统静脉气泡捕获器制定推荐性全国医用体外循环设备标准化技术委员会广东省医疗器械质量监督检验所N2020081-T-GZ81血液透析和相关治疗用液体的制备和质量管理第2部分:血液透析和相关治疗用水处理设备修订推荐性全国医用体外循环设备标准化技术委员会广东省医疗器械质量监督检验所A2020082-T-GZ82血液透析和相关治疗用液体的制备和质量管理第5部分:血液透析和相关治疗用透析液质量制定推荐性全国医用体外循环设备标准化技术委员会广东省医疗器械质量监督检验所N2020083-T-GZ83牙科学与牙齿结构粘接的测试修订推荐性全国口腔材料和器械设备标准化技术委员会北京大学口腔医学院口腔医疗器械检验中心N2020084-T-BD84牙科学牙本质小管封堵效果体外评价方法制定推荐性全国口腔材料和器械设备标准化技术委员会北京大学口腔医学院口腔医疗器械检验中心N2020085-T-BD85牙科学修复用金属材料中主要成分的快速无损检测方法手持式X射线荧光光谱法(半定量法)制定推荐性全国口腔材料和器械设备标准化技术委员会北京大学口腔医学院口腔医疗器械检验中心N2020086-T-BD86牙科学正畸矫治器用膜片制定推荐性全国口腔材料和器械设备标准化技术委员会北京大学口腔医学院口腔医疗器械检验中心N2020087-T-BD——结束——。
TCAMDI 039-2020 生物打印医疗器械生产质量体系特殊要求

全国团体标准信息平台
T/CAMDI 039-2020
生物打印医疗器械生产质量体系特殊要求
1 范围
本标准适用于通过增材制造系统生产的生物打印医疗器械。 本标准是对生物打印医疗器械设计开发、生产、销售和售后服务等全过程适用《医疗器械生产质量管 理规范》的特殊要求。
2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。 凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
2020-07-01 实施
中国医疗器械行业协会 发 布
全国团体标准信息平台
目次
T/CAMDI 039-2020
前 言 .................................................................................... 1 1 范围 .................................................................................... 2 2 规范性引用文件 .......................................................................... 2 3 术语和定义 .............................................................................. 2 4 一般要求 ................................................................................ 3 5 特殊要求 ................................................................................ 3 参考文献........................................................................................................................................................................... 10
消毒供应室管理规范解读

9.耗材要求
• 9.8 包装材料:最终灭菌医疗器械包装材料应符合GB/T 19633的要求.皱纹纸、无纺布、纺织品还 应符合YY/T 0698.2的要求;纸袋还应符合YY/T 0698.4的要求;纸塑袋还应符合YY/T 0698.5的要 求;硬质容器还应符合YY/T 0698.8的要求.
• 普通棉布应为非漂白织物,除四边外不应有缝线,不应缝补;初次使用前应高温洗涤,脱脂去浆. • 开放式储槽不应用作无菌物品的最终灭菌包装材料.
31
9.耗材要求
9.9 消毒灭菌监测材料:应符合国家相关标准和规定,在有效期内 使用.自制测试标准包应符合WS/T 367的相关要求。
32
10.水与蒸汽质量要求
p 10.1 清洗用水:应有自来水、热水、软水、经纯化的水供应.自来水水质
应符合GB 5749的规定;终末漂洗用水的电导率≤15µS/cm(25℃).
p 10.2 灭菌蒸汽:灭菌蒸汽供给水的质量指标参见附录B 的B.1.蒸汽冷凝物
用于反映压力蒸汽灭菌器蒸汽的质量,主要指标见附录B的B.2.(2016版)
医院消毒供应中心 第2部分 :清洗消毒及灭菌技术操作规范
目
录
1范围 2规范性引用文件 3术语和定义 4诊疗器械、器具和物品处理的基本要求(原则) 5诊疗器械、器具和物品处理的操作流程 附录
p 应配备机械清洗消毒设备.
8.设备设施
p 8.2 检查、包装设备:应配有器械检查台、包装台、器械柜、敷
料柜、包装材料切割机、医用热封机、清洁物品装载设备及带光源 放大镜、压力气枪、绝缘检测仪等.
8、建筑要求
p 8.3 灭菌设备及设施:应配有压力蒸汽灭菌器、无菌物品装、卸
载设备等.根据需要配备灭菌蒸汽发生器、干热灭菌和低温灭菌及 相应的监测设备.各类灭菌设备应符合国家相关标准,并设有配套 的辅助设备.
国家药监局关于发布医疗器械产品技术要求编写指导原则的通告-国家药监局通告2022年第8号

国家药监局关于发布医疗器械产品技术要求编写指导原则的通告正文:----------------------------------------------------------------------------------------------------------------------------------------------------国家药监局通告2022年第8号关于发布医疗器械产品技术要求编写指导原则的通告为提高医疗器械技术审评的规范性和科学性,指导医疗器械注册人/备案人编写产品技术要求,根据《医疗器械监督管理条例》及《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》的规定,国家药品监督管理局组织修订了《医疗器械产品技术要求编写指导原则》,现予发布。
特此通告。
附件:医疗器械产品技术要求编写指导原则国家药监局2022年2月8日附件医疗器械产品技术要求编写指导原则为提高医疗器械技术审评的规范性和科学性,指导医疗器械注册人/备案人进行产品技术要求的编写,根据《医疗器械监督管理条例》《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》等规定,制定本指导原则。
一、适用范围本指导原则适用于申请注册或备案的医疗器械产品,包括体外诊断试剂产品。
本指导原则仅对医疗器械产品技术要求的格式和内容提出一般要求,不对具体产品的具体要求进行规定。
指导原则中给出的示例仅供参考,相关监管机构及注册人/备案人应根据具体情形进行细化。
二、基本要求(一)产品技术要求的编制应符合国家相关法律法规。
(二)产品技术要求应采用规范、通用的术语。
如涉及特殊的术语,需提供明确定义,并写入“4.术语”部分。
直接采用相关标准、指导原则中的术语或其他公认术语的,不需要在技术要求“4.术语”部分重复列明。
不应使用与上述术语名称相同但改变了原义的自定义术语。
(三)产品技术要求中检验方法各项内容的编号原则上应与性能指标各项内容的编号相对应。
国家药监局关于发布家用体外诊断医疗器械注册技术审查指导原则等7项注册技术审查指导原则的通告

国家药监局关于发布家用体外诊断医疗器械注册技术审查指导原则等7项注册技术审查指导原则的通告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2020.12.01
•【文号】国家药品监督管理局通告2020年第80号
•【施行日期】2020.12.01
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局通告
2020年第80号
国家药监局关于发布家用体外诊断医疗器械注册技术审查指导原则等7项注册技术审查指导原则的通告为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《家用体外诊断医疗器械注册技术审查指导原则》《特定蛋白免疫分析仪注册技术审查指导原则》《泌乳素检测试剂注册技术审查指导原则》《总三碘甲状腺原氨酸检测试剂注册技术审查指导原则》《25-羟基维生素D 检测试剂注册技术审查指导原则》《血清淀粉样蛋白A检测试剂注册技术审查指导原则》和《类风湿因子检测试剂注册技术审查指导原则》,现予发布。
特此通告。
附件:1.家用体外诊断医疗器械注册技术审查指导原则
2.特定蛋白免疫分析仪注册技术审查指导原则
3.泌乳素检测试剂注册技术审查指导原则
4.总三碘甲状腺原氨酸检测试剂注册技术审查指导原则
5.25-羟基维生素D检测试剂注册技术审查指导原则
6.血清淀粉样蛋白A检测试剂注册技术审查指导原则
7.类风湿因子检测试剂注册技术审查指导原则
国家药监局
2020年12月1日。
国家卫生健康委员会、国家发展和改革委员会关于印发发热门诊建筑装备技术导则(试行)的通知

国家卫生健康委员会、国家发展和改革委员会关于印发发热门诊建筑装备技术导则(试行)的通知文章属性•【制定机关】国家卫生健康委员会,国家发展和改革委员会•【公布日期】2020.08.17•【文号】国卫办规划函〔2020〕683号•【施行日期】2020.08.17•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】医疗机构与医师正文关于印发发热门诊建筑装备技术导则(试行)的通知国卫办规划函〔2020〕683号各省、自治区、直辖市及新疆生产建设兵团卫生健康委、发展改革委:为指导各地实施《公共卫生防控救治能力建设方案》,进一步加强医疗机构发热门诊建设,国家卫生健康委、国家发展改革委制定了《发热门诊建筑装备技术导则(试行)》。
现印发你们,请结合实际,参考执行。
国家卫生健康委办公厅国家发展改革委办公厅2020年8月17日发热门诊建筑装备技术导则(试行)一、总则1.1根据《综合医院建筑设计规范》(GB51039)、《传染病医院建筑设计规范》(GB50849)等相关要求,为指导医疗机构发热门诊建设,强化发热门诊对急性传染性疾病的筛查、预警和防控作用,制定本技术导则。
1.2本导则适用于医院发热门诊的新建、改建和扩建项目。
其他医疗机构可参照执行。
1.3发热门诊应当具备预检、分诊、筛查功能,并配备相关设备设施。
没有设置发热门诊的医疗机构,应当制定预案,并设定一个相对独立、通风良好的发热筛查区域,以备临时筛查、隔离、转运使用。
确保早发现、早报告、早隔离、早治疗。
二、建筑设计2.1发热门诊选址2.1.1发热门诊应当设置在医疗机构内相对独立的区域,与普通门(急)诊相对隔离,并宜临近急诊,设立相对独立的出入口,便于患者筛查、转运。
2.1.2有条件的发热门诊宜预留室外场地及设备管线条件,为以后快速扩建、转运等提供基础条件。
2.1.3设有发热门诊和发热筛查点的医疗机构,院区主入口和门急诊大厅外应当设置醒目的发热门诊标识,明确发热门诊所在的方向、位置及路线。
北京市药品监督管理局关于发布2020年医疗器械临床试验监督抽查项目的通告

北京市药品监督管理局关于发布2020年医疗器械临床
试验监督抽查项目的通告
文章属性
•【制定机关】北京市药品监督管理局
•【公布日期】2020.09.14
•【字号】通告〔2020〕5号
•【施行日期】2020.09.14
•【效力等级】地方规范性文件
•【时效性】现行有效
•【主题分类】卫生医药、计划生育其他规定
正文
北京市药品监督管理局关于发布2020年医疗器械临床试验监
督抽查项目的通告
通告〔2020〕5号为进一步加强北京市医疗器械临床试验监督管理,推进《医疗器械临床试验质量管理规范》有效落实,我局抽取了多维全导联同步立体心电图仪等8个临床试验项目,将对其临床试验真实性和合规性进行现场检查。
临床试验项目信息见附件,具体检查时间另行通知。
特此通告。
附件:2020年医疗器械临床试验监督抽查项目
北京市药品监督管理局
2020年9月14日附件
2020年医疗器械临床试验监督抽查项目。
放射治疗技术操作规程及规范

放射治疗技术操作规程及规范一、放射治疗操作规范二、医用直线加速器操作规程三、常规放射治疗摆位技术操作规范四、三维适形〔3DCRT〕放射治疗摆位技术操作规范五、医诺尔全自动热丝切割机操作规程六、体膜室体膜制作操作流程七、体模室工作任务八、体模设计与制作技术规范九、体模室操作规范及流程十、放射治疗计划的设计与实施规范十一、CT模拟定位技术十二、CT模拟定位机操作流程十三、激光定位系统操作规程十四、注射系统操作规程十五、放射治疗系统及设备的安全管理十六、直线加速器维修过程及日常安全联锁系统检查规定十七、直线加速器安全防护操作规范十八、放射防护工作规程十九、体模制作病人须知二十、放射治疗病人须知一、放射治疗操作规范根据我院放疗设备配置条件和放疗室相关的质控标准,结合放射治疗技术在我科的开展需要,直线加速器室按放射治疗技术分类、制定以下放射治疗操作规范。
一)直线加速器室治疗摆位要求;1.摆位技术人员必须是经过专业培训、了解和熟悉加速器的各种性能〔基本结构、射线性质、工作范围和特点〕和操作规程的技术人员。
2.在日常放疗工作中,必须严格按每台加速器的操作规程执行放射治疗技术摆位。
摆位技术人员每天在治疗病人前,应严格按加速器的操作规程做好放疗前的准备工作,机器如有异常请及时上报相关部门处理。
二)肿瘤放射治疗摆位技术基本操作规范1.放疗患者治疗单的确认,当拿到放疗患者治疗单时要做三查五对的工作;三查:查机器类型、射线性质、查治疗单内容是否清楚、是否有主管医生签名、查患者体表标志线〔或照射野〕是否清楚,特殊患者请主管医生共同摆位。
五对:对患者姓名〔或病人ID号〕、对性别、对诊断及医嘱、对照射中心及射野剂量、对累积剂量。
确认上述各项精确无误后实施技术员双签名制度。
〔摆位签名、抄单签名〕2.向患者及家属交待放疗注意事项及时间安排:1)放疗时代保证体表标志线〔或照射野〕模糊保,持皮肤干燥,不能随意擦洗体表标志线〔或照射野〕,照射野十字中心。
河北省市场监督管理局关于发布《细胞制备中心建设与管理规范》等二十八项河北省地方标准的通告

河北省市场监督管理局关于发布《细胞制备中心建设与管理规范》等二十八项河北省地方标准的通告
文章属性
•【制定机关】河北省市场监督管理局
•【公布日期】2020.03.26
•【字号】
•【施行日期】2020.03.26
•【效力等级】地方规范性文件
•【时效性】现行有效
•【主题分类】市场规范管理
正文
河北省市场监督管理局关于发布《细胞制备中心建设与管理规范》等二十八项河北省地方标准的通告河北省市场监督管理局新批准发布了《细胞制备中心建设与管理规范》等二十八项河北省地方标准,现予以通告(详细目录见附件)。
本通告可通过河北省市场监督管理局网站“通知公告”
()中进行查询,标准文本可从标准图书馆网站()“京津冀地方标准数据库”中免费下载。
附件:新批准发布的28项河北省地方标准目录
河北省市场监督管理局
2020年3月26日附件
新批准发布的28项河北省地方标准目录。
超导回旋加速器 安装管理规范

DB 34/T XXXX—XXXX超导回旋加速器安装管理规范1 范围本文件规定了超导回旋加速器安装的一般要求、装配要求、安装检测和质量及现场管理。
本文件适用于超导回旋加速器的安装管理。
2 规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
JB/T 5994-1992 装配通用技术要求JGJ 276-2012 建筑施工起重吊装工程安全技术规范ISO 13485 医疗器械质量管理体系用于法规的要求3 术语和定义下列术语和定义适用于本文件。
3.1超导回旋加速器superconducting cyclotron主线圈是超导线圈的回旋加速器。
3.2超导回旋加速器室superconducting cyclotron radiation shielding chamber用于屏蔽超导回旋加速器辐射的安装及运行房间。
4 一般要求4.1 人员4.1.1 参与安装的人员应接受过安全教育以及岗位技能培训。
4.1.2 起重/专用设备等特殊工种应持证上岗。
4.1.3 关键工序、特殊过程操作人员应经培训合格后上岗。
4.2 零部件4.2.1 所有零部件的型号、规格、数量等应与装配物料清单一致。
4.2.2 所有加工零件应检验合格,重要零件应复查关键尺寸。
4.2.3 零部件装配前要进行除油除锈、清洗、烘烤、干燥处理。
4.2.4 外购件应具有质量合格证书。
4.2.5 紧固件应对应标号及规格,按序整齐放置。
4.3 吊装DB 34/T XXXX—XXXX 零部件吊装应按JGJ 276-2012的规定进行。
4.4 联接螺钉、螺栓联接,销联接、键联接以及铆接等各种联接方法应按JB/T 5994-1992的规定进行。
4.5 安装现场4.5.1 超导回旋加速器的地基应能够承受其工作状态下的最大载荷要求,并且地基建设的沉降率满足使用要求,其10m长度的差别沉降<0.2mm/年。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ICS 27.120.99CCS F 9134安徽省地方标准DB 34/T 3768—2020超导回旋加速器旋转治疗室技术管理要求Superconducting cyclotron—Technical management specifications for rotating therapy room2020 - 11 - 27 发布2020 - 12 - 27 实施安徽省市场监督管理局发布前言本文件按照GB/T 1.1—2020《标准化工作导则第1部分:标准化文件的结构和起草规则》的规定起草。
请注意本文件的某些内容可能涉及专利。
本文件的发布机构不承担识别专利的责任。
本文件由合肥中科离子医学技术装备有限公司提出。
本文件由安徽省超导回旋加速器标准化技术委员会归口。
I超导回旋加速器旋转治疗室技术管理要求1范围本文件规定了超导回旋加速器旋转治疗室的术语和定义、技术要求、放疗设备管理要求和放疗人员管理要求。
本文件适用于超导回旋加速器旋转治疗室的技术管理。
2规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 16362 远距治疗患者放射防护与质量保证要求GBZ 126 电子加速器放射治疗放射防护要求GBZ/T149 医学放射工作人员卫生防护培训规范JJG 912治疗水平电离室剂量计3术语和定义下列术语和定义适用于本文件。
3.1图像引导系统 image-guided system图像采集、处理和反馈系统。
注:图像引导系统保证在患者进行治疗前、治疗中利用先进的影像设备对肿瘤及正常器官进行实时的监控扫描,采集并重建三维图像,与治疗计划图像配准,并能根据器官位置的变化调整治疗条件使照射野紧紧“追随”靶区,保护正常组织的同时又能够对肿瘤进行放射治疗。
3.2激光定位系统 laser positioning system通过在治疗区布置若干组激光定位灯,在三维空间将患者肿瘤位置进行定位的系统。
3.3安全激光扫描仪 safety laser scanner在一定区域内通过激光扫描来检测物体大小及位置的装置。
3.4辐射剂量监测仪 radiation dose monitor安装于旋转治疗室内用于监测室内剂量水平的仪器。
3.5束流偏转磁铁 beam bending magnet在束流输运线中,改变束流中参考粒子轨道的方向和位置的电磁偏转部件。
注:通常所用的偏转磁铁是一个偶极磁铁,两极面之间有一个间隙磁场,且磁场以间隙中央平面为反对称平面。
1DB 34/T 3768—20203.6笔形束扫描治疗头pencil beam scanning nozzle在束流输运线中精确调节束流方向与剂量的终端设备。
3.7角位置偏差 angular position deviation实际机架角度与指令机架角度的偏差。
3.8机械等中心点 mechanical iso-center理论束流中心线与机架旋转轴的交叉点。
3.9照射野 irradiation field通过束流窗口的质子束流射入成像介质的曝光面大小。
4技术要求4.1图像引导系统4.1.1结构要求4.1.1.1外壳应选用轻质的铝合金材料。
4.1.1.2两侧的探测器应对称设计。
4.1.2性能指标要求4.1.2.1平板探测器最大视野应不小于 430 mm×430 mm。
4.1.2.2X 射线管最大热容量应不大于 4.3 Mhu。
4.1.2.3应具备半扇、全扇成像功能。
4.2激光定位系统4.2.1结构要求4.2.1.1外壳使用绝缘材料。
4.2.1.2便于制造且美观。
4.2.2性能指标要求4.2.2.1聚焦范围应为 1 m~4 m。
4.2.2.2在3 m 射程处的线长应大于 3 m。
4.2.2.3最大激光输出功率应小于 1 mW。
4.2.2.4波长应不小于 450 nm。
4.3伸缩地板系统4.3.1结构要求4.3.1.1地板采用聚甲醛(POM)板,强度满足使用要求,且重量较轻。
4.3.1.2基座采用碳钢加工而成,力学性能好,便于加工。
4.3.1.3支架采用空心钢管加工而成,支撑强度满足要求,重量轻。
2DB 34/T 3768—20204.3.2 4.3.2.1 4.3.2.2 性能指标要求重复定位精度应小于 2 mm 。
从打开到闭合的时间应小于 1 min 。
4.44.4.1 安全激光扫描仪结构要求4.4.1.1 4.4.1.24.4.2 4.4.2.1 4.4.2.2 4.4.2.3 外壳使用绝缘材料。
便于制造且美观。
性能指标要求在检测距离 3 m 以内,最大测量误差应不大于 100 mm 。
检测角度应不小于 270°。
角度分辨率应不大于 0.4°。
4.54.5.1 辐射剂量监测仪结构要求4.5.1.1 4.5.1.24.5.2 4.5.2.1 4.5.2.2 4.5.2.3 支撑结构轻便牢固。
密封性好。
性能指标要求测量范围为 1×102 nSv/h ~1×108 nSv/h 。
精度为±5%。
能量范围为 50keV ~7×103 keV 。
4.64.6.1 束流偏转磁铁结构要求4.6.1.1 4.6.1.24.6.2 4.6.2.1 4.6.2.2 铁芯部分选择叠压系数较好的硅钢片,线圈部分应选择导电好、散热好的无氧铜。
上下线圈对称,部件水路、电路走线便于规整。
性能指标要求最大磁场应为 1.45T 。
积分场和横向场均匀度应不小于 1×10-3T 。
4.74.7.1 笔形束扫描治疗头结构要求4.7.1.1 4.7.1.24.7.2 铁芯部分应选择叠压系数较好的硅钢片,底板部分应选用轻质的铝合金材料。
氦气室密封性良好,对霍尔探头防护措施充分。
性能指标要求4.7.2.1 扫描方式应为笔形束点扫描。
4.7.2.2 X 方向扫描速度应大于 35 m/s ,Y 方向扫描速度应大于 10 m/s 。
3DB 34/T 3768—20204.7.2.3位置精度应处于±1 mm 范围内。
4.8旋转机架4.8.1结构要求4.8.1.1便于制造,便于零部件安装、调整、修理和更换。
4.8.1.2工艺性好,机架本身的内应力小,由温度变化引起的变形应力小。
4.8.2性能指标要求4.8.2.1角位置偏差应小于0.1°。
4.8.2.2机械等中心点的最大径向偏差应小于 0.5 mm。
5放疗设备管理要求5.1常规设备5.1.1应按 GB 16362 的规定,接受有资质的第三方定期对相关放射诊疗设备进行状态性检测,检测结果应符合 GBZ 126 的要求,每年应不少于一次。
5.1.2每月应验证医用放射源衰减系数,并进行相关数据的校正。
5.1.3每天医疗前,应检查机器及其联锁装置等,待试运行正常后方可开始治疗患者,每次检测均应记录。
5.1.4建立放疗设备的档案,并记录其保养、维修、年检等信息。
5.2特殊设备5.2.1笔形束扫描治疗头5.2.1.1照射野布野范围应每次记录,建立档案。
5.2.1.2根据病灶部位和深度匹配的束流剂量、角度应每次记录,建立档案。
5.2.1.3应按 JJG 912 的规定,每年检定和校准一次电离室剂量计的精确度。
5.2.2旋转机架5.2.2.1旋转运动重复定位精度应每年检测,建立档案。
5.2.2.2机械等中心精度应每年检测,建立档案。
6放疗人员管理要求6.1上岗证制度从事肿瘤放疗工作的放疗医师、临床物理师、放疗技师应按GBZ/T 149的规定,接受岗位培训,完成培训后,持证上岗。
6.2人员资质要求6.2.1 放疗医师6.2.1.1 6.2.1.24 具有大学医学本科或以上学历。
持有《医师执业证书》,并符合地点、执业类别与执业范围的要求。
DB 34/T 3768—20206.2.1.3 在省级三甲及以上医院经过一年以上的放疗医师培训,或完成放射治疗专业住院医师规范化 培训,并取得合格证书。
6.2.1.4 6.2.1.56.2.2 6.2.2.16.2.2.26.2.2.36.2.2.46.2.3 6.2.3.16.2.3.26.2.3.36.2.3.4持有《放射人员工作证》。
持有《大型医用设备上岗合格证》或《全国医用设备使用人员业务能力考评合格证》。
临床物理师具有医学物理或相关专业大学本科或以上学历。
在省级三甲及以上医院经过半年以上的放疗物理专业培训,并取得合格证书。
持有《放射人员工作证》。
持有《大型医用设备上岗合格证》或《全国医用设备使用人员业务能力考评合格证》。
放疗技师具有放射治疗技术或相关专业大专或以上学历。
经过半年以上的放疗技师岗位培训,并取得合格证书。
持有《放射人员工作证》。
持有《大型医用设备上岗合格证》或《全国医用设备使用人员业务能力考评合格证》。
6.36.3.1 人员职责放疗医师6.3.1.1 治疗病人的临床诊断明确(应有组织病理学或细胞学证据)。
6.3.1.2 建立、完善三级医师查房制度和疑难病例讨论制度。
6.3.1.3 放疗前明确靶区范围、照射野设置的合理性及相关补偿技术、射线质及能量的选择等,应用 放射治疗计划系统(TPS)指导照射野的设计。
6.3.1.4 应在病历及放疗单中记录所用射线质及能量、患者的体位、固定装置、照射野面积、照射野界(以体表较固定的标记为准、定位时 X 线片或打印图片)、肿瘤深度、源皮距离(SSD)、百分深度剂量、机架角度、机头角度、补偿器、滤过装置、照射方式、单次剂量、总剂量及总次数、周围重要组织和器官的剂量(脊髓、肾、脑干等)。
6.3.2 6.3.2.16.3.2.26.3.2.36.3.2.46.3.2.56.3.3 6.3.3.1 临床物理师根据临床医师的处方剂量及照射范围要求,优化放射治疗计划。
核查临床医师的处方剂量。
参与特殊照射野的摆位及照射。
定期检测各放射治疗设备的技术指标。
不定时地检查放疗技师的照射野摆位及照射情况。
放疗技师每日工作前检查放射治疗机的状况,各种常用摆位辅助用品是否齐全;检查机架、治疗床是 否正常,周围有无障碍物,电子显示角度与刻度是否一致。
6.3.3.2 核对患者相关信息,查看现行照射条件、照射剂量等参数。
6.3.3.3 引导病人进入治疗室,解释照射中的注意事项,协助病人在患者摆位系统上平躺。
6.3.3.4 协助患者完成治疗流程,治疗结束后,将机器及辅助设备按要求复位,引导病人离开。
5。
