最新11章分析化学中常用的分离和富集方法全解PPT课件
合集下载
第十一章分析化学中常见的分离和富集方法_53364

(1)无机共沉淀剂
表11-6共沉淀中常用的无机载体
共沉淀方式 氢氧化物 载体 Fe(OH)3或 Al(OH)3 CuS 硫化物 吸附共沉淀 PbS 共沉淀的离子或化合物 Be2+、Ti(IV)、Zr(IV)、 Sn(IV)、Cr3+、Co2+ 、Ni2+ 、 Zn2+、Mn2+、ASO43-、PO43Pb2+、Ni2+ 、Cd2+、Ag+、Bi3+、 Zn2+、Hg2+ Cu2+、Ni2+ 、Hg2+、Cd2+、Ag+、 Bi3+、Zn2+
分离 separation
分析方法灵敏度的 局限性 满足对灵敏度 的要求 选择灵敏度高 的方法 富集 enrichment
例: 海水中 U(IV)的测定 富集为 c = 1 ~ 3 g / L c = 100 ~ 200 g / L
难以测定 可以测定
分离效果
分离富集方法简单
干扰成分减少至不再干扰 待测组分有效回收 Recovery 样品中的待测组 分含量是未知的 如何测量回收率
As Se Te Sb Sn
Hg
AsH3
AsCl3、AsBr3( Se、Te、 Sb、Sn) 单质 HgCl2
Zn+ H2SO4
HCl(HBr)+ H2SO4加热蒸馏 H2SO4+还原剂(如SnCl2)通气 浓HCl蒸干或通Cl2气入H2SO4溶液 中(>300C) HCl+HClO4煮沸
微量As的测定
例:8-羟基喹啉-CHCl3对Al 3+ 的萃取
N Al(H2O)63+ + 3 OH O N Al
分离与富集方法溶剂萃取分离法精品PPT课件
• 如果 DA 与 DB 相差不多,两种物质就难以完全分离
下叶
上叶
分离与富集方法 /溶剂萃取分离法
• 萃取体系的分类和• a。 螯合剂(应有较多的疏水基团)溶于有机相,难溶于 水相,有些也(微)溶于水相,但在水相中的溶解度依赖 于水相的组成特别是pH值(双硫腙溶于碱性水溶液)
下叶
上叶
分离与富集方法 /溶剂萃取分离法
• 烊盐是疏水的,可被有机溶剂乙醚所萃取
下叶
上叶
分离与富集方法 /溶剂萃取分离法
• 形成三元配合物的萃取体系 • 为了萃取Ag+,可使Ag+与邻二氮杂菲配合成配阳离子,
并与溴邻苯三酚红的阴离子缔合成三元配合物。在 pH 为 7 的缓冲溶液中可用硝基苯萃取之
上叶
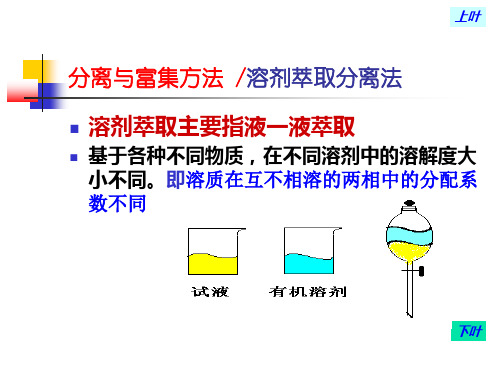
分离与富集方法 /溶剂萃取分离法 溶剂萃取主要指液一液萃取
基于各种不同物质,在不同溶剂中的溶解度大 小不同。即溶质在互不相溶的两相中的分配系 数不同
下叶
上叶
分离与富集方法 /溶剂萃取分离法
• 分配系数 分配比和萃取效率 分离因数 当溶质 A 同时接触两种互不混溶的溶剂时,例如水和一种 有机溶剂, A 就分配在这两种溶剂中:
下叶
上叶
分离与富集方法 /溶剂萃取分离法
• 有机物的萃取分离
• 相似相溶原则 • 极性有机化合物和有机化合物的盐类,通常溶解于水而不
溶于非极性有机溶剂中 • 用水从丙醇和溴丙烷的混合物中,萃取极性的丙醇 • 用弱极性的乙醚可从极性的三羟基丁烷中萃取弱极性的酯
下叶
上叶
分离与富集方法 /溶剂萃取分离法
You Know, The More Powerful You Will Be
结束语
感谢聆听
下叶
上叶
分离与富集方法 /溶剂萃取分离法
• 萃取体系的分类和• a。 螯合剂(应有较多的疏水基团)溶于有机相,难溶于 水相,有些也(微)溶于水相,但在水相中的溶解度依赖 于水相的组成特别是pH值(双硫腙溶于碱性水溶液)
下叶
上叶
分离与富集方法 /溶剂萃取分离法
• 烊盐是疏水的,可被有机溶剂乙醚所萃取
下叶
上叶
分离与富集方法 /溶剂萃取分离法
• 形成三元配合物的萃取体系 • 为了萃取Ag+,可使Ag+与邻二氮杂菲配合成配阳离子,
并与溴邻苯三酚红的阴离子缔合成三元配合物。在 pH 为 7 的缓冲溶液中可用硝基苯萃取之
上叶
分离与富集方法 /溶剂萃取分离法 溶剂萃取主要指液一液萃取
基于各种不同物质,在不同溶剂中的溶解度大 小不同。即溶质在互不相溶的两相中的分配系 数不同
下叶
上叶
分离与富集方法 /溶剂萃取分离法
• 分配系数 分配比和萃取效率 分离因数 当溶质 A 同时接触两种互不混溶的溶剂时,例如水和一种 有机溶剂, A 就分配在这两种溶剂中:
下叶
上叶
分离与富集方法 /溶剂萃取分离法
• 有机物的萃取分离
• 相似相溶原则 • 极性有机化合物和有机化合物的盐类,通常溶解于水而不
溶于非极性有机溶剂中 • 用水从丙醇和溴丙烷的混合物中,萃取极性的丙醇 • 用弱极性的乙醚可从极性的三羟基丁烷中萃取弱极性的酯
下叶
上叶
分离与富集方法 /溶剂萃取分离法
You Know, The More Powerful You Will Be
结束语
感谢聆听
第十一章常用的分离和富集方法

那么,是否什么都要分离富集呢?
NO !
沾污、损失、时间、费用等问题。
二、常用分离方法
1 沉淀分离法 传统分离方法,采用沉淀剂;液-固分离。 2 溶剂萃取分离法 被分离物质由一液相转入互不相溶的另 一液相的过程;液-液两相;互不相溶。 水相——有机相
3.离子交换分离法 通过带电荷溶质与固体离子交换剂中可交 换的离子进行反复多次交换而达到分离。
第十一章 常用的分离和富集方法
第一节 概述 第二节 沉淀分离法(自学) 第三节 溶剂萃取分离法 第四节 离子交换分离法 第五节 液相色谱分离法
第一节 概述
问题的提出
实际样品的复杂性 干扰的消除 控制实验条件 使用掩蔽剂 分离 separation 分析方法灵敏度的 局限性 例: 富集为 满足对灵敏 度的要求 选择灵敏度高 的方法 富集 enrichment 海水中 U (IV) 的测定 C = 1 ~ 3 g / L C = 100 ~ 200 g / L 难以测定 可以测定
分离效果 干扰成分减少至不再干扰 待测组分有效回收
分离后测量值 回收率(%) 100% 原始含量
质量分数 > 1%, 质量分数 0.01% ~1% 质量分数 < 0.01 %, 回收率 > 99.9 % 以上 回收率 > 99 % 回收率 > 95 % 或更低
1、分离在定量分析中的作用
1 将被测组分从复杂体系中分离出来后测定 2 把对测定有干扰的组分分离除去 3 将性质相近的组分相互分开 4 把微量或痕量的待测组分通过分离达到 富集的目的 分离前的体系:均相; 分离体系总是两相:液-液;液-固;气-液;
4.色谱分离方法 利用组分在不相混溶的两相中分配的差异进 行分离的方法。 柱色层;纸色层;薄层色层;
第11章复杂物质的分离与富集PPT课件

混晶共沉淀
表 8-6 共沉淀中常用的无机载体
载体
共沉淀的离子或化合物
备注
氢氧化物 硫化物
Fe(OH)3 或 Al(OH)3
CuS
Be2+、Ti( IV)、 Zr( IV)、 Sn( IV)、 Cr3+、 Co2+ 、 Ni2+ 、 Zn2+ 、 Mn2+、 ASO43-、PO43Pb2+、Ni2+ 、Cd2+、Ag+、Bi3+、Zn2+、 Hg2+
cO
(mO - m1)/ VO
D = ——— = ————————————
cW
m1/ VW
VW
m1 = mO • ———————— (0.63g,93.7%)
D VO + VW
• 若用VO (20mL)溶剂萃取n(n=3)次,水相中剩余被萃取物为 mn (g),则:
mn = mO •[ VW /(D VO + VW)]n (8-7)(0.0024g,99.98%)
LaF3
Hg2+ Ra2+ 、Sr2+、Pb2+ Cd2+ AsO43Th(IV)
(2)有机共沉淀剂
共沉淀方式 离子缔合物
惰性共沉淀
胶体的凝聚
表 8-6 共沉淀中常用的有机载体
载体
共沉淀的离子或化合物
甲基紫(甲基橙、结晶紫、酚酞) Zn2+、Co2+ 、Hg2+、Cd2+、Mo(VI)
的 NH4SCN 溶液 二苯硫腙+酚酞
在稀溶液中可以用浓度代替活度。表示为
[A]O
KD = ———————
表 8-6 共沉淀中常用的无机载体
载体
共沉淀的离子或化合物
备注
氢氧化物 硫化物
Fe(OH)3 或 Al(OH)3
CuS
Be2+、Ti( IV)、 Zr( IV)、 Sn( IV)、 Cr3+、 Co2+ 、 Ni2+ 、 Zn2+ 、 Mn2+、 ASO43-、PO43Pb2+、Ni2+ 、Cd2+、Ag+、Bi3+、Zn2+、 Hg2+
cO
(mO - m1)/ VO
D = ——— = ————————————
cW
m1/ VW
VW
m1 = mO • ———————— (0.63g,93.7%)
D VO + VW
• 若用VO (20mL)溶剂萃取n(n=3)次,水相中剩余被萃取物为 mn (g),则:
mn = mO •[ VW /(D VO + VW)]n (8-7)(0.0024g,99.98%)
LaF3
Hg2+ Ra2+ 、Sr2+、Pb2+ Cd2+ AsO43Th(IV)
(2)有机共沉淀剂
共沉淀方式 离子缔合物
惰性共沉淀
胶体的凝聚
表 8-6 共沉淀中常用的有机载体
载体
共沉淀的离子或化合物
甲基紫(甲基橙、结晶紫、酚酞) Zn2+、Co2+ 、Hg2+、Cd2+、Mo(VI)
的 NH4SCN 溶液 二苯硫腙+酚酞
在稀溶液中可以用浓度代替活度。表示为
[A]O
KD = ———————
第十一章 常用的分离和富集方法PPT课件

3. 利 用 氧 化 还 原 反 应 ,改 变 离 子 存 在 状 态
Fe3+
NaOH
C r3+
H2O2
F e(O H )3↓ C rO42-
究竟萃取分离法分为几类呢?
10
§11-3 溶剂萃取分离法
一 萃取分离法分为固---液、气----液和液----液萃取法。 液----液萃取法亦称溶剂萃取法。待测组分如何被萃取呢?
固相萃取 有机沉淀剂:H2C2O4,丁二酮肟
离子交换分离
阳离子交换树脂 阴离子交换树脂
离
气液分离:挥发和蒸馏
克氏定氮法,Cl2预氧化I-法 螯合物萃取
方 液液分离
萃取分离
离子缔合物萃取 三元络合物萃取 支撑型液膜
法
液膜分离 乳状液型液膜 生物膜
气固分离-超临界流体萃取
其他分离方法:萃淋树脂、螯合树脂、浮选、色谱分离法
第十一章 常用的分离和富集方法
§11-1 概述 §11-2 沉淀分离法 §11-3 溶剂萃取分离法 §11-4 离子交换分离法 §11-5 液相色谱分离法
1
标题添加
点击此处输入相 关文本内容
前言
点击此处输入 相关文本内容
标题添加
点击此处输入相 关文本内容
点击此处输入 相关文本内容
• 教学内容:回收率、分离因素、分配系数、分配比、
例1 在pH=7.0时, 以8-羟基喹啉(Oxine)氯仿溶液从(Oxine) 水溶液中萃取 已知: D=43, c(La3+)W=1.00mg/mL, VW=3+。
1. VOxine=10.0mL
14
必 须 指出 , 同 量萃 取 剂 分n次 比 一次 萃 取 的效 率 高 , 但多次萃取却增加了工作量及引起误差。
Fe3+
NaOH
C r3+
H2O2
F e(O H )3↓ C rO42-
究竟萃取分离法分为几类呢?
10
§11-3 溶剂萃取分离法
一 萃取分离法分为固---液、气----液和液----液萃取法。 液----液萃取法亦称溶剂萃取法。待测组分如何被萃取呢?
固相萃取 有机沉淀剂:H2C2O4,丁二酮肟
离子交换分离
阳离子交换树脂 阴离子交换树脂
离
气液分离:挥发和蒸馏
克氏定氮法,Cl2预氧化I-法 螯合物萃取
方 液液分离
萃取分离
离子缔合物萃取 三元络合物萃取 支撑型液膜
法
液膜分离 乳状液型液膜 生物膜
气固分离-超临界流体萃取
其他分离方法:萃淋树脂、螯合树脂、浮选、色谱分离法
第十一章 常用的分离和富集方法
§11-1 概述 §11-2 沉淀分离法 §11-3 溶剂萃取分离法 §11-4 离子交换分离法 §11-5 液相色谱分离法
1
标题添加
点击此处输入相 关文本内容
前言
点击此处输入 相关文本内容
标题添加
点击此处输入相 关文本内容
点击此处输入 相关文本内容
• 教学内容:回收率、分离因素、分配系数、分配比、
例1 在pH=7.0时, 以8-羟基喹啉(Oxine)氯仿溶液从(Oxine) 水溶液中萃取 已知: D=43, c(La3+)W=1.00mg/mL, VW=3+。
1. VOxine=10.0mL
14
必 须 指出 , 同 量萃 取 剂 分n次 比 一次 萃 取 的效 率 高 , 但多次萃取却增加了工作量及引起误差。
第十一章分离和富集53页PPT

2019/10/9
相对比移值Rf
斑点中心移动距离 R f 溶剂前缘移动距离
Rf值与溶质在固定相 和流动相间的分配系数有 关。在一定条件下,某组 分的Rf值一定。可以进行 定性鉴定。
简单、方便,在药物、染料等的分析方面较多应用。
2019/10/9
13.3.2 薄层色谱法
比纸色谱具有速度快、分离清晰、灵敏度高、可以采 用各种方法显色等特点。
§11-2 沉淀分离法
13.1.1 无机沉淀剂沉淀分离法
1. 氢氧化物沉淀分离法
沉淀剂: NaOH: 可控制pH≥12。常用于两性金属离子和非
两性金属离子的分离。 NH4OH: 可以将pH控制在9左右,常用来沉淀不与
NH3 形成配离子的许多种金属离子。 影响因素:
溶液pH ,共沉淀(该法选择性较差, 非晶形沉淀)
3. 利用有机共沉淀剂进行共沉淀分离
作用机理与无机共沉淀剂不同:形成固溶体。
有机大分子物质;选择性较好;可藉灼烧而除去。
2019/10/9
§13.2 溶剂萃取分离法
13.2.1 基本参数
1、萃取分离法
是基于各物质间在不同溶剂中,分配系数的大小不 同而实现分离的方法。 本质:(1)相似相溶规则。
(2)分子结构中有亲水性、增水性基团。
2019/10/9
2. 形成离子缔合物的萃取体系
属于这一类的是带不同电荷的离子,互相缔合成疏 水性的中性分子,而被有机溶剂所萃取。 例:用乙醚从HCl溶液中萃取Fe3+时:
该类萃取体系中,溶剂分子既是溶剂又是萃取剂。
2019/10/9
再如:UO22+ + H2O = [UO2(H2O)6]2+ [UO2(H2O)6]2+ + TBP → [ UO2(TBP)6 ]2+ [ UO2(TBP)6 ]2+ + NO3- → UO2(TBP)6(NO3)2
相对比移值Rf
斑点中心移动距离 R f 溶剂前缘移动距离
Rf值与溶质在固定相 和流动相间的分配系数有 关。在一定条件下,某组 分的Rf值一定。可以进行 定性鉴定。
简单、方便,在药物、染料等的分析方面较多应用。
2019/10/9
13.3.2 薄层色谱法
比纸色谱具有速度快、分离清晰、灵敏度高、可以采 用各种方法显色等特点。
§11-2 沉淀分离法
13.1.1 无机沉淀剂沉淀分离法
1. 氢氧化物沉淀分离法
沉淀剂: NaOH: 可控制pH≥12。常用于两性金属离子和非
两性金属离子的分离。 NH4OH: 可以将pH控制在9左右,常用来沉淀不与
NH3 形成配离子的许多种金属离子。 影响因素:
溶液pH ,共沉淀(该法选择性较差, 非晶形沉淀)
3. 利用有机共沉淀剂进行共沉淀分离
作用机理与无机共沉淀剂不同:形成固溶体。
有机大分子物质;选择性较好;可藉灼烧而除去。
2019/10/9
§13.2 溶剂萃取分离法
13.2.1 基本参数
1、萃取分离法
是基于各物质间在不同溶剂中,分配系数的大小不 同而实现分离的方法。 本质:(1)相似相溶规则。
(2)分子结构中有亲水性、增水性基团。
2019/10/9
2. 形成离子缔合物的萃取体系
属于这一类的是带不同电荷的离子,互相缔合成疏 水性的中性分子,而被有机溶剂所萃取。 例:用乙醚从HCl溶液中萃取Fe3+时:
该类萃取体系中,溶剂分子既是溶剂又是萃取剂。
2019/10/9
再如:UO22+ + H2O = [UO2(H2O)6]2+ [UO2(H2O)6]2+ + TBP → [ UO2(TBP)6 ]2+ [ UO2(TBP)6 ]2+ + NO3- → UO2(TBP)6(NO3)2
常用分离与富集方法课件

05 膜分离法
纳滤
总结词
纳滤是一种介于反渗透和超滤之间的膜分离技术,主要用于分离分子量在1001000Dalton之间的物质。
详细描述
纳滤膜具有高孔隙率和高通量,允许溶剂和小分子通过,而阻止大分子和离子通 过。这种分离方法广泛应用于制药、生物工程、食品和饮料、海水淡化等领域。
超滤
总结词
超滤是一种以压力为驱动力的膜分离 过程,主要用于分离分子量在1000100000Dalton之间的物质。
常用分离与富集方法课件
• 分离与富集方法概述 • 沉淀分离法 • 萃取分离法 • 吸附分离法 • 膜分离法 • 其他分离方法
01 分离与富集方法 概述
定义与分类
定义
分离与富集方法是指将待测组分 从样品中分离出来并进行富集的 过程,以提高待测组分的浓度, 满足检测要求。
分类
根据分离原理和富集方法的不同, 可以将分离与富集方法分为沉淀 法、萃取法、蒸馏法、色谱法等。
详细描述
超滤膜的孔径大小介于微滤和纳滤之 间,能够去除悬浮物、细菌、病毒等 大分子物质,常用于制备超纯水和超 纯化学试剂。
反渗透
总结词
反渗透是一种以压力为驱动力的膜分 离过程,主要用于分离水中的离子、 有机物和微生物。
详细描述
反渗透膜具有非常高的孔隙率和截留 率,几乎可以完全去除水中的溶解盐、 有机物、细菌和病毒等杂质,广泛应 用于海水淡化、工业废水处理和超纯 水制备等领域。
色谱分离法是一种经典的分离技术,它利用不同物质在固定相和流动相之间的分配系数差异,使不同 物质在色谱柱中滞留时间不同从而实现分离。该方法具有分离效率高、操作灵活、应用广泛等优点, 常用于分离各种有机物和无机物。
泡沫分离法
最新11章分析化学中常用的分离和富集方法全解PPT课件

E与D的关系:
E coVo D 100% coVo cwVw DVw Vo
D越大→ E越高
D一定,
Vw Vo
→E增大当D不高时,常采源自多次连续萃取的方法提高ECa2+,Sr2+,Ba2+,Th(Ⅳ)… 离
C2O42
MC2O4↓而与Al3+,Fe3+…等分
Al3+ 草酸
Al3+
Ba2+
BaC2O4↓
8-羟基喹啉 沉淀Al3+,Fe3+等
铜试剂(二乙基胺二硫代甲酸钠,简称DDTC):用于沉淀除去 重金属离子而与Al3+,碱土金属,稀土等分离。
二、痕量组分的共沉淀分离和富集
11章分析化学中常用的分离 和富集方法全解
§1 概述
海水中铀含量1-2μg[U(Ⅵ)]·L-1,不易测量,若把1L海水中的U (Ⅵ)处理到5mL溶液中,等于将U (Ⅵ)溶液富集,浓度提高了200 倍,便可准确测定。 1、对分离的要求: ①干扰组分减少至不再干扰被测组分的测定 ②被测组分的损失小至忽略不计
(1)表面吸附共沉淀
采用了颗粒较小的无定形或凝乳状↓为共沉淀剂,如 M(OH)n↓ MSn↓。如以Fe(OH)3↓为载体,吸附富集工业废水中的UO22+, Al3+,Sn4+,Bi3+等
(2)混晶共沉淀 选择性高 如BaSO4-PbSO4 MgNH4PO4-MgNH4AsO4等 2、有机共沉淀剂(应用广) 优点:选择性高,沉淀溶解度小、纯净、易灼烧除去 (1)利用胶体的凝聚作用 如分离微量H2WO4 HNO3介质中, H2WO4以带负电荷的胶体粒子存在,不易凝聚, 加入共沉淀剂辛可宁,可使H2WO4定量共沉淀 常用的共沉淀剂:辛可宁,丹宁,动物胶等 (2)利用形成离子缔合物
11的分离与富集方法课件

螯合物萃取 chelate extraction
生成螯合物的萃取
2 CH3 C N OH + Ni2+ CH3 C N OH
H
O
O
CH3 CH3
CN CN
Ni
N C CH3 N C CH3
+ 2 H+
OH O
被三氯甲烷萃取
萃取平衡 用 HL 萃取金属离子 M,有如下平衡
o HL(o)
KD(HL)
w HL(w) Ka
萃取分离 萃取富集 萃取分光光度法
例:Ni2+ 的丁二酮肟(三氯甲烷)分光光度法测定
11.3.2 溶剂萃取新技术
液相微萃取 (liquid phase microextraction, LPME)
1996年Cantwell:液相微萃取法(LPME) ——新的样品 前处理方法。
最初提出的LPME形式是微液(MD) - 液相微萃取 法(MD - LPME) ,MD-LPME避免了SPME使用中存在 的残留量的问题,有机接收相溶液的变换更是提高了 方法的选择性,但MD - LPME也存在一些问题。1999 年Pedersen-Bjergaard等提出了LPME技术的另一种形 式, 就是中空纤维膜- 液相微萃取法(HF-LPME) 。
hydrophilic 亲水性 离子型化合物
物质
相互转换
极性
hydrophobic 疏水性 萃取分离的实质
共价键化合物
弱极性或非极性
将待萃取组分由亲水性转化为疏水性,使其萃入有机相中。
例,8-羟基喹啉-CHCl3对Al 3+ 的萃取 反萃取 Back extraction
萃取的反过程(将组分从有机溶液中萃取到水溶液中)
常用的分离和富集方法幻灯片PPT

常用的别离和富集方法幻 灯片PPT
本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢!
第32讲
第十一章 常用的别离和富集方法 第一讲
〔三〕利用惰性共沉淀剂
参加一种裁体直接与被共沉淀物质形 成固溶体而沉淀下来。例如痕量的Ni2+与 丁二酮肟镍螯合物分散在溶液中,不生成 沉淀,参加丁二酮肟二烷酯的酒精溶液时, 那么析出丁二酮肟二烷酯,丁二酮肟镍便 被共沉淀下来。这里裁体与丁二酮肟及螯 合物不发生反响,实质上是“固体苯取〞 作用,那么丁二酮肟二烷酯称为“惰性共 沉淀剂〞。
Zn2+ + SCN- =Zn(SCN)42-
2R+ + Zn(SCN)42+ =R2Zn(SCN)4〔形成 缔合物〕
生成的R2Zn(SCN)4便与RSCN共同沉淀下来。沉 淀经过洗涤、灰化之后,即可将痕量的Zn2+富集在 沉淀之中,用酸溶解之后即可进展锌的测定。
第32 讲
第十一章 常用的别离和富集方法 第一讲
如果在别离时,是为了将物质与物质别离开来。那么
希望两者别离得越完全越好,其别离效果可用别离因数
SB/A表示。院
SB/A=RB/RA
式中: SB/A表示别离的完全程度。在别离过程中,SB/A 越小,别离效果越好。对常量组分的分析,一般要求 SB/A≤10-3;对痕量组分的分析,一般要求SB/A=10-6左 右。
第32 讲
第十一章 常用的别离和富集方法 第一讲
11-3 溶剂萃取别离法
萃取别离法包括液相-液相、固相-液相 和气相-液相等几种方法,但应用最广泛的为 液-液萃取别离法(亦称溶剂萃取别离法)。该 法常用一种与水不相溶的有机溶剂与试液一 起混合振荡,然后搁置分层,这时便有一种 或几种组分转入有机相中,而另一些组分那
本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢!
第32讲
第十一章 常用的别离和富集方法 第一讲
〔三〕利用惰性共沉淀剂
参加一种裁体直接与被共沉淀物质形 成固溶体而沉淀下来。例如痕量的Ni2+与 丁二酮肟镍螯合物分散在溶液中,不生成 沉淀,参加丁二酮肟二烷酯的酒精溶液时, 那么析出丁二酮肟二烷酯,丁二酮肟镍便 被共沉淀下来。这里裁体与丁二酮肟及螯 合物不发生反响,实质上是“固体苯取〞 作用,那么丁二酮肟二烷酯称为“惰性共 沉淀剂〞。
Zn2+ + SCN- =Zn(SCN)42-
2R+ + Zn(SCN)42+ =R2Zn(SCN)4〔形成 缔合物〕
生成的R2Zn(SCN)4便与RSCN共同沉淀下来。沉 淀经过洗涤、灰化之后,即可将痕量的Zn2+富集在 沉淀之中,用酸溶解之后即可进展锌的测定。
第32 讲
第十一章 常用的别离和富集方法 第一讲
如果在别离时,是为了将物质与物质别离开来。那么
希望两者别离得越完全越好,其别离效果可用别离因数
SB/A表示。院
SB/A=RB/RA
式中: SB/A表示别离的完全程度。在别离过程中,SB/A 越小,别离效果越好。对常量组分的分析,一般要求 SB/A≤10-3;对痕量组分的分析,一般要求SB/A=10-6左 右。
第32 讲
第十一章 常用的别离和富集方法 第一讲
11-3 溶剂萃取别离法
萃取别离法包括液相-液相、固相-液相 和气相-液相等几种方法,但应用最广泛的为 液-液萃取别离法(亦称溶剂萃取别离法)。该 法常用一种与水不相溶的有机溶剂与试液一 起混合振荡,然后搁置分层,这时便有一种 或几种组分转入有机相中,而另一些组分那
分离和富集方法PPT课件

m1
=
m0(
Vw DVo +
Vw
)
二次萃取后
m2
=
m1(
Vw DVo +
Vw
)=
m
0(
Vw DVo +
Vw
)2
n次萃取后
mn
=
m 0(
Vw DVo +
Vw
)n
E
=
m
0
-m m0
n
×100%
=
1
-
(
Vw DVo +
Vw
)n×100%
第十六页,共46页。
例: 含有镓的HCl水溶液10mL,其中含镓10g,若用10mL乙醚分别按下 述情况萃取:(1)全量一次萃取。(2)每次用5mL分2次萃取。求 E%. 已知 D=18
少克?
(c)若将20.00mL有机溶剂分3次萃取,其E又是多少?
解:
(a)
CI2(O)
=
18.50×0.1000×20.00 2×2.00×20.00
=
0.4625mol/L
2.648 CI2(w) =(253.8 - 0.4625×0.02000)/0.1000 = 0.01183mol/L
D
=
CI2(O) CI2(w)
如:分离痕量Zn2+ ,在酸性溶液中加入大量的SCN-及甲基紫R+
Zn 2
4SCN
Zn(SCN
)
2 4
2R
Zn(
SCN
)
2 4
R2Zn(SCN )4
R SCN RSCN
(载体)
量少
大量
③ 利用“惰性共沉淀剂”进行共沉淀;(固体萃取剂)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
回收1 率 .7 = 10 % 08= % 5 0.210
挥发和蒸馏分离法: 利用物质的挥发性的差异进行分离的方法
选择性较高,可除去干扰离子或使被测组分定量分出后再测定。 一些元素的挥发测定方法见P341表11-1
2、沉淀为硫化物 主要用于分离某些重金属离子 沉淀剂:硫代乙酰胺(TAA) H+ 中→H2S;NH3 中→(NH4)2S;OH-中→S2-
(1)表面吸附共沉淀
采用了颗粒较小的无定形或凝乳状↓为共沉淀剂,如 M(OH)n↓ MSn↓。如以Fe(OH)3↓为载体,吸附富集工业废水中的UO22+, Al3+,Sn4+,Bi3+等
(2)混晶共沉淀 选择性高 如BaSO4-PbSO4 MgNH4PO4-MgNH4AsO4等 2、有机共沉淀剂(应用广) 优点:选择性高,沉淀溶解度小、纯净、易灼烧除去 (1)利用胶体的凝聚作用 如分离微量H2WO4 HNO3介质中, H2WO4以带负电荷的胶体粒子存在,不易凝聚, 加入共沉淀剂辛可宁,可使H2WO4定量共沉淀 常用的共沉淀剂:辛可宁,丹宁,动物胶等 (2)利用形成离子缔合物
特点:设备简单,分离效果好,应用广泛; 费时,有机溶剂污染环境
一、萃取分离的基本原理 1、萃取过程的本质:将物质由亲水性转化为疏水性的过程 亲水性:离子型化合物,易溶于水,难溶于有机溶剂,形成 水合离子。如无机离子(含亲水基团-OH,-SO3H,-NH2…的 物质)
疏水性:共价化合物,难溶于水,易溶于有机溶剂。如许多 有机化合物,酚酞,油脂等(含疏水基团-CH3,-C2H5,苯基等)
2、 回收率 分原 = 离A 来 后 的A 测 的 量得 量 1的 0% 0 常量组分(>1%)回收率应>99.9% 微量组分(0.01%-1%)回收率应>99% 痕量组分(<0.01%)回收率应90%-95%或更低
例:PbS作共沉淀载体,富集海水中的Au(Au 0.2μg·L-1 10L) 富集后的Au为1.7 μg,回收率?
a. 仅适用于稀溶液 b. 溶质在萃取过程中只存在一 种型体
如用CCl4萃取I2(无副反应)
(2)分配比 D
D co cw
对符合分配定律的体系:
以Ni2+为例,说明萃取过程:
Ni2++丁二酮肟 pH=8-9NH3-NH4Cl 丁二酮肟-Ni
反萃取:将有机相中的物质再转入水相
可被CHCl3萃取
丁二酮肟-Ni(CHCl3中)0.5-1mol·L-1HCl Ni2+
2、分配系数和分配比
(1)分配系数:KD
A水 ⇌ A有
分配定律——
KD
[A]o [A]w
3、其它无机沉淀剂
H2SO4,H3PO4,HF 或 NH4F,HCl
4、利用有机沉淀剂分离
优点:沉淀吸附无机杂质少,选择性高,过量沉淀剂易灼烧除去,
也用于重量分析
Ca2+,Sr2+,Ba2+,Th(Ⅳ)… 离
C2O42
MC2O4↓而与Al3+,Fe3+…等分
Al3+ 草酸
Al3+
Ba2+
BaC2O4↓
长 的 时 间 隧 道,袅
分析化学中常用的分离和富集方法全
§1 概述
海水中铀含量1-2μg[U(Ⅵ)]·L-1,不易测量,若把1L海水中的U (Ⅵ)处理到5mL溶液中,等于将U (Ⅵ)溶液富集,浓度提高了200 倍,便可准确测定。 1、对分离的要求: ①干扰组分减少至不再干扰被测组分的测定 ②被测组分的损失小至忽略不计
罗丹明阳离子 R h C B 2 4 d (R I ) h 2 C B 2 4 d I
(3)利用“固体萃取剂”
Ni2+ + 丁二酮肟→丁二酮肟镍 丁二酮肟二烷酯乙醇溶液
பைடு நூலகம்
(水)
(浓度小,不沉淀)
丁二酮肟二烷酯↓ 丁二酮肟镍↓
为惰性载体,它不与Ni2+及丁二酮肟镍反应
§4 萃取分离法
利用溶质在两种互不混溶的溶剂间分配性质的不同而 进行分离的方法
8-羟基喹啉 沉淀Al3+,Fe3+等
铜试剂(二乙基胺二硫代甲酸钠,简称DDTC):用于沉淀除去 重金属离子而与Al3+,碱土金属,稀土等分离。
二、痕量组分的共沉淀分离和富集
加入某种离子及沉淀剂→沉淀(作载体)→使痕量组分 定量↓→沉淀与母液分离后→溶解在少量溶剂中,以达 到分离和富集的目的。
如:测水中Pb2+,测定自来水中Pb2+时,通常向水中加入大量 Na2CO3,其目的是什么? 利用生成的CaCO3来共沉淀分离富集Pb2+,加入大量 Na2CO3→CaCO3↓微量PbCO3同时共沉淀,再溶于少量酸中 1、无机共沉淀剂
进 入 夏 天 ,少 不了一 个热字 当头, 电扇空 调陆续 登场, 每逢此 时,总 会想起 那 一 把 蒲 扇 。蒲扇 ,是记 忆中的 农村, 夏季经 常用的 一件物 品。 记 忆 中 的故 乡 , 每 逢 进 入夏天 ,集市 上最常 见的便 是蒲扇 、凉席 ,不论 男女老 少,个 个手持 一 把 , 忽 闪 忽闪个 不停, 嘴里叨 叨着“ 怎么这 么热” ,于是 三五成 群,聚 在大树 下 , 或 站 着 ,或随 即坐在 石头上 ,手持 那把扇 子,边 唠嗑边 乘凉。 孩子们 却在周 围 跑 跑 跳 跳 ,热得 满头大 汗,不 时听到 “强子 ,别跑 了,快 来我给 你扇扇 ”。孩 子 们 才 不 听 这一套 ,跑个 没完, 直到累 气喘吁 吁,这 才一跑 一踮地 围过了 ,这时 母 亲总是 ,好似 生气的 样子, 边扇边 训,“ 你看热 的,跑 什么? ”此时 这把蒲 扇, 是 那 么 凉 快 ,那么 的温馨 幸福, 有母亲 的味道 ! 蒲 扇 是 中 国传 统工艺 品,在 我 国 已 有 三 千年多 年的历 史。取 材于棕 榈树, 制作简 单,方 便携带 ,且蒲 扇的表 面 光 滑 , 因 而,古 人常会 在上面 作画。 古有棕 扇、葵 扇、蒲 扇、蕉 扇诸名 ,实即 今 日 的 蒲 扇 ,江浙 称之为 芭蕉扇 。六七 十年代 ,人们 最常用 的就是 这种, 似圆非 圆 , 轻 巧 又 便宜的 蒲扇。 蒲 扇 流 传 至今, 我的记 忆中, 它跨越 了半个 世纪, 也 走 过 了 我 们的半 个人生 的轨迹 ,携带 着特有 的念想 ,一年 年,一 天天, 流向长
挥发和蒸馏分离法: 利用物质的挥发性的差异进行分离的方法
选择性较高,可除去干扰离子或使被测组分定量分出后再测定。 一些元素的挥发测定方法见P341表11-1
2、沉淀为硫化物 主要用于分离某些重金属离子 沉淀剂:硫代乙酰胺(TAA) H+ 中→H2S;NH3 中→(NH4)2S;OH-中→S2-
(1)表面吸附共沉淀
采用了颗粒较小的无定形或凝乳状↓为共沉淀剂,如 M(OH)n↓ MSn↓。如以Fe(OH)3↓为载体,吸附富集工业废水中的UO22+, Al3+,Sn4+,Bi3+等
(2)混晶共沉淀 选择性高 如BaSO4-PbSO4 MgNH4PO4-MgNH4AsO4等 2、有机共沉淀剂(应用广) 优点:选择性高,沉淀溶解度小、纯净、易灼烧除去 (1)利用胶体的凝聚作用 如分离微量H2WO4 HNO3介质中, H2WO4以带负电荷的胶体粒子存在,不易凝聚, 加入共沉淀剂辛可宁,可使H2WO4定量共沉淀 常用的共沉淀剂:辛可宁,丹宁,动物胶等 (2)利用形成离子缔合物
特点:设备简单,分离效果好,应用广泛; 费时,有机溶剂污染环境
一、萃取分离的基本原理 1、萃取过程的本质:将物质由亲水性转化为疏水性的过程 亲水性:离子型化合物,易溶于水,难溶于有机溶剂,形成 水合离子。如无机离子(含亲水基团-OH,-SO3H,-NH2…的 物质)
疏水性:共价化合物,难溶于水,易溶于有机溶剂。如许多 有机化合物,酚酞,油脂等(含疏水基团-CH3,-C2H5,苯基等)
2、 回收率 分原 = 离A 来 后 的A 测 的 量得 量 1的 0% 0 常量组分(>1%)回收率应>99.9% 微量组分(0.01%-1%)回收率应>99% 痕量组分(<0.01%)回收率应90%-95%或更低
例:PbS作共沉淀载体,富集海水中的Au(Au 0.2μg·L-1 10L) 富集后的Au为1.7 μg,回收率?
a. 仅适用于稀溶液 b. 溶质在萃取过程中只存在一 种型体
如用CCl4萃取I2(无副反应)
(2)分配比 D
D co cw
对符合分配定律的体系:
以Ni2+为例,说明萃取过程:
Ni2++丁二酮肟 pH=8-9NH3-NH4Cl 丁二酮肟-Ni
反萃取:将有机相中的物质再转入水相
可被CHCl3萃取
丁二酮肟-Ni(CHCl3中)0.5-1mol·L-1HCl Ni2+
2、分配系数和分配比
(1)分配系数:KD
A水 ⇌ A有
分配定律——
KD
[A]o [A]w
3、其它无机沉淀剂
H2SO4,H3PO4,HF 或 NH4F,HCl
4、利用有机沉淀剂分离
优点:沉淀吸附无机杂质少,选择性高,过量沉淀剂易灼烧除去,
也用于重量分析
Ca2+,Sr2+,Ba2+,Th(Ⅳ)… 离
C2O42
MC2O4↓而与Al3+,Fe3+…等分
Al3+ 草酸
Al3+
Ba2+
BaC2O4↓
长 的 时 间 隧 道,袅
分析化学中常用的分离和富集方法全
§1 概述
海水中铀含量1-2μg[U(Ⅵ)]·L-1,不易测量,若把1L海水中的U (Ⅵ)处理到5mL溶液中,等于将U (Ⅵ)溶液富集,浓度提高了200 倍,便可准确测定。 1、对分离的要求: ①干扰组分减少至不再干扰被测组分的测定 ②被测组分的损失小至忽略不计
罗丹明阳离子 R h C B 2 4 d (R I ) h 2 C B 2 4 d I
(3)利用“固体萃取剂”
Ni2+ + 丁二酮肟→丁二酮肟镍 丁二酮肟二烷酯乙醇溶液
பைடு நூலகம்
(水)
(浓度小,不沉淀)
丁二酮肟二烷酯↓ 丁二酮肟镍↓
为惰性载体,它不与Ni2+及丁二酮肟镍反应
§4 萃取分离法
利用溶质在两种互不混溶的溶剂间分配性质的不同而 进行分离的方法
8-羟基喹啉 沉淀Al3+,Fe3+等
铜试剂(二乙基胺二硫代甲酸钠,简称DDTC):用于沉淀除去 重金属离子而与Al3+,碱土金属,稀土等分离。
二、痕量组分的共沉淀分离和富集
加入某种离子及沉淀剂→沉淀(作载体)→使痕量组分 定量↓→沉淀与母液分离后→溶解在少量溶剂中,以达 到分离和富集的目的。
如:测水中Pb2+,测定自来水中Pb2+时,通常向水中加入大量 Na2CO3,其目的是什么? 利用生成的CaCO3来共沉淀分离富集Pb2+,加入大量 Na2CO3→CaCO3↓微量PbCO3同时共沉淀,再溶于少量酸中 1、无机共沉淀剂
进 入 夏 天 ,少 不了一 个热字 当头, 电扇空 调陆续 登场, 每逢此 时,总 会想起 那 一 把 蒲 扇 。蒲扇 ,是记 忆中的 农村, 夏季经 常用的 一件物 品。 记 忆 中 的故 乡 , 每 逢 进 入夏天 ,集市 上最常 见的便 是蒲扇 、凉席 ,不论 男女老 少,个 个手持 一 把 , 忽 闪 忽闪个 不停, 嘴里叨 叨着“ 怎么这 么热” ,于是 三五成 群,聚 在大树 下 , 或 站 着 ,或随 即坐在 石头上 ,手持 那把扇 子,边 唠嗑边 乘凉。 孩子们 却在周 围 跑 跑 跳 跳 ,热得 满头大 汗,不 时听到 “强子 ,别跑 了,快 来我给 你扇扇 ”。孩 子 们 才 不 听 这一套 ,跑个 没完, 直到累 气喘吁 吁,这 才一跑 一踮地 围过了 ,这时 母 亲总是 ,好似 生气的 样子, 边扇边 训,“ 你看热 的,跑 什么? ”此时 这把蒲 扇, 是 那 么 凉 快 ,那么 的温馨 幸福, 有母亲 的味道 ! 蒲 扇 是 中 国传 统工艺 品,在 我 国 已 有 三 千年多 年的历 史。取 材于棕 榈树, 制作简 单,方 便携带 ,且蒲 扇的表 面 光 滑 , 因 而,古 人常会 在上面 作画。 古有棕 扇、葵 扇、蒲 扇、蕉 扇诸名 ,实即 今 日 的 蒲 扇 ,江浙 称之为 芭蕉扇 。六七 十年代 ,人们 最常用 的就是 这种, 似圆非 圆 , 轻 巧 又 便宜的 蒲扇。 蒲 扇 流 传 至今, 我的记 忆中, 它跨越 了半个 世纪, 也 走 过 了 我 们的半 个人生 的轨迹 ,携带 着特有 的念想 ,一年 年,一 天天, 流向长
