良好的实验动物给药和采血(包括途径和体积)规范指南
动物实验操作规范

动物实验操作规范一、引言动物实验在科学研究、医学发展、药物研发等领域起着重要作用。
然而,由于与动物权益相关的伦理和道德问题,动物实验一直备受争议。
为了保障动物的福利和确保实验结果的准确性,我们需要制定和遵守一系列动物实验操作规范。
本文将探讨动物实验操作规范的重要性以及如何确保实验操作合乎规范。
二、实验动物选择1. 选择适当的物种和个体在进行动物实验时,要根据研究目的和实验需求选择合适的实验动物物种和个体。
要考虑到动物的生物学特征、遗传背景、行为习性等因素,确保实验结果的可靠性和适用性。
2. 优先考虑替代方法在选择实验动物时,应优先考虑使用替代方法,如细胞培养、计算机模拟等,减少对动物的使用和伤害。
只有在替代方法无法满足实验需求时,才可考虑使用动物实验。
三、实验环境和饲养管理1. 提供适宜的生活环境在实验过程中,应为实验动物提供适宜的生活环境,包括温度、湿度、气体浓度等。
确保实验动物的生理和心理健康,减少压力和恶劣环境对实验结果的干扰。
2. 饲养管理标准化实验动物的饲养管理需严格按照标准进行,包括饲料、饮水、清洁等。
要定期检查动物的健康状况,及时发现并处理疾病或异常情况。
四、手术和操作规范1. 预防和减轻痛苦在进行手术和操作时,要采取必要的措施减轻动物的痛苦和不适。
使用麻醉剂和镇痛药物,遵循规范的麻醉和手术操作流程。
2. 预防感染和交叉感染在手术和操作中,要注意严格的无菌操作,预防动物感染和交叉感染。
保持手术器械和操作场所的清洁和消毒,确保实验结果的准确性。
五、实验过程监测和记录1. 监测实验过程在进行动物实验过程中,要对实验动物的生理指标、行为表现等进行监测。
及时发现并记录异常情况,保证实验数据的真实性和可靠性。
2. 记录详细实验过程实验过程中的每一个操作、结果和观察都应进行详细记录。
包括实验方法、时间、剂量等,确保实验数据的可追溯性和可验证性。
六、伦理委员会审查和道德评估1. 伦理委员会审查所有涉及动物实验的研究项目都应接受伦理委员会的审查和评估。
常用动物实验操作指南

常用动物实验操作指南一、实验动物的抓取与固定。
(一)小鼠。
1. 抓取。
- 用右手拇指和食指抓住小鼠尾巴中部,将小鼠提起,放在鼠笼盖上或其他粗糙表面。
- 当小鼠试图抓住粗糙表面时,迅速用左手拇指和食指捏住小鼠双耳及颈部皮肤,无名指、小指和手掌心夹住小鼠背部皮肤及尾部,将小鼠固定成头部向上的直立位。
- 原因:抓住尾巴提起小鼠是为了能够将其从饲养环境中移出,而后续的固定方式可以限制小鼠的活动,避免被咬伤,同时方便进行各种操作,如注射等。
这种固定方式能够稳定地控制小鼠的身体,保证操作的准确性。
2. 固定。
- 如需进行尾静脉注射等操作,可将小鼠放入专门的小鼠固定器中,固定器可调节大小以适应不同体型的小鼠,固定器上有开口以便露出尾巴等部位进行操作。
- 对于一些简单操作如灌胃,也可以由一人用上述抓取方法固定小鼠,另一人进行操作。
(二)大鼠。
1. 抓取。
- 先用右手抓住大鼠尾巴中部,将大鼠提起,放在较粗糙的平面上。
- 然后用左手戴防护手套(大鼠体型较大且可能会用力挣扎和咬伤实验者),从大鼠背部抓住其肩部和颈部皮肤,将大鼠固定。
- 原因:大鼠力量较大,戴手套是为了保护实验者。
先抓尾巴提起是为了便于后续的抓取固定操作,从背部抓住肩部和颈部皮肤可以有效限制大鼠的活动,使其头部和身体得到控制,便于进行实验操作。
2. 固定。
- 对于需要长时间操作的情况,可将大鼠放入大鼠固定架中,固定架可以固定大鼠的四肢,使大鼠呈仰卧或俯卧位,根据实验需求调整。
- 在进行一些短期操作如皮下注射时,可由实验者用上述抓取方法固定大鼠,助手协助进行操作。
二、实验动物的给药操作。
(一)口服给药。
1. 小鼠灌胃。
- 准备合适的灌胃针(一般为1 - 2ml注射器连接特制的灌胃针头)。
- 将小鼠固定如前所述,使小鼠头部向上。
- 灌胃针从小鼠嘴角插入口腔,沿上腭后壁轻轻推进食管,插入深度约为3 - 4cm(根据小鼠大小调整)。
- 缓慢推动注射器活塞,将药物注入食管,然后缓慢拔出灌胃针。
实验动物管理规定

实验动物管理规定生物学实验教学中常用到实验动物,因此,切实从购入、饲育、使用、环境、处理等全过程加强对实验动物的管理,确保实验教学安全、有效进行,特制定本管理规定:第一条利用实验动物从事教学、科研、生产、检定、检验和其他活动的实验室和个人,应当按照使用许可证许可范围,使用合格的实验动物。
实验询应对实验动物作常规检查(体重、体温、常见病等)和观察,所用动物应符合实验条件要求。
第二条本条例所称实验动物,是指经人工饲育,对其携带的微生物实行控制,遗传背景明确或者来源清楚的,用于科学研究、教学以及其他科学实验的动物。
第三条实验动物的管理,应当遵循统一规划、合理分工,有利于促进实验动物教学和科学研究的原则。
笫四条实验动物的质量监督和质量合格认证制度的具体办法参照国家有关制定。
第五条实验动物遗传学、微生物学、营养学和饲育环境等方面的标准参照国家技术监督局有关规定。
第六条实验动物购入1.根据教学讣划,各实验室每学期末提交实验动物使用品种I、数量等计划单, 山实验中心主任审批,交材料釆购供应室采购。
2.购入或领取实验动物时,实验人员应向供应部门索取所用动物相应等级的山国家主管部门所颁发的质量合格证书、动物的遗传背景资料、动物微生物检查资料及动物年龄和健康等方面的资料。
3.动物健康检查,以外观为主。
主要内容包括:皮毛:有无光泽、出血、干燥;眼:有无眼屎、流泪、白内障、角膜损伤等; 耳:有无外伤、耳壳曲折、中耳炎等;四肢:有无弯曲、脱臼、外伤、关节炎;肛门:有无下痢、血便、脱肛等。
4.实验动物购入后,实验教师要负责验收,合格后方可使用。
第七条实验动物饲养室及饲养器具准备1.饲养室面积应根据所购入动物的数量来确定。
面积太小,室内氨浓度很易超过20mg・L-1,对实验的动物疾病控制将产生较大的影响。
2.饲养动物的器具等,应在动物购入前准备好。
准备的数量、规格应根据动物的品种和数量。
每笼收养动物数和分组情况而定。
垫料、饲料应按购入动物数量准备。
实验小鼠给药与采血方法

实验小鼠给药与采血方法1.实验小鼠给药方法:a.静脉注射:i.静脉注射是一种常用的给药方法,适用于需要迅速将药物输送到循环系统中的实验。
ii. 首先,选择小鼠尾静脉作为给药途径。
悬空小鼠尾部并握紧尾根,使用角度较小的针头(例如26G针头)直接注射药物。
iii. 注射前,可以先用温水或者温湿纱布预热小鼠的尾部,以增强血管的扩张和血流。
iv. 确认成功注射药物后,将小鼠放回饲养笼中,并观察其行为和健康状况。
b.口服给药:i.口服给药是一种常用的给药方法,适用于需要药物通过消化系统进行吸收的实验。
ii. 在给药前,可以在小鼠笼子的饮水中添加药物溶液,或将药物悬浮液灌注到小鼠胃部。
iii. 同时,在给药过程中,需要将小鼠固定住,可以使用实验动物颈环进行固定。
iv. 给药后,观察小鼠的饮食情况和健康状况,并适当调整药物剂量和给药方式。
2.实验小鼠采血方法:a.尾静脉采血:i.尾静脉采血是一种常用的、非常便捷的小鼠采血方法。
ii. 首先,选择小鼠尾部静脉作为采血部位。
悬空小鼠尾部并使用温湿纱布加热,以增加血管扩张和血流。
iii. 使用角度较小的针头,例如26G针头,刺入尾静脉,然后将血收集到适当的试管中。
iv. 在采血过程中,保持顺利的血流,可以使用温湿纱布加热尾部以保持血管扩张。
v.采集到所需血液样本后,用棉球或止血带对采血部位施加轻压,以避免出血和感染。
vi. 采血结束后,观察小鼠的健康状况,并给予适当的处理和护理。
b.眼窝静脉注射采血:i.眼窝静脉采血是一种比较特殊的小鼠采血方法,适用于需要大量血液样本的实验。
ii. 在采血前,可以使用温湿纱布加热小鼠眼部,以增加血管扩张和血流。
iii. 使用角度较小的针头,例如26G针头,插入眼窝静脉并拔回,将血液从针头收集到适当的试管中。
iv. 在采血过程中,保持稳定的手部和注射器位置,以避免对小鼠造成伤害。
v.采集到所需血液样本后,用棉球或止血带对采血部位施加轻压,并进行适当的处理和护理,以减少对小鼠的不适和伤害。
实验动物使用操作规程

四、动物实验及设施设备操作规程1、屏障设施使用操作规程(1)人员进出进入一更前将头发盘起,在更衣室外消毒槽站立片刻换拖鞋进入一更,关闭一更门,将门反锁。
脱下外衣放入更衣柜,更换为灭菌后内衣,将一更门解锁。
打开二更门,更换二更拖鞋,进入二更,以感应式消毒器对手消毒,戴口罩、帽子,头发应全部塞入帽子里,消毒液洗手,戴无菌手套,然后穿隔离衣。
以手套将隔离衣袖口封紧。
在消毒液内擦洗手套,要将手套表面指缝、腕部仔细擦洗。
实验人员进入动物实验室,更换各自实验室的拖鞋。
每天操作完毕,各实验室拖鞋于消毒液中洗净取出于本室晾干。
摘去手套,将手套整体泡入另一消毒盒内,关闭二更内侧门,换拖鞋。
将二更外侧门边放置的拖鞋拿到内侧门边摆放整齐,人员即可离开,离开前将拖鞋在消毒液中浸泡5分钟。
进入一更,脱去无菌内、外衣,更换自己衣服,出一更,将无菌衣拿出。
开一更、二更紫外灯消毒。
每次进出动物实验室须填写记录表。
(2)物品进出外购的饲料经紫外灯照射20—30分钟后传入内储存室。
饲料在实验区内存放,不能超过两周。
夏季注意防霉防潮。
垫料经双扉高压蒸汽灭菌柜灭菌后传入内储存室。
小件笼具等经双扉高压蒸汽灭菌柜灭菌后传入内储存室。
大件笼具经消毒浸泡后,再喷雾消毒三遍方可进入。
不能耐高温物品如消毒液瓶等,将外表擦拭干净后,用消毒液浸泡消毒,由传递窗进入饲养室准备间。
所有实验用品先用消毒剂进行表面灭菌或喷雾灭菌后再放入传递窗中经紫外灯照射20—30分钟后从内储存室侧取出。
待洗刷物品经内储存室传入消毒室。
废弃物、动物排泄物装入塑料袋,密封后经污物传递窗传出。
实验结束后,实验用品通过内储存室传递窗传出。
(3)动物管理动物进入:动物引进应先放入隔离检疫室,待隔离检疫合格后移入饲养室。
动物进入洁净区前,首先按照动物运输箱上的标签,核对动物的出生日期、品系名称、性别、数量、供应单位名称、动物的微生物控制等级等是否与计划相符。
用消毒液如5%百毒杀、0.5%~1%过氧乙酸等喷雾消毒运输箱的表面。
采血安乐死麻醉,这么全的实验动物指导方针一定要收藏!

采血安乐死麻醉,这么全的实验动物指导方针一定要收藏!导读常见实验动物指导方针:一、常见动物血液采集二、安乐死的指导方针三、常见动物麻醉的指导方针一、常见动物血液采集网站:/services-name/research-animal-resources/research-support/guidelines/blood-collection本网站收集的常见动物有以下:(点击各动物前的+号可以查看详情)1、小鼠血液采集2、大鼠血液采集3、小鼠和大鼠血液采集总结4、兔血液采集5、啮齿动物常见的采血程序介绍点击各动物前的+号,可以查看详细的采血步骤。
二、安乐死的指导方针网址:/services-name/research-animal-resources/research-support/guidelines/euthanasia本网站收集的常见动物有以下:(点击对应的物种,可以跳转到查看具体的安乐死方式)1、老鼠、老鼠、沙鼠、仓鼠或其他小啮齿动物安乐死方式① Carbon dioxide (CO2)Inhalation to effect. Flow rate must displace no more than 30% of the chamber volume/minute. Prolonged exposure may be required for neonates and fetuses.② Sodium pentobarbital(戊巴比妥钠)≥100 mg/kg intraperito neal (IP) or intravenous (IV). This is a controlled substance (DEA Schedule II). Dosing is the same for the commercial product Fatal-Plus®.③ Euthanasia solution(安乐死溶液)≥86 mg/kg IP or IV. Multiple pharmaceutical grade products available. Contains sodium pentobarbital 390 mg/ml + sodium phenytoin 50 mg/ml (dosing based on barbiturate concentration). This is a controlled substance (DEA Schedule III).④ Cervical dislocation(颈椎脱位)Use in conscious small rodents requires demonstrated technical skill (or must be performed only on unconscious/anesthetized small rodents). Use in rats >200 g to be performed under anesthesia only.⑤ Decapitation(断头)Use in conscious small rodents requires demonstrated technical skill (or must be performed only on unconscious/anesthetized small rodents). Use in rats >200 g to be performed under anesthesia only.⑥ Isoflurane overdose(异氟醚过量)Inhalation to effect. May require prolonged exposure to ensure death.⑦ Injectable anesthetic overdose(注射麻醉过量)Administration varies (IP or IV). Consult a Research Animal Resources (RAR) veterinarian regarding specific agents.⑧ Anesthesia followed by potassium chloride(麻醉后氯化钾)75-150 mg/kg KCl IV. Administer rapidly to effect.⑨ Anesthesia followed by physical method(麻醉后物理方法)Cervical dislocation, decapitation, exsanguination, bilateral pneumothorax.2、兔安乐死方式① Sodium pentobarbital(戊巴比妥钠)≥100 mg/kg IP or IV. This is a controlled substance (DEA Schedule II). Dosing is the same for the commercial product Fatal-Plus®.② Euthanasia solution(安乐死溶液)≥86 mg/kg IP or IV. Multiple pharmaceutical grade products available. Contains sodium pentobarbital 390 mg/ml + sodium phenytoin 50 mg/ml (dosing based on barbiturate concentration). This is a controlled substance (DEA Schedule III).③ Injectable anesthetic overdose(注射麻醉过量)Administration varies (IP or IV). Consult an RAR veterinarian regarding specific agents.④ Anesthesia followed by potassium chloride(麻醉后氯化钾)75-150 mg/kg KCl IV. Administered rapidly to effect.⑤ Anesthesia followed by physical method(麻醉后物理方法)Cervical dislocation, decapitation, exsanguination, bilateralpneumothorax三、常见动物麻醉的指导方针网址:/services-name/research-animal-resources/research-support/guidelines/analgesia此网站记录麻醉方式的物种有以下:1、小鼠麻醉方式小鼠麻醉指南,包括麻醉药物和程序和对新生小鼠麻醉特殊考虑。
药理实验中对动物的给药体积与采血体积控制
药理实验中对动物的给药体积与采血体积控制本文由wyj摘要翻译本文是2001年由欧洲制药工业协会联合会 (The European Federation of Pharmaceutical Industries and Associations ,EFPIA)和欧洲替代方法验证中心(European Centre for the Validation of Alternative Methods,ECV AM)联合发布的关于对动物不同途径给药或采血时所能充许的给药体积和采血体积指导原则。
动物包括小鼠、大鼠、兔、狗、猴、豚鼠,给药方法包括po、ip、im、sc、一次性iv、缓慢静注、静脉点滴等的一般给药体积、最大充许给药体积、给药速度等,采血包括各种动物的最大充许采血量和恢复时间等。
是一部实用、全面而又难得的指导原则,相信对从事药理、毒理研究者及其他动物实验工作者有一定的帮助。
下面的节选由wyj摘要翻译,原文见欧洲联盟欧洲制药工业协会联合会,A Good Practice Guide to the Administration of Substances and Removal of Blood, Including Routes and Volumes(2000). J. Appl. Toxicol. 21, 15–23 (2001)第一部分:动物实验中的给药体积与给药速度一、一般给药体积与速度对于各种给药途径的最大给药体积,取决实验动物种属和制剂性质。
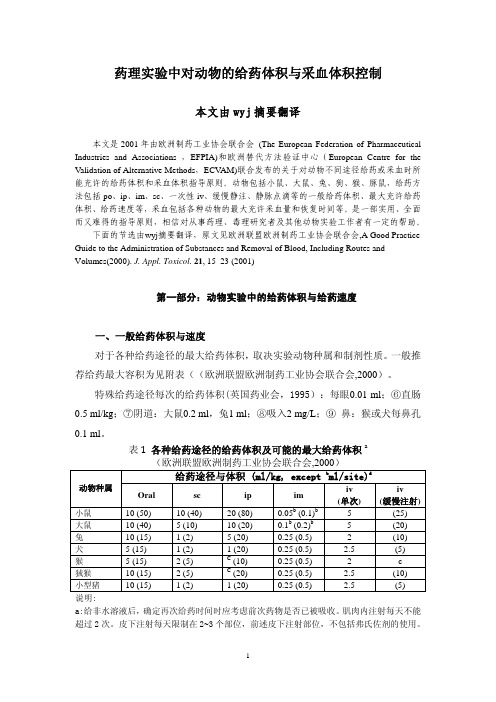
一般推荐给药最大容积为见附表((欧洲联盟欧洲制药工业协会联合会,2000)。
特殊给药途径每次的给药体积(英国药业会,1995):每眼0.01 ml;⑥直肠0.5 ml/kg;⑦阴道:大鼠0.2 ml,兔1 ml;⑧吸入2 mg/L;⑨鼻:猴或犬每鼻孔0.1 ml。
表1各种给药途径的给药体积及可能的最大给药体积a(欧洲联盟欧洲制药工业协会联合会,2000)给药途径与体积 (ml/kg, except b ml/site)d动物种属Oral sc ip imiv(单次)iv(缓慢注射)小鼠10 (50) 10 (40) 20 (80) 0.05b (0.1)b 5 (25) 大鼠10 (40) 5 (10) 10 (20) 0.1b (0.2)b 5 (20) 兔10 (15) 1 (2) 5 (20) 0.25 (0.5) 2 (10)犬 5 (15) 1 (2) 1 (20) 0.25 (0.5) 2.5 (5)猴 5 (15) 2 (5) C (10) 0.25 (0.5) 2 c狨猴10 (15) 2 (5) C (20) 0.25 (0.5) 2.5 (10)小型猪10 (15) 1 (2) 1 (20) 0.25 (0.5) 2.5 (5)说明:a:给非水溶液后,确定再次给药时间时应考虑前次药物是否已被吸收。
医学研究机构动物实验操作规范

医学研究机构动物实验操作规范一、动物管理为了保障医学研究的科学性和可靠性,医学研究机构应严格规范动物实验的操作流程和管理制度,确保实验过程中动物的福利和安全。
在进行动物实验前,必须对实验动物进行合理选择,确保动物的品种、性别、年龄等与研究目的相符。
1. 动物的来源和运输医学研究机构应选择有合法资质和良好声誉的供应商采购实验动物,确保动物的健康状态和品质。
运输过程中,应配备适当的设备和专业人员,并提供适宜的温湿度环境,确保动物在运输过程中的舒适与安全。
2. 动物的饲养环境医学研究机构应建立适宜的动物饲养环境,提供清洁卫生的饲养场所和设备,保证动物的食物、水源和床材等供应充足,并设立适当的照明与温度、湿度等环境参数,确保动物的舒适和健康。
3. 动物的饲养管理医学研究机构应制定全面的饲养管理制度,明确动物饲养人员的职责和任务。
饲养人员应具备相关的知识和技能,并定期进行培训和考核,确保动物得到正确的饲养和日常照顾。
二、动物实验操作在进行动物实验前,医学研究机构必须制定详细的操作规范,确保实验操作的准确性和可重复性,最大程度地减少对动物的伤害和痛苦。
1. 实验前准备在进行动物实验前,研究人员必须详细了解实验的目的、方法和技术要求,进行充分的文献调研和实验设计。
同时,应保证所使用的设备、试剂和器械符合相关标准和规定,确保实验操作的安全和可靠。
2. 动物实验操作流程医学研究机构应建立标准化的动物实验操作流程,并确保操作人员掌握正确的实验技术和操作方法。
实验操作应遵循医学伦理和法律法规的要求,确保动物在实验过程中的福利和安全。
3. 动物实验数据记录和分析医学研究机构应建立规范的实验数据记录和分析流程,并规定数据记录的内容和格式。
实验数据应及时、准确地记录,并进行分析和解读,以保证实验结果的可信度和可靠性。
三、动物实验伦理医学研究机构在进行动物实验时,必须遵循动物实验伦理的原则,确保动物在实验过程中的福利和权益得到充分保护。
实验动物采血完全指南

实验动物采血完全指南第一篇:实验动物采血完全指南实验动物采血完全指南凡用血量较少的检验如红、白细胞计数、血红蛋白的测定,血液涂片以及酶活性微量分析法等,可刺破组织取毛细血管的血。
当需血量较多时可作静脉采血。
静脉采血时,若需反复多次,应自远离心脏端开始,以免发生栓塞而影响整条静脉。
例如,研究毒物对肺功能的影响、血液酸碱平衡、水盐代谢紊乱,需要比较动、动脉血氧分压、二氧化碳分压和血液pH值以及K+、Na+、CI-离子浓度,必须采取动脉血液。
采血时要注意:⑴采血场所有充足的光线;室温夏季最好保持在25-28℃,冬季,15-20℃为宜;⑵采血用具有采用部位一般需要进行消毒;⑶采血用的注射器和试管必须保持清洁干燥;⑷若需抗凝全血,在注射器或试管内需预先加入抗凝剂.1.取少量血a.尾静脉大鼠、小鼠b.耳静脉兔、狗、猫、猪、山羊、绵羊c.眼底静脉丛兔、大鼠、小鼠c.舌下静脉兔d.腹壁静脉青蛙、蟾蜍e.冠、脚蹼皮下静脉鸡、鸭、鹅2.取中量血a.后肢外侧皮下小隐静脉狗、猴、猫b.前肢内侧皮下头静脉狗、猴、猫c.耳中央动脉兔d.颈静脉狗、猫、兔e.心脏豚鼠、大鼠、小鼠f.断头大鼠、小鼠g.翼下静脉鸡、鸭、鸽、鹅h.颈动脉鸡、鸭、鸽、鹅3.取大量血a.股动脉、颈动脉狗、猴、猫、兔b.心脏狗、猴、猫、兔c.颈静脉马、牛、山羊、绵羊d.摘眼球大鼠、小鼠采动物品种最大安全采血量(ml)最小致死采血量(ml) 小鼠0.20.3大鼠豚鼠兔狼狗500猎狗200猴1.割(剪)尾采血当所需血量很少时采用本法。
固定动物并露出鼠尾。
将尾部毛剪去后消毒,然后浸在45℃左右的温水中数分钟,使尾部血管充盈。
再将尾擦干,用锐器(刀或剪刀)割去尾尖0.3-0.5cm,让血液自由滴入盛器或用血红蛋白吸管吸取,采血结束,伤口消毒并压迫止血。
也可在尾部作一横切口,割破尾动脉或静脉,收集血液的方法同上。
每鼠一般可采血10余次以上。
小鼠每次可取血0.1ml,大鼠0.3~0.5ml。
良好的实验动物给药和采血(包括途径和体积)规范的指南

A Good Practice Guide to the Administration of Substances and Removal of Blood,Including Routesand Volumes良好的实验动物给药和采血(包括途径和体积)规范指南Karl-Heinz Diehl1, Robin Hull2, David Morton3, Rudolf Pfister4, Yvon Rabemampianina5,David Smith6,*, Jean-Marc Vidal7 and Cor van de Vorstenbosch 81Aventis, PO Box 1140, D35001 Marburg, Germany德国马尔堡市35001区1140信箱安万特公司2N I B S C, Blanch Lane, South Miimms, Potters Bar, Hertfordshire EN6 3QG英国赫特福德郡EN6 3QG波特斯巴镇South Miimms布兰奇道英国国家生物制品检定所3The University of Birmingham, Medical School, Edgbaston, Birmingham B15 2TT英国伯明翰市B15 2TT艾吉马斯顿伯明翰大学医学院4Novartis Pharma AG, CH-4002 Basel, Switzerland瑞士巴塞尔CH-4002诺华制药公司5Centre de Recherche Pfizer, Etablissement d’Amboise, Z1 Poce´-sur-Cisse-BP 159 37401 Amboise Cedex, France法国Amboise Cedex Z1 Poce´-sur-Cisse-BP 159 37401 Etablissement d’Amboise辉瑞研究中心6AstraZeneca R&D Charnwood, Bakewell Road, Loughborough, Leics LE11 5RH英国莱斯特郡LE11 5RH拉夫堡市贝克韦尔路Charnwood阿斯利康研究中心7Aventis, 102 Route de Noisy, 95235 Romainville Ce´dex, France法国Romainville Ce´dex 95235 Noisy路102号安万特公司8N V Organon, PO Box 20, 5340 BH Oss, Netherlands荷兰BH Oss5340 20号信箱欧加农公司Key words: blood volumes; blood removal; administration substances; laboratory animals; refinement.关键词:血容量;采血;给药;实验动物;简化This article is the result of an initiative between the European Federation of Pharmaceutical Industries Associations (EFPIA) and the European Centre for the Validation of Alternative Methods (ECVAM).Its objectives are to provide the researcher in the safety evaluation laboratory with an up-to-date, easyto-use set of data sheets to aid in the study design process whilst at the same time affording maximum welfare considerations to the experimental animals.该文章为欧盟制药工业协会(EFPIA)和欧洲替代动物实验方法验证中心(ECVAM)之间的初步结果。
良好的实验动物给药和采血(包括途径和体积)规范指南

A Good Practice Guide to the Administration of Substances and Removal of Blood,Including Routes andVolumes良好的实验动物给药和采血(包括途径和体积)规范指南Karl-Heinz Diehl1, Robin Hull2, David Morton3, Rudolf Pfister4, Yvon Rabemampianina5,David Smith6,*, Jean-Marc Vidal7 and Cor van de V orstenbosch 81Aventis, PO Box 1140, D35001 Marburg, Germany德国马尔堡市35001区1140信箱安万特公司2N I B S C, Blanch Lane, South Miimms, Potters Bar, Hertfordshire EN6 3QG英国赫特福德郡EN6 3QG波特斯巴镇South Miimms布兰奇道英国国家生物制品检定所3The University of Birmingham, Medical School, Edgbaston, Birmingham B15 2TT英国伯明翰市B15 2TT艾吉马斯顿伯明翰大学医学院4Novartis Pharma AG, CH-4002 Basel, Switzerland瑞士巴塞尔CH-4002诺华制药公司5Centre de Recherche Pfizer, Etablissement d’Amboise, Z1 Poce´-sur-Cisse-BP 159 37401 Amboise Cedex, France法国Amboise Cedex Z1 Poce´-sur-Cisse-BP 159 37401 Etablissement d’Amboise 辉瑞研究中心6AstraZeneca R&D Charnwood, Bakewell Road, Loughborough, Leics LE11 5RH英国莱斯特郡LE11 5RH拉夫堡市贝克韦尔路Charnwood阿斯利康研究中心7Aventis, 102 Route de Noisy, 95235 Romainville Ce´dex, France法国Romainville Ce´dex 95235 Noisy路102号安万特公司8N V Organon, PO Box 20, 5340 BH Oss, Netherlands荷兰BH Oss5340 20号信箱欧加农公司Key words: blood volumes; blood removal; administration substances; laboratory animals; refinement.关键词:血容量;采血;给药;实验动物;简化This article is the result of an initiative between the European Federation of Pharmaceutical Industries Associations (EFPIA) and the European Centre for the Validation of Alternative Methods (ECV AM).Its objectives are to provide the researcher in the safety evaluation laboratory with an up-to-date, easyto-use set of data sheets to aid in the study design process whilst at the same time affording maximum welfare considerations to the experimental animals.该文章为欧盟制药工业协会(EFPIA)和欧洲替代动物实验方法验证中心(ECV AM)之间的初步结果。
实验动物管理条例(2017年修订)-国务院令第676号

实验动物管理条例(2017年修订)正文:----------------------------------------------------------------------------------------------------------------------------------------------------实验动物管理条例(1988年10月31日国务院批准1988年11月14日国家科学技术委员会令第2号发布根据2011年1月8日《国务院关于废止和修改部分行政法规的决定》第一次修订根据2013年7月18日《国务院关于废止和修改部分行政法规的决定》第二次修订根据2017年3月1日《国务院关于修改和废止部分行政法规的决定》第三次修订)第一章总则第一条为了加强实验动物的管理工作,保证实验动物质量,适应科学研究、经济建设和社会发展的需要,制定本条例。
第二条本条例所称实验动物,是指经人工饲育,对其携带的微生物实行控制,遗传背景明确或者来源清楚的,用于科学研究、教学、生产、检定以及其他科学实验的动物。
第三条本条例适用于从事实验动物的研究、保种、饲育、供应、应用、管理和监督的单位和个人。
第四条实验动物的管理,应当遵循统一规划、合理分工,有利于促进实验动物科学研究和应用的原则。
第五条国家科学技术委员会主管全国实验动物工作。
省、自治区、直辖市科学技术委员会主管本地区的实验动物工作。
国务院各有关部门负责管理本部门的实验动物工作。
第六条国家实行实验动物的质量监督和质量合格认证制度。
具体办法由国家科学技术委员会另行制定。
第七条实验动物遗传学、微生物学、营养学和饲育环境等方面的国家标准由国家技术监督局制定。
第二章实验动物的饲育管理第八条从事实验动物饲育工作的单位,必须根据遗传学、微生物学、营养学和饲育环境方面的标准,定期对实验动物进行质量监测。
各项作业过程和监测数据应有完整、准确的记录,并建立统计报告制度。
(完整word版)动物免疫与动物采血实验操作规范

动物免疫与动物采血一、动物保定在进行动物免疫和动物采血之前,进行动物保定是非常必要的。
正确的抓取固定动物是为了不损害动物健康,不影响观察指标,并防止被动物咬伤,保证试验顺利进行。
下面介绍几种常见实验动物的保定方法。
1 小鼠的抓取固定方法小鼠性情温顺,一般不会主动咬人,但取用时动作也要轻缓。
抓取时先用右手抓取鼠尾提起,放在其前,爪能抓牢的物体表面稍后提,或放在实验台上,在其向前爬行时,用左手拇食指迅速提住其后颈部皮肤,把鼠体置于左手心中,将鼠尾用无名指和小指压在手掌上。
右手即可进行各种操作,如注射、灌胃及其他实验操作。
如进行解剖、手术、心脏及尾部采血和尾静脉注射时,则需将小鼠做一定形式的固定,解剖手术和心脏采血等均可使动物先取背卧式(必要时先进行麻醉),再用大头针或线绳将鼠前后肢依次固定在支持物上。
尾静脉采血或尾静脉注射时,可用小鼠尾静脉注射架固定;或倒放适当大小和重量的容器,把小鼠放在里面只露尾巴,这种容器能够压住尾部不让活动,同时起,到驱赶血液的作用;或把小鼠放在一黑布口袋里小鼠趋黑,向前爬动,在尾部将小口袋缩口,固定小布口袋后,可进行尾静脉采血或尾静脉注射等操作。
如只想移动小鼠,可用两手把它捧起或用右手拇指和食指的指腹抓住尾部中央将小鼠倒提起来。
2 大鼠的抓取固定方法4-5周龄以内的大鼠和小鼠一样抓住尾部提起来,周龄较大的大鼠尾部皮肤因为容易被剥脱,所以用左手从背部中央到胸部捏起来抓住。
由于大鼠比小鼠牙尖性猛,不易用袭击方式抓取,以防大鼠在惊恐或击怒时咬伤手指,提拿时最好戴上防护手套,轻轻抓住尾巴后提起,置于试验台上,固定方法随操作目的而定。
如需尾静脉取血或注射,可将大鼠固定盒内或用小黑布口袋装大鼠,使其只露尾部;如需腹腔注射或肌肉注射或灌胃,可用右手提住鼠尾,将鼠放在鼠爪能抓牢的物体表面,如铁丝笼子,稍向后拉鼠尾、鼠身被拉长,用左手贴在鼠背,捏紧头顶部和背部皮肤,即可将大鼠固定在左手中,右手可进行其他操作;如需长时间固定操作,可将大鼠四肢固定在木板上,用一根棉绳拉住两只门齿固定在头部后木板上。
实验动物给药途经和剂量的管理规范

Guidelines for the Administration of Substances, Including Routes andVolumes给药途经和剂量的管理规范一、目的提供常用实验动物的采血、给药方法的指导规范,同时最大限度地减少动物痛苦和我们的烦恼二、背景计量实验动物是必要的各种科学调查,以满足监管要求。
这些准则旨在突出必要的考虑因素,并找出潜在的问题,将改进的技术,构成良好实验室实践。
最恰当的注射方法和剂量(可能的最大剂量)Species 种类Route and V olumes (ml/g except *ml/site)方法和剂量(毫升/克*毫升/注射点除外) Oral口腔SC皮下IP腹腔IM肌肉IV静脉(slow iv)Mouse 小鼠0.01(0.05) 0.01(0.04) 0.02(0.8)0.05*(0.1)*0.005(0.025)Rat 大鼠0.01(0.04)0.005(0.015 )0.01(0.02)0.1* (0.2)*0.005(0.02),Species 种类Route and V olumes (ml/kg except *ml/site)方法和剂量(毫升/千克*毫升/注射点除外Oral口腔SC皮下IP腹腔IM肌肉IV静脉(slow iv)Rabbit 兔子10 (15) 1 (2) 5 (20) 0.25 (0.5)2 (10)Pig 猪10 (15) 1 (2) 1 (20)0.25 (0.5)2.5 (5)Dog 狗5 (15) 1 (2) 1 (20) 0.25 (0.5)2.5 (5)注:•对于非水溶液制剂,必须考虑吸收时间,然后再进行下一次给药。
•每天肌注不超过2个点应该使用。
•皮下注射点应限制在每天2至3注射点。
•皮下注射不包括弗氏佐剂(见兔免疫指引)。
•列左侧的数字是打算作为一个推荐量为单个或多个剂量的指导。
第二组括号内的数字是可能的最大值。
实验动物采血完全指南

实验动物采血完全指南采血方法的选择,决定于实验的目的所需血量以及动物种类。
凡用血量较少的检验如红、白细胞计数、血红蛋白的测定,血液涂片以及酶活性微量分析法等,可刺破组织取毛细血管的血。
当需血量较多时可作静脉采血。
静脉采血时,若需反复多次,应自远离心脏端开始,以免发生栓塞而影响整条静脉。
例如,研究毒物对肺功能的影响、血液酸碱平衡、水盐代谢紊乱,需要比较动、动脉血氧分压、二氧化碳分压和血液pH值以及K+、Na+、CI-离子浓度,必须采取动脉血液。
采血时要注意:⑴采血场所有充足的光线;室温夏季最好保持在25-28℃,冬季,15-20℃为宜;⑵采血用具有采用部位一般需要进行消毒;⑶采血用的注射器和试管必须保持清洁干燥;⑷若需抗凝全血,在注射器或试管内需预先加入抗凝剂.1.取少量血a.尾静脉大鼠、小鼠b.耳静脉兔、狗、猫、猪、山羊、绵羊c.眼底静脉丛兔、大鼠、小鼠d.舌下静脉兔e.腹壁静脉青蛙、蟾蜍f.冠、脚蹼皮下静脉鸡、鸭、鹅2.取中量血a.后肢外侧皮下小隐静脉狗、猴、猫b.前肢内侧皮下头静脉狗、猴、猫c.耳中央动脉兔d.颈静脉狗、猫、兔e.心脏豚鼠、大鼠、小鼠f.断头大鼠、小鼠g.翼下静脉鸡、鸭、鸽、鹅h.颈动脉鸡、鸭、鸽、鹅3.取大量血a.股动脉、颈动脉狗、猴、猫、兔b.心脏狗、猴、猫、兔c.颈静脉马、牛、山羊、绵羊d.摘眼球大鼠、小鼠采动物品种最大安全采血量(ml) 最小致死采血量(ml)小鼠0.2 0.3大鼠 1 2豚鼠 5 10兔10 40狼狗100 500猎狗50 200猴15 601.割(剪)尾采血当所需血量很少时采用本法。
固定动物并露出鼠尾。
将尾部毛剪去后消毒,然后浸在45℃左右的温水中数分钟,使尾部血管充盈。
再将尾擦干,用锐器(刀或剪刀)割去尾尖0.3-0.5cm,让血液自由滴入盛器或用血红蛋白吸管吸取,采血结束,伤口消毒并压迫止血。
也可在尾部作一横切口,割破尾动脉或静脉,收集血液的方法同上。
实验动物管理规定与操作规程修订稿

实验动物管理规定与操作规程修订稿第一章总则第一条为了规范实验动物的管理,保护实验动物的权益,促进实验科研的进展,制定本规定。
第三条实验动物管理的原则是以保护实验动物生命和健康为首要任务,加强实验动物的福利保障,尽量减少或避免实验动物的利用,推动替代方法的研发与应用。
第四条实验动物管理机构应当制定实验动物使用计划,并定期进行评估和调整,以确保实验动物的合理利用。
第五条实验动物管理机构应当优先考虑使用无血缘关系的实验动物,不得捕捉野生动物作为实验动物。
第六条实验动物管理机构应当配备专业化的实验动物管理人员,并进行必要的培训和资质认证。
第七条实验动物管理机构应当建立健全实验动物管理档案,记录相关的实验动物信息和管理措施。
第八条禁止向未经授权的实验动物管理机构提供实验动物。
第九条实验动物管理机构应当定期开展实验动物使用情况的公示,并接受社会监督。
第十条实验动物管理机构应当建立健全实验动物管理的投诉举报渠道,并及时处理相关投诉和举报。
第二章实验动物供应管理第十一条实验动物供应单位应当具备相应的资质,包括动物养殖、繁殖和贩运等环节的资质。
第十二条实验动物供应单位应当设立动物伦理审查和动物福利保护委员会,并依法组织实施。
第十三条实验动物供应单位应当建立实验动物的准入制度,对供应的实验动物进行健康监测和鉴定,确保供应的实验动物符合相关标准和要求。
第十四条实验动物供应单位应当与实验动物管理机构建立长期合作关系,确保供应的实验动物数量和质量满足需求。
第十五条实验动物供应单位应当严格控制实验动物的繁殖数量,以避免过度繁殖和过度户养。
第三章实验动物使用管理第十六条实验动物管理机构应当建立合理的实验动物使用计划,确保实验动物的合理利用。
第十七条实验动物使用前应当经过有效的伦理审查,确保实验的合法性和伦理性。
第十八条实验动物使用过程中应当提供适当的饲养条件和环境,保证其生存和生活质量。
第十九条实验动物使用过程中应当采取必要的麻醉、镇痛和护理措施,以减少实验动物的痛苦和痛苦。
A good practice guide药理实验中对动物的给药体积与采血体积控制

药理实验中对动物的给药体积与采血体积控制本文由wyj摘要翻译本文是2001年由欧洲制药工业协会联合会 (The European Federation of Pharmaceutical Industries and Associations ,EFPIA)和欧洲替代方法验证中心(European Centre for the Validation of Alternative Methods,ECV AM)联合发布的关于对动物不同途径给药或采血时所能充许的给药体积和采血体积指导原则。
动物包括小鼠、大鼠、兔、狗、猴、豚鼠,给药方法包括po、ip、im、sc、一次性iv、缓慢静注、静脉点滴等的一般给药体积、最大充许给药体积、给药速度等,采血包括各种动物的最大充许采血量和恢复时间等。
是一部实用、全面而又难得的指导原则,相信对从事药理、毒理研究者及其他动物实验工作者有一定的帮助。
下面的节选由wyj摘要翻译,原文见欧洲联盟欧洲制药工业协会联合会,A Good Practice Guide to the Administration of Substances and Removal of Blood, Including Routes and Volumes(2000). J. Appl. Toxicol. 21, 15–23 (2001)第一部分:动物实验中的给药体积与给药速度一、一般给药体积与速度对于各种给药途径的最大给药体积,取决实验动物种属和制剂性质。
一般推荐给药最大容积为见附表((欧洲联盟欧洲制药工业协会联合会,2000)。
特殊给药途径每次的给药体积(英国药业会,1995):每眼0.01 ml;⑥直肠0.5 ml/kg;⑦阴道:大鼠0.2 ml,兔1 ml;⑧吸入2 mg/L;⑨鼻:猴或犬每鼻孔0.1 ml。
表1各种给药途径的给药体积及可能的最大给药体积a(欧洲联盟欧洲制药工业协会联合会,2000)给药途径与体积 (ml/kg, except b ml/site)d动物种属Oral sc ip imiv(单次)iv(缓慢注射)小鼠10 (50) 10 (40) 20 (80) 0.05b (0.1)b 5 (25) 大鼠10 (40) 5 (10) 10 (20) 0.1b (0.2)b 5 (20) 兔10 (15) 1 (2) 5 (20) 0.25 (0.5) 2 (10)犬 5 (15) 1 (2) 1 (20) 0.25 (0.5) 2.5 (5)猴 5 (15) 2 (5) C (10) 0.25 (0.5) 2 c狨猴10 (15) 2 (5) C (20) 0.25 (0.5) 2.5 (10)小型猪10 (15) 1 (2) 1 (20) 0.25 (0.5) 2.5 (5)说明:a:给非水溶液后,确定再次给药时间时应考虑前次药物是否已被吸收。
医学研究机构动物实验操作规范

医学研究机构动物实验操作规范动物实验在医学研究中起着至关重要的作用,有助于了解疾病的发病机制、开发新的治疗方法和药物等。
为了保证动物实验的有效性和可靠性,医学研究机构必须严格遵守一系列的操作规范。
一、伦理审查和合规性医学研究机构必须设立动物实验伦理委员会,负责审查和监督动物实验方案的合规性。
该委员会的成员包括研究人员、兽医、动物保护专家以及非科研人员。
实验方案必须经过伦理审查委员会的严格审查和批准,确保研究目的合理、动物数量合适和所使用的动物种类适宜。
二、动物饲养和管理医学研究机构必须建立符合国家和国际标准的动物饲养管理体系,提供适宜的生活条件和饲养环境。
动物实验室必须设有足够的饲养空间,保证动物的舒适性和居住环境的清洁。
同时,必须对动物的饮食、水源、温度和湿度等进行细致管理,确保动物的生理需要得到满足。
三、实验操作方案四、实验过程中的动物福利医学研究机构必须确保在动物实验过程中保护动物的福利。
包括减轻动物实验过程中的痛苦和苦难,最大限度地降低实验对动物的影响。
医学研究机构必须提供合适的麻醉和镇痛剂,减少动物疼痛感受。
同时,必须正确使用和处置实验用动物的尸体和废弃物,防止对环境和人体造成危害。
五、数据收集和分析六、实验结果的报告和发布医学研究机构必须按照科研伦理规范,及时公开实验结果。
实验结果的报告必须真实准确,不夸大、不隐瞒实验结果的任何信息。
同时,在发布实验结果时,也必须注明实验过程中所使用的动物种类和数量,以及所采取的伦理措施。
七、动物实验的替代方法八、监督和处罚机制总结起来,医学研究机构在开展动物实验时,必须严格遵守一系列操作规范,包括伦理审查和合规性、动物饲养和管理、实验操作方案、实验过程中的动物福利、数据收集和分析、实验结果的报告和发布、动物实验的替代方法、监督和处罚机制等方面。
只有确保动物实验的合理性、可靠性和动物福利,才能更好地推动医学研究的发展和人类健康的进步。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A Good Practice Guide to the Administration of Substances and Removal of Blood,Including Routes andVolumes良好的实验动物给药和采血(包括途径和体积)规范指南Karl-Heinz Diehl1, Robin Hull2, David Morton3, Rudolf Pfister4, Yvon Rabemampianina5,David Smith6,*, Jean-Marc Vidal7 and Cor van de V orstenbosch 81Aventis, PO Box 1140, D35001 Marburg, Germany德国马尔堡市35001区1140信箱安万特公司2N I B S C, Blanch Lane, South Miimms, Potters Bar, Hertfordshire EN6 3QG英国赫特福德郡EN6 3QG波特斯巴镇South Miimms布兰奇道英国国家生物制品检定所3The University of Birmingham, Medical School, Edgbaston, Birmingham B15 2TT英国伯明翰市B15 2TT艾吉马斯顿伯明翰大学医学院4Novartis Pharma AG, CH-4002 Basel, Switzerland瑞士巴塞尔CH-4002诺华制药公司5Centre de Recherche Pfizer, Etablissement d’Amboise, Z1 Poce´-sur-Cisse-BP 159 37401 Amboise Cedex, France法国Amboise Cedex Z1 Poce´-sur-Cisse-BP 159 37401 Etablissement d’Amboise 辉瑞研究中心6AstraZeneca R&D Charnwood, Bakewell Road, Loughborough, Leics LE11 5RH英国莱斯特郡LE11 5RH拉夫堡市贝克韦尔路Charnwood阿斯利康研究中心7Aventis, 102 Route de Noisy, 95235 Romainville Ce´dex, France法国Romainville Ce´dex 95235 Noisy路102号安万特公司8N V Organon, PO Box 20, 5340 BH Oss, Netherlands荷兰BH Oss5340 20号信箱欧加农公司Key words: blood volumes; blood removal; administration substances; laboratory animals; refinement.关键词:血容量;采血;给药;实验动物;简化This article is the result of an initiative between the European Federation of Pharmaceutical Industries Associations (EFPIA) and the European Centre for the Validation of Alternative Methods (ECV AM).Its objectives are to provide the researcher in the safety evaluation laboratory with an up-to-date, easyto-use set of data sheets to aid in the study design process whilst at the same time affording maximum welfare considerations to the experimental animals.该文章为欧盟制药工业协会(EFPIA)和欧洲替代动物实验方法验证中心(ECV AM)之间的初步结果。
其目的在于为安全性评价实验室的研究者提供最新的易于使用的数据库以帮助研究设计过程,同时最大可能地考虑到实验动物的福利。
Although this article is targeted at researchers in the European Pharmaceutical Industry, it is considered that the principles underpinning the data sets and refinement proposals are equally applicable to all those who use these techniques on animals in their research, whether in research institutes,universities or other sectors of industry. The implications of this article may lead to discussion with regulators, such as those responsible for pharmacopoeialtesting.尽管该文章针对的是欧洲制药工业界的研究者,但支撑该数据库的基本原理及改进建议同样适用于所有在他们的研究中使用这些动物实验技术的人,不论是研究所、大学或其它行业中的研究者。
There are numerous publications dealing with the administration of test substances and the removal of blood samples, and many laboratories also have their own ‘in-house’ guidelines that have been developed by custom and practice over many years. Within European Union Directive 86/609EEC1 we have an obligation to refine experiments to cause the minimum amount of stress. We hope that this article will provide background data useful to those responsible for protocol design and review.有关供试品给予和采血的出版物众多,且许多实验室在多年的经验和实践基础之上亦发展了它们自己的内部指南。
在欧盟化妆品标准86/609EEC中,我们有义务简化实验以最小化动物的紧张程度。
我们希望该文能够对那些负责方案设计和审核的研究者提供有用的背景数据。
This guide is based on peer-reviewed publications whenever possible, but where this is not possible we have used ‘in-house’ data an d the experience of those on the working party (as well as helpful comments submitted by the industry) for a final opinion. The guide also addresses the continuing need to refine the techniques associated with the administration of substances and the withdrawal of blood, and suggests ways of doing so. Data-sharing between laboratories should be encouraged to avoid duplication of animal work, as well as sharing practical skills concerning animal welfare and scientific problems caused by ‘overdosing’ in some way or another. The recommendations in this guide refer to the ‘normal’ animal, and special consideration is needed, for instance, during pregnancy and lactation.Interpretation of studies may be confounded when large volumes are administered or excessive sampling employed, particularly if anaesthetics are used. Copyright ã 2001 John Wiley & Sons, Ltd.该文章基于历年所有可能收集到的同行评议出版物,但我们未能够收集到的内部数据和那些工作组的经验(以及行业提交的有用的注释)除外。
该指南亦强调了持续性简化与给药和采血有关的技术的必要性,并且建议该如何去进行这方面的工作。
应该鼓励实验室间的数据共享以避免重复性动物研究,以及共享在某些方法或其它情况下的“药物过量”所引起的与动物福利有关的实际技术和科学问题。
有必要对该指南中涉及到的“正常动物”要求进行特殊考虑,如妊娠和哺乳期间的动物。
当给药体积较大或过度采样时对研究结果的诠释可能会令人感到困惑,特别是使用麻醉动物时。
GOOD PRACTICE GUIDE FOR ADMINISTRATION OF SUBSTANCES良好的给药规范指南Introduction引言Dosing of experimental animals is necessary for a variety of scientific investigations and to meet regulatory demands. The pharmaceutical industry, in particular,has investigated the levels of dosing compatible with animal welfare and valid science.2 In the preclinical stage of the safety evaluation of new drugs it is normal practice to use multiples of the ‘effective dose’in order to attempt to establish the necessary safety m argins. Where chemicals are of low toxicity or are only poorly soluble in acceptable formulations, a large volume may be required to be given toindividual animals to satisfy both scientific and regulatory requirements.The intended clinical use may also have an impact on the acceptability of larger than usual dose volumes, e.g. imaging agents or plasma expanders for intravenous application.各种科学研究都需要对实验动物给药以符合药品注册要求。
