羰基的亲核加成反应 → 与魏悌希(Wittig)试剂的反应
5第五章-羰基的亲核加成及相关反应

羰基的亲核加成及 相关反应
1
羰基的结构与极化:
❖ 醛、酮、羧酸及其衍生物及二氧化碳都含有羰基 ❖ 羰基有一个σ键和一个π键;由于氧的电负性(3.5)比碳
(2.5)大,所以羰基产生极化
2
羰基的结构与极化:
❖ 羰基碳带有部分电荷为亲电中心,容纳正电荷能力差很 不稳定,易受攻击发生亲核加成反应
❖ 羰基氧为亲核中心具有容纳负电荷能力比较稳定
55
Dieckman酯缩合反应:
❖ 当可能生成两种产物时,较稳定的烯醇优先生成, 即失去酸性较大的α-氢生成较稳定的碳负离子
CH3 EtOOCCH2(CH2)2CHCOOEt
EtONa H3C 二甲苯
O
×
O COOEt
COOEt CH3
56
酯酮缩合
❖ 酮的α-碳进攻酯羰基开始,通过缩合失去一 分子醇而生成β-二酮
烃 代 亚 甲 基 三 苯 基 膦
❖ 季鏻盐酸性较弱,要强碱(C6H6Li)才能夺取其中的 质子
28
❖ 季鏻盐的α-位有强吸电子基,则酸性 增强,用普通碱可制备磷叶立德:
29
叶立德与羰基反应:引入碳-碳双键
❖ 反应历程:四元环过渡态
30
含碳亲核试剂的反应
❖ 羟醛缩合(生成β- 羟基醛酮或αβ-不饱和醛酮)
❖ 含活泼氢的化合物。
❖ CHCOR,CHCO2R, CHCO2H,CHCN,CHNO2, RC≡CH,ROH,RSH及苯酚羟基邻、对位的H
23
醛、酮羰基的烯化——Wittig(维荻 许)反应
❖ 1954年 G.Wittig发现该反应 ❖ 1979年 获 Nobel Price ❖ 醛与酮与磷叶立德(ylide)反应生成烯
醛、酮的亲核加成反应

(2)分 离
油层
水层
CH3CCH2CH2CH2CH3 NaCl, H2O, (H2SO3) O
3.与醇的加成
R
无水HCl R OH
H C O + R''OH ( R' )
C H OR'' ( R' )
R''OH
R C
OR'' + H2O
干HCl H OR''
( R' )
半缩醛(酮) 不稳定 一般不能分离出来
δ δO CC
H
R (H )
酸和亲电试剂进攻富电子的氧 碱和亲核试剂进攻缺电子的碳
涉及醛的反应(氧化反应 ) α H 的反应 羟醛缩合反应
卤代反应
一、羰基的亲核加成反应
醛酮分子中的羰基是不饱和键,其中π键比较活泼,容易断裂,可 以和氢氰酸、亚硫酸氢钠、醇、格氏试剂以及氨的衍生物等发生加成反 应。
1.与氢氰酸加成
ccrohh酸和亲电试剂进攻富电子的氧碱和亲核试剂进攻缺电子的碳涉及醛的反应氧化反应h的反应羟醛缩合反应卤代反应一羰基的亲核加成反应醛酮分子中的羰基是不饱和键其中键比较活泼容易断裂可以和氢氰酸亚硫酸氢钠醇格氏试剂以及氨的衍生物等发生加成反应
第八章 醛、酮、醌
8.2醛、酮的亲核加成反应
醛、酮的反应与结构关系一般描述如下:
苯肼
NH2 NH
2,4-二硝基苯肼 NH2 NH
NO2
O2N
这些氨的衍生物可以与醛酮发生加成反应,产物不稳 定,容易进一步脱水生成相应的肟、腙、苯腙、2,4-二 硝基苯腙。
H
加成
C O + HN Y
醛反应生成碳碳双键

醛反应生成碳碳双键该反应的机理和应用。
醛反应生成碳碳双键是一种重要的有机反应,主要用于有机合成中的构建碳碳双键和环的形成。
本文将以这一主题为基础,详细探讨该反应的机理和应用,并对相关案例进行分析和总结。
一、醛反应生成碳碳双键的机理该反应主要包括Michael反应、Claisen缩合反应、Wittig反应以及Horner-Wadsworth-Emmons反应等多个类型。
1. Michael反应Michael反应,又称Michael加成反应,是指在有机化学合成中,利用1,4-加成反应,通过醛或酮与含有α,β-不饱和键(如丙烯酰亚胺等)的化合物进行加成反应,产生碳-碳双键的合成方法。
该反应示意图如下:[pic]具体来说,Michael反应的反应机理如下:首先,酮或醛亲核加成到不饱和亚胺上,生成一个负离子中间体。
接着,在中间体的羰基上发生亲核加成反应,形成一个四元环中间体。
最后,经过环内的质子转移和酸碱中和反应,生成最终的产物,其中的碳碳双键就是通过这一系列反应步骤得到的。
2. Claisten缩合反应Claisen缩合反应是有机合成中的一种烷基乙烯类化合物的构建方法,通过醛或酮与简单的酯分子相互反应,形成α-酮酯。
[pic]该反应的机理可总结为以下几个步骤:1. 亲核加成醛或酮作为亲核发生攻击,在反应条件下,与酯的另一个羰基发生酯转移反应,形成临时的负离子过渡态。
2. β-消除此时该负离子中间体中的α-质子发生β-消除,形成α-β-不饱和中间体。
3. 先进攻再挤排此时由于α-β-不饱和中间体具有较好的亲电性,因此会发生另一个酸催化下的亲核加成过程。
但是加成到哪里呢?实验结果发现,下一步反应的位置取决于反应中氢原子的酸性,一般情况下,较酸性的氢原子亲核活性较强,容易被攻击,在反应中发生先进攻再挤排的过程,最终形成了加成产物。
4. 还原反应在失去酸性α-质子后,其余的化合物结构产物经过还原反应,得到了最终的α-酮酯产物。
有机合成面试常见反应机理

有机合成面试常见反应机理Baeyer-Villiger 反应反应机理:过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
Beckmann 重排反应肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例Cannizzaro 反应凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
具有α-活泼氢原子的醛和甲醛首先发生羟醛缩合反应,得到无α-活泼氢原子的β-羟基醛,然后再与甲醛进行交叉Cannizzaro反应,如乙醛和甲醛反应得到:反应机理醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
羰基的亲核加成及相关反应

O H CCCR (H )
a-炔基醇
•进一步应用
H OH C CC CR
炔基醇
H2 Lindlar催化剂
Na / NH3
H2O/ Hg++ H C
R=H
OH
C
R
CC
H
H
cis-烯基醇
OH
C
H
CC
trans-烯基醇
H
R
OH O
H+
C C CH3
O
C
CC
CH3
a-羟基酮
羰基的亲核加成及相关反应
a, b-不饱和酮
醛酮与金属试剂加成的立体化学 —— Cram规则
手性碳
2.5
1
•Cram的解释
Small
Medium
O
H
Et CH3MgBr
Br
Mg
O
H3C H
Et
OH
H
Et
HPh
Large
HPh
位阻大
Cram规则:羰基氧在S与M 之间,试剂从S一边进攻。
羰基的亲核加成及相关反应
H3C
H
Ph
主要产物
1.3 醛酮与LiAlH4 或 NaBH4 还原反应
N H 2
H 2 O /H +
CC N
o r O H
a-氨基腈
羰基的亲核加成及相关反应
N H 2 CC O O H
a-氨基酸
Strecker反应机理
O
H NH3
OH
OH
C
C
C
CN C
NH2
亚胺正离子
NH3 NH2 C CN
NH3 H2O/ H+ or OH
有机化学:第十三章 羰基化合物的亲核加成和取代反应

O a. H3C C O
O c. H3C C O CH3
O b. H3C C O
O d. H3C C O
NO2 OCH3
10
例题与习题
解答: 酸性按如下顺序降低
b. HO pKa
NO2 a. HO
< 10
~ 10
d. HO
OCH3 c. HO CH3
> 10
15.5
相应的烷氧基负离子碱性则按如下顺序降低
OM
L R Smajor Nu
OE
L
M
OE
M
S
R
Nu
S
主要产物
R
Nu
L
16
二、羰基的亲核加成
1. Introduction (3) Stereochemistry
1974年,Bürgi 和Dunitz指出,亲核试剂一般沿着与羰基 107º的角度进攻羰基碳原子,这样,亲核试剂的HOMO(孤
对电子所在的p轨道)可以最有效地与羰基的LUMO(p * 轨 道)重叠,形成s -键。而且也使得亲核试剂的负电荷与氧上
b. O
NO2 a. O
d. O
OCH3 c. O CH3
basicity increasing, the reactivity decreasing
11
二、羰基的亲核加成
1. Introduction
(1) Nucleophiles 负离子亲核试剂(碱性条件):
¯OH、¯OR、¯SR、¯H、¯C≡N、¯C≡CR、 ¯CR3(M-R) 中性分子亲核试剂(中性或酸性条件): HOH、HOR、HSR、NH3、H2NR、HNR2
R CR' 2.H3O
wittig反应

wittig反应羰基用磷叶立德变为烯烃,称Wittig 反应(叶立德反应、维蒂希反应)。
这是一个非常有价值的合成方法,用于从醛、酮直接合成烯烃。
基本介绍:本反应是由仲烃基溴(较典型)与三苯磷作用生成叶立德(Ylides,分子内两性离子),后者与醛或酮反应(Wittig 反应),给出烯烃和氧化三苯磷,反应形式这是极有价值的合成烯烃的一般方法。
根据中间体叶立德的稳定性可分为不稳定的叶立德的反应和稳定的叶立德的反应。
1.不稳定的叶立德的反应当 RR'CHBr 中,R 和R' 是氢原子或简单烷基,则烃基三苯基磷盐的α-H 酸性较弱,需较强的碱(常用叔丁基锂或苯基锂)才能生成叶立德,刚生成的叶立德活性很高,是类似格氏试剂那样强的亲核试剂,能迅速地在温和条件下与醛或酮起反应给出加成物,反应不可逆。
加成物可自发分解给出烯烃。
产物如有立体异构,则一般得到 E 和 Z 的混合物。
如用苯基锂制备叶立德,并且使反应在较低温度下进行,则产物以 E 异构体为主。
2.稳定的叶立德的反应当 RR'CHBr 中,R 或R' 是一个-M 基团(吸电子基团,如酯基),则烃基三苯基磷盐的去质子化可以在较弱的碱性条件下实现,并且产生的叶立德较稳定,可以分离,其活性相对较弱,一般需与亲电性较强的羰基反应。
当产物有主体异构存在时,E- 异构体通常占优。
应用:一、Wittig反应的主要用于合成各种含烯键的化合物。
(1)环外烯键化合物的合成:Wittig反应生成的烯键处于原来的羰基位置,一般不会发生异构化,可以制得能量上不利的环外双键化合物。
例:(2)共轭多烯化合物的合成:Wittig试剂与α,β-不饱和醛反应时,不发生1,4-加成,双键位置固定。
利用此特性可合成许多共轭多烯化合物。
如β-胡萝卜素的合成二、Wittig反应用于制备醛和酮:采用α-卤代醚制成Wittig试剂,然后与醛或酮反应得烯醚化合物,再经水解生成醛,提供了合成醛、酮的一个新方法。
羰基化合物的亲核加成和取代反应

含C亲核试剂
¯CN
二、羰基的亲核加成
含C亲核试剂 ¯C≡CR
二、羰基的亲核加成
4. 含C亲核试剂 (3) 有机金属试剂 格氏试剂、有机锂试剂等 广泛用于合成各级醇及羧酸等有机物 格氏试剂的应用---由醛酮合成各级醇
格氏试剂的应用---由羧酸衍生物合成醇 格氏试剂的应用---其他
格氏试剂的应用总览
低温和空间位阻作用以及使用不活泼的金属试剂可能将反应控制在酮的阶段
格氏试剂的应用---由醛酮合成各级醇
二、羰基的亲核加成
1
含C亲核试剂
2
Ylide试剂
3
Ylide 试剂是一类化合物,其中两个相邻原子具有完整的八隅体电子构型,而这两个原子却分别带有不同的电荷,典型的ylide 试剂有磷ylide试剂( phosphonium ylide):
影响 1,2- 和 1,4- 加成的因素:
亲核试剂的碱性
Explanation:
-- Direct addition is irreversible (不可逆, strong base) or reversible (可逆, weak base).
-- Conjugated addition is irreversible.
R2NH 经历亲核加成和脱水两个步骤 脱水发生在羰基的a-C上,形成烯胺(enamine)
1
2
R2NH
思考题:写出2-甲基环己酮与仲胺反应的产物
二、羰基的亲核加成
含N亲核试剂 R2NH 反应可逆,经酸水解可得回醛酮。
醛酮可以通过烯胺进行α-烷基化和α-酰基化反应,合成上应用广泛(见第十四章)
二、羰基的亲核加成
二、羰基的亲核加成
含O, S亲核试剂 包括H2O, ROH, RSH和NaHSO3。可逆反应。 H2O(水合反应)
witting的反应
Wittig反应
Wittig反应(维蒂希反应)是醛或酮与磷叶立德(Wittig试剂)发生亲核加成生成烯烃反应,该反应由德国化学家Georg Wittig在1954年发现,为此他获得了1979年的诺贝尔化学奖。
Wittig反应在烯烃合成上有着广泛的应用,可用于合成双键位置确定的烯烃。
Wittig反应的反应物一般是醛/酮和单取代的磷鎓内盐。
使用活泼叶立德时所得产物一般都是Z型的,或Z/E异构体比例相当;而使用比较稳定的叶立德时,或在Schlosser改进的条件下,产物则以E型为主。
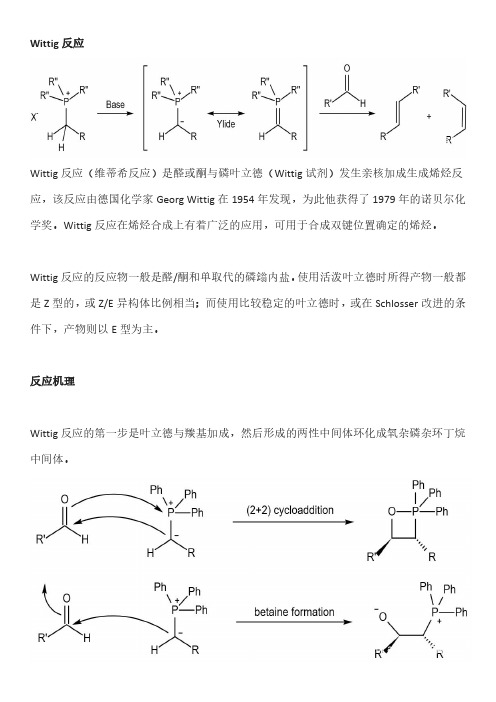
反应机理
Wittig反应的第一步是叶立德与羰基加成,然后形成的两性中间体环化成氧杂磷杂环丁烷中间体。
环碎裂后生成烯烃和三取代基氧膦。
磷和氧原子的作用力非常强是本反应的动力。
对于活泼的Wittig试剂而言,与醛和酮反应时第一步的速率都较快,但成环反应速率较慢,是速控步。
但对于稳定的叶立德而言,R基团可以稳定碳上的负电荷,第一步是速控步。
因此总体的成烯反应速率减小,而且生成的烯烃中E型比例较大。
这也是不活泼的Wittig 试剂与有位阻的酮反应很慢的缘故。
醛、酮的亲核加成反应

OH C H SO3Na
R
R C=O + NaCl + SO2↑ + H2O H R C=O + Na2SO3 + CO2↑ + H2O H
鉴别醛酮。
应用 与NaCN反应制取羟腈化合物。
分离、提纯醛、酮化合物。
稀 NaHCO 3 R OH NaHSO 3 R C O C H H 稀 HCl SO3Na ( R' ) ( R' ) 杂质不反应,分离去掉
所用醛和格氏试剂可有两种选择:(1)断裂
选择RMgX和RˊCHO;(2)断裂 RˊMgX。
,选择RCHO和
OH
若合成叔醇
R C R '
R
''
,可选择三种不同的格氏试剂和
相应的酮来制备。 5.与氨的衍生物加成 氨分子中氢原子被其它原子或基团取代后的生成物叫 做氨的衍生物。 举例: 羟胺 苯肼 NH2—OH
CH3CH 2CCH 2CH2CH 3 , H O, NaHSO 2 3 O
CH3CCH 2CH2CH2CH 3 O
NaCl, H2O, (H2SO3)
3.与醇的加成
R 无水HCl R OH C O + R''OH C H H OR'' ( R' ) ( R' ) 半缩醛(酮 ) 不稳定 一般不能分离出来 R''OH 干 HCl R H ( R' ) C OR'' OR'' + H2O
CH 3OH H
CH 3 CH 2=C-COOCH 3
练习:
(1) CHO
维蒂希反应(Wittig反应)

反应机理经典机理维蒂希反应的经典机理为:Ph3P + CH3Br → Ph3P+-CH3·Br− -(干燥乙醚,PhLi)→Ph3P+-CH2−它也是另一种合成维蒂希试剂方法的原料。
合成时一般不将它分离出来,而直接进行下一步的反应。
至于取代叶立德,可先用卤代烃R−CH2−X烷基化Ph3P=CH2,得到一个取代的鏻盐:不对称胺反应时,反应由动力学控制,较少烷基取代的β-碳上的氢由于酸性较强,位阻较小,因此优先被消除,产物主要是不稳定的取代较少的烯烃。
这个规则与查依采夫规则相反,称为霍夫曼规则(Hofmann规则)。
β-碳上连有苯基、乙烯基、羰基等取代基时,由于共轭和吸电子效应,未取代的β-碳上氢的酸性较弱,因此反应不符合Hofmann规则。
连有强吸电子基团的化合物容易按Hofmann规则发生E2消除。
霍夫曼消除可用于合成用其他方法难以合成的烯烃。
由于一级、二级和三级胺引入的甲基数目不一样,故也可通过引入的甲基数目,来判断反应物是哪一级的胺。
反应机理麦克尔加成在立体化学上属于区域选择性反应。
亲核试剂2优先进攻β-的碳原子,生成一个烯醇盐中间体4,后者在后处理步骤中被质子化,生成一个新的饱和的羰基化合物。
伯胺、仲胺分别与对甲苯磺酰氯作用生成相应的对甲苯磺酰胺沉淀,其中伯胺生成的沉淀能溶于碱(如氢氧化钠)溶液,仲胺生成的沉淀则不溶,叔胺与对甲苯磺酰氯不反应。
此反应可用于伯仲叔胺的分离与鉴定。
一个亲电的共轭体系和一个亲核的碳负离子进行共轭加成,称为Micheal加成:反应机理反应实例。
(完整版)羰基的亲核加成及相关反应

羰基的亲核加成及相关反应羰基化合物包括醛、酮、羧酸及衍生物和CO 2。
5.1 羰基的结构CO δ+δ-亲电中心羰基碳的活性较大,易被亲核试剂进攻而发生亲核加成反应和亲核取代反应。
5.2 亲核加成反应的历程及影响因素 5.2.1 HCN 的加成 反应为碱催化。
]CN ][CO [k v ->=OH -+HCNCN -+ H 2O快-COδ+δ-CO -CNCOHCN+OH - 反应的平衡位置受电子效应和空间效应的影响。
酮正向反应的趋势较小(空阻大)。
二、亲核加成反应的一般特点 1.反应可以被酸或碱催化酸催化可提高羰基的亲电活性。
CO +H ++OH碱催化提高亲核试剂的亲核性。
NuH +OH --+H 2ONu H ->2.多数醛酮的亲核加成为可逆反应,用于分离与提纯。
5.2.2 影响羰基亲核加成反应活性的因素 一、羰基化合物的结构 1.电子效应羰基碳的正电性越大,亲核加成速度越大,反应活性越大。
羰基碳所连的吸电基(-I ,-C )使其亲核加成反应的活性增加,而供电基(+I ,+C )则使其活性降低。
活泼顺序:ClCHO > HCHO > RCHO > CH 3COR > RCOOR' > RCONR'2 > RCOO --I > +C(+C)(+C,空阻)( +C > -I)(+C)CO RR'活性极低(1)π-π共轭效应(增加其稳定性);(2)+C 效应(降低羰基碳的正电性);(3)加成产物失去共轭能,反应活化能高;(4)产物的张力大幅增加。
2.立体效应CO -sp 2活性:O CHH OC CH 3H OC CH 3CH 3O OC CH 3CH 2CH 2CH 3OC Ph Ph>>>>>二、试剂的亲核性对同一羰基化合物,试剂的亲核性越大,平衡常数越大,亲核加成越容易。
1.带负电荷的亲核试剂比起共轭酸(中性分子)的亲核性强。
wittig反应介绍

Wittig反应介绍李曼琳中国药科大学0940120目录1 前言 (2)2 Wittig试剂的制备 (3)3 Wittig反应机理[5] (4)4 Wittig反应的立体选择性 (6)5 Wittig反应在有机合成中的应用[4] (8)6 Wittig反应的改进 (11)7 总结 (15)参考文献 (16)Wittig反应介绍李曼琳0940120摘要:Wittig反应是合成烯烃最为普遍的反应,该反应产率较高,条件温和,具有高度的位置选择性。
本文就Wittig反应的机理、Wittig试剂的制备,反应立体选择性、反应的应用及改进作了介绍。
关键词:Wittig反应,Wittig-Horner反应,氮杂Wittig反应,机理,立体选择,应用1 前言1953年德国科学家Wittig发现二苯甲酮和亚甲基三苯基膦作用得到接近定量产率的1,1—二苯基乙烯和三苯氧磷[1],这个发现引起了有机合成化学工作者的高度重视,并把它称之为Wittig反应。
本反应是很重要的制备烯烃方法,Wittig也因此在1979年获得诺贝尔化学奖。
在Wittig 等人不断地实践中,人们认识到多种亚甲基化三苯膦都可以同多种醛、酮发生反应得到烯。
近年来发现许多具有d空轨道的杂原子亦能与它相连的碳负离子发生p-n共扼而趋于稳定[1],这类具有新型结构的化合物被称为叶立德(Ylid).典型的反应是有Wittig反应是有亚甲基化三苯基膦与醛或酮的反应[2]:根据R的不同,可将磷叶立德分为三类:当R为强吸电子基时(如一COOCH3,—CN等),为稳定的叶立德;当R为烷基时,为活泼的叶立德;当R为烯基或芳基时,为中等活度的叶立德.制备不同活度的叶立德所用碱的强度不同,活泼的叶立德必须用强碱(如苯基锂,丁基锂),而稳定的叶立德,由于季磷盐α—H酸性较大,故用C2H5OH甚至NaOH即可。
叶立德本身就是稳定的碳负离子化合物,这些碳负离子与羰基化合物的亲核加成反应,都是合成C—C键的重要方法。
第五章 羰基的亲核加成和相关的反应解析

R Nu C
R' OH
50% dl
②
②
前(潜)手性分子
R O- H+ C
R' Nu
R OH
C
R'
Nu
50%
二、手性羰基化合物的亲核加成
加成方向遵守Cram规则,得立体选择性的非对映异构
体产物。
小基团
S OZ LCCR
SO
L C C R + R'Z
M
大基团
中基团
M R' 非对映异构体
S R' LCCR
RL
R'
M
S
R
OZ
L
(次)
Ph
O
C
H
Br
CH3 (2R)
BH4-
优
O
H
Me
BrPh (2R)
NaBH4
Ph
Ph
H
OH HO
H
+
H
Br
H
Br
CH3 (1S,2R)
赤式(次)
CH3 (1R,2R) 苏式(主)
H
H
Me
H H Me
+
Ph
OH
Br
HO
Ph
Br
(1R,2R)
(1S,2R)
(优)
[H]
位阻大
HCN>H2O(极性与电负性) 3.同周期元素的负离子的亲核性与碱性大小一致.
R3C->R2N->RO->F-
4.同一主族元素的负离子的亲核性与可极化度大小一 致。
I->Br->Cl->F5.2.3 亲核加成反应的立体化学
醛、酮的亲核加成反应

Backmann重排的一个应用实例:
6、与磷叶立德的加成反应
R1
Ph3P=CHR +
CO
R2
Ph3P=CHR的制备
R1 C CHR
R2
Ph3P + RCH2X
碱
Ph3PCH2R X
Ph3P=CHR
- HX
Ph3P=CHR叫ylide,它也可写成:
Ph3P-CHR
机理:
R1 Ph3P-CHR + R2 C O
R1 R2 C CHR
O PPh3
R1 R2 C CHR
O PPh3
R1 R2 C CHR + Ph3P=O
Wittig反应条件温和,产率高,生成的双键位子确定,没 有重排。
7、与水加成
水也可与羰基化合物加成生成二羟基化合物,在这些化合物中 两个羟基连在同一碳原子上,叫胞二醇。但由于水是相当弱的 亲核试剂,在大多数情况下该可逆反应的平衡远远偏向左边。 然而甲醛、乙醛和α-多卤代醛酮的胞二醇在水溶液中是稳定的。
δ δO CC
H
R (H )
酸和亲电试剂进攻富电子的氧 碱和亲核试剂进攻缺电子的碳
涉及醛的反应(氧化反应 ) α H 的反应 羟醛缩合反应
卤代反应
一、羰基的亲核加成反应
醛酮分子中的羰基是不饱和键,其中π键比较活泼,容易断裂,可 以和氢氰酸、亚硫酸氢钠、醇、格氏试剂以及氨的衍生物等发生加成反 应。
1.与氢氰酸加成
举例: 用化学方法鉴别2-戊醇、2-戊酮和苯甲醚。
2-戊醇 2-戊酮 苯甲醚
卢卡斯试剂
出现混浊 X X
2,4-二 硝基苯肼
醛、酮的亲核加成反应

2-戊醇 2-戊酮 苯甲醚
卢卡斯试剂
出现混浊 X X
2,4-二 硝基苯肼
生成晶体 X
Backmann重排 酮与羟胺作用生成的酮肟在强酸作用下发生重排,生成取代的 酰胺。这种由肟变为酰胺的重排,叫贝克曼(Backmann)重排。
反应历程:
特点:(1) 在不对称的酮肟中,处于羟基反位的基 团重排到氮上;
(2)分 离
油层
水层
CH3CCH2CH2CH2CH3 NaCl, H2O, (H2SO3) O
3.与醇的加成
R
无水HCl R OH
H C O + R''OH ( R' )
C H OR'' ( R' )
R''OH
R C
OR'' + H2O
干HCl H OR''
( R' )
半缩醛(酮) 不稳定 一般不能分离出来
OH CH R '
选择RMgX和RˊCHO;(2)断裂 RˊMgX。
R
OH CH
R ',选择RCHO和
OH
若合成叔醇 R C R'' ,可选择三种不同的格氏试剂和
R'
相应的酮来制备。
5.与氨的衍生物加成
氨分子中氢原子被其它原子或基团取代后的生成物叫 做氨的衍生物。
举例: 羟胺 NH2—OH
肼 NH2—NH2
1.与氢氰酸加成
C O + HCN
OH C
CN
α 羟基睛
在少量碱催化下,醛和脂肪族甲基酮与氢氰酸加成生成氰醇(或叫
第26章 羰基的亲核加成 (2)

OH OH RC RC OR' OR' OH 2 OH 2
H H
R'OH R'OH
O O RC RC OH OH
AAC1
CH3
CH3
H3 C CH3
C-OCH3
O13
+
H
+
快 快 快
H3C
C O CH3
CH3
+
O13 H
CH3
CH3OH + H3C
CH3
C
+
慢
O13
CH3
H2O
快
慢
H3C
C O
CH3
O CH2=CHCH2Cl O CH2-CH=CH2
O
O CH2-CH=CH2 CH2=CHCH2Cl
O [ CH2-CH=CH2 ]2
避免多烃化方法:烯醇盐滴加到烃化剂中
O
O
CH2=CHCH2CI
CH2-CH = CH2
O
O CH2-CH = CH2
CH2 = CHCH2 CI O
(CH2-CH = CH2)2
羟醛缩合反应复习 - 定向羟醛缩合反应
Charles-Adolphe Wurtz
亚历山大· 鲍罗丁
复习:几类烯醇负离子的反应
O R C L O C C O C R
酰基化
O O C C O R X C C R
烷基化
醛、酮或酯
C C
C
O C C C CH
O C
共轭加成 (Michael加成)
酮直接烃化的副产物是多烃化
复习:酯的酰基化——酯缩合反应
Claisen (酯)缩合(两个相同酯之间的缩合)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羰基的亲核加成反应→ 与魏悌希(Wittig)试剂的反应
与魏悌希(Wittig)试剂的反应。
由卤代烷与三苯基膦作用,生成季鏻盐:
磷原子α位的氢被带正电荷的磷活化,能与强碱(如苯基锂或乙醇钠等)结合,生成魏悌希试剂:
魏悌希试剂又称磷叶里德(Phosphous Ylid),其结构式可用下式表示:
核磁共振谱分析结果表明,磷叶里德主要是左边的极性结构,而烯式的双键即使有也是微量的,它的分子内含有负碳离子,和负碳离子相邻的磷原子带正电荷。
除磷外,杂原子还可以是硫、氮、砷和锑。
对磷叶里德的研
究比较多,合成上常用的典型例子就是亚甲基三苯基膦,即Ph P CH或Ph P=CH或取代亚甲基三苯膦Ph P=
CR。
磷叶里德的χ射线结晶结构研究表明,碳原子为平面结构,即为sp杂化。
而磷为sp杂化,有四个σ键,已满足八电子体系,但磷是第三周期元素,外层除3s、3p轨道外,还有3d空轨道可以与负碳离子的一对p电子发生重叠,便形成p-dπ键,此π键具有很强的极性。
所以魏悌希试剂是良好的亲核试剂,可与醛、酮的羰基进行亲核加成反应。
魏悌希试剂与醛、酮作用,首先发生加成反应,加成产物形成一个四元环中间体,随后在温和的条件下分解为氧化三苯基膦和烯烃,这一反应过程称为魏悌希反应:
如用魏悌希试剂与环己酮反应可合成亚甲基环己烷:
反应结果是醛、酮分子中羰基上的氧原子被亚甲基取代。
此反应可在某些“困难的”位置引进双键。
魏悌希反应操作简便,条件温和,产率比较高,双键位置肯定。
因此广泛用于烯烃的合成,特别是在用来合成天然产物上受到重视。
