GMP认证工作计划(最终稿)
药品生产企业GMP认证全过程的工作方案

要求,认证机构有权暂停或撤销企业的GMP证书。
审核结果
01
认证通过
药品生产企业符合GMP要求,审核结论为通过,认证机构将发放GMP
证书。
02
认证不通过
药品生产企业未达到GMP要求,审核结论为不通过,认证机构将要求
企业进行整改并重新申请认证。
03
认证暂停或撤销
在认证有效期内,如果药品生产企业出现严重质量问题或违反相关法规
等问题。
A
B
C
D
质量管理体系问题
人员培训问题
员工对GMP规范不了解或操作技能不足, 可能影响药品生产的质量和效率。
06 GMP认证常见问题与解 决方案
解决方案
设备更新与维护
定期对设备进行更新和维修,确保设 备性能良好、符合GMP要求。
优化生产流程
对生产流程进行全面审查和优化,确 保流程合理、操作规范、记录完整。
加强人员培训
定期组织员工参加GMP培训和技能 提升课程,提高员工的GMP意识和 操作技能。
完善质量管理体系
建立健全的质量管理体系,并确保其 得到有效执行,以提高药品生产的质 量和稳定性。
常见问题
生产流程问题
生产流程设计不合理、操作不规范或记录 不完整,可能导致生产出的药品质量不稳
定或不符合标准。
生产设备问题
设备老化、维护不当或设备配置不 符合GMP要求,可能导致药品生产 过程中出现交叉污染、微生物超标
将申请材料递交至所在地的 省级食品药品监督管理部门 。
缴纳费用
按照规定的标准缴纳GMP认 证申请费用。
现场检查
检查通知
在申请材料审查通过后,国家食品药 品监督管理总局会通知企业进行现场 检查。
新版GMP验证总计划

验证总计划起草审核批准分发目录1. 验证方针与本文件的目的 (4)1.1 验证方针 (4)1.2 本文件的目的 (4)2. 简介 (5)2.1 公司基本情况 (5)2.2 生产区域概述 (5)2.3 工艺概述 (6)2.4 产品目录 (6)3. 目的、范围、要求 (7)3.1 本验证总计划制定的目的 (7)3.2 验证范围 (8)3.3 验证基本要求 (8)4. 验证组织结构及人员职责 (9)4.1 组织结构图 (9)4.2 职责 (10)5. 验证文件 (12)5.1 文件范围 (12)5.2 验证方案 (13)5.3验证报告 (13)5.4 验证记录 (14)5.5 验证报告 (14)5.6 验证文件编号 (14)5.7 验证文件归档 (14)6. 实施过程 (14)6.1 实施前的准备 (14)6.2 方法和可接受标准 (15)6.3 验证步骤 (16)6.4 确认 (16)6.5 验证 (17)6.6 偏差处理 (20)6.7 变更控制 (20)7. 验证状态维护 (20)8. 附录 (20)1. 验证方针与本文件的目的1.1验证方针GMP勺目的是保证生产出符合既定质量标准的药品,而验证则是实现GM这个目的的基石,是证明和保证一切关键生产要素,包括设施、系统、仪器设备、生产工艺、分析方法、清洁规程以及消毒/灭菌规程符合既定要求的公认方法。
没有良好有效的验证工作,就谈不上GMP管理体系的有效,也就无法保证药品的质量。
因此,验证工作是GMP f理的最重要工作之一。
鉴于验证工作的如此重要性,本公司将验证工作放在GMP管理的重要位置,并给予高度重视。
为此提出下列验证方针:充分认识,高度重视;建立规程、依规行事;客观记录、慎重结论;资源保证。
所有新的关键方法、规程、工艺及新的关键系统、设备在投入使用前应经验证。
当发生的变更影响产品质量时,所涉及的变更应经过验证。
当验证状态发生漂移时应进行再验证。
关键工艺参数和关键工艺步骤应进行验证。
GMP验证总计划范例

标准管理规程(STANDARD MANAGEMENT PROCEDURE )一、目的:验证总计划是指导验证的纲领性文件,使具体的项目验证有组织、有计划、有步骤的实施,使各项验证必须依据计划起草、审批和实施,增加公司对GMP落实责任,是提高产品质量与安全的保证措施。
二、适用范围:厂房设施和公用系统验证、仪器校验与检验方法验证、设备验证、清洁消毒验证、工艺验证等所有验证。
三、责任人:验证总负责人:负责批准验证方案和验证报告。
验证小组组长:负责审核验证方案和验证报告,协调验证工作顺利实施,对验证结果进行评价。
验证委员会其他人员:负责审核验证方案和验证报告,协调验证工作,为验证提供足够的资源。
验证小组成员:负责验证方案和报告的起草,数据收集,样品检验等具体工作。
四、正文:1、验证总计划方针:通过验证确立控制生产过程的运行标准,通过对已验证状态进行监控,控制整个工艺过程,确保质量,并不断通过验证、建立标准、监控、再验证、再建立标准的循环动态控制为指导方针。
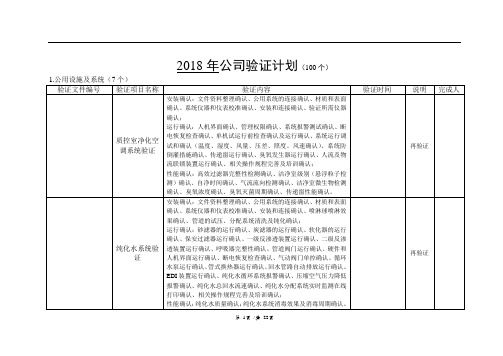
2、验证总计划范围:2.1验证范围分为五大类,分别为:2.1.1厂房设施、空调净化及公用系统验证;包括洁净厂房与设施的验证、空调净化系统的验证、纯化水系统验证、直接接触食品的压缩空气系统验证等。
2.1.2仪器校验;包含检验用精密仪器(带分析功能)3Q验证。
2.1.3设备验证;包含生产关键设备验证、检验用关键设备验证2.1.4清洁消毒验证;包含生产关键设备的清洁验证、容器具清洁验证、环境消毒效果验证等。
2.1.5工艺验证包含产品工艺验证3、依据的法律法规:3.1《药品生产质量管理规范》---国家食品药品监督管理局发布。
3.2《药品生产验证指南》---国家食品药品监督管理局组织编写。
3.3中国药典---对检验方法验证的指南。
五、术语和定义:1、验证:证明任何程序、生产过程、设备、物料、活动或系统确实能达到预期结果的有文件证明的一系列活动。
2、合格证明:常指某一机器设备/设施安装后经检查和运行,或某项工艺的运行达到设计要求而准于交付使用的证明性文件。
食品GMP认证计划书

食品GMP认证计划书引言食品GMP(Good Manufacturing Practice)是指符合食品生产过程中的卫生要求和质量管理系统的一系列规范和标准。
GMP认证是食品企业获得国际认可并提升产品质量的重要途径之一。
本计划书旨在介绍食品GMP认证的重要性,并提出实施认证的计划和具体措施。
1. 认证目标本次食品GMP认证的目标是提升企业产品的质量管理水平,确保生产过程中的卫生要求得到满足,并为食品企业打开国际市场、增强产品竞争力奠定基础。
2. 认证依据本次认证的依据主要有以下国家和国际标准:•食品药品监督管理局发布的《药品生产质量管理规范(GMP)》•国际食物法典委员会(Codex Alimentarius Commission)制定的《食品生产规范》•国际标准化组织(ISO)发布的GMP相关标准3. 认证计划3.1 认证准备阶段在认证准备阶段,我们将进行以下活动:•明确认证的目标和范围•建立项目团队并确定各成员的工作职责•分析当前生产过程中的卫生和质量管理问题,制定改进计划•制定实施GMP的时间表和计划,并进行风险评估3.2 认证实施阶段在认证实施阶段,我们将执行以下主要任务:•制定和修订标准操作程序(SOP),确保所有操作符合GMP要求•提供必要的培训和培训材料,使员工了解和遵守GMP准则•对设备和设施进行验证和校准,保证其符合GMP要求•建立监控和验证体系,定期检查生产过程中的卫生和质量控制指标•建立记录和档案管理系统,确保生产过程中的数据可追溯•建立供应商评估和管理体系,确保所采购的原辅材料符合GMP要求3.3 认证审核阶段在认证审核阶段,我们将进行以下主要活动:•建立内部审核程序,对GMP实施情况进行定期自查•委托第三方认证机构进行外部认证审核•根据认证机构提供的审核报告进行改进和纠正措施•准备认证所需的文件和资料,并进行认证申请4. 认证实施措施为了确保食品GMP认证的顺利实施,我们将采取以下措施:•成立GMP项目组,并确保每个成员了解其职责和工作范围•制定详细的实施计划和时间表,并进行动态跟踪和管理•建立内部培训计划,培训员工了解和遵守GMP要求•定期开展内部自查和审核,及时发现和纠正问题•与外部专家和认证机构密切合作,确保认证过程的顺利进行•提供必要的资源和支持,确保认证实施工作的顺利进行结论食品GMP认证是食品企业提升产品质量和竞争力的重要手段。
药企 产品质量 工作计划 gmp

药企产品质量工作计划gmp1.引言概述部分是文章引言的一部分,主要是介绍文章的主题和背景。
在这里,我们可以引入药企产品质量工作计划和GMP(Good Manufacturing Practice,良好生产规范)的概念,以及它们在制药行业中的重要性。
我们可以按照以下方式来编写1.1 概述部分的内容:概述部分:在当前的药品市场中,药企产品质量管理成为了重要议题。
为了保证药品的质量和安全性,药企需要制定有效的工作计划,并严格遵循GMP 的要求。
药企工作计划是指药企针对产品质量管理制定的一项具体计划,旨在优化药品生产过程,确保产品的质量与安全性。
其目标是通过设定具体目标和制定详细的行动计划,推动药企在产品质量方面取得可持续的进步。
产品质量管理是药企工作计划中的核心内容,它涉及到从原料采购到成品制造和出厂的整个生产过程中,各个环节的质量控制和监督措施。
通过建立合理的质量控制流程和有效的质量监督措施,药企可以确保产品的质量符合相关法规和标准要求。
而GMP则是药品行业通行的生产管理规范。
GMP的严格遵循和实施,对于药企来说是至关重要的。
它不仅可以确保药品生产过程的合规性,还可以提高药品的质量稳定性和安全性。
因此,药企需要根据GMP的要求制定相应的实施步骤,并加强对员工的培训和监督,以确保GMP措施的有效实施。
通过本篇文章,我们将详细探讨药企工作计划的目标设定和行动计划、产品质量管理的质量控制流程和监督措施,以及GMP的重要性和实施步骤。
通过深入了解这些内容,我们可以更好地认识到药企产品质量管理和GMP的重要性,以及它们对于药品行业的意义和影响。
1.2 文章结构文章结构部分的内容应该包括以下方面:文章结构是指整篇文章的框架和组织形式,它决定了内容的呈现方式和逻辑关系。
在本文中,文章结构分为引言、正文和结论三个主要部分。
引言部分用于引入文章的主题和背景,向读者介绍文章要讨论的问题,并提出文章的目的和意义。
正文部分是本文的主体部分,它包括药企工作计划、产品质量管理和GMP遵循与实施三个小节。
GMP认证工作计划(最终稿)
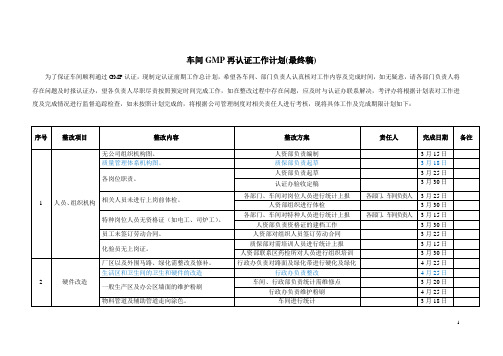
车间GMP再认证工作计划(最终稿)
为了保证车间顺利通过GMP认证,现制定认证前期工作总计划,希望各车间、部门负责人认真核对工作内容及完成时间,如无疑意,请各部门负责人将存在问题及时报认证办,望各负责人尽职尽责按照预定时间完成工作,如在整改过程中存在问题,应及时与认证办联系解决,考评办将根据计划表对工作进度及完成情况进行监督追踪检查,如未按照计划完成的,将根据公司管理制度对相关责任人进行考核,现将具体工作及完成期限计划如下:
以上认证计划只是GMP认证的前期工作计划,但是在实施过程中还会有新的问题出现,对出现的新问题也将已同样的方式处理,希望各部门、车间对新出现的问题能够积极整改。
围绕gmp方面的工作计划和目标

围绕gmp方面的工作计划和目标Working Plan and Goals for GMPIntroduction:GMP (Good Manufacturing Practice) is a set of guidelines and regulations that ensure the quality, safety, and efficacy of pharmaceutical products. As a critical aspect of the pharmaceutical industry, GMP plays a crucial role in maintaining public health and trust. In this response, I will outline a comprehensive working plan and discuss the goals associated with GMP from various perspectives.1. Regulatory Compliance:One of the primary goals of any pharmaceutical company is to comply with GMP regulations. This involves establishing and maintaining robust quality systems, implementing standard operating procedures (SOPs), andconducting regular audits. The working plan should include a thorough review of existing processes, identification of gaps, and development of strategies to address those gaps. By achieving regulatory compliance, companies can ensure the production of safe and effective medicines, leading to improved patient outcomes and trust in the industry.2. Quality Assurance:Quality assurance is a fundamental aspect of GMP. It encompasses all activities and systems that ensure the quality of pharmaceutical products. The working plan should focus on implementing quality control measures throughout the manufacturing process, starting from raw material procurement to the final product release. This includes rigorous testing, validation of analytical methods, and adherence to specifications. By prioritizing quality assurance, companies can minimize the risk of product recalls, improve customer satisfaction, and maintain a competitive edge in the market.3. Risk Management:Effective risk management is essential in GMP to identify, assess, and mitigate potential risks that could impact product quality. The working plan should incorporate a comprehensive risk assessment process, including the identification of critical control points, hazard analysis, and implementation of risk mitigation strategies. By proactively managing risks, companies can prevent quality issues, reduce manufacturing costs, and ensure the safety and efficacy of their products.4. Continuous Improvement:Continuous improvement is a key objective of GMP, aiming to enhance manufacturing processes and systems continually. The working plan should include mechanisms for collecting and analyzing data, such as process deviations, customer complaints, and quality metrics. This data-driven approach will enable companies to identify areas for improvement, implement corrective actions, and optimize their manufacturing operations. By fostering a culture of continuous improvement, companies can achieve operationalexcellence, reduce waste, and enhance overall efficiency.5. Training and Development:Investing in the training and development of employees is crucial for successful GMP implementation. The working plan should include comprehensive training programs to ensure that all personnel involved in manufacturing processes have the necessary knowledge and skills. This includes training on GMP principles, SOPs, quality control techniques, and regulatory requirements. By equipping employees with the right expertise, companies can enhance product quality, reduce errors, and foster a culture of compliance and accountability.6. Supplier Management:Supplier management is a critical aspect of GMP, as the quality of raw materials and components directly impacts the final product. The working plan should outline processes for selecting, qualifying, and monitoring suppliers based on their adherence to GMP standards. Thisincludes conducting audits, establishing quality agreements, and implementing robust supplier qualification programs. By effectively managing suppliers, companies can ensure a consistent supply of high-quality materials, minimize the risk of contamination, and maintain the integrity of their products.Conclusion:In conclusion, the working plan for GMP should encompass various aspects to ensure regulatory compliance, enhance quality assurance, manage risks, drive continuous improvement, invest in employee training, and effectively manage suppliers. By prioritizing these goals, pharmaceutical companies can produce safe, effective, and high-quality medicines, ultimately benefiting patients and maintaining the reputation of the industry.。
新版_GMP验证总计划

新版GMPR认证总计划1.概述1.1 本次认证的四车间位于龙井市工业集中区,总占地面积24000平方米,建筑面积 m2,分为生产区和仓库。
生产区面积 m2,仓库面积 m2。
主要生产塑料瓶大输液,大容量注射剂设备年生产能力为:万瓶,注册个品种。
1.2 四车间塑料瓶大输液生产线按照GMP标准设计。
四车间塑料瓶大输液生产线电力为龙井开发区统一提供,蒸汽、冷却水、纯化水及注射用水为自产自供,生产线内有独立的电气控制系统、压缩空气及排污系统。
其中纯化水、注射用水系统采用闭路循环方式供水,每个用水点由送水和回水管道组成,且管路中无盲点和死角。
在洁净区的每个用水点均设置了取样口,系统的总送水口和总回水口也设置了单独的取样口,水质检测严格按SOP有关文件执行。
洁净区压缩空气使用前经过过滤处理。
四车间塑料瓶输液生产线有独立的中央空调系统,用于洁净区新鲜空气的补充,以及空气的净化,温湿度调节和维持不同洁净区间压差,该系统由两套独立的空调机组,送回风管道系统和初中高效过滤器理构成。
其中空调机组对空气进行净化和热湿处理;空气输送设备包括送/回风机、风管系统调节风阀等,把处理好的空气按一定要求输送到各空调房间,并从房间内抽回或排除一定数量的空气;空气分布装置,即各空调房间内的送/回风口,其作第 1 页共7 页用为合理组织室内气流,以保证工作区内所要求的空气温湿度、气流速度及洁净度。
四车间塑料瓶输液生产线采用吹灌封(BFS)技术。
该技术由机械自动连续完成容器的整个吹塑、产品的罐装和封口的过程,该设备自身配备了0.22um除菌过滤器、管坯的空气过滤器及无菌空间的空气过滤器,实现了在线清洁(CIP)和在线灭菌(SIP)的全自动运行,达到减少操作人员与产品的接触,降低对产品污染风险的目的。
2.验证目的确保四车间生产环境、设施、设备运行符合《GMP》要求,生产出的产品质量符合标准。
3.适用范围用于开发区四车间大输液GMP认证证。
4. 组织机构及其职责4.1 设立验证组织机构全面负责组织验证、验证工作的协调;并对验证工作实施监督和验证文档管理。
GMP认证工作计划(最终稿)

GMP认证工作计划(最终稿)背景和概述GMP(Good Manufacturing Practice)是指制药行业为保证药品质量,按照一定的质量管理、生产管理、设备管理、人员管理和文件管理要求,实施的一系列制度、规范和标准化操作。
GMP认证是指符合GMP标准的制药企业经过认证机构评估,合格后颁发的证书。
GMP认证是制药企业质量管理工作中非常重要的一项工作。
通过GMP认证,制药企业可以保证产品质量符合国家相关要求,提高生产效率和管理水平,增强市场竞争力,得到投资人和客户的信任。
本文档旨在对GMP认证工作进行规划和安排,确保认证工作顺利进行和达到预期的目标。
认证目标•提高制药企业的管理水平和生产效率•符合国家相关要求,保证产品质量•增强企业市场竞争力,提高品牌影响力认证计划确定认证流程与时间点1.建立GMP认证工作小组,并分配工作任务和时间节点。
2.在第二季度开始对制药企业进行GMP认证前评估和现场检查,预计耗时2个月。
3.在第三季度结束前完成认证申请,确保认证机构能在第四季度进行评估和审核,预计耗时1个月。
4.在第五季度之前完成整改和追踪,保证最终达到认证要求。
确定认证范围和重点1.整理相关文件和资料,确定认证范围和重点。
2.重点关注制药生产、质量管理、设备管理、环境管理、培训和文件管理等方面。
3.根据评估情况和认证要求逐项修改和完善相关制度和标准。
加强人员培训和宣传1.组织内部员工进行GMP相关培训和考试,确保员工理解和掌握GMP要求。
2.加强GMP管理制度的宣传和实施,确保员工深入贯彻和实施。
完善设施和供应商管理1.根据GMP要求,完善设施、设备的管理和保养制度。
2.加强与供应商的合作和管理,确保供应商也符合GMP要求。
确保GMP管理制度的有效实施1.制定详细的GMP操作规程和工作指南,确保员工严格按照标准操作。
2.加强内部监测和管理,确保GMP管理制度的有效实施。
合理规划和分配工作任务1.按照认证计划和工作安排,合理分配工作任务。
(完整版)药企新版GMP验证总计划

验证总计划方针:通过验证确立控制生产过程的运行标准,通过对已验证状态进行监控,控制整个工艺过程,确保质量,并不断通过验证、建标、监控、再验证、再建标的循环动态控制为指导方针。
验证总计划发布验证总计划是指导验证的纲领性文件,使具体的验证与确认项目有组织、有计划、有步骤的实施,增加了公司对严格实施G M P规范的责任,提高了产品质量与安全的保证措施。
为了规范***药业有限公司的验证管理工作,现予以批准实施。
目录一、简介1、公司及其设施简介--------------------------------第4页2、验证总计划目的----------------------------------第4页3、验证总计划范围----------------------------------第4页4、依据的法律法规----------------------------------第4页二、术语和定义-------------------------------------第5页三、生产区域概述-----------------------------------第6页1、厂房设施及公用系统说明--------------------------第6页2、人流及物流说明----------------------------------第7页3、设备说明----------------------------------------第7页4、主要产品表--------------------------------------第15页四、验证组织机构及职责-----------------------------第16页1、验证委员会--------------------------------------第16页2、验证组织机构图----------------------------------第17页3、验证组织机构组成部门及职责----------------------第17页五、支持性文件-------------------------------------第18页六、验证方法---------------------------------------第19页1、验证的分类及适用条件----------------------------第19页2、厂房设施及公用系统确认--------------------------第21页3、设备确认----------------------------------------第28页4、检验方法验证------------------------------------第30页5、设备清洁验证------------------------------------第37页6、工艺验证----------------------------------------第38页七、可接受标准-------------------------------------第39页1、总要求------------------------------------------第39页2、厂房与设施验证可接受标准------------------------第39页3、公用系统验证可接受标准--------------------------第39页4、设备确认可接受标准------------------------------第41页5、设备清洗验证可接受标准--------------------------第41页6、生产工艺验证可接受标准--------------------------第41页八、验证文件要求-----------------------------------第42页1、验证实施的程序----------------------------------第42页1.1提出验证项目-----------------------------------第42页1.2制订项目验证计划及编写要求----------------------第42页1.3制订验证方案及编写要求--------------------------第42页1.4验证与确认方案审批------------------------------第43页1.5组织实施----------------------------------------第43页1.6验证报告及编写要求------------------------------第43页1.7审批验证报告------------------------------------第44页1.8发放验证证书------------------------------------第44页2、验证文件编号系统--------------------------------第44页3、验证文件归档系统--------------------------------第45页九、附录1、2012年度验证计划一、简介:1、公司及其设施简介公司现有**条生产线,其中制剂生产线*条(片剂、硬胶囊剂、颗粒剂、散剂、软膏剂、乳膏剂、酊剂、头孢菌素类胶囊剂),原料药生产线6条(**一条、**二条、**二条、**一条)。
(完整版)GMP验证总计划

文件类型:验证文件文件编码:部门:质量管理部页码:第 1页,共19页验证总计划目录1 验证方针与本文件的目的1.1 验证方针1.2 本文件的目的2 简介2.1 公司基本情况2.2 生产区域概述2.3 工艺概述2.4 产品目录3 目的、范围、要求3.1 本验证总计划制定的目的 3.2 验证范围3.3 验证基本要求4 验证组织结构及人员职责4.1 组织结构图4.2 职责5 验证文件5.1 文件范围5.2 验证方案5.3 验证总结5.4 验证记录5.5 验证报告5.6 验证文件编号5.7 验证文件归档6 实施过程6.1 实施前准备6.2 方法和可接受标准6.3 验证步骤6.4 确认6.5 验证6.6 偏差处理6.7 变更控制7 验证状态维护8 验证实施时间及完成时间8.1 验证实施时间8.2 质量部中心化验室的验证表9 风险评估10 附则4 4 4 4 4 5 5 5 5 5 5 6 7 7 8 10 10 10 101011 11 11 11 1111121314 16 16 16 16 16 181819验证总计划1 验证方针与本文件的目的1.1 验证方针GMP的目的是保证生产出符合既定质量标准的药品,而验证则是实现GMP这个目的的基石,是证明和保证一切关键生产要素,包括设施、系统、仪器设备、生产工艺、分析方法、清洁规程以及消毒/灭菌规程符合既定要求的公认方法。
没有良好有效的验证工作,就谈不上GMP管理体系的有效,也就无法保证药品的质量。
因此,验证工作是GMP管理的最重要工作之一。
1.1.1 鉴于验证工作的如此重要性,本公司将验证工作放在GMP管理的重要位置,并给予高度重视。
为此提出下列验证方针:a) 充分认识,高度重视;建立规程、依规行事;客观记录、慎重结论;资源保证。
b) 所有新的关键方法、规程、工艺及新的关键系统、设备在投入使用前应经验证。
c) 当发生的变更影响产品质量时,所涉及的变更应经过验证。
GMP验证计划(最终版)
再确认
S-200层析柱确认
安装确认:文件资料整理确认、公用系统的连接确认、材质和表面确认、安装和连接确认、仪器仪表校准确认;
运行确认:层析柱柱效确认、层析柱细菌内毒素确认、层析中间体(S-200液)质量确认、相关操作规程完善及培训确认。
再确认
S-100层析柱确认
安装确认:文件资料整理确认、公用系统的连接确认、材质和表面确认、安装和连接确认、仪器仪表校准确认;
运行确认:仪器示值误差和仪器示值重复性确认。
再确认
ZWY-240恒温培养振荡器确认
安装确认:文件资料整理确认、公用系统的连接确认、材质和表面确认、安装和连接确认、仪器仪表校准确认、工作条件的确认;
运行确认:设备控制和显示测试确认、设备空载确认(转速和温度)、相关操作规程完善及培训确认;
性能确认:设备负载确认(转速和温度)。
性能确认:纯化水质量确认;纯化水系统消毒效果及消毒周期确认。
再验证
注射用水系统验证
安装确认:文件资料整理确认、公用系统的连接确认、材质和表面确认、系统仪器和仪表校准确认、安装和连接确认、呼吸器完整性确认、喷淋球喷淋效果确认、管道试压、分配系统清洗及钝化确认;
运行确认:管理权限确认、硬件和人机界面运行确认、断电恢复检查确认、气动阀门单控确认、水泵运行确认、管式换热器运行确认、回水管路自动排放运行确认、注射用水回水管换自动升温的运行确认、呼吸器加热控制运行确认、注射用水循环系统报警确认、断电后重新启动系统确认、工业蒸汽压力降低进料水泵自动关闭确认、压缩空气压力降低报警确认、多效蒸馏水机纯化水供应报警确认、多效蒸馏水机储罐高液位停机确认、注射用水电导率超标自动排放确认、注射用水温度超标自动排放确认、注射用水贮藏及循环系统电导率超标报警确认、注射用水分配系统总回水流速确认、注射用水保温系统控制确认、注射用水分配系统实时监测在线打印确认、相关操作规程完善及培训确认;
GMP再认证准备工作计划
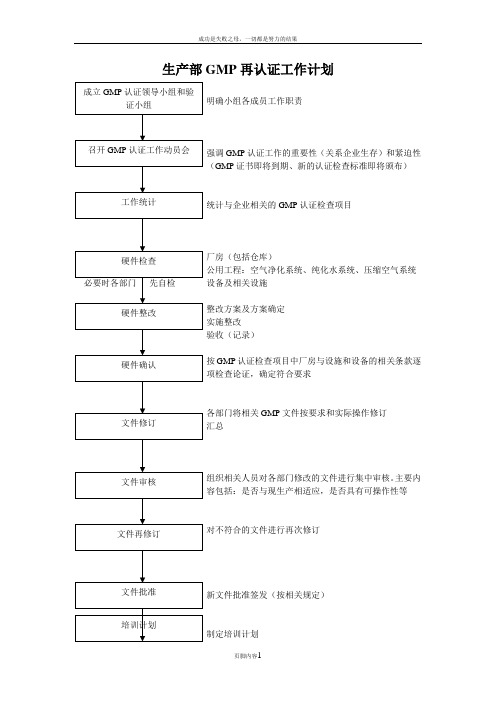
生产部GMP再认证工作计划明确小组各成员工作职责强调GMP认证工作的重要性(关系企业生存)和紧迫性(GMP证书即将到期、新的认证检查标准即将颁布)统计与企业相关的GMP认证检查项目厂房(包括仓库)公用工程:空气净化系统、纯化水系统、压缩空气系统设备及相关设施整改方案及方案确定实施整改验收(记录)按GMP认证检查项目中厂房与设施和设备的相关条款逐项检查论证,确定符合要求各部门将相关GMP文件按要求和实际操作修订汇总组织相关人员对各部门修改的文件进行集中审核。
主要内容包括:是否与现生产相适应,是否具有可操作性等对不符合的文件进行再次修订新文件批准签发(按相关规定)制定培训计划工认证前全员动员大会安排好接待工作检查组现场检查对检查组提出不符合要求的,能现场整改的立即进行整改不能立即整改的写出书面整改方案(当天)GMP认证检查总结对检查组提出不符合GMP的项目及时整改对检查组提出不符合GMP的条款,经整改后上报省局GMP认证准备工作计划细则一、成立GMP认证领导小组和验证小组(已成立)检公司是否以红头文件下发二、GMP认证动员会(已召开)三、相关的GMP认证检查项目(条款)统计1、由GMP认证领导小组组长拟定与公司本次的《GMP认证相关的检查项目(条款)统计表》。
2、召开GMP认证小组会议,对《GMP认证相关的检查项目(条款)统计表》进行审查核对。
3、将《GMP认证相关的检查项目(条款)统计表》中每一款的准备工作落实到人,并制定工作完成期限4、GMP认证小组组长每三日(或每周,也可跟据实际情况定)召开工作实施情况检查及总结会,确保工作进度。
5、每次实施情况检查及总结会,由办公室文员做好会议记录6、必要时实行奖惩制度。
四、硬件确认1、各部门应在11月5日前对现硬件情况进行自检,写出自检报告,11月7日前将自检报告交到GMP认证小组组长处。
2、召开GMP认证小组会议,对部门自检情况进行总结,写出自检不符合要求的项目。
GMP验证总计划

GMP验证总计划1. 引言GMP(Good Manufacturing Practices)是一种质量管理体系,旨在确保生物制药公司在药品生产过程中遵循相关的法规和标准。
GMP验证是验证该体系是否有效并符合要求的一系列活动。
本文档旨在制定一个GMP验证总计划,以确保公司的药品生产过程符合GMP要求并达到预期的质量标准。
2. 目标GMP验证总计划的目标是完成对公司药品生产过程的验证工作,以验证其是否符合GMP要求并达到预期的质量标准。
通过执行验证计划,我们将能够识别和解决潜在的问题,并持续改进我们的生产过程,从而确保产品的质量和安全性。
3. 验证计划3.1. 验证范围本次GMP验证计划的范围包括公司所有涉及药品生产的关键环节和设备,包括原材料采购、储存、生产工艺、设备清洁、制剂和包装等。
3.2. 验证目标本次GMP验证计划的主要目标是评估以下方面的符合性:•原材料的质量标准和采购程序是否符合GMP要求;•生产工艺是否符合GMP要求,并能够稳定产出符合规定质量标准的产品;•设备清洁程序是否有效,并能够确保设备不会对产品质量产生污染;•制剂和包装过程是否符合GMP要求,并且能够确保产品的质量和安全性。
3.3. 验证方法本次GMP验证计划将采用以下方法进行验证:•文件审查:对公司的质量管理文件、标准操作程序等进行审查,以评估其符合性;•现场检查:对关键环节和设备进行检查,确保其符合GMP要求;•质量数据分析:对生产过程中收集到的质量数据进行分析和评估,以确定生产过程是否稳定且符合要求;•员工培训和能力评估:对相关人员进行培训,并评估其对GMP要求的理解和应用程度。
3.4. 验证计划安排本次GMP验证计划将按照以下安排进行:1.制定验证计划,并确定验证的范围和目标;2.进行文件审查,评估公司质量管理文件的符合性;3.实施现场检查,对关键环节和设备进行验证;4.进行质量数据分析,评估生产过程的稳定性和符合性;5.进行员工培训和能力评估,确保相关人员了解和应用GMP要求;6.汇总验证结果,并提出改进建议;7.完成验证报告,并提交给相关部门。
药品GMP认证检查岗位工作总结汇报报告与工作计划范文模板

××单位××单位药品GMP认证检查岗位……………………………………………………………个人工作总结报告汇报……………………………………………………………ANNUAL PERSONALJOB SUMMARY ……………………………………………………………部门:XXXX-XX XX XXXX-XX岗(职)位:XXXX-XX XX XXXX-XX姓名:XXXX-XX XX XXXX-XX(共5100字,可删改)20XX年XX月XX日目录目录 (2)一、岗位履职履责情况 (3)1.1日常工作 (3)1.2协助管理 (4)1.3新建工作 (5)二、出勤与团队建设 (5)2.1出勤情况 (5)2.2思想情况 (6)2.3团队合作 (6)三、学习与个人成长情况 (6)3.1业务理论学习 (6)3.2管理能力提升 (7)3.3实践本领提高 (7)四、不足与改进 (8)4.1不足之处 (9)4.2整顿整改建议 (9)五、展望与规划 (10)5.1总结回顾 (10)5.2近期目标 (11)5.3远期目标 (11)5.4工作打算 (12)20XX年度个人工作总结充实而又忙碌的一年过去了,作为XX单位(部门)的一名药品GMP认证检查,在丰富自我阅历的同时,工作战果也得到了进一步的提升。
20XX年,我在XX单位(部门)领导及各位同事的支持与帮助下,严格要求自己,按照XX单位(部门)的要求,较好地完成了自己作为一名药品GMP认证检查的本职工作。
通过一年来的学习与工作,我在工作模式上有了新的突破,工作方式有了新的改进,在负责XX工作时能以公正、公开、公平的原则做好服务和管理。
现根据自身工作的实际情况,我对自己的工作做出分析评定,总结经验教训,提出改进方法,以便使自己在今后的工作中能惩前毖后,扬长补短,为今后不断改进工作方法,提高工作效率提供依据,以期使自己成为一名更优秀的药品GMP认证检查,为XX单位(部门)做出更大的贡献。
新版GMP验证总计划

验证总计划起草审核批准分发目录1.验证方针与本文件的目的 (4)1.1验证方针 (4)1.2本文件的目的 (4)2.简介 (5)2.1公司基本情况 (5)2.2生产区域概述 (5)2.3工艺概述 (6)2.4产品目录 (6)3.目的、范围、要求 (7)3.1本验证总计划制定的目的 (7)3.2验证范围 (8)3.3验证基本要求 (8)4.验证组织结构及人员职责 (9)4.1组织结构图 (9)4.2职责 (10)5.验证文件 (12)5.1文件范围 (12)5.2验证方案 (13)5.3验证报告 (13)5.4验证记录 (14)5.5验证报告 (14)5.6验证文件编号 (14)5.7验证文件归档 (14)6.实施过程 (14)6.1实施前的准备 (14)6.2方法和可接受标准 (15)6.3验证步骤 (16)6.4确认 (16)6.5验证 (17)6.6偏差处理 (20)6.7变更控制 (20)7.验证状态维护 (20)8.附录 (20)1. 验证方针与本文件的目的1.1 验证方针GMP的目的是保证生产出符合既定质量标准的药品,而验证则是实现GMP这个目的的基石,是证明和保证一切关键生产要素,包括设施、系统、仪器设备、生产工艺、分析方法、清洁规程以及消毒/灭菌规程符合既定要求的公认方法。
没有良好有效的验证工作,就谈不上GMP管理体系的有效,也就无法保证药品的质量。
因此,验证工作是GMP管理的最重要工作之一。
鉴于验证工作的如此重要性,本公司将验证工作放在GMP管理的重要位置,并给予高度重视。
为此提出下列验证方针:●充分认识,高度重视;建立规程、依规行事;客观记录、慎重结论;资源保证。
●所有新的关键方法、规程、工艺及新的关键系统、设备在投入使用前应经验证。
●当发生的变更影响产品质量时,所涉及的变更应经过验证。
●当验证状态发生漂移时应进行再验证。
●关键工艺参数和关键工艺步骤应进行验证。
●检验方法发生变化时应进行验证。
新版GMP验证主计划
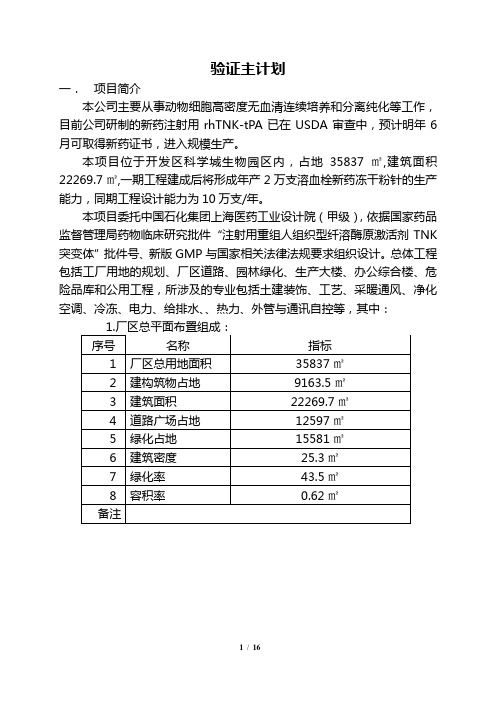
验证主计划一.项目简介本公司主要从事动物细胞高密度无血清连续培养和分离纯化等工作,目前公司研制的新药注射用rhTNK-tPA已在USDA审查中,预计明年6月可取得新药证书,进入规模生产。
本项目位于开发区科学城生物园区内,占地35837㎡,建筑面积22269.7㎡,一期工程建成后将形成年产2万支溶血栓新药冻干粉针的生产能力,同期工程设计能力为10万支/年。
本项目委托中国石化集团上海医药工业设计院(甲级),依据国家药品监督管理局药物临床研究批件“注射用重组人组织型纤溶酶原激活剂TNK 突变体”批件号、新版GMP与国家相关法律法规要求组织设计。
总体工程包括工厂用地的规划、厂区道路、园林绿化、生产大楼、办公综合楼、危险品库和公用工程,所涉及的专业包括土建装饰、工艺、采暖通风、净化空调、冷冻、电力、给排水、、热力、外管与通讯自控等,其中:5.生产方法与包装的方式:5.1细胞的生产方法生产种子――复苏――扩增――细胞培养――收获液――低温层析――洗脱――原液收获――冷冻保存――至冻干生产工序5.2冻干制剂的生产:原液收获――称量――配料――无菌过滤――灌装、半加塞――冻干、压塞――扎盖――灯检――贴签――装盒、装箱――成品入库5.3包装方式:西林瓶10ml,加丁基内塞,铝盖封口,密封。
外包装形式为小盒装,1瓶/盒。
6.总图布置的人流与物流走向(详见“厂区生产工艺总平面布置”)7.检验方法:7.1原辅料的检验方法主要依据中国药典与中国生物制品检定规程。
7.2中间产品的检验方法主要依据厂订的内控标准。
7.3包装材料的检验方法主要依据国家标准。
7.4成品的检验方法主要依据TPA制造及检定草案及起草说明。
二.验证的原则与目标1.符合新版GMP的要求2.符合中国药典相关项目项下的规定要求3.符合药品注册相关项目项下的规定要求4.符合本公司药品生产工艺方法的特殊要求三.验证的内容与合格标准总述:1.验证内容1.1厂房及设施1.1.1厂房及生产工艺设备平面的确认1.1.2净化空调系统1.1.3纯化水、注射用水和纯蒸汽系统1.1.4工业用气系统(氮气、氧气、二氧化碳和压缩空气)1.1.5备用电源1.1.6计算机系统1.2关键生产设备1.2.1细胞反应器1.2.2层析、纯化设备1.2.3配制-除菌过滤系统1.2.4洗-烘-灌生产线1.2.5扎盖机1.2.6冻干机1.2.7贴签机1.2.8干热、湿热灭菌设备1.2.9低温冷库1.3关键的生产工艺方法1.3.1细胞培养的生产方法1.3.2层析、纯化的生产方法1.3.3配制、除菌过滤生产方法1.3.4玻璃瓶洗、烘除热原生产方法1.3.5药液灌装生产方法1.3.6药液冻干、扎盖生产方法1.3.7培养基无菌灌装试验1.3.8湿热、干热灭菌方法1.3.9无菌操作人员的确认1.3.10胶塞、铝盖灭菌除热原方法的确认1.4清洁灭菌方法1.4.1生产工艺设备清洗、灭菌方法,包括:细胞反应器系统(CIP)层析、纯化系统配制、灌装和冻干等1.4.2生产环境清洁、灭菌方法1.4.3生产、容器和工具清洗、灭菌方法1.5检验方法1.5.1原辅料的检验方法1.5.2中间产品的检验方法1.5.3成品的检验方法1.5.4其他验证项目所需的检测方法1.6物料1.6.1主要原辅料、包装材料供应商的确认,包括各种培养基、精氨酸、磷酸、吐温-80、层析缓冲液、内塞、铝盖、玻璃瓶等1.6.2中间产品储存、生产时间的确认,包括细胞收获液、层析纯化液、配制液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
车间GMP再认证工作计划(最终稿)
为了保证车间顺利通过GMP认证,现制定认证前期工作总计划,希望各车间、部门负责人认真核对工作内容及完成时间,如无疑意,请各部门负责人将存在问题及时报认证办,望各负责人尽职尽责按照预定时间完成工作,如在整改过程中存在问题,应及时与认证办联系解决,考评办将根据计划表对工作进度及完成情况进行监督追踪检查,如未按照计划完成的,将根据公司管理制度对相关责任人进行考核,现将具体工作及完成期限计划如下:
以上认证计划只是GMP认证的前期工作计划,但是在实施过程中还会有新的问题出现,对出现的新问题也将已同样的方式处理,希望各部门、车间对新出现的问题能够积极整改。
