高一化学-元素推断题专项训练最新
元素推断题题目大全高中 -回复

元素推断题是高中化学中常见的一种题型,主要考察学生对元素周期表和元素性质的掌握程度。
以下是一些高中化学元素推断题的题目示例:1. 某元素A,其原子最外层电子数是次外层的3倍,则A一定是哪种元素?并说明理由。
2. X、Y、Z、W四种短周期主族元素,原子序数依次增大。
已知Y与W同族,Z 与W形成化合物中可以同时含有极性共价键和非极性共价键,则Z和W形成的化合物的化学式为____;Y与Z形成化合物为XY4,其中含有离子的电子式是____;另外一种常见的化合物中A的原子个数比为1:1,A的原子序数比Z小1,该化合物的化学式是____。
3. 短周期主族元素X、Y、Z、W的原子序数依次增大,它们分别位于三个不同周期,且X与Y同主族、Y与Z同周期、Y与W最外层电子数相等。
下列叙述正确的是( )A. 原子半径:Y > Z > W > XB. 简单氢化物的稳定性:HnY > HnZ > HnWC. W分别与X、Z形成的化合物中化学键类型相同D. 化合物YX、ZW的水溶液都呈碱性4. 下列短周期主族元素中,原子半径最大的是 ( )A. CB. NC. PD. F5. 短周期主族元素A、B、C、D的原子序数依次增大,其中C的单质是一种半导体材料,B的原子半径在同周期中最小,D位于第ⅥA族。
下列推断不正确的是 ( )A. 非金属性:B > C > DB. 元素A和B组成的化合物不止一种C. D的氢化物的稳定性比E的强D. 单质C熔点属于同周期主族元素中最低的6. 下列各组元素性质或原子结构递变规律不正确的是 ( )A. Na、Mg、Al原子最外层电子数依次增多B. P、S、Cl元素最高正化合价依次升高C. N、O、F原子半径依次增大D. Na、K、Rb离子半径依次增大7. 下列关于四种短周期元素在周期表中的位置及原子序数的关系,说法中正确的是 ( )A. 它们处于同一周期B. 它们处于同一主族C. 它们的原子序数之和与零族元素的原子序数相等D. 它们的原子序数之和与13相差18. 下列说法正确的是 ( )A. 非金属元素组成的化合物中只含共价键B. VIA族元素的氢化物中沸点最低的是氨气C. K与水反应最剧烈的金属元素位于周期表第三周期第ⅠA 族D. 元素周期表中的第三列是按原子序数递增排列的9. 下列说法正确的是 ( )A. 第ⅠA族元素的金属性比第ⅡA族元素的金属性强B. 第ⅥA族元素的氢化物中稳定性最好的其沸点也最高C. 同周期非金属氧化物对应的水化物的酸性从左到右依次增强D. 卤族元素的氢化物中,HCl的沸点最低10. 下列有关推断正确的是 ( )A. 第ⅠA族的金属元素单质的密度随着原子序数的递增逐渐减小(碱金属元素除外)B. 第VA族的非金属元素单质的熔沸点随着原子序数的递增逐渐升高C. 第ⅥA族的非金属元素最高价氧化物对应的水化物的酸性从左到右逐渐增强D. 第ⅦA族的非金属元素最高价氧化物对应的水化物的碱性从左到右逐渐减弱以上题目仅供参考,建议查阅高中化学教辅或教材获取更多相关题目。
高一化学-元素推断题专项训练 最新

第八讲推断题专项训练1. 某元素的原子,电子层数为m,最外层电子数为n,且2m=n,该元素气态氢化物中含氢25%,该元素的名称是,m= , n = 。
2. 现有原子序数之和为51的五种短周期元素A、B、C、D、E.已知A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B同主族;D的最高价氧化物的水化物的酸性在同主族元素中是最强的,E元素最外层电子数与其K层电子数相同.(1)试写出它们的元素符号:A______、B______、C______、D______、E______;(2)写出B的氢化物的电子式为_______________.(3)写出A与D反应的化学方程式_____________________.3. 有A 、B 、C 、D 、E五种元素,它们的核电荷数按C 、A、B、D、E的顺序增大。
C、D都能分别与A 按原子个数比1:1或2:1形成化合物。
CB可与EA2反应生成C2A与气态物质EB4。
E的M层电子数是K层电子数的两倍。
(1)写出这五种元素的名称:A ;B ;C ;D ;E 。
(2)画出E的原子结构简图。
(3)写出D的单质与硫酸铜溶液反应的离子方程式。
4. 今有A 、B 、C 、D四种元素,其中A元素是1826年一位法国青年科学家发现的。
他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若进一步提取,可得一种深红棕色液体,有刺鼻的臭味。
B 、C 、D的原子电子层排布均不超过3个电子层。
D原子核内的质子数正好等于C原子核内质子数的2倍,而他们最外电子层上的电子数恰好相等。
D原子的最外层电子数则是B原子核外电子数的6倍。
请回答:(1)四种元素分别是:A ;B ;C ;D 。
(2)画出A元素原子的原子结构示意图。
(3)由上述元素组成的单质和两种氧化物可发生氧化还原反应,生成两种酸,其反应方程式为。
5.请写出五种化学性质不同的物质的化学式,这些物质的原子核外都具有10个电子,它们的化学式分别为______________ 、_____________ 、_____________ 、______________、______________.6.A、B、C、D四种元素,A单质在B单质中燃烧发出苍白色火焰,C单质跟A、D形成的化合物的水溶液反应生成A单质,C原子与B原子的电子层相同,且最外层电子数之差为奇数,D原子最外层电子数为K层电子数的3倍,其单质为淡黄色固体。
高一化学推断题练习试题集

高一化学推断题练习试题答案及解析1.X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。
已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等。
请回答下列问题:(1)X元素的名称是__________,它在周期表中的位置____________。
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)____________________(3)写出F的电子式______________________________(4)已知X单质、A、B、D均为固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应。
请写出X单质、B分别与E反应的化学方程式__________________________________,;B中含有的化学键是;(5)请写出由化合物C制取Y的单质反应的化学方程式_______________________________。
【答案】(1)钠(1分)第三周期第I A族(2分)(2) Na>O>H (2分)【解析】由题可以知道X、Y、Z分别为Na、O、H,A、B、C、D、E分别为NaH、、、、,所以(1)X元素的名称是钠,在周期表中的位置为第三周期第I A族;(2)X、Y、Z的原子半径从大到小的顺序是Na>O>H ;(3)F为NaOH,其电子式为;(4)X单质、B分别与E反应的化学方程式为、,B为,其中含有的化学键是;(5)化合物C制取Y的单质反应的化学方程式为。
【考点】元素周期表点评:本题考查了元素周期表中部分元素的性质及其化合物,该题难度不大。
2.某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
微专题3元素周期表中的元素推断技巧与方法规律-2024-2025高一化学必修第一册(人教版)课后练习

微专题3元素周期表中的元素推断技巧与方法规律课后·训练提升1.部分短周期元素原子半径与原子序数的关系如图所示,下列说法错误的是()。
A.最高价氧化物对应的水化物的碱性:M<ZB.单质还原性:Z>MC.X与R形成的化合物分子含有2个共价键D.简单离子的半径:R>Y>M答案:C2.短周期主族元素X、Y、Z、W的原子序数依次增大,X位于第ⅦA族,Y的原子核外最外层与次外层电子数之和为9,Z是地壳中含量最多的金属元素,W与X 同主族。
下列说法错误的是()。
A.原子半径:r(Y)>r(Z)>r(W)>r(X)B.由X、Y组成的化合物是离子化合物C.X的简单氢化物的稳定性比W的弱D.Y、Z的最高价氧化物对应的水化物之间能反应答案:C3.部分短周期元素原子半径与原子序数的关系如图所示,X与R形成的化合物XR3中每个原子的最外层都达到8电子稳定结构,则下列说法正确的是()。
A.M在元素周期表中的位置为第三周期第Ⅳ族B.Y和R形成的化合物为离子化合物C.R的气态氢化物难溶于水D.XR3的结构式为答案:B4.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质是一种重要的半导体材料。
下列说法中,正确的是()。
A.元素W和M的某些单质可作为水处理中的消毒剂B.W、Z、M元素的简单氢化物的稳定性逐渐减弱C.元素Y位于元素周期表第ⅥA族D.X、M两种元素只能形成X2M型化合物答案:A5.一种新型医用麻醉剂的分子结构式如图所示。
X元素在所有元素中原子半径最小,元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素R的原子比元素W的原子多8个电子。
下列说法正确的是()。
A.XRZ的结构式为H—Cl—OB.简单氢化物的稳定性:W>Z>YC.最高正化合价:W>Z>YD.该麻醉剂分子中所有原子都满足8电子稳定结构答案:B解析:题给化合物结构中X、W、R均形成1个共价键,Y形成4个共价键,Z形成2个共价键。
高考化学元素推断题(大题)

_ 。
4.根据周期表对角线法则,金属Be和Al单质及化合物性质相似,又知AlCl3的熔沸点低,容易升华。
试回答下列问题:(1)写出Be和氢氧化钠反应生成Na2BeO2的离子方程式。
(2)Be(OH)2和Mg(OH)2可以用试剂鉴别,其离子方程式为。
(3)BeCl2是(填离子或共价)化合物,推测BeCl2水溶液在常温下的pH 5(填“大于“等于”“小于”)。
(4)Li和Mg根据对角线法则,性质也相似,Li在空气中燃烧,主要产物的化学式为,同时还有少量的生成。
5.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为。
(2)W与Y可形成化合物W2Y,用电子式表示该化合物的形成过程:。
(3)X的硝酸盐水溶液显性,用离子方程式解释原因:(4)Y与氢元素形成化合物H2Y,该化合物的电子式为。
(5)比较Y、Z气态氢化物的稳定性:> (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是> > > 。
(7)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。
写出该反应的热化学方程式:。
(8)W与氧元素形成离子化合物W2O2,该化合物中阴离子与阳离子个数比为。
(9)某种金属元素与Y的单质化合生成+2价的硫化物,与Z的单质化合生成+3价的氯化物,则该金属在元素周期表处于周期族。
6.(14分)A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为。
(2)由A、B、W三种元素组成的18电子微粒的电子式为。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式。
高一化学推断题含答案(已整理分类,独一无二版本)

(一)元素推断题1、周期表前20号元素中,它们形成离子化合物时,原子数之比为1﹕2,且阴阳离子的电子层结构相同。
写出这些化合物的化学式__________________________________________ 。
2、A 、B 两元素,A 的原子序数为X,A 、B 所在周期的元素种类分别为m 和n ,若A 和B 同主族,当B 在A 的上一周期时,B的原子序数为__________________。
B 在A 的下一周期时,B 的原子序数为_____________。
3、A 、B 、C 、D 为短周期元素,A 和B 同周期相邻,A 和C 同主族相邻,ABC 三种元素的原子序数之和为31,D 元素与ABC 既不同周期又不同主族,请回答:(1)元素符号 A ________B _________C_________D____________ . (2)A 、B 、D 组成为D 4B 2A 3的离子化合物,其水溶液的PH 值小于7的原因是(3)比较B 、D 形成的化合物与A 、D 形成的阴离子结合质子能力强弱_______. 请用方程式表示_____________________________________________________________(4)用电子式表示D 2A 形成过程___________________________________________。
4.有A 、B 、C 、D 四种短周期的非金属元素(其单质也可分别用A 、B 、C 、D 表示),四种元素的原子序数按B 、D 、C 、A 顺序增大,D 、C 元素在周期表中位置相邻。
在一定条件下,B 可以分别和A 、C 、D 化合生成甲、乙、丙化合物,C 和D 化合可得丁。
已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:请填写下列空格:(1)甲的浓溶液与一种黑色粉末共热可得A ,则甲为_______,乙为___________。
元素推断题题目大全高中

元素推断题题目大全高中1. 化学元素推断题1.1. 题目1在实验室中,小明得到了一个未知物质,他使用一些测试试剂进行了测试。
以下是他的测试结果:•当他用溴水滴在未知物质上时,溴水变色;•当他将未知物质与氯化钡溶液混合时,产生了白色的沉淀;•当他将未知物质与铁片接触时,铁片上出现了黑色的斑点。
请根据以上实验结果,推断出未知物质的化学元素。
解答根据实验结果可以得出以下推断:1.溴水变色说明未知物质可与溴反应,因此含有易被卤素氧化的元素;2.产生白色沉淀的反应说明未知物质与氯化钡反应,产生的沉淀为氯化物。
因此,未知物质中的一个元素是钡(Ba^2+);3.铁片上出现黑色斑点的现象表明未知物质对铁有腐蚀作用,因此可能含有具有腐蚀性的元素。
综上所述,根据实验结果推断出未知物质可能含有卤素元素(例如溴)、钡元素和具有腐蚀性的元素。
2. 生物元素推断题2.1. 题目2在实验室中,小红进行了一项生物实验,她使用了以下试剂:•氯酸钾试液•碱性铅醋试液•磷酸试纸以下是小红的实验结果:•当她将试管中的未知物质与氯酸钾试液混合时,产生了气泡;•当她将试管中的未知物质与碱性铅醋试液混合时,产生了黑色沉淀;•当她将试管中的未知物质倒入带有磷酸试纸的试管中时,试纸变红。
请根据以上实验结果,推断出未知物质中的生物元素。
解答根据实验结果可以得出以下推断:1.产生气泡的反应表明未知物质与氯酸钾反应,产生气体。
由于气泡的产生常见于金属与酸类反应,可以推断未知物质中含有金属元素;2.产生黑色沉淀的反应说明未知物质与碱性铅醋试液反应,生成硫化物沉淀。
由于硫化物常见于高硫蛋白质反应,可以推断未知物质中含有硫元素;3.磷酸试纸变红说明未知物质中的某种元素能与磷酸反应生成酸性物质。
根据常见的生物元素,可以推断未知物质中含有磷元素。
综上所述,根据实验结果推断出未知物质中可能含有金属元素、硫元素和磷元素。
3. 物理元素推断题3.1. 题目3一个学生在物理实验中进行了以下测试:•用手将一个未知物质握住,感觉很冷;•将该未知物质从塑料容器中取出,它立即开始融化;•使用红外线热像仪对该未知物质进行扫描,显示出一些明亮的点。
高一化学必修1推断题专题题库(含答案)

高一化学必修1推断题专题题库1、A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如下图所示。
A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
(1)A的化学式为,最高化合价为。
(2)B和碳反应生成A和E的化学方程式为。
(3)C的化学式为,D的化学式为。
2、下面框图中各单质和化合物间有以下转化关系,且组成各单质和化合物的元素为核电荷数是1~18的元素。
请根据框图关系判断。
(1)单质A是,单质B一定是(填“金属”或“非金属”)(2)各化合物的化学式为:甲,乙,丙,丁。
3、A、B是两种有刺激性气味气体。
试根据下列实验事实填空。
(1)写出A~F各物质的化学式:A ,B ,C ,D ,E ,F 。
(2)写出A、B跟水反应的离子方程式。
4、下图中每一方格表示的有关的一种反应物和生成物。
己知B是一种单质,其余物质都是含有B元素的化合物;C是一种钠盐;E是C对应的酸;B和D的晶体都是高熔点、坚硬的固体,且D为B的氧化物(其它不含B 元素的反应物及各步添加的必要试剂和反应条件均己略去)。
(1)写出A、D、E的化学式:A ;D ;E 。
(2)在工业上,用碳在高温下还原D的方法可制得含少量杂质的B,其化学反应方程式为;A和B的互变在工业上的实际意义是。
(3)写出D→C反应的离子方程式。
5、下图A、B、C、D、E、F六种物质中除D为单质外其余均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如下图所示。
请回答下列问题:(1)A、B、D的化学式A ,B ,D 。
(2)E和F可相互转化,图中己标明F向E转化的关系,写出E转化为F的化学方程式6、室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图所示进行反应,又知E溶液是无色的。
请回答:(1)A是,B是,C是。
(2)反应①的化学方程式。
(3)反应③的化学方程式。
(4)反应④的化学方程式。
7、下列物质之间能够发生如下图所示的化学反应。
元素推断练习题

元素推断练习题一、介绍元素推断是一种通过观察和实验数据,推断给定元素的性质和特征的方法。
在化学中,元素推断是理解元素周期表、化学反应和物质性质的重要手段。
本文将通过一些练习题,来帮助读者掌握元素推断的技巧和方法。
二、练习题1. 根据下列实验数据,推断物质X的元素。
实验一:将物质X加热,发现产生气体。
实验二:向物质X溶液中滴加碱性溶液,生成沉淀。
实验三:与酸反应,生成气体。
根据实验数据,可以推断物质X可能含有氧元素,且能与碱反应生成沉淀,同时与酸反应产生气体。
可能的元素为氧和氢。
2. 下列实验现象中,推断物质Y可能为哪种气体?实验一:物质Y在火焰中燃烧,炽热明亮。
实验二:将物质Y放入氧气中,发生爆炸。
实验三:物质Y能够溶于水,生成酸性溶液。
根据实验数据,可以推断物质Y可能为氢气。
氢气在火焰中燃烧时会产生炽热明亮的火焰;与氧气反应时会产生爆炸;能够溶于水并生成酸性溶液。
3. 根据下列实验数据,推断物质Z可能是哪种金属?实验一:物质Z的导电性很高。
实验二:将物质Z放入稀盐酸中,产生气体。
实验三:物质Z与氧气反应时发生燃烧。
根据实验数据,可以推断物质Z可能是钠(Na)。
钠具有很高的导电性;与稀盐酸反应会产生气体(氢气);与氧气反应时发生燃烧。
4. 根据以下实验数据,推断物质W可能是哪种非金属元素?实验一:物质W是一种无色气体,气味刺激。
实验二:物质W对火焰是无色的。
实验三:物质W能与氧气反应生成二氧化碳。
根据实验数据,物质W可能是氯(Cl)。
氯是一种无色气体,具有刺激性气味;对火焰来说是无色的;与氧气反应时会生成二氧化碳。
三、总结通过上述练习题,我们学习了通过观察和实验数据进行元素推断的方法。
根据不同的实验现象,我们可以推断出物质中可能存在的元素种类和性质。
元素推断是化学研究和实验中必备的技巧,它有助于我们理解元素周期表和化学反应的规律,深入了解物质的性质与特征。
通过不断的练习和实践,我们可以提高元素推断的准确性和敏感度。
元素推断题题目大全高中

元素推断题题目大全(高中)目录•说明•语文题目•数学题目•英语题目•物理题目•化学题目•生物题目•历史题目•地理题目说明元素推断题是高中各学科中常见的一种题型,要求学生从已知信息中推断出相应的结论。
以下是一些高中各学科中常见的元素推断题题目,供学生练习和参考。
语文题目1.根据下列材料推断文章的主题:[材料]2.根据上下文推断词语的意思:[句子]3.根据行文特点推断作者的写作意图:[文段]4.根据对话内容推断人物关系:[对话]5.根据人物形象描述推断人物性格:[描述]数学题目1.根据等式推断未知数的值:[等式]2.根据图形特点推断图形的性质:[图形]3.根据数据推断整体的特征:[数据]4.根据题目条件推断问题的答案:[题目]5.根据数列的规律推断下一个数:[数列]英语题目1.根据对话内容推断说话人的身份:[对话]2.根据句子结构推断词语的词性:[句子]3.根据句意推断单词的意思:[句子]4.根据语法规则推断句子的正确形式:[句子]5.根据上下文推断不熟悉词语的含义:[句子]物理题目1.根据实验结果推断物质的物理特性:[实验]2.根据力的作用方向推断物体的运动方向:[力]3.根据电路图推断电流的走向:[电路图]4.根据运动物体的变化推断物体所受的力:[物体]5.根据物质的性质推断其在特定条件下的变化:[性质]化学题目1.根据化学方程式推断反应物和产物:[方程式]2.根据物质的性质推断其在化学反应中的作用:[性质]3.根据实验结果推断溶液的酸碱性:[实验]4.根据物质的组成推断其化学性质:[组成]5.根据物质的颜色和气味推断物质的性质:[性质]生物题目1.根据动物的形态特征推断其生活习性:[动物]2.根据植物的外部结构推断其生长环境:[植物]3.根据遗传规律推断后代的表现形式:[遗传]4.根据生物的行为举止推断其种属:[行为]5.根据生态关系推断物种的相互作用:[生态]历史题目1.根据历史事件推断其背后的原因:[事件]2.根据历史文献推断古代人的生活方式:[文献]3.根据历史人物的言行推断其思想和态度:[人物]4.根据历史地理位置推断文明的发展程度:[地理]5.根据历史制度推断社会的结构和层次:[制度]地理题目1.根据地貌特征推断地质变动的原因:[地貌]2.根据气候特点推断生物分布的规律:[气候]3.根据地理位置推断城市发展的方向:[位置]4.根据地形特征推断地表水流的走向:[地形]5.根据区域特点推断经济发展的优势:[区域]以上是一些常见的元素推断题题目,通过练习这些题目,可以提高对已知信息的分析和推断能力,同时也能够培养学科知识的应用能力。
元素推断题题目大全高中

元素推断题题目大全高中1. 推断该元素是碱金属还是碱土金属2. 推断该元素的周期3. 推断该元素在同一周期中的布居规律4. 推断该元素的电子亲和能力5. 推断该元素的电离能力6. 推断该元素的电负性7. 推断该元素的原子半径8. 推断该元素的离子半径9. 推断该元素是单质还是化合物10. 推断该元素在自然界中的存在形式11. 推断该元素的合成方法12. 推断该元素的物理性质13. 推断该元素的化学性质14. 推断该元素的氧化态范围15. 推断该元素的反应活性16. 推断该元素的应用领域17. 推断该元素对人体的影响18. 推断该元素的放射性质19. 推断该元素在核反应中的应用20. 推断该元素的稳定性。
1. 推断该元素是碱金属还是碱土金属这个推断可以根据该元素所在的周期表位置进行判断。
如果在第一和第二周期,这个元素很可能是碱金属;如果在第三到第八周期,这个元素可能是碱土金属或其他元素。
如果推断不出来,可以进一步查找该元素物理化学特征。
2. 推断该元素的周期这个推断可以根据该元素的原子序数进行判断。
每个元素原子序数都唯一,按顺序排列即为周期,可以通过周期表示或周期表来进行确认。
3. 推断该元素在同一周期中的布居规律元素在同一周期中的电子数相同,通常遵循A型布局规律,即元素的外层电子排布规律为$s^1$、$s^2p^1$、$s^2p^2$、$s^2p^3$、$s^2p^4$、$s^2p^5$和$s^2p^6$。
该元素的布局规律可以根据其所处的周期表序数来推断。
4. 推断该元素的电子亲和能力电子亲和能力指的是原子能够吸收电子形成阴离子的程度。
如果原子能够轻松地接受电子,那么它的电子亲和能力就会比较高。
可以通过该元素的电子结构、化学成分、原子数和元素周期来推断该元素的电子亲和能力。
5. 推断该元素的电离能力电离能力指的是从原子中脱离电子所需的能量。
如果原子的电离能力很高,说明它的化学反应比较不活泼;如果电离能力很低,说明它的化学反应比较活泼。
济南市新高一下学期化学基础推断题狂练含解析
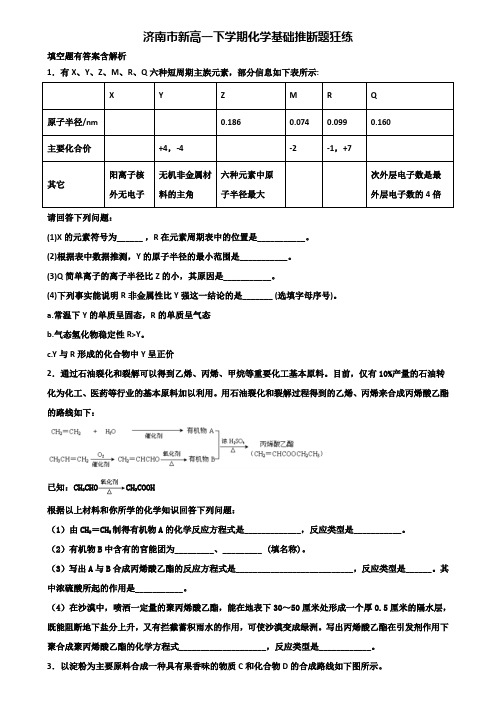
济南市新高一下学期化学基础推断题狂练填空题有答案含解析1.有X、Y、Z、M、R、Q六种短周期主族元素,部分信息如下表所示:X Y Z M R Q原子半径/nm 0.186 0.074 0.099 0.160主要化合价+4,-4 -2 -1,+7其它阳离子核外无电子无机非金属材料的主角六种元素中原子半径最大次外层电子数是最外层电子数的4倍请回答下列问题:(1)X的元素符号为______ ,R 在元素周期表中的位置是___________。
(2)根据表中数据推测,Y的原子半径的最小范围是___________。
(3)Q简单离子的离子半径比Z的小,其原因是___________。
(4)下列事实能说明R非金属性比Y强这一结论的是_______ (选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态b.气态氢化物稳定性R>Y。
c.Y与R形成的化合物中Y呈正价2.通过石油裂化和裂解可以得到乙烯、丙烯、甲烷等重要化工基本原料。
目前,仅有10%产量的石油转化为化工、医药等行业的基本原料加以利用。
用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:已知:CH3CHO CH3COOH根据以上材料和你所学的化学知识回答下列问题:(1)由CH2=CH2制得有机物A的化学反应方程式是_____________,反应类型是___________。
(2)有机物B中含有的官能团为_________、_________ (填名称)。
(3)写出A与B合成丙烯酸乙酯的反应方程式是___________________________,反应类型是______。
其中浓硫酸所起的作用是___________。
(4)在沙漠中,喷洒一定量的聚丙烯酸乙酯,能在地表下30~50厘米处形成一个厚0.5厘米的隔水层,既能阻断地下盐分上升,又有拦截蓄积雨水的作用,可使沙漠变成绿洲。
写出丙烯酸乙酯在引发剂作用下聚合成聚丙烯酸乙酯的化学方程式____________________,反应类型是____________。
高中化学元素及化合物推断题

元素及化合物推断练习题1、 已知:A 、F 为金属单质,D 、E 为气态单质,其他均为化合物,其中C 旳焰色反映呈 黄色,B 为黑色粉末,J 为红褐色沉淀。
各物质间旳转化关系如右图所示(部分生成物已略去):(1)单质A 旳保存措施为 (2)写出反映 B + G —→ E旳离子方程式:_________ _________。
(3)写出E + F —→ I 旳化学反映方程式为__________________________,D在E 中点燃时旳现象为____________________。
(4)C 与E反映旳离子方程式为 .所得混合液旳用途是 .2、已知:A、B 、C 、D 、E 、F 在常温下均为气体,其中E 为黄绿色。
它们有如下转化关系(部分反映条件与产物已略)。
请回答问题:(1)D →F 旳化学方程式为__ _______________ (2)C 旳浓溶液与黑色粉末反映旳化学方程式为________________________ (3)E 与水反映旳离子方程式为 (4)相似状态下,若A 、B混合气体积为VL ,则一定条件下与F充足反映,消耗F 旳体积为_______L.3、在下页图中所示各物质旳转化中,部分生成物已略去。
其中A旳焰色反映呈紫色,B 为黑色粉末,C、R为气态单质。
试回答:(1)操作③中分离B、D混合物旳措施是。
(2)写出④旳化学方程式:(3)写出⑥、⑦两个反映旳离子方程式:⑥,⑦。
(4)写出第②步化学反映;E旳用途为4制作现代通信材料光导纤维旳重要原料。
C旳浓溶液有挥发性,实验室把将其保存在棕色玻璃试剂瓶中并放在冷暗处。
(1)写出A与B反映旳化学方程式,产物F旳两个重要用途是。
(2)A与氢氧化钠溶液反映旳离子方程式为(3)化合物E旳水溶液与G反映旳离子方程式为。
(4)C与D反映旳离子方程式为。
该反映中化合物C体现旳性质有。
氧化剂与还原剂之比为(5)若C旳浓溶液有强烈旳脱水性,则C与单质D旳化学方程式为5、某未知液也许具有Fe2+、Fe3+、Na+、K+、Al3+、Mg2+、SO错误!、Cl-、NO错误!中旳几种,为拟定哪些离子存在,先取未知液进行焰色反映,火焰呈黄色。
高中化学元素或物质推断题(含详细过程)

高中化学元素或物质推断题59.Ⅰ.中学化学中几种常见物质的转化关系如图(部分产物未列出)。
A是一种金属单质,D是一种非金属固体单质。
请回答下列问题:(1)E既有氧化性又有还原性,写出E表现出氧化性的化学反应方程式:___________(2)写出反应E+H2O2→F的化学方程式:___________(3)若反应F+D→E转移的电子数为3.01×1023,则消耗D的质量为___________g。
Ⅰ.氮气是一种常见的气体,其在一定条件下可以转化为氮氧化物NO、NO2等。
(4)NO、NO2均为有毒气体,可以把NO、NO2一起通入氢氧化钠溶液中进行尾气处理,得到一种常见的食品添加剂。
写出该过程发生的离子方程式:___________(5)把ag的Mg、Cu固体混合物加到足量的硝酸溶液中得到蓝色溶液和气体。
所产生的气体与bL(标准状况)的O2一起通入水中得到只含硝酸的水溶液。
往蓝色溶液中滴加氢氧化钠溶液至恰好完全沉淀,所得沉淀的质量为___________g。
(用a、b的代数式表示)(6)金属Mg可以在NO2燃烧,产物可能为MgO、Mg3N2和N2.现有13.2g的Mg粉,在足量的NO2中充分燃烧,得到21.0g的固体和1120mL(标准状况)的气体。
写出燃烧过程发生的化学方程式:___________60.某无色溶液中含有K+、Cl-、OH-、SO2-3、SO2-4,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液和溴水。
检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
(1)图中试剂①~⑤溶质的化学式分别是:①___________,②___________,③___________,④___________,⑤___________。
(2)图中现象a、b、c表明检验出的离子分别是:a___________,b___________,c___________。
山东科技必修高一化学2-巧解元素推断题

巧解元素推断题【例题】A、B、C是周期表中相邻的三种元素,其中A、B同周期,B、C同主族,三种元素原子最外层电子数之和为17,核内质子数之和为31,则A、B、C三种元素分别为、、。
【常规解法1】A、B、C在元素周期表中有如下4种位置关系:(1)(2)(3)(4)由题干判断此三种元素均为短周期元素。
设B元素核内质子数为x,(1)~(4)有如下关系:(1)x+(x-1)+(x-8)=31,x=40/3(2)x+(x-1)+(x+8)=31,x=8(3)x+(x-8)+(x+1)=31,x=38/3(4)x+(x+8)+(x+1)=31,x=22/3符合题意的是(2),即B为O元素,再根据上图可知A为N,C为S。
【常规解法2】设B、C两元素原子最外层电子数均为y,A元素原子最外层电子数为y+1或y-1。
可分两种情况讨论:(1)若A元素原子最外层电子数为y+1,则y+1+y+y=17,解得:y=16/3(舍去)。
(2)若A元素原子最外层电子数为y-1,则y-1+y+y=17,解得:y=6,即B、C原子的最外层电子数为6个,则B、C分别为O或S中一种。
然后首先确定A,A元素核内质子数=31-8-16=7,所以A是N;再由“A、B同周期”可知B为O,C为S。
【巧解】三种元素原子最外层电子数的平均值为17/3≈5.7。
因为5<5.7<6且三种元素位置相邻,所以三种元素原子的最外层电子数要么为5,要么为6。
再根据“最外层电子数之和为17”可知,这三种元素的原子中只能有一种原子的最外层电子数为5,另外两种原子的最外层电子数为6。
这就说,三种元素中一定有第ⅤA族的一种元素和第ⅥA族的两种元素:O和S。
由于“B、C同主族”,故B、C为O或S。
以下可首先确定A,再确定B、C,具体方法同常规解法2。
【点评】该解法最突出的优点是口算即可,避免了三种元素位置关系的繁琐讨论,考试时可节省宝贵的时间。
高一化学必修二元素推断专题(解析版)

高一化学必修二元素推断专题(解析版)1.短周期元素W、X、Y、Z在元素周期表中的位置如图所示。
下列说法中正确的是( )A.Y的原子半径在同周期主族元素中最大B.W的非金属性比Z的弱C.Z的气态氢化物的稳定性在同主族元素中最强D.W的最高价氧化物对应的水化物是强酸【答案】D【解析】【详解】A、同周期自左而右原子半径减小,Y的原子半径在同周期主族元素中最小,A错误;B、同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以W的非金属性比Z的强,B错误;C、元素的非金属性越强,其氢化物越稳定,同一主族元素中,Z的非极性不是最强的,所以其氢化物不是最稳定的,C错误;D、Cl元素最高价氧化物对应的水化物是高氯酸,高氯酸是强酸,D正确;故选D。
2.X、Y、Z、R,W是原子序数依次递增的五种短周期主族元素,它们所在周期数之和为11。
YZ气体遇空气变成红棕色,R的原子半径是五种元素中最大的,W与Z同主族。
下列说法错误的是()A.简单离子的半径:Y>XB.气态氢化物的稳定性:Y>WC.X、Z和R形成强碱D.最高价氧化物对应的水化物的酸性:W>R【答案】C【解析】【分析】X、Y、Z、R、W是原子序数依次递增的五种短周期主族元素,YZ气体遇空气变成红棕色,则YZ为NO,故Y为N元素、Z为O元素;W与Z同主族,则W为S元素;R的原子半径是五种元素中最大的,R处于第三周期,可能为Na、Mg、Al、Si、P中的一种;五元素所在周期数之和为11,则X处于第一周期,故X为H元素。
【详解】A.X、Y简单离子分别为H+(或H-)、N3-,电子层越多离子半径越大,故离子半径;N3->H+(或H-),故A正确;B.非金属性N>S,故氢化物稳定性NH3>H2S,故B正确;C.X、Z和R可能形成NaOH、氢氧化镁、氢氧化铝、硅酸、磷酸等,故C错误;D.W的非金属性比R的强,最高价氧化物对应的水化物的酸性:W>R,故D正确。
故选:C。
2021北京高一化学期末汇编:元素周期表、元素周期律推断(教师版)

2021北京高一化学期末汇编:元素周期表、元素周期律推断第I卷(选择题)一、单选题1.(2021·北京二十中高一期末)A、B、C均为短周期元素,它们在周期表中的位置如图所示。
已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是A.Be、Na、Al B.O、P、ClC.C、Al、P D.B、Mg、Si2.(2021·北京·101中学高一期末)X、Y、Z三种元素的原子,其价电子排布式分别为ns1、3s23p2和2s22p4,由这三种元素组成的化合物的化学式可能是A.XYZ2B.X2YZ3C.X2YZ2D.XYZ33.(2021·北京二十中高一期末)已知第一、二、三周期元素A、B、C、D的离子a A2+、b B+、c C3-、d D-具有相同的电子层结构。
则下列叙述正确的是A.原子半径:A>B>C>D B.原子序数:d>c>b>aC.原子的最外层电子数:C>D>A>B D.离子半径:C3->D->B+>A2+4.(2020·北京市第十九中学高一期末)科学家利用四种原子序数依次递增的短周期主族元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。
W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。
(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确...的是A.Y单质的氧化性在同主族中最强B.离子半径:Z>YC.Z与Y可组成多种离子化合物D.最简氢化物的热稳定性:Y>X5.(2019·北京四中高一期末)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。
若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是A.X的气态氢化物比Y的稳定B.W的最高价氧化物对应水化物的酸性比Z的强C.Z的非金属性比Y的强D.X与Y形成的化合物都易溶于水6.(2019·北京·高一期末)几种不同周期的短周期元素的原子半径及主要化合价如下表:下列叙述正确的是()A.X、Y元素的金属性:X<YB.Y的单质只能与强酸反应C.四种元素形成的简单离子半径:Z->X+>Y3+>W2-D.Z的单质与X的最高价氧化物的水化物反应的产物之一具有漂白性7.(2019·北京西城·高一期末)某元素X的最高正价与最低负价的代数和为4,其气态氢化物的化学式可能是A.HX B.H2X C.XH3D.XH48.(2019·北京西城·高一期末)X、Y、Z、W 为4 种短周期元素,已知X、Z 同主族,2Y+、Z-、W+ 3 种离子的电子层结构与氖原子相同,下列叙述正确的是A.原子序数:Z<Y B.原子半径:W<XC.金属性:Y>W D.气态氢化物稳定性:HX>HZ9.(2021·北京二十中高一期末)X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为()A.HX B.H2X C.XH4D.XH310.(2019·北京四中高一期末)卤族元素随着原子序数的增大,下列递变规律正确的是()A.单质熔、沸点逐渐降低B.单质的氧化性逐渐增强C.原子半径逐渐增大D.气态氢化物稳定性逐渐增强11.(2020·北京丰台·高一期末)某元素原子的结构示意图为,由此得到的结论不正确的是A.该原子有3个电子层B.该元素最高化合价为+5价C.该原子在化学反应中易失电子D.该元素在周期表中的位置是第三周期第V A族12.(2020·北京·中关村中学高一期末)X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八讲推断题专项训练
1. 某元素的原子,电子层数为m,最外层电子数为n,且2m=n,该元素气态氢化物中含氢25%,该元素的名称是,m= , n = 。
2. 现有原子序数之和为51的五种短周期元素A、B、C、D、E.已知A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B同主族;D的最高价氧化物的水化物的酸性在同主族元素中
是最强的,E元素最外层电子数与其K层电子数相同.
(1)试写出它们的元素符号:A______、B______、C______、D______、E______;
(2)写出B的氢化物的电子式为_______________.
(3)写出A与D反应的化学方程式_____________________.
3. 有A 、B 、C 、D 、E五种元素,它们的核电荷数按 C 、A、B、D、E的顺序增大。
C、D都能分别与A 按原子个数比1:1或2:1形成化合物。
CB可与EA2反应生成C2A与气态物质EB4。
E的M层电子数是K层电子数的两倍。
(1)写出这五种元素的名称: A ;B ;C ;D ;E 。
(2)画出E的原子结构简图。
(3)写出D的单质与硫酸铜溶液反应的离子方程式。
4. 今有 A 、B 、C 、D四种元素,其中A元素是1826年一位法国青年科学家发现的。
他在研究海水制盐
时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若进一步提取,可得一种深红棕色液体,有刺
鼻的臭味。
B 、C 、D的原子电子层排布均不超过3个电子层。
D原子核内的质子数正好等于C原子核内质子数的2倍,而他们最外电子层上的电子数恰好相等。
D原子的最外层电子数则是B原子核外电子数的6倍。
请回答:
(1)四种元素分别是: A ;B ;C ;D 。
(2)画出A元素原子的原子结构示意图。
(3)由上述元素组成的单质和两种氧化物可发生氧化还原反应,生成两种酸,其反应方程式为。
5.请写出五种化学性质不同的物质的化学式,这些物质的原子核外都具有10个电子,它们的化学式分别为
______________ 、_____________ 、_____________ 、______________、______________.
6.A、B、C、D四种元素,A单质在B单质中燃烧发出苍白色火焰,C单质跟A、D形成的化合物的水溶液反
应生成A单质,C原子与B原子的电子层相同,且最外层电子数之差为奇数,D原子最外层电子数为K层电子数的3倍,其单质为淡黄色固体。
(1)四种元素符号为A______________,B___________,C___________,D______________;
(2)离子的电子层结构相同的二种元素是___________,离子的结构示意图分别为____________、_________;
(3)四种元素中能形成AB型共价化合物的元素是___________,由它们的同位素原子形成的AB型分子共有____________,其中质量数最小的一种分子可用同位素符号表示为_____________________;
(4)A、B、C、D原子形成的最高价氧化物的分子式分别为______ 、______、___________、______________.
7.有A、B、C、D四种元素,最高正价依次为1、4、5、7,其核电荷数按B、C、D、A顺序增大。
已知B 的次外层电子数为2,C、D、A原子次外层电子数均为8,C、D原子的电子层数相同,A原子的核外电子数不超过20,则A为,B为,C为,D为 .
8.X、Y、Z三种主族元素位于周期表中连续的三个不同周期.原子序数:Z>X>Y,其中Y原子的次外层电子数为2,X原子的次外层电子数与Y、Z原子的次外层电子数均不相同,X与Y的族序数之和等于Z的族序数。
已知X的氢氧化物难溶于水,Y的最高价氧化物的水化物是一种强酸.由此推出:X是,Y 是,Z 是 .将X的单质投入到Z单质的水溶液中,观察到的现象是,有关反应的化学方程式是 .。
