高二化学《烷烃的同分异构体》
【新教材】烷烃的同分异构体书写及取代物的种类

【新教材】烷烃的同分异构体书写及取代物的种类【学习目标】1、掌握同分异构体的概念,会辨析“四同”2、会用“减碳法”正确书写常见烷烃的同分异构体,掌握烷烃取代物的找法 【主干知识梳理】一、同分异构体、同分异构现象 正丁烷和异丁烷物理性质的比较1(1)同分异构现象:化合物具有相同的分子式,但具有不同的结构的现象 (2)同分异构体:具有同分异构现象的化合物互称为同分异构体 (3)同分异构体特点①分子式相同,即:化学组成和相对分子质量相同 ②可以是同类物质,也可以是不同类物质 ③结构不同,性质可能相似也可能不同 ④同分异构体之间的转化是化学变化 【微点拨】①同分异构体要求分子式相同,但结构不同,二者缺一不可;分子式相同,则相对分子质量相等,但相对分子质量相等的物质,分子式不一定相同,如:CO 和C 2H 4②结构不同意味着同分异构体不一定是同类物质,如:CH 3CH 2CH===CH 2和③同分异构体的结构一定不同,因此它们的物理性质存在差异;如果同分异构体的结构相似,属于同类物质,则它们的化学性质相似;如果同分异构体是不同类别的物质,则它们的化学性质不同④烷烃中,甲烷、乙烷、丙烷不存在同分异构体,其他烷烃均存在同分异构体,且同分异构体的数目随碳原子数的增加而增多,如:丁烷有2种同分异构体、己烷有5种同分异构体、癸烷有75种同分异构体。
同分异构现象是有机物种类繁多的原因之一 2、化学“四同”的比较对象原子单质有机化合物无机化合物、有机化合物性质化学性质几乎完全相同,物理性质略有差异化学性质相似,物理性质差异较大化学性质相似,熔沸点、密度规律性变化化学性质相似或不同,物理性质有差异【对点训练1】1、下列叙述正确的是()A.分子式相同,各元素含量也相同的物质是同种物质B.通式相同的不同物质一定属于同系物C.分子式相同的不同物质一定是同分异构体D.相对分子质量相同的不同物质一定是同分异构体二、烷烃同分异构体的书写方法——“减碳法” (烷烃只存在碳链异构,以C6H14为例)书写的步骤碳架式注意①将分子中所有碳原子连成直链作为主链C—C—C—C—C—C (a)②从主链一端取下一个碳原子作为支链(即甲基),依次连在主链对称轴一侧的各个碳原子上,此时碳骨架有两种(b)(c)甲基不能连在①位和⑤位碳原子上,否则与原直链时相同;对于(b)中②位和④位碳原子等效,只能用一个,否则重复③从主链上取下两个碳原子作为一个支链(即乙基)或两个支链(即两个甲基)依次连在主链对称轴一侧的各个碳原子上,此时碳骨架结构有两种(d)(e)②位或③位碳原子上不能连乙基,否则主链上会有5个碳原子,则与(b)中结构重复(1)两注意:①选择碳原子数最多的碳链为主链;②找出对称轴(2)四句话:主链由长到短,支链由整到散,位置由心到边,排列对、邻到间(3)取代基不能连在末端,否则与原直链时相同(4)从母链上取上的碳原子数,不得多于母链所剩余的碳原子数【当堂训练】烷烃(C n H2n+2,只可能存在碳链异构)n=1n=2n=3n=4n=51、分子式为C7H16的烷烃中,在结构式中含有3个甲基的同分异构体数目是( )A.2个 B.3个 C.4个 D.5个2、分子式为C8H18,每个分子中含有4个甲基的烃的结构可能是( )A.5种 B.6种 C.7种 D. 8种三、烷烃烃基的找法、一卤代烃的找法和多卤代烃的找法1、烷烃烃基的找法2(1)同一个碳原子上连接的氢原子等效如:甲烷(CH4)分子中4个氢原子是等效的(2)同一个碳原子上所连接的甲基上的氢原子等效如:新戊烷()分子中四个甲基等效,各甲基上的氢原子完全等效,也就是说新戊烷分子中的12个H 原子是等效的(3)分子中处于对称位置上的氢原子是等效的如:分子中的18个氢原子是等效的3、烷烃一氯代物和多氯代物的找法(1)一元取代物的找法:烃分子中有多少中结构不同的氢原子,其一元取代物就有多少种同分异构体①根据烷基的种类确定一元取代物种类如:丁基(—C4H9)的结构有4种,戊基(—C5H11)的结构有8种,则C4H9Cl有4种,C5H11Cl有8种②等效氢法:有几种等效氢原子就有几种一元取代物1、某烃的一种同分异构只能生成1种一氯代物,该烃的分子式可以是( )A.C3H8 B.C4H10 C.C5H12 D.C6H142、某烃的一卤代物有四种不同沸点的产物,则烃可能是( )A.甲烷 B.C3H8 C.C4H10 D.2-甲基丙烷3、(多选)C6H14的各种同分异构体中,所含甲基数和它的一氯代物的数目与下列相符的是( )A.2个甲基,4种一氯代物 B.3个甲基,4种一氯代物C.3个甲基,5种一氯代物 D.4个甲基,4种一氯代物4、含碳原子个数为10或小于10的烷烃中,其一卤代烷烃不存在同分异构体的烷烃共有( )A.2种B.3种C.4种D.5种(2)多元取代物种类——分次定位法如:C3H8的二氯代物,先找一氯代物,再利用等效氢法,再用氯原子取代一氯代物上的氢原子①二氯代物的找法:先找一氯代物,再用氯原子取代一氯代物上的氢原子CH2Cl2C2H4Cl2C3H6Cl2C4H8Cl21、某烃的相对分子质量为86,其结构中含有1个—CH2—和4个—CH3,则该烃的二氯代物有()A.5种 B.6种 C.7种 D.8种2、C4H10的二氯取代产物异构体数目为( )A.7种 B.8种 C.9种 D.10种②三氯代物的找法:先找二氯代物,再用氯原子取代二氯代物上的氢原子CHCl3C2H3Cl3C3H5Cl34如:乙烷分子中共有6个H原子,若有一个H原子被Cl原子取代所得一氯乙烷只有一种结构,那么五氯乙烷有多少种?假设把五氯乙烷分子中的Cl原子转换为H原子,而H原子转换为Cl原子,其情况跟一氯乙烷完全相同,故五氯乙烷也有一种结构。
《烷烃中的同分异构体》教学设计

《烷烃中的同分异构体》教学设计教学设计:烷烃中的同分异构体一、教学目标1.了解同分异构体的概念和特点。
2.能够根据分子式判断烷烃是否存在同分异构体。
3.能够通过摩尔式方法确定同分异构体的个数。
4.能够通过结构式方法表示同分异构体。
5.了解同分异构体对物理性质和化学性质的影响。
二、教学重点1.同分异构体的概念和特点。
2.摩尔式方法和结构式方法判断同分异构体。
三、教学步骤和内容安排Step1:导入(15分钟)1.引入同分异构体的概念,通过提问和展示图片的方式,让学生思考烷烃是否存在同分异构体。
2.为学生提供一个具体的例子,如丙烷和异丙烷,引导学生思考它们的分子式是否相同,分子结构是否相同。
3.总结同分异构体的特点,包括分子式相同,分子结构不同,物理性质和化学性质可能不同。
Step2:同分异构体的判断(30分钟)1.教师通过实例介绍同分异构体的摩尔式方法判断,即通过分子式中C和H原子的个数来推断是否存在同分异构体。
2.设计一些练习题,让学生根据分子式判断是否存在同分异构体,并让学生解答。
3.讲解答案,引导学生思考判断的依据,总结同分异构体的判断方法。
Step3:同分异构体的表示(30分钟)1.介绍同分异构体的结构式表示方法,即通过化学键的连接关系来表示分子结构。
2.讲解同分异构体在结构上的差异,比如碳原子的连接方式、碳骨架的形状等。
3.设计一些实例,让学生根据分子式画出同分异构体的结构式,并让学生互相交流。
Step4:同分异构体的性质(30分钟)1.引入同分异构体对物理性质的影响,如沸点、熔点和密度等。
2.引入同分异构体对化学性质的影响,如反应活性、氧化性等。
3.通过讨论和实例,让学生发现同分异构体在性质上的差异。
四、课堂巩固和拓展(15分钟)1.设计一些案例题,让学生综合运用所学知识判断同分异构体的个数和结构式。
2.布置相关的习题,引导学生进一步巩固和拓展所学内容。
五、教育手段与教具准备1.教育手段:以问题引导、讨论互动、案例讲解等多种手段。
高二有机化学烷烃的性质同分异构体综合练习(附答案)

高二有机化学烷烃的性质同分异构体综合练习一、单选题1.下列有关烷烃的叙述中,正确的是( ) ①在烷烃分子中,所有的化学键都是单键②烷烃中除甲烷外,很多都能使酸性4KMnO 溶液的紫色褪去 ③分子通式为22C H n n 的烃不一定是烷烃④所有的烷烃在光照条件下都能与氯气发生取代反应 ⑤光照条件下,乙烷通入溴水中,可使溴水褪色 A.①③⑤B.②③C.①④D.①②④2.常温下,1mol 某烷烃在光照条件下与氯气发生取代反应,若在适当的条件下,完全取代需要消耗6mol 2Cl ,则下列判断正确的是( ) A.该烷烃的分子式为512C HB.反应所生成的有机产物能直接与3AgNO 溶液反应生成白色沉淀C.该烷烃的四氯代物有2种D.反应容器中,有机产物中的一氯代物所占的物质的量分数一定最大 3.下列说法正确的是( )A.乙烷的一氯代物同分异构体有1种,二氯代物的同分异构体有3种B.丙烷的一氯代物同分异构体有2种,二氯代物的同分异构体有5种C.正丁烷的一氯代物同分异构体有2种,二氯代物的同分异构体有5种D.正戊烷的一氯代物同分异构体有3种,二氯代物的同分异构体有9种4.C 5H 12有3种不同结构:甲CH 3(CH 2)3CH 3,乙CH 3CH(CH 3)CH 2CH 3,丙C(CH 3)4。
下列相关叙述正确的是( )A.甲、乙、丙属同系物,均可与氯气、溴蒸气发生取代反应B.C 5H 12表示一种纯净物C.甲、乙、丙中,丙的沸点最低D.丙有3种不同沸点的二氯取代物5.下列烷烃在光照条件下与氯气反应,只生成一种一氯代物的是( )A.CH 3CH 2CH 2CH 3B.C. D.6.正己烷是优良的有机溶剂,其球棍模型如图所示。
下列有关说法正确的是( )A.正己烷的分子式为C H,其沸点比丙烷低612B.正己烷的一氯代物有3种C.正己烷能与溴水发生取代反应而使溴水褪色D.正己烷所有碳原子可在一条直线上7.下列五种烃①2-甲基丁烷;②2,2-二甲基丙烷;③戊烷;④丙烷;⑤丁烷.按沸点由高到低的顺序排列的是( )A.①>②>③>④>⑤B.②>③>⑤>④>①C.③>①>②>⑤>④.④>⑤>②>①>③8.验证某有机物属于烃,应完成的实验内容是( )A.只测定它的C、H原子个数比B.只证明它完全燃烧后的产物只有水和CO2C.只测定其燃烧产物中水和CO2的物质的量之比D.只测定该试样的质量及试样完全燃烧后生成CO2和水的质量9.下列表示异丙基的是( )A.CH3CH2CH3B.CH3CH2CH2-C.-CH2CH2CH2-D.(CH3)2CH-10.丙烷的分子结构可简写成键线式结构,有机物A的键线式结构为,有机物B与等物质的量的H2发生加成反应可得到有机物A。
化学人教版(2019)必修第二册7.1.2烷烃的同分异构体(共40张ppt)

【解析】A中物质名称为正丁烷,A错误;甲烷为正四面体构型,两者为 同一物质,B正确;C中两种分子的分子式相同,结构不同,互为同分异构 体,C错误;同素异形体是同种元素形成的不同单质,而12C为原子,D错误
01 有机物分子结构特点
任务二、认识同分异构体 学生活动1:根据教材P63页图7-7 中的数据可知,正丁烷和异丁烷 虽含有相同的碳原子和氢原子,但物理性质(熔点、沸点)均不 同, 由①正此丁可烷以和得异丁到烷什虽么含结有相论同?的原子种类和数目,但结构不同(前者是直链,后
②丁烷的两种不同结构的物质物理性质(熔点、沸点)不同,且直连的丁烷熔、 沸点更高,含有支链的丁烷熔、沸点更低。
③结论:碳原子数相同的烷烃,可能存在不同的结构,且性质不同。
01 有机物分子结构特点
【典例1】下列化学式及结构式中,从成键情况看不合理的是( B )
A.CH3N
B.CH4Si
C.CH2OS
新课导入
通过上节课的学习和预习,我们知道分子式为C4H10的有机物(丁 烷),可以组成CH3CH2CH2CH3(正丁烷)、CH(CH3)3(异丁烷)两种 不同结构的物质,尽管它们的分子分子式相同,但它们的结构是完全不 一样的,这一现象在有机化合物中非常普遍,我们称之为同分异构现象。 具有相同分子式但结构不同的化合物之间互称为同分构体。
任务二、认识同分异构体
【归纳小结】同分异构体的特点:
H3C-CH-CH3
①分子式相同,即化学组成和相对分子质量相同。
特点:①分子式相同—均为C4H10 ②结构不同(异),前者直连, 后者含有支链。
【温馨提示】同分异构体的分子式相同(相对分子质量必然相同),分子结构 不同是分子中的原子或原子团的排列方式不同而引起的。结构决定性质,所以 化学性质和物理性质均有一定差异,如正丁烷和异丁烷的熔、沸点不同。
烷烃的同分异构体

烷烃是一类碳氢化合物,由碳和氢原子构成。
它们的分子结构由碳原子形成链状,氢原子附着在碳链上。
烷烃的同分异构体是指具有相同分子式(相同的碳氢比)但结构不同的化合物。
烷烃的同分异构体主要是由于碳原子在空间中的不同排列方式导致分子结构的差异。
以下是烷烃的同分异构体示例:
1.丙烷(C3H8)和异丙烷(C3H8):它们的分子式相同,都由三个碳原子和八
个氢原子组成,但结构不同。
丙烷的三个碳原子排列成直链,而异丙烷的三个碳原子中间的碳原子与两个其他碳原子形成支链结构。
2.正丁烷(C4H10)和异丁烷(C4H10):它们的分子式相同,都由四个碳原子
和十个氢原子组成,但结构不同。
正丁烷的四个碳原子排列成直链,而异丁烷的四个碳原子中间的两个碳原子形成支链结构。
3.戊烷(C5H12)和异戊烷(C5H12):它们的分子式相同,都由五个碳原子和
十二个氢原子组成,但结构不同。
戊烷的五个碳原子排列成直链,而异戊烷的五个碳原子中间的一个碳原子形成支链结构。
烷烃的同分异构体是有机化学中的常见现象,同分异构体的存在使得有机化合物的种类变得更加丰富多样。
在有机合成和化学工业中,对同分异构体的识别和区分是十分重要的。
《烷烃中的同分异构体》教学设计

《烷烃中的同分异构体》教学设计教学设计:《烷烃中的同分异构体》一、教学目标1.知识与技能:了解同分异构体的定义、特点、分类及其在烷烃中的特例;掌握同分异构体的判断方法和同分异构体间的性质差异。
2.过程与方法:通过理论讲解和案例分析相结合的方式,激发学生的学习兴趣,提高学生的分析和解决问题的能力。
3.情感态度与价值观:培养学生对化学知识的兴趣和积极性,培养学生的观察、思考和实验能力。
二、教学重点与难点1.重点:同分异构体的定义、特点、分类及其在烷烃中的表现。
2.难点:同分异构体的判断方法和同分异构体间的性质差异。
三、教学内容1.同分异构体的概念和特点2.烷烃的同分异构体3.同分异构体的分类4.同分异构体的性质比较四、教学过程1.导入教师可以利用生活中的例子引入同分异构体的概念,如表达式相同但结构不同的单词、图形等,并提出“同分异构体”的概念,引起学生对此概念的思考。
2.理论讲解通过PPT或黑板,介绍同分异构体的概念和特点,让学生了解同分异构体的定义以及常见的特点,引导学生思考同分异构体在化学结构中的表现。
3.案例分析教师可以给出一些烷烃的分子结构式,让学生通过分析结构式来判断哪些是同分异构体,引导学生掌握同分异构体的判断方法。
4.同分异构体的分类介绍同分异构体的分类,如链式同分异构体、环式同分异构体等,让学生了解不同类型的同分异构体的表现形式。
5.实验设计设计一个简单的实验,通过对同分异构体的性质比较来加深学生对同分异构体的理解。
例如,烷烃的同分异构体在燃烧时产生的热量有何不同等。
6.总结与讨论通过总结本节课的重点内容,让学生对同分异构体的概念和性质有更深入的理解,鼓励学生积极参与讨论,促进学生之间的交流和思考。
五、教学资源1.PPT或黑板2.实验器材3.实验指导书4.测量工具5.课堂讨论题目六、教学评估1.课堂小测验:利用选择题、判断题等形式的小测验,检验学生对同分异构体的基本概念和性质的掌握情况。
烷烃同分异构体数目规律

烷烃同分异构体数目规律
烷烃同分异构体数目规律为:
1. 烷烃的同分异构体随着碳原子数的增多而增多,呈递增趋势。
2. 尽管随着碳原子数的增多而增多,但是始终遵循一定的规律,即彼此之间是相似的,具有相似的结构特征,只是位置不同而已。
3. 烷烃的同分异构体之间可以通过分子重排反应相互转化,并遵循一定的规律,即遵循基元反应机理,反应速率受到温度和催化剂等因素的影响,并且在一定条件下可以形成多种产物。
4. 烷烃的同分异构体之间还可以通过分子内重排反应相互转化,并遵循一定的规律,即遵循基元反应机理,反应速率受到温度和催化剂等因素的影响,并且在一定条件下可以形成多种产物。
烷烃的命名及同分异构体的书写课件 -高二上学期化学人教版(2019)选择性必修3

1,2-二甲基环己烷
Br
溴苯
NO 2
硝基苯
OH
COOH
OH
1,3-苯二酚
(习惯命名:
间苯二酚)
苯甲酸
专题:同分异构
作业本P80
作业本P79
专题:同分异构
作业本P83
专题:同分异构
作业本P83
作业本P77
作业本P82-83
作业本P82
专题2:烃的燃烧规律
例1、等物质的量的下列烃完全燃烧时,消耗O2最多的是( D )
甲基:-CH3
亚甲基: -CH2 -
次甲基: -CH -
∣
乙基: -CH2CH3
OH—
丙基:-CH2CH2CH3
一C3H7
H3C
异丙基:H C
3
根和基的区别
—OH
(羟基)
CH
“根” 带电荷,可稳定存在。如:NH4+
“基” 不带 电荷,不能单独存在
➢ 基与基之间可以直接结合成共价分子
-C2H5 乙醇
-OH
1
2
3
4
5
6
1
CH3CH2CH2CH2CH2CH3
2
3
4
CH3CH-CHCH3
CH3 CH3
己烷
1
2
3
4
5
CH3CHCH2CH2CH3
CH3
2-甲基戊烷
1
2
3
4
5
CH3CH2CHCH2CH3
CH3
3-甲基戊烷
2,3-二甲基丁烷
CH3
CH3CH2CCH3
CH3
4
3
2
1
2,2-二甲基丁烷
烷烃的同分异构体

书写构造式时,常用简化的式子为: 书写构造式时,常用简化的式子为: CH3CH2CH2CH2CH3或CH3(CH2)4CH3。 伯、仲、叔和季碳原子。 叔和季碳原子。
直接与一个碳原子相连的称为" 直接与一个碳原子相连的称为"伯"(Primary)或一 Primary) 级碳原子,用1o表示; 级碳原子, 表示; 直接与二个碳原子相连的称为" Secondary) 直接与二个碳原子相连的称为"仲"(Secondary)或 二级碳原子, 表示; 二级碳原子,用2o表示; 直接与三个碳原子相连的称为" Tertary) 直接与三个碳原子相连的称为"叔"(Tertary)或三 级碳原子, 表示; 级碳原子,用3o表示; 直接与四个碳原子相连的称为"季"(Quaternary) 直接与四个碳原子相连的称为" Quaternary) 或四级碳原子,用4o表示; 或四级碳原子, 表示;
以己烷为例其基本步骤如下; 以己烷为例其基本步骤如下; 首先,写出这个烷烃的最长直链式 写出这个烷烃的最长直链式: 首先 写出这个烷烃的最长直链式:
(省少一个碳原子的直链式作 为主链把剩下的碳当作支链。 为主链把剩下的碳当作支链。依次 当取代基连在各碳原子上, 当取代基连在各碳原子上,就能写 出可能的同分异构体的构造式。 出可能的同分异构体的构造式。
再次,写出少二个碳原子的直链式作为主链。 再次,写出少二个碳原子的直链式作为主链。 把两个碳原子当作支链( 个甲基), ),接在各 把两个碳原子当作支链(2个甲基),接在各 碳原子上,或把两个碳原子当作(乙基), 碳原子上,或把两个碳原子当作(乙基), 接在各碳上。 接在各碳上。
把重复者去掉。这样己烷的同分异构体 把重复者去掉。 只有5 只有5个。
高二化学选修五《有机化学基础》1.2.4烷烃的同分异构体的书写

【练一练】
下列式子是某学生书写的C5H12的同分异构体的结构简式
这些结构中出现重复的是( C )
A.①和② B.④和⑤ C.②③④
D.均不重复
课堂小结
烷烃的同分异构体的书写:一般采用“学组:夏伟
1
学习目标 掌握烷烃的同分异构体的书写方法;
烷烃的同分异构体的书写
烷烃只存在碳链异构,书写烷烃同分异构体时一般 采用“减碳法” 。
下面以己烷(C6H14)为例说明。 (1)将分子中所有的碳原子连成直链作为母链。
(2)从母链的一端取下1个C原子,依次连接在母链中心对称线一侧的 各个C原子上,即得到多个带有甲基、主链比母链少1个C原子的异构体骨 架。
(3)从母链上一端再取下一个C原子,使这两个C原子相连(整连)或分 开(散连),依次连接在母链所剩下的各个C原子上,即得到多个带1个乙基 或两个甲基、主链比母链少两个C原子的异构体骨架。
重点提醒
1. 力求顺序性 顺序为:无支链→有一个支链(先甲基后乙基)→有两个支链……;支链的位置:由中到边但 不到端。当支链不止一个时,彼此的相对位置应是先同位再到邻位后到间位; 2. 采用对称性 找出中心对称线,以避免重复书写; 3. 做到简约性 先写出碳骨架,再补充H原子;
烷烃的同分异构现象 概述及解释说明

烷烃的同分异构现象概述及解释说明1. 引言1.1 概述烷烃是碳原子连结成直链或支链的简单有机化合物,其分子结构中只包含碳和氢原子。
在许多有机化学反应中,烷烃的同分异构现象备受关注。
同分异构指的是具有相同分子式但结构不同的化合物现象。
例如,甲烷和乙烷具有相同的分子式CH4和C2H6,但它们的分子结构不同。
1.2 文章结构本文将系统介绍烷烃的同分异构现象及其解释说明。
首先,在"2. 烷烃的同分异构现象"部分我们将定义并背景介绍同分异构,并探讨导致此现象发生的原因以及对其进行分类。
接着,在"3. 同分异构的解释说明"部分,我们将探究键长、键键能力、空间取向与排列方式等因素对于同分异构现象产生重要影响,并引入量子力学解释和分子轨道理论以加深我们对此现象的理解。
然后,在"4. 案例分析"部分,我们将通过具体案例来进一步阐述甲烷与乙烷、支链烷烃与直链烷烃以及环状烷烃与链式烷烃的同分异构现象。
最后,在"5. 结论"部分,我们将对同分异构现象及其解释说明进行总结,并探讨其在化学反应和材料设计中的启示和应用前景。
1.3 目的本文的目的是全面介绍烷烃同分异构现象,并解释说明其原因和机制。
通过深入理解同分异构现象,我们可以更好地把握化学反应中不同分子结构之间的差异,并为材料设计提供新思路和方法。
这对于促进有机化学领域的发展以及相关工业领域的创新具有重要意义。
2. 烷烃的同分异构现象2.1 定义和背景烷烃是一类碳氢化合物,由于其分子结构简单,主要由碳原子和氢原子组成,因此存在着同分异构的现象。
同分异构是指具有相同分子式但结构不同的化合物之间的关系。
2.2 同分异构的原因导致烷烃发生同分异构的主要原因包括碳原子键长和键键能力的影响、空间取向与排列方式的影响以及量子力学解释和分子轨道理论等。
2.3 同分异构的分类根据烷烃同分异构的特点,可以将其分类为以下几种形式:a) 结构异构体:指在碳骨架上某些原子或基团位置发生变化,如链式异构体和环状异构体等。
烷烃同分异构体

Q(n)表n顶点轴树个数。
S(n)表n顶点轴称树(即含有对称轴的树)个数。
由(1)式有:$sum_{TinX_n}p-sum_{TinX_n}q+sum_{TinX_n}s=sum_{TinX_n}1$
即P(n)-Q(n)+S(n)=C(n).
于是要计算无根树个数C(n).转化成计算根树个数P(n),轴树个数Q(n)和轴称树个数S(n).
考虑p与q的关系:
(图中同轨顶点圈在一起,同轨边用相同字母。
边轨道划分方法如下:如果两边两端对应同轨,则此两边同轨。)
T1任一边两端不同轨。所以显然有p=q+1.
T2有一边(边b)的两端同轨,若不计此边的轨道,则为p=q+1,再于q中计入此轨道,q增加1,所以是p=q。
故得结论:(*)若树T中任一边两端不同轨,则p=q+1;若存在一边两端同轨,则p=q。
若存在一边e的两端A,B同轨,则说明根树$T_A$与$T_B$同构(据1),所以e是T的对称轴(T关于e的垂直平分面对称)。反之,如果某边e=(A,B)是T的对称轴,则有$T_A$与$T_B$同构,所以e的两边A,B同轨。所以“T存在两端同轨的边”<=>"T有对称轴"。另外易知,树至多有一条对称轴(注)。于是(*)可叙述为:
再看Tb,标号最小的顶点只有一个,所以不存在对称轴。
S(n,t)表n顶点t-轴称树个数。
由前面推理不难看出,同样有关系:
P(n,t)-Q(n,t)+S(n,t)=C(n,t).
P(n,t),Q(n,t)及S(n,t)的计算在其它文章中提到。
--
注:确定树的对称轴方法如下:
烷烃有同分异构体区别

烷烃同分异构体的应用
烷烃的同分异构体在化学工业中具有广泛的 应用。例如,可以利用烷烃的碳链异构体来 生产不同性质的塑料和橡胶,以满足不同的 工业需求。此外,位置异构体和官能团异构 体也可以用于合成不同的有机化合物,如药
物、农药和染料等。
在石油工业中的应用
烷烃的同分异构体
石油工业中,烷烃的同分异构体也是非常重要的。例如,正烷烃和支链烷烃的同分异构体在石油的组成和性质上 具有显著差异。正烷烃是石油的主要成分之一,其含量和性质对石油的加工和使用具有重要影响。支链烷烃则是 石油中的杂质,会影响石油的质量和加工性能。
对石油化工的贡献
提高石油资源的利用率
烷烃同分异构体的研究有助于石油化工企业更有效地利用石油资源,通过优化烷烃的分离和加工过程,提高产品的质 量和产量。
开发新型石油化学品
烷烃同分异构体的研究有助于发现和开发新型石油化学品,如高辛烷值汽油、柴油等,满足市场需求并推动石油化工 行业的发展。
促进石油化工技术的进步
烷烃的同分异构体及其区别
目录
• 烷烃的同分异构体 • 同分异构体的定义与分类 • 烷烃同分异构体的鉴别方法 • 同分异构体的应用 • 同分异构体的研究意义
01 烷烃的同分异构体
正烷烃
1 2
定义
正烷烃是指所有碳原子都以单键直接相连,形成 直链的烷烃。
结构特点
碳原子之间形成单键,没有支链,碳原子呈直线 排列。
烷烃同分异构体的应用
在石油工业中,可以利用烷烃的同分异构体来改善石油的性质和加工性能。例如,通过调整石油中正烷烃和支链 烷烃的比例,可以改善石油的流动性和燃烧性能。此外,烷烃的同分异构体还可以用于生产不同的石油化学品, 如汽油、柴油和润滑油等。
《烷烃同分异构体》教学设计

化石燃料与有机化合物----烷烃、同分异构体复习教学设计(1课时)晋江平山中学姚顺金一、教学设计的内容:有机必考部分中《烷烃、同分异构体的书写》二、学生情况分析:基于福建卷的传统考查模型的束缚,学生已选修结构,有机基础薄弱,福建省高考卷会在选择题中考查1题有机物的性质及应用题及近年在第23题出现1~2空的填空或方程式。
而在新课标Ⅰ、Ⅱ卷中对有机必考部分通常有一道考查同分异构体,同样不要求立体异构。
但其中同分异构体的要求到碳链异构、位置异构、官能团异构要求较福建省高考的高,而我们的学生特对有机的概念很模糊,不知道什么是最长的碳链,有机物的简单命名,以及有机物的基本结构通常由C原子结合形成分子骨架,其它原子或原子团以共价键结合在碳骨架上;每种原子通常以特定的价键数与其他原子结合(C-4,O-2,H-1);绝大多数属于共价化合物,往往形成分子晶体,这些知识性的储备很少,理解能力也比较弱,对于甲烷、乙烯、苯、乙醇、乙酸、糖类、油脂、蛋白质的主要性质掌握也很困难,纯粹在记忆上下功夫,现在在复习过程中如何让学生进行有机物的建模和分析比较困难,尤其面对全国卷,同分异构体这个难点出现的概率有很大,因此在这一部分内容上比起以前在福建卷的考察要求上要做比较大的调整和补充,如何在复习课上提高复习的有效性,真的很重要。
三、教学设计的思路(一)、设计的背景:1、解读全国考试大纲与福建考试说明上必考有机部分上要求上的不同【全国考试大纲】①.了解有机化合物中碳的成键特征。
了解有机化合物的同分异构现象。
②.了解甲烷、乙烯、苯等有机化合物的主要性质。
③.了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
④.了解乙醇、乙酸的组成和主要性质及重要应用。
⑤.了解上述有机化合物发生反应的类型。
⑥.了解糖类、油脂、蛋白质的组成和主要性质及重要应用。
⑦.了解常见高分子材料的合成反应及重要应用。
⑧.以上各部分知识的综合运用【福建省考试说明】⑦了解常见高分子材料的合成反应及重要应用(缩聚反应不作要求)。
第三章第一节烷烃同分异构体
概念
内涵
比较对象 实例
质子数等,中子数
同位素 不等,原子之间
原子
氕氘氚
同素异 同一元素形成 形体 的不同单质
同系物
结构相似,组成上 差一个或n个CH2
同分异 相同分子式,不
构体 同结构的化合物
单质
O2、O3
化合物
C2H6、 C4H10
化合物 CH3(CH2)3CH3 C(CH3)4
下面烷烃一氯代物有__4__种同分异构体。
CH4 3—C3H—C1H—CH—CH3 l ll CH3 CH3 CH3 2
对称轴
CH3CH2CH2CH2CH3
③ ②①②③
对称点
③ ② ①② ③ CH3-CH2-CH-CH2-CH3
② CH2 ③ CH3
对称点
①
①CH3 ②
③
CH3 – C – CH2- CH3
CH4 HCH3 HCH2
甲烷
甲基
亚甲基
1、烃基的特点: 呈电中性的原子团,含有未成键的单电子 请写出甲基、羟基的电子式,并请思考1mol 甲基、羟基中各含的电子数
2、几种重要的烷烃及烷基:
CH4 -H 甲烷
CH3CH3 乙烷
-CH3 -H 甲基
-H
-CH2CH3
乙基
-CH2亚甲基
2.分子式为C3H6Cl2的有机物共有(不考虑立体异 构)( ) A.2种 B.3种 C.4种 D.5种
【提升训练】
1.一氯代物同分异构体有2种,二氯代物同分异构
体有4种的烷烃是
A.乙烷
B.丙烷
B
C.正丁烷
D.新戊烷
2.下列烷烃分子中的一个氢原子被一个氯原子取代
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
六、同分异构现象和同分异构体
CH4
甲烷
名称 甲烷 乙烷 丙烷
ቤተ መጻሕፍቲ ባይዱCH3CH3
乙烷
CH3CH2CH3
丙烷
熔点/℃ -182.5 -183.3 -189.7
沸点/℃ 相对密度 状态 -164 0.466 气态 -88.6 0.572 气态 -42.1 0.5005 气态
C4H10 丁烷
写出C5H10的同分异构体,3种
CH3-CH2-CH2-CH2-CH3
CH3-CH-CH2-CH3 CH3
CH3-CCH3
CH3
写出C6H12的同分异构体,5种
CH3-CH2-CH2-CH2-CH2-CH3
CH3-CH-CH2-CH2-CH3 CH3-CH2-CH-CH2-CH3
CH3
CH3
CH3-C-CH2-CH3 CH3
CH3-CH-CH-CH3 CH3CH3
一氯取代物同分异构体的书写方法:
烷烃的特征反应是取代反应,与氯气、溴蒸汽。
等效氢的概念:有机物分子中所处的 环境相同的氢原子叫等效氢。
分子中等效氢原子一般有如下情况: ①.分子中同一甲基上连接的氢原子等效,如甲烷上的 氢原子。 ②.同一碳原子所连甲基上的氢原子等效。 ③.处于镜面对称位置(相当于平面成像时,物与像的 关系)上的氢原子等效。
物性:随支链↗,溶、沸点↘;ρ↘ 化性:烷烃的同分异构体化学性质相似
同分异构体的比较:
相同点:分子式相同,相对分子质量相同 不同点:不同种物质
问题1:相对分子质量相同的物质一定是同分异 构体吗? 问题2:同分异构体可能是同系物吗?
问题3:同分异构体的化学性质一定相似吗?
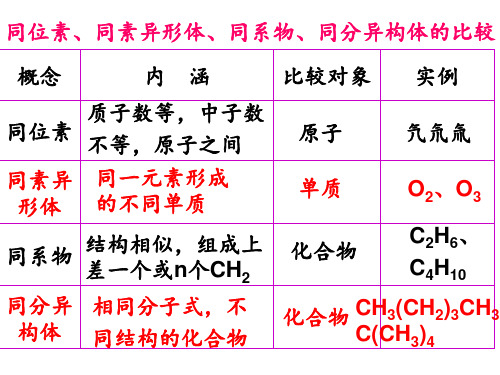
同位素、同素异形体、同系物、同分异构体 四种概念的比较
CH3CH2OH与CH3OCH3 C60与C70 H2O与D2O 16O与18O
CH4与C3H8 C2H4与C4H8
同分异构体 同素异形体
同种物质 同位素 同系物 可能是同系物
同分异构体书写方法: C6H14 己烷为例
1:把所有的C原子写成一条直线:
2:把主链减少一个C作为-CH3。 头尾不可接;接中间;看对称 3:把主链减少2个C作为2个-CH3或者作为一个 -CH2CH3? 头尾不可接;接中间;看对称 4:对于CxHy的烃,主链长大于x/2.
烷烃
等效氢
CH4
1
CH3CH3
1
CH3CH2CH3
2
CH3CH2CH2CH3
2
2
CH3CH2CH2CH2CH3
3
4
1
一氯代物
二氯代物(同碳、 不同碳)
1+0 1+1 2+2
2+3 1+2 3+6 3+7
1+1
概念 同位素
内涵
质子数等, 中子数不等
比较 对象
原子
实例 氕、氘、氚
同素异 形体
同一元素形成 的不同单质
单质
O2、O3
同系物
结构相似,相差 一个或n个CH2
化合物
C2H6、C4H10
同分异 构体
分子式相同, 结构不同
化合物CH3(CH2)3CH3、 C(CH3)4
同位素、同素异形体、同系物、同分异构体 四种概念的辨析
熔点/℃ -130
-159.9
沸点/℃ 相对密度 状态 36.1 0.6262 液态 27.8 0.6201 液态
CH3
新戊烷
新戊烷
-20
9.5 0.6135 气态
1、定义: 化合物具有相同的分子式,而具有不同结构 式的现象叫同分异构现象。
具有同分异构现象的化合物互称同分异构体。
2、烷烃同分异构体的性质:
CH3CH2CH2CH3
正丁烷 名 称 熔点/℃ 正丁烷 -138.4 异丁烷 -159.6
沸点/℃ -0.5 -11.7
CH3CHCH3 CH3
异丁烷
相对密度 0.5788 0.557
C5H12 戊烷
CH3CH2CH2CH2CH3 CH3CHCH2CH3
正戊烷
CH3异戊烷 CH3-C-CH3
名称 正戊烷 异戊烷
