2010环境化学期末复习内容
环境化学复习重点

环境化学复习要点第一章:绪论环境化学的研究对象:环境污染物造成的环境问题环境问题:全球环境或区域环境中出现不利于人类生存和发展的各种现象,称为环境问题人类面临的两大类环境问题:生态破坏和环境污染八大公害事件:美国洛杉矶光化学烟雾美国多诺拉烟雾事件英国伦敦烟雾事件比利时马斯河谷事件日本水俣病事件日本骨痛病事件日本米糠油事件日本四日市哮喘事件环境污染:指自然或人为的破坏,向环境中添加某种物质而超过环境的自净能力而产生危害的行为环境化学:环境化学是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学。
环境化学的研究内容:(1)有害物质在环境介质中存在的浓度水平和形态;(介质存在)(2)潜在有害物质的来源,它们在个别环境介质中和不同介质间的环境化学行为;(环境行为)(3)有害物质对环境和生态系统以及人体健康产生效应的机制和风险性;(环境效应)(4)有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
(环境控制)研究特点:以微观研究宏观;研究对象复杂;物质水平低。
核心:研究化学污染物在环境中的化学转化(trans- fer)和效应(transformation)。
环境污染物:环境污染物是指进入环境后使环境的正常组成和性质发生直接或间接有害于人类的变化的物质化学污染物的分类:元素、无机物、有机化合物和烃类、金属有机和准金属有机化合物、含氧有机化合物、有机氮化合物、有机卤化合物、有机硫化合物、有机磷化合物优先污染物:在化学污染物中筛选出一些毒性强、难降解、残留时间长、在环境中分布广的污染物优先进行控制中国优先控制污染物“黑名单”:共有14类,68种优先控制的污染物。
其中优先控制的有毒有机化合物有12类,58种,占总数的85.29%引起世人关注的化学污染物:(1)持久性有机污染物(2)三致化学污染物(3)环境内分泌干扰物符合上述定义的POPs物质有数千种之多。
–斯德哥尔摩国际公约提出首批控制12种:艾氏剂、狄氏剂、异狄氏剂、DDT、氯丹、六氯苯、灭蚁灵、毒杀芬、七氯、多氯联苯(PCBs)、二恶英和苯并呋喃(PCDD/Fs)环境内分泌干扰物:二恶英、六氯苯、多氯联苯、DDT等自然过程或人类的生产和生活活动会对环境造成污染和破坏,从而导致环境系统的结构和功能发生变化,称为环境效应环境效应分为环境物理效应、环境化学效应、环境生物效应环境污染源:工业、农业、交通运输、生活第二章:大气环境化学大气的组成大体上分为干洁空气、水蒸气、颗粒物(包括固体颗粒和液体颗粒)大气污染过程:大气光化学、自由基反应、活性粒子反应大气的组成:N2(78.08%)、O2(20.95%)、Ar(0.943%)和CO2 (0.0314%)。
环境化学复习资料 (部分)

一、排放源的分类源:指污染物的发生源。
按生产过程的不同可以分为人为源和天然源。
人为源:工农业生产、生活污水、交通运输、居民燃煤天然源:动物、稻田、动物反刍根据排放源的分布特点,又可分为点源、线源和面源。
点源:指排放位置明确、排放物的组成和含量相对稳定的污染源,相对比较容易控制。
如工厂、发电站和市政污水等。
线源:交通工具等属于典型的线源。
面源:具有分布面积广、排放不规律、污染物数量多、种类杂等特点,治理起来更困难。
如农田、森林、绿地及城市街道。
二、造成环境污染的因素:有物理的、化学的和生物的三方面,其中由化学物质引起的约占80%-90%。
三、自由基及其来源:自由基在其电子外层有一个未成对电子,它们对于增加第二个电子有很强的亲和力,因此能起强氧化剂的作用。
自由基的化学活性很高,是反应的中间产物,平均寿命仅为10-3 s。
已经发现大气中存在各种自由基,如·OH、HO2·、NO3·、R·、RO2 ·(过氧烷基自由基)、RO·(烷氧基自由基)、RCO·(酰基自由基)、RCO2·、RC(O)O2·、RC(O)O·等其中·OH、HO2·、RO·、RO2·是大气中重要的自由基,而·OH自由基是迄今为止发现的氧化能力最强的化学物种,能使几乎所有的有机物氧化,它与有机物反应的速率常数比O3大几个数量级。
·OH是大气中最重要的自由基,其全球平均浓度约为7 105个/cm3。
近十几年来的研究表明,·OH自由基能与大气中各种微量气体反应,并几乎控制了这些气体的氧化和去除过程。
如·OH与SO2、NO2的均相氧化生成HOSO2和HONO2是造成环境酸化的重要原因之一;·OH与烷烃、醛类以及烯烃、芳烃和卤代烃的反应速率常数要比与O3的反应大几个数量级。
环境化学期末复习资料
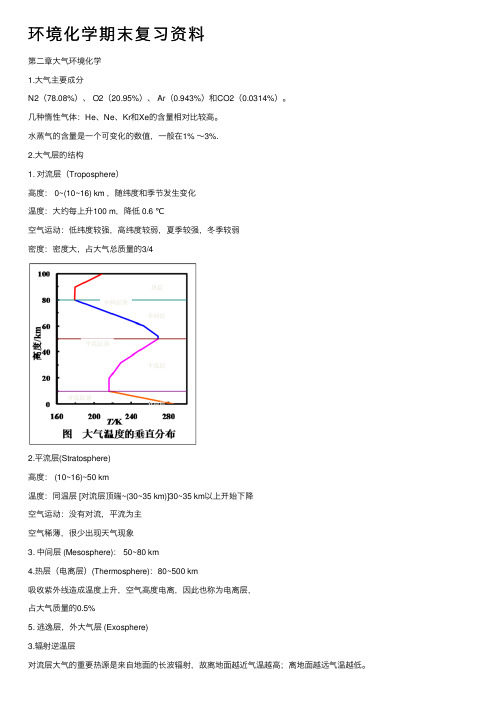
环境化学期末复习资料第⼆章⼤⽓环境化学1.⼤⽓主要成分N2(78.08%)、 O2(20.95%)、 Ar(0.943%)和CO2(0.0314%)。
⼏种惰性⽓体:He、Ne、Kr和Xe的含量相对⽐较⾼。
⽔蒸⽓的含量是⼀个可变化的数值,⼀般在1% ~3%.2.⼤⽓层的结构1. 对流层(Troposphere)⾼度: 0~(10~16) km ,随纬度和季节发⽣变化温度:⼤约每上升100 m,降低 0.6 ℃空⽓运动:低纬度较强,⾼纬度较弱,夏季较强,冬季较弱密度:密度⼤,占⼤⽓总质量的3/42.平流层(Stratosphere)⾼度: (10~16)~50 km温度:同温层 [对流层顶端~(30~35 km)]30~35 km以上开始下降空⽓运动:没有对流,平流为主空⽓稀薄,很少出现天⽓现象3. 中间层 (Mesosphere): 50~80 km4.热层(电离层)(Thermosphere):80~500 km吸收紫外线造成温度上升,空⽓⾼度电离,因此也称为电离层,占⼤⽓质量的0.5%5. 逃逸层,外⼤⽓层 (Exosphere)3.辐射逆温层对流层⼤⽓的重要热源是来⾃地⾯的长波辐射,故离地⾯越近⽓温越⾼;离地⾯越远⽓温越低。
随⾼度升⾼⽓温的降低率称为⼤⽓垂直递减率:Γ=-dT/dz式中:T——热⼒学温度,K;z——⾼度。
在对流层中,dT/dz<0,Γ = 0.6 K · (100m)-1,即每升⾼100 m ⽓温降低0.6 ℃。
⼀定条件下出现反常现象当Γ=0 时,称为等温层;当Γ<0 时,称为逆温层。
这时⽓层稳定性强,对⼤⽓的垂直运动的发展起着阻碍作⽤。
辐射逆温产⽣特点●是地⾯因强烈辐射⽽冷却降温所形成的。
●这种逆温层多发⽣在距地⾯ 100~150 m ⾼度内。
●最有利于辐射逆温发展的条件是平静⽽晴朗的夜晚。
●有云和有风都能减弱逆温。
●风速超过 2~3 m · s-1,逆温就不易形成4.主要⾃由基及其来源HO ?和HO2 ?来源1) HO ?来源清洁⼤⽓:O3 的光解是清洁⼤⽓中HO ?的重要来源O3 + h→ O ? + O2O ? + H2O → 2HO ?污染⼤⽓,如存在HNO2,H2O2 (HNO2 的光解是⼤⽓中HO ?的重要来源)HNO2 + h→ HO ? + NOH2O2 + h→ 2HO ?2)HO2 ?来源①主要来⾃醛类的光解,尤其是甲醛的光解H2CO + h→ H ? + HCO ?H ? + O2 + M → HO2 ? + MHCO ? + O2 → HO2 ? + CO②只要有 H ?和 HCO ?存在,均可与 O2 反应⽣成 HO2 ?③亚硝酸酯和 H2O2 光解CH3ONO + hv → CH3O ? + NOCH3O ? +O2 → HO2 ? + H2COH2O2 + hv → 2HO ?HO ? + H2O2 → H2O + HO2 ?④若有CO存在,则:HO ? + CO → CO2 + H ?H ? + O2 → HO2 ?R ?,RO ?,RO2 ?来源1) R ?烷基⾃由基来源:⼤⽓中存在最多的烷基是甲基,它的主要来源是⼄醛和丙酮的光解。
环境化学复习资料

环境化学复习资料环境化学复习资料环境化学是研究环境中化学物质的性质、分布、转化和对环境的影响的学科。
它涉及到大量的知识和概念,因此在复习环境化学时,我们需要有一份全面而系统的复习资料。
本文将为大家提供一些关于环境化学复习的重点内容和方法,帮助大家更好地备考。
一、环境化学基础知识1. 环境化学的定义和研究对象:环境化学是研究环境中各种化学物质的性质、分布、转化和对环境的影响的学科。
它的研究对象包括大气、水体、土壤以及生物体等。
2. 环境化学的重要概念:包括环境污染、环境质量、环境容量、环境风险等。
了解这些概念的含义和相互关系,有助于我们更好地理解环境化学的基本原理。
3. 环境化学的研究方法:环境化学研究的方法包括野外调查、实验室分析、模拟实验和数学模型等。
熟悉这些方法的应用和原理,可以帮助我们更好地进行环境化学的实验和研究。
二、环境污染物的分类和特性1. 大气污染物:包括颗粒物、二氧化硫、氮氧化物、挥发性有机物等。
它们的来源、传输和转化过程对大气环境质量具有重要影响。
2. 水污染物:包括有机污染物、无机污染物、重金属等。
了解不同污染物的特性和对水体生态系统的影响,有助于我们更好地进行水环境治理和保护。
3. 土壤污染物:包括有机污染物、重金属、农药等。
了解土壤污染物的来源和迁移途径,有助于我们更好地进行土壤环境修复和保护。
三、环境化学的应用1. 环境监测与评价:环境化学在环境监测与评价中起着重要作用。
通过采集样品,进行实验室分析,可以获得环境中各种污染物的含量和分布情况,为环境管理和决策提供科学依据。
2. 环境污染控制与治理:环境化学在环境污染控制和治理中发挥着重要作用。
通过研究污染物的来源和转化途径,制定合理的治理策略,可以有效降低环境污染的程度。
3. 环境风险评估与管理:环境化学在环境风险评估和管理中具有重要意义。
通过对环境中化学物质的毒性和暴露的评估,可以判断环境对人体健康的潜在风险,并采取相应的措施进行管理和控制。
环境化学复习资料(仅供参考_请注意核对)

环境工程化学复习第二章一、影响大气污染物迁移的因素1、风和大气湍流的影响;2、天气形势和地理地势的影响;(1)、海陆风;(2)、城郊风;(3)、山谷风、二、自由基也称游离基,是指由于共价键均裂而生成的带有未成对电子的碎片。
大气中常见的自由基如:HO·,HO2·,RO,RO2·,RC (O)O2三、与大气污染有直接关系的重要的光化学过程1、氧分子和氮分子的光解2、臭氧的光解3、NO2的光解4、亚硝酸和硝酸的光解5、二氧化硫对光的吸收6、甲醛的光解7、卤代烃的光解四、降水的化学组成无机物:土壤衍生物离子Al3+,Ca2+,Mg2+,Fe3+,Mn2+和硅酸盐等;海洋盐类离子Na+,Cl-,Br-,SO42-,HCO3-及少量K+,Mg2+,Ca2+,I-和PO43+;气体转化物SO42-,NO3-,NH4+,Cl-和H+;人为排放源As,Cd,Cr,Co,Cu,Pb,Mn,Mo,Ni,V,Zn,Ag,Sn和Hg等化合物。
五、酸雨的化学组成酸雨现象是大气化学过程和大气物理过程的综合效应。
酸雨中含有多种无机酸和有机酸,其中绝大部分是硫酸和硝酸,多数情况下以硫酸为主。
从污染源排放出来的SO2和NOx是形成酸雨的主要起始物,其形成过程为SO2+[O] →SO3SO3+H2O→H2SO4SO2+H2O→H2SO3H2SO3+[O] →H2SO4NO+[O] →NO22NO2+H2O→HNO3+HNO2式中:[O]——各种氧化剂六、影响酸雨形成的因素1、酸性污染物的排放及其转化条件2、大气中的NH33、颗粒物酸度及其缓冲能力4、天气形势的影响七、大气颗粒物的化学组成1、无机颗粒物(1)硫酸及硫酸盐颗粒物(2)硝酸及硝酸盐颗粒物2、有机颗粒物P126第四章农药的类型农药进入土壤的途径1)农药以颗粒剂形式施入土壤2)农药以种子处理剂进入土壤3)农药喷施被作物截获和散落到土壤4、农药在土壤环境中的扩散行为。
环境化学复习题库(含答案)

环境化学复习题库(含答案)环境化学复习题库第一章绪论一、填空1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占__80%-90%_。
2、环境化学研究的对象是: 环境污染物。
3、环境中污染物的迁移主要有机械、物理-化学和生物迁移三种方式。
4、人为污染源可分为_工业_、__农业_、__交通_、和__生活_。
5、如按环境变化的性质划分,环境效应可分为环境物理、环境化学、环境生物三种。
二、选择题1、属于环境化学效应的是 AA热岛效应 B温室效应 C土壤的盐碱化 D噪声A _污染水体后引起的 2、五十年代日本出现的痛痛病是由___A CdB HgC PbD As 3、五十年代日本出现的水俣病是由_B__污染水体后引起的A CdB HgC PbD As 三、问答题1、举例说明环境效应分为哪几类,2、举例简述污染物在环境各圈的迁移转化过程。
第二章大气环境化学一、填空题1、写出下列物质的光离解反应方程式:(1)NO + hν NO + O 2(2)HNO+ hν HO + NO 或HNO+ hν H + NO 2 2 2(3)HNO+ hν HO + NO 3 2(4)HCO + hν H + HCO 或HCO + hν H + CO 222(5)CHX + hν CH + X 332、大气中的NO可以转化成 HNO 、 NO和 HNO 等物质。
23333、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。
4、乙烯在大气中与O的反应机理如下: 3CH(O)CH 232第 1 页共 10 页环境化学复习题库+ CH == CH HCO+HCOO O322225、大气颗粒物的去除与颗粒物的粒度、化学组成和性质有关,去除方式有和湿沉降两种。
干沉降6、制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln + hv CFmCln-1 + ClCl + O O + ClO 32ClO +O O + Cl 27、当今世界上最引人瞩目的几个环境问题中的____温室效应_____、___臭氧层破坏_______、光化学烟雾___等是由大气污染所引起的。
《环境化学》复习资料

《环境化学》复习资料1、过氧乙酰基硝酸酯(PAN)的生成1.乙醛光解产生乙酸基2.乙酰基与空气中O2结合形成过氧乙酰基.3.过氧乙酰基与No2化合生成PANps:PAN具有热不稳定性,遇热会分解而回到过氧乙.基和NO2,因而PAN的分解和合成之间存在着平衡.2、温室效应、气体概念大气中的co2吸收了地面辐射出来的红外光,把能量截留于大气之中,从而使大气温度升高,这种现象称为温室效应,能够引起温室效应的气体,称为温室气体.3、大气颗粒物消除方式并解释/(机制)①干沉降指颗粒物在重力作用下沉降或与其他物体碰撞后发生的沉降。
机制i通重力对颗粒物作用,使其降落在土、水等物体上 ii 粒径小于0.1um 靠布朗运动扩散相互碰撞成较大颗粒随大气湍流到地面去除。
②湿沉降.指通过阵雨,降雪等使颗粒物从大气中去除.机制 i 雨除:半径小于1um ii 冲刷:半径大于4um4、水中无机物的迁移转化方式:沉淀一溶解、氧化还原、配合作用、胶体形成、吸附一解吸.5、水环境中颗粒物的吸附作用.①表面吸附:胶体具有巨大的比表面和表面能..物理吸附②离子交换吸附:静电作用,胶体每吸附一部分阳离子,同时也放出等量其他阳离子,属于物理化学吸附,不受温度影响,可逆反应③专属吸附:除化学键外,尚有加强的憎水键、范德华力、氢键在起作用.在中性表面甚至在与吸附离子带相同电荷符号的表面也可吸~6、沉积物中重金属诱发适当的因素盐浓度升高。
氧化还原条件变化。
降低ph。
增加水中配合剂的含量7、腐殖质分为腐殖酸(不碱可酸)、富里酸(可可)、腐黑物(不不)8、光解过程分三类:直接光解、敏化光解、氧化反应敏化光解:水体中存在的天然物质腐殖质被阳光激发,又将其激发态的能量转移给化合物而导致的分解。
9、有机物在土壤中的吸着在在两种机理(只适用于非离子型农药)1.分配作用:即在水溶液中,土壤有机质对有机物的溶解作用.而且在溶质的整个溶解范围内,吸附等温线都是线性的,与表面吸附位无关,只与有机物的溶解度相关(因而放出热量小)2.吸附作用:即在非极性的有机溶剂中.即在非极性有机溶剂中,土壤、矿物质对有机物表面的吸附作用或干土壤矿物质对有机物…作用.10、生物降解作用→两种代谢模式区别①生长代谢:许多有毒物质可以像天然有机污染物作为微生物的生长基质:作为微生物唯碳源有滞后期②共代谢:某些有机污染物不能作为微生物的唯一碳源和能源,必须有另外的化合物存在提供微生物碳源和能源时,该有机物才能被降解.这是共代谢无滞后期11、重金属在土壤一植物体系中的迁移及其机制,从三大类(土壤、植物、重金属分析) 1.土壤理化性质:~PH越低,H+越多,活动性越强,加大了土壤中重金属向生物体迁移的数量.~土壤质地黏重,对重金属的吸附力强,降低了重金属的迁移转化能力~土壤中有机质含量高.对重金属吸附力强.降低了重金属转化能力.~还原条件下能力弱、氧化条件下能力强。
环境化学知识点总结复习-完善版(大学期末复习资料)

第一章绪论1、环境问题:全球环境或区域环境中出现不利于人类生存和发展的各种现象,称为环境问题。
原生环境问题:自然力引发,也称第一类环境问题,火山喷发、地震、洪灾等。
次生环境问题:人类生产、生活引起生态破坏和环境污染,反过来危及人类生存和发展的现象。
目前的环境问题一般都是次生环境问题。
当今世界上最引人注目的几个环境问题温室效应、臭氧空洞、酸雨等是由大气污染所引起的。
环境污染:由于人为因素使环境的构成状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件。
造成环境污染的因素有物理、化学和生物的三个方面,其中化学物质引起的约占80%~90%。
2、认识过程:①20世纪60年代人们只把环境问题作为污染来看待,没有认识到生态破坏的问题.;②20世纪70年代1972年联合国,瑞典,斯德哥尔摩“人类环境会议”,将环境污染和生态破坏提升到同一高度看待;③20世纪80年代1987年,由挪威首相布伦特兰夫人组建的“联合国世界环境与发展委员会”发表了《我们共同的未来》;④20世纪90年代1992年,巴西,里约热内卢,联合国环境与发展大会,强调和正式确立了可持续发展的思想,并形成了当代的环境保护的主导意识。
环境保护的主要对象是由于人类生产、生活活动所引起的次生环境问题,主要包括:环境污染和生态破环两个方面。
为保护人类生存环境,联合国将每年的4月22定为世界地球日,6月5日定为世界环境日。
3、环境化学定义:是一门研究有害化学物质在环境介质中的存在、化学特征、行为和效应及其控制的化学原理和方法的科学。
研究特点:(1)以微观研究宏观:从原子、分子水平,研究宏观环境圈层中环境现象和变化机制;(2)研究对象复杂:既有人为来源的也有天然来源的,处于环境开放体系内,多种环境因素同时相互作用,其研究需要多学科的结合。
(3)物质水平低:mg/kg(ppm,10-6)、ug/kg(ppb,10-9)发展动向:目前,国界上较为重视元素(尤其是碳、氮、硫和磷)的生物地球化学循环及其相互偶合的研究;重视化学品安全评价、臭氧层破坏、气候变暖等全球变化问题。
环境化学 复习提纲

环境化学复习提纲环境化学复习提纲环境化学的发展与基本内容1.环境化学基本概念、发展动向、研究内容及热点问题水环境化学1.天然水的基本特征和组成;2.水体无机污染物的迁移转化。
着重配合作用、氧化-还原作用、沉淀和溶解、水体颗粒物的吸附作用等基本原理及其实际应用。
3.水中有机污染物的迁移转化:环境行为和归宿模型。
重点介绍了典型的分布、挥发和水解等迁移转化机制和模式。
4.水体的富营养化问题:水体富营养化;水体富营养化的机理;营养物质的来源;富营养化的影响因素;湖水的营养化程度;水体富营养化的危害及其防治对策。
大气环境化学5.大气中污染物的特性;6.大气中污染物的迁移和转化(温室效应;气相大气化学:光化学反应、光化学烟雾、臭氧层的形成与耗损化学;液相大气化学:酸沉降化学、大气中液相反应;大气颗粒物化学);7.重要的大气环境化学问题:光化学烟雾的定义、特征和形成条件;光化学烟雾主要与物质有关;光化学烟雾形成机理;光化学烟雾危害及预防;光化学烟雾和硫酸烟雾的比较;太阳和地球辐射之间的能量平衡;温室气体;温室效应;全球变暖与对策;降水的化学成分;形成酸雨;酸雨的影响因素;酸雨的危害和预防;平流层的组成;臭氧层形成和消耗的化学反应;臭氧空洞的危害;臭氧层破坏的现状与预防。
土壤环境化学8.土壤组成与性质(吸附、酸碱性、缓冲性及氧化还原性质);9.污染物在土壤-植物体系中的迁移及其机制(重金属、氮磷);10.农药在土壤中的迁移(典型迁移过程)。
农药在土壤中迁移的基本特征、扩散质体、流动吸附和分布、典型农药在土壤中的迁移和转化、有机氯农药、有机磷农药。
化学品的生物和生态效应11.污染物质在生物体内的转运及消除。
物质透过细胞膜的形式;物质在生物体内的转运,生物转化及消除。
12.污染物的生物累积、放大和积累。
生物积累,生物积累,生物放大和生物积累。
13.有机污染物的生物降解。
耗氧量(有机污染物)和有毒有机污染物的生物降解。
环境化学复习要点

环境化学复习要点绪论1.环境化学是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学。
2.有害化学物质即环境污染物:进入环境后使环境的正常组成和性质发生变化,这种变化会直接或间接地有害于人类,这样的物质称为环境污染物3.环境污染:由于人为因素使环境的构成或状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件,就叫环境污染。
4.环境容量:在人类生存和自然生态不致受害的前题下,某一环境所能容纳的污染物的最大负荷量。
5.环境效应—自然过程或人类的生产生活活动会对环境造成污染和破坏,从而导致环境系统的结构和功能发生变化。
6. 环境化学效应—在各种环境因素的影响下,物质间发生化学反应产生的环境效应,分为土壤盐碱化地下水硬度增高光化学烟雾地下水污染酸雨造成土壤酸化、建筑物受腐蚀环境物理效应—由物理作用引起的环境效应,包括噪声地面沉降热岛效应温室效应大气能见度降低7. 各圈层的环境化学:大气环境化学水环境化学土壤环境化学环境生态学第二章1. 三大环境热门话题:全球气候变化酸沉降臭氧损耗2. 温度层结-大气的温度在垂直方向的分布3. 对流层特点:气温随高度升高而降低:大气降温率0.6k/100m;垂直方向对流,上冷下热,有利于污染扩散;逆温(上热下冷)易发生污染事件;平流层特点:同温层:对流层的下层,大约25km以下,气温保持不变或稍有上升; 大约25km以上,温度随高度升高而升高平均递增率为 1.4K/km,到平流层顶,温度接近0℃4. 源-大气组分产生的途径和过程汇-指大气组分从大气中去除的途径和过程源强-进入大气的组分输入速率(Fi)汇强-从大气输出组分的速率为(Ri)某种组分在进入大气后到被清除之前在大气中停留的平均时间-称为平均停留时间或停留时间(存在时间、寿命)-τ τ=大气中的总贮量Mi / Fi 或者Ri停留时间意义:某组分的停留时间越长,表明该组分在离开大气或转化成其它物质以前,在环境中存留的时间也越长;某组分的停留时间越长,表明该组分在大气中的储量相对于输入(出)来说是很大的,即使人类活动大大改变了该组分的的输入(出)速度,对其总量的影响也不明显;若组分停留时间越短,其输入(出)速率的改变就对总贮量很敏感。
环境化学复习资料(参考)

环境化学复习主要内容绪论部分1环境化学定义及主要研究内容:环境化学:是一门研究环境介质中化学物质存在、行为、效应以及减少或消除其环境影响的科学。
其以环境问题为研究对象、以解决环境问题为目标,是环境科学的核心组成部分。
环境化学主要内容包括:✓环境介质中有害化学物质的存在水平和形态;✓污染物来源及其在环境介质的环境化学行为;✓污染物生态效应和人类健康效应风险和产生机制;✓缓解和消除污染物环境影响以及预防污染物危害的方法和途径。
2现代环境化学研究的特点体现在以下几个方面:✓研究体系复杂;✓环境样品量微;✓从微观的原子、分子水平来阐明宏观的环境问题,从深层的机制去理解和解决问题。
;✓综合性强,涉及多学科领域3、污染物的迁移方式:机械迁移、物理-化学迁移、生物迁移4、迁移:污染物在环境中所发生的空间位移及其所引起的富集、分散和消失的过程。
5、转化:污染物在环境中通过物理、化学或生物的作用改变存在形态或转变为另一种物质的过程。
(物质性质的变化)大气环境化学1、影响大气污染物迁移的因素:(1)、风和湍流。
风:污染物向下风向的扩散;湍流:向各个方向的扩散;浓度梯度:质量向低浓度的扩散(2)、天气形势和地理地势产生的逆温现象:山谷风、海陆风、城郊风(3)、污染源本身的特性(温度、浓度、化学稳定性)2、大气中HO∙和HO2∙的来源:(1)HO∙的来源清洁大气:O3的光解是OH的重要来源:O3+hv →O ∙+O2O ∙+H2O →2HO ∙污染大气:HNO2+hv →HO ∙+ NOH2O2+hv →2HO ∙(2)HO2∙的来源:醛的光解,尤其是甲醛;H2CO +hv →H ∙+HCO ∙H ∙+O2+M →HO2∙+MHCO ∙+O2→HO2∙+CO任何光解过程只要产生H 或HCO 自由基的,都可以与O2结合而导致HO2。
亚硝酸酯的光解:CH3ONO +hv →CH3O ∙+NOCH3O ∙+O2 →HO2∙+H2COH2O2的光解:H2O2+hv →2HO ∙HO ∙+H2O2 →H2O ∙+HO23、(1)光化学烟雾:氮氧化物和碳氢化合物等一次污染物在阳光照射下发生光化学反应并产生二次污染物,此过程形成的混合烟雾污染现象即为光化学烟雾。
环境化学期末复习重点

第二章1对流层:对流层是气的底层,其厚度在10~12km。
质量却占气总质量的3/4。
每升100m温度降低0.6℃平流层:由对流层顶到50km左右高度称为平流层。
温随高度而升。
存在臭氧层中间层(过渡层):处于平流层顶至85 km左右的区域,温度随度升高而下降。
热层(电离层):中间层顶800km左右的区域。
温随高度而升。
逸散层:800km以上的高空2气污染物:是指由于人类活动或自然过程排大的并对人或环境产有害影响的那些物质。
颗粒物、二氧化硫、氮氧化物、碳氢化合物、一氧化碳。
3气稳定度:指气层的稳定程度,即气中某高度处的气块在垂直向上的相对稳定程度。
4影响气污染物迁移的因素:①风和大气湍流②天气形势和地理地势5气中污染物的转化:是污染物在气中经过化学反应,转化成无毒化合物,从而去除了污染或者转化成为毒性更大的二次污染物加重污染。
6光化学反应过程:分、原子、自由基或离吸收光子而发生的化学反应称为光化学反应。
7常见自由基:OH:主要源于臭氧光解O3+hv=O·+O2 O·+H2O=2·OH HNO2+hv=·OH+NO H2O2+hv=2·OH CH4+·O=CH3·+·OHO2:主要源于醛的光HCHO+hv =H·+HCO·H+O2+M=HO2· +M HCO·+O2=HO2 ·+CO CH3ONO+hv=CH3O·+NO CH3O·+O2=HO2 ·+HCOH H2O2+hv=2·OH ·OH+H2O2=HO2·+H2O ·OH+CO=CO2+·H ·H+O2=HO2 ·R. RO. RO2等:气中存在量最多的烷基自由基是甲基,主要来源于乙醛和丙酮的光解。
CH3CHO+hv=CH3·+HCO·CH3COCH3+hv=CH3·+CH3CO ·RH+·O=R·+OHRH+·OH=R·+H2O R·+O2=ROO·CH3ONO+hv=CH3O·+NO CH3ONO2+hv=CH3O·+NO28光化学烟雾现象:含有氮氧化物和碳氢化物等一次污染物的大气,在阳光照射下发生光化学反应而产生二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾现象称为光化学烟雾。
环境化学期末复习题库

《环境化学》期末复习题库第一章绪论一、问答题1、环境中主要的化学污染物有哪些?2、当前人类生存面临的主要环境问题有哪些?3、举例简述污染物在环境各圈的迁移转化过程。
第二章大气环境化学一、问答题1、试述酸雨的主要成分、成因及危害,写出有关化学反应式。
并阐述重庆地区酸雨频率高,而北京酸雨频率低的原因。
2、写出光化学烟雾的链反应机制。
3、为什么排放到大气中的CFCs能破坏臭氧层,写出有关化学反应式。
4、说明臭氧层破坏的原因和机理。
5、试述大气中CO2等气体浓度上升,引起温室效应的原因。
6、试比较伦敦烟雾和洛杉矶光化学烟雾的区别。
7、简要叙述用富集因子法判断气溶胶粒子污染来源的基本原理、方法(步骤)。
8、影响污染物在大气中运动的主要因素有哪些?第三章水环境化学一、问答题3、水体污染物可分几类?4、试述水体中有机污染物的迁移转化途径。
5、试述水体中汞甲基化的途径及影响因素,写出有关反应式。
7、试解释用BOD5、COD Cr评价水环境质量时会掩盖有毒有害有机物污染的风险。
10、影响有机物光化学降解的因素有哪些?11、试述水的氧化还原限度及pE值。
二、计算1、若一个天然水体的pH为7.0。
碱度为1.4mmol/L,需加多少酸才能把水体的pH降低到6.0。
(碳酸平衡系数查看书本34页表2-6)7、与含21%O2的空气处于平衡的pH=7.00的水溶液,其pE值为多少?已知E = 20.75V8、书本P91页的第9题。
第四章土壤环境化学一、问答题1、有机磷农药在环境中的主要转化途径。
举例说明其原理。
2、进入土壤的农药是怎样迁移转化的?3、举例说明影响土壤中农药残留量的因素。
4、什么是土壤污染?如何判别?农药等污染物进入土壤后是怎样自净的?5、阐述As、Cd在土壤-植物体系中的迁移(存在形态、迁移、危害等)?6、什么是土壤的活性酸度与潜性酸度?试用它们二者的关系讨论我国南方土壤酸度偏高的原因。
第五章生物体内污染物质的运动过程及毒性一、简答题1、试说明化学物质致突变、致癌和抑制酶活性的生化作用机理。
《环境化学》复习资料总结(课件版)

《环境化学》复习资料总结(课件版)《环境化学》复习资料总结(课件版)一、绪论:1.什么是环境化学(1)环境化学是在化学科学的传统理论和方法基础上发展起来的,以化学物质在环境中出现而引起的环境问题为研究对象,以解决环境问题为目标的一门新兴学科。
(2)定义:它是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学,既是环境科学的核心组成部分,也是化学科学的一个新的重要分支。
2、环境化学的内容查明潜在有害物质在环境介质中存在的来源,浓度水平和形态分布;对这些潜在有害物质溯本求源,并查明它们在环境介质中和不同环境介质之间的环境化学行为;查明这些潜在有害物质对环境、生态系统和人体健康发生作用的途径、方式、程度和风险;探索缓解或消除这些有害物质已造成的影响或防止它们可能造成影响的方法和途径。
3、环境污染物:是环境化学研究的对象,主要指进入环境后使环境的正常组分和性质发生直接或间接的有害于人类的变化的物质。
大部分污染物是人类生产和生活活动产生的。
4、环境学或毒理学意义的重金属:Hg、Cd、Pb、Zn、Cu、Co、Ni、Ba(钡)、Sn(锡)、Sb(锑)等,从毒性角度讲还包括:As、Be、Li、Se、B、Al等。
5、BTEX:苯、甲苯、乙基苯和三个二甲基苯的异构体。
是汽油中的重要组成部分,并广泛用作溶剂。
这些化合物是土壤和地下水的常见污染物。
6、PAHs:多环芳烃7、有机卤化合物:①氟氯烃(CFCs)②有机溶剂③有机氯农药④PCB多氯联苯,有209 个同系物和PCT多氯三联苯,有8149 个同类物。
8、POPs名单:滴滴涕(DDT) 六氯苯二恶英呋喃9、环境效应:自然过程或人类的生产和生活活动会对环境造成污染和破坏,从而导致环境系统的结构和功能发生变化。
10、环境本底:也称环境背景值某地未受污染的环境中某种化学元素或化学物质的含量(浓度)。
目前,未受污染的环境已经基本不存在,因此获得环境本底已经十分困难,一般只能获得相对轻污染的环境背景值。
环境化学期末考试复习资料

环境化学期末考试复习资料一、名词解释:1、环境问题:人类各种活动或自然因素作用于环境而使环境质量发生变化,由此对人类的生产、生活、生存与持续发展造成不利影响的问题称为环境问题.2、环境污染:由于人为因素使环境的构成或状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件,叫做环境污染。
3、富营养化:是指在人类活动的影响下,生物所需的氮、磷等营养物质大量进入湖泊、河口、海湾等缓流水体,引起藻类及其它浮游生物迅速繁殖,水体溶解氧量下降,水质恶化,鱼类及其它生物大量死亡的现象。
4、分配系数:非离子性有机化合物可以通过溶解作用分配到土壤有机质中,并经过一段时间达到分配平衡,此时有机化合物在土壤有机质和水中的含量的比值称为分配系数。
5、标化分配系数:达分配平衡后,有机毒物在沉积物中和水中的平衡浓度之比称为标化分配系数。
6、辛醇-水分配系数:达分配平衡时,有机物在辛醇中的浓度和在水中的浓度之比称为有机物的辛醇-水分配系数。
7、生物浓缩因子:有机毒物在生物体内浓度与水中该有机物浓度之比。
8、亨利定律常数:化学物质在气——液相达平衡时,该化学物质在在水中的平衡浓度和其水面大气中的平衡分压之比。
9、水解常数:有机物在水中水解速率与其在水中浓度之比称为水解常数。
10、直接光解:有机化合物本身直接吸收太阳光而进行分解反应.11、敏化光解:腐殖质等天然物质被光激发后,将激发的能量转移给有机化合物而导致分解反应。
12、光量子产率:进行光化学反应的光子占吸收总光子数之比称为光量子产率。
13、生长代谢:微生物可用有机化合物(有机污染物)作唯一碳源和能源从而使该化合物降解的代谢。
14、共代谢:某些有机污染物不能作为微生物的唯一用碳源和能源,须有另外的化合物提供微生物的碳源和能源,该化合物才能降解。
15、生物富集(Bio—enrichment):指生物通过非吞食方式(吸收、吸附等),从周围环境(水、土壤、大气)中蓄积某种元素或难降解的物质,使其在机体内的浓度超过周围环境中浓度的现象。
环境化学复习资料

环境化学复习资料环境化学是一门涉及环境与化学相互作用的学科,其应用广泛,被广泛运用于环境保护、资源利用等领域。
而环境化学的学习则涉及较多的知识点和理论,需要通过不断的复习来掌握。
以下是本人总结的环境化学复习资料,供同学们参考。
一、环境化学基础环境化学的基础部分主要包括环境污染与环境质量标准、环境样品处理与化学分析等方面的知识。
首先需要了解环境中存在的各种污染物以及它们的来源和危害,例如大气污染物、水体污染物、土壤污染物等等。
同时,也需要掌握环境中污染物的化学分析方法,例如常用的气相色谱、液相色谱、原子吸收光谱等方法。
二、环境污染物的化学特性环境污染物的化学特性是环境化学的重要内容之一。
根据不同的污染物,其化学特性也各不相同。
例如,大气中的硫化物和氮化物在大气中可以发生化学反应,形成硫酸盐和硝酸盐,进而导致酸雨的形成。
而水中的重金属离子则具有不同的氧化态,在不同的氧化态下其危害性也不同。
因此,复习环境化学时需要掌握不同污染物的化学特性,以便更好地分析其危害性和去除方法。
三、环境污染的治理技术环境污染的治理是环境保护的重要手段。
而环境污染的治理技术既包括传统的化学处理方法,也包括先进的生物技术、膜技术等科技手段。
复习环境化学时需要掌握各种治理技术的优缺点,并对其适用场景和实际应用进行掌握。
四、绿色化学绿色化学是一种新型的化学范式,强调在化学科学研究、生产和使用中,以最小的资源利用和环境污染为前提。
复习绿色化学需要掌握其发展历程、基本理论及其在环境化学中的应用。
同时,还需要了解绿色化学的未来发展方向,以推动绿色环保事业向前发展。
综上所述,环境化学虽然知识点较多,但其应用领域非常广泛,具有重要的实用性和现实意义。
复习环境化学时,需要掌握其基础内容,了解污染物的化学特性,学习治理技术,同时也要关注绿色化学及其应用,以推动绿色环保事业的发展。
环境化学复习资料

环境化学复习资料《环境化学》综合复习资料一、填空题1.污染物在环境中的迁移主要有、和三种方式。
2. 、、以及,是目前世界上公认的主要环境问题。
3.大气的温度随地面的高度而变化,这构成了大气分层的基础。
大气圈按高度自下而上分成、、和。
4.大气颗粒物有三种重要的表面性质:、和。
大气颗粒物在雨滴形成的过程就属。
5.研究酸雨必须进行雨水样品的化学分析,通常分析的主要阳离子有;阴离子有。
6.用一个强碱标准溶液滴水样,以酚酞作为指示剂,此时所得的结果称为,其化学反应计量式为。
7.水中颗粒物的吸附作用可分为、和;其中属于物理吸附的是。
8.当向天然水体中加入有机物后可得到一氧下垂曲线。
碳元素在清洁区和腐败区内的分解产物分别是和。
9.当向天然水体中加入有机物后可得到一氧下垂曲线,它把河流分为相应的几个区段,在清洁区内决定电位物质是;在腐败区内决定电位物质是。
10.腐殖质的组成非常复杂,根据它在溶液中的溶解度不同划分为、和三类。
11.天然水P E越小,提供电子倾向,水中污染物还原态相对浓度。
12.有机污染物一般通过、、、和等过程进行迁移转化。
13.典型土壤随深度呈现不同的层次,是生物最活跃的一层,有机质大部分在这一层,金属离子和粘土颗粒在此层中被淋溶得最显著。
14.岩石的化学风化分为三个历程,即、和。
15.汞及其化合物的挥发程度与化合物的形态及、、等因素密切相关。
无机汞化合物挥发度最大的是,最小的是。
16.砷的甲基化在厌氧菌作用下主要产生,在水溶液中继续氧化成为;而汞的甲基化在厌氧菌作用下主要产生;与无机砷相比,有机砷的毒性。
17. 是金属甲基化过程中甲基基团的重要生物来源。
砷的甲基化在厌氧菌作用下主要产生,在水溶液中继续氧化成为;而好氧的甲基化反应则产生,在水溶液中继续氧化成为,它可与巯基发生的应。
18.日本西部地区发生的米糠油中毒事件是由引起的,而该物质目前唯一的处理方法是。
痛痛病是由于长期食用含量高的稻米引起的中毒。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环境化学复习题一、名词解释(一)绪论:环境问题、环境污染、环境化学(广义及狭义)、实验模拟系统研究、环境效应、环境本底、环境容量、浓缩系数、协同作用和拮抗作用、物质的源与汇、一次污染物和二次污染物(二)大气环境化学降尘、飘尘、总悬浮颗粒物、大气温度层结和密度层结、同质层和异质层、光化学反应、自由基、自由基反应、温室效应和温室气体、干沉降和湿沉降、酸沉降、酸性降水、臭氧洞、气溶胶、大气颗粒物、IP、PM10、一次颗粒物和二次颗粒物、PM2.5、空气动力学直径、颗粒物的三模态(三)水环境化学标化分配系数、Kow、天然水的碱度和酸度、吸附等温线、BCF、亨利定律、氧垂线、甲基橙碱度、酚酞碱度、电子活度、pE、决定电位、分配作用、分配系数、生长代谢和共代谢(四)污染物在环境中的转归与效应PTS、优先污染物、POPs二、问答题(一)绪论:1、环境化学的概念、任务及研究内容2、环境化学的研究方法3、什么是环境污染物?环境污染物的来源及其分类4、何谓环境效应?如按环境变化的性质划分,可分为哪几类?请分别解释并各举二例。
5、八大公害事件的主要污染物是什么?(二)水环境化学1、大气的结构2、对流层和平流层的特点3、大气污染物的分类4、大气中主要的含氮化合物有哪些?分别叙述其源和汇。
5、叙述光化学反应的过程6、物质发生光离解必须遵循哪两个定律?7、为什么波长大于700nm的光不会使物质发生光离解,试计算说明。
8、写出甲醛、亚硝酸和硝酸、NO2的光离解、臭氧、CFCl3(氟里昂一11)和 CF2Cl2(氟里昂—12)的光解9、大气层中O2分子化学键的断裂所需多少波长的光?已知O-O键能 492kJ/mol10、大气中重要的自由基及其来源(HO.和HO2·)11、写出大气氮氧化物的转化过程12、什么是光化学烟雾?叙述其特征及形成条件及形成机理,写出形成光化学烟雾的主要反应。
13、叙述SO2的污染机制及氧化机制。
14、什么是SO2的液相催化氧化?15、什么是伦敦型污染?什么是洛杉矶烟雾?试比较两者的区别。
16、为什么把pH5.6作为判定是否酸性降水的界限?试计算说明17、通过对降水的多年观察,近年来已经对pH5.6能否作为酸性降水的界限以及判别降水是否受到酸化和人为污染的合理界限提出了异议。
请解释原因。
18、降水中的重要的离子组分有哪些?19、叙述酸雨的形成机理。
20、通过比较酸雨区与非酸雨区的数据,发现阴离子(SO42-+ NO3-)浓度相差不大,但pH却相差很大,为什么?21、影响酸雨形成的因素有哪些22、平流层中臭氧的作用是什么?臭氧层减少有哪些危害?23、为什么目前认为氟氯烃化合物是导致臭氧洞出现的主要物质?24、臭氧层破坏的原因及机制25、叙述气溶胶的源与汇。
26、气溶胶的分类?27、如何理解颗粒物对人体的危害程度与其粒径大小和化学组成密切相关.28、大气中的有机化合物物种类繁多,目前关注较多的是PAHs和亚硝铵类化合物,B[a]P被认为是毒性最强的多环芳烃. 70%-90%分布在细粒子中.29、试分析具有温室效应作用的“臭氧”与平流层的“臭氧”差别?(1)地球上90%的臭氧分布在距地面25km的平流层,另外约10%存在于对流层。
(2)对流层臭氧是一种温室气体,它的浓度随纬度、经度、高度和季节变化而变化。
对流层臭氧浓度北半球比南半球高。
(3)平流层中的臭氧吸收了太阳发射到地球的大量对人类、动物和植物有害的紫外线,为地球提供了一个防止紫外线辐射的屏障。
(4)通过观测发现,平流层中的臭氧含量减少,而对流层中的臭氧含量增加。
由于有90%的臭氧在平流层,所以总量在下降。
(5)对流层臭氧形成人为来源:NO2的光解反应是它在大气中最重要的化学反应,是大气中O3生成的引发反应,也是O3唯一的人为来源。
(6)南极上空平流层臭氧(臭氧层)浓度减少,形成了臭氧空洞。
30、大气中的自由基是如何产生的?其高浓度值出现在地球的哪个地带和部位?哪个季节和时间?为什么?31、温室效应是如何产生的?写出方程式,举出三种温室气体。
32、试论述酸雨对中国西南地区和华北地区土壤酸度可能产生的影响及原因。
33、简述大气颗粒物的危害及其清除机制。
34、1946-1955年在美国洛杉矶大约有250万辆汽车,耗油1600 万升/日。
该市众多居民曾患红眼病,严重患者呼吸困难、胸痛、头晕、发烧、呕吐、以致血压降低。
试分析其环境病因及作用机理?(三)水环境化学1、天然水中的主要离子有哪些?2、在水体中存在着CO2、H2CO3、HCO3—、CO32—等四种化合态,常把CO2、H2CO3合并为H2CO3*,H2CO3含量极低,主要是溶解性气体CO2。
3、请推导出封闭体系碳酸平衡中[H2CO3*]、[HCO3-]和[CO32-]的表达式.4、什么是天然水体的酸度和碱度?它主要由哪些物质组成?5、碱度和酸度的表达式。
6、什么是水体自净。
试论述水体自净作用的机制。
7、某化工厂的含汞废水经化学处理后排入黄浦江中,排污口附近水中汞的含量为0.4~0.5 mg/L,而在下流500 m处汞的含量只有3~4μg/L,试分析自工厂排放出来的汞主要集中在排污口附近的底泥中原因?8、无机污染物(重金属)的迁移转化过程有哪些?9、天然水体中的胶体一般可分为无机胶体、有机胶体和有机无机胶体复合体。
10、水环境中颗粒物对重金属的吸附作用可分为:表面吸附、离子交换吸附和专性吸附。
11、什么是吸附等温式?吸附等温线有几种?请列出公式及对应的图形12、沉积物中的重金属可能重新进入水体产生二次污染。
分析其主要原因。
13、电子活度的意义?推导pE= pE0 +1/n lg[氧化态]/[还原态]14、推导水的氧化限度和还原限度。
15、在高H+活度,高电子活度的酸性还原介质中,Fe2+为主要形态。
高H+活度,低电子活度的酸性氧化介质中, Fe3+为主要形态。
低酸度氧化介质,Fe(OH)3(S)为主要形态。
碱性还原介质,Fe(OH)2(S)为主要形态。
16、一般天然水体溶解氧是“决定电位”,而有机污染物积累的厌氧体系中有机物是“决定电位”介于二者之间者,则其“决定电位”为溶解氧体系和有机物体系的结合。
17、重金属在天然水体中主要以腐殖酸的配合物形式存在。
腐殖质与Hg2+ , Cu2+的配合作用最为紧密,Zn2+,Cd2+次之。
18、配位体对重金属迁移的影响19、无机氮化合物的氧化还原转化20、无机铁的氧化还原转化21、化学品在水体中的光解过程有几种?22、有机污染物在水环境中的迁移转化主要途径有哪些?23、有机物生物降解存在哪两种代谢模式?三、计算题1、已知干空气中氧气的含量为20.95%(体积),250C时水的蒸气压为0.03167x105Pa,氧气的亨利定律常数是1.26x10-8mol/L·Pa。
计算250C氧在水中的溶解度.2、已知干空气中CO2的含量为0.0314%(体积),250C时水的蒸气压为0.03167x105Pa,CO2的亨利定律常数是 3.34x10-7mol/L•Pa。
计算CO2在水中的溶解度。
(CO2的酸离解常数K1=4.45x10-7)3、已知某水体碱度为 1.00 x10-3mol/L,pH为8.00, 请计算[H2CO3*]、[HCO3-]和 [CO32-]和[OH-]浓度各是多少? 若水体pH为10.0碱度仍为 1.00 x10-3mol/L时, 它们的浓度又各是多少? (CO2的酸离解常数K1=4.45x10-7,K2=4.69x10-11)4、若一个天然水的pH为7.0,碱度为1.4mmol/L,求需加多少酸才能把水体的pH降低到6.0?5、计算好氧水和厌氧水的pE6、用活性炭吸附水中某色素的Freundlish等温线方程为(x/m)=3.9C0.5。
现有100t含色素浓度为0.05g/L的待处理水,需将色素除去90%,求所需活性炭量。
7、3.0g活性炭放入含苯酚浓度C0=0.05mol/L的500ml水溶液中,使用吸附等温线x/m=5.2×C0.21(mmol/g),计算达到平衡时苯酚浓度可降至多少?8、含镉废水通入H2S达到饱和并调整pH为8.0,请计算出水中剩余镉离子浓度(已知CdS溶度积为7.9×10-27,饱和H2S浓度为0.1mol/L,H2S两级电离总平衡常数K sp’=1.16×10-23)9、已知1.013×105Pa和25℃条件下大气中二氧化碳的分压为P CO2=330ppm(全球在1974年的平均浓度),求酸雨的定义限值。
10、有如下两个单体系,其中一个是Cu2+、Cu+( pE0 = 5.82,[Cu2+]=10-5mol/L, [Cu+]=10-4mol/L),另一个是Fe3+ 、 Fe2+(pE0 = 13.05, [Fe3+]=10-3 mol/L,Fe2+ = 0.1mol/L)。
如果各取1升,将其成为一个混合体系,并假定Fe3+被Cu+还原完全,试计算哪个体系是决定电位?解:有两个单体系Cu2+ + e === Cu+ pE0 = 5.82当[Cu2+ ]=10-5mol/L,[Cu+ ]=10-4mol/L时, pECu2+ /Cu+ = 4.82Fe3+ + e = Fe2+ pE0 = 13.05当[Fe3+]=10-3 mol/L,Fe2+ = 0.1mol/L时,pEFe3+/Fe2+ = 11.05如果各取1升,将其成为一个混合体系,并假定Fe3+ 被Cu+还原完全,则有[Fe3+]=(10-3 - 10-4)/2 = 4.5×10-4 mol/L[Fe2+]=(10-1 +10-4)/2 =5.005×10-2 mol/L混合体系的电位为:pE混合 = pEFe3+/Fe2+ = pE0Fe3+/Fe2++ lg[Fe3+]/[Fe 2+]=(13.05+lg 4.5×10-4/5.005×10-2 = 11.00由上可知,混合体系的pE处在铜单体系与铁单体系电位之间,并与含量较高的铁单体系的电位相近。
所以铁体系为决定电位。
10、Kp的计算(书上例题及课后习题)。
