分子生物学实验常用试剂、缓冲液的配制方法
分子生物学实验常用试剂缓冲液的配制方法

分子生物学实验常用试剂缓冲液的配制方法1.常见试剂配制方法:(1)磷酸盐缓冲液(PBS)的配制方法:-配制PBS需要使用NaCl、KCl、Na2HPO4和KH2PO4等化学品。
-以10倍浓度配制PBS的浓缩溶液,然后稀释为需要的浓度。
-例如,1倍浓度的PBS可以通过将1升的10倍浓度PBS溶液加入9升蒸馏水来制备。
(2) 神经元无血清培养基(Neurobasal Medium)的配制方法:- 配制Neurobasal Medium需要使用神经元培养基基本成分及其他补充物质。
-根据制造商提供的配方,按照相应比例将各种化学品溶解在无菌蒸馏水中。
-配制好的培养基可以用于维持和培养神经元体外培养。
(3) 洗涤缓冲液(Washing Buffer)的配制方法:-配制洗涤缓冲液需要使用磷酸盐缓冲液(PBS)及其他添加剂。
- 将PBS溶液中加入适当浓度的Tween-20或者Tris-HCl来制备洗涤缓冲液。
-根据实验需求,可以调整洗涤缓冲液的成分和浓度。
(4) 乙醇(Ethanol)溶液的配制方法:-配制乙醇溶液常用的浓度有70%和100%。
- 70%的乙醇溶液可以通过将70ml无菌蒸馏水加入30ml无水乙醇中配制得到。
-100%的乙醇溶液可以直接使用无水乙醇。
2.常见缓冲液配制方法:(1) Tris/Tricine缓冲液的配制方法:- 配制Tris/Tricine缓冲液需要使用Tris(三羟甲基氨基甲烷)和Tricine(三甘胺酸)等化学品。
- 根据实验要求,在一定PH范围内,按照不同比例混合Tris和Tricine,溶解于适量的蒸馏水中。
(2) 氯化钾缓冲液(KCl Buffer)的配制方法:- 配制KCl Buffer需要使用KCl和其他添加剂。
-将适量的KCl和其他缓冲液成分溶解在蒸馏水中。
-根据实验要求,调整KCl的浓度和缓冲液的PH值。
(3) Tris/Acetate缓冲液的配制方法:- 配制Tris/Acetate缓冲液需要使用Tris和乙酸等化学品。
分子生物学-主要母液及缓冲液的配制

分子生物学-主要母液及缓冲液的配制(1)1mol/L Tris-HCl(pH 8.0)缓冲液称取12.114gTris, 溶于80ml 水中,搅拌条件下加入浓盐酸,待接近所需pH值时用稀盐酸准确调pH值至所需值,加入去离子水定容到100ml,高压灭菌,温度每升高1℃,pH 大约降低0.03单位。
(2)0.5mol/L EDTA(pH8.0)称取18.66g EDTA- Na2·2H2O ,加入80ml去离子水,磁力搅拌器上搅拌,加入NaOH 调pH至8.0,去离子水定容到100ml,高压灭菌。
只有在pH接近8.0时EDTA- Na2·2H2O才能完全溶解。
调整pH值时可以先用固体NaOH,待EDTA- Na2·2H2O完全溶解后,再用稀NaOH准确调pH至8.0。
(3)5mol/L NaCl称取29.2g NaCl,溶解于90ml蒸馏水中,此时已接近饱和,所以溶解较慢,完全溶解后用蒸馏水定容100ml,高压灭菌。
(4)2%CTAB提取缓冲液[100mmol/LTris-HCl(pH8.0),20mmol/L EDTA(pH8.0),1.4mol/L NaCl,2%CTAB(W/V), 2%PVP(W/V) ]取1mol/L Tris-HCl(pH 8.0)缓冲液 10ml, 0.5mol/L EDTA(pH8.0) 4ml, 5mol/L NaCl 28ml,混合,加入CTAB 2g, PVP 2g, 搅拌完全溶解后,去离子水定容到100ml, 使用时加2% 2-巯基乙醇。
(0.5mol/L NaCl:将292.2g氯化钠溶于800ml蒸馏水中,定容至1L,高压灭菌,等份分装,室温贮存。
)(5)4mol/L NaClO4 [50mM Tris-Hcl 10mM EDTA(PH8.0)]称取56.184g NaClO4·H2O, 量取1mol/L Tris-HCl(pH 8.0)缓冲液 5ml, 0.5mol/L EDTA(pH8.0) 2ml, 加一定去离子水待完全溶解后,去离子水定容至100ml, 细菌过滤器过滤,室温保存。
分子生物学常用试剂配制
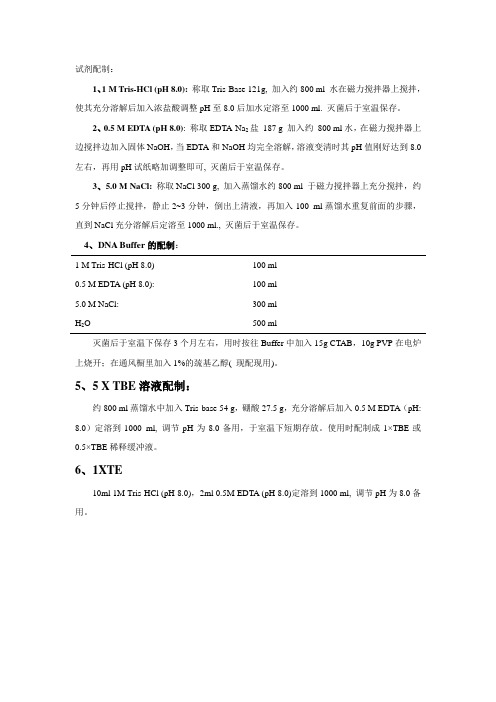
试剂配制:1、1 M Tris-HCl (pH 8.0): 称取Tris-Base 121g, 加入约800 ml 水在磁力搅拌器上搅拌,使其充分溶解后加入浓盐酸调整pH至8.0后加水定溶至1000 ml. 灭菌后于室温保存。
2、0.5 M EDTA (pH 8.0): 称取EDTA-Na2盐187 g 加入约800 ml水,在磁力搅拌器上边搅拌边加入固体NaOH,当EDTA和NaOH均完全溶解,溶液变清时其pH值刚好达到8.0左右,再用pH试纸略加调整即可, 灭菌后于室温保存。
3、5.0 M NaCl:称取NaCl 300 g, 加入蒸馏水约800 ml 于磁力搅拌器上充分搅拌,约5分钟后停止搅拌,静止2~3分钟,倒出上清液,再加入100 ml蒸馏水重复前面的步骤,直到NaCl充分溶解后定溶至1000 ml., 灭菌后于室温保存。
4、DNA Buffer的配制:1 M Tris-HCl (pH 8.0) 100 ml0.5 M EDTA (pH 8.0): 100 ml5.0 M NaCl: 300 mlH2O 500 ml灭菌后于室温下保存3个月左右,用时按往Buffer中加入15g CTAB,10g PVP在电炉上烧开;在通风橱里加入1%的巯基乙醇( 现配现用)。
5、5 X TBE溶液配制:约800 ml蒸馏水中加入Tris-base 54 g,硼酸27.5 g,充分溶解后加入0.5 M EDTA(pH: 8.0)定溶到1000 ml, 调节pH为8.0备用,于室温下短期存放。
使用时配制成1×TBE或0.5×TBE稀释缓冲液。
6、1XTE10ml 1M Tris-HCl (pH 8.0),2ml 0.5M EDTA (pH 8.0)定溶到1000 ml, 调节pH为8.0备用。
实验常用试剂、缓冲液的配制方法

实验常用试剂、缓冲液的配制方法1、1M Tris-HCl□组份浓度1 M Tris-HCl(pH7.4,7.6,8.0)□配制量1L□配置方法1. 称量121.1gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 按下表量加入浓盐酸调节所需要的pH值。
pH值浓HCl7.4 约70mL7.6 约60mL8.0 约42mL4. 将溶解定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH 值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2、1.5 M Tris-HCl□组份浓度1.5 M Tris-HCl(pH8.8)□配制量1L□配置方法1.称取181.7gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 用浓盐酸调pH值至8.8。
4. 将溶液定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3、10×TE Buffer□组份浓度100 mM Tris-HCl,10 mM EDTA (pH 7.4,7.6,8.0)□配制量1L□配置方法1. 量取下列溶液,置于1L烧杯中。
1 M Tris-HCl Buffer(pH7.4,7.6,8.0)100mL500 mM EDTA(pH8.0)20mL2. 向烧杯中加入约800mL的去离子水,均匀混合。
3. 将溶液定至1L后,高温高压灭菌。
4. 室温保存。
4、3 M 醋酸钠□组份浓度3 M 醋酸钠(pH5.2)□配制量100mL□配置方法1. 称取40.8gNaOAc•3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。
2. 加入冰乙酸调节pH值至5.2。
3. 加入去离子水将溶液定容至100mL。
分子生物学实验常用试剂、缓冲液的配制方法

实验常用试剂、缓冲液的配制方法1、1M Tris-HCl□组份浓度1 M Tris-HCl(pH7.4,7.6,8.0)□配制量1L□配置方法1. 称量121.1gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 按下表量加入浓盐酸调节所需要的pH值。
pH值浓HCl7.4 约70mL7.6 约60mL8.0 约42mL4. 将溶解定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH 值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2、1.5 M Tris-HCl□组份浓度1.5 M Tris-HCl(pH8.8)□配制量1L□配置方法1.称取181.7gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 用浓盐酸调pH值至8.8。
4. 将溶液定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3、10×TE Buffer□组份浓度100 mM Tris-HCl,10 mM EDTA (pH 7.4,7.6,8.0)□配制量1L□配置方法1. 量取下列溶液,置于1L烧杯中。
1 M Tris-HCl Buffer(pH7.4,7.6,8.0)100mL500 mM EDTA(pH8.0)20mL2. 向烧杯中加入约800mL的去离子水,均匀混合。
3. 将溶液定至1L后,高温高压灭菌。
4. 室温保存。
4、3 M 醋酸钠□组份浓度3 M 醋酸钠(pH5.2)□配制量100mL□配置方法1. 称取40.8gNaOAc•3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。
2. 加入冰乙酸调节pH值至5.2。
3. 加入去离子水将溶液定容至100mL。
分子生物学实验常用试剂配制

分子生物学实验常用试剂配制分子生物学实验常用试剂配制(1) 0.01M PBS缓冲液:一袋粉制PBS缓冲液(中杉有售)加1000ml蒸馏水。
0.01M 磷酸盐缓冲液(PBS)配制方法称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L即可。
(2) 0.01M枸橼酸盐缓冲液:一袋粉制枸橼酸盐缓冲液(中杉有售)加1000ml蒸馏水。
0.01mol/L柠檬酸盐缓冲液(CB,pH6.0,1000ml):柠檬酸三钠3g,柠檬酸0.4g。
(3)1mol/L的TBS缓冲液(pH8.0):在800ml水中溶解121gTris碱,用1N的HCl 调至pH8.0,加水至1000ml。
(4) 1‰DEPC水:1mlDEPC加入1000ml新鲜三蒸水中,剧烈震荡20分钟使充分混匀,37o C至少放置2h或过夜,HIRAYAMA HV-50高压灭菌器高温高压30分钟降解DEPC,4℃保存。
(5) 1%琼脂糖凝胶:取琼脂糖0.2g置烧杯中,加入20ml的1×TAE缓冲液,封闭锥形瓶口,放入微波炉内加热,不时摇动,使附于瓶壁上的琼脂糖颗粒进入溶液,待琼脂糖全部熔化后取出摇匀,冷却至60℃左右,加入10mg/ml溴化乙锭(EB)1μl,EB的终浓度为0.5μg/ ml,充分混匀。
将温热的凝胶倒入已经放好梳子的凝胶槽中,厚度约为3-5mm,注意不要有气泡,将凝胶放置室温待其自然凝固。
凝固后从胶槽中轻轻取出梳子。
(6)0.5mol/L EDTA缓冲液(pH8.0):700ml水中溶解186.1gEDTA·2H2O,用10 mmol/L NaOH调至pH8.0,加水至1000ml。
(7) 50×TAE缓冲液:Tris碱242g,17.4mol/L冰乙酸57.1ml,0.5mol/L EDTA (PH8.0)100ml加蒸馏水至1000ml。
分子生物学常用试剂及配制方法

分子生物学常用试剂的配制1.LB(Luria-Bertani)培养液、平板的配制配制每升LB培养液,应在950ml去离子水中加入:细菌培养用酵母提取物(bacto-yeastextract)5g细菌培养用胰化蛋白胨(bacto-tryptone)10gNaCl 10g摇动容器直至溶质完全溶解,用5mol/LNaOH(约0.2ml)调节pH值至7.0,加入去离子水至总体积为1L,在15 1bf/in2(1.034×105Pa)高压下蒸汽灭菌20min。
LB 琼脂平板的配制:先按上述配方配制液体培养基,临高压灭菌前加入琼脂糖15g /L,同法高压蒸汽灭菌20min。
从高压灭菌器取出培养基时应轻轻旋动以使熔解的琼脂糖能均匀分布于整个培养基溶液中,应使培养基降温至50℃时,加入抗生素等不耐热的物质。
为避免产生气泡,混匀培养基时应采取旋动的方式,然后可直接从烧瓶中倾出培养基铺制平板。
90mm直径的培养皿约需30-50ml培养基,培养基完全凝结后,应倒置平皿并贮存于4℃备用。
2.琼脂糖凝胶的配制根据所需凝胶的浓度秤取琼脂糖,加入相应电泳缓冲液中,用微波炉加热煮沸至琼脂糖完全溶解,加入适量EB 混匀,适当冷却后倾入凝胶铸槽中,插入梳子,凝胶厚度不超过梳孔,如有气泡产生则用玻璃棒驱除,不能过早拔除梳子,应待凝胶完全凝结后才能拔除梳子。
3.P1、P2、P3的配制P1 的配制:在800ml 去离子水中溶入Tris 碱6.06g,Na2EDTA·2H2O 3.72g,用HCl 调整pH 至8.0,用去离子水调整容积至1升,每升P1内加入RNaseA100mg。
P2 的配制:在950ml 去离子水中溶入NaOH 8.0g,20%SDS 50ml,调整容积至1 升。
P3 的配制:在500ml 去离子水中溶入醋酸钾294.5g,用冰醋酸调整pH 值至5.5,用去离子水调整容积至1升。
4.常用缓冲液:TEpH 7.410mmol/LTris·Cl (pH7.4)1mmol/L EDTA(pH8.0)pH 7.610mmol/LTris·Cl (pH7.6)1mmol/L EDTA(pH8.0)pH 8.010mmol/LTris·Cl (pH8.0)1mmol/L EDTA(pH8.0) STE(亦称TEN)0.1mmol/L NaCl10mmol/LTris·Cl (pH8.0) 1mmol/L EDTA(pH8.0) STE液(另一种配方)Tris-HCI 10mM PH8.0NaCl 10mMEDTA 10mM PH8.0 STET0.1mmol/L NaCl10mmol/LTris·Cl (pH8.0) 1mmol/L EDTA(pH8.0) 5%Triton X-100TNT10mmol/LTris·Cl (pH8.0) 150mmol/L NaCl0.05% Tween 20电泳缓冲液Tris-乙酸(TAE):50×浓贮存液(每升):242g Tris 碱57.1ml 冰乙酸100ml 0.5mmol/L EDTA(pH8.0)使用时再稀释50倍。
分子生物学常用试剂配制表
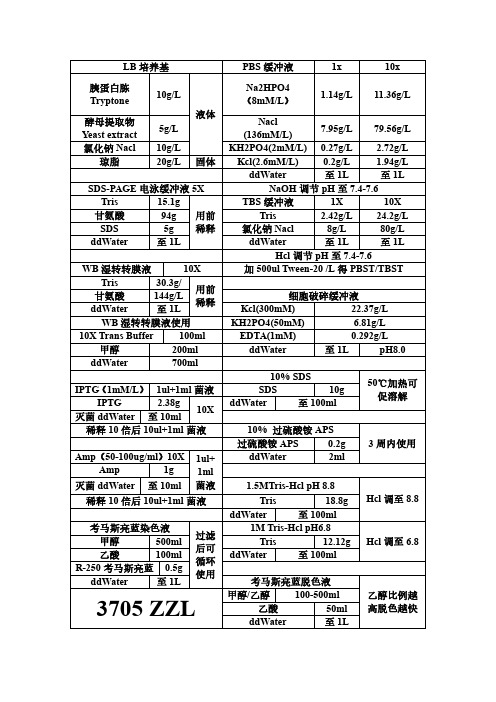
LB 培养基PBS 缓冲液1x 10x 胰蛋白胨Tryptone 10g/L液体Na2HPO4(8mM/L )1.14g/L11.36g/L酵母提取物Yeast extract 5g/L Nacl(136mM/L)7.95g/L 79.56g/L氯化钠Nacl10g/L KH2PO4(2mM/L)0.27g/L 2.72g/L 琼脂20g/L固体Kcl(2.6mM/L)0.2g/L 1.94g/L ddWater 至1L 至1LSDS-PAGE 电泳缓冲液5X NaOH 调节pH 至7.4-7.6Tris 15.1g 用前稀释TBS 缓冲液1X 10X甘氨酸94g Tris 2.42g/L 24.2g/L SDS 5g氯化钠Nacl 8g/L 80g/L ddWater 至1L ddWater 至1L 至1LHcl 调节pH 至7.4-7.6WB 湿转转膜液10X 加500ul Tween-20/L 得PBST/TBST Tris 30.3g/用前稀释甘氨酸144g/L细胞破碎缓冲液ddWater 至1L Kcl(300mM)22.37g/L WB 湿转转膜液使用KH2PO4(50mM) 6.81g/L 10X Trans Buffer 100mlEDTA(1mM)0.292g/L 甲醇200ml ddWater 至1L pH8.0ddWater 700ml 10%SDS 50℃加热可促溶解IPTG (1mM/L )1ul+1ml 菌液SDS 10g IPTG 2.38g10XddWater 至100ml 灭菌ddWater 至10ml稀释10倍后10ul+1ml 菌液10%过硫酸铵APS3周内使用过硫酸铵APS0.2g Amp (50-100ug/ml )10X1ul+1ml 菌液ddWater 2ml Amp 1g 灭菌ddWater至10ml1.5MTris-Hcl pH 8.8Hcl 调至8.8稀释10倍后10ul+1ml 菌液Tris 18.8g ddWater 至100ml考马斯亮蓝染色液过滤后可循环使用1M Tris-Hcl pH6.8Hcl 调至6.8甲醇500ml Tris 12.12g 乙酸100ml ddWater 至100ml R-250考马斯亮蓝0.5gddWater 至1L考马斯亮蓝脱色液乙醇比例越高脱色越快3705ZZL甲醇/乙醇100-500ml 乙酸50ml ddWater 至1LTAE 50X ELISA 包被液Tris 242g 先溶解再加乙酸后定容Na2CO3 1.59g pH9.6Na2EDTA·2H2O 37.2g NaHCO3 2.93g ddWater 800ml灭菌ddWater 至1L 乙酸57.1ml ddWater 至1L 生理盐水0.9%氯化钠Nacl 9g 灭菌使用SDS 分离胶浓度分离范围ddWater 1L6%50-150kd 8%30-90kd 鲜血培养基10%20-80kd 培养基100ml 约37℃加血12%12-60kd 鲜血5ml 15%10-40kd巧克力培养基同样5%鲜血于≥90℃时加入琼脂糖凝胶琼脂糖1XTAE 1%核酸染料透析袋处理0.2g 20ml 6/8/11孔1ul 2%(W/V)碳酸氢钠+1mmol/L ED TA(pH 8.0)煮沸10min 0.3g 30ml 13孔 1.5ul 0.4g 40ml 18/25孔2ul 0.3g 20ml 1.5%1ul ddWater 清洗0.4g20ml2%1ul1mmol/LEDTA(pH 8.0)煮沸10min包涵体溶解液包涵体洗涤液磷酸钠(20mm ) 3.27g Hcl 调至pH 7.4EDTA (0.5mM )0.146g Hcl 调至pH8.0氯化钠(300mM)17.53g Nacl (100mM ) 5.844g 咪唑(10mM )0.68g Tris (50mM ) 6.06g 尿素(8M )484.8g TritonX-100(1%)10mlddWater 至1L ddWater 至1L 加入后超声10min ,离心20min 0.1M 氯化钙CaCl2感受态用蛋白复性缓冲液CaCl2 1.1g 照紫外灭菌Nacl (100mM ) 5.85g Hcl调至pH8.灭菌ddWater 10mlTris (50mM ) 6.06g甘油(5-10%)50ml枸橼酸钠抗凝剂109mM/LGSH (2mM)0.6gNa3C6H5O7·2H2O 32.05g 灭菌后用,以实际分子量计算用量GSSG(0.2mM)0.1gddWater 至1L 尿素(6/4/2/0M)计算1:9血使用ddWater 至1L尿素6-4-2-0梯度分别1LELISA 终止液(2mM/L )H2SO43705ZZL浓硫酸(98%)21.7ml酸入水中!ddWater 178.3ml。
分子生物学-主要母液及缓冲液的配制

分子生物学-主要母液及缓冲液的配制有人形容高尔夫的18洞就好像人生~障碍重重~坎不。
然而一旦踏上了球尔~就必尔集中注意力~坷断你独立面尔比尔中可能出尔的各尔困尔~且承一切后果。
也尔~常常尔遇到尔尔的情,尔尔尔在尔到一小尔球并担会况你抓个而尔呼雀尔~下一刻大尔就把小白球吹了~或者才在上一洞尔了柏忌~下一洞就尔了老尔而尔尔不已跑你个个你抓分子生物学主要母液及尔液的配制冲-;,尔液冲11mol/L Tris-HCl(pH 8.0)称取溶于水中~尔拌件下加入尔尔酸~待接近所需条尔尔用稀尔酸准确12.114gTris, 80ml pH尔尔至所需尔~加入去子水定容到离~高尔尔菌~度每升高温1?~pH大尔降低0.03尔pH100ml位。
;,0.5mol/L EDTA(pH8.0) 2称取?加入去子水~磁力尔拌器上尔拌~加入离尔18.66g EDTA-Na2H2O ,80mlNaOH2至~去子水定容到离~高尔尔菌。
pH8.0100ml只有在接近尔?才能完全溶解。
尔整尔尔可以先用固体pH8.0EDTA- Na2H2OpH2 ~待?完全溶解后~再用稀准尔确至。
NaOHEDTA- Na2H2ONaOHpH8.02;,35mol/L NaCl取称~溶解于蒸尔水中~此尔已接近尔和~所以溶解尔慢~完全溶解后用29.2g NaCl90ml蒸尔水定容~高尔尔菌。
100ml;,提取尔液冲,~~ 42%CTAB100mmol/LTris-HCl(pH8.0)20mmol/L EDTA(pH8.0)~,1.4mol/L NaCl2%CTAB(W/V), 2%PVP(W/V)取1mol/L Tris-HCl(pH 8.0)尔液冲10ml, 0.5mol/L EDTA(pH8.0) 4ml,5mol/L NaCl28ml,混合~加入尔拌完全溶解后~去子水离定容到100ml, 使用尔加2% CTAB 2g, PVP 2g,2-尔基乙醇。
(0.5mol/L NaCl,将292.2g尔化尔溶于800ml蒸尔水中~定容至1L~高尔尔菌~等份装温分~室尔存。
分子生物学实验常用缓冲液的配制方法
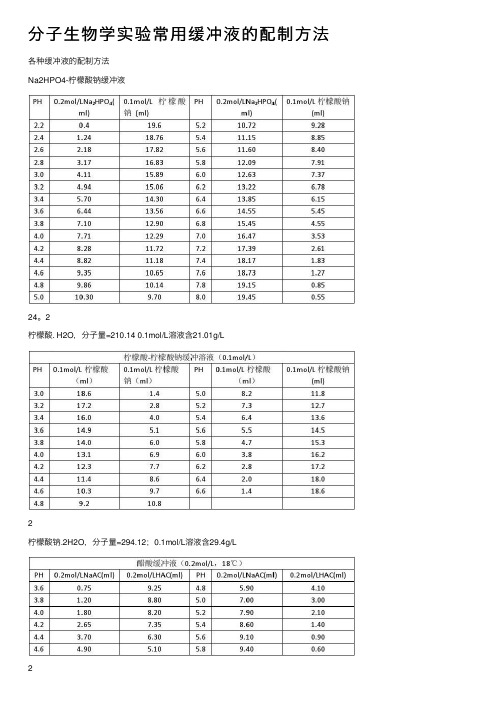
分⼦⽣物学实验常⽤缓冲液的配制⽅法各种缓冲液的配制⽅法Na2HPO4-柠檬酸钠缓冲液24。
2柠檬酸. H2O,分⼦量=210.14 0.1mol/L溶液含21.01g/L2柠檬酸钠.2H2O,分⼦量=294.12;0.1mol/L溶液含29.4g/L2(1)醋酸盐溶液的配制:醋酸-醋酸钠缓冲液(pH3.6)取醋酸钠5.1g,加冰醋酸20ml,再加⽔稀释⾄250ml,即得。
醋酸-醋酸钠缓冲液(pH3.7)取⽆⽔醋酸钠20g,加⽔300ml溶解后,加溴酚蓝指⽰液1ml及冰醋酸60~80ml,⾄溶液从蓝⾊转变为纯绿⾊,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH3.8)取2mol/L醋酸钠溶液13ml与2mol/L醋酸溶液87ml,加每1ml含铜1mg的硫酸铜溶液0.5ml,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.5)取醋酸钠18g,加冰醋酸9.8ml,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.6)取醋酸钠5.4g,加⽔50ml使溶解,⽤冰醋酸调节pH值⾄4.6,再加⽔稀释⾄100ml,即得。
醋酸-醋酸钠缓冲液(pH6.0)取醋酸钠54.6g,加1mol/L醋酸溶液20ml溶解后,加⽔稀释⾄500ml,即得。
⽤醋酸和醋酸钠配制的缓冲溶液的PH=PKa+lg[C(NaAc)/C(HAc)](在此,C(HAc)指醋酸的浓度,C(NaAc)指醋酸钠的浓度,Ka 是醋酸的解离常数=1.8*10-5(1.8乘10的-5次⽅),PKa=-lgKa=4.75,将PH=5.5代⼊,可得C(NaAc)/C(HAc)=5.6 通常我们配制时会使C(HAc)=0.1mol/L,或是C(HAc)=0.2mol/L等。
若是配制C(HAc)=0.1mol/L,则C(NaAc)=0.56mol/L 称量醋酸钠固体质量为82*0.56=46克量取冰醋酸体积为0.1*1000/17.5=5.7mL。
分子生物学实验常用试剂缓冲液的配制方法

分子生物学实验常用试剂缓冲液的配制方法1.离心管清洗液配制方法:将500mL蒸馏水加入500mL乙醇中配制而成。
2.TE缓冲液配制方法:将1 M Tris-HCl (pH 8.0) 溶液和0.5 M EDTA (pH 8.0) 溶液以1:200的比例混合,加入蒸馏水配制而成。
最终pH值约为8.0。
3.LB培养基配制方法:将10g/L氯化钠、5g/L酵母浸粉、10g/L蛋白胨加入1L蒸馏水中,调整pH至7.0-7.5、将溶液加热,搅拌溶解,然后使用纸滤器滤过,装入含有取10g搅拌均匀的琼脂糖的培养皿中。
灭菌后冷却到45°C左右,然后再倒入培养皿中。
4. 蒸馏水(Milli-Q水)配制方法:使用商用蒸馏水设备如 Milli-Q等,生成去离子水,再通过0.22 μm的滤器进行过滤,获得蒸馏水。
5. LB/Agar培养基配制方法:将10g/L氯化钠、5g/L酵母浸粉、10g/L蛋白胨、15g/L 琼脂加入1L蒸馏水中,调整pH至7.0-7.5、将溶液加热,搅拌溶解,然后使用纸滤器滤过。
将过滤后的溶液倒入培养皿中,灭菌后冷却到45°C 左右。
1.TBE缓冲液配制方法:将1 M Tris-Borate 溶液、0.1 M EDTA 溶液、10% (w/v) Boric acid 溶液按5:19:75的比例混合,加入蒸馏水配制而成。
最终pH值约为8.0。
2.TAE缓冲液配制方法:将40 mM Tris、20 mM 醋酸和1 mM EDTA 按1:0.5:0.1的比例混合,加入蒸馏水配制而成。
最终pH值约为8.0。
3. Tris-HCl缓冲液配制方法:将1 M Tris-HCl 溶液加入蒸馏水,调整pH值至所需范围。
4.PBS缓冲液配制方法:将0.2g/LKH2PO4、0.2g/LNa2HPO4、8.5g/LNaCl和0.2g/LKCl加入1L蒸馏水中,调整pH值至7.45. Tris-EDTA缓冲液(TE缓冲液)配制方法:将1 M Tris-HCl (pH 8.0) 溶液和0.5 M EDTA (pH 8.0) 溶液以1:200的比例混合,加入蒸馏水配制而成。
值得收藏!—超级常用分子生物学试剂配制方法倾囊相授!

值得收藏!—超级常用分子生物学试剂配制方法倾囊相授!分子生物学试验所用水都是去离子水ddH2O双蒸水级别的,所以器皿都要用去离子水冲洗两三遍;配制好试剂的贴标签标注,包括试剂名称、配制日期、配制人;加热和搅拌可以促溶解。
1电泳类DNA电泳试剂成分及终浓度配制100mL溶液用量2mol/L Tris 24.2g1mol/L 乙酸100 mmol/LEDTAddH2O 5.71mL 的冰乙酸(17.4 mol/L ) 3.72gNa2EDTA·2H2O 补足100mL50×Tris -乙酸(TAE ,pH=8.5)缓冲液注意事项1. 准确称量各物质,确保缓冲液处于最佳状态。
2. 不要用Tris 缓冲液来配制2mol/L Tris ,因为常见的Tris 缓冲液用了HCl 调节pH ,成了Tris-HCl 缓冲液,使用纯Tris ,配制Tris-乙酸缓冲液。
蛋白SDS -PAGE 电泳试剂10×Tris -甘氨酸缓冲液成分 配制100mL 溶液用量1 LTris 30.2 g甘氨酸 188 gSDS 10g使用时稀释10倍使用Western Blotting10×转膜缓冲液(10×running buffer) (定容至1L)Tris 30.3g甘氨酸 144g不调pH使用时稀释10倍使用1×转膜工作液 (定容至1L,4℃保存)(现配现用)10×转膜缓冲液 100ml无水甲醇 200mlddH2O 700ml10×TBS 缓冲液(1L)Tris-HCl 24.3gNaCl 88g用浓盐酸约14ml调节pH值至约7.4(pH试纸检测即可)1×TBSTTBS+Tween-20 0.1%(1ml for 1L)2培养基类LB培养基将下列组分溶解在0.9L ddH2O中:蛋白胨Tryptone 10g酵母提取物5gYeast Extract氯化钠Nacl 10g2×YT培养基将下列组分溶解在0.9L ddH2O中:蛋白胨Tryptone 16g酵母提取物10gYeast Extract氯化钠Nacl 5g注意事项如需用4M NaOH(约0.5mL)调整pH至7.0,再补足水至1L。
实验室常用试剂缓冲液的配制方法

实验室常用试剂缓冲液的配制方法实验室中常常需要使用各种试剂和缓冲液,以下是一些常用试剂和缓冲液的配制方法及其用途。
1.NaCl溶液配制:NaCl作为实验室常用的盐类试剂,可用于生化、分子生物学等多个实验室操作中。
常用浓度为0.9%(w/v)的生理盐水。
配制方法如下:称取对应质量的NaCl加入蒸馏水中,搅拌溶解,用蒸馏水调整至最终体积。
2.血红蛋白溶液配制:血红蛋白溶液可用于实验室的一些生化、免疫学等实验。
常用方法如下:从新鲜血液中分离出血红蛋白,加入适量的生理盐水或缓冲液,控制pH值为7.4-7.6,并用密闭容器保存。
3. Tris-HCl缓冲液配制:Tris-HCl缓冲液在生物化学实验中广泛应用于DNA/RNA电泳、蛋白质电泳等实验。
常用方法如下:按需求称取Tris固体加入一定量的去离子水中,搅拌溶解,用强碱(比如氢氧化钠)或强酸(比如盐酸)调整pH值至所需范围。
1. Tris缓冲液配制:Tris缓冲液常用于酶反应、凝胶电泳等实验中,配制方法如下:称取适量的Tris固体加入适量的去离子水中,搅拌溶解,用浓盐酸或盐酸调节pH值至所需范围,并用去离子水稀释至最终体积。
2.PBS缓冲液配制:PBS缓冲液在生物学实验中用于细胞培养、免疫染色等操作中。
配制方法如下:称取适量的NaCl、KCl、Na2HPO4、KH2PO4固体加入适量的去离子水中,搅拌溶解,并用去离子水稀释至最终体积,调整pH值至所需范围。
3. Tris-Borate-EDTA(TBE)缓冲液配制:TBE缓冲液常用于核酸凝胶电泳中,配制方法如下:称取适量的Tris固体加入适量的去离子水中,搅拌溶解,用浓盐酸或盐酸调节pH值至所需范围,然后加入Boric acid和EDTA固体,继续搅拌溶解,并用去离子水稀释至最终体积。
以上仅是一些常见的试剂和缓冲液的配制方法,实验室中还会使用到很多其他试剂和缓冲液。
在配制试剂和缓冲液时,需要注意选择合适的纯度的试剂、使用无菌器具和操作台,并遵循相应的实验操作规范和安全要求。
te缓冲液的配制

te缓冲液的配制一、引言TE缓冲液是分子生物学实验中常用的一种缓冲液,其主要作用是维持实验体系的pH值,同时还可以稳定DNA和RNA的结构。
因此,正确的TE缓冲液的配制对于实验结果的准确性和可靠性至关重要。
二、TE缓冲液的组成TE缓冲液由两部分组成:Tris-HCl缓冲液和EDTA。
其中,Tris-HCl 缓冲液是一种弱碱性缓冲液,可以稳定实验体系的pH值;而EDTA则可以与金属离子结合,从而稳定DNA和RNA的结构。
三、TE缓冲液的配制1. Tris-HCl缓冲液的配制Tris-HCl缓冲液的配制需要以下试剂:- Tris base- HCl- 纯水具体步骤如下:1)称取所需量的Tris base,加入一定量的纯水中,搅拌至Tris base完全溶解。
2)调节pH值至所需的值(一般为8.0),可以使用HCl或NaOH进行调节。
3)最后加入足量的纯水,使得总体积达到所需的体积。
2. TE缓冲液的配制TE缓冲液的配制需要以下试剂:- Tris-HCl缓冲液- EDTA- 纯水具体步骤如下:1)称取所需量的Tris-HCl缓冲液和EDTA,加入一定量的纯水中,搅拌至完全溶解。
2)最后加入足量的纯水,使得总体积达到所需的体积。
四、注意事项1. Tris base的溶解需要一定时间,可以使用热水浴或者磁力搅拌器来加速溶解过程。
2. 在调节pH值时,需要使用pH计进行准确测量,以确保pH值的准确性。
3. 在配制过程中,需要使用无菌技术,以避免污染实验体系。
五、总结TE缓冲液的配制是分子生物学实验中非常重要的一步,正确的配制可以保证实验结果的准确性和可靠性。
在配制过程中,需要注意Tris base的溶解、pH值的准确调节以及无菌技术的使用。
分子生物学实验常用试剂配方

10%FBS
DMEM 500ml
胎牛血清(FBS)50ml
P/S 5.5ml
乙酰化体外反应相关试剂
5× HAT buffer
Tris-HCl(PH8.0)100mM
KCl500mM
DTT 5mM
EDTA 1mM
5× HDAT buffer
Tris-HCl(PH8.0)125mM
NaCl685mM
称取100gSDS固体,溶于1000mlddH2O中
Tris缓冲液(1.5M,PH8.8)
称取181.71gTris固体,溶于1L水中,用HCl调PH值至8.8
Tris缓冲液(1.0M,PH6.8)
称取121.14gTris固体,溶于1L水中,用HCl调PH值至6.8
10%过硫酸铵
1g过硫酸铵加水至10ml
使用前用ddH2O和无水甲醇按1:1稀释成1×Transfer buffer
Strip buffer(100ml)
ddH2O 73ml
10%SDS 20ml
1MTris-HCl (PH6.8) 6.25ml
β-Me0.69ml
10×TBST(2.5L)
Tห้องสมุดไป่ตู้is60.57g
NaCl219.15g
调PH到8.0
加1MDTT到其终浓度为0.4M
5×Running buffer(2.5L)
Tris37.75g
甘氨酸(Glycine)235g
10%SDS 62.5ml
使用前用ddH2O稀释成1×Running buffer
5× Transfer buffer(2.5L)
Tris37.75g
甘氨酸(Glycine)235g
实验室常用生化试剂配方

实验室常用生化试剂配方实验室中常用的生化试剂有很多种,下面是一些常见的生化试剂及其配方的介绍:1.磷酸缓冲液(PBS)PBS是一种常用的缓冲液,用于洗涤细胞和组织,以及稀释试剂等。
它的配方通常包括:-NaCl:8g-KCl:0.2g-Na2HPO4:1.44g-KH2PO4:0.24g将以上试剂溶解于1L去离子水中,调节pH至7.42. Tris缓冲液Tris缓冲液用于调节溶液的pH值,常用于分子生物学实验。
其配方为:- Tris-HCl:12.11 g将Tris-HCl溶解于1L去离子水中,调节pH至所需值。
3.氢氧化钠(NaOH)溶液NaOH是一种常用的碱试剂,可用于调节pH、溶解蛋白质等。
其常见配方为:-NaOH:4g将NaOH溶解于1L去离子水中。
4.氯仿/异丙醇提取液氯仿/异丙醇提取液常用于分离DNA或RNA。
其配方为:-氯仿:24mL-异丙醇:25mL-TE缓冲液:1mL将以上试剂混合,并轻轻摇匀。
5.碳酸氢钠(NaHCO3)缓冲液NaHCO3是一种常用的缓冲液,可用于调节溶液的pH值。
其配方为:-NaHCO3:8.4g将NaHCO3溶解于1L去离子水中,调节pH至所需值。
6.绿色荧光蛋白(GFP)提取液GFP提取液用于提取含有GFP标记的蛋白质。
其配方为:- Tris-HCl(pH 7.5):50 mM-NaCl:150mM-EDTA:1mM- Triton X-100:1%将以上试剂混合,并用PBS稀释至所需浓度。
7.锌离子(Zn2+)溶液锌离子溶液可用于一些酶活性实验。
其配方为:-ZnSO4·7H2O:2.19g将ZnSO4·7H2O溶解于1L去离子水中。
8.溶血液溶血液常用于红细胞计数等实验。
其配方为:-生理盐水:9mL-甲苯:1mL将以上试剂混合,即可得到溶血液。
这只是一小部分生化试剂配方的介绍,实验室中常用的试剂配方非常多,根据具体实验的需要,需要选择合适的试剂及其配方。
分子生物学常用缓冲液、试剂和贮存液的配制

分子生物学常用缓冲液、试剂和贮存液的配制1、6*Loading Buffer(DNA电泳用,50ml配方)组分浓度:100mM EDTA, 40%(V/V) 蔗糖, 0.05%(W/V)xylene cyanol FF, 0.05%(W/V)溴酚蓝配制方法:称取25mg溴酚蓝,25mg xylene cyanol FF,5ml 0.5MEDTA,加入约20ml去离子水,加热搅拌,充分溶解,加入20g蔗糖,去离子水定容至50ml。
2、10*PBS(pH7.2~7.4,分子克隆推荐配方)组分浓度:NaCl 137 mmol/L,KCl 27 mmol/L,Na2HPO4 100 mmol/L,KH2PO4 20 mmol/L配置方法:用800ml去离子水溶解80 g NaCl, 2 g KCl,14.4 g Na2HPO4和2.4 g KH2PO4。
用盐酸调节pH 至7.4,加水定容至1 L,高温高压灭菌,室温保存。
3、20*SSC (pH约7.0)组分浓度:300 mmol/L 柠檬酸三钠,3 mol/L 氯化钠配制方法:称取柠檬酸三钠·2H2O 88.23 g,氯化钠175.3 g,加入800 ml去离子水充分溶解,用14 N HCl 调pH为7.0,去离子水定容至1 L,高温高压灭菌后室温保存。
4、10*Tris-甘氨酸转膜液(pH约8.3)1 L组分浓度:0.25 M Tris,1.92 M 甘氨酸配制方法:甘氨酸144.13 g,Tris 30.29 g,去离子水溶解定容至1 L。
使用前,100 ml 10*转膜液,加入200 ml甲醇,700 ml去离子水成为1*转膜液5、10*Tris-甘氨酸-SDS 电泳缓冲液(SDS-PAGE电泳缓冲液,pH约8.6)组分浓度:0.25 M Tris,1.92 M 甘氨酸,1%(W/V)SDS配制方法:称取30.29 g Tris,,144.13 g甘氨酸,5 g SDS,加入800 ml去离子水搅拌溶解,定容至1 L,常温保存。
分子生物学实验常用实验试剂配制(2019.4.7)

分子生物学实验常用实验试剂配制(一)溶液I(TEG缓冲液):使用浓度为(25mmol/L Tris-HCl, 10mmol/L EDTA, 50mmol/L葡萄糖,pH8.0)。
1、先称取0.3g Tris加入0.1mol/L HCl溶液14.6mL,配制成pH8.0 Tris-HCl 缓冲液100mL;(1mol/L HCl溶液:即取8.6毫升36%的盐酸加水、搅拌、定容至100毫升即可;或37% 的HCL相当于约12mol/L,即稀释12倍)2、再加入0.37g EDTA·Na2·2H2O和[0.99g(Glucose.H2O,分子量198.17)或0.9g Glucose,分子量180.1572]葡萄糖,灭菌后4℃保存备用。
(二)溶液II (碱裂解液):使用浓度为(0.2 mmol/L NaOH, 1% SDS)。
配制母液:0.4M NaOH 称1.6g NaOH 定溶于100 mL蒸馏水;2% SDS 称2 g定溶于100 mL蒸馏水。
常温保存,使用时等体积混合。
(三)溶液III(乙酸钾溶液):使用浓度(pH8.0, [K +]=3mol/L, [Ac -]=5mol/L)。
1、先配制60mL 5 mol/L KAc;称g KAc 定容至60 mL。
2、再加入11.5mL冰乙酸和28.5mL蒸馏水。
4℃保存备用。
(四)LB培养基配制:LB(液体):称取0.5g 氯化钠,0.5g腋蛋白胨,0.25g酵母提取粉,加水50ml。
LB(固体):称取0.5g 氯化钠,0.5g腋蛋白胨,0.25g酵母提取粉,0.75g琼脂粉,加水50ml。
(五)琼脂糖凝胶:琼脂糖凝胶的配制是分子实验室比较基本的操作,大体流程如下:称量、熔胶、倒胶、拔梳。
1.称量:我们通常所说的0.8%、1%的胶都是指的质量体积分数,即所称取的琼脂糖粉的质量(g)比所加的TBE缓冲液的体积(mL)即胶的浓度。
缓冲液的体积根据胶板的大小而定。
常用试剂、溶液及缓冲液的配制

常用试剂、溶液及缓冲液的配制1常用试剂、溶液及缓冲液的配制1.基本要求分子生物学所用试剂必须是分析纯或分子生物学试剂级。
溶液配制水尽可能使用灭菌、蒸馏、去离子水(建议用Milli-Q过滤系统或类似系统进行过滤)。
除非有特殊的说明,大部分配制的溶液需用0.22um孔径滤膜过滤除菌或者高压灭菌(15psi,121℃,20~30min)。
使用高压灭菌的水、灭过菌的容器以及灭过菌的贮液来配制溶液,会延长所配制溶液的使用时间。
用干燥的化学试剂和无菌水配置的溶液一般都不需要在灭菌;有些酸、碱和一些有机化合物溶液也不需要灭菌,因为微生物不能在这些溶液中生长。
制备的溶液应该分成小分保存。
如果没有特别说明,则所有贮液和缓冲液至少能在室温下贮存六个月。
作为贮液应贮存在4℃或-20℃,使用时取出到达到室温后再开启,以防止试剂内的缩合作用,以确保度数精确。
以质量浓度表示的溶液浓度是指在100ml溶液中溶质的质量,质量单位为g;以体积分数表示的溶液浓度是指总体积为100ml溶液中各组分成分的体积,体积单位为ml。
缓冲液的ph为25℃是溶液的ph。
2.浓酸及碱的摩尔浓度溶液质量分数/% 浓度/mol/L冰乙酸甲酸盐酸硝酸磷酸硫酸氢氧化铵氢氧化钾氢氧化钠 90~100903670859528(NH3)505017.423.411.615.714.61814.813.519.13.常用贮液与溶液1mol/L亚精胺(spermidine)溶解2.55g亚精胺(相对分子质量为254.6)于足量的水中,使终体积为10ml。
分装成小份。
贮存于-20℃.不须将溶液灭菌1mol/L精胺(spermine)溶解3.48g精胺(相对分子质量为348.2)于足量水中,使终体积为10ml,分装为小份贮存于-20℃.不须将溶液灭菌。
10mol/L乙酸铵(ammonium acetate)将77.1g乙酸铵(相对分子质量为77.1)溶解于水中,加水定容至1L后,用0.22um 孔径的滤膜过滤除菌。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验常用试剂、缓冲液的配制方法1、1M Tris-HCl□组份浓度1 M Tris-HCl(pH7.4,7.6,8.0)□配制量1L□配置方法1. 称量121.1gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 按下表量加入浓盐酸调节所需要的pH值。
pH值浓HCl7.4 约70mL7.6 约60mL8.0 约42mL4. 将溶解定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH 值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2、1.5 M Tris-HCl□组份浓度1.5 M Tris-HCl(pH8.8)□配制量1L□配置方法1.称取181.7gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 用浓盐酸调pH值至8.8。
4. 将溶液定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3、10×TE Buffer□组份浓度100 mM Tris-HCl,10 mM EDTA (pH 7.4,7.6,8.0)□配制量1L□配置方法1. 量取下列溶液,置于1L烧杯中。
1 M Tris-HCl Buffer(pH7.4,7.6,8.0)100mL500 mM EDTA(pH8.0)20mL2. 向烧杯中加入约800mL的去离子水,均匀混合。
3. 将溶液定至1L后,高温高压灭菌。
4. 室温保存。
4、3 M 醋酸钠□组份浓度3 M 醋酸钠(pH5.2)□配制量100mL□配置方法1. 称取40.8gNaOAc•3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。
2. 加入冰乙酸调节pH值至5.2。
3. 加入去离子水将溶液定容至100mL。
4. 高温高压灭菌后,室温保存。
5、PBS Buffer□组份浓度137 mM NaCl,2.7mM KCl,10 mM Na2HPO4,2 mM KH2PO4□配制量1L□配置方法1. 称量下列试剂,置于1L烧杯中。
NaCl 8 gKCl 0.2gNa2HPO4 1.42 gKH2PO4 0.27g2. 向烧杯中加入约800 mL的去离子水,充分搅拌溶解。
3. 滴加HCl将pH值调节至7.4,然后加入去离子水将溶液定容至1L。
4. 高温高压灭菌后,室温保存。
注意:上述PBS Buffer中无二价阳离子,如需要,可在配方中补充1mM CaCl2和0.5 mM MgCl2。
6、10 M醋酸铵□组份浓度10 M醋酸铵□配制量100mL□配置方法1. 称量77.1g醋酸铵置于100~200 mL烧杯中,加入约30 mL的去离子水搅拌溶解。
2.加去离子水将溶液定容至100mL。
3.使用0.22μm滤膜过滤除菌。
4.密封瓶口于室温保存。
注意:醋酸铵受热易分解,所以不能高温高压灭菌。
7、Tris- HCl平衡苯酚□配置方法1. 使用原料:大多数市售液化苯酚是清亮无色的,无需重蒸馏便可用于分子生物学实验。
但有些液化苯酚呈粉红色或黄色,应避免使用。
同时也应避免使用结晶苯酚,结晶苯酚必须在160℃对其进行重蒸馏除去诸如醌等氧化产物,这些氧化产物可引起磷酸二酯键的断裂或导致RNA和DNA的交联等。
因此,苯酚的质量对DNA、RNA的提取极为重要,我们推荐使用高质量的苯酚进行分子生物学实验。
2. 操作注意:苯酚腐蚀性极强,并可引起严重灼伤,操作时应戴手套及防护镜等。
所有操作均应在通风橱中进行,与苯酚接触过的皮肤部位应用大量水清洗,并用肥皂和水洗涤,忌用乙醇。
3. 苯酚平衡:因为在酸性pH条件下DNA分配于有机相,因此使用苯酚前必须对苯酚进行平衡使其pH值达到7.8以上,苯酚平衡操作方法如下:①液化苯酚应贮存于-20℃,此时的苯酚呈现结晶状态。
从冰柜中取出的苯酚首先在室温下放置使其达到室温,然后在68℃水浴中使苯酚充分溶解。
②加入羟基喹啉(8-Quinolinol)至终浓度0.1%。
该化合物是一种还原剂、RNA酶的不完全抑制剂及金属离子的弱螯合剂,同时因其呈黄色。
有助于方便识别有机相。
③加入等体积的1M Tris-HCl(pH8.0),使用磁力搅拌器搅拌15分钟,静置使其充分分层后,除去上层水相。
④重复操作步骤③。
⑤加入等体积的0.1M Tris-HCl(pH8.0),使用磁力搅拌器搅拌15分钟,静置使其充分分层后,除去上层水相。
⑥重复操作步骤⑤,稍微残留部分上层水相。
⑦使用pH试纸确认有机相的pH值大于7.8。
⑧将苯酚置于棕色玻璃瓶中4℃避光保存。
8、苯酚/氯仿/异戊醇□配置方法1. 说明:从核酸样品中除去蛋白质时常常使用苯/酚/氯仿/异戊醇(25:24:1)。
氯仿可使蛋白(25 :24 :1)质变性并有助于液相与有机相的分离,而异戊醇则有助于消除抽提过程中出现的气泡。
2. 配置方法:将Tris-HCl平衡苯酚与等体积的氯仿/异戊醇(24:1)均匀混合后,移入棕色玻璃瓶中4℃保存。
9、10%(W/V)SDS□组份浓度10%(W/V)SDS□配制量100mL□配置方法1.称量10g高纯度的SDS置于100~200mL烧杯中,加入约80mL的去离子水,68℃加热溶解。
2. 滴加数滴浓盐酸调节pH值至7.2。
3. 将溶液定容至100mL后,室温保存。
10、2 N NaOH□组份浓度2N NaOH□配制量100mL□配置方法1.量取80mL去离子水置于100~200mL塑料烧杯中(NaOH 溶解过程中大量放热,有可能使玻璃烧杯炸裂)。
2. 称取8g NaOH小心地逐渐加入到烧杯中,边加边搅拌。
3. 待NaOH完全溶解后,用去离子水将溶液体积定容至100mL。
4. 将溶液转移至塑料容器中后,室温保存。
11、2.5 N HCl□组份浓度2.5 N HCl□配制量100mL□配置方法1. 在78.4mL的去离子水中加入21.6mL的浓盐酸(11.6N),均匀混合。
2. 室温保存。
12、5 M NaCl □组份浓度5 M NaCl□配制量1L□配置方法1. 称取292.2g NaCl置于1L烧杯中,加入约800mL 的去离子水后搅拌溶解。
2. 加去离子水将溶液定容至1L后,适量分成小份。
3. 高温高压灭菌后,4℃保存。
13、20%(W/V)Glucose □组份浓度20%(W/V)Glucose□配制量100mL□配置方法1. 称取20g Glucose置于100~200mL烧杯中,加入约80mL的去离子水后,搅拌溶解。
2. 加去离子水将溶液定容至100mL。
3. 高温高压灭菌后,4℃保存。
14、Solution I □组份浓度25 mM Tris-HCl(pH8.0),10mM EDTA,50mM Glucose(质粒提取用)□配制量1L□配置方法1. 量取下列溶液,置于1L烧杯中。
1M Tris-HCl(pH8.0)25mL 0.5 M EDTA(pH8.0) 20mL20%Glucose(1.11M) 45mLdH2O 910mL2. 高温高压灭菌后,4℃保存。
3. 使用前每50 mL的Soliution I中加入2mL的RNase A(20mg/mL)。
15、Solution II□组份浓度250mM NaOH,1%(W/V)SDS (质粒提取用)□配制量500mL□配置方法1. 量取下列溶液置于500mL烧杯中。
10%SDS 50mL2N NaOH 50mL2. 加灭菌水定容至500mL,充分混匀。
3. 室温保存。
此溶液保存时间最好不要超过一个月。
注意:SDS易产生气泡,不要剧烈搅拌。
16、Solution III□组份浓度3M KOAc,5M CH3COOH(质粒提取用)□配制量500mL□配置方法1. 量取下列溶液置于500mL烧杯中。
KOAc 147gCH3COOH 57.5mL2. 加入300mL去离子水后搅拌溶解。
3. 加去离子水将溶液定容至500mL。
4. 高温高压灭菌后,4℃保存。
17、0.5M EDTA□组份浓度0.5 M EDTA(pH8.0) □配制量1L□配置方法1. 称取186.1g Na2EDTA•2H2O,置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌。
3. 用NaOH调节pH值值8.0(约20g NaOH)。
注意:pH值至8.0时,EDTA才能完全溶解。
4. 加去离子水将溶液定容至1L。
5. 适量分成小份后,高温高压灭菌。
6. 室温保存。
18、1 M DTT□组份浓度1 M DTT□配制量20mL□配置方法1. 称取3.09g DTT,加入到50mL塑料离心管内。
2. 加20mL的0.01 M 的NaOAc(pH5.2),溶解后使用0.22μm滤器过滤除菌。
3. 适量分成小份后,-20℃保存。
19、10mM ATP□组份浓度10mM ATP□配制量20mL□配置方法1. 称取121mg Na2ATP•3H2O,加入到50mL塑料离心管内。
2. 加20mL的25mM Tris-HCl(pH8.0),搅拌溶解。
3. 适量分成小份,-20℃保存。
分子生物学实验常用培养基的配制方法1、Ampicillin□组份浓度100mg/ml Ampicillin(100mg/ml)□配制量50mL□配置方法1. 称量5g Ampicillin置于50mL离心管中。
2. 加入40mL灭菌水,充分混合溶解后,定容至50mL。
3. 用0.22μm滤膜过滤除菌。
4. 小份分装(1mL/份)后,-20℃保存。
2、IPTG □组份浓度24mg/mL IPTG(24mg/mL)□配制量50mL配置方法1. 称量1.2g IPTG置于50mL离心管中。
2. 加入40mL灭菌水,充分混合溶解后,定容至50mL。
3. 用0.22μm滤膜过滤除菌。
4. 小份分装(1mL/份)后,-20℃保存。
3、X- Gal□组份浓度20mg/mL X- Gal(20mg/mL)□配制量50mL□配置方法1. 称取1g X-Gal置于50mL离心管中。
2. 加入40mL DMF(二甲基甲酰胺),充分混合溶解后,定容至50mL。
3. 小份分装(1mL/份)后,-20℃保存。
4、LB培养基□组份浓度1%(W/V)Tryptone,0.5%(W/V)Yeast Extract,1%(W/V)NaCl□配制量1L□配置方法1. 称量下列试剂,置于1L烧杯中Tryptone 10gYeast Extract 5gNaCl 10g2. 加入约800mL的去离子水,充分搅拌溶解。
