蛋白质分子的结构基础
蛋白质结构
c. 链由141AA残基组成, 链由146AA残基组成。
3.3.2 蛋白质的二级结构
• 指蛋白质分子中多肽链本身的折叠和盘绕的方式,它仅涉及肽 链中主链的构象,并不涉及侧链的构象。 • 蛋白质分子中某一段肽链的局部空间结构,即该段肽链主链骨 架原子的相对空间位置。
酰胺平面是构成主链构象的基本单元.
酰胺平面
多肽链可以看成由Cα串联起来的无数个酰胺平面组成
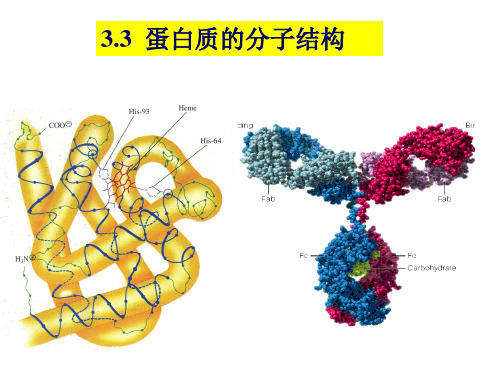
a .一条多肽链,153个氨基酸残基,一个血红素辅基,分子
量17600。 折叠成8段较直的-螺旋体(A-H),最长的有23个氨基酸残基, 最短的有7个氨基酸残基。拐弯处多由Pro、Ser、Ile、Thr等组 成。
b.肌红蛋白的整个分子具有外圆中空的不对称结构,肽链共
c.具有极性侧链的氨基酸残基分布于分子表面,而带非极性
5
βββ
5
回形拓扑结构
2 3 4 1 回形拓扑结构
平行-折叠的结构比较
卵溶菌酶
黄素蛋白 丙糖磷酸异构酶 乳酸脱氢酶结构域1
丙酮酸激酶结构域4
羧肽酶
腺苷酸激酶
(a)
(b)
next
木瓜蛋白酶
ห้องสมุดไป่ตู้
3.3.5.蛋白质的三级结构(Tertiary Structure)
是指多肽链在二级结构、超二级结构、结构域的基础上,进 一步盘绕、折叠形成的包括主链和侧链构象在内的特征三维 结构。即多肽链上的所有原子(包括主链和侧链)在三维空 间的分布。
蛋白质中相邻的二级结构单位(即单个α -螺旋或β -折叠或β -转角)组合 在一起,形成有规则的、在空间上能辩认的二级结构组合体称为蛋白质的超二 级结构. 基本组合方式:α α ;β
αβ ; β β β
蛋白质二级级结构 基础医学院生

蛋白质二级级结构基础医学院生物物理系余子璘 10589031蛋白质结构的研究很早就受到许多科学家的关注,并提出了多种假说,但是一直没有一个令人满意的理论。
直到1952年丹麦生物化学家Linderstrom—Lang第一次提出蛋白质三级结构的概念,才使蛋白质结构的研究走上了正确的道路。
Linderstrom—Lang的三级结构概念包括:一级结构指多肋链中氨基酸的一定的顺序,靠共价键维持多脓链的连接,而不涉及其空间排列;二级结构,指多肤链骨架的局部空间结构,不考虑侧链的构象及整个肽链的空间排列;三级结构则是指整个肽链的折叠情况,包括侧链的排列,也就是蛋白质分子的空间结构或三维结构。
这一概念提出之后,立即被各国科学家所接受。
1958年,英国晶体学家Bernal在研究蛋白质晶体结构时发现,并非所有蛋白质的结构都达到三级结构水平.而有些蛋白质则有更复杂的结构,即由几个蛋白质的亚基结合成几何状排列。
许多蛋白质是由相同的或不同的亚基组成,靠非共价键结合在一起.他将这种结构称为四级结构[3]。
现在蛋白质的一、二、三、四级结构的概念已由国际生物化学与分子生物学协会(IUBMB)的生化命名委员会采纳并做出正式定义。
蛋白质的一级结构一般是指构成蛋白质肽链的氨基酸残基的排列次序,有时也称为残基的序列。
这一定义对只含氨基酸的简单蛋白是适用的。
但是在生物体内还有很多复合蛋白,它们除了氨基酸外,还有其他的组成。
对复合蛋白,完整的一级结构概念念应该包括肤链以外的其他成分(例如糖蛋白上的糖链,脂蛋白中的脂质部分等)以及这些非肽肤链部分是以何种方式,接在脓链中哪些残基上。
蛋白质的一级结构是一个无空间概念的一维结构。
蛋白质的一个引入注目的特征是它们都有确定的三维结构。
一个伸展的或随机排布的多肽肋链没有任何生物活性,多肽肤链必须按照一定的规律折叠成三维结构,才具有生物活性。
生物功能来自构象,构象指的是原子在一个分子结构中的三维排布方式。
蛋白质的一二三四级结构

蛋白质的一二三四级结构
蛋白质的一级结构:
是蛋白质分子的空间结构基础。
主要的化学键是肽键。
此外还可能有二硫键。
例如胰岛素A链与B链之间是二硫键。
蛋白质二级结构:
主要化学键是氢键。
基本形式有α-螺旋、β-转角、β-折叠和无规卷曲。
主要的化学键是氢键。
蛋白质粉三级结构:
一些只有一条多肽链组成的蛋白质结构能形成的最高空间结构就是三级结构。
形成和稳定主要依靠次级键,包括疏水作用,离子键,氢键,等。
蛋白质的四级结构:
两条及以上的独立三级结构的多肽链相互作用,由非共价键连接成特定的空间构象。
每条独立的三级结构多肽链称为一个亚基,单独存在时不具有生物学活性。
蛋白质的结构与功能

2. β-折叠结构特点
(1) 相邻肽键平面的夹角为1100 ,呈锯齿状排列; 侧链R基团交错地分布在片层平面的两侧。
(2) 2~5条肽段平行排列构成,肽段之间 可顺向平行(均从N-C),也可反向平行 。 (3)由氢键维持稳定。其方向与折叠的长轴 接近垂直。
(三)β-转角(β-turn)
1.概念
以氨基末端开始→羧基末端结束,依次编1、
2、3………
蛋白质多肽链中氨基酸残基的排列顺 序称为蛋白质的一级结构
NH2 Met Phe Lys Cys Ser Thr Val COOH
各种蛋白质的根本差异在于一级结构的不同
人胰岛素的一级结构
二、蛋白质二级结构
概念:
是指蛋白质分子中一段多肽链的局部空
蛋白质的二级结构类型
蛋白质的二级结构主要包括α-螺旋,β-折 迭,β-转角及无规卷曲等
(一)α -螺旋 (α -helix)
1.概念 由肽键平面盘旋 形成的螺旋状构象
2.α -螺旋的结构特征 (1)以肽键平面为 单位,以α -碳原 子为转折盘旋形成 右手螺旋
(2) 每3.6个氨基酸残基 绕成一个螺圈(3600) 螺距为0.54nm 每个氨基酸上升0.15nm 肽键平面与中心轴平行
*类型
全a-螺旋、全β-折叠、
无规卷曲
由这些结构域缔合成具有三级结构的分 子或亚基
蛋白质三级结构的意义: 蛋白质的三级结构决定了蛋白质的
生物学功能。
维持三级结构稳定的键
侧链基团之 间形的 氢 键、 离子键、 疏水作用、 分子引力、 二硫键
维系蛋白质分子结构的作用力
1. 肽键 共价键
维系蛋白质一级结构
第二节
蛋白质的分子结构
一、 蛋白质的一级结构—基本结构
蛋白质的结构基础

第二章蛋白质的结构基础一、蛋白质结构的层次体系一级、二级、结构模体(超二级结构)、结构域、三级、四级1.一级结构一级结构是指多肽链中氨基酸的顺序,或氨基酸沿线性多肽链的排列。
(包含二硫键的数量和配对方式)一级结构决定高级结构,这是蛋白质结构组织的基本原理。
2.二级结构多肽主链局部区域的规则结构,它不涉及侧链的构象和与多肽链其他部分的关系。
规则构象主要被其内部形成的主链氢键所稳定,因此氢键的排布方式也是二级结构的重要特征。
3.结构模体一级顺序上相邻的二级结构在三维折叠中靠近,彼此按特定的几何排布形成简单地组合,以同一结构模式出现在不同的蛋白质中,这些组合单位称为结构模体。
是三级结构的建筑模块。
有的模体与特定的功能相关,如与DNA结合;许多模体并没有专一的生物功能,只是大结构和组装体的一个组成部分。
4.结构域二级结构和结构模体以特定的方式组织连接,在蛋白质分子中形成两个或多个在空间上可以明显区分的三级折叠实体。
结构单位:结构域是蛋白质三级结构的基本单位,一个分子中的结构域区之间以共价键相连接,这是与蛋白质亚基结构(非共价缔合)的基本区别。
功能单位:不同的结构域常常与蛋白质的不同功能相关联。
5.三级结构结构域在三维空间中以专一的方式组合排布,或者二级结构、结构模体及其与之相关联的各种环肽链在空间中的进一步协同盘曲、折叠,形成包括主链、侧链在内的专一排布。
6.四级结构亚基的数目、类型、空间排布方式和亚基间相互作用二、蛋白质结构分类1) α型结构(αstructure)主要由α螺旋组成,其螺旋含量一般在60%以上,有的高达80%。
α螺旋在这类蛋白质中大多以反平行方式排布和堆积,所以又称反平行α结构。
A) 线绕式α螺旋(coiled-coil α helix)B) 四螺旋束 (four helix bundle)C) 珠状折叠(globin fold)D) 复杂螺旋组合2) β型结构(β structure)主要由反平行β层构成。
蛋白质结构基础

简 写
S
T N Q Y H D E K R
生物技术学院
氨基酸的化学组成与结构
均含有C 、H 、O 、N 、S,以一定比例存在。 有些含有微量的金属元素(如铁、锌、钼、镍等) 分子质量大(10 000~ 1 000 000 Da) 易被酸、碱和蛋白酶催化水解为胨、肽。 共同的化学结构(除脯氨酸)
蛋白质工程的概念?
以蛋白质分子的结构规律及其生物功能的关系作为基础,通
过化学、物理和分子生物学的手段进行基因修饰或基因合成,
对现有蛋白质进行改造,或制造一种新的蛋白质,以满足人
类对生产和生活的需求的一门科学。
---Deliberate design and production of proteins with novel or
能如结合小分子。
模体或基序(motif)是结构域的亚单位 通常由2~3二级结构单位组成,一般为α螺旋、β折叠
和环(loop)。
生物技术学院
结构域的特点
(1)结构域是球 状蛋白质的独立 折叠单位。对一 些较小的球状蛋 白质分子或亚基 来说,结构域和 三级结构是一个 意思。 例如红氧还蛋白, 核糖核酸酶、肌 红蛋白等。
生物技术学院
结构域的特点
(2)对于较大 的球状蛋白质或 亚基,其三级结 构往往由两个或 多个结构域缔合 而成也即它们是 多结构域的,例 如免疫球蛋白的 轻链含2个结构 域。
生物技术学院
结构域的特点
(3)结构域有时也指功能域。功能域可以是一个结
构域,也可以是由两个结构域或两个以上结构域组 成,从功能角度看许多多结构域的酶,其活性中心 都位于结构域之间,因为通过结构域容易构建具有 特定三维排布的活性中心。结构域之间常常只有一
第一章蛋白质结构基础第三节

通常出现的障碍
①中间体通过外露疏水基团的聚合 ②不正确二硫键的形成 ③脯氨酸残基的异构化 为了清除这些障碍,细胞产生了一些特殊蛋 白质来帮助蛋白质正确折叠,如伴侣蛋白、 二硫键异构酶等
4.帮助正确折叠的蛋白质和酶
(1) 分子伴侣(molecular chaperone) (2) 帮助正确二硫键形成的酶 (3) 肽酰脯氨酰异构酶
N
C
β链以反平行的上-下方 式顺序连接,最后一股连 与第一股链以氢键结合, 形成一个类似桶状的结构
平行β螺旋折叠
1993年在细菌果胶酶的晶体结构中首次发现。这些β螺旋结构中, 多肽链卷曲折叠为由β链与环链区相间构成的宽松螺旋
双层螺旋
钙离子 钙离子 钙离子
每圈螺旋由2股β链与2 段环链区相间构成,在 形成结构域时这一基本 结构单位重复3次,产生 一个右手缠绕螺旋结构, 中间形成疏水内核
最大限度满足氢键的形成而达到的能量最低状态 。
1.蛋白质折叠的热力学基础
(1)Anfinsen提出 “热力学假说”
认为多肽链的氨基酸顺序包含 了形成其热力学上稳定的天然 构象所必需的全部信息,即最 终的天然构象是由氨基酸序列 决定的。不需要别的任何信息、 诱导或能量,蛋白质就可自发 折叠成天然构象,折叠过程是
第三节 多肽链的生物合成与折叠
• 蛋白质是具有高度组织、结构极复杂的生物大分子 • 了解这种复杂蛋白质结构的形成机理,对于以设计
和构建新型蛋白质为目标的蛋白质工程的战略性考 虑和具体途径选取,都有十分重要的意义
一、多肽链的生物合成
• 自然界中的蛋白质可以由几十个氨基酸组成,也 可以由上千个氨基酸组成
(1) 分 子 伴 侣
(2) 帮助正确二硫键形成的酶
蛋白质分子基础5-蛋白质一级结构测定

C末端分析
a)肼解法 b)还原法:硼氢化锂还原剂 c)羧肽酶法
还原法
肽链C末端AA ↓硼氢化锂 α-氨基醇 ↓水解 C末端氨基酸+ α-氨基醇 ↓ 色谱法鉴定
羧肽酶法
羧肽酶法:
最有效,最常用的测C端殘基方法 性质:肽链外切酶,专一地从肽链的C端逐个降 解,释放出游离AA。
巯基含量测定
DTNB法(5.5’-二硫代双(-2-硝基苯甲酸)
Protein-S- +R-S-S-R(DTNB) Protein-S-S-R+RSProtein-SH Protein-S-S-Protein+RS-(CNT) R
-
-COOH -NO2
反应产物(CNT)在412nm处可产生光吸收, 根据光吸收值可以相应地计算出巯基的含 量。
优点:Trp在水解中不受破坏。
蛋白质的水解
磺酸水解
4mol/L 甲基氨酸 ( 含 0.2%β- 吲哚乙胺 ) 色氨酸可 回收90%以上,Ser与Thr的回收接近定量值。 用二硫苏糖醇还原胱氨酸,再用过量的连四硫酸 钠氧化,得到S-磺基半胱氨酸再测定。 缺点: 水解环境需中性,条件苛刻。 水解液中含较多碳水化合物时,色氨酸容易被破 坏。 优点:中性水解液可以直接上机,色氨酸稳定。
蛋白质化学
蛋白质一级结构的测定
序列测定的基本方法学
将肽段用不同方法专一性地切断,将得到的 肽段分离纯化之后,分别测出各自的序列。 再将不同方法得到的序列进行比对,就可以 得到肽链的一级结构。
序列测定一般步骤
纯度要求:纯度在97%以上。
双向电泳;凝胶电泳;N-末端测定;纯化至恒定酶活; 肽谱分析。
蛋白质的氨基酸序列与结构

蛋白质的氨基酸序列与结构1. 氨基酸序列蛋白质是由氨基酸组成的,氨基酸序列是蛋白质结构的基础。
在生物体中,有20种不同的氨基酸,它们通过肽键连接形成蛋白质的氨基酸序列。
蛋白质的氨基酸序列决定了其结构和功能。
1.1 氨基酸的结构氨基酸由一个中心碳原子(称为α-碳原子)、一个氢原子、一个羧基(-COOH)、一个氨基(-NH2)和一个侧链(R基团)组成。
不同的氨基酸之间的区别在于它们的侧链R基团的不同。
1.2 氨基酸序列的编码氨基酸序列的编码由DNA上的基因序列决定。
基因中的核苷酸序列通过转录和翻译过程转化为氨基酸序列。
在这个过程中,三个核苷酸(称为密码子)编码一个氨基酸。
共有64个可能的密码子,其中有3个终止密码子不编码氨基酸。
1.3 氨基酸序列的变异氨基酸序列的变异是指基因序列的改变,导致蛋白质的结构或功能发生变化。
变异可以由点突变、插入或缺失突变引起。
氨基酸序列的变异可能会影响蛋白质的稳定性、活性或与其他分子的相互作用。
2. 蛋白质结构蛋白质的结构分为四个层次:一级结构、二级结构、三级结构和四级结构。
2.1 一级结构蛋白质的一级结构是指其氨基酸序列。
一级结构的氨基酸序列决定了蛋白质的生物活性、折叠方式和与其他分子的相互作用。
一级结构的改变,如氨基酸替换、插入或缺失,可能导致蛋白质功能的丧失或改变。
2.2 二级结构蛋白质的二级结构是指由氢键连接的氨基酸残基之间的局部折叠模式。
最常见的二级结构有α-螺旋和β-折叠。
α-螺旋是一种右旋螺旋结构,由氨基酸的侧链伸出并与螺旋轴形成氢键。
β-折叠是由相邻的β-折叠片段通过氢键连接而成的平面结构。
2.3 三级结构蛋白质的三级结构是指整个蛋白质分子的空间折叠方式。
三级结构的形成受到氨基酸序列、侧链相互作用、氢键、疏水作用和离子键等因素的影响。
三级结构的稳定性对于蛋白质的功能至关重要。
2.4 四级结构蛋白质的四级结构是指由多个多肽链组成的复合蛋白质的结构。
四级结构的形成受到各个多肽链之间的相互作用的影响,包括氢键、疏水作用、离子键和范德华力。
第二章_蛋白质结构基础

半胱氨酸 Cys 组氨酸 His 酪氨酸 Tyr 色氨酸 Trp
极性氨基酸
二硫键的作用 1 稳定蛋白质的三维结构; 2 将不同的多肽链连接在一起; 3 分子内二硫键可稳定单肽链的 折 叠,使蛋白质不易被降解。
特点: 侧链都可以解离使残基带上正 或负电荷
天冬氨酸 Asp 谷氨酸 Glu 精氨酸 Arg 赖氨酸 Lys
HN
精氨酸 Arginine
碱性氨基酸
O H2 N CH C CH2 CH2 CH2 NH C NH2 NH OH
精氨酸 Arginine
赖氨酸 Lysine
碱性氨基酸
O H2N CH C CH2 CH2 CH2 CH2 NH2 OH
精氨酸 Arginine
赖氨酸 Lysine 组氨酸 Histidine
稳定α -螺旋的因素
α-螺旋具有极性:
N
所有氢键都沿螺旋轴指向同一方向
α -螺旋的特征
• • • • 肽平面的键长和键角一定; 肽键的原子排列呈反式构型; 相邻的肽平面构成两面角; α -螺旋的中心没有空腔
C
-helix不稳定的因素:
R基团带同种电荷: pH=7时,多聚Lys或多聚 Glu ; R基团较大时造成空间位阻, 如Ile; 多肽链中有 Pro 或 HO-Pro,α—helix 中 断,产生‘结节’kink 它改变多肽链的方向,并终止螺旋。
含酰胺氨基酸
O H2 N CH C CH2 CH2 C NH2 O OH
氨基酸的分类
疏水氨基酸
氨基酸
极性氨基酸
荷电氨基酸
特点: 1 残基的侧链一般没有化学反应性; 2 疏水作用,趋于彼此间或与其他 非极性原子相互作用
丙氨酸 Ala 缬氨酸 Val 亮氨酸 Leu 异亮氨酸 Ile
蛋白质的分子结构

三、蛋白质的分子结构蛋白质的分子结构(一)一级结构(线性结构、基本结构)蛋白质的一级结构(primary structure ) 指它的氨基酸序列 。
比喻:珍珠项链1954年英国生物化学家Sanger 报道了胰岛素(insulin )的一级结构(参见教材P7),这是世界上第一个被确定一级结构的蛋白质。
A 链:21个AA ,B 链:30个AA ,A 、B 两链通过两个二硫键相连,A 链本身第6及11位两个半胱氨酸形成一个链内二硫键。
1960年Moore 和Stein 测出了牛胰核糖核酸酶的一级结构,含124个AA ,链内有4个二硫键。
蛋白质的一级结构是决定其空间结构的基础,而空间结构则是其实现生物学功能的基础。
(二)空间结构(又称构象)定义:是指蛋白质分子内各原子围绕某些共价键的旋转而形成的各种空间排布及相互关系。
Pr 构象:主链构象、侧链构象两者相互依赖,相互影响一般根据蛋白质构象的范围和复杂程度,人为地将Pr 的空间结构分为:二级、三级和四级结构。
1.1.二级结构二级结构二级结构::蛋白质多肽链主链原子的局部空间排布。
(1) 形成二级结构的基础肽键平面:肽键中的C 、H 、O 、N 、四个原子和与它们相邻的两个α碳原子都处在同一个平面上,这个平面称为~。
多肽链=通过可旋转的α-碳原子连接的酰胺平面链提问:影响蛋白质构象的作用力有哪些?内力(内因):蛋白质分子内各原子间作用力外力(外因):与溶剂及其他溶质作用力内因为主,外因通过改变内因起作用(2)基本形式:包括α-螺旋、β-折叠、β-转角、不规则卷曲(自由回转或松散肽段)四种方式。
A. α-螺旋(蛋白质最常见的二级结构形式)天然蛋白质大部分为右手螺旋(顺时针)几个数值:螺旋一周3.6个AA,螺距0.54nm,每个残基跨距为0.15nm作用力:氢键—相邻螺旋之间通过肽键上的酰基氧与亚氨基氢形成。
B.β折叠:是多肽链的折叠形式平行肽链间以氢键从侧面连接的构象维持β-折叠的作用力也是肽键衍生出的氢键:平行式、反平行式C.β转角作用力——同样是肽键衍生来的氢键但由于只有这一个氢键,只形成β—转角结构。
第一章蛋白质结构基础全篇

39
蛋白质工程
活性位置
无生物活性
40
蛋白质工程
(5)复杂模体(complex motif)
两个相邻的β发夹型模体通过环链相连,构成更加复杂 的模体。组合方式有24种,只有8种被观察到。
41
蛋白质工程
4. 结构域(domain)
结构域:二级结构和结构模体以特定的方式组合连接,在 蛋白质分子中形成 2 个或多个在空间上可以明显 区分的三级折叠实体,称为结构域。
半胱氨酸
Cys
C
glutarmine 谷氨酰胺
Gln Glx
Q
glutarmic acid 谷氨酸
Gln Glx
E
glycine
甘氨酸
Gly
G
histidine
组氨酸
His
H
isoleucine 异亮氨酸
Ile
I
leucine
亮氨酸
Leu
L
lysine
赖氨酸
Lys
K
methionine 甲硫氨酸
Met
可用来鉴定蛋白质构象是否合理。
⑴实线封闭区域
一般允许区,非键合原子间的距离大于一般允许距离,此区域内任何二面角确定的构象都是允许 的,且构象稳定。
⑵虚线封闭区域
是最大允许区,非键合原子间的距离介于最小允许距离和一般允许距离之间,立体化学允许,但 构象不够稳定。
⑶虚线外区域
16 是不允许区,该区域内任何二面角确定的肽链构象,都是不允许的,此构象中非键合原子间距离
构象:组成分子的原子或基团绕单键旋转而形成的不同空 间排布。构象改变,无共价键的断裂和重新形成, 化学上难于区分和分离。
蛋白质的理化性质

14.2.3 蛋白质的理化性质 Physical and Chemical Properties of Proteins讨论蛋白质的性质,一定要理解蛋白质分子的结构.蛋白质分子是具有生物活性的大分子化合物,分子量很大.蛋白质分子具有一、二、三、四级结构,一级结构是蛋白质分子结构的基础。
蛋白质分子除主链(肽链)外,还有各种不同的侧链。
在这些侧链中,既有各种烃基,也有活泼的羧基、氨基、巯基、醇羟基和酚羟基等。
这些侧链基团有些是亲水基团;有些是疏水基团;有些是酸性基团;有些是碱性基团;有些裸露在二、三级结构外面;有些是掩蔽在二、三级结构的内部。
蛋白质分子内除主键(肽键)外,还有很多副键维持它的空间结构。
蛋白质的性质主要有如下几个方面:(1)蛋白质的两性性质和等电点。
蛋白质多肽链的N ―端有氨基,C ―端有羧基,其侧链上也常有碱性基团和酸性基团。
因此,蛋白质和氨基酸相似,也具有两性性质和等电点。
调节溶液到某一pH 值时,蛋白质分子所带的正、负电荷相等,分子可成为两性离子,此时溶液的pH 值称为该蛋白质的等电点(pI )。
如果溶液的pH 值在等电点的酸侧,溶液中的H +会抑制羧基电离,并有利于氨基与H +结合,因而蛋白质的净电荷为正。
如果溶液的pH 值在等电点的碱侧,OH - 有利于羧基的电离,不利于氨基与H +结合,故蛋白质的净电荷为负。
因此,蛋白质和α―氨基酸溶液相似,也存在下列平衡关系。
如用H 2N ―Pr ―COOH 表示蛋白质分子,羧基代表分子中所有的酸性基团,氨基代表所有的碱性基团,Pr 代表其它部分,则:H 2N Pr COO −H 3N COO -H 3N COOH H +H +pH>pI 等电点(pI )pH<pI 阴离子两性离子阳离子++不同的蛋白质具有不同的等电点,多数蛋白质的等电点小于7。
在动植物组织液中,pH 值一般在7―7.4之间,蛋白质大都以阴离子形式存在,并与两性离子达成平衡。
蛋白质结构

蛋白质的结构可以分为四个层次来研究,即一级结构、二级结构、三级结构和四级结构。
其中一级结构又称蛋白质的化学结构(chemicalstructure)、共价结构或初级结构。
而二级结构、三级结构和四级结构又称为蛋白质的空间结构或三维结构(threedimensional structure)。
一、蛋白质的一级结构(一)蛋白质的一级结构所谓蛋白质的一级结构是指蛋白质多肽链中氨基酸的排列顺序以及二硫键的位置。
一级结构是蛋白质分子结构的基础,它包含了决定蛋白质分子所有结构层次构象的全部信息。
蛋白质一级结构研究的内容包括蛋白质的氨基酸组成、氨基酸排列顺序和二硫键的位置,肽链数目,末端氨基酸的种类等。
蛋白质是由氨基酸通过肽键连接起来的生物大分子,不同蛋白质的氨基酸种类、数量和排列顺序都不同,这是蛋白质生物学功能多样性的基础。
一级结构是蛋白质的共价键结合的全部情况,在生物化学及其相关领域中,许多问题都需要知道蛋白质的一级结构。
有些蛋白质不是简单的一条肽链,而是由2条以上肽链组成的,肽链之间通过二硫键连接起来,还有的在一条肽链内部形成二硫键(图2-7)。
二硫键在蛋白质分子中起着稳定空间结构的作用。
一般二硫键越多,蛋白质的结构越稳定。
蛋白质的氨基酸排列顺序对蛋白质的空间结构以及生物功能起着决定作用,通常氨基酸的排列顺序是不能轻易改变的,有的蛋白质分子只有—个氨基酸的改变就可能改变整个蛋白质分子的空间结构和功能,所以蛋白质的一级结构包含着决定其空间结构的因素。
(二)蛋白质一级结构的测定蛋白质一级结构的测定就是测定蛋白质多肽链中氨基酸的排列顺序,这是揭示生命本质,阐明结构与功能的关系,研究酶的活性中心和酶蛋白高级结构的基础,也是基因表达、克隆和核酸顺序分析的重要内容。
蛋白质一级结构的测定主要包括以下基本步骤:1.测定蛋白质的分子量和氨基酸组成获取一定量纯的蛋白质样品,测定其分子量。
将一部分样品完全水解,确定其氨基酸种类、数目和每种氨基酸的含量。
蛋白质的功能及其结构基础

(三)解毒 解毒是细胞中不可缺少的一种自我保护机制。 过多的疏水性分子的积累也对细胞是有毒害 的。 针对蛋白质类型的毒素,解毒的方法是利用 蛋白酶将毒素降解;而对疏水的分子,则是 全然不同的解毒方法。最简单的方法是将疏 水性的分子转变为水溶性分子,便于细胞和 机体的清除和排出。将疏水分子转化为水溶 性分子,可以有多种途径。
2.低等动物的防卫系统 抗菌肽是低等生物的防卫系统之一。这类 抗菌肽可以使一些细胞膜溶解。 在很多低等生物的血淋巴液中没有细胞免 疫的机制,但是含有简单的凝集素,这些 凝集素起到类似于高等动物先天免疫的作 用。其中有些凝集素的结构与高等动物的C 类凝集素有同源性。
3.植物免疫 植物没有动物的免疫系统,但是植物也能自 我防卫和保护。在受到外界的各种刺激时, 不论是生物的还是非生物的,植物都可以通 过细胞质中的信号转导过程,诱导多种类型 的基因表达,从而产生多种酶系和多种蛋白 质。这些酶系被用于合成各种类型的小分子, 对外界刺激作出应答;多种蛋白质中有所谓 的病程相关蛋白,以及针对并干扰动物病原 体的几丁质酶和蛋白酶抑制剂等。
(四)其他 在北冰洋生活的一些鱼类,它们的血液中存 在着抗冻蛋白质。这些蛋白质的分子质量并 不小,但是,这些蛋白质能引起的冰点下降 的能力远远超过了物理化学中的依数性。一 些结构不同的蛋白质却具有相同的抗冻能力。 微生物和一些昆虫多药物和农药的抗性,也 是一种自我防卫和保护。主要通过其体内经 诱导产生的能降解和改变药物和农药特性的 酶。
(二)免疫 免疫是几乎所有生物体都具备的功能,不仅 动物有免疫系统,而且植物也有免疫系统。 免疫的含义被拓展了,机体对外界感染和刺 激的应答,对环境变化的防范均可归属于免 疫的范畴。 1.高等动物免疫系统 高等动物的免疫系统大致可分为体液免疫和 细胞免疫两个部分。 体液免疫以补体为中心。 细胞免疫以淋巴细胞为中心。这种免疫系统 更高级,具有“记忆”特性。
构成蛋白质的结构基础

构成蛋白质的结构基础蛋白质,听起来是不是很高大上,其实它是咱们身体里的“搬运工”、“建房子”的小能手,简直是无处不在!你吃的每一口食物,甚至你体内的每一个细胞,都跟它息息相关。
要知道,蛋白质可是生命的基础,就像盖房子得有砖头,没它可真不行。
咱们先说说蛋白质的“构成”。
它是由一种叫氨基酸的小分子组成的,氨基酸就像小拼图块,一块块拼起来就变成了蛋白质。
你想想,拼图的时候,如果少了一块,图案是不是就不完整了?对,就是这个道理。
氨基酸的种类有好几十种,但咱们身体只会自己制造其中的部分,其他的得靠食物补充。
这就像是你在玩拼图,缺了块就得去找,找到了才能拼出美丽的图案。
蛋白质的“层次感”也不简单。
它分为四层结构,第一层是“氨基酸序列”,就像是一个个小字母拼成的单词。
第二层是“局部折叠”,这就像小字母们开始交个朋友,形成一些小圈圈,或者小卷卷。
第三层是“整体折叠”,哎呀,这个时候它们开始搞得更加复杂,形成了一个完整的三维形状。
最后的第四层,是“多聚体结构”,就像一群小伙伴组成了大团队。
没错,蛋白质就是这么个团结的小家伙!说到这里,你可能会问,这些蛋白质到底干嘛呢?蛋白质的工作可多了,简直忙得不可开交。
它们负责运输氧气,像小船一样在血液里航行,给每一个细胞送去新鲜的氧气。
还负责修复受伤的组织,感觉就像是给小伤口贴个创可贴。
它们还会参与消化,把食物变成我们身体需要的营养。
可以说,蛋白质就是身体的小小“工程师”,把一切都搞得井井有条。
再说了,蛋白质还可以影响我们的情绪和健康。
有人可能会觉得,嘿,怎么一个小分子就能影响我的心情?科学研究表明,某些氨基酸和大脑中的化学物质有关。
缺了这些氨基酸,可能会导致情绪低落,甚至抑郁。
简直让人想哭,伙计们,得好好吃饭啊!吃蛋白质丰富的食物也能让人有精力。
你想想,早餐来一份鸡蛋,午餐再来点鸡肉,晚餐来点豆腐,简直是补充能量的“万用菜谱”。
有的人说,吃多了蛋白质会不会胖呢?这个得看总的饮食结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结构域(domain)
三级结构(tertiary structure) 四级结构(quarternary structure)
Nankai University
Nankai University
§1.2.1 构型和构象
•构型(configuration):分子立体异构体中的取代原 子或基团以共价键相连时,他们在空间的取向。构 型变化,一定有化学键的断裂和手性的改变。
Nankai University
§1.2.9 蛋白质的四级结构
蛋白的四级结构是指亚基和亚基之间通过疏水相互作 用,结合成为有序排列的特定空间结构。
构成寡聚蛋白质分子的亚基可以相同,也可以不同。
Nankai University
Nankai University
Nankai University
分子量较大的蛋白,多肽链折叠成两个或多个结构域, 结构域之间以松散肽段连接,从而组装成蛋白质的三 级结构。
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
有些蛋白质分子可构成非常大的超分子复 合物,其功能多样,如提供动力(肌肉和 鞭毛)、大分子外壳(病毒外壳)、细胞 骨架(微丝、微管、中间纤维)、DNA折 叠(染色质),等。
Nankai University
Nankai University
Nankai University
§1.2.6 蛋白质的超二级结构(motif)
相邻的二级结构单元组合在一起,彼此相互作用, 排列成规则的、在空间结构上能够辨认的二级结构 组合体,并充当三级结构的构件,称为超二级结构。
介于二级结构和结构域之间的结构层次。 常见的超二级结构有:α-loop- α 、β-α- β、 β-loop- β、 Rossmann折叠、 β β β β回形拓扑结构(Greek key topology)
β -转角
Nankai University
a-螺旋 a-螺旋是蛋白质中含量最多,也是最稳定 的二级结构单元。 a-螺旋丰富的蛋白质结构紧密而稳定少变 , 故蛋白质的功能活性区常不在a-螺旋 区,而在其附近。
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Adenylyl cyclase
Forskolin
Gsa
GTP
Nankai University
§1.2 蛋白质分子的化学结构
一级结构(primary structure) 二级结构(secondary structure) 超二级结构(supersecondary structure)
Nankai University
Nankai University
Nankai University
Nankai University
amino acid three letter code single letter code
Polar (hydrophilic)
serine threonine cysteine tyrosine asparagine glutamine Ser Thr Cys Tyr Asn Gln S T C Y N Q
Nankai University
Nankai University
Nankai University
§1.2.7 蛋白质的结构域
结构域介于超二级结构和三级结构之间,多肽链在超 二级结构的基础上进一步盘绕折叠,形成紧密的近乎 于球状的结构,称为结构域。 对于较小的蛋白,只有一个结构域,此时结构域就是 三级结构。
§1.2.4 蛋白质的一级结构
蛋白质的一级结构就是蛋白质分子中氨基酸的排列 顺序。
Nankai University
§1.2.5 蛋白质的二级结构
蛋白质的二级结构是指多肽链借助氢键沿一维方 向排列呈具有周期性的结构的构象,它是多肽链 骨架的排列规则,而不涉及侧链的类型与构象。
类型主要包括: a-螺旋 β-折叠
phosphorylated
.
Nankai University
基本氨基酸的性质
Nankai University
Nankai University
Gly, G, 甘氨酸 Ala, A, 丙氨酸 Val, V, 缬氨酸 Leu, L, 亮氨酸 Ile, I, 异亮氨酸 Met, M, 蛋氨酸, 甲硫氨酸
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Nankai University
Structural domains in the polypeptide troponin (肌 钙蛋白) C, two separate calcium-binding domains
Lys, K, 赖氨酸; Arg, R, 精氨酸; His, H, 组氨酸
Nankai University
Asp, D,天冬氨酸; Glu, E,谷氨酸
Nankai University
Two additional amino acids have been identified
Selenocysteine: encoded by the RNA nucleotide triplet UGA found in Archaea, eubacteria and animals including mammals. Pyrrolysine: encoded by the RNA nucleotide triplet UAG, found in Archaea, and eubacteria. Science (2002) vol. 296, 1409
•构象(conformation):组成分子的原子或基团围绕 共价单键旋转而形成不同的空间排布。构象变化不 导致化学键的断裂和手性的变化。
Nankai University
Nankai University
Nankai University
Nankai University
§1.2.2 蛋白质分子的基本结构单位 ——氨基酸
glycine alanine valine leucine isoleucine methionine
phenylalanine
tryptophan proline
Gly Ala Val Leu Ile Met Phe Trp Pro
G A V L I M F W P
Electrically Charged (negative and hydrophilic)
的生物学功能
(1)催化功能
(2)运输功能 (3)营养和储存功能 (4)收缩和运动功能 (5)结构功能 (6)防御功能 (7)调控功能 (8)其它功能
Nankai University
Nankai University
Nankai University
Nankai University
第一部分 分子生物物理
—— 生物大分子的功能与结构
Nankai University
第一章 蛋白质分子的结构基础
蛋白质的重要地位:种类繁多,功能复杂,是生命活 动
的主要承担者,是生命活动的主
要物质基础。
蛋白质的组成:C、H、O、N、S P、Cu、Fe、I、Zn、Mo 蛋白质的分类:简单蛋白、结合蛋白 蛋白质的分子量:5kD - 1000kD,甚至更大
Nankai University
Phe, F, 苯丙氨酸; Tyr, Y, 络氨酸; Trp, W, 色氨酸
Nankai University
Ser, S, 丝氨酸 Thr, T, 苏氨酸 Cys, C, 半胱氨酸 Pro, P, 脯氨酸 Asn, N, 天冬酰胺 Gln, Q, 谷氨酰胺
Nankai University
Nankai University
Nankai University
Nankai University
§1.2.8 蛋白质的三级结构
蛋白质的三级结构蛋白质分子内所有原子在三维 空间的立体排布。是二级结构和非二级结构在空 间中的进一步盘曲、折叠,形成包括主侧链在内 的专一性三维排布。
其基本特征是:每个残基的构象符合热力学要求: 水溶性蛋白质中非极性侧链大多处于内部而形成 疏水核,极性或带电侧链分布在分子的表面;极 性基团之间、或蛋白内部的极性基团与邻近肽链 骨架上的集团之间形成氢键,等,从而使蛋白质 分子的自由能最低。
Nankai University
β-折叠 β-折叠在蛋白质中含量仅次于a-螺旋,和 a-螺旋相比,稳定性相对较差,结构参数 较易变化,扭曲程度也可各有不同,一般位 于蛋白质的中心,外面由稳定的a-螺旋包 围。也有蛋白全由β-折叠组成,如免疫球 蛋白,这样的结构相对较柔软,易于发生构 象变化。
Nankai University
