PVC PE
PPPVCPEPSABSPC管材区别和用途

PPPVCPEPSABSPC管材区别和用途聚丙烯(PP)、聚氯乙烯(PVC)、聚乙烯(PE)、聚苯乙烯(PS)、丙烯腈-丁二烯-苯乙烯共聚物(ABS)、聚碳酸酯(PC)是常见的塑料管材材料。
它们在用途和特性上各有差异,以下是它们的区别和用途。
1.PP管材:聚丙烯(PP)管材具有耐腐蚀、耐高温、耐磨、重量轻等特点。
因此,它被广泛应用于化工、制药、食品、医疗、环保等行业。
PP管材主要用于输送酸碱溶液、废水、热水、化学品等,应用范围广泛。
2.PVC管材:聚氯乙烯(PVC)管材具有耐腐蚀性好、抗老化、价格便宜等特点。
PVC管材主要用于城市给水、排水、化工输送、建筑排烟等领域。
在建筑方面,PVC管材常用于给水供排水管道、电线电缆保护管道等。
3.PE管材:聚乙烯(PE)管材具有耐压强度高、耐腐蚀性好、重量轻、安全卫生等特点。
PE管材主要用于供水、燃气、工业液体输送等领域。
在给水方面,PE管材由于其耐腐蚀性和无毒环保特性,被广泛应用于城市供水工程。
4.PS管材:聚苯乙烯(PS)管材具有良好的物理性能,如耐冲击、韧性好等特点。
PS管材主要用于给排水、工业输送等领域。
在装饰方面,PS管材透明度高,因此也被广泛应用于家具和建筑装饰领域。
5.ABS管材:丙烯腈-丁二烯-苯乙烯共聚物(ABS)管材具有耐热、耐寒性好、机械性能优异、耐腐蚀性好等特点。
ABS管材主要用于化工、建筑、电力等领域。
在建筑方面,ABS管材常用于地暖、空调系统等管道。
6.PC管材:聚碳酸酯(PC)管材具有透明度高、耐高温、耐压性好等特点。
PC管材主要应用于光纤通信、电子元件、汽车零部件等领域。
由于其良好的透明度和耐高温性,PC管材通常用于灯具、电脑外壳等制作。
总体而言,不同的管材具有不同的特点和应用领域。
选择合适的管材材料,可以根据具体的使用要求来决定。
以上只是对这些管材材料的简单介绍,实际应用中还需要考虑到更多的因素,如成本、使用环境等。
因此,在选择管材材料时,需要综合考虑各个方面的要素,以确保最佳的应用效果。
PVC、PE、PP、ABS、PMMA性质的比较
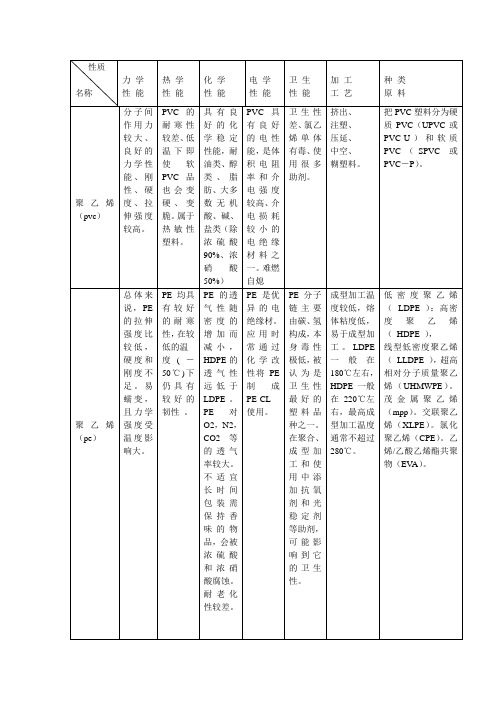
聚丙烯(pp)
PP具有良好的综合力学性能拉伸强度高于PE、聚苯乙烯和ABS树脂,并且受温度影响较小。PP在室温以上有较好的抗冲击性能。优良的耐弯曲疲劳性是PP的一个特殊力学性能。
PVC具有良好的电性能,是体积电阻率和介电强度较高、介电损耗较小的电绝缘材料之一。难燃自熄
卫生性差、氯乙烯单体有毒、使用很多助剂。
挤出、
注塑、
压延、
中空、
糊塑料。
把PVC塑料分为硬质PVC(UPVC或PVC-U)和软质PVC(SPVC或PVC-P)。
聚乙烯(pe)
总体来说,PE的拉伸强度比较低,硬度和刚度不足。易蠕变,且力学强度受温度影响大。
PE均具有较好的耐寒性,在较低的温
度(-50℃)下仍具有较好的韧性。
PE的透气性随密度的增加而减小,HDPE的透气性远低于LDPE。PE对O2,N2,CO2等的透气率较大。不适宜长时间包装需保持香味的物品,会被浓硫酸和浓硝酸腐蚀。耐老化性较差。
PE是优异的电绝缘材。
应用时常通过化学改性将PE制成PE-CL使用。
PP的熔点为164~170℃,长期使用温度可达100~120℃,是通用塑料中唯一能在水中煮沸。
PP的Tg大约为-l0℃~-30℃。
PP比PE更易发生热氧老化,是易于热氧老化及光老化的塑料品种。PP是光敏性塑料,PP光稳定性较差。存在着叔碳原子易被化学药品腐蚀。但是100℃以下耐绝大多数酸、碱、盐等。(除发烟硫酸、浓硝酸、次磺酸。
它没有明显的力学缺陷,显示出较好
的韧性和综合力学性能被广泛地用作通用工程塑料。
PVCUPVCPPPEPPRBPPEX分别是什么材料

PVCUPVCPPPEPPRBPPEX分别是什么材料PVC(聚氯乙烯)、UPVC(未塑化聚氯乙烯)、PP(聚丙烯)、PE(聚乙烯)、PPR(聚丙烯随机共聚)、BPP(粉煤灰增强聚丙烯)、PEX (交联聚乙烯)是几种广泛应用的塑料材料。
以下将对每种材料逐一进行详细解释:1.PVC(聚氯乙烯):PVC是一种常见的塑料材料,它由氯乙烯单体聚合而成。
PVC具有良好的耐腐蚀性、电绝缘性、可塑性和机械强度,广泛应用于建筑、汽车、电器等领域。
2.UPVC(未塑化聚氯乙烯):UPVC是一种不含任何塑化剂的硬质聚氯乙烯材料。
它的硬度比PVC高,具有较好的耐候性和耐腐蚀性,常用于制造管道、门窗框架等。
3.PP(聚丙烯):PP是一种聚合度较高的热塑性塑料,由丙烯单体聚合而成。
PP具有良好的耐热性、耐腐蚀性和可塑性,常用于制造家具、食品包装、医疗器械等。
4.PE(聚乙烯):PE是一种常见的塑料材料,由乙烯单体聚合而成。
它常分为高密度聚乙烯(HDPE)和低密度聚乙烯(LDPE)两种类型。
PE具有较好的耐寒性、抗冲击性和耐腐蚀性,广泛应用于包装、管道、塑料薄膜等领域。
5.PPR(聚丙烯随机共聚):PPR是丙烯单体与丁烯单体共聚得到的一种材料。
它具有较好的耐热性、耐腐蚀性和可加工性,常用于制造管道、阀门等管道系统的构建。
6.BPP(粉煤灰增强聚丙烯):BPP是一种将粉煤灰与聚丙烯混合制备而成的复合材料。
粉煤灰的添加可以提高聚丙烯材料的力学性能和耐热性,常用于制造建筑材料、塑料制品等。
7.PEX(交联聚乙烯):PEX是通过将聚乙烯进行交联处理而得到的一种特殊材料。
PEX具有较好的耐高温性能、耐化学性和耐冲击性,常用于制造供暖、供水系统中的管道和管件。
总结起来,PVC、UPVC、PP、PE、PPR、BPP、PEX等材料在不同应用领域具有各自独特的特性和优势,广泛应用于建筑、工程、制造业等领域,为社会发展做出了重要贡献。
PP、PE、PVC

PP、PE、PVC都是塑料,其中PE是聚乙烯塑料无毒透明透气性好常用于制造生活用品如简易食品包装袋、一次性注射器、给排水暗管(易降解老化)等,PP是聚丙烯塑料无毒高度透明强度好、耐腐蚀它具有PE的所有优点,常用于制造生活用品、塑料医疗器械如透明塑料脸盆、一次性注射器等等,PVC是聚氯乙烯塑料透气性差、有毒也常用于生活用品和建筑装修方面居室内墙和吊顶的装饰如排水管道等。
PP、PE、PVC都是塑料品名英文的缩写,国人对其的通俗称谓。
它们分别是聚丙烯、聚乙烯、聚氯乙烯。
再比如说PTFE是聚四氟乙稀、FEP是氟化乙烯丙稀共聚物、PVDF是聚偏二氟乙稀、ETFE是乙烯和四氟乙烯的共聚物等是同样的道理PU即聚氨基甲酸脂(polyurethane)。
PU革系指以牛、猪二层蓝坯革为底革,表面贴合一层聚氨酯薄膜的产品,也叫二层贴膜革,即干法PU革;湿法PU革为在二层革表面淋上一层聚胺酯浆液,再经干燥而成,基于聚胺酯涂料及贴膜成本较高,现已生产不多,并且已由干法转向湿法生产。
PVC即聚氯乙烯(polyvinyl chloride),PVC革以针织布料为底基,上面贴合一层PVC树脂薄膜的产品,PVC薄膜有毒且易老化,将由PE塑料薄膜代替。
PE为聚乙烯(polyethylene, polythene),无毒,成本低,用量省。
PP为聚丙烯(polypropylene)。
①聚氯乙烯(PVC)它是建筑中用量最大的一种塑料。
硬质聚氯乙烯的密度为1.38~1.43g/cm3,机械强度高,化学稳定性好,使用温度范围一般在-15~+55℃之间,适宜制造塑料门窗、下水管、线槽等。
②聚乙烯(PE)聚乙烯塑料在建筑上主要用于给排水管、卫生洁具。
③聚丙烯(PP)聚丙烯的密度在所有塑料中是最小的,约为0.90左右。
聚丙烯常用来生产管材、卫生洁具等建筑制品。
④聚苯乙烯(PS)聚苯乙烯为无色透明类似玻璃的塑料。
聚苯乙烯在建筑中主要用来生产泡沫隔热材料、透光材料等制品。
食品级PE和PVC的区别

食品级PE和PVC的区别1. 引言在食品包装和食品接触材料的选择中,食品级PE(聚乙烯)和PVC(聚氯乙烯)是两种常见的塑料材料。
虽然它们都被广泛应用于食品行业,但它们具有一些重要区别。
本文将介绍食品级PE和PVC的区别和特点。
2. 食品级PE的特点食品级PE是一种无毒、无味的塑料材料,常用于生产食品包装袋、保鲜膜等食品接触材料。
它具有以下特点:•高度安全性:食品级PE符合国际食品安全标准,不含有害物质,不会对食物品质产生不利影响。
•耐酸碱腐蚀:PE材料在一定程度上耐酸碱腐蚀,可以很好地保护食品的新鲜度和卫生安全。
•密封性强:食品级PE具有较好的密封性能,能够有效防止食品受潮变质。
•耐温性好:PE材料可以耐受较高的温度,适用于食品的冷冻、热处理等不同环境下的需求。
3. PVC的特点与食品级PE相比,PVC在食品接触材料中的应用相对较少,但仍然具有一定的特点:•廉价而广泛:PVC是一种相对廉价且易于加工的塑料材料,广泛应用于各种领域,包括食品包装。
•柔软性:PVC具有良好的柔软性和伸缩性,因此常被用于制作食品包装膜或容器等。
•化学稳定性:PVC在正常使用条件下具有较好的化学稳定性,不易受到食品酸碱的腐蚀。
•可塑性:PVC易于加工成各种形状,可以生产出多种不同的食品包装产品。
4. PE和PVC的区别尽管食品级PE和PVC都可以应用于食品包装行业,但它们存在一些重要区别:•安全性:食品级PE被认为是更安全的选择,因为它没有释放出对健康有害的物质。
相比之下,PVC在加工过程中可能会释放一些有害物质,这导致了对其安全性的担忧。
•环境影响:PE是一种可回收的塑料,具有较低的环境影响。
而PVC作为一种含氯塑料,对环境的影响相对较大。
•应用范围:PE广泛应用于各种食品包装领域,而PVC在食品接触材料中的应用较少,主要用于柔性食品包装。
5. 结论食品级PE和PVC是常见的食品接触材料,尽管它们都具有一定的特点和优势,但在选择食品包装和食品接触材料时,我们应更加倾向于使用食品级PE。
PE 和 PVC

PE塑料1.基本属性聚乙烯(polyethylene ,简称PE)是乙烯经聚合制得的一种热塑性树脂。
在工业上,也包括乙烯与少量α-烯烃的共聚物。
聚乙烯为白色蜡状半透明材料,柔而韧,比水轻,无毒,具有优良的耐低温性能,化学稳定性好,能耐大多数酸碱的侵蚀。
常温下不溶于一般溶剂,吸水性小,电绝缘性能优良。
聚乙烯容易光氧化、热氧化、臭氧分解,在紫外线作用下容易发生降解(环保),碳黑对聚乙烯有优异的光屏蔽作用。
2.分类(以化学分类为主)聚乙烯(POLYETHYLENE,PE)是由乙烯聚合而成之聚合物,产品发展至今已有60年左右历史,全球聚乙烯产量居五大泛用树脂之首。
聚乙烯依聚合方法、分子量高低、链结构之不同,分高密度聚乙烯、低密度聚乙烯及线性低密度聚乙烯。
①低密度聚乙烯(LOW DENSITY POLYETHYLENE,LDPE)俗称高压聚乙烯,因密度较低,材质最软,主要用在塑胶袋、农业用膜等。
②高密度聚乙烯(HIGH DENSITY POLYETHYLENE,HDPE)俗称低压聚乙烯,与LDPE及LLDPE相较,有较高之耐温、耐油性、耐蒸汽渗透性及抗环境应力开裂性,此外电绝缘性和抗冲击性及耐寒性能很好,主要应用于吹塑、注塑等领域。
③线型低密度聚乙烯(LINEAR LOW DENSITY POLYETHYLENE,LLDPE),则是乙烯与少量高级Α-烯烃在催化剂存在下聚合而成之共聚物。
LLDPE外观与LDPE相似,透明性较差些,惟表面光泽好,具有低温韧性、高模量、抗弯曲和耐应力开裂性,低温下抗冲击强度较佳等优点。
3.性能①一般特性聚乙烯树脂为无毒、无味的白色粉末或颗粒,外观呈乳白色,有似蜡的手感,吸水率低,小于0.01%。
聚乙烯膜透明,并随结晶度的提高而降低。
聚乙烯膜的透水率低但透气性较大,不适于保鲜包装而适于防潮包装。
易燃、氧指数为17.4,燃烧时低烟,有少量熔融落滴,火焰上黄下蓝,有石蜡气味。
聚乙烯的耐水性较好。
聚氯乙烯、聚乙烯、交联聚乙烯三者的区别

聚氯乙烯、聚乙烯、交联聚乙烯三者的区别聚乙烯英文简称PE,它是乙烯的聚合物,无毒,容易着色,化学稳定性好,耐寒,耐辐射,电绝缘性好。
它适合做食品和药物的包装材料,制作食具、医疗器械,还可做电子工业的绝缘材料等。
如:本安计算机用屏蔽电缆。
聚氯乙烯英文简称PVC,是氯乙烯的聚合物。
它化学稳定性好,耐酸、碱和有些化学药品的侵蚀。
它耐潮湿、耐老化、难燃。
它使用时温度不能超过60℃,在低温下会变硬。
聚氯乙烯分软质塑料和硬质塑料。
软质的主要制成薄膜,作包装材料、防雨用品、农用育秧膜等,还能作电缆、电线的绝缘层、人造革制品。
硬质的一般制成管材和板材,管材用作水管和输送耐腐蚀性流体管,板材用作各种贮槽的衬里和地板。
如:0.6/1kv聚氯乙烯绝缘电力电缆交联聚乙烯是提高PE性能的一种重要技术。
经过交联改性的PE可使其性能得到大幅度的改善,不仅显著提高了PE 的力学性能、耐环境应力开裂性能、耐化学药品腐蚀性能、抗蠕变性和电性能等综合性能,而且非常明显地提高了耐温等级,可使PE 的耐热温度从70℃提高到90℃以上,从而大大拓宽了PE 的应用范围。
目前,交联聚乙烯已经被广泛应用于管材、薄膜、电缆料以及泡沫制品等方面。
如:35kv及以下交联聚乙烯绝缘电力电缆。
因为工作的原因经常用到各种电缆、电线、网线、有线电视线但是常常只用那么几种,现就我知道常用的电缆、电线、网线、有线电视线的表示方法及用途作一简要归纳。
一、常用各种字母代表的含义:R-连接用软电缆(电线),软结构。
V-绝缘聚氯乙烯。
V-聚氯乙烯绝缘V-聚氯乙烯护套B-平型(扁形)。
S-双绞型。
A-镀锡或镀银。
F-耐高温P-编织屏蔽P2-铜带屏蔽P22-钢带铠装Y—预制型、一般省略,或聚烯烃护套FD—产品类别代号,指分支电缆。
将要颁布的建设部标准用FZ表示,其实质相同YJ—交联聚乙烯绝缘V—聚氯乙烯绝缘或护套ZR—阻燃型NH—耐火型WDZ—无卤低烟阻燃型WDN—无卤低烟耐火型三、电缆常识:电缆通常分为电力电缆和控制电缆两种。
PE、PP、PVC、PET、EPS、ABS、PA的识别

PE、PP、PVC、PET、EPS、ABS、PA的识别PE、PP、PVC、PET、EPS、ABS、PA这些中文名是什么应怎样认识这些我想认识一下这些燃烧有什么性质吗谢谢EPS泡沫聚苯乙烯PA聚酰胺PET 聚对苯二甲酸乙二酯.PE是聚乙烯.PVC是聚氯乙烯.PP是聚丙烯.ABS是丙烯腈,丁二烯,苯乙烯三者的共聚物。
①聚氯乙烯(PVC)它是建筑中用量最大的一种塑料。
硬质聚氯乙烯的密度为1.38~1.43g/cm3,机械强度高,化学稳定性好②聚乙烯(PE)③聚丙烯(PP)聚丙烯的密度在所有塑料中是最小的,约为0.90左右。
聚丙烯常用来生产管材、卫生洁具等建筑制品。
④聚苯乙烯(PS)聚苯乙烯为无色透明类似玻璃的塑料。
⑤ABS塑料ABS塑料是改性聚苯乙烯塑料,以丙烯睛(A)、丁二烯(B)及苯乙烯(S)为基础的三组分所组成。
PS:聚苯乙稀是一种无色透明的塑料材料。
具有高于100摄氏度的玻璃转化温度,因此经常被用来制作各种需要承受开水的温度的一次性容器,以及一次性泡沫饭盒等。
PP:聚丙烯是一种半结晶的热塑性塑料。
具有较高的耐冲击性,机械性质强韧,抗多种有机溶剂和酸碱腐蚀。
在工业界有广泛的应用,是平常常见的高分子材料之一。
澳大利亚的钱币也使用聚丙烯制作。
PE:聚乙烯是日常生活中最常用的高分子材料之一,大量用于制造塑料袋,塑料薄膜,牛奶桶的产品。
聚乙烯抗多种有机溶剂,抗多种酸碱腐蚀,但是不抗氧化性酸,例如硝酸。
在氧化性环境中聚乙烯会被氧化。
聚乙烯在薄膜状态下可以被认为是透明的,但是在块状存在的时候由于其内部存在大量的晶体,会发生强烈的光散射而不透明。
聚乙烯结晶的程度受到其枝链的个数的影响,枝链越多,越难以结晶。
聚乙烯的晶体融化温度也受到枝链个数的影响,分布于从90摄氏度到130摄氏度的范围,枝链越多融化温度越低。
聚乙烯单晶通常可以通过把高密度聚乙烯在130摄氏度以上的环境中溶于二甲苯中制备。
结构式:- CH2 - CH2 - CH2 - CH2 - CH2 - CH2 - CH2 - CH2ABS:是丙烯腈、丁二烯、苯乙烯的合成塑料丙烯腈、丁二烯、苯乙烯三种单体的接枝共聚合产物,取它们英文名的第一个字母命名。
PVC、UPVC、PP、PE、PPR、PEX分别是什么材料及其特点

PVC、UPVC、PP、PE、PPR、PEX分别是什么材料一、PVC 聚氯乙烯Poly vinyl chloridePVC是聚氯乙烯塑料,色泽鲜艳、耐腐蚀、牢固耐用,由于在制造过程中增加了增塑剂、抗老化剂等一些有毒辅助材料,故其产品一般不存放食品和药品。
PVC就是聚氯乙烯,是由43%的油和57%的盐合成出来的一种塑胶制品。
与其它种类的塑胶制品相比,PVC更有效的应用了生料,减少了油耗。
同时,PVC制造业对能量的消耗也很低。
并且在PVC产品的使用后期,能够回收并转化为其它新的产品或焚烧以获得能量。
PVC在生产时会加入稳定剂,但稳定剂有无毒和有毒之分,只有加入了铅盐之类有毒的稳定剂,才会产生隐患。
但PVC产品鱼龙混杂,一些小企业使用铅盐做稳定剂,很难达到相关卫生标准。
二、UPVC 硬聚氯乙烯UPVC又称硬PVC,它是氯乙烯单体经聚合反应而制成的无定形热塑性树脂加一定的添加剂(如稳定剂、润滑剂、填充剂等)组成。
除了用添加剂外,还采用了与其它树脂进行共混改性的办法,使其具有明显的实用价值。
这些树脂有CPVC、PE、ABS、EVA、MBS等。
UPVC的熔体粘度高,流动性差,即使提高注射压力和熔体温度,流动性的变化也不大。
另外,树脂的成型温度与热分解温度很接近,能够进行成型的温度范围很窄,是一种难于成型的材料。
UPVC管件,管材的优点:1、轻便:UPVC材料的比重只有铸铁的1/10,运输,安装简易,降低成本。
2、抗化学性优越:UPVC具有优良的抗酸碱性能,除接近饱和点强酸碱或强的Oxidising agents atmaximun外。
3、不导电:UPVC材料不能导电,也不受电解,电流的腐蚀,应此无需二次加工。
4、不能燃烧,也不助燃:没有消防顾虑。
5、安装简易,成本低廉:切割及联接都很简易,使用PVC胶水联接实践证明可安全,操作简便,成本低廉。
6、耐用:抗候性优良,也不能被细菌及菌类所腐化。
7、阻力小,流率高:内壁光滑,流体流动性损耗小,加以污垢不易附着在平滑管壁,保养较为简易,保养费用较低。
PVC管的性能参数及与PE管的比较

PVC管的性能参数及与PE管的比较PVC管是一种常见的塑料管道材料,由聚氯乙烯(PVC)制成。
它具有许多优点和特性,也与聚乙烯(PE)管道相比有一些不同之处。
本文将对PVC管道的性能参数和与PE管道的比较进行详细介绍。
1.物理性能:-强度:PVC管道具有较高的强度,可以承受一定的压力和重量。
-硬度:PVC管道硬度较高,刚性较好,不易变形。
PE管相对柔软,易变形。
-韧性:PVC管道韧性较好,具有较高的冲击强度。
PE管道也有一定的韧性,但比PVC管弱。
-导热性:PVC管道导热性较低,热传导能力较弱。
PE管道导热性较高,热传导能力较强。
2.化学性能:-耐腐蚀性:PVC管道对多种化学物质具有良好的耐腐蚀性,包括酸、碱和盐等。
PE管道也有一定的耐腐蚀性,但不如PVC管。
另外,PE管道相对PVC管道更耐酸,但不耐碱。
-耐候性:PVC管道耐候性较好,能够在恶劣的自然环境条件下使用。
PE管道的耐候性稍逊于PVC管道。
-阻燃性:PVC管道具有良好的阻燃性能,不易燃烧。
PE管道在燃烧时会释放有害气体。
3.使用范围:-温度范围:PVC管道的温度范围较窄,通常适用于-10℃至60℃之间。
PE管道的温度范围较广,适用于-40℃至60℃之间。
-应用领域:PVC管道广泛应用于建筑、给排水、污水处理等领域。
PE管道广泛用于燃气输送、水力输送和农业灌溉等领域。
4.施工和维护:-安装:PVC管道安装简单方便,使用橡胶密封圈进行连接。
PE管道需要进行热熔连接,施工相对复杂一些。
-维护:PVC管道不易被生物附着和腐蚀,维护成本较低。
PE管道容易受到微生物和化学物质的侵蚀,需要定期检查和维护。
总结来说,PVC管道具有较高的强度、良好的耐腐蚀性和阻燃性能,适用于建筑和给排水等领域。
PE管道具有较好的韧性、较高的耐酸能力和较广的温度范围,适用于燃气输送和水力输送等领域。
选用管道材料时应综合考虑各项性能参数以及具体应用需求。
pvc pe pp pet abs 各自的区别,价格,用途等

PVC:聚氯乙烯塑料是由氯乙烯单体经自由基聚合而成的聚合物,60年代后期退居第二位。
由于PVC树脂合成原料丰富,价格低廉需求量增加很快,地、位逐渐加强。
按分子量大小可将PVC分为通用型和高聚和度型两类。
通用型PVC 平均聚合度500~~150高聚和度型PVC平均聚合度为1700以上。
我们常用的PVC树脂都为通用型。
PE:超高分子量聚乙烯(UHMW-PE)是热塑性工程塑料。
它综合了大部分塑料的优越性能,耐冲击、耐低温、耐磨损、耐化学腐蚀、自身润滑、吸收冲击能,这六个特性是目前塑料中所具有的最高数值。
超高分子量聚乙烯采用齐格勒型高效催化剂低压合成法,分子量根据需要控制在150-300万以上。
考虑到加工过程分子的热降解,因此具有粘均分子量大于170万的高密度聚乙烯加工成各种制品,才能更加具有优越性能。
PP:PP(聚丙烯)具有高刚度,高硬度和高强度,但缺口抗冲击韧一般。
PP 材料能承受张拉应力并易焊接。
低温时变脆,化学稳定性和电气性能优良。
工作温度从5度到100度。
特性:密度低;耐热,不变形;高刚度;高表面强度;化学稳定性好;无毒无害;缺点:韧性一般,耐氧化性一般,耐磨强度一般,低温时脆化,不可高姘焊接,易受天气条件限制。
应用领域:泵阀部件,饮用水污水管道,密封件,喷涂载体,耐腐蚀槽、桶,耐酸碱工业用,废水,废气排放设备用,洗涤塔,无尘室,半导体厂及其相关工业之设备和机器,食品机械及斩板,电镀工艺,玩具部件,牙医用导管,广泛用于化工,机械,电器及电子工业等结构材料。
PET:聚对苯二甲酸乙醇酯,中文俗称:"赛白钢"。
PET作为工程塑料使用具有坚硬、刚度好、强度高、有韧性、摩擦系数小、尺寸稳定性高等特性。
PET型材的综合性能完全可以和尼龙/PA6,PA66,聚甲醛(POM)等品种的工程塑料相媲美,并可部分取代它们的应用。
应用范围极有前景。
应用:机械零部件、齿轮、凸轮、叶片、泵部件、高荷滑动轴承部件、电子工业绝缘体、汽车零部件、食品卫生机械配件。
PVC与PE有什么区别

PVC与PE有什么区别名称上,PVC是聚氯乙烯,PE是聚乙烯价格上,PVC便宜,PE贵性能上,都不耐热,<45℃情况下使用(有人对PE分子结构做了改变,即PEX 和PERT,可耐高温)应用上,PVC应用更广泛,也和它便宜有关系,PE的应用远没有这么广泛卫生性能上,PVC因为有氯,在加热的时候会释放出氯气,和空气中的水发生反映,产生氯化氢气体,对人体有毒,而PE只含有碳氢两种元素,卫生无毒不知道你要干什么,简单就说这么多吧!有问题可以HI我求加分哦!pvc又称聚氯乙烯,具有不易燃性、高强度、耐气侯变化性以及优良的几何稳定性。
PVC对氧化剂、还原剂和强酸都有很强的抵抗力。
然而它能够被浓氧化酸如浓硫酸、浓硝酸所腐蚀并且也不适用与芳香烃、氯化烃接触的场合。
pe又称聚乙烯,根据密度的不同分为高密度聚乙烯、中密度聚乙烯和低密度聚乙烯。
PVC管和PE管材的区别在PE双壁波纹管设备销售工作中,经常也会在商务网站上,所接收到的询盘中,看到有关PVC聚氯乙烯双壁波纹管设备的咨询,如果是行业内人士,大致是了解这2种材料所制造出的管材的不同,但是如果是初次涉足塑料管材行业的朋友们,恐怕很难对此明了,没准大部分人也会像我刚入行时一样,表现出困惑和不解。
其实这个困惑并不难解开,下面让我借助一些专业的学术资料,从PVC 管和PE管的发展历程切入,简单的介绍一下,PVC管和PE管的不同点,以及未来的应用和发展趋势。
聚氯乙烯(PVC)管目前在我国应用的塑料管主要是硬质聚氯乙烯(UPVC)管,聚氯乙烯管应用历史最久,这是因为聚氯乙烯管具有强度较高、刚性较大、材料价格比较低等优点,而且已经有丰富的使用经验,在世界各地仍然被广泛的应用、在我国已经能够为建筑给排水、室外埋地给排水管道工程等提供质量较可靠、配套较完整的聚氯乙烯管材和管件,无疑聚氯乙烯管今后在我国仍然会有发展。
在我国,UPVC管生产企业约600多家,生产能力约11O万t。
生产规模超过1万t的企业约30多个,规模在0.6万一I万t的企业约60家左右、在城市住宅建筑排水管方面,据统计,1998年UPVC管在一些城市中使用率达到90%左右,在城市供水管道上约理设5000多公里,最大竹管径为630mm。
PP、PE、PVC

PP、PE、PVC都是塑料,其中PE是聚乙烯塑料无毒透明透气性好常用于制造生活用品如简易食品包装袋、一次性注射器、给排水暗管(易降解老化)等,PP是聚丙烯塑料无毒高度透明强度好、耐腐蚀它具有PE的所有优点,常用于制造生活用品、塑料医疗器械如透明塑料脸盆、一次性注射器等等,PVC是聚氯乙烯塑料透气性差、有毒也常用于生活用品和建筑装修方面居室内墙和吊顶的装饰如排水管道等。
PP、PE、PVC都是塑料品名英文的缩写,国人对其的通俗称谓。
它们分别是聚丙烯、聚乙烯、聚氯乙烯。
再比如说PTFE是聚四氟乙稀、FEP是氟化乙烯丙稀共聚物、PVDF是聚偏二氟乙稀、ETFE是乙烯和四氟乙烯的共聚物等是同样的道理PU即聚氨基甲酸脂(polyurethane)。
PU革系指以牛、猪二层蓝坯革为底革,表面贴合一层聚氨酯薄膜的产品,也叫二层贴膜革,即干法PU革;湿法PU革为在二层革表面淋上一层聚胺酯浆液,再经干燥而成,基于聚胺酯涂料及贴膜成本较高,现已生产不多,并且已由干法转向湿法生产。
PVC即聚氯乙烯(polyvinyl chloride),PVC革以针织布料为底基,上面贴合一层PVC树脂薄膜的产品,PVC薄膜有毒且易老化,将由PE塑料薄膜代替。
PE为聚乙烯(polyethylene, polythene),无毒,成本低,用量省。
PP为聚丙烯(polypropylene)。
①聚氯乙烯(PVC)它是建筑中用量最大的一种塑料。
硬质聚氯乙烯的密度为1.38~1.43g/cm3,机械强度高,化学稳定性好,使用温度范围一般在-15~+55℃之间,适宜制造塑料门窗、下水管、线槽等。
②聚乙烯(PE)聚乙烯塑料在建筑上主要用于给排水管、卫生洁具。
③聚丙烯(PP)聚丙烯的密度在所有塑料中是最小的,约为0.90左右。
聚丙烯常用来生产管材、卫生洁具等建筑制品。
④聚苯乙烯(PS)聚苯乙烯为无色透明类似玻璃的塑料。
聚苯乙烯在建筑中主要用来生产泡沫隔热材料、透光材料等制品。
PVCPE型号及主要用途介绍解析

PVCPE型号及主要用途介绍解析PVC(聚氯乙烯)和PE(聚乙烯)是两种常见的塑料材料,具有广泛的应用领域和不同的特性。
下面将对它们的型号及主要用途进行介绍解析。
一、PVC(聚氯乙烯)PVC是一种白色粉末状的可塑性高分子材料,是目前世界上生产最大、使用最广泛的塑料之一、根据其不同的制备方法和处理工艺,PVC可以分为不同的型号,下面是一些常见的PVC型号及其主要用途:1.PVC-C:氯化聚氯乙烯,具有耐腐蚀性好、耐高温性能优异、自熄性好等特点。
主要用于化工管道系统、电力电缆护套、天然气管道等领域。
2.PVC-U:硬质聚氯乙烯,具有机械强度高、耐磨损性好、绝缘性能优异等特点。
主要用于建筑材料、电子电器元件、玩具等领域。
3.PVC-E:亚稳态聚氯乙烯,具有低收缩率、低内应力等特点。
主要用于注塑成型、吹塑等加工领域。
4.PVC-S:泡沫聚氯乙烯,具有优良的绝缘性能和吸音、抗震等特点。
主要用于建筑隔热保温材料、装饰材料等领域。
5.PVC-HFR:阻燃改进型聚氯乙烯,具有良好的阻燃性能和耐热性能。
主要用于电线电缆绝缘材料、汽车内饰材料等领域。
二、PE(聚乙烯)PE是一种常见的塑料,具有低密度、高强度、耐化学腐蚀等特点,是世界上生产量最高的工程塑料之一、根据不同的聚合方法和分子量,PE可以分为不同的型号,下面是一些常见的PE型号及其主要用途:1.LDPE(低密度聚乙烯):具有柔软、透明等特点,易于加工和吸湿性较低。
主要用于食品包装膜、农膜、塑料袋等领域。
2.HDPE(高密度聚乙烯):具有高强度、刚性和优良的阻氧性能。
主要用于塑料容器、管道、卫生用品等领域。
3.LLDPE(线性低密度聚乙烯):具有较高的拉伸强度和耐冲击性能。
主要用于薄膜、缠绕膜等领域。
4.MDPE(中密度聚乙烯):具有优良的强韧性和耐磨性。
主要用于管道、电线电缆护套等领域。
5.UHMWPE(超高分子量聚乙烯):具有超强的耐磨性和耐冲击性能。
主要用于机械零部件、输送带等领域。
PVCPE型号及主要用途介绍

PVCPE型号及主要用途介绍PVC和PE是常见的塑料材料,广泛用于各个领域。
下面将对PVC和PE的型号及主要用途进行介绍。
PVC,全称聚氯乙烯(Polyvinyl Chloride),是一种重要的合成树脂。
它以其良好的物理性能和成本优势,被广泛应用于建筑、电气、包装和医疗等领域。
一、PVC型号及主要用途:1. PVC型号:普通PVC(Emulsion PVC,简称E-PVC)和聚合物PVC (Polymer PVC,简称S-PVC)。
-普通PVC(E-PVC):也称液体PVC,是通过乳液聚合制得的PVC。
它具有良好的流动性、表面光滑,常用于生产硬质PVC制品和PVC膜。
-聚合物PVC(S-PVC):也称粉末PVC,是通过糊精聚合制得的PVC。
它具有较高的强度和硬度,常用于生产PVC管道、PVC板材和PVC型材等。
2.主要用途:-PVC管道:PVC管道具有耐腐蚀、低成本、易安装等优点,广泛应用于建筑、供水、排水和化工等领域。
-PVC板材:PVC板材具有耐候性好、防水、耐酸碱等特点,常用于室内装饰、广告招牌、隔板等。
-PVC型材:PVC型材具有优良的绝缘性能、耐热性和防火性能,常用于电气绝缘材料和建筑装潢。
-PVC地板:PVC地板具有耐磨、防滑、易清洁等特点,常用于家庭和商业场所的地面装饰。
-PVC包装膜:PVC包装膜具有良好的透明度、柔软性和抗冲击性,常用于食品包装、药品包装和工业制品包装。
PE,全称聚乙烯(Polyethylene),是一种常见的热塑性塑料。
由于其具有良好的耐化学性、电绝缘性和物理机械性能,被广泛应用于包装、建筑、医疗和农业等领域。
一、PE型号及主要用途:1.PE型号:根据聚合度和密度的不同,PE可分为高密度聚乙烯(HDPE)、线性低密度聚乙烯(LLDPE)和低密度聚乙烯(LDPE)。
-高密度聚乙烯(HDPE):具有较高的结晶度和强度,常用于生产瓶盖、水管、地板材料等。
-线性低密度聚乙烯(LLDPE):具有较高的透明度和柔软性,常用于生产塑料袋、保鲜膜、农膜等。
如何区别4种常见的塑料材质:聚乙烯(PE) 、聚氯乙烯(PVC)、聚丙烯(PP)

如何区别4种常见的塑料材质:聚乙烯(PE) 、聚氯乙烯(PVC)、聚丙烯(PP)、聚苯乙烯 (PS)的区别在哪里?常见工业塑料材质:聚乙烯(PE) 、聚氯乙烯(PVC)、聚丙烯(PP)、聚苯乙烯 (PS)化学特性不同而应用于产品生产各有不同。
聚丙烯,简称PP。
由丙烯聚合而制得的一种热塑性树脂。
未着色时呈白色半透明,蜡状;比聚乙烯轻。
透明度也较聚乙烯(PE)好,比聚乙烯(PE)刚硬。
常见制品:盆、桶、家具、薄膜、编织袋、瓶盖、汽车保险杠等。
聚乙烯,简称PE。
它是乙烯的聚合物,无毒。
容易着色,化学稳定性好,耐寒,耐辐射,电绝缘性好。
它适合做食品和药物的包装材料,制作食具、医疗器械,还可做电子工业的绝缘材料等。
聚氯乙烯,简称PVC。
是氯乙烯的聚合物。
聚氯乙烯(PVC)是合成材料,具有多种的优势,是工程塑料的理想材料。
化学稳定性好,耐酸、碱和有些化学药品的侵蚀。
耐潮湿、耐老化、难燃。
使用时温度不能超过60℃,在低温下会变硬。
聚氯乙烯分软质塑料和硬质塑料。
软质的主要制成薄膜,作包装材料、防雨用品、农用育秧膜等,还能作电缆、电线的绝缘层、人造革制品。
硬质的一般制成管材和板材,管材用作水管和输送耐腐蚀性流体管,板材用作各种贮槽的衬里和地板。
其他相关:本色为微黄色半透明状,有光泽。
透明度胜于聚乙烯、聚苯烯,差于聚苯乙烯,随助剂用量不同,分为软、硬聚氯乙烯,软制品柔而韧,手感粘,硬制品的硬度高于低密度聚乙烯,而低于聚丙烯,在屈折处会出现白化现象。
常见制品:板材、管材、鞋底、玩具、门窗、电线外皮、文具等。
聚苯乙烯,简称PS。
在未着色时透明。
制品落地或敲打,有金属似的清脆声,光泽和透明很好,类似于玻璃,性脆易断裂,用手指甲可以在制品表面划出痕迹。
改性聚苯乙烯为不透明。
常见制品:文具、杯子、食品容器、家电外壳、电气配件等。
聚乙烯、聚氯乙烯和氯乙烯分别是什么

聚乙烯、聚氯乙烯和氯乙烯分别是什么?聚乙烯聚乙烯(polyethylene ,简称PE)是乙烯经聚合制得的一种热塑性树脂。
在工业上,也包括乙烯与少量α-烯烃的共聚物。
聚乙烯无臭,无毒,手感似蜡,具有优良的耐低温性能(最低使用温度可达-100~-70°C),化学稳定性好,能耐大多数酸碱的侵蚀(不耐具有氧化性质的酸)。
常温下不溶于一般溶剂,吸水性小,电绝缘性优良。
分聚乙烯依聚合方法、分子量高低、链结构之不同,分高密度聚乙烯(HDPE)、低密度聚乙烯(LDPE)及线性低密度聚乙烯(LLDPE)。
低密度聚乙烯(LDPE)性质:无味、无臭、无毒、表面无光泽、乳白色蜡状颗粒,密度约0.920 g/cm3,熔点130℃~145℃。
不溶于水,微溶于烃类等。
能耐大多数酸碱的侵蚀,吸水性小,在低温时仍能保持柔软性,电绝缘性高。
生产工艺:主要有高压管式法和釜式法两种。
为降低反应温度和压力,管式法工艺普遍采用低温高活性引剂引发聚合体系,以高纯度乙烯为主要原料,以丙烯、丙烷等为密度调整剂,使用高活性引发剂在约200℃~330℃、150~300MPa条件下进行聚合反应。
反应器中引发聚合的熔融聚合物,必须要经过高压、中压和低压冷却、分离,高压循环气体经过冷却、分离后送入超高压(300 MPa)压缩机入口,中压循环气体经过冷却、分离后送入高压(30 MPa)压缩机入口,而低压循环气体经过冷却、分离后送入低压(0.5 MPa)压缩机循环利用,而熔融聚乙烯经过高压、低压分离后送入造粒机,进行水中切粒,在造粒时,企业可以根据不同应用领域,加入适宜的添加剂,颗粒经包装出厂。
用途:可以采用注塑、挤塑、吹塑等加工方法。
主要用作农膜、工业用包装膜、药品与食品包装薄膜、机械零件、日用品、建筑材料、电线、电缆绝缘、涂层和合成纸等。
线性低密度聚乙烯(LLDPE)性质:由于LLDPE和LDPE的分子结构明显不同,性能也有所不同。
与LDPE相比,LLDPE具有优异的耐环境应力开裂性能和电绝缘性,较高的耐热性能、抗冲和耐穿刺性能等。
ABS、PE、PP、PVC塑料材料的区别

ABS、PE、PP、PVC塑料材料的区别PET聚对苯二甲酸乙二酯.PE是聚乙烯.PVC是聚氯乙烯.PP是聚丙烯.ABS是丙烯腈,丁二烯,苯乙烯三者的共聚物。
PEP是聚乙二醇PEG和环氧丙烷PO)两者的共聚物。
①聚氯乙烯(PVC)它是建筑中用量最大的一种塑料。
硬质聚氯乙烯的密度为1.38~1.43g/cm3,机械强度高,化学稳定性好②聚乙烯(PE)③聚丙烯(PP)聚丙烯的密度在所有塑料中是最小的,约为0.90左右。
聚丙烯常用来生产管材、卫生洁具等建筑制品。
④聚苯乙烯(PS)聚苯乙烯为无色透明类似玻璃的塑料。
⑤ABS塑料ABS塑料是改性聚苯乙烯塑料,以丙烯睛(A)、丁二烯(B)及苯乙烯(S)为基础的三组分所组成。
PS:聚苯乙稀是一种无色透明的塑料材料。
具有高于100摄氏度的玻璃转化温度,因此经常被用来制作各种需要承受开水的温度的一次性容器,以及一次性泡沫饭盒等。
PP:聚丙烯是一种半结晶的热塑性塑料。
具有较高的耐冲击性,机械性质强韧,抗多种有机溶剂和酸碱腐蚀。
在工业界有广泛的应用,是平常常见的高分子材料之一。
澳大利亚的钱币也使用聚丙烯制作。
PE:聚乙烯是日常生活中最常用的高分子材料之一,大量用于制造塑料袋,塑料薄膜,牛奶桶的产品。
聚乙烯抗多种有机溶剂,抗多种酸碱腐蚀,但是不抗氧化性酸,例如硝酸。
在氧化性环境中聚乙烯会被氧化。
聚乙烯在薄膜状态下可以被认为是透明的,但是在块状存在的时候由于其内部存在大量的晶体,会发生强烈的光散射而不透明。
聚乙烯结晶的程度受到其枝链的个数的影响,枝链越多,越难以结晶。
聚乙烯的晶体融化温度也受到枝链个数的影响,分布于从90摄氏度到130摄氏度的范围,枝链越多融化温度越低。
聚乙烯单晶通常可以通过把高密度聚乙烯在130摄氏度以上的环境中溶于二甲苯中制备。
结构式:-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2ABS:是丙烯腈、丁二烯、苯乙烯的合成塑料丙烯腈、丁二烯、苯乙烯三种单体的接枝共聚合产物,取它们英文名的第一个字母命名。
PVCPCPEABSPETPP常用材料介绍

PVCPCPEABSPETPP常用材料介绍PVC(聚氯乙烯)是一种常见的塑料材料。
它具有优异的耐热性、耐腐蚀性和耐候性,是制造水管、电线绝缘层、塑料地板等产品的理想材料。
PVC可以通过针对不同应用的配方来改变其硬度,从柔软的塑料薄片到坚硬的塑料管道都可以制造。
此外,PVC还具有可塑性强、低成本等优点,因此在建筑、电子、医疗、家具等领域得到了广泛应用。
PC(聚碳酸酯)是一种强度高、透明度好的工程塑料。
PC具有良好的耐高温性能、耐冲击性能和耐候性,是汽车零部件、塑料瓶、眼镜镜片等制造的理想材料。
此外,PC还具有良好的耐化学性能和电气绝缘性能,可以用于制造电子产品的外壳和绝缘板。
PE(聚乙烯)是一种广泛用于包装领域的塑料材料。
PE分为高密度聚乙烯(HDPE)和低密度聚乙烯(LDPE)两种类型。
HDPE具有良好的机械性能和刚度,可以用于制造瓶子、水管等产品;LDPE则具有柔软性好、延展性强的特点,适用于制作塑料袋、保鲜膜等产品。
PE具有良好的耐化学性能、低吸水性和电气绝缘性能,广泛应用于农业、家居、医疗等领域。
ABS(丙烯腈-丁二烯-苯乙烯共聚物)是一种耐冲击、耐热、耐化学性好的工程塑料。
ABS具有良好的针对化学品的稳定性和电气绝缘性能,广泛应用于汽车零部件、橡胶转轮、手机外壳等产品的制造。
此外,ABS还具有良好的表面光洁度和成型性,可以通过注塑、挤出等方式制造各种复杂形状的产品。
PET(聚对苯二甲酸乙二酯)是一种常见的塑料材料,也被称为聚酯纤维。
PET具有优异的刚度、强度和耐磨性,是制造瓶子、纤维、薄膜等产品的理想材料。
PET还具有良好的耐高温性能、耐溶剂性能和电气绝缘性能,可以用于制造各种电子产品的外壳和绝缘层。
PP(聚丙烯)是一种常见的塑料材料,具有良好的韧性、耐化学性和热性能。
PP具有较低的密度和优异的刚度,可以制造坚固、轻便的产品。
因此,PP广泛应用于瓶盖、容器、桶等包装产品的制造,同时也用于汽车零部件、纤维、管道等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药包材注册申请聚氯乙烯/低密度聚乙烯液体包装复合药用硬片申报材料单位名称:单位地址:联系人:电话:传真邮编:×××公司申报资料目录一、省级(食品)药品监督管理局对申报单位药包材生产情况考核报告××××省食品药品监督管理局对申报单位药包材生产情况考核报告二、国家食品药品监督局设置或者确定的药包材检验机构出具的三批申报产品质量检验报告书。
××××省药用包装材料容器质量监督检验站检验报告书(三批)三、国家食品药品监督管理局设置或确定的药包材料或者药品检验机构出具的洁净室(区)洁净度检验报告书。
×××省医疗器械检验所出具空气质量监测检验报告书。
四、申报企业营业执照企业营业执照复印件五、申报产品生产、销售、应用情况综述企业概况生产和质量管理自查情况生产情况综述销售情况综述产品应用情况综述六、申报产品的配方聚氯乙烯/低密度聚乙烯液体包装复合药用硬片聚氯乙烯固体药用硬片质量标准(YBB00212005)液体包装用聚乙烯吹塑薄膜质量标准(QB1231-91)双组份聚氨酯胶粘剂质量标准乙酸乙酯质量标准(GB3728-91)七、申报产品的生产工艺及主要生产、检验设备说明聚氯乙烯/低密度聚乙烯液体包装复合药用硬片生产工艺主要生产设备说明主要检验仪器说明八、申报产品的质量标准聚氯乙烯/低密度聚乙烯液体包装复合药用硬片质量标准九、三批申报产品的生产企业自检报告书聚氯乙烯/低密度聚乙烯液体包装复合药用硬片检验报告书(三批)委托检验报告书十、与采用申报产品包装的药品同时进行的稳定性试验(药物相容试验)研究资料直接接触药品的包装材料与药物相容性试验资料十一、申报产品生产厂区及洁净室(区)平面图厂区平面图净化车间平面图净化车间送风图净化车间回风图净化车间检测采样点图十二、申报产品生产企业环境保护、废气废水排放、安全消防等符合国家有关法律规定所取得的有关合格证明。
××市环境保护局环保合格证明××市公安消防大队消防合格证明委托协议资料一一、省级(食品)药品监督管理局申报单位药包材生产情况考核报告×××包装材料有限公司地址:联系人:电话:邮编:×××省食品药品监督管理局对申报单位药包材生产情况考核报告×××包装材料公司资料二二、国家食品药品监督管理局设置或者确定的药包材检验机构出具的三批申报产品质量检验报告书×××包装材料有限公司地址:联系人:电话:邮编:×××省食品药品检验所出具聚氯乙烯/低密度聚乙烯液体包装复合药用硬片检验报告书(三批)×××包装材料有限公司资料三三、国家食品药品监督管理局设置或者确定的药包材或者药品检验机构出具的洁净室(区)洁净度检验报告书×××包装材料有限公司地址:联系人:电话:×××省食品药品检验所出具空气质量监测检验报告书×××包装材料有限公司资料四四、申报企业营业执照×××包装材料有限公司地址:联系人:电话:企业营业执照复印件×××包装材料有限公司资料五五、申报产品生产、销售、应用情况综述×××包装材料有限公司地址:联系人:电话:企业概况××包装材料有限公司是一家民营股份制企业,公司筹建于×××年下半年,×××年×月正式取得企业法人营业执照,公司生产聚氯乙烯固体药用硬片(简称PVC片)聚氯乙烯/低密度聚乙烯固体药用复合硬片(简称PVC/PE片),和聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片(简称PVC/PE/PVDC片)三个产品,其中后二个产品填补了××空白。
本公司座落于××工业城,占地××万平方米,其中一期生产车间厂房面积达××平方米,净化车间面积××平方米。
仓库、办公楼(检验室)达××平方米。
购置了先进的自动化生产设备,检验仪器,总投资××余万元(一期),预计年生产能力达×××吨,生产值达×××万元。
本公司按照国家食品药品监督管理局关于药包材注册管理办法要求,进行了科学设计。
布局合理,厂房、设备、人员等均符合生产上述产品的要求,公司内设总经理办、行政部、质量部、生产技术部、供销部、药包材车间等内设机构,公司现有职工××人,其中管理、技术人员××人,占公司总人数×%。
要公司的宗旨是:一流的生产环境(10万级净化车间),一流的生产设备(自动化流水作业),一流的管理模式,一流的产品质量和高水平的服务意识。
生产和质量管理自查情况根据国家食品药品监督局颁发《药材生产现场考核通则》检查项目标准,结合我公司生产三个产品的实际情况,对照《通则》有关规定:机构和人员、厂房与设施、物料、卫生、文件、生产管理、质量管理七个方面条款,组织了质量、生产管理人员进行了认真逐一的自查,现将自查情况汇报如下:一、机构和人员根据《直接接触药品包装材料和容器管理办法》的要求,组建了完善的组织机构,公司下设总经理办、行政办、生技部、质量管理部(下设检验室)、供销部、财务部。
聘用的主管生产和技术负责人具有大专学历,并且长期从事本专业工作,具有生产塑料复合硬片的实践经验。
质量检验人员具有中专以上文化学历并且长期从事医药产品化学分析工作,能承担公司检验任务。
生产操作人员均具有初中以上文化程序,经专业技术培训后,又进行了考试和考核,合格后方可上岗。
对受培训的员工建立了个人教育档案。
二、厂房与设施本公司生产环境清洁,总体布局合理,厂区道路平整,生产区与生活区分开。
符合生产药用塑料硬片的要求,生产车间面积××多平方米。
10万级净化,生产车间地面采用环氧地坪耐磨漆,洁净区采用优质彩钢板隔断。
内表面平整光滑、无裂缝,接口严密,无颗粒物脱落。
各种通道、封口、灯具与天棚或墙壁的连接部位经密封处理,墙壁与地面的交接处成弧形。
洁净区照明度和空气洁净度、温湿度、压差均符合要求,并设有应急照明设施和安全通道。
仓库设有成品库、原辅料库、待验区、退货区、不合格品区整个厂房按规定要求布局合理,人流物流分开,经消防环保部门验收,符合国家有关要求。
设备选型,安装符合生产要求,易于清洗、消毒,便于生产操作和维护保养,能防止差错和减少污染。
与物料直接接触的设备表面均采用不锈钢材质。
与设备连接的管道和流向色标。
用于和产和检验的仪器、量具、衡器等,其适用范围和精密度皆符合生产和检验要求,有明显的检定合格标志。
健全了相应的设备管理制度。
所有设备、仪器皆已登记造册,并建立了维修、保养设备档案。
设备、仪器的管理,制订了标准操作规程,操作人员经培训,考核合格后上岗,使用时严格实行定人、定机,并做好了设备清场记录和交接班记录。
三、物料仓库总面积近×××平方米,成品库、原辅料库独立,在仓库区内已划分:合格区、不合格区、待验区、退货区。
仓府地面清洁,干燥,符合储存要求。
制定了生产所用物料的购入、验收、储存、发放、使用管理制度,并按相应制度管理。
主要原辅料的购进,均选用有资质的供应商,固定了采购厂家,并建立了供货厂家档案。
购进的物料按规定项目检验合格后入库、编号、入帐、存档并执行先进先出原则,严格执行物料发放制度。
库内物料按待验品、合格品严格区分,不合格品专区存放,并设有明显标志。
库内货物设有货位卡,填写清楚。
成品经质量管理部检验合格后方可入库、出库、销售,建产了完善的成品发放台帐长销售记录。
四、卫生企业根据生产区域环境、个人、工作服的卫生要求,制订清洁卫生管理制度,建立清洁卫生规程,定期检查并记录。
生产区设置专职保洁员,分别负责洁净生产区和一般生产区卫生清扫。
直接接触产品的生产人员、检验人员等每年进行一次健康检查,合格方可上岗。
生产区的废弃物及时处理,生产区不得存在非生产物品和个人杂物。
工作服的选材、式样及穿戴方式皆与生产操作和空气洁净级别要求相适应。
设备、容器具制定了严格的清洁卫生标准操作规程,设备、容器使用后立即进行清洗,已清洁的设备、容器状态标识清晰。
非洁净区人员未给批准不得进洁清区,进入洁净区的人员均不得化妆和佩戴饰物。
五、文件公司按照要求进行了管理文件、技术文件的编写、完善、整理工作,统一文件格式,编制和完善了生产管理、质量管理的标准文件体系。
包括各种管理标准、技术标准和相应的记录。
并建立了文件的起草、修订审查、批准、撤销及保管和管理制度。
六、生产管理本公司药用塑料硬片的生产管理均按工艺规程,由生技部下达生产指令,严格按照岗位SOP监督执行,每个工序设有兼职生产工艺员的兼职质检员,负责本工序的生产管理和管理监督工作。
做好各工序清洁、清场工作。
做到有人检查、有人复核、有人监督。
中间产品如不合格保证不流入下道工序,不合格成品保证不出公司销售。
每个物料容器贴有标签,使用后即做清洁并挂状态标志,每台设备设有状态卡,运行标识或清洁标识。
由生技部下发批生产指令并直接下发批记录,生产批记录生产完毕后由车间工艺员交回生技部,由生技部递交质量管理部质量管理负责人审核。
七、质量管理质量管理部由总经理直接领导,主要执行质量管理、质量检验三大功能,公司质量管理和质量检验人员×人。
检验室面积××平方米,设有留样室、仪器室、菌检室、化学检测室、标定室。
质检人员的数量和素质都能满足生产规模的需要,检验仪器都能满足生产规模的需要。
质量部实施了对物料、半成品和成品的取样检验、留样管理,并发出检验报告,决定物料和中间产品的使用,对成品进行了放行审核,决定成品的发放。
履行了不合格品的处理程序。
通过自查,我们感到本公司硬件设施和软件管理方面基本符合生产药用包装材料的要求,但我们同时也清醒地认识到一些差距和不足,主要表现在:相关记录不太齐全,个别职工对药包材相关法规不太熟悉,厂区部分绿化区需进一步加强管理等;这些问题都是我们需要努力的。
我们一定要按照《通则》要求进一步加强学习,严格执行、严格管理,创一流的产品,为制药企业提供优质的包装材料,保证药品质量安全有效贡献应有的力量。
