乙炔分子的直线形结构——sp杂化轨道烯烃炔烃的物理性质作业
第五章炔烃和二烯烃

(2)没有正负电荷分离的更稳定
H2C C H C H CH2 H2C C H C H CH2
(3)电负性大的原子带负电荷,电负性 电负性大的原子带负电荷, 小的带正电荷的稳定
H2C N N: H2C N N:
(4)共振极限式具有相同能量时,杂化体 共振极限式具有相同能量时, 非常稳定
H2 C
C H
C H
CH2
H Br
40℃ 40℃
20% %
H3 C
高温 40℃ 40℃
H C Br
2个没有参加杂化的p轨道 个没有参加杂化的p
H
C
C
H
乙炔是直线型分子
二、同分异构和命名 炔烃是直线型分子,不存在顺反异构。 炔烃是直线型分子,不存在顺反异构。
C4H6 HC CCH2CH3 CH3C CCH3
C5H8 HC CCH2CH2CH3 CH3C CCH2CH3 HC CCHCH3 CH3
CH2 CH CH 2 CH CH 2 C CH CH O N
CH C
p -π 共轭体系 与双键碳原子直接相连的原子上有 p 轨道, 轨道, 这个p 轨道与π 轨道平行, 这个p 轨道与π 键的 p 轨道平行,从侧面 共轭体系。 重叠构成 p -π 共轭体系。如:
C H 2 = CH Cl
H H
C
H H
烯丙基碳正离子,非常稳定。 烯丙基碳正离子,非常稳定。
H H + H3C C C CH2 + H3C C C CH2 H H
低温碳正离子稳定性: > 低温碳正离子稳定性: 双键稳定性: 双键稳定性: <
低温 -80℃ 80℃
H3 C
有机化学 第四章 炔烃
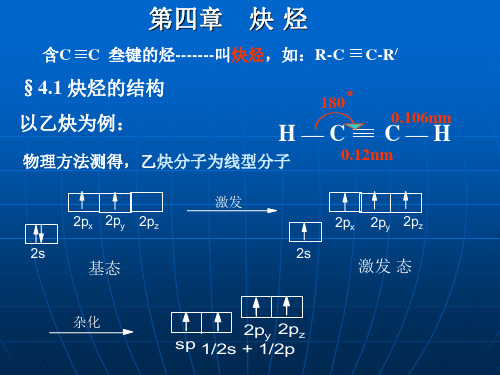
R-C
C-Na + NH3↑
R-C≡C-Na + R/X R/X/
6、聚合反应
Cu2Cl2 2 CH CH NH Cl H2O CH2 CH 4
CH CH CH2 CH Cu2Cl2 NH 4Cl H 2O
C CH
C
C CH CH2
增碳
例: 以乙炔为原料合成下列化合物: (1)Z-3-己烯; (3)醋酸乙烯脂; (2)E-3-己烯;
2) 和卤化氢加成
RC
注:
CH
HX
HgCl2
R
C X
CH2 HX
HgCl2
R
X C X
CH3
① 反应可以停留在卤代烯烃阶段; ② 在催化剂汞盐或铜盐存在时,叁键与HX反应 活性比双键大; ③ 不对称炔烃与HX加成符合马氏规则,对于HBr 有过氧化物效应。
3) 和水加成
RC CH + H2O
HgSO4 H 2SO4 ) (稀
5 4 3 2 1
CH3-CH = CH-C
CH
3-戊烯-1-炔
(不叫 2-戊烯-4-炔)
如对称,优先考虑双键。
HC CCHCH=CH 2 CH 3
6 5 4 3 2 1
3-甲基-1-戊烯-4-炔
HC C-CH2-CH2-CH=CH2
1-己烯-5-炔
§4.3 物理性质(自学) §4.4 化学性质 1、氢化反应 1)催化氢化
RC CR' + H2
催化加氢反应活性:炔烃>烯烃
Ni(Pt , Pd)
RCH
CHR'
Ni(Pt, Pd)
H2
RCH2CH2R'
RC
乙炔分子的直线形结构——sp杂化轨道烯烃炔烃的物理性质作业

CH3
3-甲基环戊烯
CH(CH3)2
1-甲基-3-异丙基环己烯
CH3
5-甲基环辛炔
3-2 乙烯分子的平面形结构——sp2杂化轨道
乙烯分子是平面形结构。
H
H
CC
H
H
HCC=121.4
HCH=117.3 C C键键长=0.1339nm C—H键键长=0.1086nm
乙烯分子中碳原子进行sp2杂化。
12
是炔烃的官能团。炔烃也形成一个同系列。烯烃的通式是
CnH2n-2。
CH CH CH C—CH3
CH3—C C—CH3
乙炔 丙炔 2-丁炔
在炔烃分子中,C C三键处于末端的,叫做末端炔烃;处于 中间的,叫做非末端炔烃。在末端炔烃分子中,C C 三键上
的氢叫做炔氢。
5
3-1 烯烃、炔烃的命名法
一、烯烃的命名法 (一)衍生命名法 以乙烯为母体,把其它烯烃看作是乙烯的烷基衍生物来命名。
CH3
H
CH3CH2
H
C
C
H
CH3
顺-2-戊烯
反-2-戊烯
20
本次课小结:
碳架异构 烯烃的异构现象 位置异构
顺反异构
衍生命名法 烯烃的命名法 系统命名法
顺-反命名法
炔烃的命名法
21
烯烃的结构——sp2杂化轨道、π键的形成 以及π键的特性。
作业 : P46. (4)、(6),2(3)、(4), 3(5)、(6),4(3)、(4),5(3)、
Cl
I
C=C
F
Br
(z)-1-氟-1-氯-2-溴-2-碘乙烯
F
CH3
C=C
Cl
炔烃

炔烃(CnH2n-2)
一、炔烃的分子结构 ( 以乙炔为例 )
碳的杂化:
杂化 2s 2p sp 2p
sp3
sp2
sp
H
C
C
H
sp杂化的碳原子含有较多的S成分 (50%),电负性较sp2、sp3强。
二、异构和命名 *异构 :
官能团异构、碳链异构、位置异构。
*命名:
原则与烯烃相同,但分子中同时含叁键和双键时:
1、结构(以 CH2=CH - CH=CH2 为例)
H H
———
C
C H
H
———
———
C
C
H H
H H
———
形成大π键 ↓ π 电子离域 ↓
H H
0.135 C CH
0.135 CH C 0.148
键长趋于平均化
↓ 共轭体系
2、共轭效应
在1,3-丁二烯中四个p轨道相邻且平行,
互相交盖,π电子不再局限于两个碳原子之 间运动,而离域到整个体系,使键长平均化, 内能降低,这样产生的效应叫
碳相连的氢容易给出而具有酸性。
1、金属炔化物的生成
CH CH + Ag(NH3)2NO3 AgC CAg↓
CHBiblioteka CH +Cu(NH3)2 Cl
CuC
CCu ↓
Na CH CH NH3(l) CH CNa
Na NaC
190~220℃
CNa
注意:
H R R C C C C C C H H R AgC RC CAg CAg
CO2 + H2O
RC
CH
RCOOH + CO2 + H2O
炔烃的物理性质,化学 性质

4、乙炔
(1)乙炔的分子结构:
电子式:
H C
● ×
●● ●● ●●
C H
● ×
结构式: H—C≡C—H 结构简式: CH≡CH 或 HC≡CH 空间结构: 直线型,键角1800
PS:乙炔结构
1、C≡C的键能和键长并不是C-C的三倍,也 不是C=C和C—C之和。说明叁键中有二个键不 稳定,容易断裂,有一个键较稳定。
原 油 的 分 馏 及 裂 化 的 产 品 和 用 途
石油炼制 的方法
分馏
裂化
裂解
在一定条件下, 利用各成分沸点 在高温下,把 的不同,用蒸发和 把相对分子质 石油分馏产品 量大、沸点高 冷凝的方法把石 中长链烃断裂 原理 油分成不同沸点 的烃断裂为相 为短链气态小 范围的分馏产物 对分子质量小、 分子烃。 沸点较低的烃。 化学变化 物理变化 化学变化 变化 重油 原油 石油分馏产品 主要原料 提高轻质油, 制得由短链气 得到各种不同 特别是汽油的 态不饱和烃组 目的 沸点范围的烃。 产量和质量 成得裂解气 乙烯、丙烯、 石油气,汽油,煤油, 主要产品 柴油,润滑油,重油等 汽油 1,3-丁二烯等
5、描述CH3—CH = CH—C≡C—CF3分子结构的下列 叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
习题1. 鉴别甲烷、乙烯、乙炔三种气体可采用 的方法是:
A. 通入溴水中,观察溴水是否褪色。 B. 通入酸化的高锰酸钾溶液中,观察颜色是否 变化。 C. 点燃,检验燃烧产物。 D. 点燃,观察火焰明亮程度及产生黑烟量的多 少。
第四章 炔烃和二烯烃

4.1 炔烃
二、炔烃的命名 1. 衍生物命名法
衍生物命名法只适用于简单的炔烃。以乙炔为母体,将其它的炔 烃看作乙炔的衍生物。
例如:
4.1 炔烃
2. 系统命名法
与烯烃的命名类似 ① 要选择含有 C≡C 的最长碳链为主链; ② 编号从最距离叁键最近的一端开始,并用阿位伯数字表示叁键的 位置。例:
837KJ/mol 0.120nm
611KJ/mol 0.134nm 0.108nm
( 3x347=1041)
347KJ/mol
0.154nm 0.110nm
H C C H H2C CH H
H3C C H2 H
原因: ① -C≡C-中有1个σ和2个π键; ② sp 杂化轨道中的 s 成份多。(s 电子的特点就是离核近,即 s 电子
CNa CNa + 2CH3I
CH3C CC2H5 + NaBr
CH3C CCH3 + 2NaI
炔化物作为亲核试剂,也可以与醛酮 发生亲核加成反应,得到 羟基炔化合物:
4.1 炔烃
(3) 过渡金属炔化物的生成及炔烃的鉴定
CH CH + 2Ag(NH3)2NO3 CH CH + 2Cu(NH3)2Cl
4.1 炔烃
③分子中同时含有双键和参键时,先叫烯后叫炔,编号要使双键和
参键的位次和最小。
1 2 3 45
CH C-CH=CHCH3
3-戊烯-1-炔
6 54 3 2 1
CH C-CH=C-CH=CH2
3-乙基-1,3-己二烯-5-炔
CH2CH3
④若双键、叁键处于相同的位次供选择时,优先给双键以最低编号。
4.1 炔烃
第五章 炔烃和二烯烃

超共轭
38
+
CH3CHCH3
6 (σ- p)
+
CH3CCH3
+
CH3
9 (σ- p)
39
碳正离子稳定性
H
HH C H
H
H C C+ > H C
H
H
C+ > H C
HH C H
HH C H
H
H
H
C+ > H C+
H
H
H
H
C-Hσ键:9
6
3
0
自由基稳定性
CH3
H
H
H
> H3C C
H3C C
> H3C C > H C
H
Br
Br Br2 H
Br Br
H
H
Br Br
分子中同时存在双键和三键时,加成首先在双键上进行。
CH3 C C CH CH2 Br2 (1mol)
CH3 C C CH CH2 Br Br
主要原因:炔烃的电子云是圆筒状,高度离域,更加稳定。
炔烃可使溴的四氯化碳溶液褪色,此反应也可作 为炔烃的鉴定试验,但褪色速率比烯烃慢。
与高锰酸钾反应 --- 不饱和键断裂
HC R1C
CH KMnO4
H+
CR2 KMnO4
H+
CO2 R1COOH
R2COOH
产物为二氧化碳和羧酸,无酮生成。该反应能 用于炔烃的鉴定。
17
(四)亲核加成( 烯烃不发生此反应 )
这类试剂的活性中心是带负电荷部分或电子云密度较大的部位,因此进 攻试剂具有亲核性,称亲核试剂。由亲核试剂引起的加成反应称亲核加 成反应。
第4章炔烃
HCl
CuCl NH4Cl HCl
CH2 CH C CH2 Cl
2-氯-1,3-丁二烯
16
三聚 四聚
3 CH CH Ni(CO)2 [Ph3P]2 苯
4 CH
CH
50
C
Ni(CO)2 ,1.5~2.0MPa
环己四烯
生成聚乙炔
催化剂
nCH CH
—CH=CH— n
聚乙炔
17
三、氧化
与烯烃相似,炔烃也可被氧化剂氧化,往往可以使叁键断裂, 最后得到完全氧化的产物——羧酸或二氧化碳。例如:
3CH CH + 10KMnO4 + 2H2O
6CO2+ 10KOH + 10MnO2
R—C
C—R' KMnO4
过量
R—COOH + R'—COOH
RCCR’
KMnO4(冷,稀,H2O,PH7-5)
OO RC CR
KMnO4(H2O,过量)
RCOOH + R’COOH
(1) O3 (2) H2O, Zn
炔烃的物理性质和烷烃、烯烃相似。低级的炔烃在常温常 压下是气体,但沸点比相同原子数的烯烃略高些。随着碳原子 数的增多,它们的沸点也升高。
炔烃不溶于水,但易溶于极性小的有机溶剂,如石油醚、 苯、乙醚、四氯化碳等。
纯的乙炔是无色、无臭味的气体。 液态乙炔受到震动会发生爆炸,所以在乙炔钢瓶中既要填 入多孔性物质,如硅藻土、石棉等,又要加入丙酮作为溶剂, 这样储存、运输、使用可以避免危险。 乙炔与空气组成的爆炸气体的组成范围比其他烃类要大的 多。在生产、使用时必须注意。
RCOOH + R’COOH
18
乙炔的结构和性质
(n≥2)
分子里碳原子数目相同的炔烃和二烯烃互为同分异构体。
3.物理性质
沸点随碳原子数的增加而升高。
4.化学性 质 与乙炔相似,能发生加成反应、氧化反应等。 5.炔烃的同分异构体 6.炔烃的命名
碳链异构 位置异构 类别异构
CO2 + H2O
乙 炔
加成反应
KMnO4溶液
褪色
Br2
Br2
(Cl2)
CHBr=CHBr CHBr2-CHBr2 (Cl )
2
H2 CH2=CH2 H2 CH3-CH3 催化剂, 催化剂, HCl(HBr)
催化剂,
CH2=CHCl
炔烃
1.概念
分子里含有碳碳三键的不饱和链烃叫做炔烃。
2.通式
CnH2n-2
三、乙炔的化学性质:
1、氧化反应:
(1)燃烧: 2C2H2 + 5O2
点燃
4CO2 + 2H2O
火焰明亮,并伴有浓烟。
(2)乙炔能使酸性KMnO4溶液褪色。
2.加成反应
与卤素反应
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷 1mol碳碳叁键最多需要2mol加成试剂
与HX等的反应
CH≡CH+HCl
乙烷
乙烯
乙炔
一、乙炔的结构
分子式: C2H2 结构式: H—C≡C—H 结构简式: CH≡CH 或 HC≡CH 空间结构: 直线型
乙炔结构小结
1、 的键能和键长并不是C-C的三倍,也不是 C=C和C—C之和。说明叁键中有二个键不稳定,容 易断裂,有一个键较稳定。 2、含有叁键结构的相邻四原子在同一直线上。 3、链烃分子里含有碳碳叁键的不饱和烃称为炔烃。
2.3.1炔烃

与氯化亚铜的液氨溶液作用-- 炔化亚铜
CHCH + 2Cu(NH3)2Cl CuCCCu +2NH4Cl + 2NH3 乙炔亚铜(红色沉淀) RCCH + Cu(NH3)2Cl RCCCu + NH4NO3 + NH3
(红色沉淀)
注1—炔化物和无机酸作用可分解为原来的炔烃 .在混合炔烃中分 离末端炔烃. 注2—重金属炔化物在干燥状态下受热或撞击易爆炸 ,对不再利用 的重金属炔化物应加酸处理.
5
(3) 乙炔的键
C : 2s22p2 2s12px12py12pz1 乙炔的每个碳原子还各有两个相互 垂直的未参加杂化的p轨道, 不同碳 原子的p轨道又是相互平行的. 一个碳原子的两个p轨道和另一个碳原子对应的两 个p轨道,在侧面交盖形成两个碳碳键.
6
2.3.1.2 炔烃的物理性质
2.3.1 炔烃
定义:分子中含碳碳叁键的烃—炔烃,它的通式: CnH2n-2 官能团为: -CC-
2.3.1.1 炔烃的命名
(1)异构体——从丁炔开始有异构体. 同烯烃一样,由于碳链不同和叁键位置不同所引起的.由于在 碳链分支的地方不可能有叁键的存在 ,所以炔烃的异构体比同 碳原子数的烯烃要少. 由于叁键碳上只可能连有一个取代基 , 因此炔烃不存在顺反 异构现象.
8
(1) 生成炔化钠和烷基化反应
与金属钠作用 CHCH Na CHCNa Na NaCCNa 与氨基钠作用 RCCH + NaNH2 液氨 RCCNa + NH3 烷基化反应 CHCNa + C2H5Br — 得到碳链增长的炔烃 ---- 炔化合物是重要的有机合成中间体.
9
液氨
20
炔烃

炔烃炔烃是分子中含有碳碳叁键的烃,炔烃比相应的烯烃少两个氢原子,通式为C n H2n-2。
1 炔烃的异构和命名乙炔是最简单的炔烃,分子式为C2H2,构造式为HC ≡ CH。
根据杂化轨道理论,乙炔分子中的碳原子以sp杂化方式参与成键,两个碳原子各以一条sp杂化轨道互相重叠形成一个碳碳σ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠,各形成一个碳氢σ键。
此外,两个碳原子还各有两个相互垂直的未杂化的2p轨道,其对称轴彼此平行,相互“肩并肩”重叠形成两个相互垂直的π键,从而构成了碳碳叁键。
两个π键电子云对称地分布在碳碳σ键周围,呈圆筒形。
乙炔分子中π键的形成及电子云分布其它炔烃中的叁键,也都是由一个σ键和两个π键组成的。
现代物理方法证明,乙炔分子中所有原子都在一条直线上,碳碳叁键的键长为0.12 nm,比碳碳双键的键长短,这是由于两个碳原子之间的电子云密度较大,使两个碳原子较之乙烯更为靠近。
但叁键的键能只有836.8 kJ•mol -1,比三个σ键的键能和(345.6 kJ•mol -1 × 3)要小,这主要是因为p轨道是侧面重叠,重叠程度较小所致。
乙炔分子的立体模型。
由于叁键的几何形状为直线形,叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象,炔烃异构体的数目比含相同碳原子数目的烯烃少。
Kekule 模型 Stuart模型乙炔的立体模型示意图2 炔烃的结构炔烃的系统命名法与烯烃相同,只是将“烯”字改为“炔”字。
例如:CH3C≡CH CH3C≡CCH3(CH3)2CHC≡CH丙炔 2-丁炔 3-甲基-1-丁炔分子中同时含有双键和叁键的化合物,称为烯炔类化合物。
命名时,选择包括双键和叁键均在内的碳链为主链,编号时应遵循最低系列原则,书写时先烯后炔。
CH3-CH=CH-C≡CH CH2=CH-CH=CH-C≡CH 3-戊烯-1-炔 1,3-己二烯-5-炔双键和叁键处在相同的位次时,应使双键的编号最小。
《烯烃炔烃》炔烃的结构与性质

《烯烃炔烃》炔烃的结构与性质在有机化学的世界里,烯烃和炔烃是两类非常重要的不饱和烃。
今天,咱们就专门来聊聊炔烃的结构与性质,一起揭开它神秘的面纱。
先来说说炔烃的结构。
炔烃的分子中含有碳碳三键(C≡C),这是它最显著的结构特征。
以最简单的炔烃——乙炔(C₂H₂)为例,两个碳原子之间通过一个三键相连,每个碳原子还分别与一个氢原子结合。
碳碳三键是由一个σ 键和两个π 键组成的。
这σ 键比较“坚强”,键能较大,而两个π 键则相对“脆弱”一些。
由于三键的存在,炔烃分子中的碳原子采取 sp 杂化。
这种杂化方式使得碳原子的两个 sp 杂化轨道在同一直线上,分别与氢原子或其他原子形成σ 键,而未参与杂化的两个p 轨道则相互垂直,与另一个碳原子的两个p 轨道“肩并肩”重叠,形成两个π 键。
接下来看看炔烃的物理性质。
通常情况下,随着碳原子数的增加,炔烃的沸点和熔点逐渐升高。
不过,总体来说,炔烃的沸点和熔点比相同碳原子数的烷烃和烯烃要低一些。
在常温常压下,含四个碳原子以下的炔烃大多是气态,从五个碳原子开始逐渐变为液态和固态。
再来说说炔烃的化学性质。
由于碳碳三键的存在,炔烃具有一些独特的化学反应。
首先是加成反应。
这就像是炔烃的“好客”特性,它很愿意与其他物质结合。
比如,与氢气发生加成反应,可以生成相应的烯烃或烷烃。
如果是和卤素(如氯气、溴气)加成,会分步进行,先加成一个卤素原子,形成二卤代烯烃,然后再继续加成,得到四卤代烷烃。
和卤化氢的加成也类似,遵循马氏规则。
其次是氧化反应。
炔烃在一定条件下可以被氧化,比如在高锰酸钾等强氧化剂的作用下。
不过,炔烃的氧化反应比烯烃要复杂一些,产物会因反应条件的不同而有所差异。
然后是聚合反应。
就像小伙伴们手拉手组成一个团队一样,炔烃分子也可以相互连接起来,形成高分子化合物。
比如,乙炔在特定条件下可以聚合成聚乙炔。
还有金属炔化物的生成。
这是炔烃的一个有趣的性质。
比如,乙炔与银氨溶液或亚铜氨溶液反应,可以生成白色的乙炔银沉淀或红棕色的乙炔亚铜沉淀。
第4章 炔烃
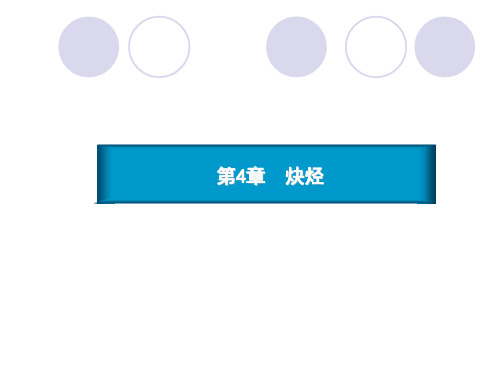
用化学方法区别下列化合物:
(1) 2-甲基丁烷 3-甲基-1-丁炔
3-甲基-1-丁烯 (2) 1-戊炔 2-戊炔
Ag(NH3)2
Br2/CCl4
无变化 褪色 Ag(NH3)2 褪色 白色沉淀 无变化
白色沉淀
无变化
4.1
4.1.1 炔烃的异构和命名
炔 烃
分子中含有碳碳叁键的不饱和烃叫做炔烃。
CH3 C CH
丙炔
CH3 CH2 C CH
1-丁 炔
炔烃的通式:炔烃的官能团是碳碳叁键。炔烃比相应的烯 烃少两个氢原子,炔烃的通式为CnH2n-2。
CH3 CH2 CH2 C CH CH3 CH2 C C 1-戊 炔
CH3 2-戊 炔 3-甲 基 -1-丁 炔
CH3 CH C CH CH3
例如:
4.1.4 炔烃的化学性质
炔烃结构对化学性质的影响: 炔的官能团是CC三键,它的化学性质就主要表现在三键上。 由于CC三键是由一个键和两个键组成。根据三键的特点, 键侧面重叠,键能小,电子云外露,易受试剂的进攻。因此,炔 烃的性质和烯烃相似,也是容易进行键的加成、氧化、聚合反 应。 此外,由于SP杂化的C电负性较大,拉电子能力较强,使得C- H键极性增加,炔氢的活性增强(也就是酸性增强)。
4. 4炔烃的化学性质
炔烃结构对化学性质的影响: 炔的官能团是CC三键,它的化学性质就主要表现在三键上。 由于CC三键是由一个键和两个键组成。根据三键的特点, 键侧面重叠,键能小,电子云外露,易受试剂的进攻。因此,炔 烃的性质和烯烃相似,也是容易进行键的加成、氧化、聚合反 应。 此外,由于SP杂化的C电负性较大,拉电子能力较强,使得C- H键极性增加,炔氢的活性增强(也就是酸性增强)。
炔烃的命名和物理性质

有机化学第5章炔烃和二烯烃5.1 炔烃结构及命名炔烃的物理性质分子中含有碳-碳叁键的烃叫做炔烃(alkyne )分子中含有两个碳-碳双键的烃叫作二烯烃(alkadiene )炔烃和二烯烃具有相同的通式C n H 2n-2,但有不同的官能团,因此具有不同的性质。
炔烃和二烯烃也是不饱和烃,它们比相应的烷烃少四个氢,其不饱和度为2。
炔烃和二烯烃概述HC CHH 2C CH CH CH 25.1 炔烃的结构:sp杂化轨道一个s轨道上的电子和1个处于p轨道上的电子杂化的结果,杂化可以使能态降低低炔烃的结构:sp 杂化轨道乙炔分子的σ键:决定了炔烃为直线型分布HC CH代表性的分子:乙炔分子式:C 2H 2两个碳各以一个sp 轨道互相重叠,形成一个C-C σ键。
每个碳又各以一个sp 轨道分别与氢的1s 轨道重叠,形成两个C-H σ键。
分子中四个原子处于一乙炔分子中的σ键Each carbon isconnected to ahydrogen by aσbond. The twocarbons are connectedto each other by aσbond and two πbonds.乙炔分子的σ键用电子衍射光谱测得乙炔为一直线分子。
两个碳剩下的两个p 轨道的轴除互相垂直外,还与sp杂化轨道的对称轴互相垂直。
因此四个p轨道可在各自的侧面平行重叠,形成两个互相垂直的π键。
两个碳剩下的两个p 轨道的轴除互相垂直外,还与sp杂化轨道的对称轴互相垂直。
因此四个p轨道可在各自的侧面平行重叠,形成两个互相垂直的π键。
乙炔的π电子云π电子云围绕连核的直线,形成一个中空的圆柱体。
炔烃碳碳三键的组成乙炔的碳碳叁键是由一个较强的σ键及两个较弱的π键组成。
叁键的键能为837KJ/mol,比碳碳双键(612.5KJ/mol)及碳碳单键(361.0 KJ/mol)的键能大。
这大致符合361.0(σ)+251.5(π)+251.5(π)=864 KJ/mol的关系。
炔 烃

• 用适线法估计频率曲线的统计参数分为初步估
计参数、用适线法调整初估值以及对比分析三
个步骤。
上一页 下一页 返回
学习情境一 大中桥设计流量的推算
• 矩法是一种简单的经典参数估计方法,它无需 事先选定频率曲线线型,因而是洪水频率分析 中 由广 此泛求使得用的Cs 的频一率种 曲方 线法 总。 是由 系矩 数法 偏估 小计,的其参中数尤及以 偏小更为明显。
上一页 下一页 返回
4.3 炔烃的化学性质
• 3. 加卤化氢 • 在汞盐的催化作用下,乙炔与氯化氢在气相发生加成反应,可以停留
在与一分子氯化氢的加成产物阶段,生成的氯乙烯是合成氯乙烯塑料 的单体。化学反应式如下:
• 炔烃与卤化氢的加成,加碘化氢容易进行,加氯化氢则难进行,一般 要在催化剂存在下才能进行。不对称炔烃加卤化氢时,服从马氏规则。 例如:
• (1)当调查的历史洪水位处于比降均一、河道顺
学习情境一 大中桥设计流量的推算
• 二、频率曲线参数估计
• 在洪水频率计算中,我国规范统一规定采用适 线法。适线法有两种:一种是经验适线法(或称目 估适线法),另一种是优化适线法。
• 经验适线法是在经验频率点据和频率曲线线型 确定之后,通过调整参数使曲线与经验频率点 据配合得最好,此时的参数就是所求的曲线线 型的参数,从而可以计算设计洪水值。
• 若分子中既含有双键又含有三键时,则应选择含有双键和三键的最长 碳链为主链,并将其命名为烯炔(烯在前、炔在后)。编号时,应使烯、 炔所在位次的和为最小。例如:
上一页 下一页 返回
4.1 炔烃的结构和命名
• 但是,当双键和三键处在相同的位次时,即烯、炔两碳原子编号之和 相等时,则从靠近双键一端开始编号。例如:
乙炔的分子结构和化学性质

乙炔的分子结构和化学性质乙炔(乙炔烷)是一种有机化合物,化学式为C2H2、它是最简单的炔烃,也是最简单的不饱和烃之一、乙炔具有线性分子结构,分子量为26.04 g/mol。
它由两个碳原子和两个氢原子组成,其中碳原子通过三键连接在一起,氢原子分别连接在碳原子上。
乙炔的分子结构具有线性排列,这种形式使得碳原子具有sp杂化,即一个2s轨道和两个2p轨道混合形成两个sp杂化轨道。
这两个碳原子的sp杂化轨道与氢原子的1s轨道重叠,形成两个碳-氢σ键。
碳原子之间的三键由两个2p轨道的相互重叠形成,这称为π键。
这种碳-碳π键是乙炔结构中最重要的键。
乙炔具有一系列特殊的化学性质。
首先,由于乙炔分子中含有两个高能的碳-碳π键,因此它具有较高的反应活性。
其次,乙炔由于具有高度线性的结构,导致它的π电子密度很高,也使得乙炔变得不稳定。
这种不稳定性使乙炔易于与其他化合物反应,尤其是与电子亲和性较大的化合物。
乙炔与水的直接反应是一个典型的例子。
当乙炔与水反应时,会发生加成反应,生成乙醇。
该反应需要使用催化剂,常用的催化剂是氯铜或银碰撞。
乙炔可以通过加氢反应与氢气反应生成乙烯。
这是一种重要的工业反应,可应用于裂解乙炔气和制造乙烯的工艺中。
乙炔还可以通过卤酸的加成反应来生成卤代乙烯,例如溴化反应可以产生1,2-二溴乙烷。
此外,乙炔还可以参与氧化反应。
例如,乙炔可以在空气中燃烧产生水和二氧化碳。
这是乙炔应用在气焊和切割中的重要反应。
乙炔也可以与酸性氧化剂反应,例如与硝酸反应可生成乙酸和一氧化氮。
乙炔还可以发生聚合反应。
在适当的条件下,乙炔可以与金属催化剂反应发生聚合反应,形成聚乙炔(亦称为聚乙炔烯,是线性结构的聚合物)。
聚乙炔是一种具有导电性的聚合物,具有良好的导电和导热性能,因此具有广泛的应用前景。
总之,乙炔具有线性分子结构和高反应活性,可以与许多化合物发生各种反应。
它的化学性质使得它在工业和实验室中具有广泛的应用。
乙炔分子的空间结构

乙炔分子的空间结构乙炔的空间构型是直线构型。
乙炔(CH≡CH)结构模型中,分子中的碳原子采取sp杂化,价电子对空间构型为直线型,分子空间构型为直线型,4个原子共直线,4个原子共面。
当乙炔分子中的氢原子被其他原子取代时,代替该氢原子的原子一定在乙炔分子所在的直线上。
乙炔是一种有机化合物,化学式为C2H2。
乙炔最简单的炔烃。
易燃气体。
在液态和固态下或在气态和一定压力下有猛烈爆炸的危险,受热、震动、电火花等因素都可以引发爆炸,因此不能在加压液化后贮存或运输。
难溶于水,易溶于丙酮,在15℃和总压力为15大气压时,在丙酮中的溶解度为237克/升,溶液是稳定的。
因此,工业上是在装满石棉等多孔物质的钢桶或钢罐中,使多孔物质吸收丙酮后将乙炔压入,以便贮存和运输。
乙炔的包装法通常是溶解在溶剂及多孔物中,装入钢瓶内。
储存于阴凉、通风的易燃气体专用库房。
远离火种、热源。
库温不宜超过30℃。
应与氧化剂、酸类、卤素分开存放,切忌混储。
采用防爆型照明、通风设施。
禁止使用易产生火花的机械设备和工具。
储区应备有泄漏应急处理设备。
小心避火。
用于制取乙醛、醋酸、丙酮、季戊四醇、丙炔醇、1,4-丁炔二醇、1,4-丁二醇、丁二烯、异戊二烯、氯乙烯、偏氯乙烯、三氯乙烯、四氯乙烯、醋酸乙烯、甲基苯乙烯、乙烯基乙炔、乙烯基乙醚、丙烯酸及其酯类等。
用于金属焊接或切割,也用于氧炔焊割。
并用于夜航标志灯和一般灯,大量用作石油化工原料,制造聚氯乙烯、氯丁橡胶、乙酸、乙酸乙烯酯等。
是有机合成的重要原料之一,亦是合成橡胶,合成纤维和塑料的单体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章 烯烃 炔烃
脂肪烃分子中含有一个 C C 双键的,叫做烯烃。 C C 双 键是烯烃的官能团,烯烃也形成一个同系列,烯烃的通式是 CnH2n。
异构体
CH2 CH2 CH3—CH CH2 CH3—CH2—CH CH2 CH3—C CH2
CH3 CH3—CH CH—CH3
乙烯 丙烯 1-丁烯 异丁烯
3-甲基-6-乙基-4-辛烯
(双键居中,两种编号相同,甲基占较小位次)
CH3(CH2)15CH=CH2 1-十八碳烯
二、炔烃的命名法
CH CH
CH3 CH C CH CH3
衍生命名法 异丙基乙炔
系统命名法 乙炔
3-甲基-1-丁炔
CH3 CH2 CH C C CH3 甲基仲丁基乙炔
CH3
4-甲基-2-己炔
2-丁烯
碳架异构 位置异构
3
C C双键位于末端的烯烃通常叫做末端烯烃或α -烯烃。
从烯烃分子中去掉一个氢原子后所剩下的基团叫做烯基。 如:
CH2 CH CH3 CH CH CH3 C CH2
乙烯基 丙烯基
异丙烯基
CH2 CH CH2
烯丙基
4
脂肪烃分子中含有一个 C C三键的,叫做炔烃。C C 三键
2s 2p
激发
2s 2p
sp2杂化
sp2 2p
13
三个sp2杂化轨道处在同一平面内,互成120˚角。
C
C
C原子的三个sp2轨道在空间 的分布
C原子的未杂化的P轨道
14
其中两个碳原子的未杂化的p都垂直于乙烯分子所在的平面, 互相平行,它们进行另一种方式的重叠——“肩并肩”的重 叠——π重叠,由此形成的共价键叫做π键。
其他的同烷烃的命名原则,如 3-甲基-2-乙基-1-丁烯
7
7
6
54
3
21
CH3 CH2 CH CH2 CH C CH2
CH3
CH3 CH2 CH3
3,5-二甲基-2-乙基-1-庚烯 (选择含有双键的最长碳链为母体)
1 2 3 4 5 67 8
CH3CH2CHCH CHCHCH2CH3
CH3
C2H5
9
分子中同时含有双键和叁键叫烯炔,命名时,要使两者编号尽 可能小,如有选择时,使双键编号小。例:
CH3 CH CH C CH
3-戊烯-1-炔
CH2 CH CH CH2 CH2 C CH CH3
3-甲基-1-庚烯-6-炔
10
如果命名的是环烯烃和环炔烃,则把1,2位留给双键和三键碳原子。 例如:
CH3
16
也可从与轨道对应的电子云的重叠来说明π键的形成 CC π电子云
π电子云有一个对称面,在这个平面内π电子云密度为零
17
C=C和C-C的区别: ⑴ C=C的键长比C-C键短。 两个碳原子之间增加了一个π键,也就增加了原子核对 电子的吸引力,使碳原子间靠得很近。C=C键长 0.134nm, 而C-C键长0.154nm。 ⑵ C=C双键中的两原子之间不能绕σ键轴自由旋转。 由于旋转时,两个p轨道重叠减程度小甚至为零,π键 便被破坏。
CH3
3-甲基环戊烯
CH(CH3)2
1-甲基-3-异丙基环己烯
CH3
5-甲基环辛炔
3-2 乙烯分子的平面形结构——sp2杂化轨道
乙烯分子是平面形结构。
H
H
CC
H
H
HCC=121.4
HCH=117.3 C C键键长=0.1339nm C—H键键长=0.1086nm
乙烯分子中碳原子进行sp2杂化。
12
11
本章教学要求: 1、掌握烯烃、炔烃的同分异构现象和命名方法。 2、掌握乙烯的结构和sp2杂化、π键的形成及C=C双键的特 征,掌握乙炔的结构和sp杂化及C三C叁键的特征; 3、认识烯烃、炔烃的物理性质。 4、掌握烯烃、炔烃的化学性质。 5、认识并理解亲电加成反应的机理,掌握Markovnikov规则。 并能够运用烷基的电子效应(诱导效应)和碳正离子的稳定性来 解释Markovnikov规则。 6、掌握不对称烯烃与溴化氢在过氧化物存在时所表现的过氧 化物效应现象。 7、掌握制取烯烃、炔烃的方法和原理。 8、能应用不饱和烃、小环烷烃的化学性质于化学鉴别中。
第三章 烯烃 炔烃
本章教学内容 1、烯烃、炔烃的同分异构(碳架异构、位置异构和顺反异构) 和命名法; 2、乙烯的结构和sp2杂化及π键、C=C双键的特征,乙炔的 结构和sp杂化及C三C叁键特征; 3、烯烃、炔烃的物理性质; 4、烯烃、炔烃的化学性质——加成反应、聚合反应、氧化反 应、α-氢原子的取代反应;炔氢的反应; 5、原子或基团的电子效应和立体效应,C=C双键亲电加成反 应机理, Markovnikov规则及其解释,过氧化物效应; 6、烯烃、炔烃的制法
如:CH3 CH2 CH CH CH2 CH3
仲丁基乙烯
CH3 CH CH CH3
对称二甲基乙烯
CH3 C CH2 CH3
(二)系统命名法
不对称二甲基乙烯
1.选择一个含双键的最长的碳链为主链。
6Байду номын сангаас
2.从最靠近双键的一端起,把主链碳原子依次编号 2,4-二甲基-2-己烯
3.双键的位次必须标明出来,只写双键两个碳原子中位次较小 的一个,放在烯烃名称的前面。
15
为了使两个p轨道“肩并肩”地达到最大程度重叠,形成的π 键最牢固,乙烯分子中的六个原子必须在同一个平面内。
H
C
H
H
C
H
π轨道
σ键与π键的区别:(1)σ 键较强, π键较弱, π键较易断 裂。
(2) π电子不像σ 电子那样集中在两个 C原子核之间,两个C原子核对π电子的“束缚力”较小,在 外界的影响下, π电子比较容易被极化,导致π键断裂发生 加成反应。
18
3-3 烯烃的顺反异构
一、顺反异构
由于乙烯分子是平面的, C=C双键不能饶键轴自由旋转,使 构造为abC=Cab这类分子中,连接在双键碳原子上的原子或 基团在空间的排列有两种不同的情况,即有两种不同的构型。
构型:分子中原子在空间的排列叫做构型。
a
b
C
C
a
b
a
b
C
C
b
a
顺式
反式
对应于这两种不同的构型就是两种不同的化合物,它们是两
是炔烃的官能团。炔烃也形成一个同系列。烯烃的通式是
CnH2n-2。
CH CH CH C—CH3
CH3—C C—CH3
乙炔 丙炔 2-丁炔
在炔烃分子中,C C三键处于末端的,叫做末端炔烃;处于 中间的,叫做非末端炔烃。在末端炔烃分子中,C C 三键上
的氢叫做炔氢。
5
3-1 烯烃、炔烃的命名法
一、烯烃的命名法 (一)衍生命名法 以乙烯为母体,把其它烯烃看作是乙烯的烷基衍生物来命名。
