医疗机构抗肿瘤药物分级管理目录备案表2021最新
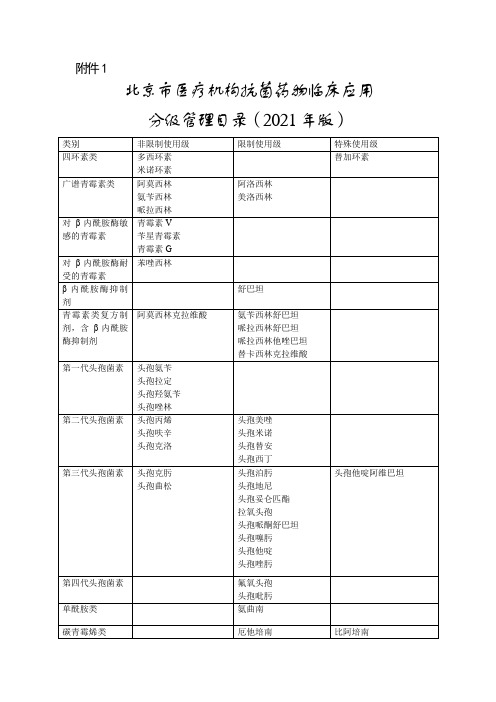
北京市医疗机构抗菌药物临床应用分级管理目录(2021年版)
米卡芬净
附件2
医疗机构抗菌药物分级管理目录外药品备案表
医疗机构名称
抗菌药物通用名称
剂型
规格
单位价格
生产企业
分级管理级别
申请使用该品种的原因及循证医学依据(可另附页)
医疗机构药事管理与药物治疗学委员会(组)意见(可另附页)
主任委员签字:
日期:
医疗机构法人代表意见:
签字(盖章):
日期:
上报单位联系人:联系电话:
第四代头孢菌素
氟氧头孢
头孢吡肟
单酰胺类
氨曲南
碳青霉烯类
厄他培南
比阿培南
美罗培南
亚胺培南西司他丁
其他头孢菌素类和青霉烯
法罗培南(口服)
磺胺类及甲氧苄啶
复方磺胺甲噁唑
联磺甲氧苄啶
大环内酯类
阿奇霉素
红霉素
琥乙红霉素
环酯红霉素
交沙霉素
克拉霉素
罗红霉素
林可胺类
克林霉素(口服)
克林霉素(注射)
林可霉素
氨基糖苷类
阿莫西林克拉维酸
氨苄西林舒巴坦
哌拉西林舒巴坦
哌拉西林他唑巴坦
替卡西林克拉维酸
第一代头孢菌素
头孢氨苄
头孢拉定
头孢羟氨苄
头孢唑林
第二代头孢菌素
头孢丙烯
头孢呋辛
头孢克洛
头孢美唑
头孢米诺
头孢替安
头孢西丁
第三代头孢菌素
头孢克肟
头孢曲松
头孢泊肟
头孢地尼
头孢妥仑匹酯
拉氧头孢
头孢哌酮舒巴坦
头孢噻肟
头孢他啶
头孢唑肟
头孢他啶阿维巴坦
替硝唑
吗啉硝唑
医疗机构抗菌药物分级管理目录备案表1

2
颗粒剂
0.125g
非限制
片剂
0.25g
非限制
头孢呋辛
1
注射剂
1.5g
非限制
4
林可酰胺类
克林霉素
1
注射剂
0.3g
非限制
5
喹诺酮类
左氧氟沙星
2
注射剂
0.2g
非限制
片剂
0.1g
非限制
6
硝基咪唑衍生物
替硝唑
2
注射剂
0.8g
非限制
甲硝唑
胶囊剂
0.2g
非限制
主管科室意见
医疗机构意见(公章)
卫生计生行政部门审核意见
XX省医疗机构抗菌药物分级管理目录备案表
品种数
类别
通用名
品规数
剂型
规格
使用级别
1
大环内酯类
阿奇霉素
2
片剂
0.25g
非限制
颗粒剂
0.1g
非限制
罗红霉素
非限制
2
广谱青霉素类
阿莫西林
2
片剂
0.25g
非限制
颗粒剂
0.25g
非限制
美洛西林
1
注射剂
1.0g
非限制
3
β-内酰胺酶抑制剂
新型抗肿瘤药的药物警戒体系概述

新型抗肿瘤药的药物警戒体系概述作者:洪英子胡骏来源:《上海医药》2022年第25期通信作者:胡駿,药学博士,高级工程师,目前担任上海市药品和医疗器械不良反应监测中心负责人。
多年来致力于医药政策与行业分析及药物警戒等领域研究。
在药品、器械和化妆品的政策法规、行政执法和认证检查领域有非常资深的从业背景和实践经验。
担任中国药品监管研究会药品监管法规和政策专委会委员,《医疗器械蓝皮书》编委,《中国药房》、《中国食品药品监管》、《上海医药》等杂志的审稿专家。
近年承担了部级、局级等行业发展、政策制定、行政监管等课题近20项,参与了多部药械化领域法律法规和部门规章等的立法和修法研究。
摘要:随着审评审批制度的优化,一大批新型抗肿瘤药通过附条件批准程序等“快速通道”拿到批准文件,压缩了上市前大样本量的安全性数据暴露,上市后药物警戒体系的建立能确保药物安全性信息得以不断的补充完善,风险管理持续的动态跟进,真正做到把患者的风险获益最优化。
本文以文献综述的形式,介绍了国内外新型抗肿瘤药的药物警戒体系及工作现状,提出了针对品种特性需要关注的问题及未来展望。
关键词:抗肿瘤药药物警戒持有人医疗机构监管中图分类号:R951文献标志码:A文章编号:1006—1533(2022)S2—0116—05引用本文洪英子,胡骏.新型抗肿瘤药的药物警戒体系概述[J].上海医药,2022,43(S2):116—120.Pharmacovigilance system in novel anti-tumor drugsHONG Yingzi,HU Jun(Shanghai Center for Adverse Drug and Medical Device Reaction Monitoring,Shanghai 200040,China)ABSTRACT Due to the improvement of the review and approval procedure, a large number of novel anti-tumor drugs obtained the approval documents by "fast pass", which is a conditional approval process. Lack of a large amount of exposed clinical safety data, post-marketing pharmacovigilance is aI vital system to ensure the sustained improvement of drug safety information,and dynamic approaches to the risk management. Patients can finally benefit from this benefit-risk life-cycle management. Using a method of literature review, this article introduces the working experience of pharmacovigilance system in novel anti-tumor drugs in EMA, in FDA as well as in China. Besides,some issues are raised according to the drug characteristics and the future prospects are put forward.KEY WORDS anti-tumor drugs;pharmacovigilance;holder;healthcare;regulators恶性肿瘤已成为威胁人类生命安全的主要疾病之一,据统计,每年全球因恶性肿瘤死亡的人数达900万左右。
2021抗肿瘤药物临床应用管理办法解读(3月1号执行)

第二十一条 抗肿瘤药物临床应用知识培训内容应当包括: (一)《处方管理办法》《抗肿瘤药物临床应用管理办法(试行)》《医疗机构处方审核规范》《医院处方点评管理规范(试行)》等; (二)诊疗规范、临床诊疗指南、临床路径和药品说明书等; (三)有关临床用药指南、新型抗肿瘤药物临床应用指导原则; (四)肿瘤综合治疗的理念和知识; (五)抗肿瘤药物临床应用管理制度; (六)抗肿瘤药物的药理学特点与注意事项; (七)抗肿瘤药物不良反应及其处理相关知识; (八)肿瘤耐药发生机制及其对策等。 第二十二条 医疗机构应当加强对本机构医师处方权的授予、考核等管理,明确可以开具限制使用级和普通使用级抗肿瘤药物处方的医师应当满足的条件,包括医师的专业、职 称、培训及考核情况、技术水平和医疗质量等。 医师按照被授予的处方权开具相应级别的抗肿瘤药物。 第二十三条 医师应当根据组织或细胞学病理诊断结果,或特殊分子病理诊断结果,合理选用抗肿瘤药物。原则上,在病理确诊结果出具前,医师不得开具抗肿瘤药物进行治疗 。 国家卫生健康委发布的诊疗规范、临床诊疗指南、临床路径或药品说明书规定需进行基因靶点检测的靶向药物,使用前需经靶点基因检测,确认患者适用后方可开具。加强对肿 瘤细胞耐药发生机制及其对策的研究,针对不同耐药机制采取相应的应对策略,增加患者获益可能。 第二十四条 医疗机构应当遵循诊疗规范、临床诊疗指南、临床路径和药品说明书等,合理使用抗肿瘤药物。在尚无更好治疗手段等特殊情况下,应当制订相应管理制度、技术 规范,对药品说明书中未明确但具有循证医学证据的药品用法进行严格管理。 特殊情况下抗肿瘤药物使用采纳的循证医学证据,依次是其他国家或地区药品说明书中已注明的用法,国际权威学协会或组织发布的诊疗规范、临床诊疗指南,国家级学协会发 布的诊疗规范、临床诊疗指南和临床路径等。(与指导原则不同:提高要求,排除了专家共识、RCT研究和mate分析) 第二十五条 首次抗肿瘤药物治疗方案应当由肿瘤诊疗能力强的医疗机构或省级卫生健康行政部门按照相应标准和程序遴选的其他医疗机构制订并实施。鼓励由三级医疗机构 制 订并实施首次抗肿瘤药物治疗方案。 对于诊断明确、病情相对稳定的肿瘤患者,其他医疗机构可以执行上述医疗机构制订的治疗方案,进行肿瘤患者的常规治疗和长期管理。 相关遴选标准和程序由省级卫生健康行政部门制订并公布。
抗肿瘤药物临床应用管理制度

抗肿瘤药物临床应用管理制度一、目的为加强抗肿瘤药物临床应用管理,提高抗肿瘤药物临床应用水平,保障医疗质量和医疗安全,根据《抗肿瘤药物临床应用管理办法(试行)》、《新型抗肿瘤药物临床应用指导原则》,制定《抗肿瘤药物临床应用管理制度》。
二、参考文件1.《抗肿瘤药物临床应用管理办法(试行)》(国卫医函〔2020〕487号)2.《新型抗肿瘤药物临床应用指导原则(2022年版)》(国卫办医政函〔2022〕465号)3.《抗肿瘤药物临床合理应用管理指标(2021年版)》(国卫办医函〔2021〕336 号)三、名词定义抗肿瘤药物:是指通过细胞杀伤、免疫调控、内分泌调节等途径,在细胞、分子水平进行作用,达到抑制肿瘤生长或消除肿瘤的药物,一般包括化学治疗药物、分子靶向治疗药物、免疫治疗药物、内分泌治疗药物等。
四、内容(一)设立抗肿瘤药物管理工作组在医院药事管理与药物治疗学委员会下设立抗肿瘤药物管理工作组。
抗肿瘤药物管理工作组由医务、药学、临床科室、医学影像、病理、护理、检验、信息管理、质控等部门负责人或具有相关专业高级技术职务任职资格的人员组成,共同管理抗肿瘤药物临床应用。
抗肿瘤药物管理工作组主要职责是:1.贯彻执行抗肿瘤药物管理相关的法律、法规、规章,制订本机构抗肿瘤药物管理制度并组织实施。
2.审议本机构抗肿瘤药物分级管理目录,制订抗肿瘤药物临床应用相关技术性文件,并组织实施。
3.对本机构抗肿瘤药物临床应用情况进行监测,定期分析、评估、上报监测数据并发布相关信息,提出干预和改进措施。
4.对医务人员进行抗肿瘤药物管理相关法律、法规、规章制度和技术规范培训,组织对患者合理使用抗肿瘤药物的宣传教育。
(二)组建抗肿瘤药物临床应用多学科诊疗团队组建由肿瘤内科、肿瘤外科、放射治疗、病理学、临床药学、影像学、检验、护理等相关专业人员组成的多学科诊疗团队,为抗肿瘤药物临床应用管理提供专业技术支持,对临床科室抗肿瘤药物临床应用进行技术指导和咨询,落实抗肿瘤药物管理要求,保障合理用药,提高肿瘤综合管理水平。
2021年抗肿瘤药物临床应用管理办法(试行)政策解读

第二章 组织机构和职责
第十一条 医疗机构抗肿瘤药物管理组织的主要职责是:
(一)贯彻执行抗肿瘤药物管理相关的法律、法规、规章,制订本机构抗肿瘤药物管理制度并组织实施 ;
(二)审议本机构抗肿瘤药物分级管理目录,制订抗肿瘤药物临床应用相关技术性文件,并组织实施;
(三)对本机构抗肿瘤药物临床应用情况进行监测,定期分析、评估、上报监测数据并发布相关信息, 提出干预和改进措施;
第十五条 医疗机构应当严格执行《药品管理法》及其实施条例、《处方管理办法》《医疗机构药事管理规 定》《医疗机构处方审核规范》等相关规定及技术规范,加强抗肿瘤药物遴选、采购、储存、处方、调配、 临床应用和药物评价的全过程管理。 第十六条 医疗机构应当建立抗肿瘤药物遴选和评估制度,根据本机构肿瘤疾病诊疗需求制订抗肿瘤药物供 应目录,并定期调整。 医疗机构抗肿瘤药 物 品种 遴 选应 当 以临 床 需求 为 目标 ,2 鼓励 优 先选 用 国家 基 本药 物 目录 、 国家 基 本医 疗 保险 药品目录中收录、国家集中谈判或招标采购,以及国家卫生健康委公布的诊疗规范、临床诊疗指南、临床路 径涉及的药品。 第十七条 医疗机构抗肿瘤药物应当由药学部门统一采购供应,其他科室或部门不得从事抗肿瘤药物的采购、 调剂活动。因特殊治疗需要,医疗机构确需使用本机构抗肿瘤药物供应目录以外抗肿瘤药物的,可以启动临 时采购程序,由临床科室提出申请,经本机构抗肿瘤药物管理工作组审核同意后,由药学部门临时一次性购 入使用。
➢ 手术风险
➢ 有些肿瘤细胞对射线不敏感
2
➢ 有些肿瘤部位不宜照射 ➢ 对机体的损害
➢ 转移、复发率高
2023/11/2
手术治疗 放射治疗
各种治疗方法的局限性
2021最新抗肿瘤药物分级目录31

V
谈判药品医保限定
安罗替尼
Anlotinib
胶囊
V
谈判药品 医保限定
索拉非尼Sorafenib
片剂
V
谈判药品医保限定
瑞戈非尼
Regorafenib
片剂
V
谈判药品 医保限定
仑伐替尼
Lenvatinib
胶囊
V
谈判药品医保限定
阿帕替尼
Apatinib
片剂
V
谈判药品 医保限定
舒尼替尼Sunitinib
胶囊
r:保限定
尼洛替尼
Nilotinib
g g
胶囊
V
达沙替尼Dasatinib
片剂
V
医保限定
氟马替尼
Flumatinib
片剂
V
诔判药品 医保限定
伊布替尼Ibrutinib
胶囊
V
彳豹鞋岛
泽布替尼Zanubrutinib
胶囊
V
谈判药品!'.'1<i
二、分子靶
芦可替尼Ruxolitinib
片剂
V
向治疗药
物
吉非替尼Gefitinib
伊尼妥单抗Inetetamab
针剂
V
谈判药品
拉帕替尼Lapatinib
片剂
V
非医保
毗咯替尼Pyrotinib
片剂
V
谈判药品
奈拉提尼Neratinib
片剂
V
非医保
哌柏西利Palbociclib
胶囊
V
非医保
西妥昔单抗Cetuximab
汴射液
V
谈判药品 医保限定
尼妥珠单抗
最新医保目录中抗肿瘤药物及适应症总结2024

最新医保目录中抗肿瘤药物及适应症总结20242023年12月13日,2023版国家医保目录调整结果公布,新增126种药品!新版医保目录将于2024年1月1日正式实施。
在谈判/竞价环节,143个目录外药品参加,其中121个谈判/竞价成功,成功率为84.6%,平均降价61.7%,成功率和价格降幅均与2023年基本相当。
其中,新增抗肿瘤药物21种,涉及多个癌种。
以下是2023年国家医保药品目录提到的抗肿瘤药物,已按不同癌症类型分类整理,可按需查询。
非小细胞肺癌1甲磺酸奥希替尼片限:1IB-HIA期存在表皮生长因子受体(EGFR)外显子19缺失或外显子21(1858R)置换突变的非小细胞肺癌(NSe1C)患者的治疗,患者须既往接受过手术切除治疗,并由医生决定接受或不接受辅助化疗;2.具有表皮生长因子受体(EGFR)外显子19缺失或外显子21(1858R)置换突变的局部晚期或转移性非小细胞肺癌(NSC1e)成人患者的一线治疗;3.既往经EGFR酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFRT790M突变阳性的局部晚期或转移性NSC1C成人患者的治疗。
有效期:2024年1月1日至2024年12月31日2甲磺酸阿美替尼片限:1.表皮生长因子受体(EGFR)外显子19缺失或外显子21(1858R)置换突变的局部晚期或转移性非小细胞肺癌(NSC1C)成人患者的一线治疗;2.既往经EGFR酪氨酸激酶抑制剂(TK1)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFRT790M突变阳性的局部晚期或转移性非小细胞肺癌成人患者的治疗。
有效期:2023年3月1日至2024年12月31日3克理替尼胶囊限间变性淋巴瘤激酶(A1K)阳性的局部晚期或转移性非小细胞肺癌患者或ROS1阳性的晚期非小细胞肺癌患者。
有效期:2023年3月1日至2024年12月31日4塞瑞替尼胶囊限间变性淋巴瘤激酶(A1K)阳性的局部晚期或转移性非小细胞肺癌(NSC1C)患者的治疗。
医疗机构抗菌药物临床应用备案表

医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表本品为第二代注射用头孢菌素
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表。
2021最新抗肿瘤药物临床使用分级管理办法(附带目录)

2021抗肿瘤药物临床使用分级管理办法(最新)一、本管理办法中抗肿瘤药物是指通过细胞杀伤、免疫调控、内分泌调节等途径,在细胞、分子水平进行作用,达到抑制肿瘤生长或消除肿瘤的药物,一般包括化学治疗药物、分子靶向治疗药物、免疫治疗药物、内分泌治疗药物等。
二、组织领导医务部负责抗肿瘤药物临床使用的监督管理工作,定期开展合理用药培训与教育,组织专家对抗肿瘤药物的临床使用情况进行监督、检查、分析,对不合理用药情况提出改进意见。
三、基本原则(一)抗肿瘤药物临床应用应当遵循安全、有效、经济的原则。
医疗机构和医务人员应当以循证医学证据为基础,以诊疗规范、临床诊疗指南、临床路径和药品说明书等为依据,充分考虑药物临床治疗价值和可及性,合理应用抗肿瘤药物,以达到治疗肿瘤、提高患者生存率、改善患者生存质量的目的。
(二)鉴于部分抗肿瘤药物有明显毒副作用,可给人体造成伤害,对抗肿瘤药物的应用要谨慎合理,需遵循以下基本原则:1、权衡利弊,确保患者最大获益。
2、明确治疗目的,适度治疗。
3、治疗前应签署知情同意书。
4、参照规范,制定合理的治疗计划。
5、个体化治疗。
6、密切监护并正确处理不良反应。
四、分级管理:(一)根据国家《抗肿瘤药物临床应用管理办法》,抗肿瘤药物临床应用实行分级管理。
根据安全性、可及性、经济性等因素,将抗肿瘤药物分为特殊使用级、限制使用级和普通使用级(分级目录见附件)。
1、特殊使用级:仅限副主任医师及以上专业技术职务任职资格的医师(包含主诊组组长)开具,由科主任审核签名。
2、限制使用级:仅限副主任医师及以上专业技术职务任职资格的医师(包含主诊组组长)开具。
3、普通使用级:主治医师及以上职称医师均可开具。
(二)分级原则。
1、特殊使用级抗肿瘤药物是指我院现有药品目录之外的,需要临时采购的品种。
2、限制使用级抗肿瘤药物是指具有下列特点之一的抗肿瘤药物:(1)药物毒副作用大,纳入毒性药品管理,适应证严格,禁忌证多,须由具有丰富临床经验的医务人员使用,使用不当可能对人体造成严重损害的抗肿瘤药物;(2)上市时间短、用药经验少的新型抗肿瘤药物;(3)价格昂贵、经济负担沉重的抗肿瘤药物。
抗菌药物分级管理药品使用备案表
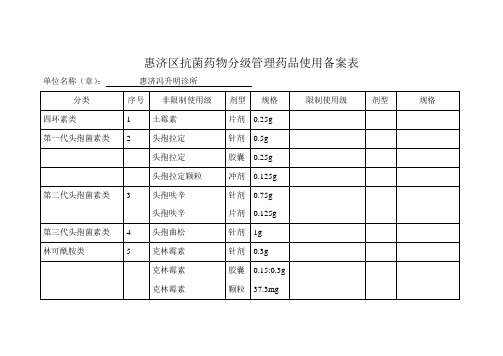
单位名称(章):惠济冯升明诊所
分类
序号
非限制使用级
剂型
规格
限制使用级
剂型
规格
四环素类
1
土霉素
片剂
0.25g
第一代头孢菌素类
2
头孢拉定
针剂
0.5g
头孢拉定
胶囊
0.25g
头孢拉定颗粒
冲剂
0.125g
第二代头孢菌素类
3
头孢呋辛
头孢呋辛
针剂Βιβλιοθήκη 片剂0.75g0.125g
第三代头孢菌素类
阿莫西林
胶囊
颗粒
0.25g
0.125g
汇总情况:非限制使用级:种规格;限制使用级:10种规格
4
头孢曲松
针剂
1g
林可酰胺类
5
克林霉素
针剂
0.3g
克林霉素
克林霉素
胶囊
颗粒
0.15:0.3g
37.3mg
咪唑衍生物
6
7
甲硝唑注射液
甲硝唑
替硝唑
针剂
片剂
针剂
0.5g
0.2g
0.5g
喹诺酮类
8
左氧氟沙星
针剂
0.2g
左氧氟沙星
胶囊
0.1g
9
阿奇霉素
阿奇霉素
片剂
颗粒
0.25g
0.125g
广谱青霉素类
10
阿莫西林
广西医疗机构抗肿瘤药物分级管理专家共识

广西医疗机构抗肿瘤药物分级管理专家共识
广西药学会循证药学专业委员会;张宏亮;蒋能;黄光明
【期刊名称】《广西医科大学学报》
【年(卷),期】2023(40)1
【摘要】抗肿瘤药物分级管理是规范抗肿瘤药物临床使用管理,提高合理用药水平的核心环节。
国家卫生健康委员会发布的《抗肿瘤药物临床应用管理办法(试行)》要求各地制定本区域内的抗肿瘤药物分级管理目录。
此外《,抗肿瘤药物临床合理应用管理指标(2021年版)》也需要各地区有一个统一的分级管理目录。
基于此,广西药学会循证药学专业委员会组织多学科专家对抗肿瘤药物的分级管理目录、处方权限等热点内容进行研讨,结合广西实际,最终形成专家共识,为广西区内医疗机构做好抗肿瘤药物的分级管理提供指导。
【总页数】7页(P166-172)
【作者】广西药学会循证药学专业委员会;张宏亮;蒋能;黄光明
【作者单位】不详;广西医科大学第一附属医院;广西医科大学附属肿瘤医院
【正文语种】中文
【中图分类】R194.2
【相关文献】
1.防治葸环类抗肿瘤药物心脏毒性的中国专家共识(2011版)
2.抗肿瘤药物引起骨髓抑制中西医结合诊治专家共识
3.新生儿脑电生理监测分级管理专家共识
4.山东省
超药品说明书用药专家共识(2022版)系列——抗肿瘤药物超药品说明书用药专家共识5.广西医疗机构落实药品集中带量采购工作专家共识
因版权原因,仅展示原文概要,查看原文内容请购买。
