【精品课件】偶极环加成反应
1,3一偶极环加成反应在叠氮推进剂中的应用

周环反应有电环化反应,环加成反应,和σ 移位反应。而其中的 环加成反应又分为[2+1]环加成,[2+2]环加成,[4+1]环加成。1,3偶极加成和[4+2]环加成即Diels-Alder反应。 本文主要介绍1,3一偶极环加成反应的基础上,综述了该反应在 聚叠氮基缩水甘油醚(GAP)侧基改性、叠氮化合物固化以及在GAP推进 剂中的应用情况。
含有叠氮侧基的聚醚粘合剂可以与含有乙炔基的化合物 通过环加成反应形成三唑粘合剂。在铜催化剂的作用下, 通过环加成反应形成三唑粘合剂。在铜催化剂的作用下,这种 反应简单且非常有效,直接使用GAP可以合成一系列的1 GAP可以合成一系列的 反应简单且非常有效,直接使用GAP可以合成一系列的1,2,3 一三唑基缩水甘油聚合物及衍生物。 一三唑基缩水甘油聚合物及衍生物。
[3+2]环加成(1,3-偶极环加成)中常见1,3-偶极体
R
C N O 腈氧化物
+
-
R
N NR' C 腈亚胺
+
-
R
N O CH2
+
-
N 氧化醛亚胺
1,3一偶极环加成反在叠氮推进剂中的应用
常用的含能叠氮黏合剂
叠氮粘合剂是侧链带有叠氮基团的含能预聚物,常用的含能粘合 剂有聚叠氮基缩水甘油醚(GAP)、双叠氮甲基氧杂丁烷聚醚(BAMO)和 叠氮甲基氧杂丁烷聚醚(AMMO)等。 这类粘合剂应用在推进剂中,能够提高推进剂的比冲和燃速,改善 温度敏感系数,是高能低特征信号、低易损性推进剂理想的含能粘合 剂。
对GAP高聚物叠氦侧基改性 高聚物叠氦侧基改性
尽管含能粘合剂GAP在能量性能方面具有优势, 尽管含能粘合剂GAP在能量性能方面具有优势,但在固体 GAP在能量性能方面具有优势 冲压发动机中,GAP推进剂在低压条件下的燃烧性能差 推进剂在低压条件下的燃烧性能差。 冲压发动机中,GAP推进剂在低压条件下的燃烧性能差。为了 改善燃烧性能, 改善燃烧性能,可以通过添加弹道改良剂或者燃速调节剂来改 变压强对GAP燃烧性能的影响,从而获得较好的燃烧性能。 GAP燃烧性能的影响 变压强对GAP燃烧性能的影响,从而获得较好的燃烧性能。
偶极环加成反应

1 背景介绍
2 各项反应
3
总结
BREAD PPT DESIGN
背景介 绍 1,3-偶极环加成反应(1,3-dipolar
cycloaddition)是发生在1,3-偶极体和烯烃、炔烃或 相应衍生物之间的环加成反应,产物是一个五元杂环化 合物。烯烃类化合物在反应中称亲偶极体。德国化学家 Rolf Huisgen首先广泛应用此类反应制取五元杂环化合 物,因此它也称为Huisgen反应。
BREAD PPT DESIGN
通过2-芳亚甲基-6,7-二氢-5H-噻唑并[3,2-a]嘧啶-3酮与靛红、肌氨酸的l,3-偶极环加成反应,合成了一系列新 的螺噻唑并嘧啶类化合物,以期为药物筛选提供先导化合物。
李筱芳 ,于贤勇 ,冯亚青1,3-偶极环加成反应合成螺噻唑并[3,2-a]嘧啶类化合物, 有机化学2010年第30卷第5期,735-739
BREAD PPT DESIGN
反应介 绍
通过1-苄基-3,5-双芳亚甲基哌啶-4-酮与靛 红、脯氨酸的1,3-偶极环加成反应,合成了一系 列新的螺哌啶-六氢吡嗪类化合物。
令玉林,刘彬,李筱芳,于贤勇,易平贵 1,3一偶极环加成反应合成螺哌啶 一六氢吡嗪
类化合物 中图分类号:062 文献标识码:A 文章编号:1672—9102(2010)04一0101-03
BREAD PPT DESIGN
在氧化剂存在下吡啶叶立德与查尔酮进行1,3-偶 极环加成反应,一锅法合成2-苯基-3-乙酰基中氮茚, 以及用类似的一锅法合成1-苯甲酰基-2-苯基-3-乙酰基 吡咯并[2,I-a]异喹啉化合物。
王炳祥,徐助雄,吴婧 吡啶叶立德与查尔酮1,3.1偶极环加成反应制备2-苯基-3乙酰基中氮茚 有机化学 2006年第26卷第11期,1587~1589
手性配体金属络合物催化的1_3_偶极环加成反应讲解

秦伟艳等,手性配体金属络合物催化的1,3-偶极环加成反应Vol.27.No.4,2005・244・手性配体金属络合物催化的1,3-偶极环加成反应秦伟艳,刘波,由君(哈尔滨理工大学化学与环境工程学院,黑龙江哈尔滨150080)摘要:综述了手性配体金属络合物催化剂催化1,3-偶极环加成反应的研究进展。
主要介绍了唑硼烷催化剂以及αα,,αα’,’-四芳基-1,3-二氧戊环-4,5-二甲醇、双唑啉、联萘二酚等手性配体的金属络合物在不同反应中的立体选择性。
关键词:1,3-偶极环加反应;不对称合成;立体选择性;手性配体;络合物中图分类号:TQ426192文献标识码:A文章编号:1001-0017(2005)04-0244-041,3-DipolarCycloadditionReactionsCatalyzedbyChiralLigandsMetalComplexes QINWei-yan,LIUBoandYOUJun (CollegeofChemicalandEnvironmentalEngineering,HarbinUniversityofScienceand,Harb in,H150080,China)Abstract:Theresearchadvancesofthechiralligandsmetalcomplexescatalysts1,3reactionsw erereviewedinthispaper.thecatalystsofoxazaborolidinoneaswellasthestereoselectiveityofplexes,,-tetraaryl-1,3-diox2alane-4,5-dimethanol(TADDOL),bisoxazoline,1,1-2-oKeywords:1,3-dipolar;;chiralligands;complexes前言1,3-偶极环加成反应是合成五元杂环化合物后,Murahash等人开始研究此类反应的不对称合成,但是不对称性是由底物的手性诱导的[2,3]。
1,3-偶极环加成反应

冯亚青1 偶极环加成反应合成螺噻唑并[3 [3, a]嘧啶类化合物 嘧啶类化合物, 李筱芳 ,于贤勇 ,冯亚青1,3-偶极环加成反应合成螺噻唑并[3,2-a]嘧啶类化合物, 有机化学2010年第30卷第5 2010年第30卷第 735有机化学2010年第30卷第5期,735-739
BREAD PPT DESIGN
BREAD PPT DESIGN
Yamada等利用 酮亚胺与钴(III) (III)阳离子的络合 Yamada等利用 B-酮亚胺与钴(III)阳离子的络合 物催化氮-芳亚甲基苯基氧化胺(2,R2=Ar,R3 =Ph)与 物催化氮-芳亚甲基苯基氧化胺(2, =Ar, =Ph)与 (2 甲酰基- 环戊烯的1 偶极环加成反应。 1-甲酰基-1-环戊烯的1,3-偶极环加成反应。在反应 液中加入NaBH4的乙醇溶液猝灭环加成反应, NaBH4的乙醇溶液猝灭环加成反应 液中加入NaBH4的乙醇溶液猝灭环加成反应,将环加成 产物的醛基转化为更稳定的醇,产物19保持了1 19保持了 产物的醛基转化为更稳定的醇,产物19保持了1,3-偶 极环加成反应的收率、非对映选择性和对映选择性。 极环加成反应的收率、非对映选择性和对映选择性。
BREAD PPT DESIGN
通过六氢- 芳基-lH-比喃[2, d]并嘧啶-2(8aH)通过六氢-4-芳基-lH-比喃[2,3-d]并嘧啶-2(8aH)[2 并嘧啶 硫酮与丁炔二酸二甲(DMAD)的加成反应, (DMAD)的加成反应 硫酮与丁炔二酸二甲(DMAD)的加成反应,合成了一系列新 的吡喃一嘧啶并噻唑类化合物。 的吡喃一嘧啶并噻唑类化合物。
BREAD PPT DESIGN
叠氮基与碳叠氮基与碳-碳双 碳三键或碳键、碳-碳三键或碳氮三键的1 氮三键的1,3一偶极 环加成反应通常有很 多优点。 多优点。
教学课件:第七章 周环反应-1

2 按照参加反应的电子数来标记(IUPAC鼓励),写为 2. 写为[i + j +… + ] 的形式。 Diels-Alder Diels Alder反应: [4 [4+2] 2]环加成反应 烯烃臭氧化的第一步反应则记为[4+2]环加成反应
表环加成反应(Formal cycloaddition) ——实际上是多步完成的反应,与周环反应有本质区别
E
hv
基态
激发态
顺旋 H Me H Me
允许
H Me
H Me
顺旋 H M Me H Me
允许
Me H
Me H
顺,反‐2, 4‐己二烯 基态
顺‐3, 4‐二甲基环丁烯
对旋 H Me H M Me
禁阻
H Me
Me H
对旋 H Me H Me
禁阻
Me H
H Me
顺,反‐2, 4‐己二烯 基态
顺‐3, 4‐二甲基环丁烯
+
2 A
hv
LUMO hv
E 1 S
基态
HOMO
激发态
轨道对称性:
( ) 热反应 (a)
(b)光反应
[2+2]——光照允许——同面/同面加成!
[2+2]——光照允许——同面/同面加成
Me hv + Me O i-PrOH, i PrOH,-78 78oC
H Me
Me H
O
71%
加热条件下:通过同面/异面方式加成(very few) 例如:烯酮的二聚
顺, 顺‐2, , 4‐己二烯 烯
6体系的分子轨道:
分子轨道对称守恒原理
A S A E S A S HOMO LUMO LUMO
13偶极环加成反应

13偶极环加成反应
13偶极环加成反应(13P cycloaddition)是自由基反应发生与重排的一种加成反应,它指的是当双重自由基靠近在可活性亚甲基头上发生反应,形成六原子环(具有四个硝基性中心)结构的方式。
13偶极环加成反应通常用于有机反应,以生成多种甲苯,环烷,环醇,环酯等类型的类似于柠檬烯的环状结构化合物。
在有机化学研究中,13偶极环加成反应的发现和发展有着十分重要的意义,它可以很方便地合成柠檬烯类衍生物,而不需要使用复杂的有机合成方法和过程。
13偶极环加成反应不仅可以用于有机化合物的合成,而且用于分子识别和配体作用反应。
它可以把生物分子动态地固定在另一生物分子上,这种反应类似于具有复杂“自我”结构的具有脱孤岛特性的有机分子在催化剂的影响下快速“自我组装”的效果。
它们可以提供一种给定的分子模板,可以把双脱氧核苷酸等生物分子结合,以形成组成双杂交复合物的“有机结构单元(OSUs)”。
13偶极环加成反应非常受欢迎,由于它具有快速,可控,易 do 等优势,探索它的新前景也没有停止过。
最近,它已经被用于金属活化过程,生物大分子的转化,活性膜的合成,多功能组件的的合成,以及药物的合成,等等。
13偶极环加成反应在许多有机合成和生物合成中发挥了重要作用,它被广泛应用于有机可控的化合物的合成,分子识别,金属催化,以及药物制备等方面。
可以预计,13偶极环加成反应将在未来更多地被用于药物合成,例如制备蛋白质和糖聚合物类药物,以及其他复杂结构化合物,从而为研究药物应用以及人们日常生活带来知识和福利。
18-2教材配套课件教材配套课件

除[4 +2]环加成外,只要参加反应的π 电子数符 合4n+2,进行同面/同面环加成,对称性都是允许的。
(2)内型加成规律
[4+2]环加成反应的另一立体化学特征是主要得 到内型加成产物。
丁烯二酸酐与环戊二烯的加成是体现这种特征 的典型实例。内型产物的生成符合阿德尔(Alder) “最大程度累积不饱和双键”经验规律。内型加成 时,几乎参与分子的所有双键(包括羰基)重叠在 一起,反应中碳氧双键也可与环戊二烯π 键相互作 用形成较稳定的过渡态。而外型加成时,羰基距离 环戊二烯π 键较远,形成的过渡态不够稳定,这样 使反应主要按内型加成进行。
利用这一规律可以合成所希望的邻对位取代的 六元环化合物。
2.其他双烯和亲双烯体的环加成 (1)不同亲双烯体的环加成 除碳碳双键外很多具有其他不饱和官能团的化 合物均可作亲双烯体,下面是含c ≡ c和N=N官能团 化合物的反应实例。
有意思的一个例子是烯丙基正离子,它具有两个 π 电子,也可作为亲双烯体与双烯加成。这个反应可 制备七元环化合物。
(3)分子内[4+2]环加成 若双烯体和亲双婦体同在一个分子内,而且反应 时无张力存在,就容易进行分子内Diels Alder反应, 合成上常用来制备多环化合物。
二、【2+2】环加成 [2 +2]环加成是两个烯分子组成四元环的反应,
在加热条件下,[2 +2]环加成以协同方式进行是困 难的,这是因为同面/同面加成是对称性禁阻的(图 18-7(a)),而同面/异面加成则对称性允许,但几何 上是不利的(图18-7(b))。
问题18-2 环戊二烯长时间放置会产生二聚环戊二 烯,当加热时二聚体又可分解再生环戊二烯。这两 个反应可能属于什么反应?写出二聚环戊二烯的结 构式。 问题18-3 写出下列反应的反应物。
1,3-偶极环加成反应-精品文档

BREAD PPT DESIGN
通过2-芳亚甲基-6,7-二氢-5H-噻唑并[3,2-a]嘧啶-3酮与靛红、肌氨酸的l,3-偶极环加成反应,合成了一系列新 的螺噻唑并嘧啶类化合物,以期为药物筛选提供先导化合物。
李筱芳 ,于贤勇 ,冯亚青1,3-偶极环加成反应合成螺噻唑并[3,2-a]嘧啶类化合物, 有机化学2019年第30卷第5期,735-739
BREAD PPT DESIGN
通过六氢-4-芳基-lH-比喃[2,3-d]并嘧啶-2(8aH)硫酮与丁炔二酸二甲(DMAD)的加成反应,合成了一系列新 的吡喃一嘧啶并噻唑类化合物。
姚飞,曾荣今,王慧,沈鹏飞 1,3一偶极环加成反应合成新型的吡喃一嘧啶并噻唑类化 合物 中图分类号:062 文献标识码:A 文章编号:1672—9102(2019)02—0101—04
叠氮基参与 的1,3-偶极 环加成反应 含能盐 含能基团的修饰 新型含能聚合物
池俊杰,夏宇,张晓勤,曲贵晨,常伟林,王建伟 1,3一偶极环加成反应 在含能材料中的应用 中图分类号:0621.3;TJ55 文献标识码:A 文章 编号:1672—2191(2019)03—0025—04
BREAD PPT DESIGN
BREAD PPT DESIGN
叠氮基与碳-碳双 键、碳-碳三键或碳氮三键的1,3一偶极 环加成反应通常有很 多优点。
反应模块化 高产率 反应条件简单 后处理简单
BREAD PPT DESIGN
立体选择性
此类反应是经典点击化学(Click Chemistry) 的精华 。故自2019年诺贝尔化学奖获得者K.B.Sharpless提出 点击化学的概念以来,叠氮基参与的1,3一偶极环加成反 应就在药物合成、分子印迹、超支化聚合物制备、 纳米材料的修饰等众多领域引起了国内外科学家的重视。 含能材料黏合剂
1,3-偶极环加成

1,3-偶极环加成分子中含有或偶极结构的分子,称为1,3-偶极分子。
这类分子都能与烯烃衍生物发生环加成反应。
常见的1,3-偶极分子如下:1,3-偶极分子与烯烃或其它不饱和化合物发生环加成反应,生成含五员环的杂环化合物:1,3-偶极分子基本上是三原子体系,其分子轨道与烯丙基负离子型结构相似,π体系中含有4个电子,存在一个离域的4π电子体系。
1,3-偶极化合物可以用偶极共振的极限式来进行描述,下表列出了臭氧,重氮甲烷和叠氮化合物的偶极共振极限式。
名称分子式电子结构偶极共振的极限式臭氧重氮甲烷叠氮化物从表中可以看出,1,3-偶极化合物具有一个三原子四电子的π体系,它与烯丙基负离子具有类似的分子轨道,它的HOMO 的对称性和普通的双烯相同,因此1,3-偶极环加成反应和Diels-Alder 反应十分类似。
如果用前线轨道理论来处理1,3-偶极环加成反应,基态时它具有以下的过渡态,是分子轨道对称守恒原理所允许的。
1,3-偶极环加成的过渡状态(点击图片将有动画表示)1,3-偶极体1,3-偶极体的种类很多,例如下面这些都是1,3-偶极环加成反应中常用的化合物。
腈叶立德腈亚铵氧化腈甲亚铵叶立德甲亚铵亚铵氧化甲亚铵羰基叶立德亲偶极体也可以是多种含碳、氮、氧、硫的重键化合物,如:烯烃亚硝基化合物炔烃二硫化碳醛因此1,3-偶极环加成反应提供了一些极有价值的五元杂环的新合成法。
悉尼酮是首次在悉尼(Sydney)发现的,因此得名。
它是一个偶极分子,具有以下结构,代表一类化合物:不过这个偶极成为环的一部分。
它也可以和亲1,3-偶极分子发生加成作用,例如和苯乙烯加成,然后再失去二氧化碳,就得到稳定的五元二唑化合物。
1,3-偶极环加成反应逆向反应1,3-偶极环加成反应,和双烯合成相似,也可以发生逆向反应。
上面悉尼酮的加成物,失去二氧化碳,就可以看作是这样的一个逆向反应。
有几个1,3-偶极分子就是利用杂环化合物的逆向分解来制备的。
第四章_周环反应-3
+
+
Y
主
X Y X Y X
+
+
Y
主
16
c) Diels-Alder反应是立体专一性反应(相对于亲二烯体)
Diels-Alder 反应是基态条件下的环加成反应,采用 同面-同面加成。产物与亲二烯体的顺反关系保持一致。
COOEt COOEt + cis COOEt EtOOC trans
COOEt COOEt cis
4
环加成反应中,在能量上只有一个组分的HOMO与另一 组分的 LUMO在分子两端以成键形式相互作用时,轨道重叠 才是最有利的。 反应过程中在空间图像上同面-同面是有效的轨道重叠。 绝对多数的环加成反应也是同面-同面过程。理论上,同面-异 面或异面-异面也可加成,但由于轨道扭曲,反应活化能较高, 只有少数分子以这种方式进行。
• 反合成分析:
HO HO CO2CH3 H CO2CH3 H + CO2CH3
顺式邻二醇
环己烯衍生物
• 合成:
CO2CH3 +
CO2CH3 H
1. OsO4 2. H2O
HO HO
CO2CH3 H
22
b) 合成1, 6-二羰基化合物
2
氧化
3 4
1 CHO
or
3 4
2 1 COOH COOH 5 6
31
R
N
R' R"
CH2=CHR
R-C
N-CH-R
+
-
S=C=S
R S
N S
R'
C6H5N=O
R R" N R' R"
偶极环加成反应

偶极环加成反应1. 引言偶极环加成反应是一种重要的有机合成反应,通过构建偶极环结构,实现化学物质的转化和功能的增强。
本文将详细介绍偶极环加成反应的原理、机制、应用以及相关的研究进展。
2. 原理与机制2.1 偶极环结构偶极环是指由两个相邻原子或官能团形成的共轭体系,其中一个原子或官能团带有正电荷,另一个带有负电荷。
这种结构具有较高的稳定性和活性,可以参与多种有机反应。
2.2 加成反应偶极环加成反应是指将一个分子中的偶极环与另一个分子中的亲核试剂发生加成反应,生成新的化合物。
这种反应可以在不同条件下进行,如酸催化、碱催化或金属催化等。
2.3 反应机制在偶极环加成反应中,通常存在两种可能的机制:电子推动机制和亲核取代机制。
•电子推动机制:在此机制下,亲核试剂与偶极环发生相互作用,形成共轭体系,并通过共轭系统中的电子重新分布实现反应的进行。
•亲核取代机制:在此机制下,亲核试剂先与偶极环中的正电荷发生反应,形成中间体,然后再通过负离子中心的亲核反应进一步生成产物。
具体的反应机制取决于底物和试剂的性质以及反应条件的选择。
3. 应用3.1 合成有机化合物偶极环加成反应广泛应用于有机化学合成中。
通过选择不同的底物和试剂,可以实现多样化的化学转化,合成出具有特定结构和功能的有机化合物。
通过偶极环加成反应可以合成出含氧、含氮、含硫等不同原子或官能团的化合物。
3.2 药物研究与开发由于偶极环加成反应可以高效地构建复杂分子结构,并引入多样性官能团,因此在药物研究与开发中得到了广泛应用。
通过对不同药理活性基团的引入和调整,可以改善药物的活性、选择性和药代动力学性质。
3.3 功能材料合成偶极环加成反应还可以用于合成各种功能材料,如光电材料、传感器和催化剂等。
通过引入特定的官能团或构建特定的分子结构,可以调控材料的性能和功能,拓展其应用领域。
4. 研究进展偶极环加成反应作为一种重要的有机合成方法,在过去几十年中得到了广泛的研究。
有机合成05-环加成反应

浓 NaOH
2.
+
O
CCl4
Mg
3.
+ +
CCl4
Mg
CHBr 3
t-BuOK
4.
第三节 卡宾[1+2]环加成
一、定义
* Carbene,亦称碳烯(甲烯) * 缺电子碳具有亲电性 * 与烯烃加成形成三元环
P77-78
二、生成பைடு நூலகம்
P279
三、应用
1、新手段的优点(3个)
P279
2、羰基卡宾的应用
3、卡宾加成选择性的应用
P280
作业
完成下列卡宾的环加成反应。 1. TEBA + CHCl3
第二节 Diels-Alder反应
一、定义
二、亲双烯体
——双键或叁键连有吸电子基
时有利
P249
P250
P250
三、双烯体——必须采取顺式构象方可反应
P252
三、双烯体——必须采取顺式构象方可反应
P257
四、逆D-A反应(P257)
五、立体化学——顺式原理(P255)
第五章 环加成反应
第一节 第二节 第三节
概述 Diels-Alder反应 卡宾(1+2)环加成
第一节 概述
成环的方法(P110) 1、分子内的酯双分子还原 2、分子内Aldol缩合 3、Dieckmann酯缩合 4、丙二酸二乙酯合成法 5、环加成反应(最主要的方法)——原子利用 率100%(绿色化学) (1)共轭二烯的[4+2] (2)偶极的[3+2] (3)卡宾[1+2] 6、光[2+2]等
10-协同反应-环加成反应

(2)内型加成规律
[4+2]环加成的另一立体化学特征是主要得到内型加成产物,如丁烯二酸酐
与环戊二烯的加成。
O
H
+
O
O
H O+
O O
O H HO O
endo
exo
内型加成时,几乎参与分子的所有双键重叠在一起,反应ห้องสมุดไป่ตู้碳氧双键可与 环戊二烯的双键作用形成较稳定的过渡态。
O O O
内型过渡态
O
O O
外型过渡态
B
LUMO
LUMO
HOMO
HOMO
B LUM O A HOMO
热反应两分子间轨道对称禁 阻不能以协同的方式成环
A
LUMO
HOMO
B
HOMO
B HOMO A LUMO
光反应两分子间轨道对称允 许能够以协同的方式成环
H C
H3C
H C
CH3
+
H
H
CC
H3C
CH3
H3C
CH3
hν
H
H
H
H
H3C
CH3
顺-1,2,3,4-四甲基环丁烷
+
O
O
O
O
4-环己烯-1,2-二甲酸酐
CHO
+
CHO
3-环己烯基甲醛
+
产率较低
1 反应特点
(1)同面/同面加成
H
COOCH3
+
H
COOCH3
顺式
H +
CH3OOC
COOCH3 H
反式
H COOCH3
COOCH3 H
环加成反应

化学术语
01 反应过程
03 反应原理
目录
02 反应实例
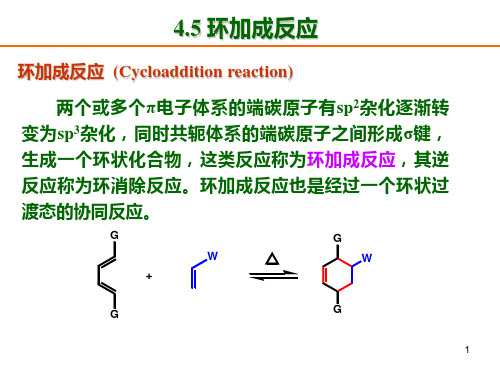
环加成反应,cycloaddition reaction
两个共轭体系结合成环状分子的一种双分子反应。通过环加成反应,两个共轭体系分子的端基碳原子彼此头 尾相接,形成两个σ键,使这两个分子结合成一个较大的环状分子,例如丁二烯与乙烯(或它们的衍生物)的加 成反应。
在有机化学中我们已经知道,两个分子中的轨道相互作用,必然产生两个新的分子轨道,一个轨的能量降 低△E,另一个轨道的能量升高△E,由于反键效应, △E略大于△E。当两个HOMO轨道相互作用时,结果使总的 分子轨道的能量增加,体系更加不稳定,因而HOMO轨道件无相互作用,不能成键。
当HOMO轨道与LUMO轨道相互作用时,形成两个新的轨道,一个能量降低,较HOMO轨道低,另一个轨道能量升 高,较LUMO轨道高,生电子优先排入能量较低的轨道,使整体能量降低,体系趋于稳定,因而可以成键。
2、能量相近规则。相互作用的HOMO和LUMO轨道,能量必须接近,能量越接近,反应越容易进行。两轨道能 量越接近,形成成键轨道能量越低,成键后能量降低的更多,体系更稳定。
3、轨道最大重叠规则。在双分子环加成反应过程中,电子云密度大的原子倾向于与电子云密度大的原子相连, 以这种方式成键后新化学键的键能更高,体系更稳定。
前线轨道
处理原则
分子周围的电子云,根据能量的不同,可以分为不同的能级轨道,根据能量最低原理,电子优先排入能量低 的轨道。前线轨道理论中,将占有电子的能级最高的轨道称之为最高占有轨道,用HOMO表示;未占有电子的能量 最低的轨道称之为最低占有轨道,用LUMO表示。有的共轭轨道中含有奇数个电子,它的最高已占有轨道只有一个 电子,这种单电子占有的轨道称之为单占轨道,用SOMO表示。在分子中,HOMO轨道对于电子的束缚最为薄弱, LUMO轨道对电子的吸引力最强,因而前线轨道认为,分子加发生化学反应,本质上就是HOMO轨道与LUMO轨道的相 互作用,形成新的化学键的过程。特别的,SOMO在前线轨道理论中即可作为HOMO处理,也可作为LUMO处理。我们 将HOMO轨道和LUMO轨道统称为前线轨道,用FOMO表示,前线轨道上的电子称为前线电子。所以,在分子间化学反 应过程中,最先作用的轨道是前线轨道,起关键作用的电子为前线电子。
有机化学协同反应PPT课件

顺旋 允许的
对旋 禁阻的
2021/5/3
11
第11页/共46页
丁二烯在激发态(光照)环化时,起反应的前线 轨道HOMO是ψ3 ,所以丁二烯在激发态(光照) 环化时,对旋允许,顺旋是禁阻。
hυ 对旋(允许)
hυ 顺旋(禁阻)
2021/5/3
12
第12页/共46页
其他含有4n 个π电子的共轭多烯烃体系的电 环化反应的方式也基本相同。 例如:
CH3
CO2CH3
顺式
CH3O2C N
CH3
N
+
CH2
CH3
CO2CH3
N N
CH3
CO2CH3 CH3 CO2CH3
顺式
N N
CO2CH3
CH3 CH3 CO2CH3
反式
反式
2021/5/3
28
第28页/共46页
3) 分子内环加成反应
O CH(CH3)3
O CH(CH3)3
2021/5/3
29
第29页/共46页
乙烯与丁二烯在加热条件下(基态)进行环加 成时,乙烯的HOMO与丁二烯的LUMO作用或丁 二烯的HOMO与乙烯的LUMO作用都是对称性允 许的,可以重叠成键。所以,[ 4+2 ]环加成是加热 允许的反应。如下图:
2021/5/3
LUMO
π
*
3
(丁二烯)
HOMO π (乙烯)
HOMO π 2 LUMO π *
HOMO
(原 LUNO )
[ 2+2 ]环加成是光作用下允许的反应。
2021/5/3
32
第32页/共46页
18.3 σ迁移
一、一般概念 在共轭π体系中, 处于烯丙位的一个 σ-键断裂, 在π 体系另一端生成一个新的σ-键,同时伴随π键的转 移, 这类反应叫做σ-移位反应, 也叫做σ-移位重排。
环加成反应

这三种类型的反应的能量可用图4-5表示:
正常的DA反应
中间的DA反应
反DA反应
双烯
亲双烯体 双烯
亲双烯体 双烯
亲双烯体
图4-5 Diels-Alder反应的三种类型
1-甲氧基-1,3-丁二烯和丙烯醛反应,实验证明只产生甲氧基 与醛基相邻的异构体而不产生相间的异构体,这是为什么呢?
OCH3 +
CHO
不同的原子轨道要有效的组成分子轨道,必须满足一定的条件。 这就是能量相近,轨道最大重叠和对称性匹配等三个条件。
在双分子反应中,一个分子的最高占有轨道和另一个分子 的最低空轨道要有效地组成新的分子轨道,假定也和原子轨道 组成分子轨道时类似,也必须满足能量相近,轨道最大重叠和 对称性匹配这三个条件。在这里,对称性匹配这个条件具有特 别重要意义。当两个分子相互接近时,起决定性作用的轨道必 须满足对称性匹配的要求,它们应属于同一对称类型。
烯烃双键碳原子上有-CHO,-CN,-NO2等吸引电子取代基Z , 可使HOMO和LUMO能量差缩小到9.1eV,反应就比较容易进行。 对正常的Diels-Alder反应来说,一个好的亲双烯试剂的最重要条 件是LUMO能量低。双键碳原子上吸引电子基团愈强,LUMO的 能量就愈低,与二烯烃HOMO的能量差也就愈小,反应速度也 就愈快。因此,四氰基乙烯是一个很好的亲双烯试剂。
图4-4 电子反向的Diels-Alder反应前线轨道能量图
根据双烯和亲双烯体的前线轨道的能量关系, Diels-Alder反应可以分成下 列三种类型:
(一)正常的Diels-Alder反应
双烯的HOMO和亲双烯体的LUMO能量差,小于双烯的LUMO和亲双烯体的 HOMO能量差值,在反应过程中,双烯的HOMO和亲双烯体的LUMO起主要 作用,叫做正常的Diels-Alder反应。双烯分子的给电子取代基和亲双烯体中 的吸电子取代基使这类反应加快。
有机化学协同反应省名师优质课赛课获奖课件市赛课一等奖课件

9
第二节 电环化反应
一 电环化反应旳定义 二 电环化反应描述立体化学过程旳措施 三 电环化反应旳选择规则 四 前线轨道理论对电环化反应选择规则旳证明 五 电环化反应选择规则旳应用实例
10
一 电环化反应定义
共轭多烯烃末端两个碳原子旳π电子环合成一种σ键, 从而形成比原来分子少一种双键旳环烯旳反应及其逆反 应统称为电环化反应。
+
环状过渡态
3
2. 周环反应旳特点:
1. 反应过程中没有自由基或离子这一类活性中间体产生; 2. 反应速率极少受溶剂极性和酸,碱催化剂旳影响,也 3. 不受自由基引起剂和克制剂旳影响; 3. 反应条件一般只需要加热或光照,而且在加热条件下 4. 得到旳产物和在光照条件下得到旳产物具有不同旳立 5. 体选择性,是高度空间定向反应。
LUMO
π
*
3
(丁二烯)
HOMOπ * (乙烯)
(原来的 LUMO)
HOMO
π
*
3
(原来的 LUMO)
LUMO π *(乙烯)
对称性禁阻旳 乙烯和丁二烯旳环加成(光作用)图
27
环加成除[ 2+2 ]、[ 4+2 ]外,还有[ 4+4 ]、[ 6+4 ]、[ 6+2 ]、 [ 8+2 ]等。例如:
[ 2+2 ]、[ 4+4 ]、[ 6+2 ]旳归纳为π电子数4n旳一类;[ 4+2 ] 、[ 6+4 ]、 [ 8+2 ]旳归纳为π电子数4n+2旳一类。
涉及两种理论:前线轨道理论,能级有关理论 6
环加成反应和机理精品PPT课件
讲师:XXXXXX XX年XX月XX日
FMO理论认为,在双分子热反应中,起决定作用的是前线 分子,即一分子出LUMO,另一分子出 HOMO。两个起作用的 轨道必须具有相同的对称性且能量相近才能重叠。
一般环加成为同面环加成
同面环加成
(suprafacial cycloaddition)
异面环加成
(antarafacial cycloaddition)
SOMO'= ψ1 S
S SOMO'= ψ1
对称性匹配 可以成环
对称禁阻的[2 π +2 ห้องสมุดไป่ตู้]热环化加成反应
前线轨道 (FMO)理论认为,在双分子光反应中,两 组分均为具有两个成单电子的激发态分子,单电子占据 的MO又称为SOMO,。故光照下的环加成方式为: 两组分能量较高的两个SOMO组合形成一个σ单键; 两组分能量较低的两个SOMO组合形成另一个σ单键。 两组分相互组合的SOMO必须具有相同的对称性且能量相 近才能重叠。若对称性不同则不能发生环加成反应
环化反应: 加成反应:
环加成反应
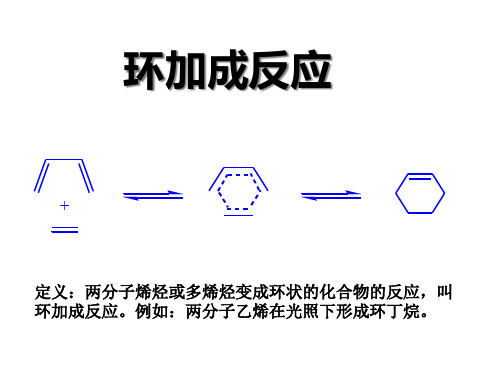
+
迁移反应: 定义:两分子烯烃或多烯烃变成环状的化合物的反应,叫 环加成反应。例如:两分子乙烯在光照下形成环丁烷。
环加成反应类型
[2+1]环加成: CH2 CH2
[2+2]环加成: CH2 CH2
R2C:
RR
CH2 CH2
[4+1]环加成: CH2 CH CH CH2 SO2
对称允许的[4π+2π]热环化加成反应
Ψ2(A) Ψ2(A)
Ψ3(S) Ψ1(S)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
谢谢!
叠氮基参与 的1,3-偶极 环加成反应
含能材料黏合剂 含能盐
含能基团的修饰
新型含能聚合物
池俊杰,夏宇,张晓勤,曲贵晨,常伟林,王建伟 1,3一偶极环加成反应 在含能材料中的应用 中图分类号:0621.3;TJ55 文献标识码:A 文章 编号:1672—2191(2011)03—0025—04
反应介 绍
通过2-芳亚甲基-6,7-二氢-5H-噻唑并[3,2-a]嘧啶-3酮与靛红、肌氨酸的l,3-偶极环加成反应,合成了一系列新 的螺噻唑并嘧啶类化合物,以期为药物筛选提供先导化合物。
李筱芳 ,于贤勇 ,冯亚青1,3-偶极环加成反应合成螺噻唑并[3,2-a]嘧啶类化合物, 有机化学2010年第30卷第5期,735-739
在硝酮与缺电子烯烃的1,3-偶极环加成反应的研究 中,常用的亲偶极体为3-(3-取代丙烯酰)-嗯唑烷-2-酮。
Yamada等利用 B-酮亚胺与钴(III)阳离子的络合 物催化氮-芳亚甲基苯基氧化胺(2,R2=Ar,R3 =Ph)与 1-甲酰基-1-环戊烯的1,3-偶极环加成反应。在反应 液中加入NaBH4的乙醇溶液猝灭环加成反应,将环加成 产物的醛基转化为更稳定的醇,产物19保持了1,3-偶 极环加成反应的收率、非对映选择性和对映杂环化合物的常 用方法。其中,以硝酮为1,3-偶极化合物、1,2-二取 代烯烃为亲偶极体的1,3-偶极环加成反应是合成异嗯 唑烷衍生物的重要途径。
胡晓芬 冯亚青冰 李筱芳 手性Lewis酸催化硝酮与烯烃的1,3.偶极环加成反应 有机化学 2005年第25卷第1期,1~7
本工作以低廉的氯化苄和取代氯化苄为原料,替代通 常的溴化物,合成了苄叠氮(3a),对甲基苄叠氮(3b),对 氰基苄叠氮(3c),对氟基苄叠氮(3d),4,4'-联苯二苄叠 氮等(3e ),有效降低反应成本。
HU.Yan—Hong ,LIU,Shi—Ling TONG,Qin—Yu HUANG,Fa—Rong,SHEN, Yong—Jia QI,Hui—Min,DU,Lei。 Synthesis of 1-(Substituted benzy1)1,2,3-triazoles by 1.3-Dipolar Cycloaddition Reaction
浅析1,3-偶极环加成反应的应用和发展
目录 CONTENTS
1 背景介绍
2 各项反应
3
总结
背景介 绍 1,3-偶极环加成反应(1,3-dipolar
cycloaddition)是发生在1,3-偶极体和烯烃、炔烃或 相应衍生物之间的环加成反应,产物是一个五元杂环化 合物。烯烃类化合物在反应中称亲偶极体。德国化学家 Rolf Huisgen首先广泛应用此类反应制取五元杂环化合 物,因此它也称为Huisgen反应。
以前曾认为1,3-偶极环加成反应是经过一个双自由 基的中间体完成的,但现在大多认为1,3-偶极环加成反 应经过五元环的过渡态,是总电子数6π体系的协同反 应。它受溶剂的极性影响很少,而且是立体专一的顺式 加成反应。分子内或逆向的1,3-偶极环加成反应都是可 以发生的。
叠氮基与碳-碳双 键、碳-碳三键或碳氮三键的1,3一偶极 环加成反应通常有很 多优点。
通过1-苄基-3,5-双芳亚甲基哌啶-4-酮与靛 红、脯氨酸的1,3-偶极环加成反应,合成了一系 列新的螺哌啶-六氢吡嗪类化合物。
令玉林,刘彬,李筱芳,于贤勇,易平贵 1,3一偶极环加成反应合成螺哌啶 一六氢吡嗪 类化合物 中图分类号:062 文献标识码:A 文章编号:1672—9102(2010)04一0101-03
在氧化剂存在下吡啶叶立德与查尔酮进行1,3-偶 极环加成反应,一锅法合成2-苯基-3-乙酰基中氮茚, 以及用类似的一锅法合成1-苯甲酰基-2-苯基-3-乙酰基 吡咯并[2,I-a]异喹啉化合物。
王炳祥,徐助雄,吴婧 吡啶叶立德与查尔酮1,3.1偶极环加成反应制备2-苯基-3乙酰基中氮茚 有机化学 2006年第26卷第11期,1587~1589
反应模块化
高产率
反应条件简单
立体选择性
后处理简单
此类反应是经典点击化学(Click Chemistry)的精华 。故自2001年诺贝尔化学奖获得者K.B.Sharpless提出 点击化学的概念以来,叠氮基参与的1,3一偶极环加成反
应就在药物合成、分子印迹、超支化聚合物制备、 纳米材料的修饰等众多领域引起了国内外科学家的重视。
总结:
1-苄基-3,5-双芳亚甲基哌啶-4-酮与由靛红及脯氨酸原位反 应生成的甲亚胺叶立德的1,3-偶极环加成具有反应时间短 (20min)、收率高(>86%)的特点,反应具有较好的选择性,仅生 成一种产物。
通过六氢-4-芳基-1H-吡喃[2,3-d]并嘧啶-2(8aH)-硫酮与 丁炔二酸二甲酯的加成、环合反应得到一系列新化合物甲基 (2Z)-[5-(4-芳基)-3-羰基-5a,7,8,9a-四氢-5H,6H-吡喃[2 ,3-d][1,3]并噻唑[3,2-a]并嘧啶-2(3I-i)-甲叉基]乙酯。具 有反应时间短(2-3h)、副反应少、后处理简单、收率高(>90%) 的特点。理论上该反应只生成一种产物。
通过六氢-4-芳基-lH-比喃[2,3-d]并嘧啶-2(8aH)硫酮与丁炔二酸二甲(DMAD)的加成反应,合成了一系列新 的吡喃一嘧啶并噻唑类化合物。
姚飞,曾荣今,王慧,沈鹏飞 1,3一偶极环加成反应合成新型的吡喃一嘧啶并噻唑类化 合物 中图分类号:062 文献标识码:A 文章编号:1672—9102(2011)02—0101—04
