Sephadex LH-20使用说明
葡聚糖凝胶 Sephadex LH20 使用说明及使用心得

问:分得效果不是很好,上了有 8 毫升的样,我用甲醇洗脱,结果用 约一个保留体积就洗完了,东西不仅越分越少,而且仍然和没上柱之前差 不多,很让人困惑,郁闷。
了 1g 干态的,Sephadex LH20 对不同溶剂中的保留体积: water 2.1ml MeOH 1.9ml EtOH 1.8ml CHCl3 1.6ml n-BuOH 1.6ml 丙酮 0.8ml 乙酸乙酯 0.4ml 甲苯 0.2ml
2 "还有是不是样品的溶解是不是要与洗脱的起使浓度相同?如何确定样品 在最佳配比的容液中溶呢?"
不要着急,实验是一点一点做出来的,刚开始总是困难的.首先我要说 的是 Sephadex LH20 不是万能的,你的样品不一定适于用它分离,
1 "结果用约一个保留体积就洗完了",这很正常,这也是 Sephadex LH20 这种填料的特点:"洗脱体积一般为 2-3 个保留体积,对特殊保留强的化合 物,可洗脱 5 个保留体积",
3. 样品的处理和洗脱溶剂的选择。
如果样品极性大,选用反相溶剂洗脱(甲醇--水),样品用最少体积 的甲醇--水(尽可能甲醇少一些)溶解,过滤后,湿法上样(必须要进 行过滤!否则把 Sephadex LH-20 堵塞,就必须将 Sephadex LH-20 的柱头 部分弃去,造成不必要的浪费)。
如果样品极性小,这选用正相溶剂洗脱(氯仿--甲醇),样品用最少 体积的氯仿--甲醇溶解,过滤后,湿法上样。
当然有影响,Sephadex LH20 在不同的溶剂中的吸涨程度是不同的(任何 填料都是这样,只是 Sephadex LH20 很明显),一般在丙酮,乙酸乙酯 中收 缩很厉害,所以一般不用丙酮,乙酸乙酯 作溶剂,如果前后使用的两种洗脱 溶剂对 Sephadex LH20 的吸涨程度相差很大,还会产生大量气泡.以下列举
Sephadex LH20详细介绍

Physical and chemical characteristics
Sephadex LH-20 is beaded, cross-linked dextran that has been hydroxypropylated to yield a chromatography medium with both hydrophilic and lipophilic character. Due to its dual character, Sephadex LH-20 swells in water and a number of organic solvents. The chemical structure of the medium is shown in Figure 1. Both the wet particle size and exclusion limit for the medium vary depending on the solvent used for swelling, see Table 2. Table 1 summarizes the general physico-chemical and chromatographic properties of Sephadex LH-20.
imagination at work
Table 1. General physico-chemical properties and chromatographic performance characteristics of Sephadex LH-20
Matrix Bead form Average particle size Dry In methanol pH stability Working Cleaning Chemical stability Autoclavable Maximum linear flow rate Recommended linear flow rate Operating temperature Sample loading volumes Adsorption mode Molecular sizing Partition mode Exclusion limit
LH-20使用说明书
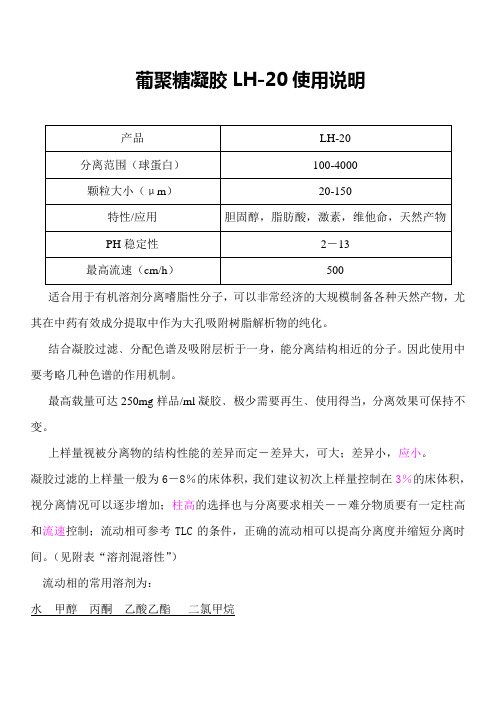
葡聚糖凝胶LH-20使用说明
适合用于有机溶剂分离嗜脂性分子,可以非常经济的大规模制备各种天然产物,尤其在中药有效成分提取中作为大孔吸附树脂解析物的纯化。
结合凝胶过滤﹑分配色谱及吸附层析于一身,能分离结构相近的分子。
因此使用中要考略几种色谱的作用机制。
最高载量可达250mg样品/ml凝胶﹑极少需要再生﹑使用得当,分离效果可保持不变。
上样量视被分离物的结构性能的差异而定-差异大,可大;差异小,应小。
凝胶过滤的上样量一般为6-8%的床体积,我们建议初次上样量控制在3%的床体积,视分离情况可以逐步增加;柱高的选择也与分离要求相关――难分物质要有一定柱高和流速控制;流动相可参考TLC的条件,正确的流动相可以提高分离度并缩短分离时间。
(见附表“溶剂混溶性”)
流动相的常用溶剂为:
水甲醇丙酮乙酸乙酯二氯甲烷
上述溶剂的极性依次降低,对带有极性的被分离物而言,保留值和分离度依次递增;同理选用的凝胶柱高可依次降低,流速可以增大(或上样量可以增加)。
使用方法:将干粉浸泡于60—70%乙醇中过夜(充分搅拌),洗去可能存在的残留物,抽干然后湿态装柱,动态用一倍柱体积的60—70%乙醇淋洗,再用水洗净乙醇即根据自己选用的流动相体系平衡、上样
LH-20在不同溶剂中的溶胀性能:
溶剂混溶性表。
sephadex lh-20 的分离葡聚糖范围

sephadex lh-20 的分离葡聚糖范围
Sephadex LH-20 是一种常用的凝胶过滤材料,用于分离并提
纯生物大分子,包括蛋白质、核酸和多糖等。
对于葡聚糖来说,Sephadex LH-20 主要可用于分离和纯化大小适中的葡聚糖。
具体而言,Sephadex LH-20 适用于分离葡聚糖的范围一般是
分子量在1000到10000之间的葡聚糖。
较小的葡聚糖可能会
在透明小球中渗透或扩散,从而导致分离效果不佳。
较大的葡聚糖则可能无法顺利进入透明小球内部,也会影响分离效果。
需要注意的是,具体的适用范围也可能会因实验条件、溶剂体系、温度等因素而有所变化。
因此,在实际操作中,最好根据具体的实验目的和实验条件进行优化和确定。
sephadexlh20分离原理

sephadexlh20分离原理
首先是一个样品的制备,将样品以不同的形式提取出来,例如溶剂提取、或者是液相色谱法。
我们知道在液相色谱法中,由于需要将不同的化合物分离开来,所以我们一般是要将其进行萃取。
但是,我们也知道在液相色谱中,对于不同的化合物其极性是不一样的,而这也就是我们要对其进行分离的原因。
利用这个原理,我们可以很容易地将其进行分离。
接下来就是在液相色谱中需要使用的物质了,当我们对样品进行萃取时,我们需要将其进行处理。
而这个过程就是溶剂提取。
对于一些大分子物质(例如蛋白质)来说,它们会很容易从溶液中被提取出来。
而对于小分子物质来说就比较难了,例如糖类、脂类以及有机酸等。
这些小分子物质一般都是以溶解度很小的形式存在的,它们的溶解度非常低(例如脂肪)。
所以要将这些小
分子物质从溶液中提取出来是比较困难的。
而将它们从溶液中分离出来则不需要使用到溶剂,而是直接将其从液相色谱柱上进行洗脱就可以了。
—— 1 —1 —。
Sephadex LH20

Sephadex LH20简介Sephadex LH20是一种价钱较高的填料,特点: 1、适合用有机溶剂分离嗜脂性分子,可以非常经济地大规模制备各种天然产物 2、结合凝胶过滤、分配色谱及吸附性层析于一身,分离结构非常相近的分子 3、载量可高达300mg样品/ml 凝胶,极少需要再生,分离效果可保持十几年不变。
Sephadex LH20 的原理Sephadex LH20的分离原理是根据分子大小,主要有两方面:以凝胶过滤作用为主,兼具反相分配的作用(在反相溶剂中)。
因为凝胶过滤作用,所以大分子的化合物保留弱,先被洗脱下来,小分子的化合物保留强,最后出柱。
如果使用反相溶剂洗脱, Sephadex LH20对化合物还起反相分配的作用,所以极性大的化合物保留弱,先被洗脱下来,极性小的化合物保留强,后出柱。
如果使用正相溶剂洗脱,这主要靠凝胶过滤作用来分离。
Sephadex LH20 洗脱溶剂Sephadex LH20 洗脱溶剂因分为两类:反相和正相两种。
用得最多的是反相溶剂洗脱,以甲醇--水系统最为常见,先用水,逐渐增加甲醇比例,最后用100%甲醇冲柱。
正相系统以氯仿--甲醇最为常见,先用50%氯仿--甲醇,逐渐增加甲醇比例,最后用100%甲醇冲柱。
样品的处理和洗脱溶剂的选择如果样品极性大,这选用反相溶剂洗脱(甲醇--水),样品用最少体积的甲醇--水(尽可能甲醇少一些)溶解,过滤后,湿法上样(一定要滤喔!要是把Sephadex LH20 堵啦,就得将Sephadex LH20 的柱头部分弃去,很心痛呀)。
如果样品极性小,这选用正相溶剂洗脱(氯仿--甲醇),样品用最少体积的氯仿--甲醇溶解,过滤后,湿法上样。
分离的技巧(1)流速不可太快,切切不可心急,所谓欲速则不达。
(2)柱子尽可能长, Sephadex LH20 柱长的增加将极大地改善分离,所不要吝惜填料,宁可将填料全装在一根大柱子中,不要将填料装成几根小柱。
SEPHADEXLH-20葡聚糖凝胶的指标

SEPHADEX LH-20葡聚糖凝胶的指标
一、主要技术指标:
1.排阻极限:4-5KD;
2.尺寸排阻模式小于总体积的20%;
3.正相分配模式小于总体积的1%;
4.胶粒形状:球形,多孔;
5.颗粒大小(干)18-111μm(直径);
6.颗粒大小中间值(干):70μm(直径);
7.颗粒大小(甲醇)27-163μm(直径);
8.颗粒大小中间值(甲醇):103μm(直径);
9.最大线性流速:720cm/min,耐受pH值为2-13;
10.操作温度4-40℃。
11.产地:瑞典,GE进口原装;
二、参考品牌及型号:
GE公司产的SEPHADEX LH-20葡聚糖凝胶
三、数量及包装(封装)方式:
8瓶500g原包装
四、到货地点与时间:
到货地点:厦门市大学路184号国家海洋局海洋生物资源综合利用工程技术中心
到货时间:中标后____14__天到货。
五、服务要求:
1、保质期限为以货到买方现场之日起___12___个月内;超过保质期限后,卖方继续提供有偿技术服务。
六、需要上传的资质附件
1.投标单位必须是正规经销商或具备正规代理资质供货商,要求供应商上传投标产品正规渠道证明,并上传相关附件;
2.法人营业执照的复印件(须加盖本单位公章),税务登记证书复印件(须加盖本单位公章),组织机构代码证复印件(须加盖本单位公章),厂家长期代理协议或授权书(须加盖本单位公章),请供应商将以上资质需求上传。
3.。
凝胶色谱柱使用注意事项

完整版pt
23
污染处理方法
• Sephadex LH20柱子被弄脏了,大
多数情况下是由于样品没滤, 将柱头 堵住,或由于样品的死吸附(一般很少 发生),使柱子的柱头部分污染。
• 一般的处理是将被污染的柱头部分的
填料弃去,具体做法很简单,只将被污
染的柱头部分的填料用玻棒轻轻搅起,
倒掉即可。
完整版pt
完整版pt
12
• 使溶胀胶体积沉淀之后占总体积
的75%,上层溶剂占25%,这 时,悬浮液从一个容器倒入另一
容器时胶粒可移动。
完整版pt
13
L•• H溶-剂20在溶m不胀l/同g体干积溶胶剂中溶的剂 溶胀溶性胀m体l/积g 能干胶
• 二甲亚砜 4.2-4.4
3.6
吡啶
4.0-4.3
3.5
水
3.8-4.2
般用3~5倍体积的缓冲液在恒压下流过
床。
• 上样前,用洗脱液平衡层析柱至少两个
柱体积直到基线变得平稳为止。
• 如改变溶剂应该注意凝胶在新溶剂中的
溶胀性质,并根据性质确定柱高调节器
的位置,如使用相同的溶剂,在以后的
层析中柱平衡可以完省整版p略t 。
17
上样
• 一般要求样品粘度小于0.01Pa·s(帕斯
甚至使一些本来可以分开的区带重叠。
如装柱时的操作压力太大,会使凝胶
床压得太实,从而降低流速。
完整版pt
15
• 一般是在柱内先装入约1/3高度的水
或缓冲液,然后将溶胀好的凝胶在搅 拌成稀浆的情况下慢慢倒入柱内,使 其自然沉降。如此连续操作,可以得 到一个均匀的柱床。
完整版pt
16
平衡
• 新柱装好后,要用洗脱缓冲液平衡,一
Sephadex LH-20 层析原理和应用基础

3
安玛西亚中国有限公司
摘自 Hans Henke 著 Preparative Gel Chromatography on Sephadex LH-20
出来,从而未分离。同样大小的最小的化合物在 V0 + Vi 最后洗脱也未分离。只有那些大小介于 最大的和最小的化合物的分子以分子量降低的次序洗脱。
表 2:溶剂的性质和物理数据*
我们将考虑对于不同溶剂作为流动相测定 V0 和 Vi 的方法,这对实际工作是很重要的。 所用的标准组件是“5 米”柱(内径=25/26 毫米),所用的流动相是甲醇、丙酮、二氯甲烷、 N-甲基吡咯烷酮、醋酸乙酯以及水。使用氯仿和四氢呋喃和其它溶剂主要限于 1 米柱(内径 25 毫米)。 流动相对分离的影响可以在 Sephadex LH20 上用不同的溶剂令人信服地证实。因此,改变 洗脱液1)可以明显提高或改进分离系统的选择性,并可以在很短的凝胶床上进行许多分离。在 29 页的图 6 表示在理想的球形填料中大为简化溶胀凝胶粒子。此图说明间隙和孔体积,其各种 的流动相的实验测定在下面讨论。
关于 B
分子筛或体积排阻层析(=SEC)是唯一发生在孔体积 Vi 内按分子大小(分子体积)降低的次 序的分离。在间隙体积 V0 内无分离能发生,因为大于凝胶最大孔的所有分子未加分离而被洗脱。
1) W.Winkle,Quantitative Analysis in the V0-Zone,A Quantitative Aprpooach by Coupling HPLC with GPC” in Chromatographia Vol.29.(1990)530.
相比,其它层析分离系统不能显示被分离物质的化学 / 分子结构和其保留行为之间如此多的相
关性。表 1 比较和对比了 HPLC 和 GPC 和 Sephadex LH20 观察到的分离机理。这种制成表对比
葡聚糖凝胶LH-20使用方法

产品简介:Sephadex G型葡聚糖凝胶只适合在水相中使用,羟基化得到的Sephadex LH-20适合用于有机溶剂分离嗜脂性分子,在有机溶剂中纯化天然产物。
葡聚糖凝胶LH-20分离主要以凝胶过滤为主,兼具反相分配的作用。
在凝胶过滤的作用下,大分子化合物的保留力弱,先被洗脱下来,分子最小的最后出柱;在反相洗脱溶剂中,起反相分配作用,极性大的物质的保留弱先被洗脱,极性小的化合物后出柱;
产品名称: 葡聚糖凝胶LH-20
英文名称:Sephadex LH-20
规格:25g
性状:多孔,白色微球
基质:交联葡聚糖
粒径:100-200目
工作Ph:2-11
操作温度:4-40度
球蛋白分离范围:100-4000
排阻极限:4-5kd(与所用溶剂有关)
保存条件:4-25度
使用说明:
1.凝胶悬浮液的制备
将干粉浸泡于60-70%乙醇中,充分搅拌过夜,洗去可能存在的残留物,根据自己的洗脱液平衡层析至少两个柱体积直到基线平稳为止。
2.洗脱溶剂
如果样品极性大,选用反相溶剂洗脱(甲醇-水),样品用最少体积的甲醇-水溶解,
过滤上柱;如果样品极性小,选用氯仿-甲醇正相洗脱。
3样品处理
用尽量少的洗脱试剂溶解样品,常压过滤。
4.湿法上柱
5.洗脱
控制流速,一般小于1drop/s。
6.再生以后下次使用。
Sephadex LH-20 层析原理和应用基础

表氯醇的比例越大,交联成分越高。较显著的交联说明溶胀能力小,因此排阻限低。 下面的图表明葡聚糖凝胶的片段,是根据交联和溶胀行为画出的。而且,葡聚糖转化为不 溶于水的凝胶也支持这一“结构式”。从该专利文献可以得到进一步细节。 得到的葡聚糖凝胶溶胀能力取决于葡聚糖的绝对浓度、其平均分子量(MW)和表氯醇的 用量。根据交联度,得到的凝胶的排阻限和分级范围有高有低 1)。溶胀能力用作真实干凝胶的 孔隙率的表征。缓冲水溶液一般用作溶胀剂和洗脱液。
DataFiles:TCM-2003-02AA
2
安玛西亚中国有限公司
摘自 Hans Henke 著 Preparative Gel Chromatography on Sephadex LH-20
为了用葡聚糖凝胶分离不溶于盐的水溶液的物质混合物,通过羟丙基化将 Sephadex G 转化 为可在有机溶剂中溶胀的葡聚糖凝胶,因为只有具有孔大小谱的溶胀的凝胶才适于用作凝胶层 析分离用的固定相。将最独特的交联的 Sephadex G-10 转化为 Sephasorb HP,同时通过 G-25 和 G-50 的“烷基化”得到 Sephadex LH-20 和 LH-60。
表1
↓开始
↓死时间 t0
A
HPLC 分离
无分离 ← 柱的总死体积 →
HPLC 分离范围
B
由分子筛层析分离
无分离
排阻区
无分离
(MSC)
按照大小递 减 分离
C
在 A 和 B 后在
无分离
排阻和吸附区
吸附区
Sephadex LH-20
Vads
上分离
C=A+B
↑
↑
↑
开始
V0
(加样)
反相层析柱装柱方案

反相层析柱装柱方案
waters 50/300 Sephadex LH-20柱填装方案1、填料Sephadex LH-20的特性
排阻分子量4—5KD,其溶胀系数及吸收溶剂能力:
溶剂溶胀系数(溶胀体积ml/干胶g)吸收能力(吸收溶剂体积ml/干胶g)
水 4.0——4.4 2.1
DMSO 4.4——4.6---
乙醇 3.6——3.9 1.8
2、柱体积及干胶用量计算
柱体积=3.14159*(5/2)2*30=589.05 ml
干胶用量=589.05/4.4=133.9 g
3、干胶的溶胀
考虑到损耗(估计为3%),称量Sephadex LH-20干胶138g,放入2000 ml的烧杯中,加入双蒸水1200 ml并在沸水浴中将湿凝胶逐渐升温至近沸10分钟,随后取出,室温静置2小时以上,直到温度降为室温。
4、空柱子组装
按照waters50/300柱子组装说明,将其组装并固定到柱架上,并连接好相关管道,备用。
5、填装与平衡
将溶胀好的Sephadex LH-20凝胶用玻璃棒缓缓搅拌均匀形成均匀胶体后,用玻璃棒引流法一次性地平缓地倾倒进waters50/300柱子,在倾倒过程中柱子下端出口开启。
待全部胶体填装完成后,上柱床床面形成前,将柱子上端进口组装进来并与akta exporler100纯化仪器连接好,用双蒸水为流动相,2 ml/min的流速进一步压实柱床,1个柱体积后,改用75%的乙醇溶液(2CV)平衡柱子备用。
LH-20介绍及应用

Sephadex LH-20
国内其它厂家生产的LH-20
FunctiontestforLH20drum201:1_UV1_254nm FunctiontestforLH20drum201:1_UV2_280nm mAU
在Sephadex LH-20 上的分离 p193
Sephadex LH-20 纯化植物激素及 蛋 白抑制剂
可利用Sephadex LH-20 分离细胞分裂素、脱落酸 和生长素。 可利用Sephadex LH-20 分离出几丁质酶的抑制剂 Psmmaplin A,它是一种酪氨酸的衍生物。 Shigeo Suzuki 从海底真菌TUF139中分离出抑制微 管蛋白组装的抑制剂,为脂肪酸的混合物。
•Sephadex LH-20 纯化黄酮及黄酮苷
5m柱 甲醇
槲皮素 Quercetin
山奈酚 Kaempferol
2m柱 甲醇
橙皮素 Hesperetin
几种黄酮类物质的分离 (上图:1. 芹菜苷配基 2. 漆黄素 3山萘酚) (下图:1.橙皮素 2.山萘酚 3. 槲皮素)
LH-20 应用:黄酮类化合物
葛根素 Puerarin
前处理后的葛根素半成品在 不同乙醇浓度的层析比较
左图:70%乙醇洗脱
右图:100%乙醇洗脱
前处理后的葛根素半成品1ml Q HiTrap 上的层析结果
•葛根素 •↙
Q柱后葛根素样品在LH-20柱上的层 析结果
•↙ 葛根素
Sephadex LH20纯化大豆异黄酮
大豆异 黄酮
Sephadex LH-20的的溶剂系统
Sephadex LH-20常选用单一的溶剂系统,应 用最多的是极性强弱不同的如下五种: 1、水; 2、甲醇; 3、丙酮; 4、乙酸乙脂 5、二氯甲烷 根据溶剂极性的不同,样品分别发生正相或 反相分配作用。 预试验时推荐使用40cm长层析柱。然后根据 预试时样品峰的分离情况,加长层析柱进行进 一步的分离。一般水、甲醇、丙酮为流动相 时,由于其洗脱能力强,柱长常使用5m;而 二氯甲烷、乙酸乙脂则更多地使用1m柱进行 分离。 优点:单一溶剂系统有利于溶剂系统的回 收。
葡聚糖凝胶柱(sephadex column)使用及注意事项(1)

葡聚糖凝胶柱(sephadex column)使用及注意事项(1)1 Sephadex G型葡聚糖凝胶只适合在水中使用,Sephadex G-25羟丙化后就是Sephadex LH-20。
其既有分子筛作用,在由极性与非极性溶剂组成的溶剂中还有反相层析效果。
虽然价位很高,但由于性能颇佳,可再生利用,所以倍受亲睐。
此外上柱样品损失很少,对处理小样品较好,这也是我们实验室常用的原因之一。
2 Sephadex LH20 的原理。
Sephadex LH20的分离原理主要有两方面:以凝胶过滤作用为主,兼具反相分配的作用(在反相溶剂中)。
因为凝胶过滤作用,所以大分子的化合物保留弱,先被洗脱下来,小分子的化合物保留强,最后出柱。
如果使用反相溶剂洗脱, Sephadex LH20对化合物还起反相分配的作用,所以极性大的化合物保留弱,先被洗脱下来,极性小的化合物保留强,后出柱。
如果使用正相溶剂洗脱,这主要靠凝胶过滤作用来分离。
3 Sephadex LH20 洗脱溶剂。
看完第2点后,就应该清楚Sephadex LH20 洗脱溶剂因分为两类:反相和正相两种。
用得最多的是反相溶剂洗脱,以甲醇--水系统最为常见,先用水,逐渐增加甲醇比例,最后用100%甲醇冲柱。
正相系统以氯仿--甲醇最为常见,先用50%氯仿--甲醇,逐渐增加甲醇比例,最后用100%甲醇冲柱。
4 Sephadex LH20 样品的处理和洗脱溶剂的选择。
如果样品极性大,这选用反相溶剂洗脱(甲醇--水),样品用最少体积的甲醇--水(尽可能甲醇少一些)溶解,过滤后,湿法上样(一定要滤喔!要是把 Sephadex LH20 堵啦,就得将Sephadex LH20的柱头部分弃去,很心痛呀)。
如果样品极性小,这选用正相溶剂洗脱(氯仿--甲醇),样品用最少体积的氯仿--甲醇溶解,过滤后,湿法上样。
5 Sephadex LH-20的步骤。
(1) 选择条件:梯度洗脱在Sephadex使用中并不象在正相柱层析中那么重要。
Sephadex LH20的使用说明

Sephadex LH-20的使用说明【制备凝胶悬浮液】Sephadex LH-20在使用之前必须进行溶涨。
在溶涨过程中,要尽量避免过分搅拌,否则会破坏球型胶粒,且要避免使用磁力搅拌器。
1 在室温下,将凝胶溶涨于层析溶液中至少三小时。
溶涨后胶体积的大小决定于使用的溶剂系统,请参考页后之干胶溶涨表计算特定主柱体积所需要干胶的量。
2 使溶涨胶体积沉淀之后涨占总体积的75%,上层溶剂占25%,这时,悬浮液从一个容器倒入另一容器时胶粒可移动。
3 将溶涨后的凝胶根据装柱要求均匀倒入柱内,在保证胶粒不变形的前提下,应尽可能高的压力下装柱,反压不要超过1.5ba。
【平衡】上样前,用洗脱液平衡层析柱至少两个柱体积直到基线变得平稳为止。
如改变溶剂应注意凝胶在新溶剂中的溶涨性质,并根据性质确定柱高调节器的位置。
如使用相同的溶剂,在以后的层析柱中柱平衡可以省略。
【洗脱液】为确保延长层析柱的使用寿命,所有的缓冲液都应该离心或经过0.45um的膜过滤以除去杂质。
【样品】样品体积应该占柱体积的1-2%,同样在使用之前样品应离心或经过0.45um的膜过滤。
【洗脱】洗脱流速应根据情况而定,最大线流速约为12cm/min(反压1.5ba),建议流速为1-10cm/h。
总体来说,较低的流速,具有较高的分辨率。
【再生】凝胶再生通常是先用2-3柱体积的洗脱液进行清洗,如更换洗脱液,则需重新平衡。
【溶涨体积】由于Sephadex LH-20的溶涨体积依赖于溶剂,所以对于不同直径的柱可以根据比例增加或减少旧柱体积以便计算出新体积。
新体积=旧体积*(新柱体积/旧柱体积)【胶的性质】Sephadex LH-20同时具备亲水和亲脂双重性质,且被分离物质的极性在分离过程中起着重要作用。
干胶溶涨表。
Sephadex LH20的分离原理

Sephadex LH20的分离原理主要有两方面:以凝胶过滤作用为主,兼具反相分配的作用(在反相溶剂中)。
因为凝胶过滤作用,所以大分子的化合物保留弱,先被洗脱下来,小分子的化合物保留强,最后出柱。
如果使用反相溶剂洗脱,Sephadex LH20对化合物还起反相分配的作用,所以极性大的化合物保留弱,先被洗脱下来,极性小的化合物保留强,后出柱。
如果使用正相溶剂洗脱,这主要靠凝胶过滤作用来分离。
Sephadex LH20 洗脱溶剂因分为两类:反相和正相两种。
用得最多的是反相溶剂洗脱,以甲醇-水系统最为常见,先用水,逐渐增加甲醇比例,最后用100%甲醇冲柱。
正相系统以氯仿-甲醇最为常见,先用50%氯仿-甲醇,逐渐增加甲醇比例,最后用100%甲醇冲柱。
(1)流速不可太快,切切不可性急,所谓欲速则不达。
(2)柱子尽可能长,Sephadex LH20柱长的增加将极大地改善分离,不要吝惜填料,宁可将填料全装在一根大柱子中,不要将填料装成几根小柱。
要集中优势兵力,打击敌人。
(3)馏分一定要接的细,可1/10,或1/20 个保留体积接成一馏分。
(4)洗脱体积一般为2-3个保留体积,对特殊保留强的化合物,可洗脱5个保留体积。
(5)鞣质成分死吸附严重,如不在乎填料者,可用Sephadex LH20 分鞣质。
(6)Sephadex LH20对黄酮类成分的分离效果极佳,方法很成型,有大量文献参考。
(7)填料反复使用,每次用完,一般可用甲醇将柱子洗干净,然后用下一次分离的起步溶剂将甲醇替换出来,待用。
对Sephadex LH20上样样品的要求是1、样品一定要溶解(Sephadex LH20很贵,要保护填料;同时,避免样品不溶解造成的脱尾)。
2、溶解样品的体积尽可能小(色谱分离理论的基本要求,减小原始谱带宽度)3、样品的溶解最好与洗脱的起使浓度相同(若样品的溶解溶剂比洗脱的起使浓度洗脱能力强,则会人为增加洗脱起使溶剂的洗脱能力;同时若样品的溶解溶剂与洗脱的起使溶剂差别很大,样品可能以为溶解性的问题而析出)。
SephadexLH-20的应用综述

1. Sephad ex LH-20简介羟丙基葡聚糖凝胶LH-20是一种S ephad ex G-25的羟丙基衍生物,字母LH的含义是这种凝胶骨架在亲脂溶剂中或在水溶剂中都能溶胀。
在G-25分子中引入羟丙基以代替分子中羟基上的氢,葡聚糖凝胶分子的葡萄糖部分将与羟丙基形成醚键连接:R—OH――→R—O—CH2CH2CH2OH与Sepha dex G相比,Sephad ex LH-20分子中-OH总数虽无改变,但碳原子所占比例却相对增加了,从而使葡聚糖的亲脂性增大。
这种凝胶既有亲水性,又有亲脂性,不仅可在水中应用,也可在极性有机溶剂或它们与水组成的混合溶剂中膨润使用,如丁醇、氯仿、四氢呋喃、二氧六环等,应用范围增大,对黄酮、蒽醌、香豆素等成分也能分离。
Sephad exLH-20除保留有Sepha dex G-25原有的分子筛特性,可按分子量大小分离物质外,在有极性与非极性溶剂组成的混合溶剂中常常起到反相分配色谱的效果,适用于不同类型有机物的分离,在天然药物分离中得到了越来越广泛的应用。
使用注意事项:羟丙基葡聚糖凝胶Sep hadex LH-20虽然是一种两性凝胶,但由于在不同溶剂中的溶胀因子各不相同(见表1),因此在柱中直接更换溶剂是不允许的,床体积在2.5mL /g干胶以下的不能用于G PC分析。
这种凝胶在有机溶剂中分离较小分子量的脂溶性化合物是十分有效的。
但在使用时不允许有氧化剂存在。
再生与保存:Sephad ex LH-20价格比较昂贵。
用过的Sep hadex LH-20可以反复再生使用,而且柱子的洗脱过程往往就是柱子的再生过程。
短期不用时可以水洗→含水醇洗(醇的浓度逐步递增)→醇洗,最后泡在醇中贮于磨口瓶中备用。
凝胶Sephadex LH-20使用方法及注意事项

凝胶使用方法及注意事项1原理Sephadex LH-20的分离原理主要有两方面:以凝胶过滤作用为主,兼具反相分配的作用(在反相溶剂中)。
因为凝胶过滤作用,所以大分子的化合物保留弱,先被洗脱下来,小分子的化合物保留强,最后出柱。
如果使用反相溶剂洗脱, Sephadex LH-20对化合物还起反相分配的作用,所以极性大的化合物保留弱,先被洗脱下来,极性小的化合物保留强,后出柱。
如果使用正相溶剂洗脱,这主要靠凝胶过滤作用来分离。
2.前处理及装柱Sephadex LH-20在使用前必须进行溶胀,溶胀过程中必须避免过分搅拌,否则会破坏球形胶粒。
(1)室温下,将凝胶溶胀于层析液(一般为甲醇)中至少三小时(2)使溶胀胶体积沉淀后占总体积的75%,上层溶剂占25%凝胶悬浮液黏度要适宜A.太稠会在搅拌时产生气泡;太稀会导致装柱时沉降时间长,加凝胶悬浮液的次数增加;B.将凝胶悬浮液静止后所得上清液弃去,保留高于凝胶液面约1 cm的液体即可;C 装柱混悬液的浓度以流动性好,搅拌阻力小为宜。
(3)装柱的要点A 装柱前,先在色谱柱中加入约1/4柱高的液体(溶胀时所用的试剂);B 装柱时,将下端活塞打开,流速尽量大,但要保证小于凝胶沉降速度,否则会干柱;C将凝胶悬浮液搅拌均匀,以漏斗倒入柱子中即可;3.流动相1.分子筛作用,常用的是甲醇、甲醇+氯仿混合溶剂。
甲醇:氯仿一般为1:1左右,切不可用氯仿做为流动相!氯仿比重大,用单纯的氯仿做流动相,填料将浮起来,严重影响分离效果!!2.反相分配作用,常用的是甲醇/水,比例可以根据实际情况进行调整,也可以是梯度洗脱(先用水,逐渐增加甲醇比例,最后用100%甲醇冲柱)4.样品的处理及洗脱过程(1).最重要的一点:用尽可能少的溶剂溶解样品,样品可以很浓。
如果溶解体积很大,一定要先进行浓缩,否则基本没有多大的分离效果。
上样体积一般为柱体积的1%~5%。
(2).很重要的一点:尽可能用起始洗脱溶剂溶解样品(很多情况下样品并不能在起始溶剂中很好地溶解)。
葡聚糖凝胶柱的使用方法

葡聚糖凝胶柱的使用方法:1 预处理称取Sephadex G-2550-100目约5g;加入蒸馏水100ml;置室温下3h进行溶胀..2 装柱凝胶层析柱的直径与柱长之比一般为1:15..柱的底部用装有细玻璃管的橡皮塞塞紧;用洗净的玻璃丝约200目尼龙布垫底或购买类似规格的商品柱..然后将柱垂直安装好;先加入1/3柱体积蒸馏水;接着将溶胀好的凝胶边搅匀边连续装入;使它们在柱内自然沉降..同时大开下口慢速流出蒸馏水..装柱后的凝胶必须均匀;不能有气泡或明显条纹..否则;必须到出重装;装好后;用蒸馏水平衡2-3h即可加样品分离..3 加样加样前;首先把柱内凝胶上面多余的蒸馏水放出;直到柱内液面与凝胶表面相齐或留一极薄液层为止..然后;由柱的上端加水解液2ml;注意不要让溶液把凝胶冲松浮起;加完样品后;打开下口缓慢放出液体至液面与凝胶面相齐;再用少量蒸馏水冲洗原来盛样品的容器2-3次;待全部进入层析柱后;即可进行洗脱..4 洗脱与收集洗脱时;用蒸馏水作洗脱剂;并且要连续不断地进行;使凝胶柱上端保持一定的液层;防止凝胶柱表面的液体流干..本实验洗脱液流出的速度应控制在0.8-1.0ml/min..洗脱液的收集采用分管连续顺序收集;每管收集3ml;共收集10管..据经验;4或5号管核苷酸浓度最大;可作为层析鉴定的样品液..但因层析柱长度的差异;管号会有变化;必要时可用紫外检测A260nm;找出浓度最大的管号..5 凝胶的再生和回收凝胶柱使用一次后;必须反冲疏松一次;平衡后再使用..若使用数次;就需要再生处理..用0.1mol/L NaOH-0.5mol/L NaCl溶液浸泡;然后用蒸馏水洗至中性备用..若实验完毕;将再生后的凝胶在布氏漏斗上用蒸馏水洗涤抽干;再用95%乙醇洗两次;在60℃烘箱中烘干;回收保存..实验五. 葡聚糖凝胶层析实验目的1.掌握葡聚糖凝胶的特性及凝胶层析的原理..2.学习葡聚糖凝胶层析的基本操作技术..实验原理凝胶层析又称分子排阻层析或凝胶过滤;是以被分离物质的分子量差异为基础的一种层析分离技术;这一技术为纯化蛋白质等生物大分子提供了一种非常温和的分离方法..层析的固定相载体是凝胶颗粒;目前应用较广的是:具有各种孔径范围的葡聚糖凝胶Sephadex和琼脂糖凝胶Sepharose..葡聚糖凝胶是由直链的葡聚糖分子和交联剂3—氯1;2—环氧丙烷交联而成的具有多孔网状结构的高分子化合物..凝胶颗粒中网孔的大小可通过调节葡聚糖和交联剂的比例来控制;交联度越大;网孔结构越紧密;交联度越小;网孔结构就越疏松;网孔的大小决定了被分离物质能够自由出入凝胶内部的分子量范围..可分离的分子量范围从几百到几十万不等..葡聚糖凝胶层析;是使待分离物质通过葡聚糖凝胶层析柱;各个组分由于分子量不相同;在凝胶柱上受到的阻滞作用不同;而在层析柱中以不同的速度移动..分子量大于允许进入凝胶网孔范围的物质完全被凝胶排阻;不能进入凝胶颗粒内部;阻滞作用小;随着溶剂在凝胶颗粒之间流动;因此流程短;而先流出层析柱;分子量小的物质可完全进入凝胶颗粒的网孔内;阻滞作用大;流程延长;而最后从层析柱中流出..若被分离物的分子量介于完全排阻和完全进入网孔物质的分子量之间;则在两者之间从柱中流出;由此就可以达到分离目的..本实验以葡聚糖凝胶G—25作为固定相载体;来分离蓝色葡聚糖—2000和溴酚蓝..蓝色葡聚糖—2000分子量接近2×106; 而溴酚蓝分子量为670;二者分子量相差较大;前者完全排阻;而后者则可完全进入凝胶颗粒网孔内;二者通过层析柱的时间不同而分开..实验材料1.实验器材层析柱1×20cm附有一小段乳胶管及螺旋夹;洗脱液瓶带下口的三角瓶;250m1;试管及试管架;量筒10m1;721型分光光度计2.实验试剂1 Tris—醋酸缓冲液pH7.0:取0.0lmol/L Tris溶液含0.1mol/L KCl900ml;用浓醋酸调pH至7.0;加蒸馏水至1000m1..2 溴酚蓝溶液:称取溴酚蓝10毫克;溶于5毫升乙醇中;充分搅拌使其溶解;然后逐滴加入Tris—醋酸缓冲液pH7.0至溶液呈深蓝色..3 蓝色葡聚糖—2000溶液:称取蓝色葡聚糖—2000 10毫克;溶于2毫升Tris—醋酸缓冲液pH7.0中即成..4 样品溶液:取溴酚蓝溶液0.1毫升;蓝色葡聚糖—2000溶液0.5毫升混匀后为上柱样品溶液..5葡聚糖凝胶G-25 Sephadex-G-25实验操作1.实验凝胶的制备:商品凝胶是干燥的颗粒;使用时需经溶胀处理;称取4克葡聚糖凝胶G—25;加50毫升蒸馏水;搅拌均匀;在室温溶胀6小时;或沸水浴溶胀 2小时;一般采用后一种方法..再用倾泻法除去凝胶上层水及细小颗粒;用蒸馏水反复洗涤几次;再以缓冲溶液pH7.0的Tris—醋酸溶液洗涤2—3次;使pH和离子强度达到平衡;最后抽去溶液及凝胶颗粒内部气泡;凝胶可保存在缓冲液内..2.装柱:将层析柱洗净;垂直固定在铁支架上;选择有薄膜端作为层析柱下口;将下口接上乳胶管并用螺旋夹夹紧..层析柱中加入洗脱液;打开下口螺旋夹;让溶液流出;排除残留气泡;最后保留约2厘米高度的洗脱液;拧紧螺旋夹..将凝胶轻轻搅动均匀;用玻璃棒沿层析柱内壁缓缓注入柱中;待凝胶沉积到柱床下已超过l厘米时;打开下口螺旋夹;继续装柱至柱床高度达到8厘米;关闭出口..装柱过程中严禁产生气泡;尽可能一次装完;避免出现分层..再用洗脱液平衡l至2个柱床体积;凝胶面上始终保持有一定的洗脱液..平衡后;拧紧下端螺旋夹..3.加样品:打开螺旋夹使柱面上的洗脱液流出;直至床面与液面刚好平齐为止;关闭下端出口..取溴酚蓝及蓝色葡聚糖—2000混合液0.3毫升;小心地加于凝胶表面上;切勿搅动层析柱床表面..打开下端出口;使样品溶液进入凝胶内;并开始收集流出液..当样品溶液恰好流至与凝胶表面平齐时;关闭下端出口..用少量洗脱液清洗层析柱加样区;共洗涤三次;每次清洗液应完全进入凝胶柱内后;再进行下一次洗涤..最后在凝胶表面上加入洗脱液;保持高度为3—4cm..4.洗脱与收集:连接好凝胶柱层析系统;调节洗脱液流速为每分钟1毫升;进行洗脱..仔细观察样品在层析柱内的分离现象;收集洗脱液;每收集3毫升即换一支收集管试管预先编号;收集约20管左右;样品即可完全被洗脱下来..将各收集管中的洗脱液分别用721型分光光度计在波长540nm处测定其光密度..5.凝胶回收处理方法:将样品完全洗脱下来后;继续用三倍柱床体积的洗脱液冲洗凝胶后;将柱下口放在小烧杯中;慢慢打开;再将上口慢慢松开;使凝胶全部回收至小烧杯中;备用..2 Sephadex LH20 的原理..Sephadex LH20的分离原理主要有两方面:以凝胶过滤作用为主;兼具反相分配的作用在反相溶剂中..因为凝胶过滤作用;所以大分子的化合物保留弱;先被洗脱下来;小分子的化合物保留强;最后出柱..如果使用反相溶剂洗脱; Sephadex LH20对化合物还起反相分配的作用;所以极性大的化合物保留弱;先被洗脱下来;极性小的化合物保留强;后出柱..如果使用正相溶剂洗脱;这主要靠凝胶过滤作用来分离..3 Sephadex LH20 洗脱溶剂..看完第2点后;就应该清楚Sephadex LH20 洗脱溶剂因分为两类:反相和正相两种..用得最多的是反相溶剂洗脱;以甲醇--水系统最为常见;先用水;逐渐增加甲醇比例;最后用100%甲醇冲柱..正相系统以氯仿--甲醇最为常见;先用50%氯仿--甲醇;逐渐增加甲醇比例;最后用100%甲醇冲柱..4 Sephadex LH20 样品的处理和洗脱溶剂的选择..如果样品极性大;这选用反相溶剂洗脱甲醇--水;样品用最少体积的甲醇--水尽可能甲醇少一些溶解;过滤后;湿法上样一定要滤喔要是把Sephadex LH20 堵啦;就得将Sephadex LH20 的柱头部分弃去;很心痛呀..如果样品极性小;这选用正相溶剂洗脱氯仿--甲醇;样品用最少体积的氯仿--甲醇溶解;过滤后;湿法上样..5 Sephadex LH-20的步骤..1 选择条件:梯度洗脱在Sephadex使用中并不象在正相柱层析中那么重要..首先你的样品须要能溶解在尽量少量的洗脱剂中..极性在的用甲醇水系统;极性小者一般用不含水的系统..我们实验室常用正己烷二氯甲烷甲醇系统;用了很多年;效果较好..2 饱和层析柱:用洗脱剂将凝胶摇匀;直立柱身;让其自然沉降;此时要防止气泡留在其中..至少半小时打开开关;流出几个柱体种的洗脱剂;目的是使其膨胀在正确比例的洗脱剂中..3 样品处理:用尽量少的洗脱剂溶解样品;常压过滤..4 湿法上柱..这也是要有技巧的步骤..5 洗脱:控制流速;一般1drop/s以下;可参见厂家的一些参数;必要时更改极性很多时一个极性就可以将样品洗脱完毕..再生以备下次使用..6 分离的技巧;最后说说我的使用心得1 流速不可太快;切切不可新急;所谓欲速则不达..2柱子尽可能长; Sephadex LH20 柱长的增加将极大地改善分离;所不要吝惜填料;宁可将填料全装在一根大柱子中;不要将填料装成几根小柱..所谓集中优势兵力;打击敌人..3 馏分一定要接的细;可1/10;或1/20 个保留体积接成一馏分..4 洗脱体积一般为2-3个保留体积;对特殊保留强的化合物;可洗脱5个保留体积..5鞣质成分死吸附严重;如不在乎填料者;可用Sephadex LH20 分鞣质6Sephadex LH20 对黄酮类成分的分离效果极佳;方法很成型;有大量文献参考..7填料反复使用;每次用完;一般可用甲醇将柱子洗干净;然后用下一次分离的起步溶剂将甲醇替换出来;待用..Sephadex LH-20是由葡聚糖G-25羟丙基化加工而成;属于分子筛凝胶;尤其适用于天然产物在有机溶剂中的纯化..例如:类固醇、萜类、脂类以及小分子多肽等;Pharmadex LH-20同时适用于分子类别非常相似的物质的分离和工业规模的制备;既可用于初步纯化步骤;也可用于最终精制步骤;如非对映同分异构体的分离..1.装柱装填的重要原则之一就是需要形成一个稳定均一的柱床..胶颗粒越均一粒径分布越窄;越容易获得稳定均一的柱床..但是对于Sephadex LH-20而言;25~100μm的粒径范围相对于许多用于制备色谱的填料而言;不能说分布均一;也就是说其粒径分布较宽..然而当胶溶胀后就相对容易得到均一的柱床..这对于长柱最高至250cm而言也是同样的..在装柱前;层析柱和储槽都必须进行彻底的清洗..Sephadex LH-20在使用之前必须进行溶胀..在溶胀的过程中;要尽量避免过分搅拌;否则会破坏球形胶粒;且要避免使用磁力搅拌器..在室温下;将凝胶溶胀于层析溶剂中至少三小时;溶胀后胶体积的大小决定于所使用的溶剂系统;请参考后页之干胶溶胀表计算特定柱体积所需要干胶的量..使溶胀胶体积沉淀之后占总体积的75%;上层溶剂占25%;这时;悬浮液从一个容器倒入另一容器时胶粒可移动..将溶胀后的凝胶根据装柱要求均匀倒入柱内;在保证胶粒不变形的前提下;应在尽可能高的压力下装柱;反压不要超过1.5ba..2.平衡上样前;用洗脱液平衡层析柱至少两个柱体积直到基线变得平稳为止;如改变溶剂应该注意凝胶在新溶剂中的溶胀性质;并根据性质确定柱高调节器的位置;如使用相同的溶剂;在以后的层析中柱平衡可以省略..3.洗脱液为确保延长层析柱的使用寿命;所有的缓冲液都应该离心或经过0.45um的膜过滤以除去杂质..4.样品样品体积应该占柱总体积的1-2%;同样在使用之前样品应该离心或经过0.45um的膜过滤..5.洗脱洗脱流速应根据情况而定;最大线性流速约12cm/min反压1.5ba;建议流速为1-10cm/h..总体来说;较低的流速;具有较高的分辩率..。
sephadexlh20柱色谱洗脱顺序

sephadexlh20柱色谱洗脱顺序Sephadex LH-20柱色谱洗脱顺序会被实验的具体目的和样品的特性所影响,以下是一种常见的洗脱顺序:
1. 检测前准备:在使用Sephadex LH-20柱之前,需要进行准备工作,例如洗脱柱、平衡柱和检查柱的情况。
2. 样品前处理:如果样品中存在杂质或高浓度的盐等物质,可能需要进行前处理,例如溶解或洗脱步骤。
3. 样品加载:将经过前处理的样品溶液缓慢地加入到预先平衡的Sephadex LH-20柱中。
4. 柱洗脱:根据实验目的不同,可以用于洗脱样品的溶剂可以是单一溶剂或者是混合溶剂。
常见的溶剂有水、醇、酸、碱等。
根据样品的特性和亲水性,可以选择不同梯度洗脱方法。
5. 收集洗脱液:根据柱洗脱条件设置,将洗脱液收集到试管或容器中,以备后续分析或进一步操作。
需要注意的是,Sephadex LH-20柱色谱洗脱顺序的具体步骤和条件可能会因不同的实验目的和样品特性而有所不同,需要根据具体的实验要求来进行设计和操
作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
技术文章
Sephadex LH-20使用说明
Sephadex LH-20使用说明
1 Sephadex G型葡聚糖凝胶只适合在水中使用,SephadexG-25羟丙化后就是SephadexLH-20。
其既有分子筛作用,在由极性与非极性溶剂组成的溶剂中还有反相层析效果。
虽然价位很高,但由于性能颇佳,可再生利用,所以倍受亲睐。
此外上柱样品损失很少,对处理小样品较好,这也是实验室常用的原因之一。
2Sephadex LH20的原理。
SephadexLH20的分离原理主要有两方面:以凝胶过滤作用为主,兼具反相分配的作用(在反相溶剂中)。
因为凝胶过滤作用,所以大分子的化合物保留弱,先被洗脱下来,小分子的化合物保留强,最后出柱。
如果使用反相溶剂洗脱,SephadexLH20对化合物还起反相分配的作用,所以极性大的化合物保留弱,先被洗脱下来,极性小的化合物保留强,后出柱。
如果使用正相溶剂洗脱,这主要靠凝胶过滤作用来分离。
3Sephadex LH20洗脱溶剂。
SephadexLH20洗脱溶剂因分为两类:反相和正相两种。
用得最多的是反相溶剂洗脱,以甲醇--水系统最为常见,先用水,逐渐增加甲醇比例,最后用100%甲醇冲柱。
正相系统以氯仿--甲醇最为常见,先用50%氯仿--甲醇,逐渐增加甲醇比例,最后用100%甲醇冲柱。
4Sephadex LH20样品的处理和洗脱溶剂的选择。
如果样品极性大,这选用反相溶剂洗脱(甲醇-水),样品用最少体积的甲醇-水(尽可能甲醇少一些)溶解,过滤后,湿法上样(一定要滤!要是把Sephadex LH20堵啦,就得将SephadexLH20的柱头部分弃去)。
如果样品极性小,这选用正相溶剂洗脱(氯仿-甲醇),样品用最少体积的氯仿-甲醇溶解,过滤后,湿法上样。
5Sephadex LH-20的步骤。
(1)选择条件:
梯度洗脱在Sephadex使用中并不象在正相柱层析中那么重要。
首先你的样品须要能溶解在尽量少量的洗脱剂中。
极性在的用甲醇水系统;极性小者一般用不含水的系统。
我们实验室常用正己烷二氯甲烷甲醇系统,用了很多年,效果较好。
(2)饱和层析柱:
用洗脱剂将凝胶摇匀,直立柱身,让其自然沉降,此时要防止气泡留在其中。
至少半小时打开开关,流出几个柱体种的洗脱剂,目的是使其膨胀在正确比例的洗脱剂中。
(3)样品处理:用尽量少的洗脱剂溶解样品,常压过滤。
(4)湿法上柱。
这也是要有技巧的步骤。
(5)洗脱:控制流速,一般1drop/s以下,可参见厂家的一些参数;必要时更改极性(很多时一个极性就可以将样品洗脱完毕)。
再生以备下次使用。
6分离的技巧
(1)流速不可太快,切切不可新急,所谓欲速则不达。
(2)柱子尽可能长,SephadexLH20柱长的增加将极大地改善分离,所不要吝惜填料,宁可将填料全装在一根大柱子中,不要将填料装成几根小柱。
(3)馏分一定要接的细,可1/10,或1/20个保留体积接成一馏分。
(4)洗脱体积一般为2-3个保留体积,对特殊保留强的化合物,可洗脱5个保留体积。
(5)鞣质成分死吸附严重,不建议用LH20分鞣质。
(6)SephadexLH20对黄酮类成分的分离效果极佳,方法很成型,有大量文献参考。
(7)填料反复使用,每次用完,一般可用甲醇将柱子洗干净,然后用下一次分离的起步溶剂将甲醇替换出来,待用。
Sephadex LH-20是由葡聚糖G-25羟丙基化加工而成,属于分子筛凝胶,尤其适用于天然产物在有机溶剂中的纯化。
例如:类固醇、萜类、脂类以及小分子多肽等,Pharmadex LH-20同时适用于分子类别非常相似的物质的分离和工业规模的制备,既可用于初步纯化步骤,也可用于最终精制步骤,如非对映同分异构体的分离。
制备凝胶悬浮液
装填的重要原则之一就是需要形成一个稳定均一的柱床。
胶颗粒越均一(粒径分布越窄),越容易获得稳定均一的柱床。
但是对于Sephadex LH-20而言,25~100μm的粒径范围相对于许多用于制备色谱的填料而言,不能说分布均一,也就是说其粒径分布较宽。
然而当胶溶胀后就相对容易得到均一的柱床。
这对于长柱(最高至250cm)而言也是同样的。
在装柱前,层析柱和储槽都必须进行彻底的清洗。
Sephadex LH-20在使用之前必须进行溶胀。
在溶胀的过程中,要尽量避免过分搅拌,否则会破坏球形胶粒,且要避免使用磁力搅拌器。
1.在室温下,将凝胶溶胀于层析溶剂中至少三小时,溶胀后胶体积的大小决定于所使用的溶剂系统,请参考后页之干胶溶胀表计算特定柱体积所需要干胶的量。
2.使溶胀胶体积沉淀之后占总体积的75%,上层溶剂占25%,这时,悬浮液从一个容器倒入另一容器时胶粒可移动。
3.将溶胀后的凝胶根据装柱要求均匀倒入柱内,在保证胶粒不变形的前提下,应在尽可能高的压力下装柱,反压不要超过1.5ba。
平衡
上样前,用洗脱液平衡层析柱至少两个柱体积直到基线变得平稳为止,如改变溶剂应该注意凝胶在新溶剂中的溶胀性质,并根据性质确定柱高调节器的位置,如使用相同的溶剂,在以后的层析中柱平衡可以省略。
洗脱液
为确保延长层析柱的使用寿命,所有的缓冲液都应该离心或经过0.45um的膜过滤以除去杂质。
样品
样品体积应该占柱总体积的1-2%,同样在使用之前样品应该离心或经过0.45um的膜过滤。
洗脱
洗脱流速应根据情况而定,最大张性流速约12cm/min(反压1.5ba),建议流速为
1-10cm/h。
总体来说,较低的流速,具有较高的分辩率。
再生
凝胶再生通常是先用2-3个柱体积的洗脱液进行清洗,如更换洗脱液,则需要重新平衡。
体积流速与线性流速的关系
线性流速=体积流速/横截面积
溶胀体积
由于Pharmadex LH-20的溶胀体积依赖于溶剂,所以对于不同直径的柱可根据比例增加或减少旧柱体积以便计算出新体积。
新体积=旧体积×(新柱体积/旧柱体积)
胶的性质
Sephadex LH-20同时具备亲水和亲脂双重性质,且被分离物质的极性在分离过程中起着重要作用。
排阻极限4-5KD(与所用溶剂有关)
上样量
吸附模式取决于所需分辩率
分子量大小小于总体积的20%
正相分配小于总体积的1%
其他
胶粒形状球形,多孔
颗粒大小(干) 18-111um(直径)
颗粒大小中间值(干) 70um(直径)
颗粒大小(甲醇) 27-163 um(直径)
颗粒大小中间值(甲醇) 103 um(直径)
最大线性流速 720cm/min
参考线性流速 60 cm/min
pH的稳定性
操作中 2-11
清洗中 2-13
化学稳定性在许多水溶液及有机溶剂系统中都稳定。
在pH2以下或强氧化剂中不稳定高压灭菌 121℃可忍受20分种
操作温度 4℃到40℃
保存条件
新填料 4-25℃(干燥)
使用后填料 4-8℃,pH6-8切勿冷冻,加入抑菌剂(如20%乙醇0.04%叠氮钠)
干胶溶胀表。
