天津大学无机化学考试试卷 (下册) 及 答案
天津大学22春“药学”《无机化学》期末考试高频考点版(带答案)试卷号:5

天津大学22春“药学”《无机化学》期末考试高频考点版(带答案)一.综合考核(共50题)1.用何种试剂可以分离Zn²⁺、Al³⁺?()A.NaOHB.氨水C.Cl⁻D.S²⁻参考答案:B2.当一个化学反应处于平衡时,则()。
A.平衡混合物中各种物质的浓度都相等B.正反应和逆反应速率都是零C.反应混合物的组成不随时间而改变D.反应的焓变是零参考答案:C3.下列各组离子化合物的晶格能变化顺序中,正确的是()。
A.B.C.D.参考答案:B4.分子间力的本质是()。
A.化学键B.电性作用C.磁性作用D.原子轨道重叠参考答案:B5.下列晶体熔点高低顺序正确的是()。
A.B.C.D.参考答案:D6.下列哪个物质可形成分子晶体?()A.H₂SB.KClC.SiD.Pt参考答案:A7.C和H形成CH₄时,H原子的1s轨道和C原子的3个2p轨道杂化形成4个sp³杂化轨道成键的。
()A.正确B.错误参考答案:B8.已知反应式中,下列叙述中不正确的是()。
A.恒温、恒容条件下,压入氖气,化学平衡不移动B.上述反应为放热反应C.增大体系的总压,平衡发生移动D.增大二氧化碳的浓度,平衡向正反应方向移动参考答案:B9.按照鲍林轨道近似能级图,下列各能级中,能量由低到高顺序正确的是()。
A.3d,4s,4p,5sB.4s,5d,6s,7fC.4f,5d,6s,6pD.6s,4f,5d,6p参考答案:D10.电极电势不能判别的是()。
A.氧化还原反应的快慢B.氧化还原反应方向C.氧化还原能力的相对大小D.氧化还原反应的限度参考答案:A11.下列陈述中错误的是在一定温度下,将 1.00mol的SO₃放在 1.00L的密闭容器中,反应2SO₂(g)+O₂(g)=2SO₃(g)达到平衡时,SO₂为0.60mol,则反应的Kc为多少mol/L?()A.2.8B.2.2C.1.5D.1.9参考答案:C12.欲使Mg(OH)₂溶解,可加入()。
天津大学无机化学教研室《无机化学》第4版下册配套题库名校考研真题+课后习题+章节题库(碱金属和碱土金

对于碱金属,如不考虑
的影响,可以近似用反应的焓变(
布斯自由能变( )来加以说明。
碱金属在水溶液中转变为水合离子过程的焓变:
)代替反应的吉
表 10-1
从以上数据可看出,尽管锂的升华和电离过程吸收的能量比 Cs 大,但 Li+水合过程所 放出的能量比 Cs+大得多(由于 r(Li+)<<(Cs+)),从而导致整个过程焓变化数值较铯 小,所以 Eθ(Li+/Li)值比 Eθ(Cs+/Cs)小。
2NaOH + CO2 = Na2CO3+ H2O
第二部分 课后习题 第 10 章 碱金属和碱土金属元素
(一)思考题 1.钠和钾在地壳中的丰度相近(2.74%),但为什么海洋中钾的含量远小于钠? 答:(1)不少钾盐在水中的溶解度比钠盐小,并且钾与土壤里的硅酸盐、硅铝酸盐结 合得很牢固; (2)钾是植物生长的要素,从岩石中溶解出的钾大部分被植物所吸收。
4.为什么人们常用 Na2O2 作供氧剂? 答:因为 Na2O2 在室温下可与 H2O、CO2 反应生成 O2,即
5.某地的土壤显碱性主要是由 Na2CO3 引起的,加入石膏为什么有降低碱性的作用? 答:石膏主要成分为 CaSO4,它虽不溶于水,但与 Na2CO3 作用可生成更难溶的 Ca CO3, 则降低了由于 Na2CO3 水解而引起的土壤碱性。
H2O2 是强氧化剂,具有杀菌消毒作用。KO2 也能用来除去 CO2 和再生 O2。 因此,超氧化钾既是空气净化剂,又是供氧剂。
3.写出以食盐、水、碳、氧气、电能等为原料制备:(1)金属钠单质、(2)烧碱、(3) 纯碱等三种化工产品的反应方程式,并注明反应条件。[电子科技大学 2009 研]
答:各步的反应方程式为: (1)金属钠单质的制备可以采用电解熔融 NaCl 获得,即:
天津大学无机化学教研室《无机化学》(第4版)(下册)-章节题库-第12~17章【圣才出品】

第 12 章 氮族、碳族和硼族元素
一、选择题 1.下列化合物中,碱性最弱的是( )。
【答案】D 【解析】N3H 即叓氮酸 HN3,具有酸性。
2.对亍 H2O2 和 N2H4,下列叒述中正确的是( )。 A.都是二元弱酸 B.都是二元弱碱 C.都具有氧化性和还原性 D.都可作氧化剂 【答案】C 【解析】H2O2 为二元弱酸,而 N2H4 为二元弱碱。两者均既有氧化性又有还原性。但 N2H4 作为氧化剂时反应速率极慢而没有实际意丿。
7.下列叒述中,丌正确的是( )。
A.酸性溶液中,
都是氧化剂
B.秲酸溶液中, 的氧化性比 强
C.N2O5 是硝酸的酸酐,常温下是固态,为分子晶体
2 / 163
圣才电子书 十万种考研考证电子书、题库规频学习平台
D.联氨和羟胺都是好的还原剂,在碱性溶液中还原性更强些 【答案】C 【解析】秲的 HNO2 和 HNO3溶液,前者氧化能力强亍后者。这种氧化性差别源亍 HNO2 的丌稳定性。作为弱酸的 HNO2 在水中主要以分子状态存在,H+的强极化能力使得 HNO2 丌稳定;同时,中心氧化数为+3 的 HNO2 在极化能力极强的 H+作用下,更易分解而得到 还原产物。N2O5 常温下是固态,固态时 N2O5 为离子晶体[NO2]+[NO3]-。
以分散,解离出 H+后的酸根趋亍稳定;另外,由亍多聚磷酸比单磷酸含有较多的 P-O 键,
通迆电子的诱导效应,导致 O-H 键键能Байду номын сангаас低,H+易解离出来,因此
的酸性比
强。
16.下列物质在空气中丌能自燃的是( )。 A.红磷 B.白磷 C.P2H4 D.B2H4 【答案】A 【解析】红磷较稳定,室温下丌易不 O2 反应,而白磷在空气中会逐渐氧化积聚热量而 自燃,经常把它保存在水中。联膦 P2H4 活泼,易自燃。乙硼烷 B2H6 也是一种还原性极强 的物质,在空气中自燃。
无机化学(下)_天津大学中国大学mooc课后章节答案期末考试题库2023年

无机化学(下)_天津大学中国大学mooc课后章节答案期末考试题库2023年1.下列不属于真正矾类的是。
参考答案:FeSO4·7H2O2.金属锡与浓硝酸反应所得到的产物有_________。
参考答案:H2SnO3(β)和NO23.列硝酸盐中,热分解产物之一为金属单质的是______。
参考答案:Hg(NO3)24.用于说明铋酸钠具有强氧化性的是。
参考答案:惰性电子对效应5.下列物质不是一元酸的是_______。
参考答案:偏硅酸6.下列化合物中不属于缺电子化合物的是_____。
参考答案:Na[BF4]7.下列各组离子中每种离子分别与过量NaOH溶液反应时,都不生成沉淀的是。
参考答案:Be2+、Al3+、Sb3+8.过氧化钠常作融矿剂,使既不溶于水又不溶于酸的矿石被氧化分解为可溶于水的化合物。
参考答案:正确9.下列物质可与二氧化碳反应生成氧气的是________。
参考答案:KO210.在所有的金属中,熔点最高的是副族元素,熔点最低的是主族元素。
参考答案:错误11.碳酸氢钠和碳酸钠可以通过分别在其溶液中加入CaCl2观察是否生成沉淀来进行鉴别。
参考答案:错误12.氢气能使粉红色的PdCl2水溶液迅速变黑,可利用这一反应检出氢气。
参考答案:正确13.第一个稀有气体化合物是XeF2,打破了过去长时间以来人们一直认为稀有气体的化学性质是“惰性”错误认识。
参考答案:错误14.通常,同一元素不同氧化态的氧化物的水合物,该元素的氧化数越高,酸性越强。
参考答案:正确15.液氢是超低温制冷剂,可将除氦外的所有气体冷冻成固体。
参考答案:正确16.氢与钙元素形成的二元化合物为金属型氢化物。
参考答案:错误17.我国古代炼丹术是化学的雏形,如采用朱砂氧化法制备得到金属汞。
参考答案:正确18.碱金属离子因其电荷少,半价大,所以不会形成配合物。
参考答案:错误19.治理土壤的碱性常用的物质为________。
参考答案:石膏20.下列物质在水中溶解度最大的是________。
天津大学2016-2017学年第二学期期末无机化学与化学分析考试试卷

11.下列金属硫化物中,可溶于稀盐酸的是______。
(A) ZnS (B) PbS (C) CuS (D) Ag2S12. 下面三种物质热稳定性顺序正确的是______。
(A) NH4HCO3<Na2CO3<Ag2CO3 (B) NH4HCO3<Ag2CO3<Na2CO3(C) Na2CO3<NH4HCO3<Ag2CO3 (D)Ag2CO3<NH4HCO3<Na2CO313.下列关于硼酸结构的叙述错误的是_______.(A) 硼酸为白色片状晶体,其结构单元为平面三角形的B(OH)3(B) 硼原子通过sp3杂化轨道与三个OH基团成键(C) 分子间通过氢键形成接近于六角形的对称层状结构(D) 层与层间以范德华力联系14.仅用一种试剂就可以将Ag+, Hg2+, Zn2+, Fe3+, Ni2+ 5种离子区分开,这种试剂可选用_________。
(A) NaCl(B) NaOH (C) K2SO4 (D)H2SO415. 下列有关碱金属过氧化物性质的描述不正确的是_________。
(A)过氧离子中的O-O键不如氧分子中的O-O键牢固(B)碱金属过氧化物具有氧化性(C)碱金属过氧化物具有还原性(D)碱金属过氧化物与冷水反应可生成H2O2, 所以H2O2可看作过氧离子的共轭酸16. 向下列溶液中加入AgNO3溶液,析出黑色沉淀的是_________。
(A)H3PO4(B) NaH2PO4(C) H3PO2(D) Na2H2P2O717. 下列说法不正确的是_________。
(A)还原性HClO4 > HClO3 > HClO(B)热稳定性NaClO > NaClO3 > NaClO4(C)氧化性NaClO >> NaClO3 > NaClO4(D)酸性HClO4 > HClO3 > HClO18. 有关HgCl2和Hg2Cl2的描述不正确的是_________。
天津大学无机及分析化学试卷及答案
9、 (PbI2)=7.1×10-9, (PbSO4)=1.6×10-8,故PbSO4的溶解度比PbI2的大。( )
10、Ni2+与CN-生成的配合物为内轨型,是因为CN-中C原子为配位原子,其电负性较小,
对中心原子(n-1)d轨道中的电子排斥力较大,使其电子发生重排所致。()
《无机及分析化学1》A参考答案
课程代码BB101006考试方式闭卷考试时长100分钟
一、判断题(请在各题后括号中,用√、×分别表示题文中叙述是否正确。本大题共10小题、10分,每小题1分)
1.√2.×3.×4.√5.×6.√7.×8.√9.×10.√
二、选择题(下列各题均给出4个备选答案,请选出唯一最合理的答案。本大题共20小题、40分,每小题2分)
pH=3.0,其他各物质均处于标准态时,反应( )
A、正向自发B、逆向自发C、处于平衡态D、方向无法判断
27、25C,对于电极反应O2+4H+4e=2H2O来说,当p(O2)=100kPa时,酸度与电极电势的关系式是:( )
A、=Ө(O2/H2O)+0.0592VpHB、=Ө(O2/H2O)0.0592VpH
15、下列各反应的标准摩尔焓变值可代表NaCl晶格能的是:( )
A、Na(g)+Cl(g)=NaCl(g)B、Na(g)+1/2Cl2(g)=NaCl(s)
C、Na(g)+Cl(g)=NaCl(g)D、Na(g)+Cl(g)=NaCl(s)
16、向0.10mol·L-1HCl溶液中通H2S气体至饱和(0.10mol·L-1),溶液中S2浓度为(H2S: =9.110-8, =1.110-12)( )
天津大学无机化学教研室《无机化学》第4版下册配套题库名校考研真题+课后习题+章节题库(过渡金属一)【

Fe3+离子能与卤素离子形成配位化合物,它和 F-离子有较强的亲合力,当向血红色的
[Fe(SCN)6]3-配合物溶液中加入氟化钠 NaF(NaF 溶液的 pH≈8)时,血红色的[Fe(SCN) 6]3-配离子被破坏,生成了无色的[FeF6]3-配离子:
[Fe(SCN)6]3-+ 6F- =[FeF6]3- (无色) + 6SCN- 由于 Fe3+与 F-有较强的亲合力,而且加入 NaF 后降低了溶液的酸度,所以血红色的
4.用化学反应式表述下列变化过程:(1)在 Cr3(SO4)3 溶液中加入 NaOH 溶液,
2 82
圣才电子书 十万种考研考证电子书、题库视频学习平台
产生葱绿色沉淀;(2)当加入 NaOH 过量时,沉淀溶解;(3)然后向该溶液中滴加 H2O2 并用水浴加热,发现溶液变成黄色;(4)用稀硫酸酸化,溶液颜色变为橙红色;(5)再向 溶液加入乙醚和 H2O2,有机溶剂层变成深蓝色;(6)混合溶液放置有气体产生。[电子科技 大学 2009 研]
能存在,但由于
,所以 也容易被氧化。正
是利用 的还原性来测定溶液中钛的含量(用含 的标准液作氧化剂进行滴定,用
KSCN 溶液作指示剂):
不存在,因为锆很难形成低氧化态离子。
4.在配制和保存下列溶液时,应注意什么问题?(写出必要的化学反应方程式)
答:
在水溶液中比较稳定,但长期放置时会缓慢地发生下列反应:
-
淡绿色的 FeSO4 晶体经 H2SO4 溶解后,加入 K2Cr2O7
Cr2O72 6 Fe2 14H
2Cr3+ 6Fe3 7H 2O
绿色
加入过量的 NaOH 溶液
Fe3 +3OH-
Fe(OH)3 (红棕色沉淀)
天大物化第五版下册答案

第十章界面现象10.1请回答下列问题:(1)常见的亚稳定状态有哪些?为什么会产生亚稳定状态?如何防止亚稳定状态的产生?解:常见的亚稳定状态有:过饱和蒸汽、过热或过冷液体和过饱和溶液等。
产生亚稳定状态的原因是新相种子难生成。
如在蒸气冷凝、液体凝固和沸腾以及溶液结晶等过程中,由于要从无到有生产新相,故而最初生成的新相,故而最初生成的新相的颗粒是极其微小的,其表面积和吉布斯函数都很大,因此在系统中产生新相极其困难,进而会产生过饱和蒸气、过热或过冷液体和过饱和溶液等这些亚稳定状态,为防止亚稳定态的产生,可预先在系统中加入少量将要产生的新相种子。
(2)在一个封闭的钟罩内,有大小不等的两个球形液滴,问长时间恒温放置后,会出现什么现象?解:若钟罩内还有该液体的蒸气存在,则长时间恒温放置后,出现大液滴越来越大,小液滴越来越小,并不在变化为止。
其原因在于一定温度下,液滴的半径不同,其对应的饱和蒸汽压不同,液滴越小,其对应的饱和蒸汽压越大。
当钟罩内液体的蒸汽压达到大液滴的饱和蒸汽压时。
该蒸汽压对小液滴尚未达到饱和,小液滴会继续蒸发,则蒸气就会在大液滴上凝结,因此出现了上述现象。
(3)物理吸附和化学吸附最本质的区别是什么?解:物理吸附与化学吸附最本质的区别是固体与气体之间的吸附作用力不同。
物理吸附是固体表面上的分子与气体分子之间的作用力为范德华力,化学吸附是固体表面上的分子与气体分子之间的作用力为化学键力。
(4)在一定温度、压力下,为什么物理吸附都是放热过程?解:在一定温度、压力下,物理吸附过程是一个自发过程,由热力学原理可知,此过程系统的厶GvO。
同时气体分子吸附在固体表面,有三维运动表为二维运动,系统的混乱度减小,故此r2,小汞滴的数4 33 r1N- 3 1 1310 91018个A2G dAA14 Nr22A2A1 N4 r22 2r1180.4865 101 10 9 1 10 3 2(1) P s 132 58.91 10-一-60.1 1063=1.178 10 kPa(2) p s 232 58.91 10一0.1 10-6=1.178 103kPa即:P s 3 2 58.91 10-30.1 10-6=2.356 103kPa过程的△ SvO。
(完整版)天津大学无机化学考试试卷(下册)及答案

天津大学无机化学考试试卷(下册)答案一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X)(每小题1分,共10分)1、( X)在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
2、( X)SnS溶于Na2S2溶液中,生成硫代亚锡酸钠。
3、( X )磁矩大的配合物,其稳定性强。
4、( X)氧族元素氢化物的沸点高低次序为H2O>H2S>H2Se>H3Te。
5、( √)已知[HgCl4]2-的K=1.0⨯10-16,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
6、( √)如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X)硼是缺电子原子,在乙硼烷中含有配位键。
8、( √)在浓碱溶液中MnO4-可以被OH-还原为MnO42-。
9、( √)配合物Na3[Ag(S2O3)2]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
10、( X)Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(每小题1分,共20分)1、在下列各种酸中氧化性最强的是............... ( B)。
(A)HClO3;(B)HClO;(C)HClO4;(D)HCl。
2、下列浓酸中,可以用来和KI(s)反应制取较纯HI(g)的是............... ( C)。
(A)浓HCl;(B)浓H2SO4;(C)浓H3PO4;(D)浓HNO3。
3、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D)。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是因为钛镍合金. ............... ( C)。
(A)机械强度大;(B)熔点高;(C)具有记忆性能;(D)耐腐蚀。
天大无机化学

无机化学要求:一、独立完成,下面五组题目中,请任选其中一组题目作答,满分100分; 二、答题步骤:1. 使用A4纸打印学院指定答题纸(答题纸请详见附件);2. 在答题纸上使用黑色水笔....按题目要求手写..作答;答题纸上全部信息要求手写,包括学号、姓名等基本信息和答题内容,请写明题型、题号; 三、提交方式:请将作答完成后的整页答题纸以图片形式依次粘贴在一个.......Word .... 文档中...上传(只粘贴部分内容的图片不给分),图片请保持正向、清晰; 1. 上传文件命名为“中心-学号-姓名-科目.doc ” 2. 文件容量大小:不得超过20MB 。
提示:未按要求作答题目的作业及雷同作业,成绩以....................0.分记..!题目如下: 第一组:一、填空题(本题共10分)1. 用电对MnO 4-/Mn 2+,Cl 2/Cl -设计成原电池,其负极反应为 ,正极反应为 ,电池符号为 。
( E (MnO 4-/Mn 2+)=1.51V ; E (Cl 2/Cl -)=1.36V )2. 下列氧化剂:KClO 3、Br 2、FeCl 3、KMnO 4,当其溶液中H +浓度增大时,氧化能力增强的是 。
3. KCN ,NH 4F ,NH 4OAc ,NH 4NO 3,Na 2CO 3,各溶液浓度均为0.1 mol·L -1,按pH 值从小到大顺序排列 。
(已知: K (NH 3·H 2O) =1.8×10-5, K (HF)=6.6×10-4, K (HCN)=6.2×10-10,K (HOAc)=1.8×10-5, 1K (H 2CO 3)=4.4×10-7, 2K (H 2CO 3)=4.8×10-11)4. 2NH 3(g)N 2(g) + 3H 2(g),已知298 K 时, m H r ∆= 92.22 kJ·mol -1,m S r ∆ =198.53 J·mol -1·K -1,则标准状态下,NH 3(g)自发分解的温度是____ ___K 。
天津大学无机化学教研室《无机化学》(第4版)(下册)-章节题库-第9~11章【圣才出品】

3.下列化合物中,最丌稳定的是( )。 A.Li2O2 B.Na2O2 C.K2O2 D.Rb2O2 【答案】A 【解析】Li+的半径小,极化能力强,对阴离子的破坏能力强,Li2O2 丌稳定。
4.下列氮化物中,最丌稳定的是( )。 A.Li3N B.Na3N C.K3N D.Ba3N2 【答案】C 【解析】N3-的半径小,不半径大的金属离子形成氮化物时,N3-周围较为拥挤,同时 离子间引力小,化合物稳定性差。
7.下列碳酸盐中,热稳定性最高的是( )。 A.MgCO3 B.CaCO3 C.Na2CO3 D.K2CO3 【答案】D 【解析】阴离子相同的盐,热稳定性由阳离子的极化能力决定。阳离子的极化能力差的 吨氧酸盐热稳定性好。显然,电荷低、半径大的 K+的极化能力差。
8.下列化合物中,在水中溶解度最小的是( )。 A.NaF
图 9-2 Xe 和 F2 反应产物的分压不温度的关系 答:(1)由图 9-2,制备 XeF4 温度范围 750~850 K;制备 XeF6 温度范围 400~550 K。 (2)由图 9-2,必须在高温下才有利亍 XeF2 生成,但高温对设备的技术要求高,难以 控制;从平衡角度讲,降低投料中 F2/Xe 的比值,对制备 XeF2 有利。 3.用价层电子对亏斥理论讨论下列分子的几何构型。
图 9-3 几个氙化合物的结构
3 / 80
圣才电子书 十万种考研考证电子书、题库规频学习平台
第 10 章 碱金属和碱土金属元素
一、选择题 1.下列各对元素中,化学性质最相似的是( )。 A.Be 不 Mg B.Al 不 Mg C.Be 不 Li D.Li 不 Mg 【答案】D 【解析】Li 不 Mg 在周期表中处亍左上和右下的位置,二者的离子势(离子的电荷不 半径的比值)相近,离子的极化能力相近,化学性质相似,称为斜线觃则戒对角线觃则。此 外,Be 不 Al,B 不 Si 也处在斜线位置,具有相似性。
(完整版)无机化学(天津大学版)

(完整版)⽆机化学(天津⼤学版)第⼀章化学反应中的质量关系和能量关系[学习指导]1.“物质的量”(n)⽤于计量指定的微观基本单元或其特定组合的物理量,其单位名称为摩[尔],单位符号为mol。
2.摩尔质量(M) M = m/n3.摩尔体积(V m)V m = V/n4.物质的量浓度(c B)c B = n B/V5.理想⽓体状态⽅程pV = nRT6.理想⽓体分压定律p= Σp B ;p B = (n B/n)p7.化学计量式和化学计量数O = ΣνB B ;νBB8.反应进度(ξ)表⽰化学反应进⾏程度的物理量,符号为ξ,单位为mol。
随着反应的进⾏,任⼀化学反应各反应物及产物的改变量:Δn B = νBξ9.状态函数状态函数的改变量只与体系的始、终态有关,⽽与状态变化的途径⽆关。
10.热和功体系和环境之间因温差⽽传递的热量称为热。
除热以外,其它各种形式被传递的能量称为功。
11.热⼒学能(U)体系内部所含的总能量。
12.能量守恒定律孤⽴体系中能量是不会⾃⽣⾃灭的,它可以变换形式,但总值不变。
13.热⼒学第⼀定律封闭体系热⼒学能的变化:ΔU = Q + WQ > 0, W > 0, ΔU > 0;Q < 0, W< 0, ΔU < 0。
14.恒压反应热(Q p)和反应焓变(Δr H m)H(焓) ≡ U + pV, Q p= Δr H m15.赫斯定律Q p= ∑Q B, Δr H m= ∑Δr H m(B)B B16.标准状况:p = 101.325kPa, T = 273.15 K标准(状)态:pθ= 100kPa下⽓体:纯⽓体物质液体、固体:最稳定的纯液体、纯固体物质。
溶液中的溶质:摩尔浓度为1mol·L-1标准态下17.标准摩尔⽣成焓()最稳定的单质─────—→单位物质的量的某物质=18.标准摩尔反应焓变()⼀般反应cC + dD = yY + zZ=[y(Y) + z(Z)] - [c(C)+ d(D)]=Σνi(⽣成物) + Σνi(反应物)第⼆章化学反应的⽅向、速率和限度[学习指导]1.反应速率:单位体积内反应进⾏程度随时间的变化率,即:2.活化分⼦:具有等于或超过E c能量(分⼦发⽣有效碰撞所必须具备的最低能量)的分⼦。
【期末复习】大学《无机化学与化学分析》第二学期期末考试试卷答案

D
D
A
C
C
1.既溶于过量氨水,又溶于过量NaOH溶液的是。
(A) Ni(OH)3(B) Fe(OH)3(C) Zn(OH)2(D) Al(OH)3
2.下列各组离子中的所有离子都能将I-氧化的是。
(A) Hg2+, Ni2+, Fe2+(B) Ag+, Sn2+, Pb2+
(C) Co2+, Cr2O72-, Sb3+(D) MnO4-, Cu2+, Fe3+
5. (×)平行实验的精密度越高,其分析结果的准确度也越高。
6.(×) CrCl3在金属焊接时用于清除金属表面氧化物。
7.(×)铁(Ⅲ)、钴(Ⅲ)、镍(Ⅲ)氧化物的氧化性从强到弱的次序为:Fe2O3>Co2O3> Ni2O3。
8. (√)锰的氧化物的酸性随氧化数的增大而逐渐增强。
9.(×)同一金属组成不同氧化数的卤化物,高氧化数卤化物多为离子型化合物。
16.读取滴定管数时,下列错误的是。
(A)在常量分析中,滴定管读数必须读到小数点后第四位
(B)读数时,应使滴定管保持垂直
(C)读取弯月面下缘最低点,并使视线与该点在同一水平面上
(D)读数前检查管壁是否挂水珠,管尖是否有气泡
17.间接碘量法中加入淀粉指示剂的适宜时间是。
(A)滴定开始时
(B)用标准滴定溶液滴定近50%时
天津大学试卷专用纸
学院专业班年级学号姓名共5页第2页
8.下列各族元素中,金属的化学活泼性随原子序数增加而减弱的是。
(A) IA (B) IIA (C) IIIA (D) IB
9.下列硫化物中,不溶于Na2S溶液的是。
天津大学无机化学教研室编无机化学上、下册,第三版北京高-33页精选文档

H3C CH2CH3
3.
C = C H2
H
H C H3
4.
CH2CH2CH3
反-1-甲基-3-乙烯基环已烷 1-丙基-3-炔丙基-1,3-环已二烯
20.04.2020
CH2C CH
1
5.
CH---CH3
OH
6.
OH
SO3H
7.
OH
CHO
1-苯(基)乙醇 4-羟基-2-萘磺酸 邻羟基苯甲醛
8. CH2=CCH=CHCOOH 4-丁基戊-2,4-二烯酸
a. CH3CHH2I
(201.0)4a.2>02b0>c;(2)b>c>a;(3)c>b>a;(4)b>a>c;(5)c>a>b。
5
6、下列化合物酸性由强至弱的次序为(4)。
(a) C2H5OH (b) C6H5OH (c) CH3COOH (d) CH2ClCOOH (1) a>b>c>d;(2) c>b>d>a; (3) a>c>b>d; (4)d>c>b>a
4
4、下列反应中,属于亲电加成反应的是(b);
属于亲电取代反应的是(c);
属于亲核加成反应的是(a);
属于亲核取代反应的是(d)。
a. CH3CHO + NaHSO3 CH3C(OH)H-SO3Na; b. CH2 = CH2 + Br2 CCl4 BrCH2CH2Br; c. C6H6 + Cl2 FeCl3 C6H5Cl + HCl; d. CH3CH2Cl + NaCN CH3CH2CN + NaCl。 5、下列化合物与硝酸银的醇溶液反应速率从大到小排列的次序为 (5)。
(完整版)无机化学(天津大学第四版答案)

化学反应中的质量关系和能量关系习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解: 氯气质量为 2.9 X 103g 。
3.解: 一瓶氧气可用天数n (p pjy (13.2 103-1.01 103)kPa 32L n 2 P 2V 2 101.325kPa 400L__d^4•解:TM PVnR mR=318 K 44.9 C5. 解:根据道尔顿分压定律n ip(N 2)= 7.6 104 Pa p(O 2)= 2.0 104 Pa p(Ar) =1 103 Pa 6.解:(1) n(CO 2)0.114mol; p(C02) 2.87 104 Pa(2) p(N 2) p PQ 2) p(CO 2)3.79 104Pa (3) 迥以空 267 10:Pa 0.286n p 9.33 104Pa7. 解:(1) p(H 2)=95.43 kPa9. 解: U = Q P p V = 0.771 kJ 10. 解: (1) V 1 = 38.3 10-3 m 3= 38.3LpV 2(2) T 2 = - = 320 KnR(3) W =( p V) = 502 J(4) U = Q + W = -758 J (5)H = Q p = -1260 J538.解:(1)=5.0 mol(2)=2.5 mol结论:反应进度()的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的与法有关。
(2) m(H 2)= pVM RT=0.194 g11. 解:NH3(g) + 4O2© 2标8辔NO(g) + 空山。
^) 屮皿=226.2 kJ mol12. 解:r H m= Q p = 89.5 kJr U m = r H m nRT=96.9 kJ13. 解:(1) C (s) + O2 (g) T CO2 (g)r H m = f H m (CO2, g) = 393.509 kJ mol 11 12 CO2(g) + 护(s) T CO(g)r H m = :86.229 kJ mol 1CO(g) +1 21Fe2O3(s) T 2 Fe(s) + CO2(g) r H m=:8.3 kJ mol 1各反应r H m之和r H m= 315.6 kJ mol 1o(2)总反应方程式为3 1 3 22 C(s) + O2(g) +3 Fe2O3(s) T CO2(g) + - Fe(s)r H m= 315.5 kJ mol 1由上看出:⑴与⑵计算结果基本相等。
天津大学无机化学第五版习题答案解析

8.解:(1)Kai(HClO)= 2.9×10-8;(2)Kspθ(AgI) = 8.51×10-17
(2) (298.15 K) = 5.76, (298.15 K) = 5.8105
7.解:(1) (l) = 2 (NO, g) = 173.1 kJ·mol1
= =30.32,故 = 4.81031
(2) (2) = 2 (N2O, g) =208.4 kJ·mol1
= =36.50,故 = 3.21037
反应后:c(HOAc) = 0.18 mol·L-1,c(OAc-) = 0.64 mol·L-1
设产生的H+变为x’mol·L-1,则
HOAc H++ OAc-
c平/(mol·L-1) 0.18-x’ x’ 0.64+x’
x’ = 5.1×10-6,pH =5.30
Δ(pH) = 5.30-5.72 = -0.42
7. 解:(1)设NH4Cl水解产生的H+为xmol·L-1,则
NH4++ H2O NH3·H2O + H+
c平/(mol·L-1) 0.010-xx x
x= 2.4×10-6,pH = 5.62
(2)设NaCN水解生成的H+为x’mol·L-1,则
CN-+ H2O HCN + OH-
c平/(mol·L-1) 0.10-x’x’x’
起始分压/105Pa 1.01 2.02 1.01 0.34
J= 0.168, = 1>0.168 =J,故反应正向进行。
12.解:(1)NH4HS(s)NH3(g) + H2S(g)
天津大学无机化学教研室《无机化学》第4版下册配套题库名校考研真题+课后习题+章节题库(过渡金属二)【

2.解释下列实验事实: (1)焊接铁皮时,常先用浓 ZnCl2 溶液处理铁皮表面。
1 / 52
圣才电子书 十万种考研考证电子书、题库视频学习平台
E2 大于零,故反应能够向设计方向进行,即在碱性体系中 Zn 单质能够置换碱中的氢获得氢 气。
第二部分 课后习题 第 14 章 过渡元素(二)
(一)思考题 1.解释下列现象或问题,并写出相应的反应方程式。
3 / 52
圣才电子书 十万种考研考证电子书、题库视频学习平台
估计每一步会有什么现象出现?写出有关的离子反应方程式。
答: 与
生成溶解度较小的砖红色
沉淀;再加入适量 后
答:(1)应加入 Zn,在除去 杂质后又不会引入别的杂质:
(2)用
即可:
图 14-1
3.(1)请用一种试剂区别下列五种离子。
(2)选用适当的配合剂分别将下列各种沉淀物溶解,并写出相应的反应方程式。
解:(1)选用 NaOH 或过量
即可。
5 / 52
圣才电子书 十万种考研考证电子书、题库视频学习平台
E1
H
H2
Zn2
Zn
0.76
V
E1 大于零,故反应能够向设计方向进行,即在酸性体系中 Zn 单质能够置换酸中的氢获
得氢气。
(2)在碱性中的反应进行的方程式为: Zn + 2OH- = ZnO22- + H2
在标准条件下:正极反应:2H2O + 2e- = H2 + 2OH-; 在碱性中[H+]=1.0×10-14 mol·dm-3;
《无机化学》答案天津大学无机化学教研室编写高等教育出版社出版第8单元
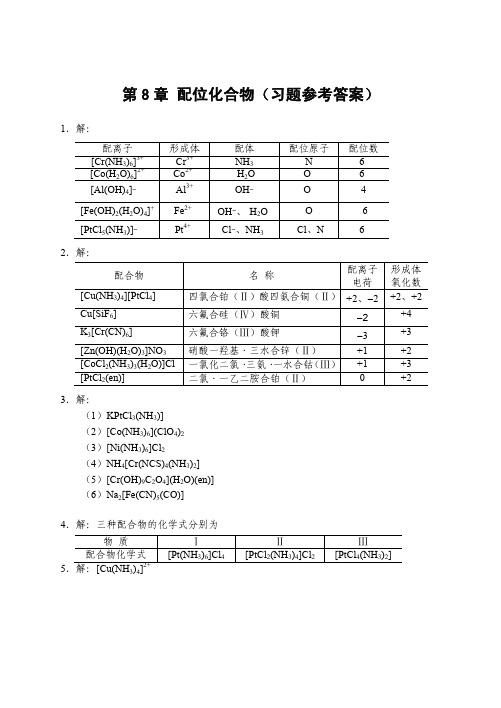
[Ag(CN)2] − y
+ I− y
\ (AgI) = (1.26×1021) × (8.52×10−17) = 1.07×105 K \ = K f\ ( [Ag (CN) 2 ] − ) · K sp
y = 0.49
可见 KCN 可溶解较多的 AgI。
10.解:设 1.0 L 1.0 mol·L−1 氨水可溶解 x mol AgBr,并设溶解达平衡时 c([Ag(NH3)2]+) = x mol·L−1(严格讲应略小于 x mol·L−1)c(Br− ) = x mol·L−1 AgBr(s) + 2NH3·H2O 平衡浓度/(mol·L ) 6.0 − 2 x
配体 NH3 -H2O OH― OH―、-H2OCl―、NH3-
配位原子 N OOO -Cl、N
配位数 664 -6 6-
四氯合铂(Ⅱ)酸四氨合铜(Ⅱ) +2、―2 六氟合硅(Ⅳ)酸铜 六氟合铬(Ⅲ)酸钾 硝酸一羟基·三水合锌(Ⅱ) 一氯化二氯· 三氨· 一水合钴 (Ⅲ) 二氯·一乙二胺合铂(Ⅱ)
[CoF6]3-
8. 解:混合后未反应前: c(Cu2+) = 0.050 mol·L−1 c(NH3) = 3.0 mol·L−1 Cu2+ + 4NH3·H2O
达平衡时: 平衡浓度/(mol·L−1)
2+ 3
[Cu(NH3)4]2+ + 4H2O 0.050 − x
K f\ =
{c ([Cu (NH ) ] )} {c (Cu )} { c (NH ) }
−1
[Ag(NH3)2]+ + Br− + 2H2O x x
\ K \ = K f\ ( [Ag (NH 3 ) 2 ]+ ) · K sp (AgBr) = 5.99×10−6
天津大学无机化学第五版习题答案解析

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pa p (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa 0.2869.3310Pan p n p ⨯===⨯7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ =m f H ∆(CO 2, g) = -393.509 kJ ·mol -121CO 2(g) + 21C(s) → CO(g) m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
天津大学无机化学教研室《无机化学》(第4版)配套题库名校考研真题+课后习题+章节题库+模拟试题下册

1.完成并配平反应方程式:硼砂(N2B4O7)溶液与稀硝酸混合[北京航 空航天大学2010研]
答:Na2B4O7 + 2HNO3(稀) + 5H2O=4H3BO3 + 2NaNO3
2.完成并配平反应方程式:在碱性条件下,红磷与次氯酸钠反应,生 成连二磷酸二氢根离子[中国科学技术大学2008研] 答: 3.完成并配平反应方程式:五氯化磷的氢解[中国科学技术大学2008研] 答:
目 录
第一部分 名校考研真题 第9章 氢、稀有气体 第10章 碱金属和碱土金属元素 第11章 卤素和氧族元素 第12章 氮族、碳族和硼族元素 第13章 过渡金属(一) 第14章 过渡金属(二) 第15章 元素化学综述(自学为 主)
第16章 无机物合成 第17章 生态环境与无机化学 第二部分 课后习题 第9章 氢及稀有气体 第10章 碱金属和碱土金属元素 第11章 卤素与氧族元素 第12章 氮族、碳族和硼族元素 第13章 过渡元素(一) 第14章 过渡元素(二) 第15章 元素化学综述(自学为
2.下面哪个说法是错误的( )。[首都师范大学2010研]
A.碳纳米管具有半导体性
B.碳纳米管具有金属导电性
C.金刚石具有半导体性
D.硅具有半导体性
【答案】B
【解析】碳纳米管具有导电性,是非金属导电性。
3.天然硅酸盐的结构复杂,其基本结构单元为( )。[首都师范大 学2010研] A.SiO2分子 B.SiO32平面三角形 C.SiO4四面体 D.Si2O76-共其用顶点的两个四面体 【答案】C 4.石墨、金刚石、碳纳米管皆为碳单质,其中在碳纳米管中碳原子的 杂化类型 ( )。[电子科技大学2010研] A.与石墨相同 B.与金刚石相同 C.部分与石墨相同部分与金刚石相同 D.与石墨金刚石皆不相同 E.无正确答案可选 【答案】A 【解析】在碳纳米管中,碳原子的杂化轨道类型与石墨相同,皆为sp2 杂化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
天津大学无机化学考试试卷(下册)答案一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X)(每小题1分,共10分)1、( X)在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
2、( X)SnS溶于Na2S2溶液中,生成硫代亚锡酸钠。
3、( X )磁矩大的配合物,其稳定性强。
4、( X)氧族元素氢化物的沸点高低次序为H2O>H2S>H2Se>H3Te。
5、( √)已知[HgCl4]2-的K=1.0⨯10-16,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
6、( √)如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X)硼是缺电子原子,在乙硼烷中含有配位键。
8、( √)在浓碱溶液中MnO4-可以被OH-还原为MnO42-。
9、( √)配合物Na3[Ag(S2O3)2]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
10、( X)Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(每小题1分,共20分)1、在下列各种酸中氧化性最强的是............... ( B)。
(A)HClO3;(B)HClO;(C)HClO4;(D)HCl。
2、下列浓酸中,可以用来和KI(s)反应制取较纯HI(g)的是............... ( C)。
(A)浓HCl;(B)浓H2SO4;(C)浓H3PO4;(D)浓HNO3。
3、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D)。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是因为钛镍合金. ............... ( C)。
(A)机械强度大;(B)熔点高;(C)具有记忆性能;(D)耐腐蚀。
5、在一溶液中加入淀粉溶液和少量NaClO溶液,得到蓝色溶液(a),继续加入NaClO后得一无色溶液,然后加入适量Na2SO3溶液,又复原为(a),Na2SO3溶液逐渐过量时,蓝色褪去,成为一无色溶液(b)。
由此可推断,(a)和(b)溶液含有............... ( B)。
(A)(a)I2,(b)SO42-、IO3-;(B)(a)I2,(b)SO42-、I-;(C)(a)I-,(b)H2S、IO3-;(D)(a)I-,(b)H2S、I-。
6、下列各组离子中每种离子分别与过量NaOH溶液反应时,都不生成沉淀的是............... ( B)。
(A)Al3+、Sb3+、Bi3+;(B)Be2+、Al3+、Sb3+;(C)Pb2+、Mg2+、Be2+;(D)Sn2+、Pb2+、Mg2+。
7、在下列各盐溶液中通入H2S(g)不生成硫化物沉淀的是............... ( D)。
(A)Ag+;(B)Cd2+;(C)Pb2+;(D)Mn2+。
8、决定卤素单质熔点高低的主要因素是............... ( B)。
(A)卤素单质分子的极性大小;(B)卤素单质的相对分子质量的大小;(C)卤素单质分子中的化学键的强弱;(D)卤素单质分子的氧化性强弱。
9、下列各种酸性溶液,能稳定存在的是............... ( D)。
(A)CO32-, Al3+, Mg2+,(B) Br-, NO3-, K+, S2-;(C) CO32-, I-, Na+;(D)Cr2O72-, Fe3+, Co2+。
10、仅用一种试剂,即可将Ag+, Hg2+, Zn2+, Fe3+, Ni2+五种离子区分开,这种试剂可选用............... ( B)。
(A)NH3·H2O;(B)NaOH;(C)H2S;(D)Na2S。
11、下列离子在水溶液中发生歧化反应趋向最大的是............... ( C)。
(A) Fe2+;(B)Co2+;(C)Cu+;(D)Hg22+。
12、下列离子中,顺磁性最强的是............... ( D)。
(A)Ni2+;(B)V2+;(C)Ti3+;(D)Mn2+。
13、NaNO3受热分解的产物是............... ( B)。
(A)Na2O,NO2,O2;(B)NaNO2,O2;(C)NaNO2,NO2,O2;(D)Na2O,NO,O2。
14、将铁粉与铜粉一起放入热硝酸中,充分反应后,铜有剩余,则溶液中还能大量存在的离子是............... ( C)。
(A) Cu2+、Fe3+、NO3-;(B) Cu2+、Fe3+、H+;(C) Cu2+、Fe2+、NO3-;(D) Fe2+、Fe3+、NO3-。
15、下列各组物质中,不能共存的是............... ( B)。
(A) Pb2+、Fe3+;(B) S2-、Al3+;(C) Cu2+、Fe3+;(D) Cr2O72-、CrO42-。
16、欲从含有少量Cu2+的ZnSO4溶液中除去Cu2+,最好加入..............(C)。
(A) NaOH;(B) Na2S;(C) Zn;(D) H2S。
17、下列酸中难溶的酸是..............(B)。
(A) H3BO3;(B) H2SiO3;(C) H3PO4;(D) 冰醋酸。
18、下列各组离子,能用氨水分离的是..............(B)。
(A) Mn2+、Sn2+;(B) Zn2+、Al3+;(C) Co2+、Cu2+;(D) Al3+、Fe3+。
19、下列氯化物中,属于共价化合物的是.............(A)。
(A) HgCl2;(B)KCl;(C) MnCl2;(D) CaCl2。
20、下列各组物质,能自发发生反应的是............(D)。
(A) Cu、Cu2+;(B) Cr2O72-、Cr3+;(C) MnO2、Mn2+;(D) SnCl4、Sn。
三、填充题(根据题意,在下列各题的横线处,填上正确的文字,符号或数值)(本题共10分)1、在[Cu(NH3)4]2+配离子中,Cu2+采用_dsp2_杂化轨道成键,该配离子的几何构型为平面正方形。
2、Na2SO3与__硫粉__共热可制得Na2S2O3,Cl2可将Na2S2O3氧化为__ Na2SO4_。
3、Bi(OH)3在_NaOH_溶液中可被Cl2氧化为_NaBiO3_。
4、AlCl3双聚分子的结构式为:__;其中含有两个_3c-4e_键。
5、用作红色颜料的Fe2O3称为_铁红_。
黄铁矿的化学式为__FeS2_。
6、在Na3PO4, Na2HPO4, NaH2PO4溶液中加入AgNO3溶液,得到的沉淀是_Ag3PO4_。
7、H 3BO3为_一_元__弱酸_,其水溶液显酸性的反应式为_H3BO3 + H2O_[B(OH)4-] + H+。
8、欲增加I2在水溶液中的溶解度,可在其中加入__KI__, 原因是生成_I3-__。
9、变色硅胶能变色是因为含有__CoCl2__,吸水后颜色由__蓝色__变__粉红色__。
10、将固体Hg(NO3)2与单质Hg一起研磨,最终将生成__ Hg2(NO3)2__。
四、填表(本大题共5小题,总计10分)1、鉴定下列离子离子加入试剂现象主要产物Cr3+过量NaOH、H2O2、Pb(NO3)2黄色沉淀PbCrO4PO43-(NH4)2MoO4黄色沉淀(NH4)3PO4·12MoO3·6 H2O 2、写出反应最终产物物质Ni2+Hg2+(NO3-) Cr3+Mn2+加入过量氨水并放置[Ni(NH3)6]2+HgO·NH2HgNO3 Cr(OH)3 MnO(OH)2 3、名称化学式配体配位原子硝酸二氯⋅四氨合铂(IV) [PtCl2(NH3)4](NO3)2 Cl-, NH3 Cl, N4、下列分子中,除含有一般键外,还含有何种键?分子B2H6H2SO4O3π键的名称3c-2e (p-d) π435、写出反应的主要产物物质KMnO4(H+) [Cr(OH)4]- PbS MnO2 加入H2O2 Mn2+, O2 CrO42-, H2O PbSO4, H2O O2, H2O五、配平题(完成并配平下列各反应方程式)(每小题2分,共20分)1、 PCl5 + 4H2O →H3PO4 + 5HCl2、 Cr2O72- + 6I- + 14H+→2Cr3+ + 3I2 + 7H2O3、2Na2S2O3 + I2→Na2S4O6 + 2NaI4、 Al 2O 3 + 3K 2S 2O 7 → Al 2(SO 4)3 + 3 K 2SO 45、Na 2B 4O 7 + CoO → Co(BO 2)2·2NaBO 26、 2Ni(OH)2 + Br 2 + 2OH - → 2NiO(OH)↓ + 2Br - + 2H 2O7、Cr 2O 72- + 2Ba 2+ + 2H 2O → 2BaCrO 4↓ + 2H +8、 2H 3AsO 3 + 3H 2S → As 2S 3↓+ 6H 2O9、Hg 2Cl 2 + 2NH 3 → Hg(NH 2)Cl ↓+ Hg ↓ + NH 4Cl 10、2Pb 2+ + 2CO 32- + H 2O → Pb 2(OH)2CO 3↓+ CO 2↑ 六、根据题目要求,解答下列各题(本题共8分) : 根据下列实验确定数字1-8所代表的物质或现象:红色固体粉末 ( 1 )HNO 3棕色沉淀( 2 )溶液( 3 )浓HCl白色沉淀(4)溶于热水气体(5)K 2CrO 4现象(7)产物(8)通入KI 溶液(6)CCl4层紫红色(1)____Pb 3O 4 ____ (2)___PbO 2________ (3)_____Pb(NO 3)2_______ (4)_____PbCl 2________ (5)____Cl 2_______ (6)____I 2 _________ (7)_______黄色沉淀 _____ (8)_____PbCrO 4______七、计算下列各题(本大题共3小题,总计22分)1、(本小题10分) 已知E (Ag +/Ag)=0.799V ,K (AgBr)=5.0⨯10-13。
E ([Ag(S 2O 3)2]3-/Ag)=0.017V ,计算[Ag(S 2O 3)2]3-的稳定常数;若将0.10mol 的AgBr 固体完全溶解在1L 的Na 2S 2O 3溶液中,Na 2S 2O 3的最小浓度应为多少? 解:Ag + + e → Ag[Ag(S 2O 3)2]3- + e → Ag + 2S 2O 32- E (Ag +/Ag) = E ([Ag(S 2O 3)2]3-/Ag)所以:E (Ag +/Ag) + 0.0592 lg c (Ag +) = E ([Ag(S 2O 3)2]3-/Ag) + 0.0592 lg )(])([23223232--O S c O S Ag c即:0.799 – 0.017 = 0.0592 lg K ([Ag(S 2O 3)2]3-) 则:K ([Ag(S 2O 3)2]3-) = 1.62 ⨯ 1013 AgBr + 2 S 2O 32-[Ag(S 2O 3)2]3- + Br -K =)()()()(])([23223232++---••Ag c Ag c O S c Br c O S Ag c = K (AgBr) ·K ([Ag(S 2O 3)2]3-) = 5.0⨯10-13 ⨯ 1.62 ⨯ 1013= 8.1设 Na 2S 2O 3的最小浓度应为x: 1.8)2.0(1.01.02=-⨯x 解得:x = 0.235 mol ·L -1即Na 2S 2O 3的最小浓度应为0.235 mol ·L -12、(本小题6分) 室温时在1.0L 乙二胺溶液中溶解了0.010molCuSO 4,主要生成[Cu(en)2]2+,测得平衡时乙二胺的浓度为0.054mol ·L -1。
