中考化学复习专题之《溶解度曲线上点的移动》
(word完整版)2015年初三化学溶解度曲线知识点及习题,推荐文档
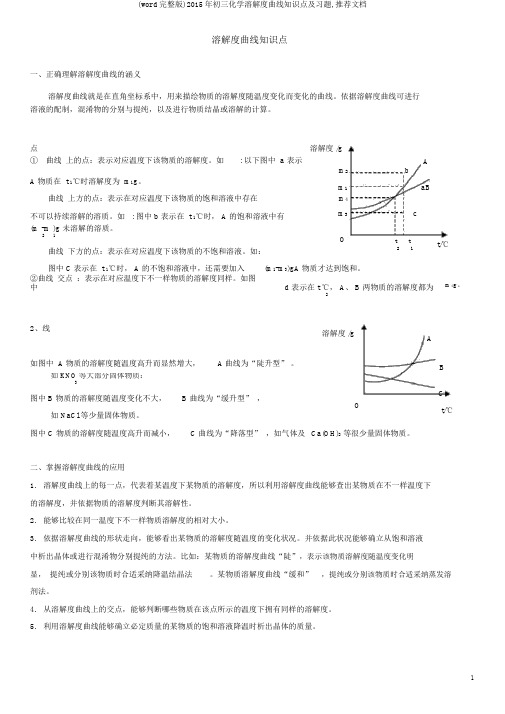
溶解度曲线知识点一、正确理解溶解度曲线的涵义溶解度曲线就是在直角坐标系中,用来描绘物质的溶解度随温度变化而变化的曲线。
依据溶解度曲线可进行溶液的配制,混淆物的分别与提纯,以及进行物质结晶或溶解的计算。
点溶解度 /g① 曲线上的点:表示对应温度下该物质的溶解度。
如: 以下图中 a 表示b Am2A 物质在 t 1℃时溶解度为 m1g。
m1 aB 曲线上方的点:表示在对应温度下该物质的饱和溶液中存在m4不可以持续溶解的溶质。
如 : 图中 b 表示在 t 1℃时, A 的饱和溶液中有m3 c (m -m )g 未溶解的溶质。
2 1 O t t曲线下方的点:表示在对应温度下该物质的不饱和溶液。
如: 2 1 图中 C表示在 t 1℃时, A 的不饱和溶液中,还需要加入(m1-m3)gA 物质才达到饱和。
②曲线交点:表示在对应温度下不一样物质的溶解度同样。
如图中 d 表示在 t ℃, A、 B 两物质的溶解度都为2 t/℃m4g。
2、线溶解度 /gA如图中 A 物质的溶解度随温度高升而显然增大,A曲线为“陡升型”。
B 如 KNO等大部分固体物质:3图中 B 物质的溶解度随温度变化不大, B 曲线为“缓升型” ,C O如 NaCl 等少量固体物质。
t/℃图中 C 物质的溶解度随温度高升而减小, C 曲线为“降落型” ,如气体及Ca(OH)2等很少量固体物质。
二、掌握溶解度曲线的应用1.溶解度曲线上的每一点,代表着某温度下某物质的溶解度,所以利用溶解度曲线能够查出某物质在不一样温度下的溶解度,并依据物质的溶解度判断其溶解性。
2.能够比较在同一温度下不一样物质溶解度的相对大小。
3.依据溶解度曲线的形状走向,能够看出某物质的溶解度随温度的变化状况。
并依据此状况能够确立从饱和溶液中析出晶体或进行混淆物分别提纯的方法。
比如:某物质的溶解度曲线“陡”,表示该物质溶解度随温度变化明显,提纯或分别该物质时合适采纳降温结晶法。
2023年中考化学专题复习课件专题四 溶解度曲线的应用

。
解析:(2)t2 ℃时,a的溶解度为50 g,该温度下,将60 g a物质加入100 g水中,充
分溶解后,只能溶解50 g,所得溶液中溶质与溶液的质量比是50 g∶150 g=1∶3。
(3)t2 ℃时,要使接近饱和的c溶液变为饱和溶液,采用的方法是增加溶质c或恒温
蒸发溶剂。(4)t2 ℃时,溶解度:a>b>c,故该温度下,等质量的a、b、c三种物质的
D.欲使 KNO3 溶液的状态从 b 点转化为 c 点,可采取降低温度的措施
解析:溶解度曲线上的点表示该温度下的饱和溶液,a 点表示 30 ℃时,硝酸钾的溶解度
为 45.8 g,A 正确;在饱和溶液中,溶质的质量分数=
.
×100%,B 正确;溶解度
+.
曲线上的点表示该温度下的饱和溶液,溶解度曲线下面的点表示该温度下的不饱和溶
时要注意,物质完全溶于水后所得溶液不一定是不饱和溶液,也可能是恰好饱和。
[典例8](2021济宁)为探究硝酸钾的溶解性,进行了如图实验(见图Ⅰ),结合KNO3溶
解度曲线(见图Ⅱ)判断,下列说法错误的是(
)
A.溶液②、溶液④一定是饱和溶液
B.溶液①、溶液③一定是不饱和溶液
C.溶液②、溶液③的质量:③>②
系是乙>甲=丙;将这三种溶液分别升温到t2 ℃,甲和乙溶解度变大,由饱和变为不
饱和,溶质质量分数不变,还是乙>甲,丙升温后,溶解度变小,析出晶体,溶质质量
分数变小,所以升温到t2 ℃,所得溶液中溶质质量分数大小关系是乙>甲>丙。
答案:(1)C
(2)为了将接近饱和的丙溶液变为饱和溶液,可采用的方法有
①一定是不饱和溶液,溶液③的状态不能确定,故 B 错误;溶液②、溶液③的质量:③>
溶解度曲线点的移动专题

D C
T
初三化学 第1页 共1页
Байду номын сангаас
S C (不存在)
A (不饱和) B (恰好饱和)
T 二、反常曲线: 点的移动 升温 向右平移至曲线,沿曲线 下移(先不变,饱和后变 小) 沿曲线下移(变小) 降温 向左平移 (不变) 向左平移 (不变) 加溶质(蒸发溶剂) 加溶剂
C 点(浓 度)
D 点(浓 度)
S
竖直上移至曲线,静止 竖 直 下 移 (先变大,饱和后不变) (变小) 静止(不变) 竖直下移 (变小)
溶解度曲线点的移动
一、正常曲线: 点的移动 A 点(浓 度) B 点(浓 度) 升温 向右平移 (不变) 向右平移 (不变) 降温 加溶质(蒸发溶剂) 加溶剂 向左平移至曲线, 沿曲线下 竖直上移至曲线,静止 竖 直 下 移 移(先不变,饱和后变小) (先变大,饱和后不变) (变小) 竖直下移 沿曲线下移(不变) 静止(不变) (变小)
河南中考化学溶解度曲线专题复习

专题复习:溶解度曲线❖溶解度曲线:溶解度随温度变化的曲线❖解析近六年中考试题,使同学们再也不怕溶解度曲线的有关题目。
这8年河南中考究竟在考什么,无非以下几点:❖第一,根据溶解度曲线读出一条信息(2005年,2007年),根据溶解度曲线读出某物质在一定温度下的溶解度(2008年,2010年)❖第二,对于溶解度曲线是溶解度随温度升高而减小的物质,饱和溶液和不饱和溶液之间的转化所采取的措施(2005年,2007年,2011年第5题c选项),对于溶解度曲线是随温度升高而减小的物质,饱和溶液转变成不饱和溶液,可以采取降温,增加溶剂这两个措施,不饱和溶液向饱和溶液转化,可以采取升温,增加溶质,蒸发溶剂这三个措施。
剩余固体继续溶解可以采取的措施(2006年)事实上,剩余固体继续溶解,就是要么改变温度增加溶解度,要么就是增加溶剂。
❖第三,考察同学们对溶液是饱和溶液还是不饱和溶液的判断,对于溶液是否饱和,主要有两种判断方法:一是观察是否有剩余固体,有固体剩余一定是饱和溶液(2006年)。
二是根据溶解度进行计算,判断溶液是否饱和(2010年)。
❖第四,在溶解度曲线的交点处,A,B饱和溶液溶质质量分数大小的比较(2011年第5题c选项),以及升温或降温后溶质质量分数大小的比较(2008年,2009年)。
在溶解度曲线的交点处,A,B饱和溶液的溶质质量分数是相等的关系,实质上,对于饱和溶液而言,溶质质量分数大小的比较完全可以转化到比较溶解度大小上,换言之,溶解度越大,其饱和溶液溶质质量分数就越大。
❖第五,同温度下同质量的A,B的饱和溶液降温到交点处后析出晶体多少的比较(2013年),比较方法:降温后溶解度大的析出的晶体较比溶解度小的析出的晶体要多。
❖第六,析出晶体质量的计算。
2011年河南中考还对溶解度定义的理解进行了考察❖ 1. (1)如图是氢氧化钙的溶解度曲线,从图中你能得到的信息是(写出一条即可)_________________________________。
专题5溶解度及溶解度曲线(课件)-2023年中考化学新课标一轮复习

36 × 64
A.该溶液是饱和溶液
64g水中最多溶解NaCl:
= 23.04g
100
B.溶液中Na+和Cl-个数一定相等 得到饱和溶液的质量:
C.溶液质量为100克
64+23.04=87.04(g)
溶质、溶剂的质量比:36∶100 = 9∶25
D.溶质与溶剂质量比为 9∶25
考点突破
6.我国古代提纯焰硝(含KNO3和少量NaCl、CaCl2等)工艺的主要过程示意如图所示。
专题5
溶解度及溶NE
溶解度
溶液的浓度
1、溶液的浓度常用溶质的 质量分数
来表示,即溶质的质量与溶液的质量
比。
溶质质量
(1)溶质质量分数(%)=
×100%
溶液质量
溶剂质量
注意: ① 溶液质量 = 溶质质量
+
;
② 溶质的质量是指已经溶解在水中的那一部分溶质的质量。
溶解度
③ 饱和溶液中溶质质量分数(%)=
,
(3)由图可知,a、b两物质的溶解度受温度影响
较大的是 a 。
考点突破:比较溶解度大小,一定要指明温度。
考点突破
2.(1)1 ℃时,100g水中最多溶解 20
g物
质c恰好形成饱和溶液;
(2)2 ℃时,向50g水中加入30g物质a,充
分溶解后,得到的溶液是 饱和
(填“饱和”
或“不饱和”)溶液,此时溶液的质量为 g。
硝酸钾 ;、氯化铵等
; 氯化钠
。氢氧化钙
气体的溶解度
减小
减小
结晶
不大
较大
考点突破
1.室温时,向25g某固体中分批次加人水,充分搅拌,结果如图所示(保持温
中考化学复习专题之《溶解度曲线上点的移动》PPT

A点(浓度)
B点(浓度)
向右平移 (不变)
竖直下移 (变小)
二、反常曲线 :
S
S
D饱和
C不饱和
T T
点的移动 C点(浓度)
升温
向右平移至 曲线,沿曲 线下移(先 不变,饱和 后变小) 沿曲线下移 (变小)
降温
加溶质(蒸发溶剂)
加溶剂
向左平移 (不变)
竖直上移至曲线, 静止(先变大,饱 和后不变)
A B -----------------------------
10
7、 (2017年肇庆市)关于右图两种物质的溶解度曲线 说法正确的是 ( C ) A.升高温度,可使甲的不饱 溶液变为饱和溶液。 B.50℃时甲的饱和溶液溶质 质量分数为40%。 C.20℃时,甲、乙两种物质 溶解度相等。 D.要使乙从其浓溶液中析出, 可冷却乙的热浓溶液。
KNO3
NaCl
t
2
t℃
2、 (2017年晋江市)右图是甲、乙两种固体物质 的溶解度曲线。下列说法正确的是( B ) A.甲物质的溶解度为 60g。 B.t℃时,甲、乙两物 质的溶解度相等。 C.升高温度可使不饱和 的甲溶液变为饱和。 D.乙物质的溶解度随温 度的升高而增大。
3、 (2017年安徽省)已知KNO3的溶解度随温度的 升高而增大。下图各图是某KNO3饱和溶液的浓 度随温度升高而变化的图像(不考虑溶剂的质量变 化),其中正确的是 ( C )
13、 (2017年宿迁市)根据图8所示的溶解度曲线,判断 下列说法中不正确的是( B )
溶解度/g
E
c ----------- 甲
乙
A B
O t1
F ----------O
溶解度曲线点的移动

①升高温度 ②降低温度 ③恒温蒸发溶剂 ④添加对应溶质 ⑤பைடு நூலகம்释溶液
A点的变动 向右平移
B点的变动
(2)将该溶液从状态A改变为B有多种途径。试设计并简述 一操作最简单、结果最准确的实验途径:
2、t℃时,根据某物质在不同质量的水中达 到饱和状态时所溶解的质量绘制成右图中的 斜线。下列说法中正确的是( )
溶解度曲线点的移动
师宗县龙庆民族中学 孟永平
复习:饱和溶液与不饱和溶液的相互转化
3、改变温度
不 饱 和 溶 液
2、恒温蒸发溶剂 1、增加溶质
饱 和
1、减少溶质
溶 液
2、增加溶剂
3、改变温度
改变一个条件使溶解度曲线上点的移动分三种 情况:横向平移、垂直移动或者是沿着溶解度曲线 上下移动。
s
一、正常曲线
甲图中的R溶液从A状态变到B状态,请设计并简述两个简单的实验操作途径:
a.
、
b.
;
c.A状态由两种不同途径变到B状态时,溶液的溶质质量分数是否相等———(填“是”
或“否”)。
②乙图是表示M、N两种物质饱和溶液的溶质质量分数随温度变化的曲线。现分别
向50g M、80g N固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,冷
C点 (浓度)
D点 (浓度)
升温 向右平移至曲线,沿曲线下移 (先不变,饱和后变小)
沿曲线下移 (变小)
降温 向左平移 (不变)
向左平移 (不变)
加溶质(蒸发溶剂) 加溶剂
垂直上移至曲线,静止 垂直下移 (先变大,饱和后不变) (变小)
静止 (不变)
垂直下移 (变小)
三、例题解析
1、溶解度曲线中的任何一点都表示溶液的一种特定状态。当 溶液状态发生变化时,表示溶液状态的点的位置(坐标)也 将发生相应的改变。某固态物质的溶解度曲线如图所示,试 根据右图回答下列问题。 (1)当处于A、B点状态的该溶液分别发生下列变化(其他条 件不变)时,试参考表中例示描述A、B点的变动过程。
溶解度曲线点的移

溶解度曲线点的移动与相分离过程有关。当溶质浓度超过溶解度时,会发生相分 离,产生固液或液液相分离现象。相分离过程会影响溶解度曲线点的移动。
感谢您的观看
THANKS
溶质的性质
不同物质具有不同的溶解度,溶质的性质如分子结构、晶体结构等也 会影响其溶解度。
02
溶解度曲线点的移动
温度对溶解度曲线点的影响
升高温度
溶解度曲线点向右移动,表示溶 解度增加。
降低温度
溶解度曲线点向左移动,表示溶 解度减少。
压力对溶解度曲线点的影响
增大压力
溶解度曲线点向右移动,表示溶解度 增加。
溶解度曲线点的移动
目录
• 溶解度曲线点的概念 • 溶解度曲线点的移动 • 溶解度曲线点的应用 • 溶解度曲线点的实验研究 • 溶解度曲线点的理论分析
01
溶解度曲线点的概念
溶解度曲线的定义
溶解度曲线是描述物质溶解度随 温度变化的曲线,通常以温度为
横坐标,溶解度为纵坐标。
溶解度是指在一定温度和压力下, 溶质在溶剂中的最大溶解量。
分离过程改进
溶解度曲线点有助于优化混合物 的分离过程,如蒸馏和萃取,从 而提高产品的纯度和收率。
结晶过程控制
溶解度曲线点可用于控制结晶过 程,以获得特定形状和大小的晶 体,从而提高产品的质量和性能。
在环境工程中的应用
污染物去除
溶解度曲线点可用于指导污染物去除过程,如吸附和萃取,以提 高污染物的去除效率和效果。
废水处理
溶解度曲线点可用于优化废水处理过程,如沉淀和过滤,以提高废 水的处理效果和降低处理成本。
气体分离
溶解度曲线点可用于指导气体分离过程,如吸收和吸附,以提高气 体的分离效率和纯度。
【火线100天】中考化学 滚动小专题(三)溶解度曲线及其应用

滚动小专题(三) 溶解度曲线及其应用一、溶解度曲线的意义1.溶解度曲线上的每个点表示的是某温度下某种物质的溶解度,即曲线上的任意一点都对应有相应的温度和溶解度。
2.溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。
3.两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
4.在溶解度曲线上的每一个点都表示溶质在某温度下的溶解度,此时的溶液必然是恰好饱和的溶液;在溶解度曲线下方的点,则表示溶液是不饱和溶液;在溶解度曲线上方的点,则表示未溶解的溶质与饱和溶液共存的混合物或过饱和溶液。
二、溶解度曲线的应用1.溶解度曲线上的点有三个方面的作用:(1)根据已知温度查出有关物质的溶解度;(2)根据物质的溶解度查出对应的温度;(3)比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
2.溶解度曲线也有三个方面的应用:(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况;(2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小;(3)根据溶解度曲线,选择分离某些可溶性混合物的方法。
3.如果要使不饱和溶液(曲线下方的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。
类型1 溶解度曲线的意义例1 (2014·潍坊)甲、乙、丙三种固体物质的溶解度曲线如图所示。
下列说法正确的是( )A.把a1℃时甲、乙的饱和溶液升温到a2℃仍是饱和溶液B.a2℃时,丙的溶液的质量分数大于乙的溶液的质量分数C.三种物质的溶解度都随温度的升高而增大D.a3℃时,三种物质的溶解度大小关系:甲>丙>乙思路点拨:根据甲、乙、丙三种固体物质的溶解度曲线可知,a1℃时甲、乙的饱和溶液升温到a2℃都为不饱和溶液;a2℃时,乙和丙的溶液是否达到饱和都无法确定,所以无法比较其溶液中溶质质量分数的大小;丙物质的溶解度随温度的升高而减小。
