高考化学一轮复习 第一节 化学能与热能习题讲解课件
合集下载
第一节化学能与热能考点(一)焓变热化学方程式课件新高考化学一轮复习

2.某反应使用催化剂后,其反应过程中能量变化如图。
下列说法不正确的是
()
A.反应②为放热反应
B.ΔH=ΔH2-ΔH1 C.反应①旧键断裂吸收的能量大于新键形成释放
的能量
D.使用催化剂后,活化能降低
解析:ΔH=-(-ΔH2-ΔH1),B 不正确。 答案:B
题点(二) 焓变的有关计算
3.(2021·浙江选考)已知共价键的键能与热化学方程式信息如下表:
()
生成O2和H+,即2H2O-4e- ==== O2↑+4H+,阴极上H2O得电子生成H2和OH-,即
A.428 kJ·mol 离子浓度,利用同离子效应,促进NH4VO3尽可能析出完-全1 。
共价键
H—H
H—O
键能/(kJ·mol ) 436 463 eB..冷Na却C结lO晶通:过提氧取化溶灭解活度病随毒温度变化较大的溶质-、1易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
3)Ksp(CaF2)=5.29×10-9,除铁后所得100 mL溶液中c(Ca2+)=0.01 mol·L-1,加
(1)常温常压下,11.2 L甲烷气体含有的甲烷分子数为0.5NA( )
的pH=10时,溶液中c(H+)=10-10mol·L-1,c(OH-)=10-4mol·L-1,则Ksp[Co(OH)2]
高低 的总能量,ΔH<0 以阳极的电极反应式为2Cl--2e-====Cl2↑,故A正确;由图可知,戊室电极与电
3.(1)101 kPa 时,1 mol CH4 完全燃烧生成液态水和 CO2 气体,放出 890.3 kJ 的热量,反应的热化学方程式为___________________________________。
高考化学一轮复习课件:6.1化学能与热能(1)基本概念一课过(过基础)

应
⑥大多数化合反应 ⑤大多数的分解反应
知识点一 焓变、热化学方程式 考点
提醒
知识点一 焓变、热化学方程式 考点
知识点一 焓变、热化学方程式 考点
知识点一 焓变、热化学方程式 考点
知识点一 焓变、热化学方程式 考点
对点训练
知识点一 焓变、热化学方程式 考点
知识点一 焓变、热化学方程式 考点
知识点二 燃烧热、中和热、能源考点
考点
知识点二 燃烧热、中和热、能源考点
知识点二 燃烧热、中和热、能源考点
知识点二 燃烧热、中和热、能源考点
知识点二 燃烧热、中和热、能源考点
知识点三 盖斯定律
考点
知识点三 盖斯定律
知识点三 盖斯定律
考点
知识点三 盖斯定律
考点
知识点三 斯定律
考点
知识点一 焓变、热化学方程式 考点
知识点一 焓变、热化学方程式 考点
放热 反应
吸热 反应
①可燃物的燃烧 ①弱电 解质 的电 离
②酸碱中和反应 ②盐类 的水解反应
常
③金属与酸的置换 见
③Ba(OH)2·8H2O与NH4Cl的
反应
反应
反
应 ④物质 的缓 慢氧化 ④C和H2O(g)、C和CO2的反
⑤铝热 反应
考纲要求
教学建议
目 录
01 焓变、热化学方程式 02
燃烧热、中和热、能源
03 盖斯定律
04 课时跟踪检测
知识点一 焓变、热化学方程式 考点
知识点一 焓变、热化学方程式
知识点一 焓变、热化学方程式 考点
知识点一 焓变、热化学方程式 考点
知识点一 焓变、热化学方程式 考点
知识点一 焓变、热化学方程式 考点
高三化学第一轮复习能与热能人教.pptx
(6)NH4NO3固体溶于水时吸热属于吸热反应。 解析:该过程中没有新物质生成,不属于化学反应。
(× )
2.已知反应 X+Y===M+N 为吸热反应,对这个反应的下列说
法中正确的是
(
)
A.X 的能量一定低于 M 的能量,Y 的能量一定低于 N 的能量
B.因为该反应为吸热反应,故一定要加热反应才能进行
((32))根 已据 知拆 C 开 原子 1 m 守o恒l H有—:HC键 2H、 5O1Hm~ol2NC— O2H~键 2C、a1Cm Oo3。 l N生≡成N 1键00分g别 C需a要 CO的3 能 沉量 淀是 ,乙43醇6 为 kJ、 0.359m1 oklJ,、则 9461 kmJo,l 则乙N醇2燃 与烧H放 2 反2应 Q 生 kJ成热N量H,3 据 的此 热可 化写 学出 方反 程应 式的 为热 _N_化 _2(_g学 _)_+方 __3程 _H_2式 _(g_: )_=C_=_2=H _2_5N_O_HH_3_((l_g)_)+_ 3O2(g)===2CO2(g) + _Δ_3H_H_=_2O_-_(_l9)_2_k_ΔJ_H·_m_=o_l_- -_1_2_Q。kJ·mol-1。 (3)在 25 ℃、101 kPa 下,一定质量的无水乙醇完全燃烧时放出
(
)
C.催化剂能降低该反应的活化能
A 项D,.由逆图反可应以的看活出化,能反大应于物正的反总应能的 量活 低化 于能 生成物的总能量,故该
反应为吸热反应,A 错;B 项,催化剂不能改变反应的焓变,B 错;
2.(2014·浙江联考)下列反应符合如图所示的是
(
)
A.铝片与盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl晶体的反应
高三化学一轮复习 第六章第1讲化学能与热能课件

该物质的物质的量,可以是整数,也可以是分数。且化学
计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也
要加倍。
基础再现·深度思考
第1讲
深度思考
6.已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水
蒸气,放出484 kJ热量,下列热化学方程式正确的是
本 课 栏 目
(D ) A.H2O(g)===H2(g)+12O2(g) ΔH=-242 kJ·mol-1
第1讲
第六章 化学反应与能量
本
第 1 讲 化学能与热能
课
栏 目
[考纲解读] 1.了解化学反应中能量转化的原因,能说出常
开 关
见的能量转化形式。2.了解化学能与热能的相互转化,了解
吸热反应、放热反应、反应热等概念。3.了解热化学方程式
的含义,能用盖斯定律进行有关反应热的简单计算。4.了解
能源是人类生存和社会发展的重要基础,了解化学在解决能
基础再现·深度思考
第1讲
考点三 中和热和燃烧热
比较项目
燃烧热
中和热
本 课 栏
相 能量变化
放热 反应
目 开
同点 ΔH
ΔH < 0,单位: kJ·mol-1
关
不
反应物的量 1 mol (O2的量 可能是1 mol,也可
不限)
能是0.5 mol
同点
生成物的量
不限量
H2O是 1 mol
基础再现·深度思考
2.焓变、反应热 (1)定义:在 恒压 条件下进行的反应的热效应。
(2)符号: ΔH 。 (3)单位: kJ·mol-1 或 kJ/mol 。
基础再现·深度思考
第1讲
2020届高考化学一轮复习化学能与热能课件(28张)

3.(RJ必修2·P38改编)常温下,1 mol化学键分解成气 态原子所需要的能量用E表示。结合表中信息判断下 列说法不正确的是 ( )
共价键
E(kJ· mol-1)
H—H 436
F—F 157
H—F 568
H—Cl 432
H—I 298
A.432 kJ·mol-1>E(H—Br)>298 kJ·mol-1 B.表中最稳定的共价键是H—F键 C.H2(g)→2H(g) ΔH=+436 kJ·mol-1 D.H2(g)+F2(g)====2HF(g) ΔH=-25 kJ·mol-1
(2)计算公式:
ΔH=- 0.418t2 t1kJ·mol-1。
0.025
t1——起始温度,t2——终止温度。
(3)注意事项: ①泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温隔 热,减少实验过程中的热量损失。 ②为保证酸完全中和,采取的措施是_使__碱__稍__过__量__。
【微点拨】 注意两个1 mol,燃烧热要求可燃物必须是1 mol,中和 热要求产物水必须是1 mol。
2.(RJ选修4·P3改编)下列关于热化学反应的描述中 正确的是 ( ) A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则 H2SO4和Ca(OH)2反应的中和热ΔH=2× (-57.3) kJ·mol-1 B.CO(g)的燃烧热是283.0kJ·mol-1,则2CO2(g)==== 2CO(g)+O2(g)的ΔH=2×(+283.0)kJ·mol-1
8H2O ====BaCl2+2NH3↑ 酸的反应
+
③酸碱中和反应
③C+CO2
2CO
高三化学一轮复习化学能与热能精品PPT课件

未标注状态 • (2)500℃、30Mpa下,将0.5molN2(g)和1.5molH2
(g)置于密闭容器中充分反应生成NH3(g),放热 19.3kJ,其热化学方程式为:
• N2(g)+3H2(g)⇌2NH3(g)△H=-38.6kJ•mol-1
未标注反应条件
可逆反应中的△H表示反应进行到底时的能量变化
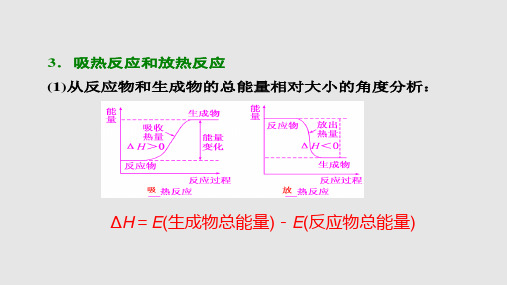
△H=生成物的总能量 - 反应物的总能量
-
+
当反应物的总能量 高于生成物时,该 反应为放热反应
当反应物的总能量 低于生成物时,该 反应为吸热反应
一、反应热与焓变
• 2、反应热的计算方法 • ②微观角度 • 化学反应的实质是:
反应物化学键的断裂和生成物化学键的形成
吸热
放热
断键吸收的热量<成键放出的热量
能量守恒
煤转化为水煤气之后可以使煤燃烧放出更 多的热量吗?
煤的气化 直接气化:使煤与氢气作用生成液体燃料; 间接气化:先转化为CO和H2,再在催化剂作用下合成 甲醛等。写出CO和H2合成甲醛的热化学方程式。 CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ·mol-1
目前可使用铜基催化剂催化该反应,请用画出反应过 程中的能量变化情况,并用曲线I和曲线II分别表示不 使用催化剂和使用催化剂的两种情况,
不是生成稳 定化合物
燃料的系数 不是1
燃烧热定义:在101kPa时,1mol物质完全燃烧生 成稳定的氧化物时所放出的热量。
表示燃烧热的热化学方程式注意: 1、生成物是常温下完全燃烧时的稳定氧化物 2、燃料的系数为1
二、热化学方程式
• 3、书写热化学方程式的注意事项:
配平方程式
标明各物质的聚 集状态(g、l、s)
(g)置于密闭容器中充分反应生成NH3(g),放热 19.3kJ,其热化学方程式为:
• N2(g)+3H2(g)⇌2NH3(g)△H=-38.6kJ•mol-1
未标注反应条件
可逆反应中的△H表示反应进行到底时的能量变化
△H=生成物的总能量 - 反应物的总能量
-
+
当反应物的总能量 高于生成物时,该 反应为放热反应
当反应物的总能量 低于生成物时,该 反应为吸热反应
一、反应热与焓变
• 2、反应热的计算方法 • ②微观角度 • 化学反应的实质是:
反应物化学键的断裂和生成物化学键的形成
吸热
放热
断键吸收的热量<成键放出的热量
能量守恒
煤转化为水煤气之后可以使煤燃烧放出更 多的热量吗?
煤的气化 直接气化:使煤与氢气作用生成液体燃料; 间接气化:先转化为CO和H2,再在催化剂作用下合成 甲醛等。写出CO和H2合成甲醛的热化学方程式。 CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ·mol-1
目前可使用铜基催化剂催化该反应,请用画出反应过 程中的能量变化情况,并用曲线I和曲线II分别表示不 使用催化剂和使用催化剂的两种情况,
不是生成稳 定化合物
燃料的系数 不是1
燃烧热定义:在101kPa时,1mol物质完全燃烧生 成稳定的氧化物时所放出的热量。
表示燃烧热的热化学方程式注意: 1、生成物是常温下完全燃烧时的稳定氧化物 2、燃料的系数为1
二、热化学方程式
• 3、书写热化学方程式的注意事项:
配平方程式
标明各物质的聚 集状态(g、l、s)
高考专题:化学能与热能第一课时课件高三高考化学一轮复习

共价键
H—H F—F H—F
H—Cl
H—I
E(kJ·mol-1)
436
157
568
432
299
A.299 kJ·mol-1<E(H—Br)<432 kJ·mol-1 B.表中最稳定的共价键是H—F键
C.H2(g)=2H(g) ΔH=+436 kJ·mol-1 D.H2(g)+F2(g)=2HF(g) ΔH=-25 kJ·mol-1
7.肼(H2N—NH2)是一种高能燃料,有关化学反应的能 量变化如图所示。已知断裂1 mol化学键所需的能量 (kJ):N≡N为942、O=O为500、 N—N为154,O—H 为452.5,则断裂 1 mol N—H所需的 能量(kJ)是( B )
A.194
B.391
C.516
D.658
真题再现
小于0。
解析 观察起始态物质的相对能量与终态物质的相对能量知,终态物质相对能量低于始态物质相对能量,说明该反应是放热反应,ΔH
学方程式。 小于0。
可知水煤气变换的ΔH
0(填“大于”“等于”或“小于”)。
在方程式后写出△H ,并根据信息注明△H的“+”或‘“-”’
(2)意义:不仅表明化学反应中物质的变化,也表明了 (1)从化学键角度理解:
该历程中最大能垒(活化能)E正=
eV,写出该步骤的化学方程式__________________
通常主要表现为热量的变化。
0 kJ的热量,则该反应的热化学方程式为_________________________________________。
E(kJ·mol-1)
第一课时 。
(3)化学反应的反应热用一定条件下的焓变表示,符号为ΔH,单位为kJ·mol-1 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精品
12
[高考考查层面] 命题点 1 1.解析:A 项,生成的是 2 mol H2O(l);B 项,应生成 H2O(l);
D 项,辛烷应为 1 mol。 答案:C 2.解析:浓硫酸溶于水放热;稀醋酸与氢氧化钠溶液反应过程 中醋酸电离吸热。 答案:D
精品
13
命题点 2 1.解析:写出在测量并计算反应放出的热量时用到的公式为:
2.解析:图示反应物的总能量低,故为吸热过程,只有 B 项符
合。
答案:B
精品
4
[考点达标层面] 1.解析:由图可知这是一个吸热反应,但发生吸热反应不一定需
要加热,A 错误;吸热反应 ΔH>0,B 错误,C 正确;断键需 要能量,D 错误。 答案:C 2.解析:从图像中分析,总反应的能量变化应为 E2 与 E3 的差值, A 错误;O3 和 O 的能量要高于 2O2 的能量,故 O 和 O3 反应生 成 O2 的反应为放热反应,B 错误;从盖斯定律知,将两个反应 叠加即得总反应,则 ΔH 也是由两个反应的焓变相加而得的,C 正确;大气层中的臭氧可以再生,D 错误。 答案:C
Q=mcΔt,理解各符号表示的物理意义即可:m 表示④ 反应 后溶液的质量,c 表示③比热容 ,Δt 表示⑥反应前后温度变 化,C 正确。 答案:C
精品
14
2.解析:由图可知,加入 5 mL 盐酸时混合液的温度达到 22 ℃, 故环境的温度应低于 22 ℃;反应放热,由化学能转化为热能; 恰 好 反 应 时 放 出 热 量 最 多 , NaOH 溶 液 的 浓 度 为 : 1.0 mo2l·0L×-11×0-330×L 10-3L=1.5 mol·L-1;有水生成的反应不一 定 是 放 热 反 应 , 如 Ba(OH)2·8H2O + 2NH4Cl===BaCl2 + 2NH3↑+10H2O 是吸热反应。 答案:B
精品
3
命题点 2
1.解析:A 项,由图可以看出,反应物的总能量低于生成物的
总能量,故该反应为吸热反应,A 错;B 项,催化剂不能改
变反应的焓变,B 错;C 项,由图像可以看出,催化剂能降
低该反应的活化能,C 正确;D 项,由图像可以看出 E1>E2, 即逆反应的活化能小于正反应的活化能,D 错。
答案:C
精品
2
2.解析:已知 X+Y===M+N ΔH>0,说明 X 与 Y 总能量低于 M 与 N 总能量,A 错误,D 正确;破坏反应物中的化学键所吸 收的能量大于形成生成物中化学键所放出的能量,C 错误;吸 热反应有的不需要加热也可反应,如氢氧化钡晶体与氯化铵混 合搅拌即可发生反应,B 错误。 答案:D
燃烧热的热化学方程式。
答案:C
精品
9
[考点达标层面] 1.解析:写热化学方程式时要注意其与普通化学方程式不同的几
点:(1)产物的稳定状态,H2O 为液态,C 的稳定化合物为 CO2; (2)单位是 kJ·mol-1,不是 kJ;(3)数值,ΔH 的数值要与热化学 方程式中计量系数保持一致;(4)符号,吸热用“+”,放热用 “-”。②④符合要求。 答案:B
+2H2O(l) ΔH=-1 427.2 kJ·mol-1。
(2)N2(g)+3H2(g)===2NH3(g) ΔH=(946+436×3-
391×6)kJ·mol-1=-92 kJ·mol-1。
精品
6
(3)根据 C 原子守恒有:C2H5OH~2CO2~2CaCO3。生成 100 g CaCO3 沉淀,乙醇为 0.5 mol,则 1 mol 乙醇燃烧放 2Q kJ 热量, 据此可写出反应的热化学方程式:C2H5OH(l)+3O2(g)===2CO2(g) +3H2O(l) ΔH=-2Q kJ·mol-1。 答案:(1)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l)
精品
8
Байду номын сангаас
命题点 2
1.解析:A 项,表示燃烧热时,应生成稳定的氧化物,这时水的状
态应为液态;B 项,中和反应为放热反应,ΔH 为负值;D 项,
未注明物质的聚集状态。
答案:C
2.解析:由题设知 2 mol CO2 → 2b kJ → 1 mol C2H2,则乙炔燃烧 的 热 化 学 方 程 式 为 C2H2(g) + 5/2O2(g)= = = 2CO2(g) + H2O(l) ΔH=-2b kJ/mol。注意审题,题目并没有要求一定写表示乙炔
ΔH=-1 427.2 kJ·mol-1 (2)N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1 (3)C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)
ΔH=-2Q kJ·mol-1
精品
7
2.解析:由图可知,产物总能量低于反应物总能量,该反应是放 热反应,ΔH=E1-E2=134 kJ·mol-1-368 kJ·mol-1=-234 kJ·mol-1。 答案:NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1
精品
5
考点二
[教材知识层面]
1.物质的量 反应热 2.物质 能量 3.聚集状态 数值 单位 [高考考查层面]
命题点 1
1.解析: (1)2 g SiH4 自燃放出热量 89.2 kJ,1 mol SiH4 自燃放出
热量 1 427.2 kJ,故热化学方程式为 SiH4(g)+2O2(g)===SiO2(s)
精品
10
2.解析:因 1 mol 甲醇燃烧生成 CO2 和液态水,放出 22.68 kJ/g×32 g=725.8 kJ热量,所以 2 mol 甲醇燃烧生成 CO2 和液态水的 ΔH =-1 451.6 kJ/mol。 答案:B
精品
11
考点三 [教材知识层面] 1.<0 1 mol 1 mol 1 mol 1 mol 水 -57.3 kJ·mol-1 2. 环形玻璃搅拌棒 温度计 (3)①保温隔热,减少实验过程中的 热量损失 ②碱稍过量 偏小 3.不可 可再生
第一节 化学能与热能 考点一 [教材知识层面] 1.(1)化学键的断裂 化学键的形成 (2)物质 能量 热量 2.(1)放出或吸收 (2)kJ/mol 3.(1)吸 放
精品
1
[高考考查层面] 命题点 1 1.解析:(2)化学反应中的能量变化也有化学能与光能或电能间的
相互转化。(4)物质在三态变化中涉及能量变化,但三态变化不 属于化学变化。(5)该过程是物理变化过程,其能量变化不能称 为反应热。(6)该过程中没有新物质生成,不属于化学反应。 答案:(1)√ (2)× (3)× (4)× (5)× (6)×
