北京大学中级无机化学答案
中级无机化学习题答案已打印

第一章、酸碱理论1.下列化合物中,哪些是路易斯酸,哪些是路易斯碱?BH4-,PH3,BeCl2,CO2,CO,Hg(NO3)2,SnCl2解答:路易斯酸BeCl2,CO2,CO,Hg(NO3)2,SnCl2路易斯碱PH3,CO,SnCl22.写出下列物种的共轭酸和共轭碱:NH2,NH2,H2O,HI,HSO4-解答:共轭酸共轭碱NH3:NH4+ NH2-NH2-:NH3NH2-H2O:H3O+OH-HI:I-HSO4-:H2SO4SO42-3.下列各对中哪一个酸性较强?并说明理由。
(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+ (b) [Al(H2O)6]3+和[Ga(H2O)6]3+(c) Si(OH)4 和Ge(OH)4 (d) HClO3和HClO4(e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4解答:(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+路易斯酸性:前者,中心离子电荷高,吸引电子能力大质子酸性:前者,中心离子电荷高,对O的极化能力大,H+易离解;(b)[Al(H2O)6]3+和[Ga(H2O)6]3+路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(c) Si(OH)4 和Ge(OH)4路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(d) HClO3和HClO4 (e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4均为后者,非羟基氧原子多,酸性越强。
4.应用Pauling规则,(1) 判断H3PO4(pKa=2.12)、H3PO3(pKa=1.80)和H3PO2(pKa=2.0)的结构;(2) 粗略估计H3PO4、H2PO4-和HPO42-的pKa值。
解答:(1)根据pKa值判断,应有相同非羟基氧原子。
(2)H3PO4:一个非羟基氧原子,pKa值约为2;H2PO4-pKa值增加5,约为7;HPO42-pKa约为12。
中级无机课后题答案

5 解释下列事实:①[ZnCl4]2-为四面体构型,而[PdCl4]2-却为平面正方形?解:其中Zn 为第一过渡系元素,Zn2+为d10 组态,不管是平面正方形还是四面体其LFSE 均为0,当以sp3 杂化轨道生成四面体构型配合物时配体之间排斥作用小;而Pd 为第三过渡系元素(△大)且Pd2+为d8 组态,易以dsp2 杂化生成平面正方形配合物可获得较多LFSE,所以[PdCl4]2-为平面正方形。
②Ni(II)的四配位化合物既可以有四面体构型也可以有平面正方形构型,但Pd(II)和Pt(II)却没有已知的四面体配合物?答:四配位化合物既可以以sp3 杂化生成四面体构型配合物也可以以dsp2 生成平面正方形型配合物,作为d8 组态的离子,若以dsp2 杂化生成平面正方形配合物可获得较多LFSE.虽然Ni(II)、Pd(II)和Pt(II)均为d8 组态,但Ni(II)为第一过渡系元素,分裂能绝对值小,且半径较小,当遇半径较大的配体时因空间位阻的关系,Ni(II)只能以sp3 杂化生成四面体构型配合物;而与半径较小的配体则有可能生成平面正方形构型配合物。
Pd(II)和Pt(II)分别属第二、第三过渡系元素,首先是半径较大,生成平面正方形构型没有空间障碍,其次是分裂能比Ni(II)分别大40~50 %和60~75 %以dsp2杂化生成平面正方形配合物得到的稳定化能远比四面体构型的稳定化能大得多,故采用平面正方形构型。
6 根据[Fe(CN)6]4-水溶液的13C 核磁共振谱只显示一个峰的事实,讨论它的结构。
解:13C 核磁共振谱只显示一个峰,说明6 个CN-的环境完全相同,即[Fe(CN)6]4-为正八面体结构,Fe II,d6,当与CN-强场配体配位时,应有t2g6e g0 的排布。
7 主族元素和过渡元素四配位化合物的几何构型有何异同?为什么?解:主族元素,四面体;过渡元素,有四面体和平面四边形两种可能结构。
中级无机化学答案

中级无机化学答案1. 什么是晶体?晶体是由规则的,周期性的结构单元有序排列而成的固体,拥有清晰的界面和平滑的表面,可以呈现出各种美丽的颜色和形态。
2. 什么是立方晶系?立方晶系是晶体学中最为简单的晶系,其晶胞中的各边长相等,角度为90度,晶胞中的原子或者分子沿立方体对称放置。
3. 什么是对称性?对称性是指物体在空间立体角度上的对称性,如旋转对称性和镜像对称性等。
在晶体学中通常使用点群对称性和空间群对称性来描述晶体的对称性。
4. 什么是晶体缺陷?晶体缺陷是指晶体中的结构缺陷,如点缺陷、线缺陷和面缺陷等。
晶体缺陷可以影响晶体的物理、化学和光学性质等。
5. 什么是配位数?配位数是指一个原子周围被多少个其他原子或配合物离子所包围,通常用于描述化合物中金属离子的结构。
6. 什么是路易斯酸碱理论?路易斯酸碱理论是描述电子对传递的一种理论,认为酸和碱的本质是其对电子对的亲和力和反应性。
在该理论中,酸是指可以接受电子对的物质,碱是指可以提供电子对的物质。
7. 什么是晶体场理论?晶体场理论是描述配合物中金属离子与其周围配位体相互作用的一种理论。
在该理论中,金属离子与配位体之间的相互作用可以被分为两种类型,一种是取向不敏感的电子云整体作用,另一种是取向敏感的电子云局部作用。
8. 什么是配位化合物?配位化合物是由一个中心原子或离子与一定数目的配位体所组成的化合物,可以分为分子配合物和离子配合物。
9. 什么是整体反应和分步反应?整体反应是指一个反应可以直接从反应物转化为产物,而分步反应则是由多个中间产物相继反应得到最终产物的反应。
10. 什么是消光系数?消光系数是描述光吸收强度和物质浓度之间关系的物理量,通常使用分光光度计来测量。
消光系数与物质的吸收截面积、溶液浓度和光程等因素有关。
北京大学中级无机化学答案

无机化学习题参考答案(II) 1.4.解:(1)H2O22C(2)S2O32-3vC(3)N2O (N-N-O方式)vC∞(4)Hg2Cl2hD∞(5)H2C=C=CH22dD(6)UOF4C5v(7)BF4-dT(8)SClF54vC(9)反-Pt(NH3)2Cl22hD(10)PtCl3(C2H4)-2vC1.B(CH3)3和BCl3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
(BCl3易水解;B(CH3)3不溶于水,在空气中易燃)2.BH3和BF3都可和(CH3)2NPF2生成加合物,在一种加合物中,B原子和N相连,另一种则和P相连,绘出两种结构式,并说明形成两种结构的原因。
(该题可参考史启桢等翻译的"无机化学",作者Shriver等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在?配位饱和(6配位),失去Lewis酸性4. 吸水后失效的AlCl3有什么方法可以脱水?因为Al3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl,NH4Cl,SOCl2等气氛下加热脱水。
(只能加强热生成 Al2O3后,用高温下用加C和Cl2用还原氯化法制备,这就不是脱水方法了)。
第二章2.1 解:Ni2+ d8组态Pt2+ d8组态第四周期(分裂能小)第六周期(分裂能大)trans cis 四面体构型平面四方形构型(两种构型)只有一种结构(P代表PPh3)2.2 解(1)MA2B4(2)MA3B3trans cis fac(面式) mer(经式)D 4h C 2v C 3v C 2vμ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+trans cis Co(en)(NH 3)2Cl 2+trans(1) trans(2) cis 2.4 Co(en)33+Ru(bipy)32+手性分子D 3D 3PtCl(dien)+dien HNCH 2CH 2CH 2NH 2NH 2CH 2基本上为平面分子,无手性2.5 (1) 分别用BaCl 2溶液滴入,有白色沉液出现的为[Co(NH 3)5Br]SO 4,或分别加入AgNO 3溶液,产生浅黄色沉淀的为[Co(NH 3)5SO 4]Br 。
北大中级无机化学有机金属化学(2)
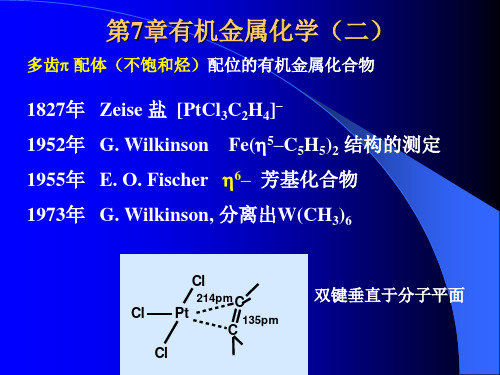
H H H CH 4
H H H N H3 OH2 H H FH H
H
2. 等瓣相似
R. Hoffmann, (Nobel Lecture, 1982) ―Building Bridges between Inorganic and Organic Chemistry‖
练习
写出下列化合物 的结构、总价电子计数和金属原子 的氧化态 1. (5–C5H5)Mn(CO)3 2. (5–C5H5)Mo(CO)2 (3–C3H5) 3. (5–C5H5)2Ta (CH2)(CH3)
Fe(5–C5H5)2
Fluxional ferrocene 转动势垒低,~ 3.8kJ.mol–1
固态:交错型 D5d
气相:重叠型 D5h 室温时不规则,低温为D5
合成方法: C5H6 C5H5–
1) C5H6(二聚体) + Na (THF) C5H5– + Na+ + H2
FeCl2+ NaC5H5(THF, 苯) Fe(5–C5H5)2
Alkylidyne ( CR )次烷基配合物 Carbyne配合物
3电子给体
OM e (O C ) 5 M o= C Ph OC
+
Br CO Mo OC C O C Ph
+
B B r3
CO
+
B B r2 (O M e )
卡宾化合物
卡拜化合物
Carbene 和 Carbyne的配合物
讨论:
1. 烯丙基配合物[PdC3H5Cl]2的结构和总价电子计数,
R2 C M CR
第十章中级无机化学课后习题答案

第10章习题1 简要回答问题(1) 什么叫稀土元素? 什么叫镧系元素?答:参见本书10.1节《概述》。
(2) 镧系收缩的原因是什么? 简述镧系收缩造成的影响。
答:关于镧系收缩的原因参见本书10.1.2节《原子半径和离子半径》。
由于镧系收缩的影响,使第二、三过渡系的Zr和Hf、Nb与Ta、Mo与W三对元素的半径相近,化学性质相似,分离困难。
(3) 为什么Eu、Yb原子半径比相邻元素大? 而Ce又小?答:① Eu、Yb元素参与形成金属键的电子数为2,Ce为3.1,其余为3.0;② Eu、Yb具碱土性;③ Eu、Yb的f7、f14的半充满和全充满的结构能量低、稳定、屏蔽大,核对外面的6s电子吸引较弱。
(4) 为什么镧系元素的电子结构在固态和气态不同?解:参见本书10.1.1节《镧系元素的价电子层结构》。
(5) 镧系离子的电子光谱同d区过渡金属离子相比有何不同? 为什么?解:除La3+、Lu3+离子的4f电子层是全空(4f0)和全满(4f14)之外,其余Ln3+离子4f轨道上的电子数由1到14,这些电子可以在7条4f简并轨道上任意排布,这样就会产生各种光谱项和能级。
4f 电子在不同能级间跃迁可以吸收或发射从紫外经可见直至红外区的各种波长的电磁辐射。
通常具有未充满的4f电子壳层的原子或离子,可以观察到的光谱线大约有30 000条,而具有未充满d电子壳层的过渡金属元素的谱线约有7 000条。
在理论上,f→f跃迁产生的谱线强度不大。
但是某些f→f跃迁的吸收带的强度,随镧系离子周围环境的变化而明显增大(这种跃迁称为超灵敏跃迁)。
这可能是由于配体的碱性、溶剂的极性、配合物的对称性以及配位数等多种因素的影响,亦即离子周围环境的变化,再加上镧系离子本身的性质等诸因素的综合作用所引起的。
镧系离子的吸收谱带范围较广且镧系离子光谱谱带狭窄,表明电子跃迁时并不显示激发分子振动,狭窄的谱带意味着电子受激发时分子势能面几乎没有变化,这与f 电子与配体只存在弱相互作用相一致。
2016《中级无机化学》第四讲-习题参考答案
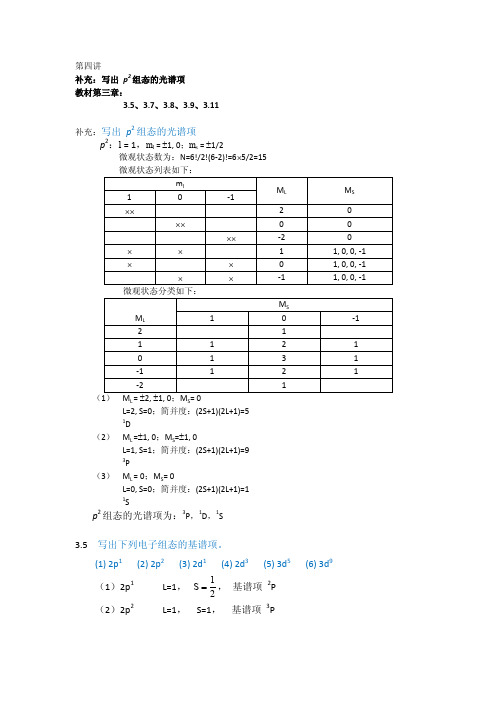
第四讲补充:写出p2组态的光谱项教材第三章:3.5、3.7、3.8、3.9、3.11补充:写出p2组态的光谱项p2:l = 1,m l= ±1, 0;m s= ±1/2微观状态数为:N=6!/2!(6-2)!=6⨯5/2=15(L SL=2, S=0;简并度:(2S+1)(2L+1)=51D(2)M L =±1, 0;M S=±1, 0L=1, S=1;简并度:(2S+1)(2L+1)=93P(3)M L = 0;M S= 0L=0, S=0;简并度:(2S+1)(2L+1)=11Sp2组态的光谱项为:3P,1D,1S3.5 写出下列电子组态的基谱项。
(1) 2p1(2) 2p2(3) 2d1(4) 2d3(5) 3d5(6) 3d9(1)2p1L=1,12S=,基谱项2P(2)2p2L=1,S=1,基谱项3P(3)3d 1L=2, 12S =, 基谱项 2D (4)3d 3 L=3, 32S =, 基谱项 4F(5)3d 5 L=0, 52S =, 基谱项 6S(6)3d 9 L=2, 12S =, 基谱项 2D3.7 已知1017600cm -∆=,1918cm B -=,用Tanabe-Sugano 图预言Cr(H 2O)63+吸收光谱中自旋允许的两个四重态谱带。
Cr(H 2O)63+中Cr 3+为d 3组态,且0/17600/91819.2B ∆==从T -S 图上得到:可能的两个允许跃迁为4A 2g →4T 2g 4A 2g →4T 1g在横轴上找到19.2的点,作垂线与4T 1g 和4T 2g 分别相交于E/B=28.5和E/B=19.5两点。
∴E 1/B=28.5 E 1=28.5×918=26200(cm -1) E 2/B=19.5E 2=19.5×918=17901(cm -1)3.8 用Tanabe-Sugano 图确定基态能级:(1)低自旋[Rh(NH 3)6]3+;(2)[Ti(H 2O)6]3+;(3)[Fe(H 2O)6]3+。
中级无机化学答案整理版

中级无机化学项斯芬 姚光庆 编著 北京大学出版社第一章1.4.解:1) H 2O 2C 22(2)S 2O 32C3v3) N 2O (N N O 方式 ) C v(4)Hg 2Cl 2 D h5)H 2C=C=CH 2 D2d(6)UOF 4 C 5v7) BF 4T d(8)SClF 5C 4v9) 反 -Pt (NH 3)2Cl 2D2h(10)PtCl 3(C 2H 4)C2v第二章2.1 解:transP 代表 PPh 3)2.2 解 1)MA 2B 4Ni 2+d 8 组态 Pt 2+ d 8 组态第四周期 分裂能小) 第六周期(分裂能大)ClNi PClClP Cl Cl Pt PP Cl P P Pt C C l l四面体构型 平面四方形构型(两种构型)BM BA B M A BAMAAA MBcis只有一种结构 2)MA 3B 3Co(en)2(NH 3)Cl 2+trans cis fac(面式) mer(经式) D 4h=00 C 2vC 3vC 2v2.3 Co(en)2Cl 2+ D 2hC 2 光活异构体 C 2trans Co(en)(NH 3)2Cl 2+ Cl Cl NH 3 NH 3cisCl NH 3trans(1) trans(2) 2.4 Co(en)33+ D 3PtCl(dien)+Ru(bipy)32+D 3H 3cis手性分子CH 2 CH 2 NH 2HNCH 2 CH 2 NH 2dien基本上为平面分子 ,无手性2.5 (1) 分别用 BaCl 2 溶液滴入,有白色沉液出现的为 [Co(NH 3)5Br]SO 4,或分别加入 AgNO 3溶液,产生浅黄色沉淀的为 [Co(NH 3)5SO 4]Br 。
(2) 等物质量的异构体中分别加入过量 AgNO 3,产生少量沉淀( 1molAgCl ↓) 的为前者(摩尔比为 2:1),产生大量沉淀( 2molAgCl ↓)的为后者。
中级无机化学习题(含答案)

(B) 对 B(CH3)3 的碱性较强:(1) Me3N,Et3N;(2) (2-CH3)C5H4N,(4-CH3)C5H4N;(Bu
丁基;C5H4N 吡啶) 答:(A) (1) BBr3;(2) BCl3;(3) B(n-Bu)3;(B) (1) Me3N;(2) (4-CH3)C5H4N 6. 解释酸性变化规律 HOI < HOBr < HOCl。
9. 比较下列每组两个化合物与乙醇形成氢键的能力:
2
(1) (H3Si)2O 和(H3CH2C)2O;(2) (H3Si)3N 和(H3C)3N 答:对同一种 H 给体(如乙醇)而言,Lewis 碱性越强形成的氢键也越强。因为 O 和 N 上
的电子可扩充到 Si 的空 d 轨道上,因此与 Si 结合的 O 和 N 较与 C 结合的 O 和 N 的
Lewis 碱性低,因而可以预期(1)中的乙醚和(2)中的三甲胺形成的氢键更强些。
10.比较 HCF3 与 HCH2NO2 的酸性强弱,叙述理由。 答:HCF3 酸性较弱。按照诱导效应似应是前者的酸性强,因为 3 个电负性很大的 F 使 C
原子上带很高的正电荷。然而 HCF3 失去质子形成的 CF3-基团 C 上的负电荷离域化程 度并不高,而在 HCH2NO2 失去质子形成的 CH2NO2-基团 C 上的负电荷可以向 NO2 基 团的*轨道离域而稳定。所以后者的酸性较强。
子是
,与 BF3 相结合的原子是
。
答:P,N
4. 按照质子亲和势增加的顺序将下列各碱 HS,F,I,NH2-排序为。 答: I- < F- < HS- < NH25 . 在下述各组化合物中按题目要求进行选择。
(A) 最强的 Lewis 酸:(1) BF3,BCl3,BBr3;(2) BeCl2,BCl3;(3) B(n-Bu)3,B(t-Bu)3;
中级无机化学-习题及答案-完整版

(2)属D4h点群,含对称元素C4、C2、2 C2' 、 2C2'' 、i、2S4、σh、2σv、2σd
(3)若忽略H原子,属C2v点群,含对称元素C2、2σv (4)属D3d点群,含对称元素C3、3C2'⊥C3、i、2S6、3σd (5)属C3v点群,含对称元素C3、3σv (6)属D2h点群,含对称元素C2、2C2'⊥C2、i、2σv、σh (7)属D∞h点群,含对称元素C∞、∞C2'、σh、∞σv、i、S∞ (8)属C2v点群,含对称元素C2、2σv
2.8 PtCl42-属于什么点群?画出它的结构,标出各类操作元素(每类只标一个)。
2.9 已知下列分子(离子)所属的点群,画出它们的结构: (1)B(OH)3(C3h);(2)Cr(en)33+(D3);(3)Co(gly)3(C3); (4)Mn2(CO)10(D4d);(5)(H2C=C=CH2)(D2d)。
H2CO3 + OH-(水-离子理
论:解离出OH-,或溶剂体系理论:生成溶剂的特征阴离子),所以NaHCO3水溶液显碱性
因为SO3 + H2O → H+ + HSO4-(水-离子理论和质子理论:解离出H+),或SO3 +
2H2O → H3O+ + HSO4-(溶剂体系理论:生成溶剂的特征阳离子),所以SO3水溶液显酸
2.5 [MA2B2]2-呈平面四边形构型时属D2h点群,含有对称元素:C2、2C2'、σh、i、2σv。[MA2B2]2 -呈四面体构型时属C2v点群,含有对称元素:C2、2σv。
2.6 C4h点群比D4h点群缺少 4 条垂直于主轴的C2'旋转轴。D4h点群的例子有配离子PtCl42-,C4h 点群例子有:
第九章中级无机化学课后习题答案

第九章中级无机化学课后习题答案162 第9章习题1 计算下列化合物的价电子数,指出哪些符合FAN 规则。
解:(1) V(CO)6 V :5,6CO :12;共17。
不符合(2) W(CO)6 W :6,6CO :12;共18。
符合(3) Ru(CO)4H Ru +:7,4CO :8,H -:2;共17。
不符合(4) Ir(CO)(PPh 3)2Cl Ir +:8,CO :2,2PPh 3:4,Cl -:2;共16。
符合(5) Ni(η5-C 5H 5)(NO) Ni +:9,C 5H 5-:6,NO :3;共18。
符合(6) PtCl 3(η2-C 2H 4)- Pt 2+:8,3Cl -:6,C 2H 4:2;共16。
符合2 下列原子簇化合物中哪些具有M =M 双键?为什么?解:(1) Fe 3(CO)12 3×8 (Fe)+12×2 (CO)=48 (3×18-48)/2=3,三条键连接三个Fe ,三个Fe 按三角形排布,,故应该无M =M 键;(2) H +2[Os 3(CO)10]2-3×8 (Os)+10×2 (CO)+2(负电荷)=46 (3×18-46)/2=4,四条键连接三个Os ,三个Os 按三角形排布,,故应该有一条M =M 键;(3) H +4 [Re 4(CO)12]4-4×7 (Re)+12×2 (CO)+4(负电荷)=56 (4×18-56)/2=8,八条键连接四个Re ,四个Re 按四面体排布,,故应该有两条M =M 键;(4) [Re 4(CO)16]2-4×7 (Re)+16×2 (CO)+2(负电荷)=62 (4×18-62)/2=5五条键连接四个Re ,四个Re 按蝶形排布,,故应该无M =M 键。
3 [HFe 4(CO)13]-和H 3Os 4(CO)12I 具有怎样的结构?画图说明之。
北京大学中级无机化学答案

无机化学习题参考答案(II)第一章1.4.解:(1)H 2O 22C(2)S 2O 32- 3v C (3)N 2O (N -N -O 方式) v C ∞(4)Hg 2Cl 2h D ∞(5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4-d T (8)SClF 54v C(9)反-Pt(NH 3)2Cl 22h D(10)PtCl 3(C 2H 4)- 2v C1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
(BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃)2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3CH 3PF F H 3CH 3B BH 3F 3(该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性4. 吸水后失效 的AlCl 3有什么方法可以脱水?因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。
(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。
第二章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态 第四周期(分裂能小)第六周期(分裂能大)P Ni ClP ClClCl P Ptrans cis四面体构型 平面四方形构型(两种构型) 只有一种结构 (P 代表PPh 3)2.2 解 (1)MA 2B 4(2)MA 3B 3M A BB M AA BM AAB M A A Btrans cis fac(面式) mer(经式) D 4h C 2v C 3v C 2v μ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+33Htrans cisCo(en)(NH3)2Cl2+3Cl333NHNH33trans(1) trans(2)cis2.4 Co(en)33+Ru(bipy)32+手性分子D3D3PtCl(dien)+dienHNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
北京大学医学继续教育学院 无机化学 答案P02A作业4-2

1、用H3PO4(pKa1= 2.16,pKa2= 7.21,pKa3= 12.32)和NaOH所配成的pH = 7.35的缓冲溶液中,抗碱成分是()(4 分)A.H3PO4B.H2PO4-C.HPO42-D.PO43-我的答案:B得分:4分2、对于一个化学反应,下列说法中正确的是()(4 分)A.越负,反应速率越大B.越负,反应速率越大C.活化能越大,反应速率越大D.活化能越小,反应速率越大我的答案:D得分:4分3、蛋白质发生盐析的主要原因是()(4 分)A.电解质离子强烈的水化作用使大分子去水化B.蛋白质所带的电荷发生了变化C.由于电解质的加入,使大分子溶液处于等电点D.蛋白质上基团的解离情况发生了变化我的答案:A得分:4分4、已知某蛋白的pI = 5.6,欲使该蛋白移向正极,则电泳液的pH应()(4 分)A.<5.6B.=5.6C.>5.6D.无法确定我的答案:C得分:4分5、聚沉As2S3负溶胶,下列电解质中聚沉能力最强的是()(4 分)A.Ca(NO3)2B.K2SO4C.Na3PO4D.AlCl3我的答案:D得分:4分6、溶胶在一定时间内能稳定存在而不聚沉,主要原因是()(4 分)A.溶胶的分散相粒子很小B.溶胶的分散相粒子很大,扩散速度慢C.溶胶的胶粒呈均匀分布,是均相系统D.胶粒带电,相互排斥;胶粒带有水化膜保护,阻止彼此碰撞时聚结沉淀我的答案:D得分:4分7、溶胶的丁铎尔(Tyndall)现象的本质是胶粒对光的()(4 分)A.透射作用B.反射作用C.折射作用D.散射作用我的答案:D得分:4分8、下列关于胶体分散系的描述,正确的是()(4 分)A.分散相粒子的直径小于1nmB.它是多相系统C.分散相粒子的直径在1~100nm之间D.分散介质只能为水我的答案:C得分:4分9、已知HAc的Ka= 1.8´10−5,NH3∙H2O 的Kb=1.8´10−5,则下列水溶液(各相关物质的浓度均为0.10mol∙L-1)中,pH最高的是()(4 分)A.HAc−HCl混合溶液B.NH4Ac溶液C.HAc−NaAc混合溶液D.pH = 5.00的溶液我的答案:B得分:4分10、在1 L下列缓冲溶液中,缓冲容量最大的是()(4 分)A.含0.15mol HAc和0.05mol NaAc B.含0.10mol HAc和0.10mol NaAc C.含0.12mol HAc和0.15mol NaAc D.含0.15mol HAc和0.15mol NaAc 我的答案:D得分:4分。
《无机化学》北师大等习题答案

石膏:CaSO4•2H2O(生石膏)CaSO4 •0.5H2O(熟石膏)
萤石:CaF2
芒硝:Na2SO4•10H2O
元明粉:Na2SO4 泻盐:MgSO4•7H2O
20-11:下列反应的热力学数据如下: MgO(s) + C(s,石墨) = CO(g) +Mg(g)
试计算:(1)反应的热效应 (2)反应的自由能变 ;(3)在标准条件 下,用 C (s,石墨)还原 MgO制取金属镁时,反应自发进行的最低温 度是什么?
反应不可进行
(2)Cr2O72-/Cr3+=1.33V Sn4+/Sn2+=0.15V 反应可进行
(3)I2/I-=0.535V Sn4+/Sn2+=0.15V 反应可进行
22-5 1ml 0.2 mol.L-1 溶液中含有Cu2+ 5mg ,若在室温及101.325kPa 下 通入H2S 气体至饱和,析出 CuS沉淀,问达平衡时,溶液中残留的Cu2+ 离子浓度(用mg.ml-1 表示)为多少?
21-4(1)因为氢氧化铝是难溶于水的弱碱,铝的弱 酸盐会强烈水解,无法得到碳酸铝。
(2)PbO2具有很强的氧化性,与盐酸反应获得 氯化亚铅和氯气。
(3)Bi(III)很稳定,不会被多硫化物氧化。
21-5:利用标准电极判断锡从铅(Ⅱ)盐置换出铅 的过程能否进行到底。
解: Pb2++Sn=Sn2++Pb E=Pb2+/Pb-Sn2+/Sn=-0.126-(-0.136)=0.01V lgK=nE/0.0592=0.02/0.0592 K=2.18 平衡常数太小,无法反应完全。
Mg(OH)2的电离和溶解。
无机化学北大试题及答案

无机化学北大试题及答案无机化学是化学学科的一个重要分支,它主要研究无机物质的结构、性质、反应及其应用。
以下是一份模拟的无机化学试题及其答案,供参考。
一、选择题(每题2分,共20分)1. 以下哪种元素的原子序数为26?A. 铁B. 铜C. 锌D. 铁答案:C. 锌2. 哪种化合物的化学式为NaCl?A. 氯化钠B. 氯化钾C. 氯化镁D. 氯化钙答案:A. 氯化钠3. 以下哪种元素属于碱土金属?A. 锂B. 钠C. 钾D. 钙答案:D. 钙4. 哪种元素的电子排布为1s² 2s² 2p⁶ 3s² 3p⁶?B. 氧C. 氮D. 氖答案:D. 氖5. 以下哪种化合物是共价化合物?A. NaClB. HClC. MgOD. Fe答案:B. HCl6. 哪种元素的原子半径最大?A. 氢B. 氦C. 锂D. 铯答案:D. 铯7. 以下哪种化合物是离子化合物?A. H₂OB. CO₂C. NaClD. CH₄答案:C. NaCl8. 哪种元素的电子排布为[Ar] 3d⁵ 4s¹?A. 铬B. 锰C. 铁答案:C. 铁9. 以下哪种化合物是酸性氧化物?A. CO₂B. SO₂C. NO₂D. SiO₂答案:D. SiO₂10. 哪种元素的原子序数为29?A. 铜B. 镍C. 钴D. 锌答案:B. 镍二、填空题(每空1分,共20分)1. 元素周期表中,第IA族元素的价电子数为____。
答案:12. 元素的电负性越大,其非金属性越____。
答案:强3. 元素周期表中,第VIII族元素的价电子数为____。
答案:84. 在周期表中,同一周期的元素,从左到右,原子半径逐渐____。
答案:减小5. 元素的电离能越大,其金属性越____。
答案:弱6. 元素的电负性越小,其非金属性越____。
答案:弱7. 元素周期表中,第IIIA族元素的价电子数为____。
答案:38. 在周期表中,同一族的元素,从上到下,原子半径逐渐____。
北京大学中无机化学答案

无机化学习题参考答案(II)第一章1.4.解:(1)H 2O 22C(2)S 2O 323v C(3)N 2O (NN O 方式) v C ∞(4)Hg 2Cl 2h D ∞(5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4d T (8)SClF 54v C (9)反-Pt(NH 3)2Cl 2 2h D(10)PtCl 3(C 2H 4)2v C1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
(BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃)2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3C CH 3NPF F H 3CCH 3NB BH 3F 3(该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性4. 吸水后失效 的AlCl 3有什么方法可以脱水?因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。
(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。
第二章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态 第四周期(分裂能小)第六周期(分裂能大)P Ni ClP ClPtCl ClPtCl ClP PPPtrans cis四面体构型 平面四方形构型(两种构型) 只有一种结构 (P 代表PPh 3)2.2 解 (1)MA 2B 4(2)MA 3B 3M A AB BBB M ABA BBB M ABA ABB M A AA BBBtrans cis fac(面式) mer(经式) D 4h C 2v C 3v C 2v =0 0 0facmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+Cl NH3ClNH 3ClH3Ntrans cis Co(en)(NH3)2Cl2+NH3NH3ClClClNH3ClNH3ClNH3ClNH3ClClNH3NH3trans(1) trans(2) cis2.4 Co(en)33+Ru(bipy)32+手性分子D3D3PtCl(dien)+ClNN Ndien HNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学习题参考答案(II)第一章1.4.解:(1)H 2O 2ﻩ2Cﻩ (2)S 2O 32-3v C(3)N 2O ﻩ(N -N-O 方式)ﻩv C ∞ﻩ (4)Hg 2Cl 2ﻩh D ∞(5)H 2C=C=CH 2 2d D(6)UOF4ﻩﻩ C 5v (7)B F4-ﻩﻩd T ﻩ(8)SClF 5ﻩ4v C(9)反-P t(NH 3)2Cl 2ﻩ2h D ﻩ ﻩ (10)PtCl 3(C 2H4)- 2v C1.B(CH 3)3和BCl 3相比,哪一个的Lew is 酸性强,为什么?一般来说,C H3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
(BCl 3易水解;B(CH3)3不溶于水,在空气中易燃)2.BH 3和BF3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3CH 3PF F H 3CH 3B BH 3F 3(该题可参考史启桢等翻译的"无机化学",作者Shri ve r等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在?配位饱和(6配位),失去L ewis 酸性4. 吸水后失效 的A lCl 3有什么方法可以脱水?因为A l3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HC l,NH 4C l,SO Cl 2等气氛下加热脱水。
(只能加强热生成 Al 2O3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。
第二章2.1 解:Ni2+ d 8组态ﻩﻩﻩﻩ P t2+ d 8组态 第四周期(分裂能小)ﻩﻩ 第六周期(分裂能大)P Ni ClP ClPtClCl P Ptra ns c is四面体构型 平面四方形构型(两种构型) 只有一种结构 (P 代表PPh 3)2.2 解 (1)MA 2B 4 ﻩﻩ (2)MA 3B 3M A BB M A A BM A BAB M A AA Btra ns cis fac(面式) mer(经式) D 4hC 2vC 3vC 2vμ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 C o(en )2Cl 2+D2hﻩﻩﻩC2光活异构体ﻩC2Co(en)2(NH3)Cl2+33Htrans cisCo(en)(NH3)2Cl2+3Cl333NHNH33trans(1) trans(2)cis2.4Co(en)33+ﻩﻩRu(bipy)32+ﻩﻩ手性分子D3ﻩﻩD3PtCl(dien)+dienHNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5(1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
(2)等物质量的异构体中分别加入过量AgNO3,产生少量沉淀(1molAgCl↓)的为前者(摩尔比为2:1),产生大量沉淀(2molAgCl↓)的为后者。
或用电导方法测量,前者和后者的电导比为2:3(3)[Co(H2O)4Cl2]+顺式C2v、反式D4h,对称性不同,偶极矩不同,可以用物理方法鉴别,例如红外或Raman光谱不同。
2.68个CN -基团在化合物中的化学环境是完全等同的,可能的结构是四方反棱柱和四方棱柱构型,不可能是12面体(D2d点群),实验证明是四方反棱柱。
2.7根据HSAB的协同作用(symbiotic)原理,软配体可使中心金属变软,反之亦然,CN是软配体,NH3是硬配体。
桥连配体NCS中S比N软,因此分子结构为:(H3N)5Co-NCS-Co(CN)52.8同上题,桥连配体NC中C比N软,因此,分子结构为:Co(NH3)5-NC-Co(CN)52.9 AgO晶体中的Ag(Ⅱ)实际上是Ag(Ⅰ)和Ag(Ⅲ)混合而成,d10的Ag(I)为sp杂化,直线型d8的Ag(Ⅲ)倾向dsp2杂化,以获得更多的晶体场稳定化能,因此为平面四方。
COLICSDCollection Code 202055DATE Recorded Dec19, 1988; updated Aug 1, 1989NAME Silver(I,III) oxide - tetragonalFORMAg O= Ag OTITLStructure and magneticproperties of tetragonal Silver(I,III)oxide Ag OREF Journal of Solid State ChemistryJSSCB 65 (1986) 225-230REFJournal of Solid State ChemistryJSSCB 68 (1987)380AUTYvon K, BezingeA, Tissot P, FischerPCELL a=6.883(3) b=6.883(3) c=9.122(4)?90.0 ?90.0 ?90.0 V=432.2 Z=16SGR I 41/a Z (88)- tetragonalCLAS 4/m (Hermann-Mauguin) -C4h (Schoenflies)PRS tI32ANX ABX2PARMAtom__No OxStat Wyck -----X----- -----Y----- -----Z----- -SOF-Ag 1 3.000 8c0.0. 0.Ag 2 1.000 8d 0. 0. 1/2 O 1 -2.000 16f 0.0798(3) 0.0130(5) 0.2128(3) WYCK f d cITF Ag 1 U=0.0168(8)ITFAg 2 U=0.0058(6)ITF O 1 U=0.0066(4)REM NDP (neutron diffraction from a powder)RVAL 0.0662.10 Mn(CO)5(NO)(1)C4v(2)Co(PPh2Me)2(NO)Cl2C2vC2v C1C1 (对映体的点群不变,未给出)(3)[Fe(CO)4(CN)]-C2vC3v(4)Ni(PPhMe2)2Br3C2vCsD3h (5)Ru(PPh3)3Cl2D3hC s C2v (6)VOCl42-C3v C2vﻬ第三章习题3.1 3-6Fe(CN)ﻩﻩ3+26Fe(H O)3+Fe为d5,CN--强场配体ﻩH2O为弱场配体∴3-6Fe(CN)为LSﻩﻩﻩ3+26Fe(H O)为HS有一个未成对电子有五个未成对电子d8Ni(CN)42-NiCl42-ﻩCN--强场LS Cl--弱场HSﻩﻩ平面四方ﻩﻩ四面体3.2Ni2+为d8组态第四周期Pt2+为d8组态,第六周期按照g f ∆=⨯ﻩﻩg 为金属离子的性属,周期数越高,g 因子越大∴Pt 2+的g 因子大于N i2+的g 因子。
∆( PtC l42-) > ∆ (NiCl 42-)分裂能∆大,容易形成平面四方构型,∆小,则为四面体构型 3.5(1)2p 1L =1, 12S =, 基谱项 2P (2)2p 2ﻩ L =1, S=1, 基谱项 3P(3)2d 1ﻩﻩL =2, 12S =, 基谱项 2D (4)2d3 ﻩL=3, 32S =, 基谱项 4F(5)3d 5ﻩﻩL=0, 52S =, 基谱项 6S(6)3d 9ﻩ 与3d 1类似 L =2, 12S =, 基谱项 2D3.6 CoF 63-中,Co 3+的电子组态为d 6,高自旋(弱场配体)∴在T-S 图中,允许在跃迁是5T 2g →5E g ,只有一个吸收带。
3.7 1017600cm -∆=ﻩ ﻩ1918cm B -= Cr(H 2O)63+中Cr 3+为d3组态 从T-S 图上得到:可能的两个允许跃迁为4A2→4T 2 4A 214T →0/17600/91819.2B ∆==在横轴上找到19.2的点,作垂线与4T 2和4T 1分别相交于E/B=28.5和E/B=19.5两点。
∴E 1/B=28.5 ﻩE 1=28.5×918=26200(cm -1) E 2/B=19.5ﻩ E 2=19.5×918=17901(c m-1) 3.8 (1)L SﻩRh(NH 3)63+ﻩﻩd 6组态 强场1A 1g(2)Ti (H 2O)63+ﻩﻩd 12T 2g(3)Fe(H 2O)63+d 5ﻩﻩHS,弱场6A1g3.9 CrL 6ﻩﻩd 3ﻩLMCT 光谱(a )4A 2g →4T 2g (4F)(低能量峰)4A 2g→4T 1g (4F)(高能量峰)(b ) e nﻩox 2- F-−−−−−−→ 配位场强度减弱F -的配位场强度最弱,在T-S图中偏左,∴有可能得4A 2g →4T1g (4P)的跃迁 3.10 Mn 2+为d 5,H 2O为弱场配体d 5弱扬,基谱项为六重态的6A 1,而高能级谱项中没有相应的六重态谱项,∴没有自旋允许的跃迁。
Cr(aq )3+为d 3,弱场允许的电子跃迁有4A 2→4T 1,4A 2→T 1,吸收光谱在能量较低的可见光区,∴有色。
3.11 d 2组态的金属含氧酸根离子+4 +5 +6 +6 CrO 44-, M nO 43-,FeO 42-和RuO 42-, 四周期 四周期 四周期 五周期 氧化态和所在周期的位置对下列性质有影响 (1)RuO 42-的t ∆最大,Cr O44-的t ∆最小。
(2)Fe O42-有最短的M-0键,∵Fe(Ⅵ)离子半径最小r Fe(Ⅵ)< r Mn(Ⅴ)< r C r(Ⅳ) (3)是LMCTﻬ第四章习题4.1 进入基团y 不同而反应速率相同,说明反应与y无关,速控步为离去基团的解离,因此反应属于S N 1反应,即离解机理,或D机理。
4.2ClClClPt2Cl NH3NO2H3ClClPtClPtClcistrans--∵反位效应的顺序为:NO2->Cl->NH34.3(1)PR3PR3PR3PR3PR3ClCl-Cl-PR3PRClcis2++cis- PtCl2(PR3)2反位效应PR3>Cl-(2) .trans-PtCl2(PR3)2反位效应PR3>Cl-ClCl Cl PR3Cl PR3PR3PR3trans2--反位效应PR3>Cl-(3)pyCl-33NH3ClPtNH3ClPt+∵反位效应Cl->NH3≥py4.5速率=k1[Au(dien)Cl2+]+k2[Au(dien)Cl2+][Cl*-]取代反应中存在两种机理①前一项表示SN1反应,即单分子反应的离解机理,②后一项表示双分子取代的缔合机理。
