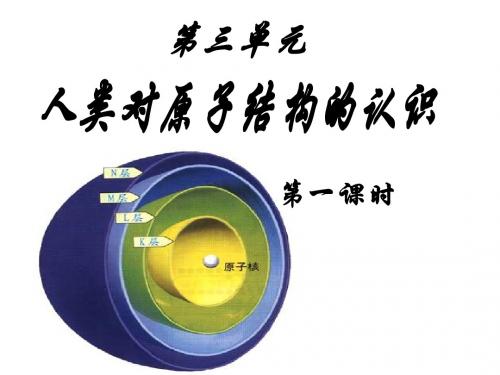
人类研究原子结构的历史发展历程
原子结构演变的5个阶段

原子结构演变的5个阶段原子结构是材料科学重要的基础概念之一。
从19世纪末到20世纪初,科学家们开始探索原子的结构。
在不断的探索、研究和实验中,人们逐渐认识到了原子结构的复杂性和演变历程。
本文将介绍原子结构演变的5个阶段。
第一阶段:罗瑟福的阿尔法粒子散射实验1909年,英国科学家罗瑟福通过研究阿尔法粒子散射实验得出了原子模型。
这个模型认为原子由带正电的原子核和负电子组成,而电子分布在原子核之外。
这个模型为后来的原子核模型打下了基础。
第二阶段:卢瑟福-玻尔原子模型1913年,丹麦物理学家玻尔在研究氢原子光谱时提出了一个新的原子模型,被称为卢瑟福-玻尔原子模型。
这个模型认为原子是由带电质子和不带电的中性粒子组成的。
电子围绕原子核旋转,每条轨道对应不同的能量水平。
第三阶段:量子力学的发展随着量子力学的发展,原子的结构变得更加复杂。
量子力学认为原子的能量是量子化的,而不是连续分布的。
通过研究原子的波函数和能量状态,科学家们得出了原子的电子云结构,即一个原子中电子分布的概率密度分布。
这为化学分子和材料科学的研究奠定了基础。
第四阶段:原子核模型的发展在量子力学理论基础上,原子核模型得到发展,并确定了元素周期表。
原子核由带正电荷的质子和中性的中子组成。
质子数量不同的原子称为不同的元素。
不同的元素具有不同的化学性质和同位素。
第五阶段:超越原子的研究随着科学技术的发展,人们开始研究原子以外的更小、更基本的粒子。
通过加速器、探测器等尖端设备,科学家们研究了粒子物理学、核能等领域,揭示了一些重大问题,如弱相互作用、暗物质、暗能量等,为人类认识宇宙提供了新的契机。
总之,原子结构演变是一个在不断探索中不断发展的过程。
每个阶段都有其重要性,并且为后来的研究和探索奠定了基础。
我们应该把握历史机遇,用科学的方法深入研究原子结构,为未来的人类文明和科技进步做出贡献。
《原子结构》 讲义

《原子结构》讲义一、原子的发现历程在人类探索物质世界的漫长历史中,对原子结构的认识是一个逐渐深入的过程。
早在公元前 5 世纪,古希腊哲学家德谟克利特就提出了“原子”的概念,他认为物质是由不可分割的微小粒子——原子组成。
然而,这仅仅是一种哲学上的推测,缺乏科学的依据和实验的验证。
到了 19 世纪初,英国科学家约翰·道尔顿基于大量的实验观察和分析,正式提出了近代原子学说。
他指出,物质是由具有一定质量的原子组成,同种元素的原子性质和质量相同,不同元素的原子性质和质量不同,并且化合物是由不同原子以一定比例结合而成。
随着科学技术的不断发展,19 世纪末,英国物理学家 JJ汤姆孙发现了电子。
这一发现打破了原子不可分割的观念,使人们认识到原子是有内部结构的。
汤姆孙提出了“葡萄干布丁”模型,认为原子是一个带正电的球体,电子像葡萄干一样镶嵌在其中。
但这个模型很快就被新的实验所推翻。
1911 年,卢瑟福通过α粒子散射实验,提出了原子的核式结构模型。
他指出,原子的中心有一个很小的原子核,带正电,而电子则在核外绕核运动,就像行星绕太阳运转一样。
二、原子的构成原子由原子核和核外电子组成。
原子核位于原子的中心,体积很小,但却集中了原子几乎全部的质量。
原子核由质子和中子组成。
质子带一个单位的正电荷,中子不带电。
质子的数量决定了元素的种类,我们将质子数相同的一类原子称为一种元素。
比如氢原子的质子数为 1,氧原子的质子数为 8。
核外电子带一个单位的负电荷,在原子核外分层排布。
电子的数量和排布方式决定了原子的化学性质。
三、电子的排布规律电子在原子核外的排布遵循一定的规律。
首先,电子按照能量的高低分层排布,离原子核越近的电子能量越低,越稳定;离原子核越远的电子能量越高,越不稳定。
其次,每层所能容纳的电子数量是有限的。
第一层最多容纳 2 个电子,第二层最多容纳 8 个电子,第三层最多容纳 18 个电子……最外层电子数对原子的化学性质有着至关重要的影响。
人类对原子结构发展的历史

人类对原子结构发展的历史原子是物质世界的基本单位,是具有静止电荷和质量的微观粒子。
对原子结构的研究始于古希腊时期,然而,最令人兴奋的进展始于19世纪末和20世纪初。
在19世纪末的时候,英国化学家约翰·道尔顿将原子描述为无法分割的质点,这一假设在很长一段时间内都被认为是正确的。
但是,很快就有科学家开始发现,原子是可分割的,并且具有子结构。
这一思想确立了19世纪晚期和20世纪初期的两个主要原子理论模型:汤姆逊模型和拉瑞模型。
汤姆逊在1897年的实验中首次发现了电子。
他发现,通过磁场作用,带有负电荷的电子可以从气体放电管中的钨丝中释放出来,并对光谱产生影响。
进一步的研究表明,在原子中,正电荷和负电荷是分别分布在不同的小区域内的。
这就是汤姆逊模型,即"面包布丁模型",也被称为"水饺模型"。
然而,这个模型并没有得到普遍认可。
英国物理学家欧内斯特·拉瑞在1911年的实验中提出了另一种原子模型,即拉瑞模型。
他认为,原子是由中心核和负电荷电子组成的。
这个模型被称为"太阳系模型"或"行星模型",得到了广泛认可,并为量子力学的发展奠定了基础。
量子理论在20世纪20年代首次得到广泛应用,它描述了电子的轨道和能级。
在这个模型中,电子被认为不是沿着一条固定的轨道运动的,而是存在于一系列的能级中,并且只有在吸收特定量的能量时,电子才能跳到一个更高的能级。
这些能级和跳跃可以通过放出具有特定波长的光线来识别。
在20世纪50年代,发展出了现代原子理论,它结合了量子理论和相对论。
这样可以更准确地预测原子的能级和性质,也启发了更深一层次的研究,如原子核和更小的粒子研究。
在研究原子结构的历程中,人类的想象力和实验技术一直得到了不断的提高,我们对于微观世界的理解也越来越深刻。
现在,我们知道原子不是基本粒子,它们由质子、中子和电子组成,而这些质子和中子又是由更小的基本粒子组成的。
原子结构的探索历程

原子结构的探索历程摘要:原子结构的探索发展,由古代的物质可分性,到19世纪初,道尔顿提出原子论,再到1898年,汤姆逊提出枣糕模型,再到1911年,卢瑟福提出原子核式结构模型,再到1926年,薛定谔提出电子云模型。
自古以来,当人们仰望明月星辰的旋转,俯视花草藤萝的盛衰,纵看鸟兽鱼虫的活动,面对这无限反复的世界,人们不断寻找自然界最基本的东西,每一种原子结构模型的提出就代表了人类对原子结构认识的一个阶段,人类对原子的认识是漫长的,也是无止境的。
在古代,最初提出物质可分的光辉思想的,是我国学者墨翟(前468-376年),他说,把一根木棍砍到只剩下不能再砍为两半的细粒时,这个细粒就叫“端”。
古希腊的德谟克利特也认为万物是由最小的不可再分的原子组成的。
这两种见解都认识到物质自身的可分性。
随着近代自然科学的形成和发展,19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是组成物质的最基本的粒子,它们是坚实的,微小的不可分割的实心球体。
1879年,汤姆孙通过阴极射线管实验首次发现了电子,冲破了千百年来原子是组成最小单元的陈旧观念。
1897年,汤姆逊发现了电子,这就证明了原子内部还有更小的粒子。
1898年,汤姆逊提出枣糕模型。
1899年,卢瑟福通过研究铀和镭发出来的射线,发现了带正电的a射线、带负电的β射线和穿透力最强的γ射。
a、β、γ射线的发现,踢开了以前认为是不可分的原子的大门,把含有巨大能量的原子内部世界暴露在人们面前。
1904年,日本长冈半太郎提出土星模型。
1900年,卢瑟福在蒙特利尔发现钍放射性气体,他将这种气体称为钍射气,并发现钍射气还产生别的放射性淀积物,卢瑟福的研究表明,原子不但是可分的,而且原子结构还是十分复杂的。
1909年,卢瑟福通过a散射实验发现大多数a粒子通过金属箔的轨迹是直线,也有极少数会发生大角度偏转,个别粒子还会被弹回来。
经过反复实验和周密计算,卢瑟福于1911年提出了核式原子模型:原子中有一个体积很小的带正电的核,这个核具有原子的绝大部分质量,电子沿着轨道绕核旋转,像行星环绕太阳运转一样。
人类研究原子结构的历史发展历程

人类研究原子结构的历史发展历程解滨泽一.道尔顿原子学说各种物质的原子,它们各自的形状、大小、重量一定是相同的,不同物质的原子,其形状、大小及重量必不相同。
为此,他曾经作出这样的推理:假如水的某些原子比其他的水原子重,再假如某一体积的水恰恰由这些较重的水原子组成,那么这一体积的水的比重必然较其他水的比重要大(这显然与事实不符,因为我们知道无论从什么地方得来的纯水的比重都是相同的)。
由此及彼,其他物质也是如此。
道尔顿又指出,不同气体的原子的大小必然各异。
他说,如果将一体积氮与一体积氧进行化合,则会生成二体积的氧化氮,这二体积的氧化氮的数目一定不能多于一体积氮或氧的原子数。
因此,他说氧化氮的原子一定比氧、氮的原子大。
在这这种见解的基础上,道尔顿为了进一步解释一种气体扩散于他种气体的理由以及混合气体的压力问题,他又提出:同一化学物质的原子相互排斥。
道尔顿又推理说,当两种有弹性的流体混合在一起时,同一种微粒相互排斥,但并不排斥另一种微粒,因此,加在一个微粒上的压力,完全来自与它相同的微粒。
由此,他解释了他的分压定律。
正如他的一位朋友所说的那样,一种气体对别的任何气体来说都是一种真空。
以后,道尔顿进一步考虑到对各种原子的相对质量进行测量的问题,虽然进行了许多研究工作,但是依据当时的水平所测得的原子量是很不准确的,甚至无法计算各种元素的原子量,因而他不得不作了一些大胆的猜测和假设。
他首先为复杂原子进行了命名:二元化合物、三元化合物和四元化合物。
然后,他又很武断地作出了这样的结论:如果两种元素彼此化合,其化合时则遵循从最简单的方式开始,其层次分为4个。
道尔顿又据以上原则,以氢原子量为1,以此作为标准,规定了其他元素原子的相对质量。
道尔顿确定的化合物组成的规则是没有什么科学依据的,不能不说是过于主观、随意和武断之举。
因此,很多化合物复杂原子的组成被他弄错了,比如水是H2O,而他误作HO,随之氧的原子量也就错了。
1803年,10月18日,道尔顿在曼彻斯特的学会上第一次宣读了他的有关原子论的论文。
原子结构模型演变历程及其物理意义

原子结构模型演变历程及其物理意义在我们生活中无处不在的原子是构成物质的基本单位,通过对原子结构的研究,我们可以更好地理解物质的性质和现象。
原子结构模型的演变历程是科学发展的一个重要方面,也是物理学的重要研究领域之一。
本文将通过回顾原子结构模型从古希腊时代开始的演变历程,探讨各个时期提出的模型的物理意义。
古希腊时代:原子的概念古希腊哲学家德谟克利特首次提出了“原子”这一概念,他认为物质由不可分割的微小粒子构成,这些粒子就是原子。
德谟克利特的原子观为后来的原子理论奠定了基础,虽然他未能提供实验证据,但这一概念的提出开启了原子结构研究的大门。
19世纪:化学元素周期律的发现随着化学元素周期律的发现,科学家们开始意识到原子不可能是最基本的粒子,反而是由更小的粒子构成。
著名的化学家门捷列夫提出了元素周期律,揭示了元素性质的周期变化规律,这启发了人们对原子内部结构的探索。
20世纪初:卢瑟福散射实验卢瑟福的著名散射实验揭示了原子的大部分质量和正电荷集中在原子核中心的事实。
这一发现推动了卢瑟福原子模型的提出,认为原子由一个小而密集的带正电的核和围绕核运动的电子组成,象征着原子模型的重大突破。
量子力学的发展:现代原子结构模型随着量子力学的发展,原子结构模型经历了量子力学的革新。
量子力学描述了微观粒子的运动和行为,诞生了现代原子结构模型,如薛定谔的波动力学模型和海森堡的矩阵力学模型,这些模型更准确地描述了原子内部结构和性质。
物理意义原子结构模型的演变历程在物理意义上具有重要意义。
通过对不同模型的逐步完善和修正,我们更深入地理解了原子的内部结构和性质,揭示了微观世界的奥秘。
原子结构模型的研究对于物质的性质、化学反应、材料科学等方面都具有重要的影响,为人类认识和利用自然界提供了重要的理论基础。
综上所述,原子结构模型演变历程是科学发展的重要组成部分,也是物理学研究的重要方向。
通过对原子结构模型历史的回顾和探讨,我们能更深入地理解物质世界的微观结构,为科学研究和应用提供了重要的理论支持和指导。
原子结构的探索化学史

3.师道传承,知识和精神传统要源远流长。
4.基础自然科学的研究短期内可能看不到社会经济效益,但长远来看必定是促进人 类社会发展。
谢谢大家!
2.1876年成为剑桥大学的数学研究生。1880年,他取得数学优等荣誉 学位(继1854年麦克斯韦以后的第二位)。后在一位物理教师影响下 决心转攻物理学。
3.他在阴极射线的研究中,证实了阴极射线在电场和磁场中发生偏转,这是判定阴 极射线确实是带电粒子的决定性证据,并进一步测出它们的质量约为氢原子质量的 1/1837。由此推断,阴极射线粒子比原子要小得多,可见这种粒子是组成一切原子 的基本材料。汤姆孙于1904年4月30日宣布了他的成果,电子由此被发现。电子是人 类所认识的第一种基本粒子。
差生查德威炮火下的科研(1ห้องสมุดไป่ตู้91-1974)
1.詹姆斯.查德威克:1891年生于英国柴郡。上中学的时候, 他的学习成绩并不出彩,实验课甚至都没有考及格。但是,查德威克 信:“会做则必须做对,一丝不苟;不会做又没弄懂,绝不下笔。” 正是这种实事求是、功在不舍的精神,使他在科学研究事业中受益一生。
2.1908年,查德威克考入曼切斯特大学。他在物理方面的天赋引起了 卢瑟福的关注,并很快便崭露头角,他的“射线穿过金属箔时发生偏离 的实验成功,有力的证实了原子核的存在。。
4.1906年,由于汤姆孙对电子研究的重要贡献而被授予诺贝尔物理奖(距电子的发 现时隔两年)。
卓越教师汤姆孙
1.汤姆逊除发现电子外,他在研究极隧射线时反现了质谱方法。 他的方法经过同事阿斯顿的改进和完善发展为今天的质谱仪。
2.在担任卡文迪什实验室教授期间,他创建了完整的研究生培养制度 和培育了良好的学术风气,使卡文迪什实验室成为国际物理前沿研究 中心之一。他的学生有7人获诺贝尔奖。英国能够在20世纪前30年在 原子物理学领域保持重要的领先地位,汤姆孙的有力指导和优秀教学 能力起了相当作用。
原子结构的历史发展

原子结构的历史发展原子结构是现代物理学中的基本概念之一,指的是物质构成的最基本单元。
随着科学的进步,人们对原子结构的认识也在不断深化和演变。
本文将就原子结构的历史发展进行探讨,以了解人类对于原子结构的认识是如何逐步建立的。
1. 早期观念和哲学思考的影响在古代,人们对原子结构的认识主要依靠哲学思考和逻辑推理。
古希腊的哲学家德谟克利特提出了原子学说,认为物质是由不可再分的微小颗粒构成的,这些颗粒具有不同的形态和质量。
虽然他的学说并没有经受住时间的考验,但这是人类第一次对原子这一概念进行了系统的思考。
2. 化学实验的重要突破随着化学实验技术的发展,科学家们开始通过实验来探索原子结构。
英国化学家道尔顿在18世纪末提出了道尔顿原子模型,认为元素由不可再分的小颗粒组成,各种元素的原子在化学反应中会重新组合。
道尔顿的学说在化学界得到了广泛的认可,并且对后续的原子理论发展产生了深远的影响。
3. 雷利散射实验的发现20世纪初,英国物理学家雷利通过散射实验发现了原子的结构不是均匀的,而是由一个小而致密的核心和外围电子云组成。
这一实验为后来的量子力学奠定了基础,揭示了原子中存在不同的子粒子。
4. 量子力学的问世20世纪初,量子力学的诞生彻底改变了人们对于原子结构的认识。
物理学家们发现,原子结构的描述需要借助于量子力学的数学框架,原子中的电子存在于离散的能级中。
薛定谔方程的提出使得人们对于原子结构有了更深入的理解,并且能够解释许多先前无法解释的实验现象。
5. 粒子加速器的发展随着粒子加速器技术的进步,科学家们得以通过高能碰撞实验来研究原子的内部结构。
通过对粒子间相互作用的观察和测量,人们发现原子核内存在着质子和中子。
这一发现进一步完善了对于原子结构的认识,使原子结构模型更趋于完整。
总结:原子结构的历史发展经历了古代哲学思考、化学实验突破、雷利散射实验的发现、量子力学的问世以及粒子加速器的发展等多个阶段。
通过这些阶段的发展,人类对于原子结构的认识得到了不断深化和完善。
《原子的构成》 讲义

《原子的构成》讲义一、引入在我们周围的世界中,无论是构成生命的基础物质,还是各种材料和物质,都是由原子组成的。
那么,原子究竟是由什么构成的呢?这就是我们今天要探讨的主题。
二、原子的发现历程在人类探索物质构成的漫长历史中,科学家们经过了不懈的努力。
早在古希腊时期,哲学家德谟克利特就提出了“原子”的概念,他认为物质是由不可再分的微小颗粒——原子组成的。
然而,真正对原子结构进行科学研究是在近代。
19 世纪初,英国科学家约翰·道尔顿提出了原子学说,他认为原子是构成物质的最小单位,且同种元素的原子具有相同的性质和质量。
随着科学技术的不断发展,人们对原子的认识逐渐深入。
19 世纪末,汤姆逊发现了电子,这一发现打破了原子不可再分的观念。
三、原子的构成原子虽然非常小,但它也有自己的结构。
原子是由居于原子中心的原子核和核外电子构成的。
原子核带正电荷,它由质子和中子组成。
质子带正电荷,中子不带电。
而核外电子则带负电荷,它们围绕着原子核高速运动。
就好比一个小小的太阳系,原子核就像太阳,处于中心位置,而电子就像行星,围绕着原子核运转。
不同元素的原子,其质子数不同。
质子数决定了元素的种类。
比如氢原子,它的原子核内只有一个质子,而氧原子的原子核内有8 个质子。
四、原子核原子核虽然在原子中所占的体积非常小,但它却集中了原子几乎全部的质量。
质子和中子的质量差不多,而电子的质量相比于质子和中子来说非常小,可以忽略不计。
原子核的大小通常只有原子直径的几万分之一,但它却包含了原子的大部分质量。
五、质子质子是原子核中的一种粒子,带正电荷。
一个质子所带的电荷量与一个电子所带的电荷量相等,但电性相反。
质子数决定了元素的种类,也决定了原子的序数。
例如,氦原子的质子数为 2,所以它的原子序数也是 2。
六、中子中子是原子核中的另一种粒子,它不带电。
中子的存在对于维持原子核的稳定性起着重要的作用。
在一些原子核中,中子的数量会多于质子的数量。
人类探索物质结构的历史ppt 苏教版

人类探索物质结构的历史
1、 公元前5世纪,古希腊哲 学家德谟克利特等人认为 : 万物是由大量的不可分割 的微粒构成的,即原子。
ቤተ መጻሕፍቲ ባይዱ
2.
19世纪初,英国科学家 道尔顿提出近代原子学 说,他认为: 物质由原子组成,原子 不能被创造也不能被毁 灭,在化学变化中原子 不可再分割,它们的化 学性质在化学反应中保 持不变。
电子在球体运动
3、1911年英国物理学家卢瑟福(汤姆生的 学生)提出了带核的原子结构模型。
α粒子散射实验
4、1913年丹麦物理学家波尔(卢瑟福的学 生)引入量子论观点,提出电子在一定轨 道上运动的原子结构模型。
电子云模型
(几率说)
启示:
人类对原子结构认识的逐渐深入,都是 建立在实验研究基础上的,实验是揭示 原子结构的重要手段。 汤姆生、卢瑟福、玻尔等几代师生都是 诺贝尔科学奖获得者,他们勇于怀疑科 学上的“定论”,不迷信权威,为科学 的发展作出了重要贡献。自然科学就是 在不断探索中修正错误而前进的。
6、19世纪末20世纪初,量子力学 (微观粒子具有波粒二象性) 确立。量子力学是研究原子和 分子结构的理论基础。
原子结构模型的演变
1、19世纪初,英国科学家道尔顿提出 近代原子学说,他认为原子是微小 的不可分割的实心球体。
实心圆球体
2、 1897年,英国科学家汤姆生发现了电子。 1904年提出“葡萄干面包式”的原子结构 模型。
3、1811年,阿伏加德 罗提出了分子的概 念,他认为气体分子 是由几个原子构成 的。 1860年,国际化 学界确立了原子分 子论。
4、1869年,已有63 种元素为科学家所认 识,门捷列夫将各元 素按原子量的变化联 系起来,揭示了自然 界的一条基本规律--元素周期律。
原子结构的发现与发展历程

原子结构的发现与发展历程在人类探索自然的漫长历史中,对原子结构的研究是一项至关重要的课题。
从古希腊哲学家的思辨到现代科学的精确实验,我们对原子结构的认识经历了一个曲折而又充满惊喜的过程。
早在两千多年前,古希腊哲学家德谟克利特就提出了“原子”的概念。
他认为,物质是由不可分割的微小粒子——原子组成的。
然而,由于当时的技术条件限制,这仅仅是一种哲学上的思考,缺乏实验的验证。
真正开启原子结构科学研究之门的是英国科学家道尔顿。
在 19 世纪初,道尔顿提出了近代原子学说。
他认为,原子是构成物质的最小单位,同种元素的原子具有相同的质量和性质,不同元素的原子质量和性质不同。
道尔顿的学说为后来的原子结构研究奠定了基础。
进入19 世纪后期,科学家们开始通过实验来探索原子的内部结构。
英国物理学家汤姆逊在研究阴极射线时发现了电子。
这一发现打破了原子不可分割的观念,使人们认识到原子是由带负电的电子和带正电的部分组成的。
汤姆逊提出了“葡萄干布丁”模型,认为原子就像一个均匀分布着正电荷的球体,电子像葡萄干一样镶嵌在其中。
然而,汤姆逊的模型很快就受到了挑战。
新西兰物理学家卢瑟福通过著名的α粒子散射实验,对原子结构有了新的认识。
他用一束带正电的α粒子轰击金箔,发现大部分α粒子能够直接穿过金箔,但有少数α粒子发生了大角度的偏转,甚至有的被反弹回来。
这一实验结果表明,原子的中心存在一个体积很小、质量很大、带正电荷的原子核,而电子则在原子核外的空间围绕着原子核运动。
卢瑟福的这一发现被称为“原子核式结构模型”。
随着研究的深入,丹麦科学家玻尔对原子结构模型进行了进一步的改进。
他在卢瑟福模型的基础上,引入了量子化的概念。
玻尔认为,电子在原子核外的轨道是量子化的,电子只能在特定的轨道上运动,并且在这些轨道上运动时,电子不辐射能量。
当电子从一个轨道跃迁到另一个轨道时,会吸收或发射特定频率的光子。
20 世纪初,量子力学的发展为原子结构的研究提供了更强大的理论工具。
人类对原子结构的认识历史

最外层电子数 最外层电子数
一般多于4个 已达到最多(2
a
个或8个)20
画出K、Ca、Fe原子的原子结构示意图:
K
Ca
Fe
结论:同一电子层内,电子能量也并非完全相同。
a
21
5、原子轨道——电子亚层
量子力学研究表明,处于同一电子层 的原子核外电子,也可以在不同类型的原 子轨道上运动。
轨道的类型不同,轨道的形状也不同。
a
33
1.原子核外电子排布原理 (1)能量最低原理。原子核外 电子先占有能量低的轨道.然 后依次进入能量较高的轨道。
(2)泡利不相容原理。每个原 子轨道上最多只能容纳两个自 旋状态不同的电子。
(3)洪特规则。原子核外电子
在能量相同的各个轨道上排布
时①电子尽可能分占不同的原
子轨道, ②自旋状态相同,
③全充或半充满时能量最低。
a
34
a
35
2.原子的电子排布式和轨道表示式
(1)电子排布式的书写格式: ①元素符号; ②轨道符号(带电子层数); ③电子个数(右上角)。
练习:写出下列元素的电子排布式:
Na:1s22s22p63s1
K: 1s22s22p63s23p64s1
Rb:1s22s22p63s23p64s23d104p65s1
几率少,通常用所谓的“电子
云”名称形象地加以描述。电
子运动的轨道也不是传统意义
上的轨道,而是通过求解薛定
谔波动方程的一个统计值,指
的是电子出现几率最大的区域。
这个建立在量子力学基础上的
原子结构模型才是今天我们认
识的、完整的、科学的原子结
构理论。
a
9
1.人类认识原子结构的历史
原子结构认识的发展史

原子结构认识的发展史原子结构的认识发展史就像一部精彩的科幻小说,真是让人目不暇接。
想象一下,早在几千年前,古希腊的哲学家德莫克里特就开始思考物质的基本组成。
他提出了“原子”这个概念,虽然当时他没法像我们现在这样用显微镜看见原子,但他那种探索未知的精神,简直像是科学界的开山鼻祖。
德莫克里特那时说,物质是由极小的、不再可分的颗粒组成,这些颗粒就像小豆子一样,嘿,那可真是个大胆的想法!时间跳到18世纪,约翰·道尔顿来了,像是一位魔法师,把德莫克里特的理论带入了新的时代。
道尔顿用自己的实验数据,验证了原子的存在。
他认为每种元素的原子都是独一无二的,像是不同的拼图块。
道尔顿的原子理论,简直像是给科学界打开了一扇窗,大家纷纷涌进来研究原子,真是热闹非凡。
进入19世纪,巧妙的科学家们开始用更先进的实验手段,试图揭开原子的神秘面纱。
比如,J.J.汤姆森通过阴极射线实验发现了电子,这小家伙简直像是原子里的“飞人”,让大家对原子有了新的认识。
汤姆森还提出了著名的“葡萄干蛋糕模型”,想象一下,一个大蛋糕上面满是葡萄干,葡萄干就是电子,蛋糕则是正电荷的“面团”。
这画面,哈哈,简直太形象了!然而,科学从来不乏质疑。
厄尼斯特·卢瑟福可不买账,他通过金箔实验发现,原子大部分是空的,中心有个小小的核,像个超级迷你版的太阳。
这个发现让人惊呆了,原来原子并不是汤姆森想象中的那样,结构可谓天翻地覆。
卢瑟福的模型就像是一颗行星系统,中心是原子核,周围环绕着电子,真是个精妙的宇宙。
尼尔斯·玻尔又来了,带着他的新模型。
玻尔提出,电子在固定的轨道上运动,就像是小卫星在绕着行星转。
这个模型让很多人恍然大悟,原来原子的世界竟然如此有序。
玻尔的理论不仅解决了许多问题,还激发了更多科学家的想象,大家纷纷想要进一步探索原子的秘密,简直热火朝天。
但这还没完,20世纪初,量子力学的崛起让一切变得更加复杂。
海森堡的“不确定性原理”就像是给了我们一记重拳,让人不得不面对现实:在微观世界,很多东西都是模糊的,想要精确知道电子的位置和动量,几乎是不可能的。
原子结构的发展史

原子结构的发展史古代哲学观点在古代,许多哲学家提出了关于原子的理论。
最早的原子理论可以追溯到公元前5世纪的古希腊哲学家列维那,他认为物质由不可再分割的小颗粒组成。
他的观点在柏拉图和亚里士多德的著作中得到了发展。
然而,缺乏实验证据限制了这些理论的发展。
分子理论的提出17世纪末到18世纪初,化学开始成为一门独立的科学,人们开始尝试解释化学反应的基本原理。
丹尼尔·贝赫勒利(1667-1738)是最早提出分子理论的化学家之一、他认为物质由不可分割的小颗粒组成,并且具有特定的化学性质。
他的工作为后来的原子理论奠定了基础。
约翰·道尔顿的原子理论19世纪初,英国化学家约翰·道尔顿(1766-1844)提出了原子理论的著名学说。
他认为原子是不可再分割的,是物质的基本单位。
道尔顿还提出了一系列原子理论的假设,包括元素由原子组成、原子在化学反应中保持不变、不同元素的原子具有不同的质量等。
虽然他的理论在当时获得了广泛的认可,但在后来的实验中出现了一些不符合其理论的结果。
汤姆逊的电子模型19世纪末,英国物理学家约瑟夫·约翰·汤姆逊(1856-1940)通过对阴极射线的研究,提出了电子模型。
他发现阴极射线是由带负电荷的粒子组成的,并称这些粒子为电子。
汤姆逊提出了“蔓延的蛋糕模型”,将原子看作是一个带有正电荷的球体,电子均匀分布在球体内,类似于蛋糕上的水果。
这个模型成功地解释了许多实验结果,但仍然无法解释原子的稳定性和原子核内部结构。
卢瑟福的金箔实验1909年,新西兰物理学家欧内斯特·卢瑟福(1871-1937)进行了著名的金箔实验,他发射了高速α粒子(即氦离子)来轰击金箔薄片。
实验结果表明,大部分α粒子直接穿过金箔而无明显偏转,少部分粒子偏转角度很大。
卢瑟福根据实验结果提出了著名的“太阳系模型”,也称为卢瑟福模型。
根据该模型,原子中存在一个带正电荷的原子核,电子围绕着核运动,类似于行星绕着太阳运动。
My 人类对原子结构的认识
3、核电荷数为11和16的A、B两种元素 所形成的化合物一定是( B ) A、AB型 C、AB2型 B、A2B型 D、A2B3型
4、某元素B的核电荷数为Z。已知Bn-和Am+的核 外具有相同的电子层结构,则A元素的核电荷 数用Z、n、m来表示,应为( D )
A
C
Z+n-m
Z-n-m
B
D
Z-n+m
原子结构模型的演变过程
现代量子力学原子结构模型(电子云模型)①原子由原子核 和核外电子构成②电子运动的规律跟宏观物体运动的规律截 然不同;③对于多电子的原子,电子在核外一定的空间近似 于分层排布
二、原子核外电子的分层排布
1、原子核外电子的分层排布
电子层 原子核 +18 +10
+2
He
质子数或 Ne
用AZXC± 表示
18 O 8 32 16S
40 Ar 18 35 Cl17 1 H+ 1
ClH+
1
0
1
0
例题:已知R2+核内共有N个中子,R的质量数为A, m克R2+中含电子的物质的量为( D )
m( A N ) A A ( A N 2) C Am
mol
mol
m( A N 2) B A m( A N 2) D A
(4)原子在反应过程中失去或得到电子的 数目与最外层的电子数有什么关系?元素的 化合价与原子结构中的什么有关?
4、元素化合价与最外层电子数的关系:
元素 Na Mg O Cl 化合价 +1 +2 原子最外层电子数目 1 失去(或得到)电子的数目 失1个电子 失2个电子
-2
2 6
7
核科学的发展历史简介

核科学的发展历史
核科学的发展历史可以追溯到19世纪末期,在这一时期,物理学家开始对原子及其结构进行深入研究。
以下是核科学主要发展历程:
1.1896年,亨利·贝克勒尔发现了放射性。
2.1900年,玛丽·居里、皮埃尔·居里和贝克勒尔夫妇开始研究放射性,并于1903年共
同获得诺贝尔物理学奖。
3.1917年,欧内斯特·卢瑟福在实验室中发现核裂变。
这项发现为人们认识核能提供了
奠基性的证据。
4.1932年,詹姆斯·查德威克利用粒子轰击的方法分离出了重水素(氘)并证明了核反
应。
5.1938年,奥托·哈恩和弗里茨·斯特劳斯曼首次实验成功把铀原子核分裂成较小的原
子核,并放出大量能量。
这个实验奠定了核能利用的基础。
6.随后,研究人员继续探索核裂变和核聚变的过程,在第二次世界大战期间,核科学
研究成果被用于制造原子弹。
7.在战后,核科学发展出了众多应用,包括用于医学影像学的核磁共振成像技术、以
及电力生产的核能反应堆等。
总之,核科学的发展历程充满着重大的突破和里程碑式的事件,它不仅揭示了物质的内部机制,也开启了人类利用核能的新纪元。
原子结构模型演变历史

原子结构模型演变历史一、引言原子是物质的最基本单位,研究原子结构模型的发展历程是物理学的重要组成部分。
本文将从经典原子结构模型、量子力学原子结构模型到现代原子结构模型三个阶段进行详细阐述,以展示原子结构模型的演变历史。
二、经典原子结构模型1. 道尔顿原子模型19世纪早期,英国化学家道尔顿提出了第一个经典原子结构模型。
他认为原子是不可分割的,是质点球体,且不同元素的原子具有不同的质量。
2. 汤姆逊原子模型1897年,汤姆逊发现了电子,提出了“面包状模型”,即认为原子是一个正电荷均匀分布的球体,电子均匀地分布在球体内。
3. 卢瑟福原子模型1909年,卢瑟福进行了一系列散射实验,发现了原子的核心,并提出了著名的卢瑟福原子模型。
该模型认为原子是由一个极小、带正电荷的核心和绕核心运动的电子构成,电子围绕核心运动,类似于行星围绕太阳运动。
三、量子力学原子结构模型1. 波尔原子模型1913年,丹麦物理学家波尔提出了量子力学的原子结构模型,也称为波尔原子模型。
他认为电子只能在特定的能级轨道上运动,每个轨道对应一定能量。
当电子跃迁到较低能级时,会放出光子。
2. 德布罗意波动力学模型1924年,法国物理学家德布罗意提出了物质粒子也具有波动性的假设,即德布罗意波动力学模型。
他认为电子的运动状态可以用波函数描述,波函数的平方表示电子在空间中的概率分布。
四、现代原子结构模型1. 薛定谔方程1926年,奥地利物理学家薛定谔提出了薛定谔方程,用于描述电子的波动性和粒子性。
这一方程成为量子力学的核心方程,被广泛应用于原子结构模型的研究。
2. 现代原子轨道模型根据薛定谔方程解得的波函数,可以得到电子的能级和轨道分布。
根据这些信息,科学家们发展出了现代原子轨道模型。
该模型认为电子沿着不同的轨道分布,每个轨道可以容纳一定数量的电子。
3. 量子力学云模型云模型是对电子位置的概率分布进行可视化的一种方法。
该模型认为电子不是精确地位于轨道上的某一点,而是存在于一定的空间区域,被称为电子云。
人类对原子结构的认识

原子核
电子层
+6 2 4 核电荷数
原子结构示意图
观察与思考
观察上面几种原子的核外电子排布: 1、请画出Na、Mg、O 、Cl元素原子的结构示意 图。 2、稀解有释气H体e最、外Ne层、是A2r化个学或性8个质,稳达定到的稳原定因结?构。
问题解决 请从原子结构角度提出可能的观点:解 释镁原子与氧原子形成氧化镁的过程。
问题解决 完成教材31页的问题解决。
原 质子数 中子数 子 (Z) (N)
F 9 10 Na 11 12 Al 13 14
质子数+中子 数
(1A9) 23
27
相对原子质 量
18.998 22.990 26.986
ZAX
199F
23 11
Na
27 13
Al
X 原子的组成表示法: A Z
问题解决
现有三种原子的质子数(Z)、中子数
提出观点:
实验证实:
Mg +12 2 8 2
Mg2+ +12 2 8
O +8 2 6
O2- +8 2 8
Mg2+ O2-
迁移应用:分析钠原子与氯原子形成氯化钠的过程。
Mg +12 2 8 2
Mg2+ +12 2 8
O +8 2 6
O2- +8 2 8
Mg2+ O2-
交流与讨论
在MgO和NaCl的形成过程中,原子核有没有变 化?什么粒子在变化?
历程 1803年 道尔顿
1904年 汤姆生 1911年 卢瑟福 1913年 玻 尔
原子模型 “实心球”模型 “葡萄干面包”模型 “核式”模型 “核外电子分层”模型
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人类研究原子结构的历史发展历程解滨泽一.道尔顿原子学说各种物质的原子,它们各自的形状、大小、重量一定是相同的,不同物质的原子,其形状、大小及重量必不相同。
为此,他曾经作出这样的推理:假如水的某些原子比其他的水原子重,再假如某一体积的水恰恰由这些较重的水原子组成,那么这一体积的水的比重必然较其他水的比重要大(这显然与事实不符,因为我们知道无论从什么地方得来的纯水的比重都是相同的)。
由此及彼,其他物质也是如此。
道尔顿又指出,不同气体的原子的大小必然各异。
他说,如果将一体积氮与一体积氧进行化合,则会生成二体积的氧化氮,这二体积的氧化氮的数目一定不能多于一体积氮或氧的原子数。
因此,他说氧化氮的原子一定比氧、氮的原子大。
在这这种见解的基础上,道尔顿为了进一步解释一种气体扩散于他种气体的理由以及混合气体的压力问题,他又提出:同一化学物质的原子相互排斥。
道尔顿又推理说,当两种有弹性的流体混合在一起时,同一种微粒相互排斥,但并不排斥另一种微粒,因此,加在一个微粒上的压力,完全来自与它相同的微粒。
由此,他解释了他的分压定律。
正如他的一位朋友所说的那样,一种气体对别的任何气体来说都是一种真空。
以后,道尔顿进一步考虑到对各种原子的相对质量进行测量的问题,虽然进行了许多研究工作,但是依据当时的水平所测得的原子量是很不准确的,甚至无法计算各种元素的原子量,因而他不得不作了一些大胆的猜测和假设。
他首先为复杂原子进行了命名:二元化合物、三元化合物和四元化合物。
然后,他又很武断地作出了这样的结论:如果两种元素彼此化合,其化合时则遵循从最简单的方式开始,其层次分为4个。
道尔顿又据以上原则,以氢原子量为1,以此作为标准,规定了其他元素原子的相对质量。
道尔顿确定的化合物组成的规则是没有什么科学依据的,不能不说是过于主观、随意和武断之举。
因此,很多化合物复杂原子的组成被他弄错了,比如水是H2O,而他误作HO,随之氧的原子量也就错了。
1803年,10月18日,道尔顿在曼彻斯特的学会上第一次宣读了他的有关原子论的论文。
论文中说了如下几个原子论的要点:1元素的最终组成称为简单原子,它们是不可见的,既不能创造,也不能毁灭和再分割,它们在一切化学变化中本性不变。
2同一元素的原子,其形状、质量及性质是相同的;不同元素的原子则相反。
每一种元素以其原子的质量为其最基本的特征(此点乃道原子论的核心)。
3不同元素的原子以简单数目的比例相结合,形成化合物。
化合物的原子称为复杂原子,其质量为所含各元素原子质量的总和。
同一种复杂原子,其形状、质量及性质也必然相同。
至此,道尔顿完成了提出原子论的历史使命,由于该学说解决了很多化学基本定律的解释,所以很快为化学界所接受。
二.卢瑟福原子模型卢瑟福原子模型又称“有核原子模型”、“原子太阳系模型”、“原子行星模型”。
关于原子结构的一种模型。
1911年由卢瑟福提出。
认为原子的质量几乎全部集中在直径很小的核心区域,叫原子核,电子在原子核外绕核作轨道运动。
原子核带正电,电子带负电。
三、普朗克解释黑体辐射的量子理论1900年普朗克获得一个和实验结果一致的纯粹经验公式,1901年他提出了能量量子化假设:辐射中心是带电的线性谐振子,它能够同周围的电磁场交换能量,谐振子的能量不连续,是一个量子能量的整数倍:式中v是振子的振动频率,h是普朗克常数,它是量子论中最基本的常数。
根据这个假设,可以导出普朗克公式:它给出辐射场能量密度按频率的分布,式中是热力学温度, 是玻耳兹曼常数。
如图表示辐射场能量密度随波长变化的曲线,它同实验结果完全一致。
作为黑体的空腔内的辐射场,既可以分解为一系列单色平面波的叠加,又可看作是由光子组成的"气体"。
光子的能量ε、动量p、波长λ和频率v之间遵从德布罗意关系ε=hv,则有ε=сp,在p到p+d p的动量间隔内,光子的量子态数目为其中V是空腔的体积。
只有腔壁不断发射和吸收光子才能在辐射场中建立起热平衡,所以光子"气体"中的光子数就不恒定,这意味着光子"气体"的化学势为零。
而且,光子彼此间没有相互作用,光子"气体"是遵从玻色分布的理想气体。
于是,每个量子态上的平均光子数应为这样容易得到普朗克公式。
普朗克公式在高频范围hvkT的极限条件下,过渡到维恩公式此式表明,w(v,T)随着v的增加很快地趋近于零,也就是说在热平衡状态下,几乎不存在高频光子,这是因为高频光子的能量远大于kT,而腔壁发射这样高能量的光子的几率是极小的。
普朗克公式在低频hv<<kT的极限条件下,过渡到瑞利-金斯公式,这正是以经典统计理论为基础的能量均分的结果。
在瑞利-金斯公式中不出现普朗克常数h。
可见,把h看作很小乃至零时,量子理论就过渡到经典理论。
普朗克通过对黑体辐射的深刻研究而建立起来的公式是物理学的一个重大突破,他首次提出的量子论,开创了理论物理学发展的新纪元。
四.爱因斯坦解释光电效应的量子理论1905年,爱因斯坦发表论文《关于光的产生和转化的一个试探性观点》,对于光电效应给出另外一种解释。
他将光束描述为一群离散的量子,现称为光子,而不是连续性波动。
对于马克斯·普朗克先前在研究黑体辐射中所发现的普朗克关系式,爱因斯坦给出另一种诠释:频率为的光子拥有的能量为;其中,因子是普朗克常数。
爱因斯坦认为,组成光束的每一个量子所拥有的能量等于频率乘以普朗克常数。
假若光子的频率大于某极限频率,则这光子拥有足够能量来使得一个电子逃逸,造成光电效应。
爱因斯坦的论述解释了为什么光电子的能量只与频率有关,而与辐照度无关。
虽然光束的辐照度很微弱,只要频率足够高,必会产生一些高能量光子来促使束缚电子逃逸。
尽管光束的辐照度很强劲,假若频率低于极限频率,则仍旧无法给出任何高能量光子来促使束缚电子逃逸。
爱因斯坦的论述极具想像力与说服力,但却遭遇到学术界强烈的抗拒,这是因为它与詹姆斯·麦克斯韦所表述,而且经过严格理论检验、通过精密实验证明的光的波动理论相互矛盾,它无法解释光波的折射性与相干性,更一般而言,它与物理系统的能量“无穷可分性假说”相互矛盾。
甚至在实验证实爱因斯坦的光电效应方程正确无误之后,强烈抗拒仍旧延续多年。
爱因斯坦的发现开启了的量子物理的大门,爱因斯坦因为“对理论物理学的成就,特别是光电效应定律的发现”荣获1921年诺贝尔物理学奖。
图为密立根做光电效应实验得到的最大能量与频率关系线。
竖轴是能够阻止最大能量光电子抵达阳极的截止电压,P是逸出功,PD是电势差(potential difference)。
爱因斯坦的论文很快地引起美国物理学者罗伯特·密立根的注意,但他也不赞同爱因斯坦的理论。
之后十年,他花费很多时间做实验研究光电效应。
他发现,增加阴极的温度,光电子最大能量不会跟着增加。
他又证实光电疲劳现象是因氧化作用所产生的杂质造成,假若能够将清洁干净的阴极保存于高真空内,就不会出现这种现象了。
1916年,他证实了爱因斯坦的理论正确无误,并且应用光电效应直接计算出普朗克常数。
密立根因为“关于基本电荷以及光电效应的工作”获颁1923年诺贝尔物理学奖。
根据波粒二象性,光电效应也可以用波动概念来分析,完全不需用到光子概念。
威利斯·兰姆与马兰·斯考立(Marlan Scully)于1969年证明这理论。
五、波尔解释氢光谱的波尔假设玻尔的原子理论给出这样的原子图像:1.电子在一些特定的可能轨道上绕核作圆周运动,离核愈远能量愈高;2.可能的轨道由电子的角动量必须是h/2π的整数倍决定;3.当电子在这些可能的轨道上运动时原子不发射也不吸收能量,只有当电子从一个轨道跃迁到另一个轨道时原子才发射或吸收能量,而且发射或吸收的辐射是单频的,辐射的频率和能量之间关系由E=hν给出。
h为普朗克常数。
h=6.626×10^(-34)Js玻尔的理论成功地说明了原子的稳定性和氢原子光谱线规律。
玻尔的理论大大扩展了量子论的影响,加速了量子论的发展。
1915年,德国物理学家索末菲(Arnold Sommerfeld,1868-1951)把玻尔的原子理论推广到包括椭圆轨道,并考虑了电子的质量随其速度而变化的狭义相对论效应,导出光谱的精细结构同实验相符。
六、波粒二象性和测不准原理不确定性原理(Uncertainty principle)是由海森堡于1927年提出,这个理论是说,你不可能同时知道一个粒子的位置和它的速度,粒子位置的不确定性,必然大于或等于普朗克常数(Planck constant)除于4π(ΔxΔp≥h/4π),这表明微观世界的粒子行为与宏观物质很不一样。
此外,不确定原理涉及很多深刻的哲学问题,用海森堡自己的话说:“在因果律的陈述中,即‘若确切地知道现在,就能预见未来’,所得出的并不是结论,而是前提。
我们不能知道现在的所有细节,是一种原则性的事情。
”七、薛定谔方程的意义薛定谔方程(Schrödinger equation)又称薛定谔波动方程(Schrodinger wave equation),是由奥地利物理学家薛定谔提出的量子力学中的一个基本方程,也是量子力学的一个基本假定。
它是将物质波的概念和波动方程相结合建立的二阶偏微分方程,可描述微观粒子的运动,每个微观系统都有一个相应的薛定谔方程式,通过解方程可得到波函数的具体形式以及对应的能量,从而了解微观系统的性质。
薛定谔方程表明量子力学中,粒子以概率的方式出现,具有不确定性,宏观尺度下失效可忽略不计。
