反应工程课后答案
(完整版)化学反应工程课后习题答案.

积分之
2.10在催化剂上进行三甲基苯的氢解反应:
反应器进口原料气组成为66.67%H2,33.33%三甲基苯。在0.1Mpa及523K下等温反应,当反应器出口三甲基苯的转化率为80%时,其混合气体的氢含量为20%,试求:
(1)(1)此时反应器出口的气体组成。
(2)(2)若这两个反应的动力学方程分别为:
组分
摩尔分率yi0
摩尔数ni0(mol)
CH3OH
2/(2+4+1.3)=0.2740
27.40
空气
4/(2+4+1.3)=0.5479
54.79
水
1.3/(2+4+1.3)=0.1781
17.81
总计
1.000
100.0
设甲醇的转化率为XA,甲醛的收率为YP,根据(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数nA、nP和nc分别为:
组分
摩尔质量
摩尔分率yi
CO
28
15.49
H2
2
69.78
CO2
44
0.82
CH4
16
3.62
N2
28
10.29
总计
100
其中冷凝分离后气体平均分子量为
M’m=∑yiMi=9.554
又设放空气体流量为Akmol/h,粗甲醇的流量为Bkg/h。对整个系统的N2作衡算得:
5.38B/28×1000+0.1029A=2.92 (A)
20
30
40
50
60
70
试求当进口原料气体流量为50ml/min时CO的转化速率。
解:是一个流动反应器,其反应速率式可用(2.7)式来表示
反应工程答案

1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) 反应的选择性;(2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反甲醛和二氧化碳的摩尔数nA 、nP 和nc 分别为:nA=nA0(1-XA)=7.672 mol nP=nA0YP=18.96 molnC=nA0(XA-YP)=0.7672 mol 结合上述反应的化学计量式,水(nW )、氧气(nO )和氮气(nN )的摩尔数分别为:nW=nW0+nP+2nC=38.30 mol nO=nO0-1/2nP-3/2nC=0.8788 mol nN=nN0=43.28 mol2 反应动力学基础2.1在一体积为4L 的恒容反应器中进行A 的水解反应,反应前 A 的含量为12.23%(重量),混合物的密度为1g/mL ,反应物A 的分子量为88。
在等温常压下不断取样分析,测的解:利用反应时间与组分A 的浓度变化数据,作出CA ~t 的关系曲线,用镜面法求得t=3.5h 时该点的切线,即为水解速率。
切线的斜率为0.760.125/.6.1α-==-mol l h由(2.6)式可知反应物的水解速率为0.125/.-==dC A r mol l hAdt2.4在等温下进行液相反应A+B →C+D ,在该条件下的反应速率方程为:1.50.50.8/min =⋅A A B r C C mol l若将A 和B 的初始浓度均为3mol/l 的原料混合进行反应,求反应4min 时A 的转化率。
《化学反应工程》课后习题答案

(2)放热反应吸热反应
(3)M点速率最大,A点速率最小M点速率最大,A点速率最小
(4)O点速率最大,B点速率最小H点速率最大,B点速率最小
(5)R点速率大于C点速率C点速率大于R点速率
(6)M点速率最大根据等速线的走向来判断H,M点的速率大小。
2.7在进行一氧化碳变换反应动力学研究中,采用B106催化剂进行试验,测得正反应活化能为 ,如果不考虑逆反应,试问反应温度是550℃时的速率比反应温度是400℃时的速率大多少倍?
(1)(1)以反应体积为基准的速率常数kV。
(2)(2)以反应相界面积为基准的速率常数kg。
(3)(3)以分压表示反应物系组成时的速率常数kg。
(4)(4)以摩尔浓度表示反应物系组成时的速率常数kC。
解:利用(2.10)式及(2.28)式可求得问题的解。注意题中所给比表面的单位换算成m2/m3。
2.4在等温下进行液相反应A+B→C+D,在该条件下的反应速率方程为:
原料气和冷凝分离后的气体组成如下:(mol)
组分
原料气
冷凝分离后的气体
CO
26.82
15.49
H2
68.25
69.78
CO2
1.46
0.82
CH4
0.55
3.62
N2
2.92
10.29
粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg粗甲醇而言,其溶解量为CO29.82g,CO 9.38g,H21.76g,CH42.14g,N25.38g。若循环气与原料气之比为7.2(摩尔比),试计算:
(完整版)反应工程课后答案完整版.
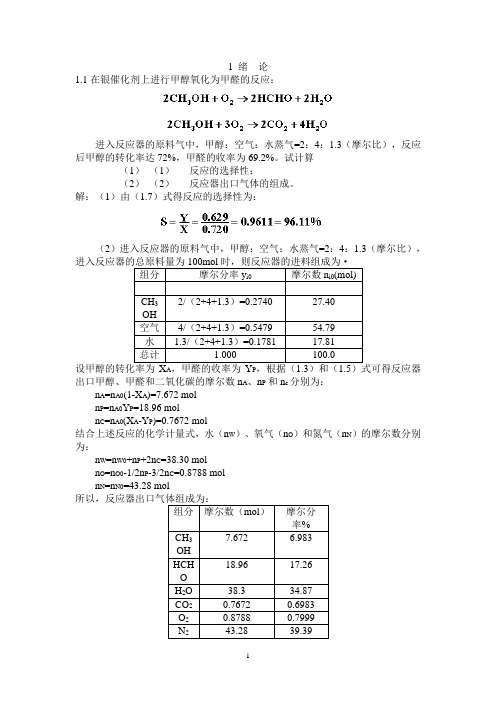
1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分摩尔分率y i0 摩尔数n i0(mol)CH32/(2+4+1.3)=0.2740 27.40OH空气4/(2+4+1.3)=0.5479 54.79水 1.3/(2+4+1.3)=0.1781 17.81总计 1.000 100.0A P出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol组分摩尔数(mol)摩尔分率%7.672 6.983CH3OH18.96 17.26HCHOH2O 38.3 34.87CO2 0.7672 0.6983O2 0.8788 0.7999N2 43.28 39.392 反应动力学基础2.4在等温下进行液相反应A+B→C+D,在该条件下的反应速率方程为:若将A和B的初始浓度均为3mol/l的原料混合进行反应,求反应4min时A的转化率。
解:由题中条件知是个等容反应过程,且A和B的初始浓度均相等,即为1.5mol/l,故可把反应速率式简化,得由(2.6)式可知代入速率方程式化简整理得积分得解得X A=82.76%。
2.6下面是两个反应的T-X图,图中AB是平衡曲线,NP是最佳温度曲线,AM是等温线,HB是等转化率线。
《化学反应工程》(第四版)课后习题答案详解

(3)两个CSTR串联
VR C A0 x A1 C A0 ( x A2 x A1 ) 根据 V0 rA1 rA2
m 1 m2
C A0 x A1 C A0 ( x A2 x A1 ) kCA0 (1 x A1 )C A0 x A1 kCA0 (1 x A2 )C A0 x A2 1 ( x A2 x A1 ) ; (1 x A1 ) (1 x A2 ) x A2
x A1
0
xA2 dxA dxA 4.35 2 2 x A1 (1 x ) (1 x A1 ) A1
1 1 1 1 4.35 1 x A1 1 x A2 1 x A1 1 1 4.35; 1 x A1 1 5.35 4.35; 1 x A2 1 5.35; x A1 0.81; 1 x A1
1 1 8.314 0.7 1 ln[ / ln ] 423 T2 83.681000 1 0.7 1 0.6 1 1 8.314 0.9347 ; 423 T2 83.681000
T2 441K
习题3-5解答
C A0
1 C B 0 2.0 1.0mol / L 2 CP 0 CR 0 0; xAf CB 0 xBf 1.0 0.8 0.533 xBf 0.8; ; C A0 1.5 CA 1.5 (1 0.533) 0.7; CP CR CB0 xBf 1.0 0.8 0.8;
1 5 0.99 t2 ln 5.81(h) 4 0.615 0.307 5 (1 0.99)
分析:等当量配料,随转化率提高,反应时间迅速增长; 若采用过量组分配料,随转化率提高,反应时间增长放慢。
李绍芬《反应工程》课后习题答案

李绍芬《反应工程》课后习题答案1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分 摩尔分率y i0 摩尔数n i0(mol) CH 3OH 2/(2+4+1.3)=0.2740 27.40 空气 4/(2+4+1.3)=0.5479 54.79 水 1.3/(2+4+1.3)=0.1781 17.81 总计 1.000 100.0A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol组分 摩尔数(mol ) 摩尔分率% CH 3OH 7.672 6.983 HCHO 18.96 17.26 H 2O 38.3 34.87 CO 2 0.7672 0.6983 O 2 0.8788 0.7999 N 2 43.28 39.391. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+ 242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩原料气 Bkg/h 粗甲醇 Akmol/h100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
化学反应工程第二版课后答案

第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。
2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。
基元反应符合质量作用定律。
基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。
基元反应的反应级数是该反应的反应分子数。
一切不符合质量作用定律的反应都是非基元反应。
非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。
非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。
3若将反应速率写成tc rd d AA -=-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。
4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器?答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。
5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)A+2B ↔C A+C ↔ D (2)A+2B ↔C B+C ↔D C+D →E(3)2A+2B ↔CA+C ↔D 解(1)D4C A 3D D 4C A 3C 22BA 1C C22B A 1B D 4C A 3C 22B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=(2)E6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22BA 1C D4C B 3C 22B A 1B C22B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-=(3)D4C A 3D D 4C A 3C 22B2A 1C C22B 2A 1B D 4C A 3C 22B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65×104m 6kmol -2s -1。
李绍芬版反应工程答案

1 绪论之答禄夫天创作1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol时,则反应A P)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol1.1. 2其主副反应如下:由于化学平衡的限制,反应过程中一氧化碳不成能全部转化成甲醇,为了提高原料的利用率,生产上采取循环操纵,即将反应后的气体冷却,可凝组份变成液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回原料气Bkg/h 粗甲醇 Akmol/h100kmol放空气体原料气和冷凝分离后的气体组成如下:(mol)组分原料气冷凝分离后的气体COH2CO2CH4N2粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
在操纵压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg粗甲醇而言,其溶解量为CO2 9.82g,CO 9.38g,H2 1.76g,CH4 2.14g,N25.38g。
《化学反应工程》第五版(朱炳辰)课后习题答案

第一章1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+ 242CO 3H CH H O +⇔+ 24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩Bkg/h 粗甲醇100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
化学反应工程第二版课后答案

第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。
2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。
基元反应符合质量作用定律。
基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。
基元反应的反应级数是该反应的反应分子数。
一切不符合质量作用定律的反应都是非基元反应。
非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。
非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。
3若将反应速率写成tc rd d AA -=-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。
4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器?答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。
5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)A+2B →C (2)A+2B →C (3)2A+2B →CA+C →D B+C →D A+C →D C+D →E 解(1)D4C A 3D D 4C A 3C 22BA 1C C22B A 1B D4C A 3C 22B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=(2)E6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22BA 1C D4C B 3C 22B A 1B C22B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-=(3)D4C A 3D D 4C A 3C 22B2A 1C C22B 2A 1B D 4C A 3C 22B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65×104m 6kmol -2s -1。
生物反应工程第二版课后习题答案

生物反应工程第二版课后习题答案生物反应工程第二版课后习题答案生物反应工程是一门研究利用生物体进行工程化生产的学科,它涉及到生物体的生理学、微生物学、化学工程学等多个学科的知识。
生物反应工程的目标是通过合理设计和优化反应条件,提高生物体的生产能力和产物质量,从而实现高效、可持续的生产。
在学习生物反应工程的过程中,课后习题是检验学生对知识掌握程度的重要方式。
下面是《生物反应工程第二版》课后习题的答案,供大家参考。
第一章:生物反应工程概述1. 生物反应工程是一门研究利用生物体进行工程化生产的学科。
2. 生物反应工程的目标是通过合理设计和优化反应条件,提高生物体的生产能力和产物质量。
3. 生物反应工程涉及到生物体的生理学、微生物学、化学工程学等多个学科的知识。
第二章:微生物生长动力学1. 微生物生长动力学是研究微生物生长和代谢的数量关系的学科。
2. 在生物反应工程中,通常使用生长速率方程来描述微生物生长的动力学过程。
3. 常见的生长速率方程有Monod方程、麦克斯韦方程等。
第三章:反应器设计与操作1. 反应器是进行生物反应工程的核心设备,其设计与操作对反应过程的效果有重要影响。
2. 常见的反应器类型有批式反应器、连续流动反应器、气液循环反应器等。
3. 反应器的设计应考虑反应物的输送、温度、pH值等因素。
第四章:质量传递与传质过程1. 质量传递是指物质在反应器中的传输过程,包括物质的输送和扩散。
2. 传质过程对反应的速率和效果有重要影响,需要进行合理的设计和优化。
3. 常见的传质方式有对流传质、扩散传质等。
第五章:反应动力学与反应机理1. 反应动力学是研究反应速率与反应物浓度之间关系的学科。
2. 反应机理是指反应过程中发生的化学反应步骤和反应物之间的转化关系。
3. 反应动力学和反应机理的研究对于反应过程的优化和控制具有重要意义。
总结起来,生物反应工程是一门综合性学科,涉及到生物体的生理学、微生物学和化学工程学等多个学科的知识。
化学反应工程1-2章习题答案

化学反应工程1-2章答案(华东理工大学张濂版课后习题)第一章1-1 乙苯循环量:46kg/h 补充的新鲜乙苯:100-46=54 kg/h单程转化率=(100-46)/100×100%=54%选择率=(48/105)/(54/107)×100%=90.6%单程摩尔收率=(48/105)/(100/107)×100%=48.9% 单程质量收率=48/100×100%=48% 总摩尔收率=(48/105)/(54/107)×100%=90.6% 总质量收率=48/54×100%=88.9%单耗(摩尔)=1/90.6%=1.104 单耗(质量)=1/88.9%=1.1241-2以100kg进口气体为基准,设甲醛转化量为xkg则:进口出口100kg 100kg甲醛:10kg 1.6kg丁炔二醇:0kg 7.65kg转化率=(10-1.6)/10×100%=84%选择率=(7.65/86)/((10-1.6)/30)×100%=31.76%单程质量收率=7.65/100×100%=7.65%总质量收率=7.65/(10-1.6)×100%=91.07%1-3得到的顺丁烯二酸酐:20.27×34.5%=6.99t质量收率:6.99/7.21×100%=96.9%摩尔收率:(6.99/98)/(7.21/78)×100%=72.7%第二章2-1 化学计量方程式不影响速率表达式,因此以反应物B和产物P表示的反应速率表达式为:(-r B)=k B C B2C p22-2k C=(-r A)/C A n k P=(-r A)/P A nn=0 (-r A)=k C=k P mol/m3﹒hn=1 k C =(-r A)/C A=( mol/m3﹒h)/(mol/L)=(103h)-1k P=(-r A)/P A=( mol/m3﹒h)/Mpa=mol/m3﹒h﹒Mpan=2 k C=(-r A)/C A2=( mol/m3﹒h)/ (mol/L)2=(106h﹒mol)-1k P=(-r A)/P A2=( mol/m3﹒h)/(Mpa)2= mol/m3﹒h﹒Mpa2 2-3 t1=8d=11520min T1=20℃=293Kt2=10min T2=120℃=393Kln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)ln(11520/10)=E/8.314(1/293-1/393)E=67751J/mol2-4 ln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)1)r2/r1=2 T1=473K E1=156.9kJ/molln2=156.9×103 /8.314(1/473-1/T2)T2=482.3K=209.3℃△T=9.3℃2)同1),ln2=104.6×103 /8.314(1/473-1/T2)T2=489K=216℃△T=16℃2-5 ln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)ln2=E1/8.314(1/300-1/310) E1=57616J/mol同理:ln2=E2/8.314(1/400-1/410) E2=94607J/mol ln2=E3/8.314(1/500-1/510) E3=144040J/molln2=E4/8.314(1/600-1/610) E4=208332J/mol。
化学反应工程课后习题答案

化学反应工程课后习题答案化学反应工程课后习题答案化学反应工程是化学工程学科中的重要分支之一,它研究的是化学反应在工业生产中的应用。
通过对反应过程的分析和优化,可以提高反应的产率、选择性和经济性。
在学习化学反应工程的过程中,我们经常会遇到一些习题,下面我将为大家提供一些常见习题的解答。
1. 习题一:对于一个一级反应A→B,初始浓度为C0的A,经过一段时间t后,浓度为Ct。
求该反应的速率常数k。
解答:根据一级反应的速率方程,可以得到d[A]/dt = -k[A],其中d[A]/dt表示A的浓度随时间的变化率。
根据题意,我们可以得到d[A]/dt = (Ct - C0)/t。
将这两个式子相等,可以得到(Ct - C0)/t = -k[A]。
由于初始浓度为C0的A,所以[A] = C0。
将这个值代入上式,可以得到(Ct - C0)/t = -kC0。
整理一下,就可以得到k = (C0 - Ct)/C0t。
2. 习题二:对于一个二级反应A + B→C,初始浓度分别为C0的A和C1的B,经过一段时间t后,浓度分别为Ct的A和Ct+1的B。
求该反应的速率常数k。
解答:根据二级反应的速率方程,可以得到d[A]/dt = -k[A][B],d[B]/dt = -k[A][B]。
根据题意,我们可以得到d[A]/dt = (Ct - C0)/t,d[B]/dt = (Ct+1 - C1)/t。
将这两个式子相等,可以得到(Ct - C0)/t = (Ct+1 - C1)/t = -k[A][B]。
由于初始浓度分别为C0的A和C1的B,所以[A] = C0,[B] = C1。
将这两个值代入上式,可以得到(Ct - C0)/t = (Ct+1 - C1)/t = -kC0C1。
整理一下,就可以得到k = (C0- Ct)/(C0C1t) = (Ct+1 - C1)/(C0C1t)。
3. 习题三:对于一个零级反应,初始浓度为C0的A,经过一段时间t后,浓度为Ct。
化学反应工程梁斌习题答案

化学反应工程(梁斌)习题答案化学反应工程是研究和优化化学反应过程的学科,涉及到反应的热力学、动力学、传质和传热等方面。
在化学工程中,反应工程是一个非常重要的环节,它直接关系到产品质量、产量和能源消耗等方面。
下面是一些化学反应工程的习题及其答案:1. 对于以下反应:A → B + C,饱和蒸汽中的A浓度为0.1 mol/L。
在一连续流动反应器中,反应速率常数k为0.02 min^-1。
求当反应器长度为10 m时,反应程度的变化。
答案:反应程度可以通过反应物的浓度变化来表示。
根据连续流动反应器的质量平衡方程,可以得到:dC/dL = -kCA其中,C为B的浓度,L为反应器长度,CA为A的浓度。
将该方程进行积分,得到:∫dC/C = -k∫dLln(C/C0) = -kL其中,C0为初始反应物A的浓度。
代入相关数值,可以得到反应程度随反应器长度的变化。
2. 某一反应的活化能为50 kJ/mol,温度升高10 K时,反应速率增加2倍。
求该反应在298 K时的速率常数。
答案:根据阿累尼乌斯方程,可以得到:k1/k2 = exp[(Ea/R) * (1/T2 - 1/T1)]其中,k1和k2分别为温度T1和T2下的速率常数,Ea为活化能,R为气体常数。
代入相关数值,可以求得该反应在298 K时的速率常数。
3. 某一反应的反应速率方程为r = kCACB。
当CA = 0.1 mol/L,CB = 0.2 mol/L时,反应速率为0.05 mol/(L·min)。
求该反应的速率常数。
答案:根据反应速率方程,可以得到:r = kCACB代入相关数值,可以求得该反应的速率常数。
化学反应工程课后习题答案.

1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+ 242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩Bkg/h 粗甲醇100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
化学反应工程第三版课后答案

化学反应工程第三版课后答案【篇一:化学反应工程第二版课后习题】> 2何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么? 345现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)a+2b?c a+c? d (2)a+2b?c b+c?d c+d→e (3)2a+2b?ca+c?d10mkmols。
现以气相分压来表示速率方程,即(?ra)=kppapb,求kp=?(假定气体为理想气体)46-2-12化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?若将反应速率写成?ra??dcadt,有什么条件?为什么均相液相反应过程的动力学方程实验测定采用间歇反应器? 78反应a(g) +b(l)→c(l)气相反应物a被b的水溶液吸收,吸收后a与b生成c。
反应动力学方程为:?ra=kcacb。
由于反应物b在水中的浓度远大有一反应在间歇反应器中进行,经过8min后,反应物转化掉80%,经过18min后,转化掉90%,求表达此反应的动力学方程式。
反应2h2?2no?n2?2h2o,在恒容下用等摩尔h2,no进行实验,测得以下数据总压/mpa 半衰期/s10 考虑反应a?3p,其动力学方程为?ra??容下以总压表示的动力学方程。
11 a和b在水溶液中进行反应,在25℃下测得下列数据,试确定该反应反应级数和反应速度常数。
116.8 319.8 490.2 913.8 1188 时间/s-312 丁烷在700℃,总压为0.3mpa的条件下热分解反应:c4h10→2c2h4+h2 (a) (r)(s)起始时丁烷为116kg,当转化率为50%时?dprdnsdya,?。
dtdtdtdpadt?0.24mpa?s?13-1-1-3-33-10.0272265 0.0326 186 0.0381 135 0.0435 104 0.0543 67求此反应的级数。
化学反应工程郭凯第三版课后答案

化学反应工程郭凯第三版课后答案
一、填空题
1、化学反应工程是一门研究的科学。
(化学反应的工程问题)。
2、化学反应工程是一研究化学反应的工程问题的科学,以作为研究对象,以为研究象的学科体系。
(学反应、工程问题)。
3、是化学反应工程的基础。
(三传一反)。
4、程操作法分为、操作。
(分批式操作、连续式操作,半分批式)。
5、化学反应工程中的“三传一反”中的三传是指。
(传质、传热、动量传递)。
6、不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称,(数学模型)。
7、在建立数学模型时,根据基础资料建立物料、热量和动量衡算式的一般式为。
(累积量=输入量-输出量)。
二、选择题
8、“三传一反”是化学反应工程的基础,其中所谓的一反是指(D)。
A、化学反应
B、反应工程
C、反应热力学
D、反应动力学
9、“三传一反”是化学反应工程的基础,下列不属于三传的是。
(A)。
A、能量传递
B、质量传递
C、热量传递
D、动量传递。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 均相反应动力学1、有一反应在间歇反应器中进行,经过8min 后,反应物转化掉80%,经过18min 后,转化掉90%,求表达此反应的动力学方程式。
2A A min 18A0min 8A0AA A0d d 219.019.0181)(218.018.081)(11kc tc kc kc x x c kt =-=-⋅==-⋅=-⋅=为假设正确,动力学方程3、 在间歇反应器中有一级液相可逆反应P A ⇔,初始反应时C A0=0.5mol/L ,C P0=0反应8min 后,A 的转化率为1/3,而平衡转化率是2/3,求此反应的动力学方程式。
解:p A AC k C k dtdC 21-=-21002122)1(k k x C x C C C K k k Ae A Ae A Ae Pe ==-===即根据一级可逆反应积分式1212121min 08664.082ln 3132ln 18ln1-==+∴+=-+=k k k k x x x k k t AAe Ae 1211m in 02888.0m in 05776.0--==∴k kP A p A AC C C k C k dtdC 02888.005776.021-=-=-5、恒温恒容的气相反应A →3P ,其动力学方程为Vn k dt dn V r A AA =-=-1)(,在反应过程中系统总压p t 及组分A 的分压均为变量,试推导)(A tp f dtdp =的表达式。
解:AtAA AtA A A A AAA A t A A t A A A t kp dtdp RT pk kc V n k dt dp RT dt dp RT dt dp RT dt dc r V n k dt dn v r dtdpdt dp p p p p p p p 221211(1)(22)(3)00======-=-=-=-=--=--=-+=得即8、纯气相组分A 在一等温等容间歇反应器中按计量式P A 5.2⇔进行反应,实验测得如下数据,时间/min 0 2 4 6 8 10 12 14 ∝ 分压p A /MPa 0.1 0.08 0.0625 0.0510.0420.0360.0320.028 0.020用积分法求此反应的动力学方程式。
解:由于当∞→t 时,02.0=A p 常数,因此假设为一级可逆反应。
)即,即,达到平衡时,020220202202121212102151(5.125.25.125.25.210)(5.2101002.02.02.0)02.01.0(5.2)(5.25.2A A A A A A A A A A AAe pe peAeA A p pA Ap p k p k p k p k p k p k p p k p k dtdp k k p p k k RT p k RT p k MPap p p c k c k dtdc pA e -=-=-+-=-⋅-=-====∴==-=-=-=-→∞tktk p p p p p p p ktp p kdtp p dp A A A A AA A pp A A A AAAA 2200000005.1202.008.0ln 5.12518.0ln 5151ln5.1251ln 5.12510==-=--=⎥⎦⎤⎢⎣⎡--=--11122min 126.0min 0126.01581.05.121581.0--====k k k 即,斜率)2.0(0126.05.120126.0126.0,0A A A p A Ap p dtdpc c dt dc -⨯=--=-即第三章 均相反应过程1、液相一级等温反应在间歇釜中达到70%转化率需要12min ,若此反应移到同温度下平推流反应器和全混流反应器中进行时,所需要的空时和空速各为多少?解:10011min 0429.07031min3.23370)7.01(1.07.0)1()(min 083.01211min12min 1.07.01ln 12111ln 111ln---===∴==-⨯=-==-========-=∴-=cv A AA A A f A A A c v BR A Ax k x kc x c r x c CSTR t PFR x t k x kt τδττδ中在空速中所需的空时在3、液相反应在一间歇反应器中进行,反应速率如下表所示: C A /mol/L0.10.2 0.3 0.4 0.5 0.60.70.81.01.32.0(-r A )/mol/(L.min) 0.10.30.50.60.50.25 0.10 0.06 0.05 0.045 0.042(1) 若C A0=1.3mol/L ,,则反应时间为多少?(2)若反应移至平推流反应器中进行,C 0A =.5mol/L ,F A0=1000mol/h ,求x A0=0.30时所需反应器的大小。
(3) 当C A0=1.2mol/l ,F A0=1000mol/h ,x A =0.75时,求所需全混流釜式反应器大小。
解:由)(~A A r c -表作出A A c r ~)(1-曲线 (1)min7.12045.005.03.02105.006.02.0212106.01.025.05.06.0215.01.0?3.0,3.111111111110=+⨯⨯++⨯⨯+⨯+++++⨯⨯====----------)()()(用梯形法BR Af A t L mol c L mol c(2)lmol x c c l c F V mol L F V r c r c r dc r dc F V L mol x c c A A Af A A p A p A A A A A A c c A A Aop A A Af A A3.0)75.01(2.1)1()3(1092.160100081.981.9min 81.9)67.2222.22(2.021)22.2237.20)(05.13.1(2167.22)22.228.23(7.02.022.22(1,5.137.2022.2167.020)2022.22(3.005.020(1,05.1)()(05.1)3.01(5.1)1(0000))5.105.100=-=-==⨯=⨯=⋅=+⨯⋅++-⨯==-⋅+=-==⨯+=-⋅+=-=-=-==-⨯=-=⎰⎰梯形法:用内插法:L V r c c c F V f A A Af A A 256010005.15.15.02.13.02.1)(000=⨯==⨯-=--=∴5、丙烷裂解为乙烯的反应可表示为C 3H 8→C 2H 4+CH 4(忽略副反应) 在772℃等温反应时,动力学方程为-A Akp dtdp =,其中k=0.4h -1。
若系统保持恒压p=0.1MPa,ν0=0.8m 3/h(772℃,0.1MPa),求当x A =0.5时,所需平推流反应器的体积大小。
解:恒压变容反应()30020220000036077.28.0466.3466.32ln 4.0211ln 2)1(2)1(21)()1(2)1)(1(21112))1(1)1()1(1(11)(5.111045314.8101.0m V x k x kdx v V x c kdt dx x c r x k x x k dt dx x x kp kp dt dx x dt dp dt dx x x x p dt dp x x p p x dx c v V m mol RT p c p A x A Ap A A A A A A A A A A A A A A A A A AA A A A A AAA A x AAA p A A AA =⨯===-=-=∴-=+=--=+-=+--=-=+-=+⨯--+-=+-=-==⨯⨯==⎰⎰即:8、一级反应A→P ,在一体积为VP 的平推流反应器中进行,已知进料温度为150℃,活化能为84kJ·mol-1,如改用全混流反应器,其所需体积设为Vm ,则Vm/Vp 应有何关系?当转化率为0.6时,如果使Vm=Vp ,反应温度应如何变化?如反应级数分别为n=2,1/2,−1时,全混流反应器的体积将怎样改变?解:)1ln()1()exp()1ln()1()1(CSTR)1ln(11d 1)(d PFR )exp()(A A Ap m A A A p m A 0A AA0m A A00A A A00A A A0PA 0A A AAx x x RT E RT E x x k kx V V x k c x F V x kc x x kc r x F V c RTE k kc r x x ----=---=-=--=-=-=-==-⎰⎰)1ln()1()1ln()1( IF A A A A A P m mp x x x x x k k x V V T T A---=---==()()K07. 43215. 42302064.015.423876.234929.015.423876.23exp6109 .0637.115.42315.423314.884000exp 1)6.01ln(6.016.0exp 10.6 and1IFmmmmmmmmmPmPAPm=-=--=-⎪⎪⎭⎫⎝⎛⎪⎪⎭⎫⎝⎛-=⨯⎪⎪⎭⎫⎝⎛⎪⎪⎭⎫⎝⎛-=--⨯⎪⎪⎭⎫⎝⎛--===TTTTTTTTTTTTTRExVVmnnnnkcxFVcVVcVVkcxFVncVVkcxFVncVVkcxFVnAfAfA0m1Am1m2A1m1m1AAA0m2/1A1m2/1m2/1AAA0mA1m2m2AAAm1,1,2/11 ,2==⎪⎪⎪⎩⎪⎪⎪⎨⎧==-=======---或PPT课件答案1、在间歇反应器中进行液相反应A+B→P,C A0=0.307mol/L,测得二级反应速率常数k=61.5×10-2L/(mol·h),计算当C B0/C AO=1和5时,转化率分别为0.5,0.9,0.99所需要的反应时间,并对计算结果加以讨论。
2、 已知:苯醌与环戊二烯在25℃下进行液相二烯合成反应 A+B →C(-r A )=B A C kC ;k=9.92×10-3[m 3/kmol·s];C AO =0.1[kmol/m 3];C BO =0.08[kmol/m 3];x A =0.95;t /=1[h];每天处理300kg 环戊二烯。
求:反应器有效容积?AOC t =⎰-Ax A A r dx 0)(; (-r A )=A kC B C =2)1(A BO AO x C kC -65.63600195.0195.008.01092.91)1(3=⋅-⋅⨯⨯=--A BO A x kC x [h]]/[261.4367.2894.108.02466/3001.02466/3003h m v v v OB OA o =+=⨯+⨯=+=V=][6.32)165.6(261.4)(3/m t t v O =+=+⎰⎰-=-=AAx x A A BOA BO AO A AO x dx kC x C kC dx C t 02)1(1)1(3、在等温间歇反应器中进行乙酸乙酯皂化反应: CH3COOC2H5+NaOH→CH3COONa+C2H5OH 该反应对乙酸乙酯及氢氧化钠均为一级。
