蔗糖酶课件(郑)讲课讲稿
合集下载
实验二蔗糖酶

3. 酵母细胞存在两种蔗糖酶,一种在细胞壁中,一种在细胞 质内,前者活力较高,分子量较大(约270KDa),后者活 力较低,分子量约为135KDa,两种酶的底物专一性和动力 学性质十分相似,因此,本实验未区分内酶与外酶。
提取工艺
1. 破碎酵母细胞的方法:
蔗糖酶分子量较大,一般采用研磨法彻底破碎 细胞使其释放出来,但应注意研磨过程中保持 低温防止酶失活;
或者采用自溶法(适当的酸度和温度下利用酵 母菌自身的酶系破坏细胞壁),此方法较为温 和,但是时间较长,需加入少量防腐剂,防止 过程中外界细菌污染;
原则:低温,处理时间短,防止酶失活。
2. 选择性热变性: 根据蔗糖酶的耐热性质,将热不稳定性杂蛋白变性除去, 而蔗糖酶保持活性仍在上清液中;该法简便易行。
离心获得粗酶液 吸取3mL酵母细胞破碎液于离心管中(两组同学配平),5000rpm 15min, 保留上清液;——粗酶液
分离纯化获得纯酶液 1. 吸取剩余的7mL酵母细胞破碎液于烧杯中,45度水浴15min,缓慢搅拌(防
止产生泡沫,蛋白质变性),迅速冷却, 5000rpm 15min,保留上清 液;——选择性热变性除去杂蛋白 2. 将上清液置于烧杯中,加入等体积预冷的无水乙醇(乙醇终浓度约50%), 边加边缓慢搅拌,-20度静置15~20min,5000rpm 15min,保留沉淀 物;——有机溶剂沉淀法获得蔗糖酶 3. 吸取7mLPBS(pH7.2)于沉淀物中,轻轻搅拌促溶;——纯酶液
原则:1、选择合适的温度和加热时间,防止目的物变性, 2、溶液的蛋白质浓度要合适,防止蔗糖酶与杂蛋白共沉淀。
3. 有机溶剂沉淀法: 根据蔗糖酶的分子量和亲水性,在溶液中加入一定量的无水乙醇溶 液,利用其脱水作用,破坏了蛋白质分子表面的水化膜,使蔗糖酶 聚集沉淀下来,而与其它杂质分开。一般采用分级沉淀法摸索目的 物沉淀的条件。
提取工艺
1. 破碎酵母细胞的方法:
蔗糖酶分子量较大,一般采用研磨法彻底破碎 细胞使其释放出来,但应注意研磨过程中保持 低温防止酶失活;
或者采用自溶法(适当的酸度和温度下利用酵 母菌自身的酶系破坏细胞壁),此方法较为温 和,但是时间较长,需加入少量防腐剂,防止 过程中外界细菌污染;
原则:低温,处理时间短,防止酶失活。
2. 选择性热变性: 根据蔗糖酶的耐热性质,将热不稳定性杂蛋白变性除去, 而蔗糖酶保持活性仍在上清液中;该法简便易行。
离心获得粗酶液 吸取3mL酵母细胞破碎液于离心管中(两组同学配平),5000rpm 15min, 保留上清液;——粗酶液
分离纯化获得纯酶液 1. 吸取剩余的7mL酵母细胞破碎液于烧杯中,45度水浴15min,缓慢搅拌(防
止产生泡沫,蛋白质变性),迅速冷却, 5000rpm 15min,保留上清 液;——选择性热变性除去杂蛋白 2. 将上清液置于烧杯中,加入等体积预冷的无水乙醇(乙醇终浓度约50%), 边加边缓慢搅拌,-20度静置15~20min,5000rpm 15min,保留沉淀 物;——有机溶剂沉淀法获得蔗糖酶 3. 吸取7mLPBS(pH7.2)于沉淀物中,轻轻搅拌促溶;——纯酶液
原则:1、选择合适的温度和加热时间,防止目的物变性, 2、溶液的蛋白质浓度要合适,防止蔗糖酶与杂蛋白共沉淀。
3. 有机溶剂沉淀法: 根据蔗糖酶的分子量和亲水性,在溶液中加入一定量的无水乙醇溶 液,利用其脱水作用,破坏了蛋白质分子表面的水化膜,使蔗糖酶 聚集沉淀下来,而与其它杂质分开。一般采用分级沉淀法摸索目的 物沉淀的条件。
实验二蔗糖酶培训课件

熟悉操作流程
详细了解整个实验的操作流程,包括试剂的配制、样品处理、测 定等步骤。
实验步骤
试剂配制
按照一定的比例配制缓 冲液、工作液等,确保 试剂的质量和准确性。
加样处理
将待测样品加入离心管 中,加入适量的缓冲液 和工作液,充分混合均 匀。
孵育
将混合液放入适宜温度 下孵育一定时间,使蔗 糖酶充分分解葡萄糖。
通过实验方法和技术的学习,提高实验技能和实践能 力
通过实验数据的分析和处理,提高科学素养和分析能 力
02
蔗糖酶基础知识
蔗糖酶简介
蔗糖酶是一种水解蔗糖的酶,它属于转化酶家族 。
蔗糖酶的主要作用是分解蔗糖,将其转化为葡萄 糖和果糖。
蔗糖酶在自然界中广泛存在,特别是在高等植物 和微生物中。
蔗糖酶的分类和分布
实验二蔗糖酶培训课件
xx年xx月xx日
contents
目录
• 实验目的和背景 • 蔗糖酶基础知识 • 实验操作流程 • 数据分析和处理 • 实验结果展示 • 生活中的应用 • 学习体会分享
01
实验目的和背景
实验目的
掌握蔗糖酶的基本 性质和作用机理
了解蔗糖酶在食品 、发酵和生物能源 等领域的应用
分光光度计测 定
在适当的波长下,使用 分光光度计测定吸光度 值,从而计算出葡萄糖 的含量。
数据记录和处 理
记录实验数据,整理成 表格,计算葡萄糖含量 以及蔗糖酶的活力等指 标。
实验注意事项
注意安全
实验过程中需要注意安全问题,如戴手套、口罩 等防护措施,避免直接接触有毒有害物质。
实验规范
严格遵守实验室规范,保持实验环境的整洁和卫 生,避免污染和交叉污染。
学习使用和操作蔗 糖酶相关实验的方 法和技术
详细了解整个实验的操作流程,包括试剂的配制、样品处理、测 定等步骤。
实验步骤
试剂配制
按照一定的比例配制缓 冲液、工作液等,确保 试剂的质量和准确性。
加样处理
将待测样品加入离心管 中,加入适量的缓冲液 和工作液,充分混合均 匀。
孵育
将混合液放入适宜温度 下孵育一定时间,使蔗 糖酶充分分解葡萄糖。
通过实验方法和技术的学习,提高实验技能和实践能 力
通过实验数据的分析和处理,提高科学素养和分析能 力
02
蔗糖酶基础知识
蔗糖酶简介
蔗糖酶是一种水解蔗糖的酶,它属于转化酶家族 。
蔗糖酶的主要作用是分解蔗糖,将其转化为葡萄 糖和果糖。
蔗糖酶在自然界中广泛存在,特别是在高等植物 和微生物中。
蔗糖酶的分类和分布
实验二蔗糖酶培训课件
xx年xx月xx日
contents
目录
• 实验目的和背景 • 蔗糖酶基础知识 • 实验操作流程 • 数据分析和处理 • 实验结果展示 • 生活中的应用 • 学习体会分享
01
实验目的和背景
实验目的
掌握蔗糖酶的基本 性质和作用机理
了解蔗糖酶在食品 、发酵和生物能源 等领域的应用
分光光度计测 定
在适当的波长下,使用 分光光度计测定吸光度 值,从而计算出葡萄糖 的含量。
数据记录和处 理
记录实验数据,整理成 表格,计算葡萄糖含量 以及蔗糖酶的活力等指 标。
实验注意事项
注意安全
实验过程中需要注意安全问题,如戴手套、口罩 等防护措施,避免直接接触有毒有害物质。
实验规范
严格遵守实验室规范,保持实验环境的整洁和卫 生,避免污染和交叉污染。
学习使用和操作蔗 糖酶相关实验的方 法和技术
实验十四酵母蔗糖酶的提取纯化及活力测定课件

甲液:溶解6.9g 结晶酚于15.2ml 10%NaOH溶液中,并用水稀释至 69ml,在此溶液中加6.9g亚硫酸氢钠。
乙液:称取255克酒石酸钾钠加到300ml 10%NaOH溶液中,再加 入800ml 1%3,5-二硝基水杨酸溶液.甲,乙二溶液相混合即得黄色试剂,贮 于棕色瓶中备用,在室温放置7-10天以后使用。
实验十四酵母蔗糖酶的提取纯化及活力
测定
15
酶活力检测:
取试管若干支编号,各加入0.5mL 5%蔗糖 (pH4.6),每隔一管取100uL收集液,按先后顺 序分别加入上述含0.5mL 5%的蔗糖的试管中混匀, 置50℃水浴10min。再加入0.5mL 3,5-二硝基水杨 酸,于沸水浴中煮沸5min,用自来水冷却,直接 目测。即可确定酶活力高峰范围。
实验十四酵母蔗糖酶的提取纯化及活力
测定
13
装柱(层析柱规格1×20cm): 装柱前先将柱下端的出水口关闭,加进5ml(约1/3柱床体 积) 20 mmol/L Tris-HCl、pH7.3的缓冲液,然后将处理 好的DEAE—Sepharose FF轻轻搅匀(注意不能太稀,也 不能太稠,刚好呈流质状态)沿玻棒靠近柱管壁慢慢连续 加进柱内。注意不能带进气泡,待凝胶沉积约1-2cm后松 开层析柱出口,控制流速0.5ml/min;待柱内DEAE— Sepharose FF自然沉降至所需高度并分出水层后,吸去水 层,用玻棒将沉降界面搅匀,再加进处理好的DEAE— Sephadex至距层析柱上端4cm处为止(这时须保持 DEAE—Sepharose FF柱面平整)。用 50ml 20 mmol/L Tris-HCl、pH7.3的缓冲液装进洗脱杯,连通层析柱,进 行柱平衡,直到流出液与缓冲液的pH一致。
实验十四酵母蔗糖酶的提取纯化及活力
乙液:称取255克酒石酸钾钠加到300ml 10%NaOH溶液中,再加 入800ml 1%3,5-二硝基水杨酸溶液.甲,乙二溶液相混合即得黄色试剂,贮 于棕色瓶中备用,在室温放置7-10天以后使用。
实验十四酵母蔗糖酶的提取纯化及活力
测定
15
酶活力检测:
取试管若干支编号,各加入0.5mL 5%蔗糖 (pH4.6),每隔一管取100uL收集液,按先后顺 序分别加入上述含0.5mL 5%的蔗糖的试管中混匀, 置50℃水浴10min。再加入0.5mL 3,5-二硝基水杨 酸,于沸水浴中煮沸5min,用自来水冷却,直接 目测。即可确定酶活力高峰范围。
实验十四酵母蔗糖酶的提取纯化及活力
测定
13
装柱(层析柱规格1×20cm): 装柱前先将柱下端的出水口关闭,加进5ml(约1/3柱床体 积) 20 mmol/L Tris-HCl、pH7.3的缓冲液,然后将处理 好的DEAE—Sepharose FF轻轻搅匀(注意不能太稀,也 不能太稠,刚好呈流质状态)沿玻棒靠近柱管壁慢慢连续 加进柱内。注意不能带进气泡,待凝胶沉积约1-2cm后松 开层析柱出口,控制流速0.5ml/min;待柱内DEAE— Sepharose FF自然沉降至所需高度并分出水层后,吸去水 层,用玻棒将沉降界面搅匀,再加进处理好的DEAE— Sephadex至距层析柱上端4cm处为止(这时须保持 DEAE—Sepharose FF柱面平整)。用 50ml 20 mmol/L Tris-HCl、pH7.3的缓冲液装进洗脱杯,连通层析柱,进 行柱平衡,直到流出液与缓冲液的pH一致。
实验十四酵母蔗糖酶的提取纯化及活力
酵母蔗糖酶的提取及其性质研究 ppt课件

外酶 27万 50% 双 26mM
150 mM 5.0 4.9 3.0-7.5 60℃
内酶13.5万 <3% 双 25mM
150 mM 5.0 4.5 6.0-9.0 60℃
实验中,用测定生成还原糖(葡萄糖和果糖)的量来测定蔗 糖水解的速度,在给定的实验条件下,每分钟水解底物的量 定为蔗糖酶的活力单位。比活力为每毫克蛋白质的活力单位 数。
ppt课件
24
层析柱的制备与层析操作 柱层析的设备:
层析柱、蠕动泵(恒流泵)、紫外检测 仪、部分收集器、梯度洗脱器。
ppt课件
25
ppt课件
26
层析设备
层析装置: 梯度混和器 蠕动泵 层析柱 监测仪 记录仪 收集器
ppt课件
27
低 温 层 析 柜
ppt课件
28
柱上操作
裂,此法多适用于微生物材料。
5、化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠
(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处
理效果更好。
6、有机溶剂沉淀法:即向水溶液中加入一定量的亲水性的有机溶剂可降低
溶质的溶解度使其沉淀被析出。
ppt课件
6
操作步骤
(1)准备一个冰浴,将研钵稳妥放入冰浴中。 (2)称取2g干啤酒酵母,称10mg蜗牛酶及少量二氧化硅, 放入研钵中。二氧化硅要预先研细。 (3)量取预冷的去离子水6ml(分两次)缓慢加入酵母中, 边加边研磨成糊状,约需60分钟。研磨时用显微镜检查研磨的 效果,至酵母细胞大部分研碎。 (4)缓慢加入预冷的10ml去离子水,每次加2ml左右,边 加边研磨,至少用10分钟。 (5)将混合物转入1个离心管中,平衡后,用高速冷冻离心机 离心,4℃,8000rpm,10min。如果中间白色的脂肪层厚,说
浙江大学生物化学实验甲用正交法测定几种因素对蔗糖酶活性的影响PPT课件

用正交法测定几种因素对蔗糖酶活力的影 响
• 我们常常需要考察各因素对实验影响的情况,但在多因素、多水平试验中,如果对每个因素的每个水 平都互相搭配进行全面试验,需要做的试验次数就会很多。
• 比如对两个7水平的因素,如果两因素的各个水平都互相搭配进行全面试验,要做72=49次试验, • 而3个7水平的因素要进行全面试验,要做73=343次试验。 • 作这么多次试验,要花费大量的人力、物力,还要用相当长的时间,显然是非常困难的。
水平就均出现几次) ➢ b、任何两列中,横行组成的数对出现的次数相等,均出现一次(这里有9个不同的数对,均出现一
次),即(1,1)、(1,2)、(1,3)、(2,1)、(2,2)、(2,3)、(3,1)、(3, 2)、(3,3)各出现一次。
第9页/共19页
用正交法测定几种因素对蔗糖酶活力的影
响
• 以上这些特点保证了用正交表安排的试验计划是均衡搭配的,因此分析 数据比较方便,可进行综合比较,结果比较可靠。
分钟(显色反应)。 • 取出后立即用冷水冷却至室温,再向各管中加入5ml蒸馏水,摇匀,测A540值。
第13页/共19页
用正交法测定几种因素对蔗糖酶活力的影 响
• 2、非酶对照管(调零用) • 另取试管一支作非酶对照管(调零用), • 先加入蔗糖酶溶液0.5ml , • 再加入蒸馏水2.0ml,摇匀后沸水中加热10min让酶变性失活, • 再加入5%蔗糖溶液0.5ml,65℃保温10分钟。 • 然后向管中加入1.0ml 3.5-二硝基水杨酸试剂(碱性终止酶促反应,同时为显色剂),沸水中加热5分
• 试验次数n=q(t-1)+1
• 本试验选用四因素,每个因素选三个水平,因此可选用正交表L9(34)。 4、在所选的正交表上进行表头设计
• 我们常常需要考察各因素对实验影响的情况,但在多因素、多水平试验中,如果对每个因素的每个水 平都互相搭配进行全面试验,需要做的试验次数就会很多。
• 比如对两个7水平的因素,如果两因素的各个水平都互相搭配进行全面试验,要做72=49次试验, • 而3个7水平的因素要进行全面试验,要做73=343次试验。 • 作这么多次试验,要花费大量的人力、物力,还要用相当长的时间,显然是非常困难的。
水平就均出现几次) ➢ b、任何两列中,横行组成的数对出现的次数相等,均出现一次(这里有9个不同的数对,均出现一
次),即(1,1)、(1,2)、(1,3)、(2,1)、(2,2)、(2,3)、(3,1)、(3, 2)、(3,3)各出现一次。
第9页/共19页
用正交法测定几种因素对蔗糖酶活力的影
响
• 以上这些特点保证了用正交表安排的试验计划是均衡搭配的,因此分析 数据比较方便,可进行综合比较,结果比较可靠。
分钟(显色反应)。 • 取出后立即用冷水冷却至室温,再向各管中加入5ml蒸馏水,摇匀,测A540值。
第13页/共19页
用正交法测定几种因素对蔗糖酶活力的影 响
• 2、非酶对照管(调零用) • 另取试管一支作非酶对照管(调零用), • 先加入蔗糖酶溶液0.5ml , • 再加入蒸馏水2.0ml,摇匀后沸水中加热10min让酶变性失活, • 再加入5%蔗糖溶液0.5ml,65℃保温10分钟。 • 然后向管中加入1.0ml 3.5-二硝基水杨酸试剂(碱性终止酶促反应,同时为显色剂),沸水中加热5分
• 试验次数n=q(t-1)+1
• 本试验选用四因素,每个因素选三个水平,因此可选用正交表L9(34)。 4、在所选的正交表上进行表头设计
蔗糖酶的分离提纯及酶促56页PPT

糖酶样品(E1、E2 、E3)的测定(蛋白质含量); 3、蔗糖酶的分离提纯(细胞破壁、抽提、有机溶剂分级、
透析和离子交换柱层析—装柱、上样、洗柱、洗脱、收
集酶活力峰、保存);
4、蔗糖酶米氏常数的测定(用双倒数法);
5、用正交法测定几种因素对蔗糖酶活力的影响(含实验设
计及数据处理的相关知识)。
23.09.2019
3
二、实验原理
前言
酶是生物体内具有催化功能的蛋白质,可据酶蛋白的结
构和性质选择分离提纯条件和含量测定方法。
酶分离提纯的总目标是提高纯度(或比活力)及收率;
依据在溶液中的性质(分子大小、溶解度、电荷、吸附等)
进行分离; 胞内酶的分离提纯步骤:选材、破壁、提取、分
离、纯化、测活、保存;用测定酶活力的方法跟踪酶的去向、
⑥ 保存成品E3
测酶E3活力及蛋白质浓度
23.09.2019
14
成品E3
计算出E3浓度
周六(全天)上午8:00开始
(1).蔗糖酶米氏常数的测定
(2).用正交法测定几种因素
对蔗糖酶 活力的影响
23.09.2019
15
四、操作步骤及注意事项
1、 DNS比色定糖法工作曲线的制作
3、制作Folin-酚法测定蛋白质 含量的工作曲线 (当天画出工作曲线)
23.09.2019
11
4、乙醇分级和透析(制E2)
①离心得E1(无细胞抽提液)
取样、测定酶E1活力及蛋白质浓度
② 第一次乙醇分级(32%乙醇饱和度)
③ 第二次乙醇分级(47.5%乙醇饱和度)
蔗糖酶理论讲授813共35页文档
(还原糖)
强碱性溶液氨基化合物
沸水浴
(棕红色)
2) 在一定范围内还原糖的量与反应液的颜色强度成一定比例关系(可 于比色测定),所以可用DNS比色法测定还原糖的含量。
➢ 2、 蔗糖酶活力测定的原理:
1)蔗糖酶催化的反应是:
蔗糖 蔗糖酶D-果糖 + D-葡萄糖
2)蔗糖酶活力的规定:在本实验条件下,每3分钟释放1毫克还原糖所需的
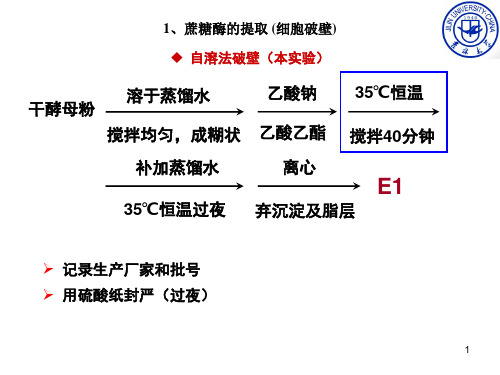
1、蔗糖酶的提取 (细胞破壁) 自溶法破壁(本实验)
溶于蒸馏水 干酵母粉
乙酸钠
搅拌均匀,成糊状 乙酸乙酯
35℃恒温 搅拌40分钟
补加蒸馏水 35℃恒温过夜
离心
E1
弃沉淀及脂层
➢ 记录生产厂家和批号 ➢ 用硫酸纸封严(过夜)
1
2、蔗糖酶的纯化
E1
用稀 HAC 调 pH至4.5
乙醇分级 (32%乙醇饱和度)Ι
酶活力 (enzyme activity) 酶催化某一反应的能力——V
V——单位时间内单位体积中 底物 (substrate) 的减少量或 产物 (product) 的增加量
9
2、酶活力和比活力表示方式
酶活力单位:
国际单位(IU):在特定的条件下,每分钟催化1μmol 底物转化为产物所需的酶量。
➢ 凝胶层析
常见名称:凝胶过滤、分子筛层析、排阻层析、凝胶渗透层析。
6
➢ 凝胶层析的基本原理
凝胶层析是利用凝胶把分子大小不同的物质分离开的
一种方法,其原理是分子筛效应,混合样品如同“过
筛”一样,因分子大小的不同得以彼此分开。 在洗脱过程中,大分子不能进入凝胶内部,而沿凝胶
颗粒间的空隙最先流出柱外;而小分子可以进入凝胶 颗粒内部的多孔网状结构,路径长、流速慢,以至最 后流出柱外。
强碱性溶液氨基化合物
沸水浴
(棕红色)
2) 在一定范围内还原糖的量与反应液的颜色强度成一定比例关系(可 于比色测定),所以可用DNS比色法测定还原糖的含量。
➢ 2、 蔗糖酶活力测定的原理:
1)蔗糖酶催化的反应是:
蔗糖 蔗糖酶D-果糖 + D-葡萄糖
2)蔗糖酶活力的规定:在本实验条件下,每3分钟释放1毫克还原糖所需的
1、蔗糖酶的提取 (细胞破壁) 自溶法破壁(本实验)
溶于蒸馏水 干酵母粉
乙酸钠
搅拌均匀,成糊状 乙酸乙酯
35℃恒温 搅拌40分钟
补加蒸馏水 35℃恒温过夜
离心
E1
弃沉淀及脂层
➢ 记录生产厂家和批号 ➢ 用硫酸纸封严(过夜)
1
2、蔗糖酶的纯化
E1
用稀 HAC 调 pH至4.5
乙醇分级 (32%乙醇饱和度)Ι
酶活力 (enzyme activity) 酶催化某一反应的能力——V
V——单位时间内单位体积中 底物 (substrate) 的减少量或 产物 (product) 的增加量
9
2、酶活力和比活力表示方式
酶活力单位:
国际单位(IU):在特定的条件下,每分钟催化1μmol 底物转化为产物所需的酶量。
➢ 凝胶层析
常见名称:凝胶过滤、分子筛层析、排阻层析、凝胶渗透层析。
6
➢ 凝胶层析的基本原理
凝胶层析是利用凝胶把分子大小不同的物质分离开的
一种方法,其原理是分子筛效应,混合样品如同“过
筛”一样,因分子大小的不同得以彼此分开。 在洗脱过程中,大分子不能进入凝胶内部,而沿凝胶
颗粒间的空隙最先流出柱外;而小分子可以进入凝胶 颗粒内部的多孔网状结构,路径长、流速慢,以至最 后流出柱外。
实验二蔗糖酶

1.
测定酶活的原理
蔗糖酶可作用于 β - 1 , 2 糖苷键,将蔗糖水解为 D -葡萄糖和 D -果糖; Cu2+ 、 Zn2+ 、 Fe2+ 是其激活剂,Mn2+ 是其抑制剂。 葡萄糖和果糖具有还原性,在偏碱性条件下,可与3,5-二硝基水杨酸共热 后生成棕红色物质,在一定浓度范围内,还原糖的量和反应液的颜色强度成 正比例关系。 蔗糖酶的活力通过其水解生成的还原糖量来反映。
生物技术综合实验
2010.3
实验二、酵母蔗糖酶的提取和 酶活测定
实验目的
学习提取酵母蔗糖酶和测定酶活力的方法; 学习提取生物活性大分子的方法。
实验材料
材料:活性干酵母粉、石英砂; 试剂:95%冰乙醇、DNS液、PBS(pH7.2)、 5%蔗糖溶液、1N NaOH溶液; 仪器:水浴锅、高速冷冻离心机、722型分光 光度计。
2.
3.
提取工艺 1. 破碎酵母细胞的方法: 蔗糖酶分子量较大,一般采用研磨法彻底破碎 细胞使其释放出来,但应注意研磨过程中保持 低温防止酶失活; 或者采用自溶法(适当的酸度和温度下利用酵 母菌自身的酶系破坏细胞壁),此方法较为温 和,但是时间较长,需加入少量防腐剂,防止 过程中外界细菌污染; 原则:低温,处理时间短,防止酶失活。
2、DNS法测定还原糖量 试剂 粗酶液组 测定组1 对照组1 纯酶液组 测定组2 对照组2
水解液 (mL)
蒸馏水 (mL) DNS液 (mL)
1.0
1.0 1.0
1.0
1.0 1.0
1.0
1.0 1.0
1.0
1.0 1.0
沸水浴5min,自来水冷却,稀释至12mL,以对照组 调零,记录测定组OD540nm。
实验二酵母蔗糖酶

了解目的物的分子量、酸碱稳定性、热稳定性,选择适宜的提取条件;
35度水浴10min,2自、来水溶冷却液的蛋白质浓度要适宜,防止蔗糖酶与杂蛋白共沉淀。
蔗糖酶可作用于β-1,2糖苷键,将蔗糖水解为D-葡萄糖和D-果糖;
有机溶3剂.沉淀有法机: 溶剂沉淀法:
——有机溶剂沉淀法获得蔗糖酶
根据蔗糖酶的根耐据热性蔗质,糖将酶热不的稳定分性子杂蛋量白变和性亲除去水, 性,在溶液中参加一定量的无水乙醇溶
——选择性热变性除去杂蛋白
3、离心后应迅速将上清倒出,沉淀物用缓冲液溶解,防止酶与有 机溶剂长时间接触,防止其变性。
测定酶活的原理 蔗糖酶可作用于β-1,2糖苷键,将蔗糖
水解为D-葡萄糖和D-果糖; Cu2+ 、 Zn2+ 、 Fe2+ 是其激活剂,Mn2+ 是其抑 制剂。
葡萄糖和果糖具有复原性,在偏碱性条件 下,可与3,5-二硝基水杨酸共热后生成 棕红色物质,在一定浓度范围内,复原糖 的量和反响液的颜色强度成正比例关系。
通过酶活测定物,沉调节淀提取的条条件。件。
原那么:低温,处理时间短,防止酶失活。
2、边加 原乙那醇边么搅拌:溶1液、,防注止意局部在乙醇低过温浓,下导致操酶作变性,失活故;无水乙醇要预冷;
蔗糖酶的提取过程和酶活的测定方法;
蔗糖酶的耐热温度2为、50度边,加45度乙以下醇可边保持搅酶活拌不溶变;液,防止局部乙醇过浓,导致酶变性失活;
实验二酵母蔗糖酶
实验目的
学习提取酵母蔗糖酶和测定酶活力的方法; 学习提取生物活性大分子的方法。
实验材料
材料:活性干酵母粉、石英砂;
试剂:95%冰乙醇、DNS液、PBS〔pH7.2〕、
5%蔗糖溶液、1N NaOH溶液;
35度水浴10min,2自、来水溶冷却液的蛋白质浓度要适宜,防止蔗糖酶与杂蛋白共沉淀。
蔗糖酶可作用于β-1,2糖苷键,将蔗糖水解为D-葡萄糖和D-果糖;
有机溶3剂.沉淀有法机: 溶剂沉淀法:
——有机溶剂沉淀法获得蔗糖酶
根据蔗糖酶的根耐据热性蔗质,糖将酶热不的稳定分性子杂蛋量白变和性亲除去水, 性,在溶液中参加一定量的无水乙醇溶
——选择性热变性除去杂蛋白
3、离心后应迅速将上清倒出,沉淀物用缓冲液溶解,防止酶与有 机溶剂长时间接触,防止其变性。
测定酶活的原理 蔗糖酶可作用于β-1,2糖苷键,将蔗糖
水解为D-葡萄糖和D-果糖; Cu2+ 、 Zn2+ 、 Fe2+ 是其激活剂,Mn2+ 是其抑 制剂。
葡萄糖和果糖具有复原性,在偏碱性条件 下,可与3,5-二硝基水杨酸共热后生成 棕红色物质,在一定浓度范围内,复原糖 的量和反响液的颜色强度成正比例关系。
通过酶活测定物,沉调节淀提取的条条件。件。
原那么:低温,处理时间短,防止酶失活。
2、边加 原乙那醇边么搅拌:溶1液、,防注止意局部在乙醇低过温浓,下导致操酶作变性,失活故;无水乙醇要预冷;
蔗糖酶的提取过程和酶活的测定方法;
蔗糖酶的耐热温度2为、50度边,加45度乙以下醇可边保持搅酶活拌不溶变;液,防止局部乙醇过浓,导致酶变性失活;
实验二酵母蔗糖酶
实验目的
学习提取酵母蔗糖酶和测定酶活力的方法; 学习提取生物活性大分子的方法。
实验材料
材料:活性干酵母粉、石英砂;
试剂:95%冰乙醇、DNS液、PBS〔pH7.2〕、
5%蔗糖溶液、1N NaOH溶液;
《酵母蔗糖酶》PPT课件

12
精品医学
实验结果
计算酶活力
将吸光值代入还原糖标准曲线,得到水解液中还原糖的质量。 Y=0.67X+0.027(Y:吸光值;X:还原糖的质量(mg)) 蔗糖酶活力定义:在一定实验条件下,在规定时间内释放1mg还原糖的酶量 为一个活力单位。 酶活力(U/mL)=还原糖毫克数×3.5(水解液体积)÷1.0(酶液体积)
0.5
-
0.5
0.5 2.0
-
精品医学
2、DNS法测定还原糖量
试剂
水解液 (mL)
粗酶液组
测定组1 对照组1
1.0
1.0
纯酶液组
测定组2 对照组2
1.0
1.0
蒸馏水
1.0
1.0
1.0
1.0
(mL)
DNS液
1.0
1.0
1.0
1.0
(mL)
沸水浴5min,自来水冷却,稀释至10mL,以对照组调零,记 录测定组OD540nm。
实验二、酵母蔗糖酶的提取和 酶活测定
1
精品医学
实验目的
学习提取酵母蔗糖酶的方法; 测定蔗糖酶活力的方法。
2
精品医学
实验材料
材料:活性干酵母粉、石英砂; 试剂:95%冰乙醇、DNS液、PBS(pH7.2)、
5%蔗糖溶液、1N NaOH溶液; 仪器:水浴锅、离心机、722型分光光度计。
3
精品医学
10
精品医学
酶活测定 1. 蔗糖酶将蔗糖水解为还原糖
试剂
(均35度预 热)
粗酶液组 测定组1 对照组1
酶液(mL)
1.0
1.0
纯酶液组 测定组2 对照组2
1.0
课件

5.2 双糖和多糖的酶促降解
一、双糖的酶促降解
蔗糖+H 2O 葡萄糖+果糖
蔗糖酶
麦芽糖+H 2O 葡萄糖
麦芽糖酶乳糖 +H 2O 葡萄糖+半乳糖
--β-半乳糖苷酶
二、淀粉的酶促降解
淀粉磷酸化酶 脱支酶
淀粉+nH 3PO 4 nG-1-p+少量葡萄糖
∙ 淀粉的磷酸解
∙ 淀粉的酶促水解 α-淀粉酶:在淀粉
分子内部任意水解α-1.4糖苷键。
需要Ca 2+(内切酶)
β-淀粉酶:从非还原端开始,水解α-1.4糖苷键,依次水解下一个β-麦芽糖单位(外切酶) 脱支酶(R酶):水解α-淀粉酶和β-淀粉酶作用后留下的极限糊精中的1.6 -糖苷键。
α-淀粉酶
β-淀粉酶
1833年,Payen和Persoz首次发现酶(酵素)——淀粉酶
α-,β-在此处仅表示两种酶
三、糖原的酶促降解
糖原分解始于非还原端
磷酸化酶
H3PO4
+
糖原的酶促降解
糖原磷酸化酶
转移酶
脱支酶
糖原
磷酸化酶、H3PO4
+ 葡萄糖(少量)转移酶、脱支酶
变位酶
葡萄糖6-磷酸酶
H2O H3PO4
葡萄糖
肝、肾
只有肝脏能通过糖原的分解直接补充血糖
糖原的分解
磷酸解α-1,4糖苷键
水解α-1,6糖苷键
四、纤维素的酶促降解
晶状纤维素
无定型纤维素
C1酶
C X 酶
纤维二糖
D-葡萄糖
β-葡萄糖酶
破坏天然纤维素晶状结构
水解溶解的纤维素衍生物或者膨胀和部分降解的纤维素
水解纤维二糖和短链的纤维寡糖
人的消化道无纤维素酶,细菌、真菌、放线菌、原生动物能产生。
蔗糖酶的提取和纯化步骤34页PPT

39、没有不老的誓言,没有不变的承 诺,踏 上旅途 ,义无 反顾。 40、对时间的价值没有没有深切认识 的人, 决不会 坚韧勤 勉。Fra bibliotek 谢谢你的阅读
❖ 知识就是财富 ❖ 丰富你的人生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
蔗糖酶的提取和纯化步骤
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
❖ 知识就是财富 ❖ 丰富你的人生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
蔗糖酶的提取和纯化步骤
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020/7/16
3
一、pH对酶反应速度的影响
在一定的pH 下, 酶 具有最大的催化活 性, 通常称此pH 为 最适pH。
R e la tiv e A c tiv ity (% )
100
80
60
40
20
0 2 3 4 5 6 7 8 9 10 pH
2020/7/16
4
二 、温度对酶反应速度的影响
抑制剂与酶蛋白以非共价方式结合,引起酶活性暂 时性丧失。抑制剂可以通过透析等方法被除去,并且 能部分或全部恢复酶的活性。根椐抑制剂与酶结合的 情况,又可以分为两类(竞争性抑制和非竞争性抑制)
2020/7/16
14
五、抑制剂对酶活性的影响
可逆抑制
(1) 竟争性抑制
某些抑制剂的化学结构与底物相似,因而能与底物竟 争与酶活性中心结合。当抑制剂与活性中心结合后, 底物被排斥在反应中心之外,其结果是酶促反应被抑 制了。 竟争性抑制通常可以通过增大底物浓度,即提高底物 的竞争能力来消除。
2020/7/16
9
四、底物浓度对酶反应速度的影响
当V=Vmax/2 时,米氏方程变换为:
Vmax = Vmax [S]
2
Km+[S]
V = 1/2 Vmax, Km = [S] 米氏常数是反应速度为最大值的一半时的底物浓度。 米氏常数的单位为mol/L。
2020/7/16
10
四、底物浓度对酶反应速度的影响
酶促反应动力学方程式——米氏学说的提出
1913年Michaelis和Menten提出反应速度与底物浓度关系的数学方程 式,即米-曼氏方程式,简称米氏方程式(Michaelis equation)。
Vmax [S] V= Km + [S]
[S]: 底物浓度 V: 不同[S]时的反应速度 Vmax:最大反应速度
(2) 非竟争性抑制
酶可同时与底物及抑制剂结合,引起酶分子构象变化, 并导至酶活性下降。由于这类物质并不是与底物竞争与 酶活性中心结合,所以称为非竞争性抑制剂。
如某些金属离子(Cu2+、Ag+、Hg2+)以及EDTA等, 通常能与酶分子的调控部位中的-SH基团作用,改变酶 的空间构象,引起非竞争性抑制。
2020/7/16
5
三、酶浓度对酶反应速度的影响
如果底物浓度 足够大,足以使酶 饱和,则反应速度 与酶浓度成正比。
2020/7/16
6
四、底物浓度对酶反应速度的影响
在低底物浓度时, 反应速度与 底物浓度成正比,表现为一级 反应特征。 当底物浓度达到一定值,几乎 所有的酶都与底物结合后,反 应速度达到最大(Vmax),此 时再增加底物浓度,反应速度 不再增加,表现为零级反应。
Km和Vmax值的测定方法: 双倒数作图法
将米氏方程两边取倒数,可转化为下列形式:
1
Km 1
1
= +
V
Vmax [S] Vmax
Vmax [S] V= Km + [S]
2020/7/16
11
双倒数作图
1 .0 斜率=Km/Vmax
0 .8
0 .6
1 /v
-1/Km
0 .4
0 .2
1/Vmax
2010蔗糖酶课件(郑)
酶促反应动力学?
(Kinetics of enzyme-catalyzed reaction )
酶促反应动力学是研究酶促反应的速度内容。
2020/7/16
2
酶促反应动力学(反应速度及影响因素)
pH值对酶促反应速度的影响 温度对酶促反应速度的影响 酶浓度对酶促反应速度的影响 底物浓度对酶促反应速度的影响 激活剂对酶促反应速度的影响 抑制剂对酶促反应速度的影响
k1 k2 E + S ES E + P
k-1
R a te o f R e a c tio n (v )
100
80
60
40
20
0 0 2 4 6 8 10 12 14 16 18 20 Concentration of Substrate(um ol/L)
2020/7/16
7
四、底物浓度对酶反应速度的影响
一方面是温度升高,酶促反 应速度加快。 另一方面,温度升高,酶的 高级结构将发生变化或变 性,导致酶活性降低甚至 丧失。 因此大多数酶都有一个最 适温度。 在最适温度条件 下,反应速度最大。
R e la tiv e A c tiv ity (% )
100
80
60
40
20
0 10 20 30 40 50 60 70 80 90 Tem perature OC
2020/7/16
17
加入非竞争性
抑制剂后, Km 不变,但 由于Vmax减 小,所以酶促 反应速度也下 降了。
非竞争性抑制剂
1 .0
0 .8
0 .6
Km: 米氏常数
2020/7/16
8
四、底物浓度对酶反应速度的影响
米氏常数(Km)的意义
Km值是酶的特征常数之一,只跟酶的性质有关,而 与酶的浓度无关。
Km值作为常数只是对一定的底物、一定的pH、一定 的温度条件而言,测定酶的Km值可以作为鉴别酶的一 种手段。
1/ Km可以表示酶对底物亲和力的大小, 1/ Km越大, 表 明亲和力越大, 多底物酶有不同的 Km值, 最适底物的 Km值最小。
酶的抑制剂一般具备两个方面的特点:
✓ 在化学结构上与被抑制的底物分子或底物的过渡状态相似。 ✓ 能够与酶的活性中心以非共价或共价的方式形成比较稳定的
复合体。
2020/7/16
13
五、抑制剂对酶活性的影响
抑制剂的作用方式
不可逆抑制
抑制剂与酶反应中心的活性基团以共价形式结合, 引起酶的永久性失活。
可逆抑制
0 .0
-4
-2
0
2
4
6
1 /[S ](1 /m m o l.L -1)
8
10
以1/V对1/[S]作图得一直线,其斜率是Km/Vm,在纵轴上 的截距为1/Vm,横轴上的截距为-1/Km。
2020/7/16
12
五、抑制剂对酶活性的影响
➢ 使酶的活性降低或丧失的现象,称为酶的抑制作用。 ➢ 能够引起酶的抑制作用的化合物则称为抑制剂。
2020/7/16
15
加入竞争
性抑制剂 后,Km 变大,酶 促反应 Vmax不变。
1 .0
0 .8
1/Vmax 0 .6
竞争性抑制剂
1 /v
0 .4
无抑制剂
0 .2
0 .0
-4
-2
0
2
4
6
1 /[S ](1 /m m o l.L -1)
8
10
2020/7/16
16
五、抑制剂对酶活性的影响
可逆抑制
