李绍芬版反应工程答案
最新李绍芬版反应工程第二版完整答案教程文件

1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+ 242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩Bkg/h 粗甲醇100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
李绍芬版反应工程第二版完整答案精品文档64页

1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 moln P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 moln O =n O0-1/2n P -3/2n C =0.8788 moln N =n N0=43.28 mol1. 1. 2 由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩原料气 Bkg/h 粗甲醇 Akmol/h100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分原料气冷凝分离后的气体CO 26.82 15.49H268.25 69.78CO21.46 0.82CH40.55 3.62N22.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg粗甲醇而言,其溶解量为CO29.82g,CO9.38g,H2 1.76g,CH42.14g,N25.38g。
李绍芬版反应工程答案

1 绪论之阳早格格创做1.1正在银催化剂上举止甲醇氧化为甲醛的反应:加进反应器的本料气中,甲醇:气氛:火蒸气=2:4:1.3(摩我比),反应后甲醇的转移率达72%,甲醛的支率为69.2%.试预计(1)(1)反应的采用性;(2)(2)反应器出心气体的组成.解:(1)由(1.7)式得反应的采用性为:(2)加进反应器的本料气中,甲醇:气氛:火蒸气=2:4:1.3(摩我比),当加进反应器的总本料量为100mol设甲醇的转移率为X A,甲醛的支率为Y P,根据(1.3)战(1.5)式可得反应器出心甲醇、甲醛战二氧化碳的摩我数n A、n P战n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol分散上述反应的化教计量式,火(n W)、氧气(n O)战氮气(n N)的摩我数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol1.1. 2工业上采与铜锌铝催化剂由一氧化碳战氢合成甲醇,其主副反应如下:由于化教仄稳的节制,反应历程中一氧化碳不可能局部转移成甲醇,为了普及本料的利用率,死产上采与循环支配,将要反应后的气体热却,可凝组份形成液体即为细甲醇,不凝组份如氢气及一氧化碳等部分搁空,大部分经循环压缩机后与本料气混同返回合成塔中.下图是死产过程示企图本料气Bkg/h 细甲醇 Akmol/h100kmol搁气氛体本料气战热凝分散后的气体组成如下:(mol)组分本料气热凝分散后的气体COH2CO2CH4N2细甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为沉量百分率.正在支配压力及温度下,其余组分均为不凝组分,然而正在热凝热却历程中可部分溶解于细甲醇中,对付1kg细甲醇而止,其溶解量为CO29.82g,CO 9.38g,H2 1.76g,CH4 2.14g,N25.38g.若循环气与本料气之比为7.2(摩我比),试预计:(1)(1)一氧化碳的单程变更率战齐程转移率;(2)(2)甲醇的单程支率战齐程支率.解:(1)设新陈本料气进料流量为100kmol/h,则根据已知条件,预计进料本料气组成以品量分率表示如下:其中x i=y i M i/∑y i M i.进料的仄稳摩我品量M m=∑y i M i=10.42kg/kmol.经热凝分散后的气体组成(亦即搁气氛体的组成)如下:其中热凝分散后气体仄稳分子量为M’m=∑y i M i又设搁气氛体流量为Akmol/h,细甲醇的流量为Bkg/h.对付所有系统的N2做衡算得:×1000+=2.92 (A)对付所有系统便所有物料做衡算得:100×10.42=B+ (B) 联坐(A)、(B)二个圆程,解之得/h反应后产品中CO摩我流量为F CO=+9.38B/(28×1000)将供得的A、B值代进得F CO=4.431 kmol/h故CO的齐程转移率为由已知循环气与新陈气之摩我比,可得反应器出心处的CO 摩我流量为F’CO,0=100××100×0.1549=138.4 kmol/h所以CO的单程转移率为产品细甲醇所溶解的CO2、CO、H2、CH4战N2总量D为细甲醇中甲醇的量为(B-D)X甲/M m=(785.2-0.02848B) ×所以,甲醇的齐程支率为Y总甲醇的单程支率为Y单2 反应能源教前提4L的恒容反应器中举止A的火解反应,反应前 A的含量为12.23%(沉量),混同物的稀度为1g/mL,反应物A 的分子量为88.正在等温常压下不竭与样领会,测的组分A 的浓度随时间变更的数据如下:试供反当令间为3.5h的A的火解速率.解:利用反当令间与组分A的浓度变更数据,做出C A~t的关系直线,用镜里法供得t=3.5h时该面的切线,即为火解速率.切线的斜率为由(2.6)式可知反应物的火解速率为300℃等温下举止甲烷化反应:催化剂体积为10ml,本料气中CO的含量为3%,其余为N2,H2气体,改变进心本料气流量Q0举止真验,测得出心CO的转移率为:试供当进心本料气体流量为50ml/min时CO的转移速率.解:是一个震动反应器,其反应速率式可用(2.7)式去表示故反应速率可表示为:用X A~V R/Q0做图,过V R/Q0=0.20min的面做切线,即得该条件下的dX A/d(V/Q)值α.故CO的转移速率为2.3已知正在Fe-Mg催化剂上火煤气变更反应的正反应能源教圆程为:式中y CO战y CO2W等于0.0535kmol/kg.h.如催化剂的比表面积为30m23,试预计:(1)(1)以反应体积为基准的速率常数k V.(2)(2)以反应相界里积为基准的速率常数k g.(3)(3)以分压表示反应物系组成时的速率常数k g.(4)(4)以摩我浓度表示反应物系组成时的速率常数k C.解:利用(2.10)式及(2.28)式可供得问题的解.注意题中所给比表面的单位换算成m2/m3.2.4正在等温下举止液好同应A+B→C+D,正在该条件下的反应速率圆程为:若将A战B的初初浓度均为3mol/l的本料混同举止反应,供反应4min时A的转移率.解:由题中条件知是个等容反应历程,且A战B的初初浓度均相等,即为1.5mol/l,故可把反应速率式简化,得由(2.6)式可知代进速率圆程式化简整治得积分得解得X A =82.76%.3.5%NH 3,20.8%N 2,62.6%H 2,7.08%Ar 及4.该塔是正在30MPa 压力下支配.已知催化剂床层中某处的温度为490℃,反应气体中氨含量为10%(mol ),试预计该处的反应速率.正在Fe 催化剂上氨合成反应速率式为:顺反应的活化能417.5810/=⨯E J mol .450℃时30.5322277()/=⋅k m MPa m h ,且212/=P k k K ,490℃时,Kp 可按下式预计:472log 2047.8/ 2.4943log 1.25610 1.856410 3.206--=--⨯+⨯+p K T T T T 注:m 3为尺度坐圆米.解:题中给出450℃时的k 2值,而反应是正在490℃下,故最先央供出490℃时的k 2值.利用(2.27)试,供出频次果子A:44217.5810/8.314723162'1617.5810/8.314723430.532exp()exp()2277/ 1.14510exp() 1.14510 1.05510()/.-⨯⨯-⨯⨯-=-===⨯-==⨯=⨯E k A RTE A k e RTE k A e m MPa m h RT490℃的Kp 值由题给公式预计出4722log 2047.8/763 2.4943log763 1.25610763 1.8564107633.206 1.25245.59210 ---=--⨯⨯+⨯⨯+=-=⨯p p K K 供k 1值:供各组分的分压值:各组分的分率及分压值为反应速率为:2.6底下是二个反应的T-X图,图中AB是仄稳直线,NP是最佳温度直线,AM是等温线,HB是等转移率线.根据底下二图回问:(1)(1)是可顺反应仍旧不可顺反应?(2)(2)是搁热反应仍旧吸热反应?(3)(3)正在等温线上,A,D,O,E,M面中哪一面速率最大,哪一面速率最小?(4)(4)正在等转移率线上,H,C,R,O,F及B面中,哪一面速率最大,哪一面速率最小?(5)(5)正在C,R二面中,谁的速率大?(6)(6)根据图中所给的十面中,推断哪一面速率最大?(1)可顺反应可顺反应(2)搁热反应吸热反应(3)M面速率最大,A面速率最小 M面速率最大,A面速率最小(4)O面速率最大,B面速率最小 H面速率最大,B 面速率最小(5)R面速率大于C面速率 C面速率大于R面速率(6)M面速率最大根据等速线的走背去推断H,M面的速率大小.2.7正在举止一氧化碳变更反应能源教钻研中,采与B106催化剂举止考查,测得正反应活化能为4J mol,如果不思量顺反应,试问反应温度是550℃9.62910/时的速率比反应温度是400℃时的速率大几倍?解:从题中可知,反应条件除了温度分歧中,其余条件皆相共,而温度的效用表示正在反应速率常数k上,故可用反应速率常数之近去形貌反应速率之比.2.8常压下,正在钒催化剂上举止SO2氧化反应,本料气组成为7%O2及82%N2.试预计转移率为80%时的最佳温度.二氧化硫正在钒催化剂上氧化的正反应活化能为4⨯J mol,化教计量数等于2,反应式为:9.21110/其仄稳常数与温度的关系为:该反应的热效力4-=⨯9.62910/H J mol.r解:(1)供出转移率为80%时各组分的分压:以100mol为基准(2)供与上述组成对付应的仄稳常数K P值:(3)供仄稳温度Te(4)利用(2.31)式供顺反应活化能E值(5)利用(2.31)式供最佳温度T OP2.9正在一恒容反应器中举止下列液好同应:式中r R,r D分别表示产品R及D的死成速率.反应用的本料为A与B的混同物,其中A的浓度为2kmol/m3,试预计A 的转移率达到95%时所需的反当令间.解:反应物A的消耗速率应为二反应速率之战,即利用(2.6)式积分之2.10正在催化剂上举止三甲基苯的氢解反应:反应器进心本料气组成为66.67%H2,33.33%三甲基苯.正在0.1Mpa及523K下等温反应,当反应器出心三甲基苯的转移率为80%时,其混同气体的氢含量为20%,试供:(1)(1)此时反应器出心的气体组成.(2)(2)若那二个反应的能源教圆程分别为:则出心处二甲基苯的死成速率是几?解:以100mol为预计基准,设X为三甲基苯的转移率,Y为死成的甲苯摩我数.(1)(1)用物料衡算供出心气体组成:由题给条件可知,混同气中氢的含量为20%,所以有:66.67-33.33X-Y=20×0.8-20=20.01kmol(甲苯量)×××氢气含量为:20kmol故出心尾气组成为:三甲基苯6.666%,氢气20%,二甲基苯6.654%,甲烷46.67%,甲基苯20.01%.(2)(2)由题给条件可知,三甲基苯的出心浓度为:210℃等温下举止亚硝酸乙脂的气相领会反应:该反应为一级不可顺反应,反应速率常数与温度的关系为1441k T s,若反应是正在恒容下举=⨯-⨯1.3910exp( 1.89710/)()-止,系统的起初总压为0.1013MPa,采与的是杂亚硝酸乙脂,试预计亚硝酸乙脂领会率为80%时,亚硝酸乙脂的领会速率及乙醇的死成速率.若采与恒压反应,乙醇的死成速率又是几?解:(1)恒容历程,其反应式可表示为:反应速率式表示为:设为理念气体,反应物A的初初浓度为:亚硝酸乙脂的领会速率为:乙醇的死成速率为:(2)恒压历程,由于反应前后摩我数有变更,是个变容历程,由(2.49)式可供得总摩我数的变更.由于反应物是杂A ,故有:y A0=1.由(2.52)式可供得组分的瞬间浓度:22001426(1) 2.52310(10.8) 2.80310/11110.81.3910exp(18973/483)2.803103.39510/.δ-----⨯-===⨯++⨯⨯==⨯-⨯⨯=⨯A A A A A A A A C X C mol l y X r kC mol l s 乙醇的死成速率为:750℃等温下的转移反应为:本料气中甲烷与火蒸气的摩我比为1:4,若那个反应付于各反应物均为一级,已知k=2l/mol.s,试供:(1) (1) 反应正在恒容下举止,系统的初初总压为0.1013MPa ,当反应器出心的CH 4转移率为80%时,CO 2战H 2的死成速率是几?(2) (2) 反应正在恒压下举止,其余条件如(1),CO 2的死成速率又是几?解:(1)由题意可将反应速率表示为:对付于恒容历程,则有当X A0(2)对付于恒压历程,是个变容反应历程,由(2.49)式可供得总摩我数的变更反应物A 的本初分率:由(2.52)式可供得转移率为80%时的浓度:2.13正在473K 等温及常压下举止气好同应:(1)3→A R 1.2/min =⋅R A r C mol l(2)2→A S 0.5/min =⋅S A r C mol l(3)→A T 2.1/min =⋅T A r C mol l式中C A 为反应物A 的浓度(mol/l ),本料中A 战惰性气体各为一半(体积比),试供当A 的转移率达85%时,其转移速率是几?解:要领(1),先供出总摩我变更数δA .最先将产品的死成速率形成对付应的反应物的转移速率: 总反应速率为:以一摩我反应物A 为基准,总摩我变更数为:初初浓度为:则有要领(2),可将C A 表示为:要领(3),利用物料衡算可分别供出反应物A 死成R 及S 的瞬间采用性S R ,S S ,果而可供出产品R 及S 的支率y R ,y S ,供得A 转移率为85%时的分率:其中:2.14正在Pt 催化剂上举止同丙苯领会反应:以A,B 及R 分别表示同丙苯,苯及丙烯,反应步调如下:(1)σσ+⇔A A(2)σσ⇔+A B R(3)σσ⇔+B B若表面反应为速率统制步调,试推导同丙苯领会的速率圆程.解:根据速率统制步调及定态近似本理,除表面反应中,其余二步达到仄稳,形貌如下:以表面反应速率圆程去代表所有反应的速率圆程: 由于1θθθ++=A B V将,θθA B 代进上式得:整治得:将,,θθθA B V 代进速率圆程中其中2.15正在银催化剂上举止乙烯氧化反应:化做22()()2()+→A B R其反应步调可表示如下:(1)σσ+⇔A A(2)222σσ+⇔B B(3)σσσσ+⇔+A B R(4)σσ⇔+R R假如第三步是速率统制步调,试推导其能源教圆程.解:根据速率统制步调及定态近似本理,除表面反应步调中,其余近似达到仄稳,写出相映的覆盖率表白式: 所有反应的速率圆程以表面反应的速率圆程去表示: 根据总覆盖率为1的准则,则有:或者整治得:将,,,θθθθA B R V 代进反应速率圆程,得:其中→+A B D ,其反应步调表示如下:(1)σσ+⇔A A(2)σσ→+A B D(3)σσ⇔+B B若(1)速率统制步调,试推导其能源教圆程.解:先写出各步的速率式:由于(1)是速率统制步调,第(2)步是不可顺反应,其反应速率应等于(1)的吸附速率,故有:整治得:根据定态近似准则果为1θθθ++=A B V将,θθA B 代进上式,化简后得:末尾将,θθA V 代进吸附速率式,即为该反应的能源教圆程式.2.17一氧化碳变更反应:正在较矮温度下,其能源教圆程可表示为:试拟定该反应的符合的反应步调.解:根据题意,假设反应步调如下:并假设第二步是统制步调,其速率圆程便代表了所有反应的速率圆程:其余的二步可认为达到仄稳,则有:由于1θθθ++=A B V ,有:将,θθA V 代进速率式,得:式中=S A k k K .故上述假定与题意切合.然而上述假定的反应步调不是唯一的.2.18利用习题2.1的数据,试用积分法战微分法供其能源教圆程.解:先用积分法供其能源教圆程.设为一级不可顺反应,其速率表白式为:积分得: 用0ln()A A C C ~t 做图.-1,故假设一级反应是合理的,其能源教圆程可表示为: 用微分法供解能源教圆程最先用C A ~t 直线,正在直线上与时间为0,1,2,……9h 所对付应面的切线,为了准确可采与镜里法,供得各切线的斜率即为对付应的dC A /dt 之值,而后再以dC A /dt ~C A设为一级不可顺反应,用dC A /dt ~C A -1,其能源教圆程可表示为:或者将速率圆程直线化,即二边与对付数,得: ≈1,反应速率常数值为k=0.4996.还可用一数教公式去拟合C A ~t 直线,而后再将该数教公式对付t 供导,供得dC A /dt 之值,此法会比做图法去的准确.2.19正在Ni 催化剂上举止甲烷化反应:由真验测得200℃时甲烷的死成速率R CH4及CO 战H 2的分压p CO ,p H 2的关系如下:若该反应的能源教圆程可用幂函数表示,试用最小二乘法供一氧化碳的反应级数及正反应速率常数.解:由题意可写出速率圆程式:然而由于氢的分压脆持为0.1013MPa 的恒定值,反应速率式可简化为:式中2'β=H k k p .将速率式直线化:4ln ln ln =+CH CO r k a p 或者=+y b ax式中4ln ,ln ,ln ===+CH CO y r b k x p ,由残好仄圆战最小而导出最小二乘法的系数预计式:将乏加值代进a,b 系数式中,得:2.20正在铂催化剂上,乙烯深度氧化的能源教圆程可表示为:式中p A,p B分别表示乙烯及氧的分压.正在473K等温下的真验数据如下:试供该温度下的反应速率常数k战吸附仄稳常数K B.解:最先将能源教圆程式直线化:或者y=b+ax.其中仄稳偏偏好 4.7%δ=,截止是令人谦意的.3 釜式反应器3.1正在等温间歇反应器中举止乙酸乙酯白化反应:该反应付于乙酸乙酯及氢氧化钠均为一级.反应启初时乙酸乙酯及氢氧化钠的浓度均为0.02mol/l ,反应速率常数等于5.6l/mol.min.央供最后转移率达到95%.试问:(1) (1) 当反应器的反应体积为1m 3时,需要多少的反当令间?(2) (2) 若反应器的反应体积为2m 3,,所需的反当令间又是几?解:(1)00222000001()(1)110.95169.6min(2.83)5.60.0210.95===⨯---=⨯=⨯-⎰⎰Af Af X X A A A A A A A A A A A dX dX X t C C R k C X kC X h(2) 果为间歇反应器的反当令间与反应器的大小无关,所以反当令间仍为2.83h.3.2拟正在等温间歇反应器中举止氯乙醇的白化反应: 以死产乙二醇,产量为20㎏/h ,使用15%(沉量)的NaHCO 3火溶液及30%(沉量)的氯乙醇火溶液做本料,反应器拆料中氯乙醇战碳酸氢钠的摩我比为1:1,混同液的比沉为1.02.该反应付于氯乙醇战碳酸氢钠均为一级,正在反应温度下反应速率常数等于5.2l/mol.h ,央供转移率达到95%.(1) (1) 若辅帮时间为0.5h ,试预计反应器的灵验体积;(2) (2) 若拆挖系数与0.75,试预计反应器的本量体积. 解:氯乙醇,碳酸氢钠,战乙二醇的分子量分别为80.5,84 战 62kg/kmol,每小时产乙二醇:20/62=0.3226 kmol/h 每小时需氯乙醇:0.326680.591.11/0.9530%⨯=⨯kg h 每小时需碳酸氢钠:0.326684190.2/0.9515%⨯=⨯kg h 本料体积流量:091.11190.2275.8/1.02+==Q l h氯乙醇初初浓度:00.32661000 1.231/0.95275.8⨯==⨯A C mol l 反当令间:反应体积:0(')275.8(2.9680.5)956.5=+=⨯+=r V Q t t l(2) (2) 反应器的本量体积:956.512750.75===r V V l f3.3丙酸钠与盐酸的反应:为二级可顺反应(对付丙酸钠战盐酸均为一级),正在真验室中用间歇反应器于50℃等温下举止该反应的真验.反应启初时二反应物的摩我比为1,为了决定反应举止的程度,正在分歧的反当令间下与出10ml 反应液用0.515N 的NaOH 溶液滴定,以决定已反应盐酸浓度.分歧反当令间下,NaOH 溶液用量如下表所示:现拟用与真验室反应条件相共的间歇反应器死产丙酸,产量为500kg/h ,且丙酸钠的转移率要达到仄稳转移率的90%.试预计反应器的反应体积.假定(1)本料拆进以及加热至反应温度(50℃)所需的时间为20min ,且正在加热历程中不举止反应;(2)卸料及荡涤时间为10min ;(3)反应历程中反应物稀度恒定.解:用A,B,R,S 分别表示反应圆程式中的四种物量,利用当量关系可供出任一时刻盐酸的浓度(也便是丙酸钠的浓度,果为其计量比战投量比均为1:1)为: 于是可供出A 的仄稳转移率:现以丙酸浓度对付时间做图:由上图,当C A ×14.7mol/l 时,所对付应的反当令间为48min.由于正在共样条件下,间歇反应器的反当令间与反应器的大小无关,所以该死产规模反应器的反当令间也是48min.丙酸的产量为:500kg/h=112.6mol/min.所需丙酸钠的量为:112.6/0.72=156.4mol/min.本料处理量为:000/156.4/(0.051552.5)57.84/min ==+=A A Q F C l 反应器体积:00()57.84(182010)4512=+=⨯++=r V Q t t l 本量反应体积:4512/0.85640=l3.4正在间歇反应器中,正在绝热条件下举止液好同应: 其反应速率圆程为:143110001.110exp()/.=⨯-A A B r C C kmol m h T式中组分A 及B 的浓度C A 及C B 以kmol/m 333.K 预计.反应启初时反应混同物的温度为50℃.(1) (1) 试预计A 的转移率达85%时所需的反当令间及此时的反应温度.(2) (2) 如果央供局部反应物皆转移为产品R ,是可大概?为什么?解:(1)(由数值积分得出)(2)若A 局部转移为R,即X A =1.0,则由上头的积分式知,t →∝,那隐然是不可能的.3.5正在间歇反应器中举止液好同应:3,C ,D 的初初浓度为整,B 过量,反当令间为t 1时,C A 3,C C =0.038 kmol/m 3,而反当令间为t 2时,C A =0.01 kmol/m 3,C C 3,试供:(1) (1) k 2/k 1;(2) (2) 产品C 的最大浓度;(3) (3) 对付应C 的最大浓度时A 的转移率.解:(1)果为B 过量,所以:恒容时:'1-=A A dC k C dt (A )''12-=-C A C dC k C k C dt (B)(B )式除以(A )式得:解此微分圆程得:'2'10'200'11⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥⎝⎭⎢⎥-⎣⎦k k A A A C A A C C C C k C C k(C )将t 1,C A ,C C 及t 2,C A ,C C 数据代进(C )式化简得: 解之得:(2)先供出最大转移率:(3)产品C 的最大支率:产品C 的最大浓度:3.6 正在等温间歇反应器中举止液好同应初初的反应物料中不含A 2战A 3,A 1的浓度为2mol/l ,正在反应温度下k 1-1,k 2-1,k 3-1.试供:(1) (1) 反当令间为1.0min 时,反应物系的组成.(2) (2) 反当令间无限延万古,反应物系的组成.(3) (3) 将上述反应改为31123−−→⇔←−→k k A A A 反当令间无限延万古,反应物系的组成.解:根据题中给的二种反应情况,可分别列出微分圆程,而后举止供解.然而小心领会那二种情况,本去量是下述反应的惯例:12123←−→←−→k k A A A (A)当'20=k 时,(A )式形成123⇔→A A A (B) 当'10=k 时,(A )式形成123→⇔A A A (C) 当''120,0==k k 时,(A )式形成123→→A A A (D) 其中式(D )即为书籍道的一级不可顺连串反应.可睹只消得到(A )式的解,则可简单化简得到(B ),(C)及(D)式的解.对付于(A)式,可列出如下微分圆程组:'11111-=-dC k C k C dt (1)''211231222=+--dC k C k C k C k C dt (2)'32223=-dC k C k C dt (3)由题意知初初条件为:11023(0),(0)(0)0===C C C C (4)联坐供解此微分圆程组可得:'''''21112211011()()()()⎧⎫⎡⎤++⎪⎪=+-⎨⎬⎢⎥-++⎪⎪⎣⎦⎩⎭t t k k k k k e k e C C k k αβαβαβαβααββ (5)'''12122210()()⎧⎫⎡⎤++⎪⎪=+-⎨⎬⎢⎥-⎪⎪⎣⎦⎩⎭t t k k k k e k e C C αβαβαβαβαβ (6)1212310⎧⎫⎡⎤⎪⎪=+-⎨⎬⎢⎥-⎪⎪⎣⎦⎩⎭t t k k k k e e C C αβαβαβαβ (7)式中,,αβ由如下式决定:'''121221=++k k k k k k αβ (8)''1122()+=-+++k k k k αβ (9)当前可用上述截止对付本题举止预计:(1)1'11'11224.0min , 3.6min , 1.5min ,0,1min ---=====k k k k t 由(5)~(9)式得(2)当t →∝时,由(5)~(9)式得(3)此时为'10=k 的情况,当t →∝时,由114.0min ,-=k 1'1221.5min , 3.6min --==k k 得:3.7拟安排一反应拆置等温举止下列液好同应:脚段产品为R ,B 的代价近较A 贵且阻挡易回支,试问:(1) (1) 怎么样采用本料配比?(2) (2) 若采与多段齐混流反应器串联,何种加料办法最佳?(3) (3) 若用半间歇反应器,加料办法又怎么样?解:(1)212221211221===++A R A B AB A A B A B B r kC C S k C R k C C k C C k C νν 由上式知,欲使S 减少,需使C A 矮,C B 下,然而由于B 的代价下且阻挡易回支,故应按主反应的计量比投料为好.(2)包管C A 矮,C B 下,故可用下图所示的多釜串联办法:(3)用半间歇反应器,若欲使C A 矮,C B 下,不妨将B 一次先加进反应器,而后滴加A.300l 的反应器中86℃3的过氧化氢同丙苯溶液领会: -1,最后转移率达98.9%,试预计苯酚的产量.(1) (1) 如果那个反应器是间歇支配反应器,并设辅帮支配时间为15min;(2) (2) 如果是齐混流反应器;(3) (3) 试比较上二问的预计截止;(4) (4) 若过氧化氢同丙苯浓度减少一倍,其余条件稳定,截止何如?解:(1)苯酚浓度0 3.20.989 3.165/==⨯=苯酚A A C C X mol l苯酚产量018.82 3.16559.56/min 335.9/=⨯==苯酚Q C mol kg h(2)齐混流反应器苯酚产量016.02 3.20.98950.69/min 285.9/=⨯⨯==苯酚Q C mol kg h(3)证明齐混釜的产量小于间歇釜的产量,那是由于齐混釜中反应物浓度矮,反应速度缓的本果.(4)由于该反应为一级反应,由上述预计可知,无论是间歇反应器或者齐混流反应器,其本料处理量稳定,然而由于C AB 减少一倍,故C 苯酚也减少一倍,故上述二个反应器中苯酚的产量均减少一倍.3.9正在间歇反应器中等温举止下列液好同应:r D及r R分别为产品D及R的死成速率.反应用的本料为A 及B的混同液,其中A的浓度等于2kmol/m3.(1)(1)预计A的转移率达95%时所需的反当令间;(2)(2) A的转移率为95%时,R的支率是几?(3)(3)若反应温度稳定,央供D的支率达70%,是可办到?(4)(4)改用齐混反应器支配,反应温度与本料组成均不改变,脆持空时与(1)的反当令间相共,A的转移率是可可达到95%?(5)(5)正在齐混反应器中支配时,A的转移率如仍央供达到95%,其余条件稳定,R的支率是几?(6)(6)若采与半间歇支配,B先搁进反应器内,启初反当令A按(1)预计的时间均速加进反应器内.假若B的量为1m33,试预计A加完时,组分A所能达到的转移率及R的支率.(2)(3)若转移率仍为0.95,且温度为常数,则D的瞬时采用性为:D的支率:那证明能使D的支率达到70%(4)对付齐混流反应器,若使τ=t=0.3958h,则有解之得:C A所以:0.77840.95-==A AAAC CXC那证明正在那种情况下转移率达不到95%.(5)(5)对付齐混流反应器,若X=0.95,则R的支率为:(6)依题意知半间歇式反应器属于连绝加料而间歇出料的情况.为了供分组A 的转移率及R 的支率,需央供出A 及R 的浓度随时间的变更关系,现列出如下的微分圆程组:对付A: 200()(1.616.4)++=A A A A d VC C C V Q C dt (1)对付R:() 1.60-=R A d VC C V dt (2)00=+V V Q t (3)正在反当令间(t=0.4038h,为便当起睹与t ≈0.4h )内将0.4 m 3的A 均速加进反应器内,故300.41/0.4==Q m h 采与间歇釜支配时,本料为A 与B 的混同物,A 的浓度为2kmol/ m 3.现采与半间歇釜支配,且331,0.4==B A V m V m ,故可算出本料A 的浓度为:30(10.4)2/0.4+⨯=A C kmol m 由于:代进(1),(2)式则得如下一阶非线性微分圆程组:27 1.616.41-=--+A A A A dC C C C dt t (4) 1.61=-+R RA dC C C dt t (5)初初条件:t=0,C A =0,C R =0可用龙格---库塔法举止数值供解.与步少△A 战C R 不妨举止A 的转移率战R 的支率预计:0000--==A A A A A A A A A N N C V C V X N C V式中V A 为所加进的A 的体积,且V A 3;C A0为所加进的A 的浓度,且C A0=7kmol/m 33.共理不妨预计出R 的支率:0=R R A A C V Y C V 3.10正在二个齐混流反应器串联的系统中等温举止液好同应:3,流量为4m 3/h,央供A 的最后转移率为90%,试问:(1) (1) 总反应体积的最小值是几?(2) (2) 此时脚段产品B 的支率是几?(3) (3) 如劣化目标函数改为B 的支率最大,最后转移率为几?此时总反应体积最小值是几?解:(1)对付上式供dV r /dX A1=0可得:1212111(1)+-=--A A A X X X将X A2=0.9代进上式,则311100(1)1-=+A A X X解之得X A1所以总反应体积的最小值为(2) 即113.24940.0912314=-B B C C解得C B1=0.005992 kmol/m 3 共理212222220224.6760.0059924341434(1)14--===---BB B A B A A B CC C C C C X C τ解得C B2=0.00126 kmol/m 3B 的支率:2020.001262 1.26%0.2⨯===B B A C Y C(3)目标函数改为B 的支率,那时的预计步调如下:对付于第i 个釜,组分A,B 的衡算圆程分别为:对付A: 1268--=Ai AiiAi C C C τ对付B: 123414--=-Bi Bi iAi Bi C C C C τ当i=1时,0112168-=A A A C C C τ (1)112113414=-B A B C C C τ (2)当i=2时,1222268-=A A A C C C τ (3)222223414=-B A B C C C τ (4)由(1)式解出C A1代进(2)式可解出C B1; 由(1)式解出C A1代进(3)式可解出C A2;将C B1及C A2代进(4)式可解出C B2,其为τ1,τ2的函数,即2012(,,)=B A C f C ττ(5)式中C A0为常数.由题意,欲使C B2最大,则需对付上述二元函数供极值:联坐上述二个圆程不妨供出τ1及τ2.题中已给出Q 0,故由012()=+r V Q ττ可供出C B2最大时反应器系统的总体积.将τ1,τ2代进(5)式即可供出B 的最下浓度,从而可进一步供出Y BmaX .将τ1,τ2代进C A2,则由X A2=(C A0-C A2)/C A0可供出最后转移率.490cm 3的CSTR 中举止氨与甲醛死成黑洛托品的反应:3264246()6+→+NH HCHO CH N H O式中(A )--NH 3,(B)—HCHO,反应速率圆程为:式中31.4210exp(3090/)=⨯-k T 3/s 的流量加进反应器,反应温度可与为36℃,假设该系统稀度恒定,试供氨的转移率X A 及反应器出心物料中氨战甲醛的浓度C A 及C B .解: 即得:234900.06447(1)(3.16 1.5 2.03)=--⨯AfAf Af X X X整治得:323.075 3.162 1.0770-+-=Af Af Af X X X解得:X Af反应器出心A,B 得浓度分别为:3.12正在一多釜串通联统,/h 的乙醇 战.h 的醋酸举止可顺反应.各个反应器的体积均为3,反应温度为100℃×10-4l ×10-4 l/mol.min.反应混同物的稀度为864kg/m 3,欲使醋酸的转移率达60%,供此串通联统釜的数目.解:等体积的多釜串通联统A,B,C,D 分别代表乙酸,乙酸乙酯战火.由计量关系得: 从已知条件预计出:将上述数据代进(A )式,化简后得到:若i=1,则(B )式形成:21100.04056 1.51130.887 6.48+-==A A A C C C 解之得:114.364/,0.326==A A C mol l X 若i=2,则(B )式形成:22210.04056 1.51130.887 4.364+-==A A A C C C 解之得:213.20/,0.506==A A C mol l X 若i=3,则(B )式形成:23320.04056 1.51130.887 3.2+-==A A A C C C 解之得:312.53/,0.609==A A C mol l X 即:三釜串联能谦脚央供.3.13以硫酸为催化剂,由醋酸战丁醇反应可制得醋酸丁酯.堆栈里忙置着二台反应釜,一台的反应体积为3m 3,另一台则为1m 33,丁酯则洪量过剩,该反应付于醋酸为2级,正在反应温度下反应速率常数等于3/h.kmol ,央供醋酸的最后转移率不小于50%,那二台反应釜可视为齐混反应器,您认为采与何如的串联办法醋酸丁酯的产量最大?为什么?试预计您所采用的规划得到的醋酸丁酯产量.如果举止的反应是一级反应,那二台反应器的串联办法又应怎么样? 解:果为反应级数大于1,所以联坐办法应当是小釜正在前,大釜正在后才搞使醋酸丁酯产量最大.现举止预计: 二式联坐化简后得到:(将X A2=0.5代进)解之得:X A1醋酸丁酯产量=0020.48730.150.536.55/=⨯⨯=A A Q C X mol h 如果举止的是一级反应,可举止如下预计:(1) (1) 小反应器正在前,大反应器正在后: 联坐二式,且将X A2=0.5代进,化简后得到:解得:X A1 所以有:3101(1) 1.2(10.1771) 5.576/0.1771--===A A k X Q m h X 醋酸丁酯产量=002 5.5760.150.50.4182/=⨯⨯=A A Q C X kmol h (2)大反应器正在前,小反应器正在后:解得X A1 所以有:31013(1)3 1.2(10.3924) 5.575/0.3924-⨯-===A A k X Q m h X产量共前.证明对付此一级反应,对接办法不效用.3.14等温下举止1.5级液相不可顺反应:→+A B C .反应速率常数等于5m/kmol.h ,A 的浓度为2kmol/m 3的溶液加进反应拆置的流量为3/h ,试分别预计下列情况下A 的转移率达95%时所需的反应体积:(1)齐混流反应器;(2)二个等体积的齐混流反应器串联;(3)包管总反应体积最小的前提下,二个齐混流反应器串联.解:(1)齐混流反应器(2) (2) 二个等体积齐混流反应器串联由于12=r r V V ,所以由上二式得:将X A2=0.95代进上式,化简后得到X A1=0.8245,所以: 串通联统总体积为:312 4.758==r r V V m (3) (3) 此时的情况共(1),即318.03=r V m 3/min 的流量连绝通进反应体积为20m 3的齐混流反应器,举止液好同应:C A ,C R 为组分A 及R 的浓度.r A 为组分A 的转移速率,。
李绍芬《反应工程》课后习题答案

李绍芬《反应工程》课后习题答案1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分 摩尔分率y i0 摩尔数n i0(mol) CH 3OH 2/(2+4+1.3)=0.2740 27.40 空气 4/(2+4+1.3)=0.5479 54.79 水 1.3/(2+4+1.3)=0.1781 17.81 总计 1.000 100.0A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol组分 摩尔数(mol ) 摩尔分率% CH 3OH 7.672 6.983 HCHO 18.96 17.26 H 2O 38.3 34.87 CO 2 0.7672 0.6983 O 2 0.8788 0.7999 N 2 43.28 39.391. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+ 242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩原料气 Bkg/h 粗甲醇 Akmol/h100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
李绍芬版反应工程答案之令狐文艳创作

1 绪论令狐文艳1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol时,A P)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol1.1. 2醇,其主副反应如下:由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气原料气Bkg/h 粗甲醇 Akmol/h100kmol放空气体原料气和冷凝分离后的气体组成如下:(mol)组分原料气冷凝分离后的气体CO 26.82 15.49H268.25 69.78CO2 1.46 0.82CH40.55 3.62N2 2.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg粗甲醇而言,其溶解量为CO29.82g,CO 9.38g,H2 1.76g,CH4 2.14g,N25.38g。
李绍芬版本 反应工程 课后习题全解 管式反应器

4 管式反应器4.1在常压及800℃等温下在活塞流反应器中进行下列气相均相反应: 6532664+→+C H CH H C H CH在反应条件下该反应的速率方程为:0.51.5,/.=T H r C C mol l s式中C T 及C H 分别为甲苯及氢的浓度,mol/l ,原料处理量为2kmol/h ,其中甲苯与氢的摩尔比等于1。
若反应器的直径为50mm ,试计算甲苯最终转化率为95%时的反应器长度。
解:根据题意可知甲苯加氢反应为恒容过程,原料甲苯与氢的摩尔比等于1,即:00=T H C C ,则有:0(1)==-T H T T C C C X示中下标T 和H 分别代表甲苯与氢,其中:53300330000.5 1.01310 5.6810/8.3141010732/21/0.27810/--⨯⨯===⨯⨯⨯====⨯T T T T p C kmol mRT F Q C kmol h kmol s所以,所需反应器体积为:00000.5 1.500 2.50.95333 1.5 1.501.5 1.5(10.95)10.278100.4329 3.0061.5(5.6810)(1) 1.51---==--=⨯=⨯=⨯--⎰⎰⎰TT X X T Tr T T T H T T T dX dX V Q C Q C C C C dX mX 所以,反应器的长度为:23.0061531.10.05 3.14/4=⨯m4.2根据习题3.2所规定的条件和给定数据,改用活塞流反应器生产乙二醇,试计算所需的反应体积,并与间歇釜式反应器进行比较。
解:题给条件说明该反应为液相反应,可视为恒容过程,在习题3.2中已算出:0275.8/=Q l h 0 1.231/=A C mol l所以,所需反应器体积:00000000(1)()275.80.95818.61 5.2 1.23110.95=--===-⨯-⎰AX Ar A A A B A A A A A dX V Q C kC X C C X Q X lkC X由计算结果可知,活塞流反应器的反应体积小,间歇釜式反应器的反应体积大,这是由于间歇式反应器有辅助时间造成的。
反应工程_天大_李绍芬
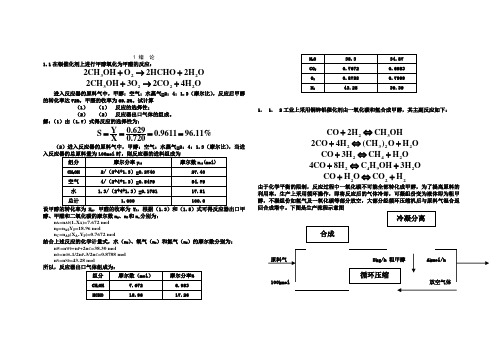
1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进A P 醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P=18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图Bkg/h 粗甲醇原料气和冷凝分离后的气体组成如下:(mol)组分原料气冷凝分离后的气体CO 26.82 15.49H268.25 69.78CO2 1.46 0.82CH40.55 3.62N2 2.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
李绍芬版反应工程答案之欧阳美创编

1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol时,则A P)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol1.1. 2醇,其主副反应如下:由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气原料气Bkg/h 粗甲醇 Akmol/h100kmol放空气体原料气和冷凝分离后的气体组成如下:(mol)组分原料气冷凝分离后的气体CO 26.82 15.49H268.25 69.78CO2 1.46 0.82CH40.55 3.62N2 2.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg粗甲醇而言,其溶解量为CO2 9.82g,CO 9.38g,H2 1.76g,CH4 2.14g,N25.38g。
反应工程 李少芬答案

CA(mol/L) 0.9 0.61 0.42 0.28 0.17 0.12 0.08 0.045 0.03
试求反应时间为3.5h的A的水解速率。
解:利用反应时间与组分A的浓度变化数据,作出CA~t的关系曲线,用镜面法求得t=3.5h时该点的切线,即为水解速率。
原料气和冷凝分离后的气体组成如下:(mol)
组分 原料气 冷凝分离后的气体
CO 26.82 15.49
H2 68.25 69.78
CO2 1.46 0.82
CH4 0.55 3.62
N2 2.92 10.29
粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg粗甲醇而言,其溶解量为CO2 9.82g,CO 9.38g,H2 1.76g,CH4 2.14g,N25.38g。若循环气与原料气之比为7.2(摩尔比),试计算:
(6) (6) 根据图中所给的十点中,判断哪一点速率最大?
解: 图2.1 图2.2
(1)可逆反应 可逆反应
(2)放热反应 吸热反应
(3)M点速率最大,A点速率最小 M点速率最大,A点速率最小
解:从题中可知,反应条件除了温度不同外,其它条件都相同,而温度的影响表现在反应速率常数k上,故可用反应速率常数之比来描述反应速率之比。
2.8常压下,在钒催化剂上进行SO2氧化反应,原料气组成为7%O2及82%N2。试计算转化率为80%时的最佳温度。二氧化硫在钒催化剂上氧化的正反应活化能为 ,化学计量数等于2,反应式为:
李绍芬版反应工程答案之欧阳音创编

1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总A P(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol1.1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图原料气Bkg/h 粗甲醇 Akmol/h100kmol放空气体原料气和冷凝分离后的气体组成如下:(mol)组分原料气冷凝分离后的气体CO 26.82 15.49H268.25 69.78CO2 1.46 0.82CH40.55 3.62N2 2.92 10.29 粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg粗甲醇而言,其溶解量为CO2 9.82g,CO 9.38g,H2 1.76g,CH4 2.14g,N25.38g。
化学反应工程李绍芬第三版课后答案

化学反应工程李绍芬第三版课后答案1、苯丙素类的基本母核是具有一个或数个()单元的天然化合物()[单选题] * AC6-C3基团(正确答案)BC6-C6基团CC5-C3基团DC8-C8基团2、在结晶溶剂的选择过程中首先要遵循的是()[单选题] *A成分的纯度(正确答案)B相似相容原理C冷却热饱和原理D以上都不对3、阿托品的结构类型是()[单选题] *A喹啉类B异喹啉类C莨菪烷类(正确答案)D苄基异喹啉类4、E连续回流提取法(正确答案)能用乙醇作溶剂提取的方法有(多选)()* A浸渍法(正确答案)B渗漉法(正确答案)C煎煮法D回流提取法(正确答案)5、下列应用最广的经典提取方法是()[单选题] *A水蒸气蒸馏法B溶剂提取法(正确答案)C超临界流体萃取法D超声提取法6、下列化合物中β位有-COOH取代的是()[单选题] *A大黄素B大黄酸(正确答案)C大黄素甲醚D芦荟大黄素7、属于挥发油特殊提取方法的是()[单选题] *A酸提碱沉B水蒸气蒸馏(正确答案)C煎煮法D浸渍法8、南五味子保肝的主要效药效成分是()[单选题] *A蒽醌B香豆素C黄酮D木脂素(正确答案)9、处方中厚朴主要化学成分厚朴酚,其结构类型是()[单选题] * A黄酮B香豆素C木脂素(正确答案)D三萜皂苷10、具有升华性的生物碱是()[单选题] *A烟碱B咖啡因(正确答案)C槟榔碱D苦参碱11、游离生物碱和生物碱盐都易溶解的溶剂是()[单选题] *A三氯甲烷B正丁醇C乙醇(正确答案)D水12、从香豆素类的结构与分类看,下列属于简单香豆素类的是()[单选题] * A龙脑B七叶内酯(正确答案)C薄荷醇D西瑞香素13、木脂素母核结构中的C6-C3单体数目为()[单选题] *A1个B2个(正确答案)C3个D4个14、下列不能作为极性吸附剂的是()[单选题] *A活性炭(正确答案)B氧化铝C硅胶D氧化镁15、碱水提取芦丁时,若PH过高会使()[单选题] * A产品质量降低B产品收率降低(正确答案)C苷键水解断裂D内酯环开环16、下列含有蒽醌类成分的中药是()*A丹参B决明子(正确答案)C芦荟(正确答案)D紫草17、分馏法分离挥发油的主要依据是()[单选题] * A密度的差异B沸点的差异(正确答案)C溶解性的差异D旋光性的差异18、可沉淀具有羧基或邻二酚羟基成分的沉淀法是()[单选题] *A溶剂沉淀法B醋酸铅沉淀法(正确答案)C酸碱沉淀法D水提醇沉法19、以下哪种方法是利用成分可以直接由固态加热变为气态的原理()A [单选题] * A升华法(正确答案)B分馏法C沉淀法D透析法20、四氢硼钠反应变红的是()[单选题] *A山柰酚B橙皮素(正确答案)C大豆素D红花苷21、结晶法一般是在分离纯化物质的哪个阶段常常使用的()[单选题] * A开始B中期C最后(正确答案)D以上均可22、连续回流提取法与回流提取法比较,其优越性是()[单选题] *A节省时间且效率高B节省溶剂且效率高(正确答案)C受热时间短D提取量较大23、具有挥发性的生物碱是()[单选题] *A苦参碱B莨菪碱C麻黄碱(正确答案)D小檗碱24、具有挥发性的生物碱是()[单选题] *A吗啡碱B麻黄碱(正确答案)C苦参碱D小檗碱25、极性最大的溶剂是()[单选题] *A酸乙酯(正确答案)B苯C乙醚D氯仿26、二氢黄酮类专属性的颜色反应是()[单选题] * A盐酸-镁粉反应B四氢硼钠反应(正确答案)C硼酸显色反应D锆盐-枸橼酸反应27、水蛭的主要化学成分是()[单选题] *A有机酸B蛋白质(正确答案)C多糖D生物碱28、下列化合物中,酸性最强的是()[单选题] *A芦荟大黄素B大黄酚C大黄素甲醚D大黄酸(正确答案)29、与明胶反应生成沉淀的成分是()[单选题] *A强心苷B皂苷C有机酸D鞣质(正确答案)30、E连续回流提取法(正确答案)用乙醇作溶剂提取时,下列说法正确的是()* A对植物细胞壁穿透力强(正确答案)B溶解范围广,提取较全面(正确答案)C提取液中蛋白质、多糖等水溶性杂质少(正确答案)D有防腐作用,提取液不易发霉变质(正确答案)。
李绍芬版反应工程答案之欧阳歌谷创编

1 绪论欧阳歌谷(2021.02.01)1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol时,则反应设甲醇的转化率为X A P 1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c 分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol1.1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图原料气Bkg/h 粗甲醇 Akmol/h100kmol放空气体原料气和冷凝分离后的气体组成如下:(mol)组分原料气冷凝分离后的气体CO 26.82 15.49H268.25 69.78CO2 1.46 0.82CH40.55 3.62N2 2.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
李绍芬版反应工程习题答案第二章

2 反应动力学基础2.1在一体积为4L 的恒容反应器中进行A 的水解反应,反应前 A 的含量为12.23%(重量),混合物的密度为1g/mL ,反应物A 的分子量为88。
在等温常压下不断取样分析,测的组分A 的浓度随时间变化的数据如下:反应时间(h ) 1.0 2.0 3.0 4.0 5.0 6.0 7.0 8.0 9.0 C A (mol/L) 0.9 0.61 0.42 0.28 0.17 0.12 0.08 0.045 0.03 试求反应时间为3.5h 的A 的水解速率。
解:利用反应时间与组分A 的浓度变化数据,作出C A ~t 的关系曲线,用镜面法求得t=3.5h 时该点的切线,即为水解速率。
切线的斜率为0.760.125/.6.1α-==-mol l h由(2.6)式可知反应物的水解速率为0.125/.-==dC A r mol l hAdt2.2在一管式反应器中常压300℃等温下进行甲烷化反应:2423+→+CO H CH H O催化剂体积为10ml ,原料气中CO 的含量为3%,其余为N 2,H 2气体,改变进口原料气流量Q 0进行实验,测得出口CO 的转化率为:Q 0(ml/min) 83.3 67.6 50.0 38.5 29.4 22.2 X(%) 20 30 40 50 60 70试求当进口原料气体流量为50ml/min 时CO 的转化速率。
解:是一个流动反应器,其反应速率式可用(2.7)式来表示00000(1)(1)-==-=-=-A A RA A A A A A A AdF r dV F F X Q C X dF Q C dX故反应速率可表示为:000(/)==A AA A A R R dX dX r Q C C dV d V Q用X A ~V R /Q 0作图,过V R /Q 0=0.20min 的点作切线,即得该条件下的dX A /d(V R /Q 0)值α。
V R /Q 0min 0.12 0.148 0.20 0.26 0.34 0.45 X A % 20.0 30.0 40.0 50.0 60.0 70.00.650.04 1.790.34α-==故CO 的转化速率为40030.10130.03 6.3810/8.31410573--⨯===⨯⨯⨯A A P C mol l RT4300 6.3810 1.79 1.1410/.min(/)--==⨯⨯=⨯AA A R dX r C mol l d V Q2.3已知在Fe-Mg 催化剂上水煤气变换反应的正反应动力学方程为: 20.850.4/-=⋅w CO CO r k y y kmol kg h式中y CO 和y CO2为一氧化碳及二氧化碳的瞬间摩尔分率,0.1MPa 压力及700K 时反应速率常数k W 等于0.0535kmol/kg.h 。
李绍芬版本 反应工程 课后习题全解 管式反应器

4 管式反应器4.1在常压及800℃等温下在活塞流反应器中进行下列气相均相反应: 6532664+→+C H CH H C H CH在反应条件下该反应的速率方程为:0.51.5,/.=T H r C C mol l s式中C T 及C H 分别为甲苯及氢的浓度,mol/l ,原料处理量为2kmol/h ,其中甲苯与氢的摩尔比等于1。
若反应器的直径为50mm ,试计算甲苯最终转化率为95%时的反应器长度。
解:根据题意可知甲苯加氢反应为恒容过程,原料甲苯与氢的摩尔比等于1,即:00=T H C C ,则有:0(1)==-T H T T C C C X示中下标T 和H 分别代表甲苯与氢,其中:53300330000.5 1.01310 5.6810/8.3141010732/21/0.27810/--⨯⨯===⨯⨯⨯====⨯T T T T p C kmol mRT F Q C kmol h kmol s所以,所需反应器体积为:00000.5 1.500 2.50.95333 1.5 1.501.5 1.5(10.95)10.278100.4329 3.0061.5(5.6810)(1) 1.51---==--=⨯=⨯=⨯--⎰⎰⎰TT X X T Tr T T T H T T T dX dX V Q C Q C C C C dX mX 所以,反应器的长度为:23.0061531.10.05 3.14/4=⨯m4.2根据习题3.2所规定的条件和给定数据,改用活塞流反应器生产乙二醇,试计算所需的反应体积,并与间歇釜式反应器进行比较。
解:题给条件说明该反应为液相反应,可视为恒容过程,在习题3.2中已算出:0275.8/=Q l h 0 1.231/=A C mol l所以,所需反应器体积:00000000(1)()275.80.95818.61 5.2 1.23110.95=--===-⨯-⎰AX Ar A A A B A A A A A dX V Q C kC X C C X Q X lkC X由计算结果可知,活塞流反应器的反应体积小,间歇釜式反应器的反应体积大,这是由于间歇式反应器有辅助时间造成的。
李绍芬版本 反应工程 课后习题全解 多相系统中的化学反应

李绍芬版本反应工程课后习题全解多相系统中的化学反应6.多相系统中的化学反应与传递现象6.1、在半径为R 的球形催化剂上,等温进行气相反应⇔A B 。
试以产物B 的浓度C B 为纵座标,径向距离r 为横座标,针对下列三种情况分别绘出产物B 的浓度分布示意图。
(1) (1) 化学动力学控制 (2) (2) 外扩散控制(3) (3) 内、外扩散的影响均不能忽略图中要示出C BG ,C BS 及C Be 的相对位置,它们分别为气相主体、催化剂外表面、催化剂颗粒中心处B 的浓度,C Be 是B 的平衡浓度。
如以产物A 的浓度CA 为纵座标,情况又是如何?解(1)以产物B 的浓度为纵座标(2)以产物A 的浓度为纵座标6.2 已知催化剂颗粒外表面的气膜传热系数为117w/m 2K,气体的密度和热容分别为0.8kg/m 3和2.4J/kgK,试估算气膜的传质系数. 解:-=====⨯⨯=⨯=2/3321/(/)(/Pr),/Pr 1/117/0.8 2.410 6.09410/219.4/D H G p s c c G s p J J k C h S S k h C m s m hρρ又6.3 某催化剂,其真密度为3.60g/cm3,颗粒密度为1.65g/cm3,比表面积为100m2/g.试求该催化剂的孔容,孔隙率和平均孔半径. 解:=-=<>=<>====3(1),0.5422/,65.6/0.542/1.650.328/p t p p a p r p a g p p r S r AV cm g ρρεεερερ由得由得由催化剂6.4 已知铁催化剂的堆密度为 2.7g/cm 3, 颗粒密度为 3.8 g/cm 3,比表面积为16m 2/g,试求每毫升颗粒和每毫升床层的催化剂表面积. 解:==2260.8/43.2/p g g S m ml S m mlρρb 每毫升颗粒的表面积=每毫升床层的表面积=6.5 试推导二级反应和半级反应的扩散有效因子表达式(6.23)和(6.24). 解:(1)二级反应,()()(()=-=-==-±+=⎡⎤=-±+⎣⎦=+-222222222,,4/2/114//2141,/A w AS G m AG AS w ASG m G m w G m AG w w AS w AGG m w AG G m w AG w AG G mR k C k a C C k C k a k a k k a C k k C k C k a k C k a k C Da k C k a αηA S x 由上解得:C 按定义此即(6.23)式式中D a=(2)半级反应()(=-=-==-±+==-++⎛=-++=+-+ ⎝1/21/21/22221/21/22221/21/22221/2,(),4/2/(4)/21411/4222A w AS G m AG AS w AS AS w w G m AG G m w AS w AGw w G m AG G m AGR k C k a C C k C C k k k a C k a k C k C k k k a C k a C Da Da Da Da αηx 由上解得:按定义:()()-⎡++⎢=--⎢⎢⎣⎡⎤⎛+⎢⎥ =--⎢⎥ +⎢⎥⎝⎣⎦=1/22221/22221/222124241122(6.24),:/w AG G mDa Da Da Da Da k C k a 此即式式中6.6 在充填ZnO-Fe2O3催化剂的固床反应器中,进行乙炔水合反应:+→++2223322232C H H O CH COCH CO H已知床层某处的压力和温度分别为0.10Mpa,400℃,气相中C 2H 2含量为3%(mol),该反应速率方程为r=kC A ,式中C A 为C 2H 2的浓度,速率常数k=7.06×107exp(-61570/RT),h -1,试求该处的外扩散有效因子.数据:催化剂颗粒直径0.5cm,颗粒密度1.6g/cm 3,C 2H 2扩散系数7.3×10-5m 2/s,气体粘度2.35×10-5Pa ﹒s,床层中气体的质量流速0.2kg/m 2s. 解:由已知条件可得()()---=⋅=⨯⨯=⨯+⨯=+===⨯⨯⨯===-=⨯⨯2530.359552/370.24/Re 0.0050.24/2.351051.06260.03180.972730.3303/22.44002730.357/(Re )0.24852.3510/(0.33037.310)0.97460.1837/()615707.0610exp 8.314673D b c G D c G kg m skg m j S Gk j m s S k ρερ()-⎡⎤= = ⎢⎥⎣⎦==⨯ ⋅⎡⎤=⨯=⎢⎥⎣⎦332221174.6/0.3263//0.203910/10.005/(0.005)16000.756w p m l h l s k k m kg sa m ρππ====+/0.0014810.99851w G m Da k k a Daπη6.7实验室管式反应器的内径2.1cm,长80cm ,内装直径6.35mm 的银催化剂进行乙烯氧化反应,原料气为含乙烯 2.25%(mol)的空气,在反应器内某处测得P=1.06×105Pa,T G =470K,乙烯转化率35.7%,环氧乙烷收率23.2%,已知+→ =-⨯ +→+ =-⨯ 42422412462422222419.6110/232 1.2510/C H O C H O H J molC H C H O CO H O H J molC H ∆∆颗粒外表面对气相主体的传热系数为58.3w/m 2K,颗粒密度为1.89g/cm 3.设乙烯氧化的反应速率为 1.02×10-2kmol/kg ﹒h,试求该处催化剂外表面与气流主体间的温度差. 解:()-= ⋅⎛⎫-=-+--=⨯ ⎪⎝⎭= ⋅=⨯⋅⋅=== -=--= 512252223()10.2/23.223.2()()1 5.00110/35.735.758.3/ 2.09910/0.50/16()()/48.59A r s ppm p pp p g G A r s m R mol kg h H H H J mol h w m k J m K h S d a m kgV d T T R H h a Kπρπρ∆∆∆∆6.8 一级连串反应:−−→−−→12A B C在0.1Mpa 及360℃下进行,已知k 1=4.368 s -1,k 2=0.417 s -1,催化剂颗粒密度为1.3g/cm 3,(k G a m )A 和(k G a m )B 均为20cm 3/g ﹒s.试求当C BG /C AG =0.4时目的产物B 的瞬时选择性和外扩散不发生影响时的瞬时选择性.解:外扩散无影响时,由(6.35)式得:⨯'=-=0.41730.410.96184.368S外扩散有影响时,由(6.34)式得:⨯=-=+10.41730.4(1.168)0.940310.01605 4.368(1.01605)S上式中所用的====1122/0.168/0.01605a G ma G mk D k a k D k a ρρ6.9 在Pt/Al 2O 3催化剂上于200℃用空气进行微量一氧化碳反应,已知催化剂的孔容为0.3cm 3/g,比表面积为200m 2/g,颗粒密度为1.2g/cm 3,曲节因子为3.7.CO-空气二元系统中CO 的正常扩散系数为0.192cm 2/s.试求CO 在该催化剂颗粒中的有效扩散系数.(----=== ===≥=⨯⨯=⨯ ==⨯ 53822322/30,10,0.36/216.610,,:9.7103010473/28 1.19610// 1.16410/g gp g p a k k p V S A cm V r D cm sDe D cm sλερλετa 解:r 为努森扩散故有6.10 试推导球形催化剂的内扩散有效因子表达式(6.60). 解:==-=-+2222223,:1122A A A C u dC du udr r dr rd C d u du udr r dr r dr r 令可得用以上各式对教材中(6.55)式进行变量置换得:= =2222p d u b u drb k De式中 (A)(A) (A) 式为二阶常系数齐次微分方程,边界条件:r=0 du/dr=0; r=R p u=C AS R p (B) 结合边界条件(B)式解(A)得:= sinh()()sinh()p A ASp R br C C C r bR有内扩散影响时的反应速率为:()=-= 24()p AA pr R dC R De R D dr π ()=⎛⎫-=-⎪⎝⎭(),():114tanh p A r R A p s AS s s dCC D drR R C De πφφφ由式求出代入式得按内扩散有效因子的定义:⎛⎫⎛⎫=-=- ⎪ ⎪⎝⎭⎝⎭3411311()3tanh tanh 4p s AS s s s s s p p ASR C De E R k C πφηφφφφφπ==/s p p bR R k Deφ式中==⎛⎫=- ⎪⎝⎭/3/():3111()tanh(3)3ps p R k De E F φφηφφφ若令则式可改写为(F)即为教材(6.60)式,(E)式是(6.60)的又一形式.6.11 在球形催化剂上进行气体A 的分解反应,该反应为一级不可逆放热反应.已知颗粒直径为0.3cm,气体在颗粒 中有效扩散系数为 4.5×10-5m 2/h,颗粒外表面气膜传热系数为44.72w/m 2﹒K,气膜传质系数为310m/h,反应热效应为-162kJ/mol,气相主体A 的浓度为0.20mol/l,实验测得A 的表观反应速率为1.67mol/minl, 试估算:(1) (1) 外扩散阻力对反应速率的影响; (2) (2) 内扩散阻力对反应速率的影响; (3) (3) 外表面与气相主体间的温度差. 解:--=⋅=⨯⋅⨯⨯==⨯<*53331.67/min 1.00210/(1)31.671060.8081100.150.2(310/60),.AAG G R mol l mol m h L C k *A 判别外扩散阻力的影响用(6.79)式:R 故仅从传质考虑外扩散影响可不计==*2(2)(6.82),:2.783s A s AGR L DeC φφ判别内扩散阻力的影响用式先求出====2, 2.783,(6.60) 3.1,0.288,s s φηφφφη因有从可借助式估算出由此可知内扩散阻力影响严重.(3)计算外表面与气相主体间温度差⊿Tm : =-=⋅⋅⋅*)/m G s A s T T T R h ∆∆r 颗粒体积(H 颗粒外表面积=50.4K6.12 在固体催化剂上进行一级不可逆反应→ ()A B A已知反应速率常数k,催化剂外表面积对气相的传质系数为k G a m ,内扩散有效因子η.C AG 为气相主体中组分A 的浓度. (1)试推导:()()-=+11AG A G mC R B k k a η(2)若反应式(A)改为一级可逆反应则相应的(B)式如何?解:(1)一级不可逆反应 A B:()()()()-=-==+==+/1A G AG AS m G m AG G m AG G m R k C C a k k a C k k a C k k a kηηηηA S A S A A S C 由上可解得:C 解得:-RC(2)一级可逆反应:AB()()()()()()()()-=-=+-+=+--=+-=++:11A G m AG AS AS Ae G m AG AeG m AG AS A AS Ae G mR k a C C k k C C k a C kC k a kC C R k k C C k a k k ηηηηηA S 由解得:C 则有6.13 在150℃,用半径100μm 的镍催化剂进行气相苯加氢反应,由于原料中氢大量过剩,可将该反应按一级(对苯)反应处理,在内,外扩散影响已消除的情况下,测得反应速率常数k p =5min -1, 苯在催化剂颗粒中有效扩散系数为0.2cm 2/s,试问:(1) (1) 在0.1Mpa 下,要使η=0.8,催化剂颗粒的最大直径是多少?(2) (2) 改在2.02Mpa 下操作,并假定苯的有效扩散系数与压力成反比,重复上问的计算.(3) (3) 改为液相苯加氢反应,液态苯在催化剂颗粒中的有效扩散系数10-5cm 2/s.而反应速率常数保持不变,要使η=0.8,求催化剂颗粒的最大直径. 解:()==⎛⎫- ⎪ ⎪⎝⎭(1)0.1076611tanh 33p p pd k d Deφηφφφ1由(6.60)式=用试差法从上二式可解得当η=0.8时,需d p <6.36cm(2)2.02Mpa 时,De ≈0.2×0.101/2.02=0.01 cm 2/s,与此相对应:==0.4186p p pd k d Deφ同上法可求得当η=0.8时,需d p <1.42cm(3)液相反应时,De=1×10-6cm 2/s,与此相应的φ为21.51dp,同上法可求得当η=0.8时,需d p <0.0142cm.6.14 一级不可逆反应A B,在装有球形催化剂的微分固定床反应器中进行温度为400℃等温,测得反应物浓度为0.05kmol/m 3时的反应速率为 2.5 kmol/m 3床层﹒min ,该温度下以单位体积床层计的本征速率常数为k v =50s -1 ,床层孔隙率为0.3,A 的有效扩散系数为0.03cm 2/s,假定外扩散阻力可不计,试求:(1) (1) 反应条件下催化剂的内扩散有效因子 (2) (2) 反应器中所装催化剂颗粒的半径()===== --==-==⨯⨯ ⋅3171.43/18.136500.05/p v B B B vv v p B p p pA v AS V k V V V k k k l s V V V d k d DeR k C kmol s m εεφηηp p 解:k k 床层实验测得(-R A )=0.0417 kmol/s ﹒m 3床层,解上二式得η=0.0167,可见内扩散影响严重.由η=1/φ=1/8.13dp=0.0167,可解出dp=7.38cm,即反应器所装催化剂的颗粒 半径为3.69cm.6.15 在0.10Mpa,530℃进行丁烷脱氢反应,采用直径5mm 的球形铬铝催化剂,此催化剂的物理性质为:比表面积120m 2/g,孔容0.35cm 3/g,颗粒密度1.2g/cm 3,曲节因子 3.4.在上述反应条件下该反应可按一级不可逆反应处理,本征反应速率常数为0.94cm 3/gs,外扩散阻力可忽略,试求内扩散有效因子.解:丁烷分子量为58,λ=10-5cm,<ra>=2Vg/Sg=58.3×10-8cm, λ/2<ra>=8.576,此值与10接近,故可近似扩散是以奴森扩散为主:()--=⨯⨯+=⨯22970058.310530273/58 2.10410/k D cm s--==⨯⨯==⨯323/ 2.610/0.50.94 1.2 1.7366 2.610k p m De D cm s ετφ由(6.60)式算得η=0.465.6.16 在固定床反应器中等温进行一级不可逆反应,床内填充直径为6mm 的球形催化剂,反应组分在其中的扩散系数为0.02cm 2/s,在操作温度下,反应式速率常数等于0.01min -1,有人建议改有3mm 的球形催化剂以提高产量,你认为采用此建议能否增产?增产幅度有多大?假定催化剂的物理性质及化学性质均不随颗粒大小而改变,并且改换粒度后仍保持同一温度操作.解:=======0.6,0.02887,0.9995,60.3,0.01444,0.9998p pp p d k d cm Ded cm φηφη故采用此建议产量的增加是很有限的.6.17 在V 2O 5/SiO 2催化剂上进行萘氧化制苯酐的反应,反应在 1.013×105Pa 和350℃下进行,萘-空气混合气体中萘的含量为0.10%(mol),反应速率式为:⎛⎫=⨯-⋅ ⎪⎝⎭50.381353603.82110exp ,/A A r p kmol kg hRT式中PA 为萘的分压,Pa.已知催化剂颗粒密度为1.3g/cm 3,颗粒直径为0.5cm,试计算萘氧化率为80%时萘的转化速率(假定外扩散阻力可忽略),有效扩散系数等于3×10-3cm 2/s.解:因外扩散阻力可不计,故C AS ≈C AG , ()-= ⋅0.38/A p AGR k C kmol kg h η 式中η由教材(6.66)式计算,为此先计算以下数据:--==⨯⎛⎫=⨯-⋅ ⎪⎝⎭⎛⎫ =⨯-⋅ ⎪⎝⎭13250.3850.383/12,310/,1353603.8210exp /1353603.8210exp /p p p AGp AG a V cm De cm s k p kmol kg h RT p kmol m h RT ρA 的值由:r 颗粒将此P AG =C AG RT,ρp =1300kg/m 3颗粒,T=(350+273)K 代入上式,并将小时换为秒计则得:-=⨯⋅40.3832.19610/A AG r C kmol m s 颗粒由上式得 k p =2.196×10-4又:C AS =C AG =P AG /RT=105×0.1%(1-0.8)/(8314×623)=3.861×10-6 kmol/m 3 将有关数值代入(6.66)式得:()()()()()--=====⨯==⨯⎰⎰⎰1/20.3831/20.381/242] 1.12:8.76910[][] 1.566310ASACASACAS C A A C p p AS C AS AG AGA A C C A A a De f C dC V k f C f C f C C f C dC C dC η式中最后得萘氧化率为80%时的萘的转化速率为: ()--==⨯⋅0.38632.15710/A p AGR k C kmol m s η颗粒6.18 乙苯脱氢反应在直径为0.4cm 的球形催化剂上进行,反应条件是0.10Mpa,600℃,原料气为乙苯和水蒸汽的混合物,二者摩尔比为1:9,假定该反应可按拟一级反应处理.⎛⎫''= =-⋅⋅ ⎪⎝⎭913000.1244exp ,/w EB w r k p k kmol kg h PaRT 苯乙烯(1)当催化剂的孔径足够大,孔内扩散属于正常扩散,扩散系数D’=1.5×10-5m 2/s, 试计算内扩散有效因子.(2)当催化剂的平均孔径为100Å时,重新计算内扩散有效因子. 已知:催化剂颗粒密度为1.45g/cm 3,孔率为0.35,曲节因子为3.0. 解:为计算内扩散有效因子,先求取K p := ⋅= ⋅3//EB p EB r kp kmol kg h k p kmol m h ρ由颗粒 将 P EB =RTC EB ,T=(600+273)代入上式得:=⨯ ⋅= ⋅3334.50810/ 1.252/BE EB r C kmol m h C kmol m s 颗粒颗粒由此得K p =1.252 s -1(1) (1) 孔径足够大,属正常扩散时, -==⨯ 62/ 1.7510/p m De D m s ετ由此求得Φ=0.564,由(6.60)式算得η=0.85(2) (2) 孔半径为100Å时:λ/2<ra>=10-5/200×10-8=5,属于过渡区扩散,由教材(6.36)式可算得乙苯的Dk=2.784×10-2cm 2/s. --==⨯+⨯22212.34810/112.784100.15D cm s--==⨯=⨯32722.73910/ 2.73910/p m D De cm s m s ετ 由上数据可算得φ=1.425,由教材(6.60)式算得η=0.5286.19 苯(B)在钒催化剂上部分氧化成顺酐(MA),反应为:这三个反应均为一级反应.实验测得反应器内某处气相中苯和顺酐的浓度分别为 1.27%和0.55%(均为mol%),催化剂外表面温度为623K,此温度下,k1=0.0196 s -1,k2=0.0158 s -1,k3=1.98×10-3 s -1,苯与顺酐的k G a m 均为 1.0×10-4m 3/skg.催化剂的颗粒密度为1500kg/m 3,试计算反应的瞬间选择性并与外扩散无影响时的瞬时选择性相比较.解:()()---==⨯=⨯=⨯⋅====-=+ 55512332312/ 1.30710, 1.05310,0.13210/./0.1307,0.1053,0.0132),w p w w w w G m a a m BG BS w w BS k k k k k m kg s Da k k a D D A a C C k k C ρa12G 由可算出单位均为由可算得D 为简化起见以表示顺酐,C 表示(C O +C O 由教材(6.18)式可写出:k ()()(A)-= - (B)-= - (1223)m AS AG w BS w AS m CS CG w AS w BS a C C k C k C a C C k C k C C G G k k=++=+++++1221121(1)/(1)(2)/(1)/[(1)(1)]BS BG a a As AG a a BG a a a C C D D C C D D C D D D 由得由得 有外扩散影响时的瞬时选择性: ()()()()()=-+⎡⎤⎡⎤++=-+⎢⎥⎢⎥++++++⎣⎦⎣⎦⎡⎤++=-+⎢⎥++++⎣⎦=1213121131313213212131131322/1111(1)110.4742w BS w AS w w BSw w AG a BG a a w w w w a a a a BG w w a a AG a w w w w a BG a S k C k C k k C k k C D C D D k k k k D D D D C k k D D C D k k k k D C D 无外扩散影响时的瞬时选择性:'=-=++1213130.5726w w CG w w w w BG k k C S k k k k C6.20 原题见教材,今补充如下:实验测得A 的气相浓度为1.68×10-5mol/cm 3时的反应速率为1.04×10-5(mol/cm 3床层﹒s).解:已知 ()---=⨯-=⨯ ⋅*5531.0410/(10.4) 1.73310/A R mol cm s颗粒若不计外扩散阻力,则C AS =C AG =1.68×10-5mol/cm 3 由教材312页: ()=-*2/s A AGR L DeC φL=dp/6=0.04cm,可算得s φ=0.1375,由(6.82)式=2s φφη,将此式与(6.60)式用试差法联立求解可得:φ=0.387 η=0.92。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性; (2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol 时,则反应器的进料组成为A P )式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 moln O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+242CO 3H CH H O +⇔+ 24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图100kmol放空气体原料气和冷凝分离后的气体组成如下:(mol)组分原料气冷凝分离后的气体CO 26.82 15.49H268.25 69.78CO2 1.46 0.82CH40.55 3.62N2 2.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg粗甲醇而言,其溶解量为CO2 9.82g,CO 9.38g,H2 1.76g,CH4 2.14g,N25.38g。
若循环气与原料气之比为7.2(摩尔比),试计算:(1)(1)一氧化碳的单程转换率和全程转化率;(2)(2)甲醇的单程收率和全程收率。
解:(1)设新鲜原料气进料流量为100kmol/h,则根据已知条件,计其中i i i i i m i i。
经冷凝分离后的气体组成(亦即放空气体的组成)如下:M ’m =∑y i M i =9.554又设放空气体流量为Akmol/h ,粗甲醇的流量为Bkg/h 。
对整个系统的N 2作衡算得:5.38B/28×1000+0.1029A=2.92 (A) 对整个系统就所有物料作衡算得:100×10.42=B+9.554A (B) 联立(A )、(B )两个方程,解之得A=26.91kmol/h B=785.2kg/h 反应后产物中CO 摩尔流量为F CO =0.1549A+9.38B/(28×1000) 将求得的A 、B 值代入得F CO =4.431 kmol/h 故CO 的全程转化率为CO,0CO CO CO,0F F 26.82 4.435X 83.48%F 26.82--===由已知循环气与新鲜气之摩尔比,可得反应器出口处的CO 摩尔流量为F ’CO,0=100×0.2682+7.2×100×0.1549=138.4 kmol/h 所以CO 的单程转化率为CO,0CO 'CO CO,0F F 26.82 4.435X 16.18%F 138.4--===产物粗甲醇所溶解的CO 2、CO 、H 2、CH 4和N 2总量D 为(9.829.38 1.76 2.14 5.38)B D 0.02848Bkmol /h1000++++==粗甲醇中甲醇的量为(B-D)X 甲/M m =(785.2-0.02848B) ×0.8915/32=21.25 kmol/h 所以,甲醇的全程收率为Y 总=21.25/26.82=79.24% 甲醇的单程收率为Y 单=21.25/138.4=15.36%2 反应动力学基础2.1在一体积为4L 的恒容反应器中进行A 的水解反应,反应前 A 的含量为12.23%(重量),混合物的密度为1g/mL ,反应物A 的分子量为88。
在等温常压下不断取样分析,测的组分A 的浓度随时间变解:利用反应时间与组分A 的浓度变化数据,作出C A ~t 的关系曲线,用镜面法求得t=3.5h 时该点的切线,即为水解速率。
切线的斜率为0.760.125/.6.1α-==-mol l h由(2.6)式可知反应物的水解速率为0.125/.-==dCA r mol l h A dt2.2在一管式反应器中常压300℃等温下进行甲烷化反应:2423+→+CO H CH H O催化剂体积为10ml ,原料气中CO 的含量为3%,其余为N 2,H 2气体,解:是一个流动反应器,其反应速率式可用(2.7)式来表示00000(1)(1)-==-=-=-A A RA A A A A A A AdF r dV F F X Q C X dF Q C dX故反应速率可表示为:0000(/)==A AA A A R R dX dX r Q C C dV d V Q用X A ~V R /Q 0作图,过V R /Q 0=0.20min 的点作切线,即得该条件下的dX A /d(V R0.650.04 1.790.34α-==故CO 的转化速率为40030.10130.03 6.3810/8.31410573--⨯===⨯⨯⨯A A P C mol l RT4300 6.3810 1.79 1.1410/.min(/)--==⨯⨯=⨯AA A R dX r C mol l d V Q2.3已知在Fe-Mg 催化剂上水煤气变换反应的正反应动力学方程为:20.850.4/-=⋅w CO CO r k y y kmol kg h式中y CO 和y CO2为一氧化碳及二氧化碳的瞬间摩尔分率,0.1MPa 压力及700K 时反应速率常数k W 等于0.0535kmol/kg.h 。
如催化剂的比表面积为30m 2/g ,堆密度为1.13g/cm 3,试计算: (1) (1) 以反应体积为基准的速率常数k V 。
(2) (2) 以反应相界面积为基准的速率常数k g 。
(3) (3) 以分压表示反应物系组成时的速率常数k g 。
(4) (4) 以摩尔浓度表示反应物系组成时的速率常数k C 。
解:利用(2.10)式及(2.28)式可求得问题的解。
注意题中所给比表面的单位换算成m 2/m 3。
33230.450.45330.45(1) 1.13100.053560.46/.6(2) 1.7810/.301011(3)()()0.05350.15080.1013..()8.3110700(4)()(0.05350.333(0.1)ρρρρ-==⨯⨯=-===⨯⨯⨯==⨯=⨯⨯==⨯=v b w bbg w wvb n p w nc w k k kmol m h k k k kmol m h a kmol k k P kg h MPa m RT k k P km 0.45)().kmol ol kg h2.4在等温下进行液相反应A+B →C+D ,在该条件下的反应速率方程为:1.50.50.8/min =⋅A A B r C C mol l若将A 和B 的初始浓度均为3mol/l 的原料混合进行反应,求反应4min 时A 的转化率。
解:由题中条件知是个等容反应过程,且A 和B 的初始浓度均相等,即为1.5mol/l ,故可把反应速率式简化,得1.50.522200.80.80.8(1)===-A A B A A A r C C C C X 由(2.6)式可知00(1)⎡⎤⎢⎥⎣⎦--==-=A A A A A A d C X dC dX r C dt dt dt代入速率方程式22000.8(1)=-A A A AdX C C X dt化简整理得00.8(1)=-AA A dX C dtX 积分得00.81=-AA A X C t X解得X A =82.76%。
2.5氨合成塔入口的气体组成为3.5%NH 3,20.8%N 2,62.6%H 2,7.08%Ar 及5.89CH 4。
该塔是在30MPa 压力下操作。
已知催化剂床层中某处的温度为490℃,反应气体中氨含量为10%(mol ),试计算该处的反应速率。
在Fe 催化剂上氨合成反应速率式为:322321.531.512/=-⋅NH H N NH H p p r k p k kmol m hp p逆反应的活化能417.5810/=⨯E J mol 。
450℃时30.5322277()/=⋅k m MPa m h ,且212/=Pk k K ,490℃时,Kp 可按下式计算:472log 2047.8/ 2.4943log 1.25610 1.856410 3.206--=--⨯+⨯+p K T T T T 注:m 3为标准立方米。
解:题中给出450℃时的k 2值,而反应是在490℃下,故首先要求出490℃时的k 2值。
利用(2.27)试,求出频率因子A:44217.5810/8.314723162'1617.5810/8.314723430.532exp()exp()2277/ 1.14510exp() 1.14510 1.05510()/.-⨯⨯-⨯⨯-=-===⨯-==⨯=⨯E k A RTE A k e RTE k A e m MPa m hRT490℃的Kp 值由题给公式计算出4722log 2047.8/763 2.4943log763 1.25610763 1.8564107633.206 1.25245.59210 ---=--⨯⨯+⨯⨯+=-=⨯p p K K 求k 1值:22'112'22243 1.531(5.59210) 1.0551033()/.--===⨯⨯⨯=p p k K k K k k k m MPa m h求各组分的分压值:2233122+↔N H NH5716.0.14160*(-2)*2087.01.14160*2087.0*3-626.0 1y 13y y 1904.0 .14160*(-2)*2087.01)1416.0-(12087.0 1y y y 1416.05.6914.45*(-2)*2087.01*2087.0*211035.010.01y y y 22123211 %87.20Py , 1y y y 1000H H 000A A 00R 0R R 0000000==-)+-(=,+=δ+-==+=δ+-===+--=δ+νν-=δ==δ+νν-=δ+νν-=A A A AA AA A AA A A AA AA A AA AA A i i AA A A A Aii i AA A A A Aii i X y X X y X X X X X X y X y p X y X X y X p p p P y i i p =反应速率为:322321.5 1.541.5121.5333317.15333.0 5.718 1.05510317.154.02310/.(179.6/.)=-=⨯⨯-⨯⨯=⨯NH H N NH H p p r k p k p p m m cat h kmol m cat h2.6下面是两个反应的T-X 图,图中AB 是平衡曲线,NP 是最佳温度曲线,AM 是等温线,HB 是等转化率线。
