哪些设备仪器需要“审计追踪”
审计追踪液相色谱仪安全操作及保养规程

审计追踪液相色谱仪安全操作及保养规程1. 引言审计追踪液相色谱仪是一种常用的实验室仪器,用于分析和检测样品中的化合物。
在日常实验室工作中,安全操作和仪器的定期维护保养是确保实验结果准确可靠的重要环节。
本文将介绍审计追踪液相色谱仪的安全操作方法以及保养规程,以帮助用户正确并有效地使用这一仪器。
2. 安全操作2.1 实验室环境确保实验室环境整洁、通风良好,并保持适宜的温度和湿度。
为了防止仪器受到外界因素的干扰,实验室中应该尽量避免直接阳光照射和电磁干扰。
此外,实验室的工作区域应该保持整洁,杂物要尽量远离仪器。
2.2 电源连接审计追踪液相色谱仪的电源连接需要专业人员进行,确保仪器接线正确并与地线连接良好。
在连接电源之前,用户应仔细检查电源线和插座是否完好,避免出现短路或电流过载的情况。
2.3 液相色谱柱的安装在安装液相色谱柱之前,先确保柱子是否干净并符合使用要求。
然后,按照仪器操作手册的指导,正确安装柱子并调整相关参数。
在调整柱子时,应注意保持稳定的操作力,避免对柱子施加过大的压力,以免损坏柱子。
2.4 溶液准备在进行色谱分析之前,需要准备好合适的溶液。
用户应严格按照操作手册的要求,正确配置溶液的浓度、pH值等参数。
在配置溶液时,需要注意使用干净的容器和工具,并进行必要的标记,以避免混淆和误用。
2.5 样品处理在将样品注入液相色谱仪之前,需要先进行适当的预处理。
预处理方式根据具体样品的性质和测试要求而定,可能包括稀释、过滤和固相萃取等步骤。
在进行样品处理时,用户应遵循标准操作流程,并注意保持实验场地的整洁和安全。
2.6 仪器启动和关闭在启动和关闭液相色谱仪时,用户应按照操作手册的要求进行操作。
启动仪器时,应检查各个部件的连接是否正常,并确保检测器和泵浦等组件正常工作。
关闭仪器时,应先按照操作手册中的步骤逐一关闭各个部件,然后拔掉电源插头。
3. 保养规程3.1 日常清洁为保持仪器的正常运行和延长使用寿命,需定期对审计追踪液相色谱仪进行日常清洁。
医疗设备的查对和审计制度

医疗设备的查对和审计制度1. 引言为了确保医疗设备的安全性、有效性和合规性,本文档规定了医疗设备的查对和审计制度。
本制度适用于医院内所有医疗设备的采购、验收、使用、维护和报废环节。
2. 医疗设备查对制度2.1 采购环节在医疗设备采购前,需进行详细的市场调研和供应商评估。
采购部门应与医学工程部门密切合作,确保所采购设备符合医院需求、国家法规和行业标准。
2.2 验收环节医疗设备到达医院后,医学工程部门应立即进行验收。
验收内容包括设备外观、随机文件、配件和功能性能等方面。
验收合格的设备方可投入使用。
2.3 使用环节医疗设备使用过程中,操作人员应严格按照操作规程进行操作,并定期进行设备维护。
医学工程部门应对设备使用情况进行定期查对,确保设备安全、有效使用。
2.4 维护环节医学工程部门应制定医疗设备维护计划,并对设备进行定期维护。
维护记录应详细记录设备运行状况、维修内容和更换配件等信息。
2.5 报废环节当医疗设备达到使用寿命或无法修复时,医学工程部门应进行设备报废处理。
报废处理过程中,应确保患者安全和环境保护。
3. 医疗设备审计制度3.1 定期审计医学工程部门应定期对医疗设备进行审计,确保设备使用合规、安全有效。
审计内容包括设备采购、验收、使用、维护和报废等环节。
3.2 专项审计针对医疗设备重大事故、投诉等情况,医学工程部门应进行专项审计,查明事故原因,并提出改进措施。
3.3 审计报告审计结束后,医学工程部门应撰写审计报告,总结审计发现的问题和改进措施。
审计报告应提交给医院管理层和相关科室,以确保医疗设备安全、有效使用。
4. 制度执行与监督4.1 培训与宣传医院应组织定期培训,提高医务人员对医疗设备查对和审计制度的认识。
同时,通过宣传途径,加强医务人员对制度重要性的理解。
4.2 监督与考核医院管理层应加强对医疗设备查对和审计制度的监督与考核,确保制度得到有效执行。
对违反制度的单位和个人,应按照相关规定进行处理。
仪器设备的期间核查

仪器设备的期间核查环境监测机构一般有较多的仪器设备,并且往往分属于不同的类别。
仪器设备的期间核查(或称“运行检查”、“中间核查”)是国家实验室认可和计量认证要求的质量管理的一种方式,应纳入日常的工作,并应有明确的规定。
1 、需要实施期间核查的仪器设备并非所有的仪器设备均需要进行期间核查,期间核查一般需要考虑以下条件:a)“主要或重要检测设备;不够稳定、易漂移、易老化且使用频繁的检测设备;经常携带到现场检测的仪器设备;其它认为对检测结果有重要影响的测量设备。
”[1] 一般不涉及计量的采样、制样、抽样设备、辅助性的设备、计算机设备无需实行期间核查。
玻璃温度计、玻璃量具等性能稳定的设备一般不需期间核查。
b)监测方法规定的要求或仪器本身的要求。
有些方法规定了一些必须的期间核查要求,有些方法中的规定则是推荐性的。
c)必须具备相应的核查标准和实施条件。
对于一些没有核查标准的并且监测方法没有要求的,可以不实施期间核查。
d)成本和风险的均衡。
期间核查可以提高监测质量的可靠性,降低出错的风险,但并不能完全排除风险。
期间核查的实施以及实施频次应结合监测机构自身的特点寻求成本和风险的平衡点。
一般地,信誉度较高、规模较大监测机构所实施的期间核查的覆盖范围广、频次高。
此外,通常一次期间核查的费用应比一次检定或校准的费用少。
如果一次(必须的)期间核查的费用超过委托外单位检定或校准的费用,则可以采用委托外单位检定或校准。
结合以上几点,笔者认为环境监测机构需要实施期间核查的仪器设备一般应包括:a)各类气体采样器,如大气采样器、烟尘采样器、烟气采样器等等;b)各类气体监测仪,如二氧化硫测定仪、氧气测定仪、一氧化碳测定仪、汽车尾气监测仪;c)环境空气自动监测仪器、烟尘烟气在线自动监测系统;d)水质自动(在线)监测仪;e)电化学仪器,如溶解氧测定仪、pH计、离子计、电导仪等;f)噪声监测仪、声级校准器;g)分析天平;h)空气压力表、风速仪;对于采用相对测量方法的仪器,一般不必进行期间核查。
仪器审计追踪操作规程

仪器审计追踪操作规程仪器审计追踪操作规程一、目的本操作规程的目的是为了规范仪器审计追踪的操作流程,确保仪器的使用和维护符合相关要求,并且能够有效地追踪和管理仪器的状态和变更。
二、适用范围本操作规程适用于所有公司内部的仪器设备,并且适用于所有相关负责人和用户。
三、定义1. 仪器:指公司使用的各种设备和仪器,包括但不限于实验仪器、生产设备等。
2. 仪器审计追踪:对仪器进行定期检查和记录,以确保仪器的使用和维护符合相关要求。
3. 仪器状态:指仪器的当前使用状态,包括正常使用、维护中、停用等。
四、操作流程1. 仪器登记1.1 新购入的仪器,在到货后由相关负责人进行登记,包括仪器名称、型号、供应商、购买日期等信息。
1.2 已有的仪器,在使用前应当进行登记,包括仪器名称、型号、使用部门、责任人等信息。
1.3 登记记录应当包括仪器的所有信息和相关文档的副本。
2. 仪器审计计划制定2.1 每年由仪器管理部门(或负责人)制定仪器审计计划,包括对哪些仪器进行审计、审计的时间和频率等。
2.2 审计计划应当与公司的维护计划相结合,以确保维护工作和审计的协同进行。
3. 仪器审计执行3.1 根据审计计划,由仪器管理部门(或负责人)进行仪器审计。
3.2 审计范围包括仪器的使用情况、维护情况、标定情况等。
审计时应当查阅相关的记录和文档,如维护记录、标定证书等。
3.3 审计结果应当详细记录,包括仪器的检查情况、存在的问题、建议的改进等。
4. 仪器状态管理4.1 根据审计结果,对仪器进行状态管理,包括将仪器标记为正常使用、维护中、停用等状态。
4.2 如果发现仪器有问题或需要维修,则应当立即进行维修,并且将仪器标记为维护中状态。
4.3 如果需要停用仪器,则应当按照相关程序进行停用,并且将仪器标记为停用状态。
五、记录和报告1. 仪器审计记录5.1 每次审计都应当有相应的记录,包括审计的日期、审计的仪器、审计的结果等。
5.2 审计记录应当保存在仪器管理部门,并且能够随时查询和查阅。
医疗设备专项审计方案

一、背景为加强医院内部管理,提高医疗设备使用效率,确保医疗设备资产保值增值,根据我国相关法律法规和医院实际情况,特制定本医疗设备专项审计方案。
二、审计目的1. 查找医疗设备采购、使用、维护等环节存在的问题,提出改进建议;2. 评估医疗设备资产配置的合理性,确保医疗资源得到有效利用;3. 提高医疗设备使用效率,降低运营成本;4. 促进医院内部管理水平的提升。
三、审计范围1. 医疗设备采购环节:包括采购计划、审批流程、采购价格、合同签订等;2. 医疗设备使用环节:包括设备运行状况、使用频率、维护保养等;3. 医疗设备维护环节:包括维修记录、备品备件采购、维护费用等;4. 医疗设备报废环节:包括报废申请、审批流程、报废设备处理等。
四、审计内容1. 采购环节审计:(1)采购计划的制定依据及合理性;(2)采购审批流程是否符合规定;(3)采购价格是否公正、合理;(4)合同签订是否符合法律法规要求。
2. 使用环节审计:(1)设备运行状况、使用频率、维护保养情况;(2)设备使用效率与预期目标是否相符;(3)是否存在闲置设备或设备利用率不高等问题。
3. 维护环节审计:(1)维修记录的完整性与准确性;(2)备品备件采购的合理性;(3)维护费用的预算与实际支出。
4. 报废环节审计:(1)报废申请的审批流程;(2)报废设备处理是否符合规定。
五、审计方法1. 审计人员查阅相关资料,包括采购合同、使用记录、维护记录等;2. 审计人员实地考察医疗设备的使用状况、维护保养情况等;3. 审计人员与相关部门负责人、设备操作人员等进行访谈;4. 审计人员对审计发现的问题进行梳理、分析,提出改进建议。
六、审计时间本次医疗设备专项审计时间为XX年XX月至XX年XX月。
七、审计报告审计结束后,审计组将形成审计报告,提交给医院管理层。
审计报告包括以下内容:1. 审计发现的问题及原因分析;2. 改进建议及措施;3. 审计结论。
八、审计成果应用1. 医院管理层根据审计报告,对发现的问题进行整改;2. 审计成果应用于优化医疗设备采购、使用、维护等环节的管理;3. 提高医疗设备使用效率,降低运营成本,确保医疗资源得到有效利用。
这10个审计追踪问题,很多人都遇到

这10个审计追踪问题,很多人都遇到审计追踪一直是业内老生常谈的话题,那到底什么是审计追踪呢?为何要审计追踪呢?审计追踪你了解多少呢?看看这10问,或许你会豁然开朗!1、问:什么是审计追踪?为什么要审计追踪?答:①审计追踪指一种元数据,包含创建、修改和删除等GXP记录相关信息。
在纸质或电子记录中,审计追踪可以安全地记录一些数据的生命周期细节,如在记录中创建、补充、删除或变更信息,却不掩盖或覆盖原始记录。
②审计追踪有助于重现所记录的事件历史,包括某项行动“由谁做、做了什么、何时做和为什么这样做”。
其本身是一种记录,这种记录记录下了GXP记录(创建、修改或删除)的状态变化,让所有人能查询到是谁,什么时候做了什么,对于关键的记录状态的变化还需要知道为什么要这么做。
审计追踪的核心目的是实现变化的可追溯。
狭义来讲,审计追踪是指以电子形式的记录存在的,而广义来讲,手写记录的杠改记录和文件的升版历史及批准都是一种审计追踪。
/forum.php?mod=viewthread&tid=445203&highlight=%C9 %F3%BC%C6%D7%B7%D7%D92、问:非终端灭菌的无菌制剂,洗瓶和隧道烘箱的操作过程是否需要设置审计追踪?答:涉及产品放行用到的主要检验设备应具备审计追踪功能,比如气相、液相、紫/红外光度计等,目前,法规还未没有要求生产系统及公用系统必须有审计追踪功能。
/forum.php?mod=viewthread&tid=516225&highlight=%C9 %F3%BC%C6%D7%B7%D7%D93、问:管理员权限应该是IT人员拥有吗?化验室的负责人是否可以持有管理员权限呢?审计追踪数据审核必须是QA吗?答:第一、别说数据完整性的审查要求QA进行,任何生产和质量活动都会要求QA的参与,包括但不限于EM数据的审核、QC数据的审核、生产批记录的审核。
事实上,在做任何有关GMP的事情时,基本都需要咨询QA,听取QA的建议;第二、我们通常所说的管理员权限,一般是指软件中内置的最高级权限,其通常拥有软件内的所有权限。
药品生产行业的数据完整性

行时超标数据不会纳入考虑范围。
四、常见数据完整性问题举例
3、未能记录实验室活动 -实验室填写记录早于或晚于真实活动日期 -常见于含量、干燥失重、样品称重及稳定性试验中。 -QA未做到审核、放行批次却签名确认
7、微生物数据缺失 - 未能报告微生物计数 ; -未能采集数百个环境监测数据 -培养箱中部分培养皿缺失 -没有进行微生物检测,而COA中却报告微生物检测结果。 -数据太完美(too good to be true),如环境监测都为0 cfu。
四、常见数据完整性问题举例
8、色谱分析 -数据删除(文件夹或单个文件) -数据覆盖 -重复进样、试针,直至获得满意的结果 -对HPLC的积分参数进行修改 -预测试检验样品 -管理员权限 必须被保护(软件:数据删除 ;电脑:修改日期/时间)
✓环境 市场的需求和压力是什么?
四 、常见数据完整性问题举例
动机/压力: 我要达成本月定 额要求。
舞弊三角
机会: 没人会真的发现。
态度/借口: 每个人都这样。
四、常见数据完整性问题举例
1、未能记录生产和工艺控制参数 -员工在原料分发之前记录原料的重量 -员工承认在执行操作时没有记录活动内容 -QA未做到审核、放行批次却签名确认
准确的 完整的 一致的 长久保存的 可获得的
一、什么是数据完整性
A-attributable
可归因/可追溯的
L-legible C-contemportaneous
清晰可辨的 同步记录的
O-original
原始的
A-accurate
C-complete C-consistent E-enduring A-available
仪器审计追踪管理规程
仪器审计追踪管理规程目的:规范检验仪器的使用管理,保证原始数据的完全性、一致性和准确性。
适用范围:适用于仪器检验过程中的数据管理。
责任人:QC、QC主任。
内容:1术语或定义1.1元数据:又称中介数据、中继数据,为描述数据的数据,主要是描述数据属性的信息,用来支持如指示存储位置、历史数据、资源查找文件记载功能,元数据算是一种电子式目录,为了达到编制目录的目的,必须在描述并收藏数据的内容或特色,进而达成协助数据检索的目的。
1.2原始数据:初始的记录和文档,以初始生成的格式(即纸质或电子形式)或以“正确的副本”进行保留。
1.3数据完整性:是指所有数据在整个数据生命周期中的全面性,一致性和准确性的程度。
2 仪器计算机系统的用户访问权限/系统管理员角色2.1应设置访问权限级别来保证员工只能访问与他们的工作角色相适应的功能区,并确保可以获取用户访问权限的历史信息。
2.2不应使用共享登录账号和密码或无权限级別区分的登入方式,当计算机系统的设计支持单个用户访问权限时,该功能必须被使用。
2.3担任系统管理员的人员登入系统时应采用唯一的登录账号,以便审计追踪能追踪到特定个人。
在现有计算机化系统能提供所需数量的唯一登录之前,允许使用具有可追溯性的纸质记录方法,但应通过对系统设计的审核来证明缺乏合适的系统的理由是合理的,并进行相应记录。
2.4不得未经批准擅自分配系统管理员权限(授权的操作,如数据删除、数据库修改或系统配置的修改),当由于组织结构原因不可避免时,可采用不同权限的双用户帐户来实现同等水平的控制。
使用系统管理员权限进行的所有更改必须经质量管理负责人批准并质量保证人员监督下进行。
2.5用户应使用与实施任务相适应的访问权限进行账户登录,例如,当已有一个更合适的访问权限存在时,QC主任在进行数据复核时不应以系统管理员的账户登录。
3 审计追踪3.1 GMP审计追踪主要对象是元数据,元数据记录了可以再现该GMP活动的关键信息(例如对于相关数据的修改和删除)。
实验室设备和分析仪器的确认和验证

确认流程 方案起草
方案批准
人员培训
方案实施
报告起草
报告批准
确认方案 在认实施前,由确认负责人对确认的各个阶段(IQ,OQ,PQ)的要求进行规定。
1.比较复杂的仪器设备,每个阶段可单独的 起草方案。也就是说IQ有IQ的方案和报告, OQ有OQ的方案和报告。
2.对与相对简单的仪器设备,所有阶段可包
9)、确认过程中的培训,包括使用、校准和维护的培训; 10)、相关SOP的制定,包括仪器操作、校准和维护标准操作规程; 11)、确认过程中偏差的处理; 12)、确认报告的编写。
如果确认方案是由仪器的供应商提供,在确认实施前,确认方案应由确认负责人和质量部门审核批 准,以确认符合本公司确认的要求才能使用。如不符合,应和供应商进行沟通,修改或增加确认项 目或要求。
5、网络和数据存储:一些仪器需要连接网络或者数据存储器。三楼灭菌柜验证.doc
C、运行确认
运行确认是在仪器安装确认完成后,测试仪器的功能能否满足设计要求和用户需求的过程。 测试的种类和范围依赖于仪器的复杂性和功能性。如需要,仪器所采用的操作系统的功能也在此阶
段进行测试。 运行确认的草案应包含测试项目,详细的测试过程,使用的标准仪器或标准品等,以及接受标准。
B类:此类仪器具有测量功能,并且仪器控制的物理参数(如温度,压力或流速等)需要校准,用 户需求一般与供应商的功能标准和操作限度相同。例如:熔点仪、分析天平、ph计、干燥箱等。此 类仪器或设备通常需要进行安装确认和运行确认,并制定相关操作、校验及维护的标准规程。
C类:此类仪器通常包括仪器硬件和其控制系统(固件或软件),用户需要对仪器的功能要求、操 作参数要求、系统配置要求等详细描述。例如:熔出仪、紫外分光光度计、高效液相色谱仪、气相 色谱仪、恒温恒湿箱,红外光谱仪等。此类仪器或设备需要安装确认,运行确认和专门的性能确认, 并制定相关操作、校验及维护的标准规程。
仪器审计追踪管理规程

仪器审计追踪管理规程目的:规范检验仪器的使用管理,保证原始数据的完全性、一致性和准确性。
适用范围:适用于仪器检验过程中的数据管理。
责任人:QC、QC主任。
内容:1术语或定义1.1元数据:又称中介数据、中继数据,为描述数据的数据,主要是描述数据属性的信息,用来支持如指示存储位置、历史数据、资源查找文件记载功能,元数据算是一种电子式目录,为了达到编制目录的目的,必须在描述并收藏数据的内容或特色,进而达成协助数据检索的目的。
1.2原始数据:初始的记录和文档,以初始生成的格式(即纸质或电子形式)或以“正确的副本”进行保留。
1.3数据完整性:是指所有数据在整个数据生命周期中的全面性,一致性和准确性的程度。
2 仪器计算机系统的用户访问权限/系统管理员角色2.1应设置访问权限级别来保证员工只能访问与他们的工作角色相适应的功能区,并确保可以获取用户访问权限的历史信息。
2.2不应使用共享登录账号和密码或无权限级別区分的登入方式,当计算机系统的设计支持单个用户访问权限时,该功能必须被使用。
2.3担任系统管理员的人员登入系统时应采用唯一的登录账号,以便审计追踪能追踪到特定个人。
在现有计算机化系统能提供所需数量的唯一登录之前,允许使用具有可追溯性的纸质记录方法,但应通过对系统设计的审核来证明缺乏合适的系统的理由是合理的,并进行相应记录。
2.4不得未经批准擅自分配系统管理员权限(授权的操作,如数据删除、数据库修改或系统配置的修改),当由于组织结构原因不可避免时,可采用不同权限的双用户帐户来实现同等水平的控制。
使用系统管理员权限进行的所有更改必须经质量管理负责人批准并质量保证人员监督下进行。
2.5用户应使用与实施任务相适应的访问权限进行账户登录,例如,当已有一个更合适的访问权限存在时,QC主任在进行数据复核时不应以系统管理员的账户登录。
3 审计追踪3.1 GMP审计追踪主要对象是元数据,元数据记录了可以再现该GMP活动的关键信息(例如对于相关数据的修改和删除)。
审计追踪

19
a
Байду номын сангаас
C类
C类,适用于大部分“可配置系统” 的不含“动态数据或隐含信息”数据 的自动化获取、自动化打印记录。 比如大部分生产过程控制设备、大 部分检验检测设备。
分类说明
A、B类都是直接读取的数据或者直接打印 的数据,“记录”数据和真实的被测对象有一 定的、简单的线性关系,依靠记录的数据 可以直接追溯到原始数据和真实状态。
C类生成的数据不含有“动态数据或隐含信 息”,通过“打印记录数据”和“相关仪器参数、 计算公式”等要素,可以追溯与还原原始数 据和真实状态。
这是我们以前一贯的做法!
5
a
电子记录的审计追踪
电子记录的审计追踪,在系统和记录中均 应允许复原或再现与事件相关的创建、修 改和删除电子数据的过程,应保存原始输 入和文档的用户 ID,行动的时间、日期、 及行动的理由。
计算机系统用于获取、处理、报告、存贮
原始数据时,系统设计应能提供全面审计
追踪的功能,能够显示对数据进行的所有
17
a
A类
A类,适用于“简单的、不可配置系 统”的“非连续数据”的人工读取、人 工记录。一次性读取、一次性记录, 或者定时周期性读取和记录。比如 “天平、台称、温度、湿度、手持 式工具……”等的数据记录。
18
a
B类
B类,适用于“简单的、不可配置系 统”的“连续数据”的自动化记录和打 印,比如“连续的在线监测数据 (洁净室温湿度记录、水系统在线 记录、灭菌温度压力的记录……)。
但是,我们更应该把精力放在如何让企
业“不需要”作假上!而不是一味的利用硬
件措施和技术手段去限制企业“不可能”作
9
a
到底哪些设备仪器需要审计追踪?
实验室审计追踪具体包含哪些项目

实验室审计追踪具体包含哪些项目Audit Trails审计追踪An audit trail is a chronology of the “who, what, when, and why” of a record. It ensures a secure, computer-generated, time-stamped electronic record is available that allows for reconstruction of the course of events relating to the creation, modification, or deletion of an electronic record. For example, the audit trail for an HPLC run could include the user name, date and time of the run, integration parameters used, and details of reprocessing, if any, including the change justification. In addition, as part of reconciliation, the injection log can be included, but this injection log does not include audit trail injection information (blank/system suitability/Lot#) (2).审计追踪是记录“谁、做什么、何时、为什么”的记录,能确保安全受控计算机所生成的,带时间戳的电子记录可以重建与电子记录的创建、修改或删除有关的事件过程。
例如,HPLC运行的审计追踪可以包括,用户名,运行日期以及时间,所使用的完整参数记录,再处理过程细节,或,修改理由。
哪些设备仪器需要审计追踪

哪些设备仪器需要“审计追踪”?“数据完整性缺陷”在制药行业被炒的如火如荼,无论是国内还是国外,无论是欧盟还是FDA,检查官都以发现“数据完整性缺陷”为荣,似乎如果检查中没发现什么“数据完整性”方面的缺陷,检查官就会“很丢面子”一样“无颜见江东父老!”企业呢?战战兢兢、诚惶诚恐,都把“审计追踪”当成了“救命稻草”和“辟邪剑法”,手里举着钱、排长队要求供应商给升级系统和传授武功。
那么你想过没有?什么是“审计追踪”功能,审计追踪功能是用来干什么的?有了审计追踪功能你就“不需要”造假了?有了审计追踪功能你就“不能够”造假了?答案当然是NO。
审计追踪是一系列有关计算机操作系统、应用程序及用户操作等事件的记录,用以帮助我们从原始数据追踪到有关的记录、报告或事件,或从记录、报告、事件追溯到原始数据。
纸质记录中的审计追踪,任何修改、删除都必须使原始数据清晰可读,并记录进行修改的人员、修改日期及修改原因,根据需要证实并说明变化的理由。
这是我们以前一贯的做法!电子记录的审计追踪,在系统和记录中均应允许复原或再现与事件相关的创建、修改和删除电子数据的过程,应保存原始输入和文档的用户 ID,行动的时间、日期、及行动的理由。
计算机系统用于获取、处理、报告、存贮原始数据时,系统设计应能提供全面审计追踪的功能,能够显示对数据进行的所有删、改。
审计追踪功能应显示删改人、删改时间,并记录删改的理由,必要时删、改应经过批准。
说白了,“审计追踪功能”并不是用来“控制”数据的“采集、录入、存储、备份、转移、检索、恢复、计算、处理、输出、引用、失效、修改、删除……”等过程的。
审计追踪功能只是对“数据事件”的一种记录,能够对“违法犯罪行为”进行“追踪”,能够快速锁定“犯罪分子”,能够还原“历史真相”,但是并不能有效“控制”和“降低”有“犯罪动机”的“犯罪行为”的发生,也不能降低“犯罪行为”对“社会”的危害!手工纸质数据和电子数据在数据完整性方面的要求是一致的,诚信的纸质记录在任何时候都是可以接受的,关键是如何保证你是诚信的?如何让别人相信你是诚信的?手工纸质记录并不能减少对数据完整性进行控制的要求,纸质记录更容易作假,难度和成本更低,所以,我们需要适当的电子数据。
常规仪器设备期间审计规程

常规仪器设备期间审计规程1. 背景常规仪器设备是公司运营中重要的工具,对业务活动的顺利进行起着关键作用。
为了确保常规仪器设备的可靠性和合规性,本审计规程旨在规范常规仪器设备的期间审计程序和要求。
2. 审计目的本规程的审计目的是确保常规仪器设备的合理性、完整性和准确性,以及遵守相关法律法规和内部规定。
通过期间审计,能够及时发现常规仪器设备管理中存在的问题和风险,并采取相应的纠正和改进措施。
3. 审计程序3.1 数据收集审计人员应收集与常规仪器设备相关的各项数据和文件,包括但不限于常规仪器设备清单、购买合同、维护记录、检验报告等。
数据收集可以通过查阅文档、沟通询问和现场实地观察等方式进行。
3.2 核实与比对审计人员应核实收集到的数据和文件的真实性和准确性,并与公司内部记录进行比对。
核实的内容包括常规仪器设备的型号、数量、购置日期、维护记录等。
3.3 检查使用情况审计人员应检查常规仪器设备的使用情况和使用记录,确保其符合公司制定的规定和流程。
检查的内容包括常规仪器设备的维护保养情况、计量校准情况等。
3.4 风险评估审计人员应评估常规仪器设备相关的风险,并进行风险分类和优先级评定。
评估的依据包括设备重要性、设备状况、使用频率等因素。
3.5 缺陷和建议审计人员应记录常规仪器设备审计中发现的问题和缺陷,并提出改进建议。
缺陷和建议应详细描述,包括问题的具体情况、影响程度以及改进措施等。
4. 审计要求4.1 审计频率公司应按照一定的频率进行常规仪器设备的期间审计。
审计频率应根据常规仪器设备的重要性和风险程度确定,保证审计覆盖范围的全面性和及时性。
4.2 审计记录审计人员应详细记录常规仪器设备审计过程中的数据、发现和建议等信息,并形成审计报告。
审计报告应包括审计结果、问题和缺陷清单以及改进建议等内容。
4.3 追踪和监督公司应建立常规仪器设备审计的追踪和监督机制,确保审计结果的整改和改进措施的执行。
相关部门应负责跟踪和监督审计发现的问题的整改进度和效果。
哪些设备仪器需要审计追踪

哪些设备仪器需要“审计追踪”?“数据完整性缺陷”在制药行业被炒的如火如荼,无论是国内还是国外,无论是欧盟还是FDA,检查官都以发现“数据完整性缺陷”为荣,似乎如果检查中没发现什么“数据完整性”方面的缺陷,检查官就会“很丢面子”一样“无颜见江东父老!”企业呢?战战兢兢、诚惶诚恐,都把“审计追踪”当成了“救命稻草”和“辟邪剑法”,手里举着钱、排长队要求供应商给升级系统和传授武功。
那么你想过没有?什么是“审计追踪”功能,审计追踪功能是用来干什么的?有了审计追踪功能你就“不需要”造假了?有了审计追踪功能你就“不能够”造假了?答案当然是NO。
审计追踪是一系列有关计算机操作系统、应用程序及用户操作等事件的记录,用以帮助我们从原始数据追踪到有关的记录、报告或事件,或从记录、报告、事件追溯到原始数据。
纸质记录中的审计追踪,任何修改、删除都必须使原始数据清晰可读,并记录进行修改的人员、修改日期及修改原因,根据需要证实并说明变化的理由。
这是我们以前一贯的做法!电子记录的审计追踪,在系统和记录中均应允许复原或再现与事件相关的创建、修改和删除电子数据的过程,应保存原始输入和文档的用户 ID,行动的时间、日期、及行动的理由。
计算机系统用于获取、处理、报告、存贮原始数据时,系统设计应能提供全面审计追踪的功能,能够显示对数据进行的所有删、改。
审计追踪功能应显示删改人、删改时间,并记录删改的理由,必要时删、改应经过批准。
说白了,“审计追踪功能”并不是用来“控制”数据的“采集、录入、存储、备份、转移、检索、恢复、计算、处理、输出、引用、失效、修改、删除……”等过程的。
审计追踪功能只是对“数据事件”的一种记录,能够对“违法犯罪行为”进行“追踪”,能够快速锁定“犯罪分子”,能够还原“历史真相”,但是并不能有效“控制”和“降低”有“犯罪动机”的“犯罪行为”的发生,也不能降低“犯罪行为”对“社会”的危害!手工纸质数据和电子数据在数据完整性方面的要求是一致的,诚信的纸质记录在任何时候都是可以接受的,关键是如何保证你是诚信的?如何让别人相信你是诚信的?手工纸质记录并不能减少对数据完整性进行控制的要求,纸质记录更容易作假,难度和成本更低,所以,我们需要适当的电子数据。
审计追踪

关于“作假”
A类“作假”最简单,故意人工填写错误就行 了。
B类“作假”受到一定的限制,因为是不可配 置系统。
C类、D类可能更容易“作假”。
质量影响性的风险评估
除了以上技术分析归类,下面说一下质量影响 性的风险评估。
其实计算机系统发展了这么多年,技术复杂性 虽然很高,但是技术成熟度也很高,计算机本 身的技术风险很低,那么我们重点关注的应该 是计算机“使用的场合和实现的功能”,离开被 控对象单独对计算机系统进行风险评估,必要 性为0!
到底哪些设备仪器需要审计追踪?
所有的设备、仪器都需要装打印机吗? 所有的设备、仪器都需要电子记录吗? 所有的设备、仪器都需要审计追踪吗?
法规要求
附录《计算机化系统》
第三条:作为质量风险管理的一部分,应 当根据书面的风险评估结果确定验证和数 据完整性控制的程度。
第十六条:应当根据风险评估的结果,考 虑在计算机化系统中建立数据审计跟踪系 统,用于记录数据的输入和修改以及系统 的使用和变更。
法规要求二
MHRA《数据完整性定义与行业指导原则》 投入到数据管理的精力和资源应与其产品
的风险等级相适应。 对数据生命周期中各要素的组织性控制和
技术性控制的程度及投入的资源,要与该 数据对产品属性的影响程度相适应。
基本原则
数据完整性实施程度的基本原则是: 根据对产品质量属性的影响程度、对关键
C类
C类,适用于大部分“可配置系统” 的不含“动态数据或隐含信息”数据 的自动化获取、自动化打印记录。 比如大部分生产过程控制设备、大 部分检验检测设备。
D类
D类,适用于大部分“可配置系统” 的含有“动态数据或隐含信息”数据 的存储管理。
审计需要监测的主要设备
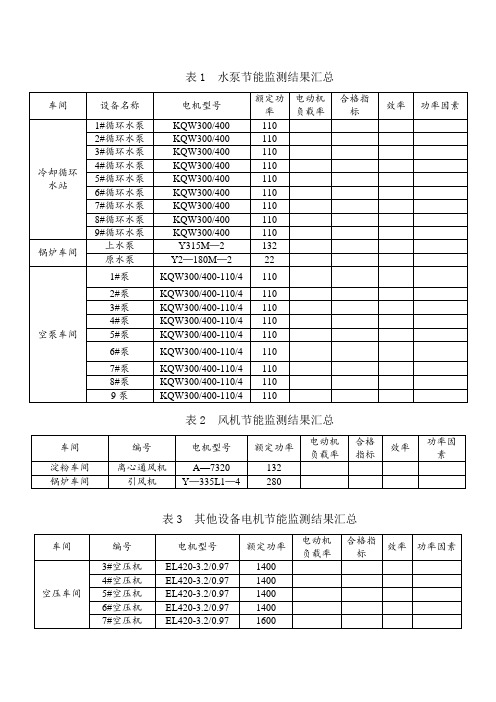
淀粉车间(1台)
S9-1000kVA-10/0.4kV
锅炉车间(1台)
S9-2500kVA-10/0.4kV
102泵房(1台)
S9-2500kVA-10/0.4kV
101车间(1台)
S9-2500kVA-10/0.4kV
环保车间(1台)
S9-1000kVA-10/0.4kV
1400
5#空压机
EL420-3.2/0.97
1400
6#空压机
EL420-3.2/0.97
1400
7#空压机
EL420-3.2/0.97
1600
环保车间
高压清洗机
Y315M2-4
160
102车间
三相异步电动机
YSL500-100
200
淀粉车间
蝶式分离机
DPF—800
132
卧式刮刀卸料离心机
GK1600—NO
110
7#循环水泵
KQW300/400
110
8#循环水泵
KQW300/400
110
9#循环水泵
KQW300/400
110
锅炉车间
上水泵
Y315M—2
132
原水泵
Y2—180M—2
22
空泵车间
1#泵
KQW300/400-110/4
110
2#泵
KQW300/400-110/4
110
3#泵
KQW300/400-110/4
110
4#泵
KQW300/400-110/4
110
5#泵KQW300/400 Nhomakorabea110/4
8仪器设备期间核查规定

仪器设备期间核查规定l.目的通过对使用频繁的检测设备和仪器仪表进行期间核查,确保检测设备和仪器仪表满足检测工作的需要。
2.职责2.1 质管部编制《设备/仪器仪表期间核查计划》,设备工程师审核,技术部批准。
2.2 设备/仪器仪表使用部门或管理部门进行期间核查。
2.3 技术部对核查结果进行判定。
3.程序概况3.1 期间核查的对象3.1.1 仪器设备的性能不够稳定漂移率较大。
3.1.2 使用频繁的仪器设备。
3.1.3 经常携带运输到现场检测以及在恶劣环境下使用的仪器设备。
3.1.4 给出检测数据的仪器设备。
3.1.5 理化室需要做期间核查的仪器设备及核查频率见附件1。
3.2 期间核查的方法3.2.1 等精度核查:仪器间的比对、标准物质验证等。
3.2.2 核查标准:用来代表被测对象的一种相对稳定的仪器或其他物体,它的量限、准确度等级都接近被测对象,而它的稳定性要比实际的被测对象好。
3.2.3 核查标准应依据相关国家或行业标准或可靠的方法。
3.2.4 编制需进行核查仪器设备的期间核查方法。
3.3 期间核查的过程3.3.1质管部每年初编制《设备/仪器仪表期间核查计划》,设备工程师审核,技术部批准后执行。
3.3.2设备/仪器仪表使用部门或管理部门依据相应的期间核查办法进行期间核查,填写相关记录后上报质量管理部。
3.3.3 质管部将期间核查记录报技术部,由技术部对数据进行分析和评价,结果满意时方可投入使用。
3.3.4 对经分析发现仪器设备已经出现较大偏离,可能导致检测结果不可靠时,质管部应对该仪器设备挂“停止使用”标志,以防止误用。
同时尽快组织维修,直到经证实的结果满意时方可投入使用。
3.3.5 期间核查的相关记录保存在设备管理科。
3.4期间核查的频率3.4.1 两次检定或校准期间至少进行一次期间核查。
4.相关文件《理化室仪器设备期间核查方法》5.质量记录《设备/仪器仪表期间核查计划》附件1以上仪器设备的期间核查依据《理化室仪器设备期间核查方法》。
药企实验室电子数据与审计追踪审核管理规程
质量管理规程目的:建立实验室电子数据与系统活动日志的管理规程,确保所产生的电子数据与系统活动日志都得到审核和评估。
范围:适用于检验中心计算机化系统检验仪器产生的电子数据及相应的纸质记录、仪器审计追踪活动日志。
责任人:质量部负责人、质量部(QC)副经理、检验主管、检验员责任人职责:1.质量部负责人:督促检查本规程的执行情况,可有因或临时发起审核指令。
2.质量部副经理:分配检查人执行电子数据和审计追踪的审核;对纠正和预防措施进行批准;批准审核结果在审核表单上签名和标注日期。
3.检验主管:每月执行一次电子数据和审计追踪审核,在审核表上记录所有发现的缺陷;对不合规项提出偏差调意见;对偏差进行纠正和预防;对审核表进行归档;审核完成后在检查表单上签名和注明日期。
4.系统管理员(IT):为审核员分配执行电子记录和审计追踪审查活动所需要的权限。
5.检验员:全面配审核,对检查中发现的偏差进行调查和纠正预防措施。
内容:1.定义1.1电子数据:指文字、图、数据、声音、图标或其他数字形式信息的任何组合,其创建、修订、保存、归档、撷取或分发由计算机系统管制。
1.2审计追踪:安全的、计算机产生的、有时间印记的电子记录,依据该记录,可以重建作业者进行创建、修订或删除电子记录等系统活动的事件过程。
1.3计算机化系统:包含硬件、软件、外围装置、人员及管理规程。
2.审核频次检验主管定期审查每个系统的电子记录和系统活动日志,频次为每月一次。
质量负责人可根据系统复杂性、既定用途或其它需要,可以增加审核频率。
3.审核目标:液相色谱、气相色谱、原子吸收分光光度计、红外光谱、紫外分光光度计所产生的电子数据。
4.审核方式每个自然月对仪器操作使用人员全覆盖,采取随机抽查部分数据的方式,每人每月抽查自上次审查之后生成的2个批次数据,如当月该操作员生成数据少于2个批次的则全部抽查。
含盖设备包括色谱类与光谱类。
必要时也可以按人员、产品、物料或仪器类型等,有针对性的抽查或全面查验审核。
审计追踪审核,是否都是必须?

审计追踪审核,是否都是必须?Audit Trail Review for Devices with 'StandardAudit Trail' Functions具有'标准审计追踪'功能的设备的审计追踪审核Devices andequipment often have standard audit trail functions.There is a huge amount of data being recorded (on/off), and only a fraction ofthis data is critical and relevant for audit trail reviews. What is the best way to proceed witha review?设备通常具有标准审计追踪功能。
大量的数据(开/关)被记录,其中只有一小部分数据是关键,并需要审计追踪审核的。
这种审核的最佳方法是什么?SolutionApproach解决方案Especially withregard to the audit trail, the view has changed. Before the revision of the EUGMP Guideline Annex 11, the general view was that of the conservation ofevidence in order to have further data available in case of a deviation.Statements made by the US American FDA in its dockets also nourished this view:'Audit Trail... we may use it for anuseful purpose e.g prosecution'. Consequently, the emphasis inthe software was not put on later evaluability, but on the recording. For thisreason, the audit trail data was simply stored sequentially in tables.特别是在审计追踪方面,现在观点发生了变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
哪些设备仪器需要“审计追踪”?
2015即将过去,“数据完整性缺陷”在制药行业被炒的如火如荼,无论是国内还是国外,无论是欧盟还是FDA,检查官都以发现“数据完整性缺陷”为荣,似乎如果检查中没发现什么“数据完整性”方面的缺陷,检查官就会“很丢面子”一样“无颜见江东父老!”
企业呢?战战兢兢、诚惶诚恐,都把“审计追踪”当成了“救命稻草”和“辟邪剑法”,手里举着钱、排长队要求供应商给升级系统和传授武功。
那么你想过没有?什么是“审计追踪”功能,审计追踪功能是用来干什么的?
有了审计追踪功能你就“不需要”造假了?
有了审计追踪功能你就“不能够”造假了?
答案当然是NO。
审计追踪是一系列有关计算机操作系统、应用程序及用户操作等事件的记录,用以帮助我们从原始数据追踪到有关的记录、报告或事件,或从记录、报告、事件追溯到原始数据。
纸质记录中的审计追踪,任何修改、删除都必须使原始数据清晰可读,并记录进行修改的人员、修改日期及修改原因,根据需要证实并说明变化的理由。
这是我们以前一贯的做法!
电子记录的审计追踪,在系统和记录中均应允许复原或再现与事件相关的创建、修改和删除电子数据的过程,应保存原始输入和文档的用户 ID,行动的时间、日期、及行动的理由。
计算机系统用于获取、处理、报告、存贮原始数据时,系统设计应能提供全面审计追踪的功能,能够显示对数据进行的所有删、改。
审计追踪功能应显示删改人、删改时间,并记录删改的理由,必要时删、改应经过批准。
说白了,“审计追踪功能”并不是用来“控制”数据的“采集、录入、存储、备份、转移、检索、恢复、计算、处理、输出、引用、失效、修改、删除……”等过程的。
审计追踪功能只是对“数据事件”的一种记录,能够对“违法犯罪行为”进行“追踪”,能够快速锁定“犯罪分子”,能够还原“历史真相”,但是并不能有效“控制”和“降低”有“犯罪动机”的“犯罪行为”的发生,也不能降低“犯罪行为”对“社会”的危害!
手工纸质数据和电子数据在数据完整性方面的要求是一致的,诚信的纸质记录在任何时候都是可以接受的,关键是如何保证你是诚信的?如何让别人相信你是诚信的?
手工纸质记录并不能减少对数据完整性进行控制的要求,纸质记录更容易作假,难度和成本更低,所以,我们需要适当的电子数据。
但电子数据也不是万能的,权限范围内的“作假行为”“易如反掌”,因为,数据完整性方面,“权力”才是最大的“黑客”!
当然,企业应该根据“科学和技术发展的状况”,采用“普遍被接受的科学的方法”进行药品生产和检验,我们需要采用先进的技术手段来尽可能的降低“作假”行为的发生!
但是,我们更应该把精力放在如何让企业“不需要”作假上!而不是一味的利用硬件措施和技术手段去限制企业“不可能”作假,这样做其实是永远“不可能”的事情!
企业什么时候能够真正“不需要”“作假”?我们仍然任重道远,无论是企业自己,还是监管方,都需要百倍的努力!
当然,恶意的作假行为,任何时候都将被严厉查处!
那么
所有的设备、仪器都需要装打印机吗?
所有的设备、仪器都需要电子记录吗?
所有的设备、仪器都需要审计追踪吗?
到底哪些“数据”需要“电子记录”,哪些设备需要“审计追踪功能”?
附录《计算机化系统》
第三条:作为质量风险管理的一部分,应当根据书面的风险评估结果确定验证和数据完整性控制的程度。
第十六条:应当根据风险评估的结果,考虑在计算机化系统中建立数据审计跟踪系统,用于记录数据的输入和修改以及系统的使用和变更。
MHRA《数据完整性定义与行业指导原则》
投入到数据管理的精力和资源应与其产品的风险等级相适应。
对数据生命周期中各要素的组织性控制和技术性控制的程度及投入的资源,要与该数据对产品属性的影响程度相适应。
数据完整性实施程度的基本原则是:
根据对产品质量属性的影响程度、对关键工艺参数的影响程度,进行风险评估确定。
那么如何评估质量风险,我们暂且不说,先从数据的生成、数据的采集原理上进行分类说明:
A类:
简单的、不可配置的“仪器仪表、在线传感器、测试工具”直接测量或显示数据,人工读取记录到纸质介质上,形成纸质的记录,可以直接作为原始记录存档。
B类:
简单的、不可配置的“仪器仪表、在线传感器、测试工具”直接测量或显示数据,连接打印机将数据打印在纸质介质上,形成纸质的记录,可以直接作为原始记录存档。
C类:
一般的、可配置系统的“仪器仪表、测试工具、计算机系统”通过“仪器参数的设置、软件程序的计算”生成可显示的数据,并直接打印在纸质介质上,形成纸质的记录,可以作为原始记录存档。
D类:
复杂的、可配置系统的“仪器仪表、测试工具、计算机系统”通过“复杂的参数设置、程序计算、数据处理”后得到的具有一系列“动态数据或隐含信息”的数据,直接打印出来的图谱或曲线,失去了被再处理的能力,也不能对其动态数据或隐含的信息进行审核或检查。
A、B类都是直接读取的数据或者直接打印的数据,“记录”数据和真实的被测对象有一定的、简单的线性关系,依靠记录的数据可以直接追溯到原始数据和真实状态。
C类生成的数据不含有“动态数据或隐含信息”,通过“打印记录数据”和“相关仪器参数、计算公式”等要素,可以追溯与还原原始数据和真实状态。
D类生成的数据含有“动态数据或隐含信息”,以数据库格式存在的动态电子数据,仅靠纸质打印的记录和图谱曲线、相关仪器的参数,无法追溯和还原原始数据和信息。
根据以上分析,理论上,只有D类才需要“电子数据”保存,有电子数据保存,才会考虑数据完整性要求的“审计追踪功能”。
也就是说,A类人工读取填写纸质记录,B类、C类自动打印纸质记录,D类必须有电子数据保存。
A类,适用于“简单的、不可配置系统”的“非连续数据”的人工读取、人工记录。
一次性读取、一次性记录,或者定时周期性读取和记录。
比如“天平、台称、温度、湿度、手持式工具……”等的数据记录。
B类,适用于“简单的、不可配置系统”的“连续数据”的自动化记录和打印,比如“连续的在线监测数据(洁净室温湿度记录、水系统在线记录、灭菌温度压力的记录……)。
C类,适用于大部分“可配置系统”的不含“动态数据或隐含信息”数据的自动化获取、自动化打印记录。
比如大部分生产过程控制设备、大部分检验检测设备。
D类,适用于大部分“可配置系统”的含有“动态数据或隐含信息”数据的存储管理。
话说,纯粹的GMP管理类计算机、ERP管理类计算机、仓储物料管理类计算机、用于生产质量活动的个人计算机,应该全部是电子数据保存,纸质打印,并具有审计追踪功能,并且所有产生的数据记录,不能直接作为原始记录。
A类“作假”最简单,故意人工填写错误就行了。
B类“作假”受到一定的限制,因为是不可配置系统。
C类、D类可能更容易“作假”。
除了以上技术分析归类,下面说一下质量影响性的风险评估。
其实计算机系统发展了这么多年,技术复杂性虽然很高,但是技术成熟度也很高,计算机本身的技术风险很低,那么我们重点关注的应该是计算机“使用的场合和实现的功能”,离开被控对象单独对计算机系统进行风险评估,必要性为0!
那么计算机系统的风险评估,实际上就是对于被控对象“设备系统、检验仪器”对“药品质量属性、关键工艺参数、产品放行”的风险评估。
为了从技术上防止“作假行为”,ABCD可以进行逐级的“升级管理”,比如AB类都配备打印机,CD类都存储电子数据,D类一定要有“审计追踪功能”或者CD类都具有“审计追踪功能”。
自己可以根据使用场合与风险等级来确定你的管理策略!
没有人强迫你怎么样!
最后总结:
1、应当根据书面的风险评估结果确定验证和数据完整性控制的程度。
2、应当根据“科学和技术发展的状况”。
