根据醇类催化氧化反应的原理,完成下列方程式:共32页
乙醇的催化氧化反应方程式

乙醇的催化氧化反应方程式引言乙醇(C2H5OH)是一种常见的有机化合物,具有广泛的应用,包括作为溶剂、燃料和饮料的成分等。
乙醇的催化氧化反应是一个重要的反应,可以将乙醇转化为醛和酸等有机化合物。
本文将就乙醇的催化氧化反应方程式展开探讨。
乙醇的催化氧化反应乙醇的催化氧化反应主要是指将乙醇氧化为乙醛(CH3CHO)或乙酸(CH3COOH)的反应。
这种反应通常在氧气存在下进行,多采用一种催化剂来加速反应速率。
常用的催化剂包括铜、铬、钒等过渡金属及其氧化物。
催化氧化反应的方程式可以表示为:1.乙醇被氧化为乙醛:C2H5OH + O2 -> CH3CHO + H2O2.乙醇被氧化为乙酸:C2H5OH + O2 -> CH3COOH + H2O催化氧化反应机理乙醇的催化氧化反应机理在不同催化剂的作用下可能略有不同,下面将以铜催化剂为例,介绍一种典型的催化氧化反应机理。
1.吸附:乙醇分子在铜表面吸附,生成吸附态的乙醇。
2.脱氢:吸附态的乙醇失去一个氢原子,生成吸附态的乙醛。
3.氧化:吸附态的乙醛与吸附态的氧分子反应,发生氧化反应,生成水和乙酸。
4.脱附:水和乙酸从催化剂表面脱附,得到最终产物。
影响催化氧化反应的因素乙醇的催化氧化反应受到多种因素的影响,以下列举了其中几个重要的因素。
1.温度:反应温度对反应速率有明显的影响,通常反应速率随着温度的升高而增加。
但过高的温度可能会导致副反应的发生。
2.催化剂:不同的催化剂对反应速率和产物选择性有不同的影响。
铜、铬等过渡金属催化剂常用于乙醇的催化氧化反应。
3.气氛:反应气氛中的气体组成对催化氧化反应也有一定的影响。
氧气是常见的氧化剂,但还有其他气体如氮气、氢气等可能对反应产生干扰。
应用乙醇的催化氧化反应在实际生产中具有广泛的应用。
1.乙醛的生产:乙醇可以通过催化氧化反应转化为乙醛,乙醛是合成醋酸和其他有机化合物的重要原料。
2.乙酸的生产:乙醇的催化氧化反应还可以直接将乙醇氧化为乙酸,乙酸是一种广泛应用的化学品,用于制药、染料和塑料等领域。
醇的催化氧化方程式

醇的催化氧化方程式
乙醇的催化氧化是一类重要的化学反应,在多种化学合成中扮演着重要的角色。
最近,物理催化,尤其是催化金属超微粒,已被用作高效的催化剂来氧化乙醇。
它的催化氧化反应方程式如下:
2CH_3CH_2OH(乙醇)+ 3O_2(氧气)→ 2CO_2(二氧化碳)+ 4H_2O(水)
两个乙醇分子反应完成后,使用3个氧气分子,产生2个CO2分子,并常常
伴随有4个水分子。
催化氧化过程一般发生在较低温度(160~240摄氏度)和较低压力(0.5~5MPa)条件下。
对乙醇氧化反应,引入金属催化剂可以显著提高反应
效率。
金属超微粒可以促进交叉碳-碳键和交叉氧-碳键的氧解和混合的分解等反应,从而使反应更加迅速,提高氧化乙醇的效率。
乙醇氧化反应中使用催化金属超微粒具有许多优势。
首先,催化剂可在相对较低温度和压力条件下完成反应,这大大降低了能耗。
其次,使用催化剂可以有效地利用反应物中的能量,不会产生过量的热量,可实现可控的过程。
最后,催化剂有很强的可重复使用性,反应完成后,可以通过萃取和洗涤等技术,将催化剂从反应剂中回收,再次使用。
乙醇的催化氧化反应对社会的发展具有重要的意义。
此反应既可以把乙醇催化氧化,从而减少不必要的有毒气体排放,又可以产生大量的CO2作为替代能源。
由于催化剂可以反复使用,因此,催化乙醇氧化又可以大幅降低成本和环境污染,使得氧化乙醇技术更加完善和可行,也大大拓展了可再生能源的应用范围。
乙醇的催化氧化化学方程式

乙醇的催化氧化化学方程式乙醇的催化氧化简介乙醇的催化氧化是一种常见的有机化学反应,通过添加催化剂可以加速乙醇与氧气的反应,产生乙醛或乙酸等氧化产物。
这种反应在工业生产乙醛、乙酸等有机化学品中具有重要的应用价值。
催化剂常用的催化剂有铬酸铷 (Rb2Cr2O7)、铜杂多酸、二氧化锆 (ZrO2) 等。
反应方程式乙醇催化氧化的反应方程式如下: 1. 乙醇氧化成乙醛的方程式:2 C2H5OH + 2[O] -> 2 CH3CHO + 2 H2O 2. 乙醇继续氧化成乙酸的方程式:2 CH3CHO + [O] -> 2 CH3COOH解释说明以铬酸铷作为催化剂的乙醇氧化反应为例进行解释。
1.乙醇氧化成乙醛:–反应物:乙醇 (C2H5OH)–催化剂:铬酸铷 (Rb2Cr2O7)–产物:乙醛 (CH3CHO)、水 (H2O)–反应过程:乙醇在铬酸铷的作用下发生氧化反应,其中铬酸铷作为氧化剂提供氧原子。
乙醇分子中的一个羟基 (OH)被氧化成醛基 (CHO),生成乙醛和水。
–反应方程式:2 C2H5OH + 2[O] -> 2 CH3CHO + 2 H2O2.乙醛继续氧化成乙酸:–反应物:乙醛 (CH3CHO)–催化剂:铬酸铷 (Rb2Cr2O7)–产物:乙酸 (CH3COOH)–反应过程:乙醛在铬酸铷的作用下继续氧化,醛基 (CHO) 被氧化成羧基 (COOH),生成乙酸。
–反应方程式:2 CH3CHO + [O] -> 2 CH3COOH乙醇的催化氧化反应可通过添加适量的催化剂来控制反应速率和产物选择性,从而实现高效、可控的有机化学转化。
该反应在工业上用于生产乙醛、乙酸等重要化学品,具有广泛的应用前景。
以上是乙醇的催化氧化的相关方程式及解释说明。
该反应的研究对于推动有机合成化学的发展和工业生产具有重要的意义。
乙醇催化氧化的化学反应方程式

乙醇催化氧化的化学反应方程式
乙醇催化氧化是将乙醇与氧分子在催化剂的作用下反应而生成乙醛、乙酸或二氧化碳和水的化学反应。
该反应常常用于工业上的乙醇生产和用于排放废气的净化处理。
催化剂是该反应中不可或缺的一部分,催化剂可以加速反应速度,提高反应效率。
经常使用的催化剂有铬、铜、铋、钼等过渡金属,以及氧化钛、氧化铝等无机氧化物。
催化剂会使得乙醇分子进入催化剂表面的活性中心,与氧分子形成化合物,使得反应条件下的反应物之间的距离缩短,从而增强反应效果。
化学反应方程式如下:
C2H5OH + O2 -> CH3CHO + H2O (反应条件:Cu、Cr、Mo等催化剂下 200-300℃)
C2H5OH + 2O2 -> CH3COOH + H2O (反应条件:Ag催化剂下 150-200℃)
C2H5OH + 3O2 -> 2CO2 + 3H2O (反应条件:催化剂氧化剂下200℃)
从反应方程式可以看出,催化剂的选择会影响反应结果。
当使用不同的催化剂时,生成的产物会有所不同。
例如,在铬或铜的催化剂下,反应产物是乙醛和水,而在使用银的催化剂下则反应产物是乙酸和水。
乙醇催化氧化反应在工业上有着广泛的应用,因为乙醇是一种常见的有机化合物,可作为生物燃料;并且当乙醇被燃烧时,会产生有毒废气,因此在清洁环保上,催化氧化处理乙醇废气是一种常用的方法。
总之,乙醇催化氧化是一种重要的化学反应,在催化剂的作用下,乙醇可以与氧分子反应而生成不同的产物,因此在工业生产和环境保护上都有着广泛的应用。
醛导学案完整

【温故知新】根据醇类催化氧化反应的原理,完成下列方程式 on I △ CHiCHC CHjCHjOH+O,斥练习:分子式为C5HI2O 的醇中,能被催化氧化为醛的醇有 能被催化氧化为的醇有 不能被催化氧化的醇有_ 【新知识导航】 一、乙醛 1. 组成与结构乙醛的分子式 _________ 2. 物理性质 乙醛是—色、具有_乙醇、氯仿等互溶0 3. 化学性质(1) _______________________ 加成反应(醛基中的 能够发生加成反应)_ 还原反应:在有机化学反应中,常把有机物分子中得 (2) 氧化反应:① 可燃性: ____________________________________________ ② 催化氧化(在醛基中的碳氢之间插入 ______________ ) _ 氧化反应:在有机化学反应中,通常把有机物分子中得—或失 __________________ 的反应。
③ 被弱氧化剂氧化 a 、乙醛银镜反应方程式及现象 结构简式 官能团气味的液体,密度小于水,沸点为20・8匸。
乙醛易挥发,能与水、 或失 的反应称为还原反应。
银氨溶液的配置过程 b 、乙醛与新制Cu (0H )2悬浊液反应方程式及现象 ④被强的氧化剂氧化: 思考!乙醛 _______ 使酸性KMnO •,溶液褪色,乙醛 4乙醛的用途及工业制法 浪水褪色(是否加成反应?)(1) 乙醇氧化法: (2) 乙烯氧化法: -------------------------------- O 4111 ±h 2CIh=Cm + O, —— 2C^^^Z-C-U - - -(niJk. WMU o CIh-C-H (3) 二、醛类 1.概念: 2. 醛类的化学通性: 1) ______________________________饱和一元醛的通式: ___ 或 ,由于醛类物质都含有醛基,它们的 性质很相似。
人教版高中化学选修五课件高二第3章第2节《醛》

OH
-OH
CH2=C-CH3
甲醛乙醛CnH丙2n醛+1CHO或CnH2nO
3、化学性质
R CH HH
(1)和H2加成被还原成醇(2)氧化反应
a.燃烧b.催化氧化成羧 c.被弱氧化剂氧化d.使酸性KMnO4溶液和溴水褪色
Ⅰ银镜反应Ⅱ与新制的氢氧化铜反应
五、甲醛
分子式: 结构简式: 结构式: O
CH2OHCHO
H CH
物理性质:
无色有强烈刺激性气味的气体,易溶于水
应重用要:的有机合成原料;
其水溶液(福尔马林)有杀菌和防腐能力。
写出甲醛发生银镜反应与新制的氢氧化铜反应的方程式
六、醛的同分异构现象
除本身的碳架异构外,醛与酮、烯醇、环醇互 为同分异构体
如:C3H6O O
CH3-CH2-C-H
O CH3-C-CH3
CH2=CH-CH-OH
Na2O2固体的质量增加了bg,并且a<b,则x、y、z的
关系是 A.x>zB.x=y=zC.x=zD.x<z
A
Ⅱ 与新制的氢氧化铜反应
现象:有红棕色(Cu2O)沉淀生成 反应:
注意:氢氧化铜溶液一定要新制,碱一定要过量
硫酸铜只能少量。
应用: 检验Zx.xk 醛基的存在,检验病人是否患糖尿病
乙醛能否使溴水或酸性KMnO4溶液褪色? 能 乙醛能否使溴的CCl4溶液褪色? 不能 小结:醛的化学性质 氧化性 碳氧双键发生加成反应,被H2还原为醇 还原性 醛基中碳氢键较活泼,能被氧化成相应羧酸
能跟水互溶的有:甲醇、乙醇、丙醇、甲醛,乙醛、 丙酮、苯酚(65℃以上)等
三、乙醛的化学性质
思考:分析醛基的结构,推测其在化学反应中 1的、断加裂成方反式应 碳氧双键断开
乙醇的催化氧化化学方程式

乙醇的催化氧化化学方程式乙醇的催化氧化是一种将乙醇转化为乙醛或乙酸的反应。
催化氧化反应可以通过将乙醇与氧气在催化剂的作用下进行反应来实现。
催化剂在反应中起到了促进反应速率、降低反应能量等作用。
乙醇的催化氧化反应在化学工业上有很重要的应用,可以用于制备有机合成中的重要化合物。
乙醇的催化氧化是一个复杂的反应过程,其具体的化学方程式可以表示为:C2H5OH + O2 → CH3CHO + H2OC2H5OH + O2 → CH3COOH + H2O在第一个化学方程式中,乙醇与氧气反应生成乙醛和水。
乙醛是一种无色液体,有着特殊的气味,广泛应用于化学工业中。
乙醛是许多有机合成反应的重要中间体,可以制备醇、酸、酯等化合物。
在第二个化学方程式中,乙醇与氧气反应生成乙酸和水。
乙酸是一种无色液体,有着刺激性的酸味,广泛应用于食品工业、医药工业等领域。
乙酸可以用作食品的酸味调味剂,也可以用于制备酯类化合物。
乙醇的催化氧化反应通常需要在高温下进行,以提高反应速率和产率。
常用的催化剂包括铜、银、金等贵金属,以及钨、钼、铁等过渡金属。
这些催化剂能够提供活化能,促进乙醇与氧气之间的反应。
催化剂的选择和使用条件对于反应的效果有着重要的影响。
乙醇的催化氧化反应是一个重要的有机合成反应,具有广泛的应用前景。
通过该反应,可以将乙醇转化为重要的有机化合物,为化学工业的发展提供了重要的支持。
催化氧化反应的研究和应用也是化学领域的一个重要方向,有助于推动有机合成方法的发展和改进。
总结起来,乙醇的催化氧化是将乙醇转化为乙醛或乙酸的反应。
该反应在化学工业中有着广泛的应用,可以制备许多有机合成中的重要化合物。
催化剂在乙醇的催化氧化反应中起到了重要的作用,可以促进反应速率和产率。
通过研究和应用乙醇的催化氧化反应,可以推动有机合成方法的发展和改进,为化学工业的发展做出贡献。
根据醇类催化氧化反应的原理

返回
2、氧化反应 、
实验3-5 ] 实验 (1)银镜反应 [实验 a、配制银氨溶液 、 Ag++NH3H2O→AgOH +NH4+ AgOH+2 NH3H2O=[Ag(NH3)2]++OH-+2H2O b、水浴加热生成银镜 、
CH3CHO+2Ag(NH3)2OH →CH3COONH4+2Ag↓+3NH3+H2O (
b、乙醛的氧化: 、乙醛的氧化: 2Cu(OH)2+CH3CHO
现象: 现象:有砖红色沉淀生成 △
Cu2O↓+CH3COOH+2H2O
注意: 注意:氢氧化铜溶液一定要新制 碱一定要过量 应用: 应用: 检验醛基的存在 医学上检验病人是否患糖尿病
ቤተ መጻሕፍቲ ባይዱ
学 与 问 1
写出甲醛发生银镜反应, 写出甲醛发生银镜反应,以及与新制的 氢氧化铜反应的化学方程式
肉桂醛
CH2=CH—CHO
苯甲醛
CHO
二、乙醛的分子结构
分子式 结构式 C2H4O H O H C C H H CH3CHO O 官能团 醛基: 醛基 CHO 或 C H
结构简式
学 与 问
乙醛分子结构中含有两类不同位置的氢原子, 乙醛分子结构中含有两类不同位置的氢原子, 因此在核磁共振氢谱中有两组峰, 因此在核磁共振氢谱中有两组峰,峰的面积与氢 原子数成正比。 原子数成正比。因此峰面积较大或峰高较高的是 甲基氢原子,反之,是醛基上的氢原子。 甲基氢原子,反之,是醛基上的氢原子。
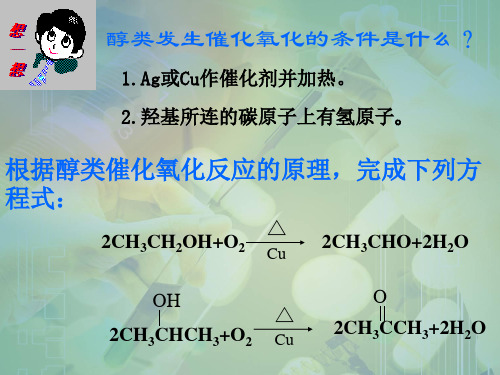
醇类发生催化氧化的条件是什么?
1.Ag或Cu作催化剂并加热。 1.Ag或Cu作催化剂并加热。 作催化剂并加热 2.羟基所连的碳原子上有氢原子。 2.羟基所连的碳原子上有氢原子。 羟基所连的碳原子上有氢原子
醇的氧化反应方程式总结

醇的氧化反应方程式总结醇是有机化合物中含有羟基(OH基团)的一类物质,它们在化学反应中常常发生氧化反应。
醇的氧化反应是一种重要的有机化学反应,不仅具有理论意义,还具有广泛的应用价值。
本文将对醇的氧化反应进行总结,并列举一些常见的氧化反应方程式。
一、醇的氧化反应类型醇的氧化反应可以分为两类:部分氧化和完全氧化。
部分氧化是指醇中的羟基(OH基团)被氧化成为醛或酮,而完全氧化则是指醇被氧化为羧酸。
二、常见的醇的氧化反应方程式1. 一级醇的氧化反应:一级醇经过氧化反应可以生成醛或羧酸。
常见的一级醇氧化反应包括以下方程式:(1)一级醇氧化生成醛的反应方程式:RCH2OH + [O] → RCHO + H2O例如:CH3CH2OH + [O] → CH3CHO + H2O(2)一级醇氧化生成羧酸的反应方程式:RCH2OH + 2[O] → RCOOH + H2O例如:CH3CH2OH + 2[O] → CH3COOH + H2O2. 二级醇的氧化反应:二级醇经过氧化反应可以生成酮或羧酸。
常见的二级醇氧化反应包括以下方程式:(1)二级醇氧化生成酮的反应方程式:R1R2CHOH + [O] → R1R2CO + H2O例如:(CH3)2CHOH + [O] → (CH3)2CO + H2O(2)二级醇氧化生成羧酸的反应方程式:R1R2CHOH + 2[O] → R1R2COOH + H2O例如:(CH3)2CHOH + 2[O] → (CH3)2COOH + H2O3. 三级醇的氧化反应:三级醇经过氧化反应可以生成羧酸。
常见的三级醇氧化反应包括以下方程式:R1R2R3COH + 2[O] → R1R2R3COOH + H2O例如:(CH3)3COH + 2[O] → (CH3)3COOH + H2O三、醇的氧化反应的应用醇的氧化反应广泛应用于化学工业、有机合成、生物化学等领域。
以下为醇的氧化反应在一些常见应用中的例子:1. 醇的氧化反应用于醛的合成:一级醇经过氧化反应可以生成醛,醛具有很大的合成和应用价值。
乙醇催化氧化的方程式

乙醇催化氧化的方程式
把铜丝烧成螺旋状,在火焰上加热后,铜丝表面发黑生成黑色的氧化铜,把它迅速插
入酒精中,待黑色退去后,取出铜丝再加热,再插入酒精中,反复数次后嗅闻气味。
2cu+o2→2cuo
cuo+ch3ch2oh→ch3cho+cu+h2o
总方程式为:ch3ch2oh+o2→ch3cho+h2o
常用的'水解反应
(2)醛的氧化:醛生成酸
(3)有机物的冷却水解、与酸性高锰酸钾溶液的强氧化剂水解。
能够被银氨溶液或崭
新制取的cu(oh)2悬浊液水解的:醛类、甲酸及甲酸酯、葡萄糖、麦芽糖。
在催化剂(ni、cu、pt、pd等)存有下,烯烃与氢差率获得烷烃;醛、酮与氢气差率获得醇,产率低。
乙醇的催化氧化反应现象

乙醇的催化氧化反应现象
乙醇的催化氧化反应是指当在催化剂的存在下,乙醇与氧气发生化学反应,生成乙醛或乙酸的现象。
常用的催化剂包括金属铜、铜氧化物、银和银盐、钯、铂等。
这些催化剂可以提供反应表面,促使乙醇与氧气发生反应。
乙醇的催化氧化反应可以用以下方程式表示:
乙醇 + 氧气→ 乙醛 + 水
乙醇 + 1/2 氧气→ 乙酸 + 水
乙醛是乙醇催化氧化反应的主要产物,而乙酸是通过进一步催化氧化乙醛生成的产物。
这种催化氧化反应常见于工业上的乙醇制乙醛或乙酸的生产过程。
同时,乙醇的催化氧化反应也可用于酒精饮料的陈化过程中,以改变酒的风味和品质。
根据醇类催化氧化反应的原理,完成下列方程式:
乙醛:乙醛是一种没有颜色,有刺激性气味的液体,密度比水
小,沸点20.8℃,易挥发易燃烧,易溶于水及乙醇、乙 醚、氯仿等有机溶剂。
肉桂醛
CH2=CH—CHO
苯甲醛
CHO
4. 物理通性 醛一般有特殊的刺激性气味,密度一 般比水小。
含有1-3个碳原子的醛能以任意比例和
把有机物分子中加入氢原子或失去氧 原子的反应叫做还原反应。 把有机物分子中加入氧原子或失去氢 原子的反应叫做氧化反应。
2、乙醛的氧化反应 (1)与氧气的反应
①、燃烧
2CH3CHO + 5O2
点燃
4CO2 + 4H2O
②催化氧化
O 催化剂 2CH3—C—H + O2 △ 2CH3COOH 工业制乙酸 乙醇
【知识拓展】
五、乙醛的制法
催化剂 △
1、乙炔水化法:CH≡CH + H2O 2、乙烯氧化:2CH2=CH2 + O2
CH3CHO
催化剂 △ 催化剂 △
2CH3CHO 2CH3CHO + 2H2O
3、乙醇氧化:2CH3CH2OH + O2
醛类应该具备哪些重要的化学性质? 小结:醛类化学性质 (1) 和H2加成被还原成醇 (2)氧化反应 a.燃烧 b.催化氧化成羧酸 c.被弱氧化剂氧化 Ⅰ 银镜反应
酒精c巩固练习1用化学方法鉴别下列各组物质1溴乙烷乙醇乙醛2苯甲苯乙醇1己烯甲醛苯酚1用新制氢氧化铜溶液重铬酸甲酸性溶液2用溴水用新制氢氧化铜溶液酸性高锰酸钾溶液2一定量的某饱和一元醛发生银镜反应析出银216g等量的此醛完全燃烧时生成co2一定量的某饱和一元醛发生银镜反应析出银216g等量的此醛完全燃烧时生成co2089l则此醛是a乙醛b丙醛c丁醛d2甲基丙醛089l则此醛是a乙醛b丙醛c丁醛d2甲基丙醛cd返回co称羰基是酮的官能团丙酮是最简单的酮
