多聚二磷酸腺苷(ADP)核糖聚合酶-1(PARP-1)在高糖致大鼠肾脏系膜细胞细胞外基质沉积中的作用
前列腺素E1对大鼠脊髓损伤后PARP-1表达

前列腺素E1对大鼠脊髓损伤后PARP-1表达摘要】目的:观察前列腺素E1对大鼠脊髓损伤后多聚ADP核糖聚合酶(PPRP-1) 表达的影响。
方法成年SD大鼠30只,采用Allen重物打击法制作大鼠脊髓损伤模型,随机分为前列腺素E1治疗组及对照组各15只。
治疗组每日尾静脉注射前列腺素E15ug/d,对照组尾静脉注射等量生理盐水。
取损伤段脊髓组织,免疫组化检测6小时及12小时后PPRP-1的表达变化。
结果 6小时及12小时后,前列腺素E1治疗组PARP-1表达均低于对照组(P<0.05)。
结论前列腺素E1可减少大鼠继发性脊髓损伤时的氧化应激反应,可能作为脊髓损伤的一种有潜力的新药。
【关键词】前列腺素E1;脊髓损伤;多聚ADP核糖聚合酶【中图分类号】R352【文献标识码】A【文章编号】1005-0515(2011)03-0010-01继发性脊髓损伤与脊髓序列性组织自毁性破坏发生的继发性性损伤相关,其中,氧化应激反应在损伤的继发性病理变化中有着重要作用[1]。
多聚ADP核糖聚合酶(poly(ADP-ribose)polymerase PARP)是一种DNA修复酶,DNA受到氧化损伤时被活化,参与脊髓继发性损伤[2]。
手术、药物及基因治疗的运用对脊髓损伤带来一定的效果,但脊髓损伤所致的致残率仍相当高。
前列腺素E1 (prostaglandin E1, PGE1) 是一种具有高度生物活性物质,它可舒张血管平滑肌,降低外周阻力,扩张微血管,改善全身血流动力学,并可抑制血小板聚集。
本实验通过观察PARP-1的表达,探讨PGE1对脊髓继发性损害的保护作用。
1材料与方法1.1材料:成年健康雄性SD大鼠30只,3~4月龄,体重(250±30) g,由湖北省实验动物中心提供。
实验器材为Allen打击器,FA2004A电子天平,OLYMPUS显微镜,荧光显微镜。
具体试剂及来源如下:PGE1注射液(北京泰德公司),多聚ADP核糖聚合酶(PARP-1)兔抗大鼠多克隆抗体(eBioscience公司),FITC标记的山羊抗兔抗体IgG(北京中杉金桥生物技术公司)。
【国家自然科学基金】_parp-1_基金支持热词逐年推荐_【万方软件创新助手】_20140803

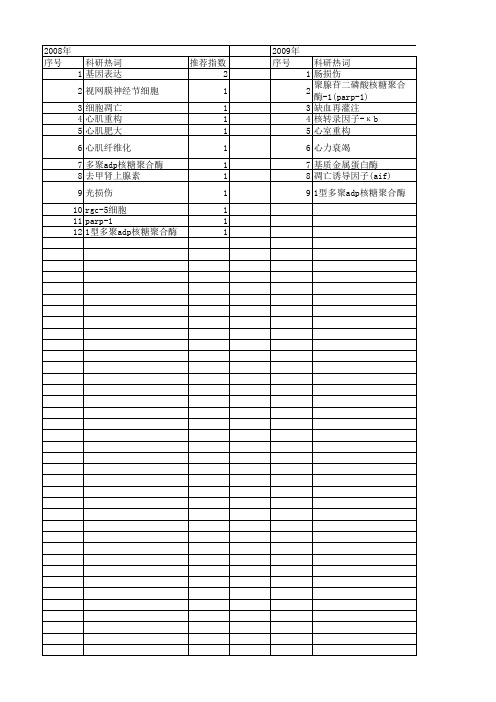
2009年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
科研热词 脑损害 脑损伤 肠损伤 聚腺苷二磷酸核糖聚合酶-1(parp-1) 缺血再灌注 深低温停循环 核转录因子-κ b 心室重构 心力衰竭 基质金属蛋白酶 分子机制 凋亡诱导因子(aif) 体外循环 低血糖 1型多聚adp核糖聚合酶
科研热词 推荐指数 脑卒中 2 神经退行性疾病 2 多聚adp核糖聚合酶 2 靶向治疗 1 重症急性胰腺炎 1 肾上腺皮质细胞 1 聚adp核糖聚合酶类 1 氧化应激 1 抑制剂 1 多聚腺苷二磷酸核糖聚合酶-1 1 多柔比星 1 增殖 1 基因表达 1 合成致死策略 1 前庭毛细胞 1 前列腺癌 1 凋亡诱导因子 1 凋亡 1 依托泊苷 1 乳腺肿瘤 1 三阴性乳腺癌 1 retina pigment epithelial cells 1 parthanatos 1 parp-1抑制剂 1 parp-1依赖性细胞死亡 1 parp 1 oxidative stress 1 nf-κ b 1 brca1蛋白 1 age-related macular degeneration 1 acetylcholinesterase 1 5-氨基异喹啉酮 1
2012年 科研热词 推荐指数 序号 科研热词 推荐指数 凋亡 3 1 细胞增殖 3 血管内皮生长因子c 2 2 细胞凋亡 3 肿瘤淋巴管形成 2 3 凋亡 3 细胞凋亡 2 4 骨髓间充质干细胞 2 慢性粒细胞性白血病 2 5 聚腺苷二磷酸核糖聚合酶-1 2 nf-κ b 2 6 大鼠 2 bcr/abl 2 7 食管癌 1 黄酮 1 8 遗传性乳腺癌 1 阿尔茨海默病 1 9 转染 1 转录因子-kappab 1 10 表皮生长因子 1 英文摘要 1 11 血管瘤内皮细胞 1 自噬 1 12 蛋白激酶b(akt)磷酸化 1 肝癌细胞 1 13 蛇毒 1 聚腺苷二磷酸核糖聚合酶-1 1 14 脑卒中 1 聚adp-核糖聚合酶-1 1 15 肝转移 1 聚(腺苷酸二磷酸核糖)聚合酶-1 1 16 聚腺苷二磷酸核糖水解酶(parg) 1 聚(腺苷二磷酸核糖)水解酶 1 17 聚腺苷二磷酸核糖 1 编辑工作 1 18 聚adp核糖聚合酶类 1 细胞周期 1 19 聚adp核糖聚合酶1(parp-1) 1 糖原合酶激酶-3 1 20 聚adp-核糖聚合酶-1(parp-1) 1 磷酸化 1 21 羟基喜树碱 1 磷酰化 1 22 结肠癌 1 白杨素 1 23 细胞死亡 1 氢醌 1 24 细胞周期 1 标记 1 25 短发夹rna 1 期刊 1 26 相互作用 1 放射性核素 1 27 番荔枝内酯类聚醚类似物aa005 1 抗肿瘤药物 1 28 生物学性状 1 扫描电镜 1 29 烟酰胺腺嘌呤二核苷酸磷酸氧化酶1 微绒毛 1 30 烟酰胺腺嘌呤二核苷酸 1 多聚腺苷酸二磷酸核糖聚合酶-1基因 1 31 活性氧 1 多聚(腺苷二磷酸核糖)聚合酶 1 32 氯通道 1 多聚(腺苷二磷酸核糖)水解酶 1 33 氧化应激 1 基因,肿瘤抑制 1 34 氢醌 1 单核苷酸多态性 1 35 急性早幼粒细胞白血病 1 半胱氨酸天冬氨酸蛋白酶3 1 36 平阳霉素 1 内容介绍 1 37 多聚腺苷二磷酸核糖聚合酶1 1 人肝细胞癌 1 38 多聚(腺苷二磷酸核糖)聚合酶 1 乳腺癌 1 39 受体 1 tk6细胞 1 40 单核苷酸多态性 1 tau蛋白 1 41 前列腺肿瘤 1 rna干扰 1 42 前列腺增生 1 poly (adp-ribose) polymerase-l, 1 poly (adp-ribosyl)ation, 43 凋亡诱导因子(aif) inflammation, lung 1 injury, inhibitor, parp-j基因 1 44 乳腺肿瘤 1 parp-1抑制剂 1 45 中华眼镜蛇 1 nf-kb 1 46 一氧化氮多聚腺苷酸二磷酸核糖聚合酶-1(parp-1) 1 microrna 1 47 sirtuins 1 ku80 1 48 phⅱ-7 1 49 parp-1抑制剂 1 50 parp-1 1 51 p-gp 1 52 nu1025 1
PARP-1、 Caspase-3在子宫内膜癌组织中的表达变化及意义

PARP-1、 Caspase-3在子宫内膜癌组织中的表达变化及意义宫莹莹;何玉;席玉玲【摘要】目的探讨多聚ADP核糖聚合酶1(PARP-1)、半胱氨酸蛋白酶3(Caspase-3)在子宫内膜癌组织中的表达变化及其临床意义.方法收集子宫内膜癌组织60例份、正常子宫内膜组织20例份、子宫内膜增生组织20例份,采用免疫组化法检测各组织PARP-1、Caspase-3蛋白表达,分析子宫内膜癌组织PARP-1、Caspase-3表达与患者临床病理参数的关系及二者的相关性.结果子宫内膜癌组织、正常子宫内膜组织及子宫内膜增生组织PARP-1阳性表达率分别为73.33%、15.00%、45.00%,不同组织间PARP-1阳性表达率比较P<0.05或<0.01.子宫内膜癌组织、正常子宫内膜组织及子宫内膜增生组织Caspase-3阳性表达率分别为41.67%、85.00%、45.00%,正常子宫内膜组织Caspase-3阳性表达率高于子宫内膜癌组织及子宫内膜增生组织(P均<0.01).子宫内膜癌组织PARP-1阳性表达与患者的临床分期、分化程度、浸润深度均有关(P均<0.05),与淋巴结转移无关(P>0.05).子宫内膜癌组织Caspase-3阳性表达与患者的临床分期、分化程度、浸润深度及淋巴结转移均无关(P均>0.05).子宫内膜癌组织PARR-1、Caspase-3阳性表达率呈负相关(r=-0.64,P<0.01).结论子宫内膜癌组织PARP-1表达升高、Caspase-3表达降低;PARP-1表达升高可能参与子宫内膜癌的发生与发展.【期刊名称】《山东医药》【年(卷),期】2017(057)044【总页数】3页(P92-94)【关键词】子宫内膜癌;多聚ADP核糖聚合酶1;半胱氨酸蛋白酶3【作者】宫莹莹;何玉;席玉玲【作者单位】蚌埠医学院第一附属医院,安徽蚌埠233004;蚌埠医学院第一附属医院,安徽蚌埠233004;蚌埠医学院第一附属医院,安徽蚌埠233004【正文语种】中文【中图分类】R737.33子宫内膜癌占女性生殖系统恶性肿瘤的20%~30%,其具体发病机制尚未研究清楚[1]。
二甲双胍通过调控PARP-1活性对Ⅱ型糖尿病肾脏的保护作用

kidney under the high glucose environment caused by diabetes through regulating the expression of PARP-1,downregulating the expression of NF-kB in the DN model, inhibiting NF-kB/iNOS/NO pathway, inhibiting oxidative damage,and reducing inflammation.
[摘要] 目的 研究二甲双胍通过调控多聚(ADP-核糖)聚合酶 1(PARP-1)的活性,对Ⅱ型糖尿病肾脏的保 护作用及其机制。方法 Wistar 大鼠分为正常组(n = 12),DN 组(n = 12),DN+DPQ 组(n = 12),DN+二甲双胍 组(n = 12)以及 DN+二甲双胍+DPQ 组(n = 12)。建模后检测各组大鼠空腹血糖含量,尿素氮含量,肌酐含量以 及尿蛋白浓度等生化指标,HE 染色和 TUNEL 染色观察肾脏病理情况,Western blot 检测 PARP-1,iNOS,NFκB 及 caspase-3 的蛋白表达,ELISA 检测炎性因子 TNF-α 及 IL-1β 的表达,免疫组化测定 3-硝基酪氨酸(3nitrotyrosine,3-NT)的表达。结果 (1)3 组治疗组大鼠的各项生化指标相较于 DN 组均有下降,其中 DN + 二甲 双胍 + DPQ 组大鼠生化指标改变最为明显(P < 0. 01);(2)3 组治疗组大鼠 PARP-1 的表达较于 DN 组下降,其 中 DN + 二甲双胍 + DPQ 组的表达下降最为明显(P < 0.05);(3)3 组治疗组大鼠肾脏组织的病理变化及肾脏细胞 的凋亡较于 DN 组减缓,其中 DN + 二甲双胍 + DPQ 组的改善最为明显;(4)3 组治疗组大鼠炎性因子的表达以 及 NF-kB,iNOS 及 3-NT 的表达较于 DN 组下降,其中 DN + 二甲双胍 + DPQ 组的表达下降最为明显(P < 0.05)。 结论 二甲双胍通过调控 PARP-1 的表达,下调 DN 模型中 NF-kB 的表达,抑制 NF-kB/iNOS/NO 通路,抑制 氧化损伤,减轻炎症反应,从而起到在糖尿病导致的高糖环境下,对肾脏的保护作用。
parp蛋白定位

parp蛋白定位
PARP(聚(腺苷二磷酸-核糖)多聚酶)是一种真核DNA结合蛋白,主要定位在细胞核中。
PARP蛋白具有依赖Zn2+的结构特点,可以特异性地识别DNA断裂末端并结合,是一种重
要的DNA修复酶。
在细胞凋亡发生的早期,PARP是caspase家族(如caspase3和7)的
作用底物,后者可使PARP的DNA修复功能丧失。
PARP蛋白在细胞中的分布与其功能密切相关。
在正常细胞中,PARP蛋白主要分布在细胞
核中,参与DNA损伤修复和细胞凋亡等过程。
在凋亡早期,PARP蛋白被caspase家族酶
切割,使其DNA修复功能丧失,从而促使细胞进入凋亡通道。
在癌症研究中,PARP蛋白的表达和定位也受到关注。
研究发现,PARP7与多种癌症相关,如肺鳞状细胞癌、非小细胞肺癌等。
PARP7表达水平的上升使肿瘤细胞逃避衰老,并且避
免被免疫系统识别和消灭。
因此,针对PARP蛋白的靶向治疗成为近年来癌症研究的热点
之一。
例如,Ribon Therapeutics公司研发的RBN-2397和RBN-3143,分别为PARP7
和PARP14,用于治疗实体瘤和炎症疾病。
多方向聚(ADP-核糖)聚合酶-1在神经系统疾病中的作用

多方向聚(ADP-核糖)聚合酶-1在神经系统疾病中的作用高丰度蛋白核聚(ADP-核糖)聚合酶-1(PARP-1)可被DNA损伤激活,而PARP-1激活与DNA修复,细胞死亡和在炎症相关联。
因为氧化应激会诱导严重的DNA损伤,而炎性反应的广泛传播在各种中枢神经系统疾病中是常见病理特征,因此PARP-1作为治疗靶点的研究方向已经开始引起科学家们的注意。
印度药学教育与研究国立研究所的Chandra Shekhar Sriram教授及其同事在发表于《中国神经再生研究(英文版)》的评论文章(2015年1月1期)中,着重报道了PARP-1在神经系统疾病中的多重作用以及PARP-1抑制剂转化为临床研究的潜在能力。
PARP-1抑制剂已经在多个神经系统疾病的临床前研究治疗中显示出可喜的成果。
现在,PARP-1可能是神经系统疾病领域内开发出的较新可靠药物靶标。
但PARP-1抑制剂疗法同样有其自身的一些限制。
PARP-1的主要功能是DNA损伤修复,PARP-1抑制剂的广泛使用可能留下带有大量DNA异常的细胞,这会增加基因组的不稳定性风险。
DNA损伤的存活神经元可能会因此造成机能失调,随后发生凋亡。
另外,PARP-1的延长性抑制可能具有超出遗传稳定性的负面影响。
为了解决这些问题,仍需要进一步研究证实该种治疗方法的安全性和稳定性。
Article: "Multiple facets of poly(ADP-ribose) polymerase-1 in neurological diseases" by Chandra Shaker Sriram1, Ashok Jangra1, Rajaram Mohanrao Madhana1, Satendra Singh Gurjar2, Pritam Mohan3, Babul Kumar Bezbaruah1,4 (1Department of Pharmacology & Toxicology, National Institute of Pharmaceutical Education & Research (NIPER), Guwahati, Assam-781032, India; 2 Department of Biotechnology, National Institute of Pharmaceutical Education and Research (NIPER), Guwahati, Assam-781032, India; 3Department of Pharmacology, College of Veterinary Sciences, AAU, Khanapra, Guwahati, Assam-781022, India; 4Department of Pharmacology, Gauhati Medical College, Guwahati, Assam-781032, India (Bezbaruah BK))Sriram CS, Jangra A, Madhana RM, Gurjar SS, Mohan P, Bezbaruah BK (2015) Multiple facets of poly(ADP-ribose) polymerase-1 in neurological diseases. Neural Regen Res 10(1):49-51.欲获更多资讯:Neural Regen ResMultiple facets of poly(ADP-Ribose) polymerase-1 in neurological diseasesThe highly conserved abundant nuclear protein poly(ADP-ribose) polymerase-1 (PARP-1) is activated by DNA damage. PARP-1 activation is associated in DNA repair, cell death and inflammation. Since oxidative stress induced robust DNA damage and wide spread inflammatory responses are common pathologies of various CNS diseases, the attention towards PARP-1 as a therapeutic target has been amplifying. Dr. Chandra Shaker Sriram and his coworkers (National Institute of Pharmaceutical Education & Research (NIPER), India) published a commentaries in Neural Regeneration Research (January 2015, Volume 10 Number 1) highlight the multiple roles of PARP-1 in neurological diseases and potential of PARP-1 inhibitors to enter clinical translation.Extreme severity and restricted clinical options are making neurological indications more difficult to handle. However, the treatment with PARP-1 inhibitors showing promising results for neurological indications in multiple preclinical studies. Now PARP-1 could be reliable target for newer drug developments in the field of neurological diseases. In spite of this much propitious situation, PARP-1 inhibition therapy having its own set of limitations also. The primary function of PARP1 is in DNA-damage repair, widespread PARP-1 inhibition may leave cells with larger number of DNA anomalies which may amplify the risk of genomic instability. Surviving neurons with DNA damage might be dysfunctional and thus later on undergo apoptosis. Additionally, the prolonged PARP1 inhibition might have negative effects beyond the genetic stability. To combat these issues some more studies are still required to corroborate the safety of the therapeutic approach.Article: "Multiple facets of poly(ADP-ribose) polymerase-1 in neurological diseases" by Chandra Shaker Sriram1, Ashok Jangra1, Rajaram Mohanrao Madhana1, Satendra Singh Gurjar2, Pritam Mohan3, Babul Kumar Bezbaruah1,4 (1Department of Pharmacology & Toxicology, National Institute of Pharmaceutical Education & Research (NIPER), Guwahati, Assam-781032, India; 2 Department of Biotechnology, National Institute of Pharmaceutical Education and Research (NIPER), Guwahati, Assam-781032, India; 3Department of Pharmacology, College of Veterinary Sciences, AAU, Khanapra, Guwahati, Assam-781022, India; 4Department of Pharmacology, Gauhati Medical College, Guwahati, Assam-781032, India (Bezbaruah BK))Sriram CS, Jangra A, Madhana RM, Gurjar SS, Mohan P, Bezbaruah BK (2015) Multiple facets of poly(ADP-ribose) polymerase-1 in neurological diseases. Neural Regen Res 10(1):49-51.。
parp作用机制

parp作用机制PARP(聚合酶)是一类广泛存在于细胞中的酶,它可以在DNA损伤修复和细胞死亡的过程中发挥重要作用。
本文将从以下几个方面详细介绍PARP的作用机制。
一、PARP基本概念PARP全称聚合酶(Poly(ADP-ribose) polymerase),是一类催化作用于核苷酸的酶。
PARP的主要催化作用是在DNA损伤修复和细胞死亡的过程中将NAD+转化为聚合ADP-核糖(PAR),PAR作为DNA损伤后细胞自愈机制的一个重要组成部分,参与了细胞的DNA修复、基因表达等生命物质代谢过程中的多种生物学效应。
二、PARP作用机制(一)PARP在DNA修复中的作用当DNA受到损伤时,PARP会被激活并进入DNA损伤部位,将NAD+转化为PAR。
PAR能够与DNA结合,从而在伤口周围形成一个称为“PAR云”(Paraspeckle Associated Repository Cloud)的结构,吸附或筛选DNA修复蛋白到受损区域,大大提高了DNA修复的效率。
PAR还会吸附其他细胞信号蛋白,参与调节DNA损伤响应和细胞死亡等生命过程。
(二)PARP在细胞死亡中的作用PARP在细胞凋亡、坏死和激活性氧自由基诱导的细胞毒性中发挥作用。
在上述过程中,细胞发生DNA的单链和双链断裂,PARP会被大量激活并消耗大量的NAD+,致使细胞内NAD+枯竭,能量代谢混乱,进而导致细胞坏死。
此外,当PARP的活性被抑制时,可以减少细胞对DNA断裂的响应,从而抑制细胞死亡。
三、PARP的研究与应用PARP在铂类化疗、放疗、DNA损伤和炎症等生理和病理过程中发挥着重要的作用。
近年来,PARP成为了肿瘤治疗的重要研究领域之一。
PARP抑制剂能够通过阻止PARP催化酶活性,诱导肿瘤细胞凋亡,从而增强化疗药物对肿瘤细胞的杀伤作用。
此外,PARP对衰老、肿瘤、心肌缺血再灌注等多个方面都具有广泛的研究意义。
总之,PARP作为一种催化酶,在DNA损伤修复和细胞死亡的过程中具有重要作用。
PARP-1抑制剂与其他药物联用克服耐药性的研究进展

JournalofChinaPharmaceuticalUniversity 2019,50(5):523-530
523
PARP1抑制剂与其他药物联用克服耐药性的研究进展
施锦渝,柏 英,彭珂文,张文慧,朱启华 ,徐云根
(中国药科大学药物化学系,南京 211198)
摘 要 聚腺苷二磷酸核糖聚合酶1(PARP1)在 DNA修复和细胞凋亡中发挥着至关重要的作用,PARP1抑制剂在肿瘤 治疗领域取得了突破性的进展,但耐药性的出现限制了其在临床上的进一步应用。本文就 PARP1抑制剂与其他药物联用 克服耐药性的研究进展进行了综述,重点介绍了临床上现有的药物组合方法及其疗效,并对药物联用策略进行了评价与展 望,提出双靶点或多靶点药物的开发将成为克服 PARP1抑制剂耐药性、拓宽适应证的新思路。 关键词 聚腺苷二磷酸核糖聚合酶1;聚腺苷二磷酸核糖聚合酶1抑制剂;抗肿瘤;耐药性;药物联用 中图分类号 R9142;R9791 文献标志码 A 文章编号 1000-5048(2019)05-0523-08
收稿日期 20190329 通信作者 Tel:15951930589 Email:zhuqihua@vip126com Tel:025-83271244 Email:xyg64@126com
基金项目 国家自然科学基金资助项目(No81502928);江苏高等学校优秀科技创新团队资助项目(2015)
聚腺苷二磷酸核糖聚合酶(poly(ADPribose) polymerase,PARP)是存在于真核细胞中参与 DNA 损伤修复 的 一 种 多 功 能 蛋 白 质 翻 译 后 修 饰 酶[1]。 PARP通过识别并结合断裂的 DNA链,募集烟酰 胺腺嘌 呤 二 核 苷 (nicotinamideadeninedinucleoti de,NAD)依赖的 ADP核糖单位、组蛋白以及各种
PARP-1抑制剂通过激活SIRT1-PGC-1α轴减轻慢性阻塞性肺疾病大鼠的炎症和氧化应激反应

doi:10.3969/j.issn.1000-484X.2023.12.014PARP-1抑制剂通过激活SIRT1-PGC-1α轴减轻慢性阻塞性肺疾病大鼠的炎症和氧化应激反应侯亚儒舒新乐张霞李森雍文穆①(汉中市中心医院,汉中 723000)中图分类号R563.1 R364.5 文献标志码 A 文章编号1000-484X(2023)12-2540-05[摘要]目的:通过构建慢性阻塞性肺疾病(COPD)大鼠实验模型,探讨聚二磷酸腺苷核糖聚合酶-1(PARP-1)抑制剂是否通过调控沉默信息调节因子相关酶1(SIRT1)、过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)减轻COPD大鼠的炎症和氧化应激反应,探究SIRT1-PGC-1α轴作为PARP-1抑制剂作用新靶点的可能性。
方法:将48只SD大鼠随机选取12只作为健康组,剩余大鼠构建COPD实验模型,将造模成功的大鼠随机分为模型组、PARP-1抑制剂处理组、PARP-1抑制剂+ PGC-1α抑制剂组,HE染色观察肺组织病理形态变化,ELISA检测大鼠肺组织TNF-α、IL-6、IL-1β、丙二醛(MDA)、超氧化物歧化酶(SOD)水平,荧光定量PCR法检测各组大鼠SIRT1、PGC-1α mRNA表达水平,Western blot检测SIRT1、PGC-1α蛋白表达。
结果:健康组大鼠肺组织结构完整,与健康组相比,模型组大鼠肺组织产生结构损伤,有大量炎症细胞浸润,肺泡灌洗液中TNF-α、IL-1β、IL-6含量均显著升高,血清中MDA含量显著升高,SOD含量显著降低,SIRT1、PGC-1α mRNA及蛋白表达量显著降低;与模型组相比,PARP-1抑制剂处理组大鼠肺组织结构恢复,炎症细胞减少,TNF-α、IL-1β、IL-6含量均显著降低,血清中MDA含量显著降低,SOD含量显著升高,SIRT1、PGC-1α mRNA及蛋白表达量显著升高;与PARP-1抑制剂处理组相比,PARP-1抑制剂+PGC-1α抑制剂组炎症细胞数量增加,TNF-α、IL-1β、IL-6含量均显著升高,血清中MDA含量显著升高,SOD含量显著降低,SIRT1、PGC-1α mRNA及蛋白表达显著降低。
【国家自然科学基金】_parp-1抑制剂_基金支持热词逐年推荐_【万方软件创新助手】_20140803
2013年 序号 1 2 3 4 5 7 8 9 10 11 12 13 14 15 16 17 18 19
科研热词 推荐指数 靶向治疗 1 重症急性胰腺炎 1 肾上腺皮质细胞 1 聚adp核糖聚合酶类 1 抑制剂 1 多聚腺苷二磷酸核糖聚合酶-1 1 多柔比星 1 增殖 1 基因表达 1 合成致死策略 1 前列腺癌 1 依托泊苷 1 乳腺肿瘤 1 三阴性乳腺癌 1 parp-1抑制剂 1 parp 1 nf-κ b 1 brca1蛋白 1 5-氨基异喹啉酮 1
2009年 序号 1 2 3 4 5 6 7 8 9
科研热词 肠损伤 聚腺苷二磷酸核糖聚合酶-1(parp-1) 缺血再灌注 核转录因子-κ b 心室重构 心力衰竭 基质金属蛋白酶 凋亡诱导因子(aif) 1型多聚adp核糖聚合酶
推荐指数 1 1 1 1 1 1 1 1 1
2010年 序号 1 2 3 4
科研热词 推荐指数 脑室周围白质软化 1 聚腺苷二磷酸核糖聚合酶 1 热休克蛋白60 1 少突胶质前体细胞 1
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
2011年 科研热词 推荐指数 黄酮 1 阿尔茨海默病 1 自噬 1 肝癌细胞 1 聚adp-核糖聚合酶-1 1 细胞凋亡 1 糖原合酶激酶-3 1 磷酸化 1 磷酰化 1 白杨素 1 标记 1 放射性核素 1 抗肿瘤药物 1 扫描电镜 1 微绒毛 1 基因,肿瘤抑制 1 半胱氨酸天冬氨酸蛋白酶3 1 凋亡 1 tau蛋白 1 parp-1抑制剂 1
2012年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
parp生物学功能和作用机制

parp生物学功能和作用机制
parp生物学功能和作用机制:
PARP(聚合酶-1)是一种广泛存在于细胞核中的酶,其主要作用是参与DNA修复和蛋白质修饰过程。
PARP通过催化NAD+分子上的酰基转移反应来形成PAR(聚(ADP-核糖)聚合物)链,将这些链附着到受损的DNA直到DNA修复完成。
此外,PARP还可以对一些重要的细胞蛋白进行修饰,如调节DNA合成、细胞凋亡和炎症等生命过程。
在DNA双链断裂修复中,PARP被认为是一个重要的因子,当DNA发生断裂时,PARP 会立即被激活并结合到DNA断裂部位,释放ADP-核糖基链并吸引其他DNA修复相关蛋白分子到该区域促进DNA修复。
此外,在某些特定情况下,PARP还可介导非同源末端连接(NHEJ)过程,帮助维持基因组稳定性。
近年来,PARP抑制剂已成为肿瘤治疗中新兴的策略之一。
PARP抑制剂可抑制PARP催化作用,导致DNA修复的失调和细胞凋亡,从而利用PARP在DNA修复中的作用机制杀死癌细胞。
该类药物主要用于治疗携带有BRCA1或BRCA2基因突变的乳腺癌或卵巢癌等,且效果显著。
parp 裂解百分比

parp 裂解百分比
PARP(多腺苷二磷酸核糖聚合酶)裂解百分比是指在细胞凋亡过程中,PARP被裂解的百分比。
PARP是一种蛋白质,在DNA损伤修复和细胞凋亡中起着重要作用。
当细胞受到损伤或凋亡信号时,PARP会被裂解成两个片段,一个较小的N端片段和一个较大的C端片段。
裂解百分比可以通过测定这两个片段的量来计算。
在许多研究中,PARP裂解百分比被用作衡量细胞凋亡程度的指标。
例如,当细胞受到辐射、化疗药物等凋亡刺激时,PARP裂解百分比可能会增加。
因此,通过测定PARP 裂解百分比,可以评估凋亡刺激对细胞凋亡的影响。
除了作为凋亡指标外,PARP裂解百分比还可以用于研究凋亡信号转导通路。
例如,一些研究表明,PARP裂解百分比可能与线粒体膜电位、Caspase活性等因素有关。
因此,通过测定PARP裂解百分比,可以了解凋亡信号转导通路的激活情况。
此外,PARP裂解百分比还可以用于评估某些药物的抗癌效果。
例如,一些PARP抑制剂可以抑制DNA损伤修复,促进细胞凋亡。
通过测定PARP裂解百分比,可以评估这些药物对细胞凋亡的影响,从而为药物研发提供参考。
总之,PARP裂解百分比是一个重要的生物学指标,可以用于研究细胞凋亡、凋亡信号转导通路以及药物抗癌效果等方面。
通过深入了解PARP裂解百分比的作用机制和应用价值,有助于推动相关领域的研究进展。
parylation parpi机制

parylation parpi机制Parylation(可能是一个拼写错误,应该是“Parylation”,但目前在科学文献中并没有广泛认可的这个术语)和PARP(Poly(ADP-ribose) polymerase,聚ADP核糖聚合酶)机制通常与细胞内的DNA损伤修复和细胞死亡等生物学过程紧密相关。
这里,我们主要讨论PARP及其相关的PARylation(聚ADP核糖基化)机制。
PARP是一类在真核生物中广泛存在的酶,它们能够催化ADP-核糖单元从NAD+(烟酰胺腺嘌呤二核苷酸)转移到靶蛋白上,形成聚ADP核糖链(PAR),这个过程被称为PARylation。
这种修饰是一种可逆的、动态的蛋白质翻译后修饰,能够迅速改变蛋白质的功能和定位。
在DNA损伤修复中,PARP通过PARylation修饰自身和其他修复因子,促进它们招募到DNA损伤位点,从而启动和调控DNA修复过程。
此外,PARP还通过PARylation参与染色质重塑、基因表达调控和细胞信号转导等多个生物学过程。
当DNA损伤过于严重无法修复时,PARP会过度激活,导致细胞内NAD+和ATP的耗竭,最终引发细胞死亡,这种死亡方式被称为PARP依赖性细胞死亡(Parthanatos)。
因此,PARP 和PARylation机制在维持基因组稳定性和细胞存活中起着至关重要的作用。
近年来,PARP抑制剂作为一类新型的抗癌药物受到了广泛关注。
它们通过抑制PARP的酶活性,阻断DNA损伤修复过程,从而选择性地杀死癌细胞。
这类药物在治疗某些类型的癌症中展现出了良好的疗效和安全性,为癌症治疗提供了新的策略和方法。
总之,PARP和PARylation机制在细胞生物学和医学领域具有重要的研究价值和应用前景。
未来随着对这一机制的深入研究和理解,我们有望开发出更加高效和安全的癌症治疗药物和方法。
(注:由于“Parylation”这个术语并不常见且可能是拼写错误,我在回答中将其解释为“PARylation”,即聚ADP核糖基化。
聚腺苷二磷酸核糖聚合酶作用

聚腺苷二磷酸核糖聚合酶作用-概述说明以及解释1.引言1.1 概述概述:聚腺苷二磷酸核糖聚合酶,即RNA聚合酶,是一种重要的酶类蛋白质,在细胞内具有多种重要的生物学功能。
它参与了RNA的合成过程,是转录的关键酶。
在细胞内,RNA聚合酶不仅参与了基因的转录和表达调控,还影响了细胞的生长、发育和分化。
因此,深入了解RNA聚合酶的作用机制与作用范围,对于揭示细胞功能的调控机制、疾病的发生发展以及药物的研发具有重要意义。
本文将对聚腺苷二磷酸核糖聚合酶作用进行系统的介绍和分析,以期能够对该领域的研究和应用提供一定的参考和启发。
1.2 文章结构文章的结构主要包括引言、正文和结论三个部分。
在引言部分,我们将简要介绍聚腺苷二磷酸核糖聚合酶的作用,以及本文的目的和文章结构。
正文部分将详细阐述聚腺苷二磷酸核糖聚合酶的作用、作用机制和作用范围。
结论部分将对前文进行总结,探讨聚腺苷二磷酸核糖聚合酶作用的应用前景,并展望其可能的发展方向。
1.3 目的本文旨在深入探讨聚腺苷二磷酸核糖聚合酶的作用机制及其作用范围,以期加深对该酶的理解。
同时,通过对其作用机制的分析,可以为相关领域的科研工作者提供理论依据,为该酶在医学和生物技术领域的应用提供更多可能性。
希望通过本文的研究,能够为聚腺苷二磷酸核糖聚合酶的进一步研究和应用提供有益的参考和启发。
2.正文2.1 聚腺苷二磷酸核糖聚合酶的作用聚腺苷二磷酸核糖聚合酶(polyadenosine diphosphate ribose polymerase, PARP)是一种重要的酶,其主要作用是在DNA修复和基因转录调控过程中起着关键作用。
PARP作用于细胞核和细胞质中,参与了一系列细胞生命活动,包括DNA修复、基因表达、转录调控、凋亡、细胞增殖和细胞分化等过程。
具体来说,PARP在DNA修复中的作用是通过修复DNA单链断裂,防止其演变为双链断裂,并保护DNA免受损伤。
PARP还能调控基因的转录,从而影响细胞的功能和特性。
聚腺苷二磷酸-核糖聚合酶抑制剂研究进展

聚腺苷二磷酸-核糖聚合酶抑制剂研究进展齐静;刘宁波【摘要】肿瘤基因的不稳定性使其更容易产生并积累DNA损伤,但同时也会导致肿瘤DNA损伤修复功能发生部分丢失,使其更依赖于尚存的DNA修复路径,充分修复放化疗所致的DNA损伤,导致放化疗抵抗.聚腺苷二磷酸-核糖聚合酶[poly-(ADP-ribose)polymerase,PARP]抑制剂可以在同源重组修复缺陷(homologous recombination deficiency,HRD)肿瘤细胞中充分修复DNA损伤,产生协同细胞杀伤的作用.目前,多种PARP抑制剂(PARP inhibitor,PARPi)通过美国食品药品监督管理局(FDA)审批用于晚期卵巢癌患者,多项临床试验也正在评估PARPi单药或联合放化疗是否可以使更多患者获益,以及毒性是否可以耐受,研究对象也从卵巢癌扩大到乳腺癌、前列腺癌、直肠癌、肺癌、胰腺癌、腹膜肿瘤、头颈部肿瘤、脑瘤、鳞状细胞癌及肉瘤等.本文对已应用于临床的PARPi研究情况及面临的问题进行综述.%Genomic instability with increased DNA damage accumulations and partial DNA repair defects is more dependent on exist-ing DNA repair pathways, leading to disturbance in restoration of completely chemoradiation-induced DNA damage and finally induc-ing resistance to chemoradiation. The discovery of poly (ADP-ribose) polymerase inhibitors (PARPis) has sparked interest in synergistic reactions to kill tumor cells that are deficient in homologous recombination repair. Currently, under FDA approval of PARPis on ad-vanced ovarian cancer, clinical trials for several PARPis are being conducted to assess toxicities, efficacies, and benefits of drugs as monotherapy or in combination with radiation or other chemotherapeutic agents for ovarian, breast, prostate, rectal, lung,pancreatic, peritoneal, head and neck, and brain cancers;squamous cell carcinomas;sarcomas;and others. In this review, we focus on outlining the molecular mechanisms and clinical developments of approved PARPis and the emerging confusions in ongoing clinical trials and practice.【期刊名称】《中国肿瘤临床》【年(卷),期】2018(045)010【总页数】4页(P521-524)【关键词】聚腺苷二磷酸-核糖聚合酶抑制剂;PARP;DNA损伤修复【作者】齐静;刘宁波【作者单位】天津医科大学肿瘤医院放疗科,天津市肿瘤防治重点实验室,国家肿瘤临床医学研究中心天津市300060;天津医科大学肿瘤医院放疗科,天津市肿瘤防治重点实验室,国家肿瘤临床医学研究中心天津市300060【正文语种】中文目前美国食品药品监督管理局(FDA)已批准上市用于临床治疗的聚腺苷二磷酸-核糖聚合酶[poly-(ADP-ribose)polymerase,PARP]抑制剂包括olaparib (奥拉帕利)、rucaparib(芦卡帕利)、niraparib(尼拉帕利),正在进行临床Ⅲ期试验的包括:veliparib(维利帕尼)以及最近开发的第二代更有效的talazoparib等。
聚二磷酸腺苷核糖聚合酶-1在细胞死亡中的作用

聚二磷酸腺苷核糖聚合酶-1在细胞死亡中的作用金玮【摘要】聚二磷酸腺苷核糖化是细胞应对DNA损伤、保持基因组完整的一种重要机制.负责催化该反应的酶-聚二磷酸腺苷核糖聚合酶-1(PARP-1)参与了DNA损伤导致的两种细胞死亡:细胞凋亡和细胞坏死.细胞凋亡时,PARP-1被caspase特异性地降解,产生氨基端的24 ku片段和羧基端的89 ku片段;而完整的PARP-1的过度活化会引起能量丧失而致细胞坏死.现对PARP-1在这两种死亡结局中的作用作一综述.【期刊名称】《安徽医科大学学报》【年(卷),期】2011(046)007【总页数】4页(P696-699)【关键词】细胞凋亡;DNA损伤【作者】金玮【作者单位】安徽医科大学第六临床学院耳鼻咽喉科,巢湖,238000【正文语种】中文【中图分类】R329.2;R345;R394.3聚二磷酸腺苷核糖聚合酶-1[poly(ADP-ribose)polymerase-1,PARP-1]是真核细胞中催化聚二磷酸腺苷核糖化的一种细胞核酶,于1963年由法国Mandel小组从肝细胞核中提取[1]。
自发现40多年来,其在DNA损伤监测和修复、染色质修饰、转录调控、细胞死亡等方面的重要作用引起广大学者的关注。
本文从细胞死亡角度,对其与两种死亡通路的关系作一综述。
1 PARP-1结构与代谢1.1 PARP-1分子结构 PARP-1是一种高度保守、含量极为丰富的蛋白质,平均每个细胞中有1.0×106个,远远超过其他核酶。
它由1 014个氨基酸组成,分子量113 ku,见图1,编码基因位于染色体的q41~q42区,等电点在8.0~9.8之间[2]。
氨基端的42 ku的DNA结合结构域(DBD),含大量碱性氨基酸,是与DNA结合的部分。
DBD通过两个“锌指结构”识别DNA缺口。
第一个锌指主要识别DNA 双链缺口,而第二个锌指识别DNA单链缺口。
DBD还有两个螺旋-转角-螺旋基序,是唯一有DNA结合活性的结构。
人多聚adp核糖聚合酶

人多聚adp核糖聚合酶ADP核糖聚合酶,全称为腺苷二磷酸核糖聚合酶(Adenosine Diphosphate Ribose Polymerase),是一种参与DNA修复的重要酶类。
它在细胞内发挥着至关重要的作用,对于维持细胞的正常功能和生存具有重要意义。
ADP核糖聚合酶是一种能够催化DNA链的修复的酶,它可以识别并结合DNA链上的损伤点,通过将ADP核糖基团从NAD+中释放出来,将其附加到DNA链上的损伤点上,从而修复DNA链。
这个过程被称为ADP核糖化修复。
ADP核糖聚合酶可以修复多种不同类型的DNA损伤,包括单链断裂、碱基损伤、减数分裂过程中的叉结构以及DNA链上的交叉连锁。
ADP核糖聚合酶是一个高度保守的酶,在不同的物种中都存在。
它的结构由数个功能区域组成,包括活性中心、DNA结合区和底物结合区。
这些功能区域的协同作用使得ADP核糖聚合酶能够高效地进行DNA修复。
ADP核糖聚合酶在DNA修复过程中起到了关键的作用。
当DNA链上出现损伤时,细胞会通过一系列信号传导机制将ADP核糖聚合酶招募到损伤点附近。
ADP核糖聚合酶与其他DNA修复酶相互作用,共同协调DNA修复过程。
它通过与DNA链上的损伤点结合,将ADP核糖基团转移到DNA链上,从而实现修复。
ADP核糖聚合酶的功能异常与多种疾病的发生和发展相关。
例如,ADP核糖聚合酶的缺陷会导致一种遗传性疾病——PARP缺陷症,这种疾病会增加细胞受到DNA损伤的敏感性,从而增加患者患上癌症的风险。
此外,ADP核糖聚合酶还参与了细胞凋亡、细胞老化以及基因组稳定性的调控。
近年来,ADP核糖聚合酶成为了抗肿瘤药物研究的热点。
由于癌细胞对DNA损伤的修复能力较低,因此通过抑制ADP核糖聚合酶的活性,可以增加肿瘤细胞对化疗药物的敏感性,从而提高治疗效果。
许多PARP抑制剂已经在临床上被广泛应用于治疗乳腺癌、卵巢癌等肿瘤。
ADP核糖聚合酶作为一种重要的DNA修复酶,在细胞的正常功能和生存中起着至关重要的作用。
多聚腺苷二磷酸核糖聚合酶抑制剂对脑缺血大鼠海马炎性因子表达水平的影响

多聚腺苷二磷酸核糖聚合酶抑制剂对脑缺血大鼠海马炎性因子表达水平的影响【摘要】目的探讨多聚腺苷二磷酸核糖聚合酶(parp)抑制剂3-氨基苯甲酰胺(3-ab)对脑缺血大鼠海马炎性因子表达水平的影响。
方法56只大鼠随机分为假手术组、脑缺血对照组、3-ab组,用线栓法建立大鼠局灶性脑缺血模型,用免疫组化学染色法观察大鼠海马ca1区肿瘤坏死因子-a(tnf-a)和基质金属蛋白酶(mmp-9)的表达。
结果与假手术组比较,缺血对照组及3-ab组的海马ca1区tnf-a和mmp-9的表达均明显增高(均p <0.01);与脑缺血对照组比较,3-ab 组海马ca1区tnf-a和mmp-9的表达均明显减少(p <0.05)。
结论parp抑制剂3-ab能明显降低脑缺血大鼠海马ca1区炎性因子tnf-a和mmp-9的表达水平,提示其有减轻炎症反应及神经保护作用。
【关键词】脑缺血;多聚腺苷二磷酸核糖聚合酶;3-氨基苯甲酰胺;肿瘤坏死因子-a;基质金属蛋白酶-9the protective effect of parp inhibitor on cerebral ischemia of rats in delayed treatmentzhang wei-fa, wang dong-yu【abstract】objective to explore the poly(adp-ribose) polymerase(parp) inhibitor 3-aminobenzamide(3-ab) oncerebral ischemia of rats in delayed treatment.methodsthe rats were divided randomly into sham operationgroup,ischemica control group, 3-ab group.rat model of cerebral ischemia was established by left middle cerebral artery occlusion(mcao).at the different time points, killed the rats and brain tissues of rats were isolated. the expressions of tnf-a and mmp-9 in hippocampus ca1 region after mcao were detected in immuno-histochemicalmethed.resultscompared with ischemia groups, the number of tnf-a and mmp-9 positive cell in 3-ab group were decreased significantly at the same time point(p<0.05 or p<0.01). conclusion administration of parp inhibitor 3-ab at 8 h after mcao has a large brains protective effect.this effect may be mediated by decreased the expression of tnf-a and mmp-9 in hippocampus ca1 region of rats,suppression of the post-ischemic brain inflammatory response.【key words】 brain ischemia;poly(adp-ribose) polymerase; inflammation;tnf-a;mmp-9【中图分类号】r743.3 【文献标识码】b 【文章编号】1005-0515(2011)10-0016-03缺血性脑血管病具有高发病率、高致残率及高死亡率等特点,近年来炎症反应在缺血性脑损伤中的作用受到广泛重视,脑组织的炎症反应主要特征是小胶质细胞的的激活,研究发现小胶质细胞的激活与多聚腺苷二磷酸核糖聚合酶(parp)密切相关, parp是核转录因子-kb (nf-kb)介导的小胶质细胞的基因转录、整合素的表达、形态改变、迁移和神经毒性所必需的因子,脑缺血后小胶质细胞的全部激活需要较长的时间,白细胞从外周血中浸润到脑组织需要更长的时间[1]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高血糖作为糖尿病的最基本生化特性,通过多种机制引起糖尿病肾病(diabetic nephropathy,DN),其中氧化应激是一个重要损伤机制。
而有研究发现高血糖介导的ROS可以激活多聚ADP核糖聚合酶[poly(ADP-ribose)polymerase,PARP][1]。
PARP是一种存在于除酵母外所有真核细胞核内对DNA断裂敏感的蛋白酶,目前其在DN发病机制中的作用尚未完全阐明。
DN时,肾小球系膜细胞是多种致病因子作用的主要靶细胞,主要表现为肾小球的肥大、细胞外基质的堆积、肾小多聚二磷酸腺苷(ADP)核糖聚合酶-1(PARP-1)在高糖致大鼠肾脏系膜细胞细胞外基质沉积中的作用朱恒梅祝胜郎▲陈结慧叶玲蒋莹李向阳广东省深圳市第六人民医院肾内科,广东深圳510082[摘要]目的探讨多聚二磷酸腺苷(ADP)核糖聚合酶-1(PARP-1)在高糖(25mM)致大鼠肾脏系膜细胞细胞外基质沉积中的作用。
方法①体外培养大鼠肾脏系膜细胞株(MCs1097),使用高糖(25mM)处理大鼠肾脏系膜细胞,部分实验组中应用PARP-1抑制剂PJ34(3×10-6M)进行干预处理。
②RT-PCR和Western blot检测PARP-1、纤维粘连蛋白(FN)、胶原Ⅳ(COLⅣ)的mRNA及蛋白表达。
③高通量比色测定法检测PARP-1的活性。
结果①高糖显著诱导大鼠肾脏系膜细胞PARP-1mRNA和蛋白的表达,分别较低糖对照组增加72.3%和68.4%(P<0.05),PJ34可明显抑制高糖诱导的PARP-1mRNA和蛋白的过度表达,mRNA和蛋白分别为高糖组的31.8%和55.5%(P<0.05)。
同时,高糖显著诱导大鼠肾脏系膜细胞PARP-1激活,高糖组为低糖对照组活性的1.77倍(P<0.05),PJ34可显著抑制高糖诱导的PARP激活,活性降低为高糖组的67.8%(P<0.05)。
②高糖显著增加COLⅣ和FN表达,PJ34显著抑制高糖诱导的COLⅣ和FN mRNA过度表达(分别为高糖组的68.2%和54.7%(P<0.05);COLⅣ和FN蛋白水平的变化与RNA水平变化相一致,PJ34可显著抑制高糖诱导的COLⅣ和FN蛋白表达(分别为高糖组的54.0%及66.6%(P<0.05)。
结论高糖可以诱导培养的大鼠肾脏系膜细胞内PARP激活,PARP-1表达增加,PJ-34预处理可以明显降低高糖诱导的大鼠肾脏系膜细胞内PARP的激活以及下游FN及COLⅣ的高表达,提示PARP1参与了肾脏系膜细胞细胞外基质沉积的发生发展过程。
[关键词]系膜细胞;PARP;高血糖;细胞外基质[中图分类号]R587.2[文献标识码]A[文章编号]1673-7210(2012)11(a)-0008-04Poly(ADP-ribose)polymerase-1mediates high glucose-induced extracel-lular matrix accumulation in rat mesangial cellsZHU Hengmei ZHU Shenglang▲CHEN Jiehui YE Ling JIANG Ying LI XiangyangDepartment of Nephrology,the Sixth People's Hospital of Shenzhen City,Guangdong Province,Shenzhen510082,China [Abstract]Objective To investigate the role of Poly(ADP-ribose)Polymerase-1(PARP-1)in high glucose-induced accu-mulation of extracellular matrix(ECM)in rat mesangial cells(RMCs).Methods RMCs were treated with or without high glucose(25mmol/L).In some experimental groups,cells were pre-treated with PARP-1inhibitor PJ34(3×10-6mol/L).RT-PCR was employed to detect the mRNA expression for ADP-ribose polymerase-1(PARP-1),fibronectin(FN).collagen Ⅳ(COLⅣ),and all those proteins expression were examined by Western blot.The activity of PARP-1was examined by Colorimetric assay.Results high glucose significantly stimulated both PARP-1mRNA and protein overexpression in RM-Cs.the mRNA and protein expression of PARP-1were up-regulated by72.3%and68.4%(P<0.05).PJ34reduced high glucose-induced upregulation of PARP-1mRNA and protein to31.8%and55.5%(P<0.05),compared with high glucose stimulation group.At the same time,high glucose obviously stimulated PARP-1activation,the PARP-1activity of high glucose group was upregulated by1.77fold(P<0.05),compared with control cells.PJ34effectively inhibited the activa-tion of PARP-1by32.2%(P<0.05),compared with the cells treated with high glucose alone.Also,high glucose in-creased COLⅣand FN pared with high glucose stimulation group,PJ34suppressed high glucose-induced upregulation of COLⅣand FN mRNA by31.8%and45.3%,respectively(P<0.05).The changes in COLⅣand FN were confirmed at protein level.the inhibition rate of COLⅣand FN protein expression were54.0%and66.6%,respec-tively,compared with high glucose stimulation group(P<0.05).Conclusion Our data suggest that PARP-1mediates high glucose-induced accumulation of ECM in rat mesangial cells and thus may represent a potential therapeutic target in the management of glomerular disease.[Key words]Mesangial cells;PARP;Extracellular matrix[基金项目]2011广东省医学科研立项(编号:A2011570)。
2011年广东省深圳市科技局科技立项(编号:201102134)。
广东省深圳市南山区科技局基金(编号:南卫2011004)。
▲通讯作者8中国医药导报CHINA MEDICAL HERALD球基底膜的增厚和肾小球滤过屏障功能的异常,其中肾脏细胞外基质(extracellular matrix,ECM)的蓄积引起的肾小球硬化与间质纤维化是DN发展至终末期肾功能衰竭的主要病理表现[2]。
因此本实验以大鼠肾脏系膜细胞作为研究对象,探讨多聚二磷酸腺苷(ADP)核糖聚合酶-1(PARP-1)在高糖致外细胞基质沉积中的作用,以探讨PARP在DN发生发展中的作用。
1材料与方法1.1材料D-Glucose购自Sigma公司,PJ34购自默克公司;细胞培养用RPMI1640,胎牛血清购自Gibco公司;Trizol溶液购自美国Invitrogen公司;胰岛素购自甘李药物公司,Trizol Reagent购自Invitrogen公司;细胞裂解液、HRP标记的兔抗大鼠Ⅱ抗、小鼠抗大鼠Ⅱ抗购自Cell signaling公司,小鼠抗大鼠COLⅣ、FN一抗,兔抗大鼠PARP-1一抗购自CHEMICON公司;PARP/Apoptosis检测试剂盒购自trevigen 公司;RevertAidTM FirstStrand cDNA逆转录试剂盒购自Fer-mentas公司,Taq DNA聚合酶购自Takaka公司。
其余化学试剂为国产分析纯。
1.2方法1.2.1细胞培养及分组大鼠肾脏系膜细胞株(MCs1097,购自美国ATCC公司)培养于含有15%胎牛血清及0.6U/mL 胰岛素的RPMI1640培养基中。
细胞培养至85%融合后,换用无血清培养基培养24h,后换用新鲜无血清的DMEM低糖(5mmol/L)培养基,分别加入药物刺激干预:高糖刺激组中高糖浓度为25mmol/L,刺激时间为24h。
PJ34干预组先给予3×10-6mol/L PJ34孵育1h后,加入高糖刺激24h。
单纯使用PJ34组作为对照。
1.2.2细胞总蛋白提取细胞用PBS清洗后加入细胞裂解液,冰上放置5min。
用细胞刮刮取细胞,收集至1.5mL Eppen-dorf管中,放置于冰上。
用超声粉碎仪在冰上进行超声粉碎,500W、1s×15次,以剪切DNA,降低黏稠度。
4℃,12000r/min 离心10min,留取上清。
取10μL上清测定浓度,余储存于-80℃备用。
细胞总蛋白提取物做Western blot分析高糖对于大鼠肾脏系膜细胞PARP-1表达的影响。
