2021高考高中化学方程式大全(绝对全)883_KB(word打印版整套下载)
(完整word版)高中化学方程式大全(最最完整版)

优质解答1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓2、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O6、碳酸氢盐溶液与醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓8、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH–=CaCO3↓+H2O10、澄清石灰水与少量小苏打溶液混合:Ca2++OH–+HCO3-=CaCO3↓+H2O11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O12、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O14、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3•H2O16、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O17、向氢氧化钠溶液中通入少量的CO2¬:CO2+2OH–=CO32–+H2O18、过量的CO2通入氢氧化钠溶液中:CO2+OH–=HCO3-19、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O20、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O22、澄清石灰水与稀盐酸反应:H++OH–=H2O23、磷酸溶液与少量澄清石灰水:H3PO4+OH–=H2O+H2PO4–24、磷酸溶液与过量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O25、碳酸镁溶于强酸:MgCO3+2H+=Mg2++CO2↑+H2O26、硫酸镁溶液跟氢氧化钡溶液反应:Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓27、硫酸溶液跟氢氧化钡溶液反应:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O28、硫酸氢钠溶液与氢氧化钡反应至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:H++SO42–+OH–+Ba2+=BaSO4↓+H2O30、硫酸铝溶液中加入过量氢氧化钡溶液:2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H+=Mg2++2H2O32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑33、物质的量之比为1:1NaAl合金置于水中:Na+Al+2H2O=Na++AlO2–+2H2↑34、氧化铝溶于强碱溶液:Al2O3+2OH–=2AlO2–+H2O35、氧化铝溶于强酸溶液:Al2O3+6H+=2Al3++3H2O36、氢氧化铝与氢氧化钠溶液:Al(OH)3+OH–=AlO2–+2H2O37、氢氧化铝与盐酸溶液反应:Al(OH)3+3H+=Al3++3H2O38、硫酸铝溶液与碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+CO2↑39、硫酸铝溶液与碳酸钠溶液:2Al3++3CO32–+3H2O=2Al(OH)3↓+3CO2↑40、氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+41、明矾溶液加热水解生成沉淀:Al3++3H2O=Al(OH)3↓+3H+42、氯化铝溶液与偏铝酸钠溶液:Al3++3AlO2–+6H2O=4Al(OH)3↓43、偏铝酸钠溶液中加入氯化铁溶液:Fe3++3AlO2–+6H2O=Fe(OH)3↓+3Al(OH)3↓44、偏铝酸钠溶液中加入少量盐酸:AlO2–+H++H2O=Al(OH)3↓45、偏铝酸钠溶液中加入过量盐酸:AlO2–+4H+=Al3++2H2O46、偏铝酸钠溶液中加入氯化铵溶液:AlO2–+NH4++H2O=Al(OH)3↓+NH3↑47、金属铁溶于盐酸中:Fe+2H+=Fe2++H2↑48、铁粉与氯化铁溶液反应:Fe+2Fe3+=3Fe2+49、铜与氯化铁溶液反应:Cu+2Fe3+=Cu2++3Fe2+50、硫化亚铁与盐酸反应:FeS+H+=Fe2++H2S↑51、硫化钠与盐酸反应:S2–+2H+=H2S↑52、硫化钠溶液中加入溴水:S2–+Br2=S↓+2Br–53、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–54、向硫酸铁的酸性溶液中通入足量的H2S:2Fe3++H2S=2Fe2++S↓+2H+55、氯化铁溶液中滴加少量硫化钠溶液:2Fe3++S2–=S↓+2F e2+56、硫化钠溶液中滴加少量氯化铁溶液:2Fe3++3S2–=S↓+2FeS↓57、氯化铁溶液中滴加少量碘化钾溶液:2Fe3++2I–=2Fe2++I258、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH–=Fe(OH)3↓59、氯化铁溶液跟过量氨水反应:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+60、氯化铁溶液与硫氰化钾溶液: Fe3++3SCN–=Fe(SCN)361、氯化铁溶液跟过量锌粉反应: 2Fe3++3Zn=2Fe+3Zn2+62、锌与稀硫酸: Zn+2H+=Z n2++H2↑63、锌与醋酸: Zn+2CH3COOH=CH3COO–+Zn2++H2↑64、锌与氯化铵溶液:Zn+2NH4+=Zn2++NH3↑+H2↑65、氯化铁溶液加入碘化钾溶液: 2Fe3++2I-=2Fe2++I266、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O68、四氧化三铁溶于浓盐酸: Fe3O4+8H+=2Fe3++Fe2++4H2O69、氧化铁溶于盐酸: Fe2O3+6H+=2Fe3++3H2O70、氧化铁溶于氢碘酸溶液: Fe2O3+2I-+6H+=2Fe2++I2+3H2O71、用氯化铁与沸水反应制氢氧化铁胶体:Fe3++3H2O Fe(OH)3+3H+72、向溴化亚铁溶液通入足量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-73、向溴化亚铁溶液通入少量氯气: 2Fe2++Cl2=2Fe3++2Cl-74、向碘化亚铁溶液通入足量氯气: 2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-75、向碘化亚铁溶液通入少量氯气: 2I-+Cl2=I2+2Cl-76、碘化钾溶液中加入氯水: 2I-+Cl2=I2+2Cl-77、碘化钾溶液中加入过量氯水: I-+3Cl2+3H2O=6H++IO3-+6Cl-78、溴化钠溶液中加入氯水: 2Br-+Cl2=Br2+2Cl-79、亚硫酸溶液中加入氯水: H2SO3+Cl2+H2O=4H++2Cl-+SO42-80、亚硫酸溶液中加入氯化铁: H2SO3+2Fe2++H2O=4H++2Fe2++SO42-81、亚硫酸溶液中加入双氧水: H2SO3++H2O2=2H++H2O+SO42-82、氯气通入水中: Cl2+H2O=H++Cl-+HClO83、氯气通入碳酸氢钠溶液中: Cl2+HCO3=Cl-+CO2+HClO84、亚硫酸钠溶液中加入溴水: SO32-+H2O+Br2=SO42-+Br-+2H+85、亚硫酸钠溶液中加入双氧水: SO32-+H2O2=SO42-+2H2O86、二氧化硫通入溴水中: SO2+Br2+2H2O=4H++2Br-+SO42-87、单质铁溶于过量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O88、过量单质铁溶于稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O89、单质铜与稀硝酸反应: 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O90、单质铜与浓硝酸反应: Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O91、铜片插入硝酸银溶液: 2Ag++Cu=2Ag+Cu2+92、用氨水吸收少量SO2: SO2+2NH3+H2O=2NH4++SO32-93、用氨水吸收过量的SO¬2 : SO2+NH3+H2O=NH4++HSO3-94、稀硝酸中通入SO2: 3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+95、浓硝酸中通入SO2: SO2+2NO3-=SO42-+2NO2↑96、氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH- NH3↑+H2O97、向次氯酸钙溶液中通入SO2: Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+98、用碳酸钠溶液吸收过量SO2: CO32-+H2O+2SO2=CO2↑+2HSO3-99、硫酸铜溶液中通入硫化氢:H2S+Cu2+=CuS↓+2H+100、硫酸铜溶液中加入硫化钠溶液:S2-+Cu2+=CuS↓101、电解饱和食盐水: 2Cl-+2H2O 2OH-+H2↑+Cl2↑102、电解硫酸铜溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+103、电解氯化铜溶液: Cu2++2Cl- Cu↓+Cl2↑104、电解熔融氯化钠: 2Na++2Cl-(熔融) 2Na+Cl2↑105、电解熔融氧化铝: 4Al3+ +6O2- 4Al+3O2↑106、二氧化锰与浓盐酸共热: MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O107、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O108、氯气通入热的氢氧化钾溶液中:3Cl2+6OH-=5Cl-+ClO3-+3H2O109、次氯酸钙溶液通入过量的二氧化碳:ClO-+H2O+CO2=HClO+HCO3-110、次氯酸钠溶液中加入浓盐酸: ClO-+Cl-+2H+=Cl2↑+H2O111、氯酸钾与浓盐酸: ClO3-+5Cl-+6H+=3Cl2↑+3H2O112、硫化钠、亚硫酸钠混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O113、NO2溶于水: 3NO2+H2O=2H++NO3-+NO↑114、NO2通入亚硫酸钠溶液: SO32-+NO2=SO42-+NO↑115、硫化钠的第一步水 S2-+H2O HSO3-+OH-116、碳酸钠的第一步水 CO32-+H2O HCO3-+OH-117、氯化钡溶液与硫酸反应: Ba2++SO42-=BaSO4↓118、硫溶于热的氢氧化钠溶液: 3S+6OH-=2S2-+SO32-+3H2O119、醋酸钡溶液与硫酸反应:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH 120、醋酸与氢氧化钾溶液反应: CH3COOH+OH-=CH3COO-+H2O121、醋酸与氨水反应:CH3COOH+NH3•H2O=CH3COO-+NH4++2H2O122、苯酚溶于氢氧化钠溶液: C6H5OH+OH-=C6H5O-+H2O123、苯酚与氯化铁溶液反应: 6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+ 124、苯酚钠溶于醋酸溶液: C6H5O-+CH3COOH=C6H5OH+CH3COO-125、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-126、碳酸钠溶液中加入过量苯酚:C6H5OH+CO32-=C6H5O-+HCO3-127、碳酸钙跟甲酸反应:CaCO3+HCOOH=Ca2++CO2↑+H2O+HCOO-128、甲酸钠跟盐酸反应: HCOO-+H+=HCOOH129、小苏打溶液与甲酸溶液反应:HCOOH+HCO3-=CO2↑+H2O+HCOO-130、Na2C2O4溶液中加入酸性高锰酸钾溶液:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O131、酸性高锰酸钾溶液与双氧水:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O 132、酸性氯化亚铁溶液与双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O133、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ 134、乙烯通入酸性高锰酸钾溶液生成CO2:5C2H4+12MnO4-+36H+=10CO2↑+12Mn2++28H2O135、乙酸乙酯与氢氧化钠溶液:CH3COOCH2CH3+OH-=CH3COO-+HOCH2CH3 136、硬脂酸甘油酯与氢氧化钠溶液:(C17H35COO)3(C3H5O3)+3OH-=3C17H35COO-+CH2(OH)CH(OH)CH2OH 137、氯乙烷在氢氧化钠溶液中水CH3CH2Cl+OH-=CH3CH2OH+Cl-138、硝酸银溶液中滴入少量氨水:Ag++NH3•H2O=AgOH↓+NH4+139、硝酸银溶液中滴加氨水至过量:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O 140、葡萄糖发生银镜反应:CH2(OH)(CHOH)4CHO+2[Ag(NH3)2]++2OH-=CH2(OH)(CHOH)4COO-+NH4++3NH3+H2O+2Ag↓141、硫酸铜溶液中加入氢氧化钠溶液:Cu2++2OH-=Cu(OH)2↓142、硫酸铜溶液中加入少量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+143、硫酸铜溶液中加入过量氨水:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O 144、硫酸锌溶液中加入少量氨水:Zn2++2NH3•H2O=Zn(OH)2↓+2NH4+145、硫酸锌溶液中加入过量氨水:Zn2++4NH3•H2O=[Zn(NH3)4]2++4H2O第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃 3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气)44、kJ 6.571O H 2O H 2222+→+(液)(气)(气)45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固)第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22SO O S −−→−+点燃51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 2253、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足)55、↓+−−→−+S 3O H 2SO S H 2222点燃56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合)63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀)65、3222SO H O H SO ⇔+66、3OV 22SO 2O SO 252∆−−→←+67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3O V 22SO 2O SO 252∆−−→←+79、4232SO H SO O H →+第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓)81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓)82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓)83、O H 2SO S SO H S H 22422++−→−+∆(浓)84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓)85、HCl 2BaSO SO H BaCl 4422+↓→+86、NaCl 2BaSO SO Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓)95、OH SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)97、O H 11C 12O H C 2SO H11221142+−−−→−浓第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+ 118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃 123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素)124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
(word完整版)高考化学方程式汇总,推荐文档
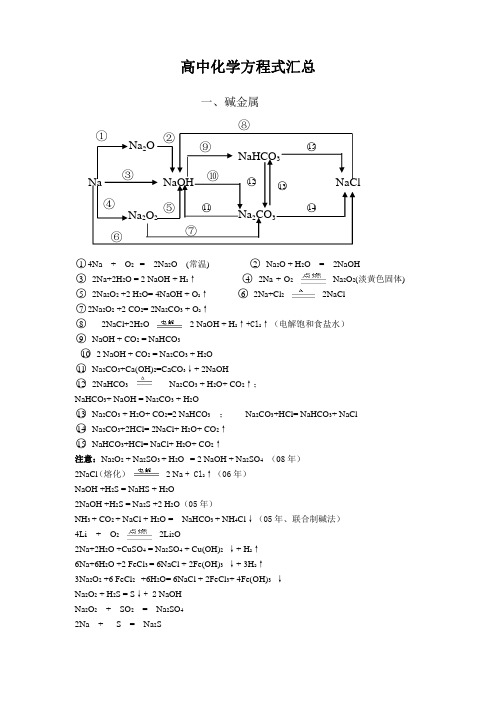
Na NaOH NaClNa 2O Na 2O 2Na 2CO 3NaHCO 3①②③ ④⑤⑥⑦⑧⑨⑩ ○11 ○12 ○13 ○14 ○15 高中化学方程式汇总○14Na + O 2 = 2Na 2O (常温) ○2 Na 2O + H 2O = 2NaOH ○3 2Na+2H 2O = 2 NaOH + H 2↑ ○4 2Na + O 2Na 2O 2(淡黄色固体) ○5 2Na 2O 2 +2 H 2O= 4NaOH + O 2↑ ○62Na+Cl 22NaCl ○72Na 2O 2 +2 CO 2= 2Na 2CO 3 + O 2↑ ○82NaCl+2H 2O 2 NaOH + H 2↑+Cl 2↑(电解饱和食盐水) ○9 NaOH + CO 2 = NaHCO 3 ○10 2 NaOH + CO 2 = Na 2CO 3 + H 2O ○11 Na 2CO 3+Ca(OH)2=CaCO 3↓+ 2NaOH ○12 2NaHCO 3 Na 2CO 3 + H 2O+ CO 2↑; NaHCO 3+ NaOH = Na 2CO 3 + H 2O○13 Na 2CO 3 + H 2O+ CO 2=2 NaHCO 3 ; Na 2CO 3+HCl= NaHCO 3+ NaCl ○14 Na 2CO 3+2HCl= 2NaCl+ H 2O+ CO 2↑ ○15 NaHCO 3+HCl= NaCl+ H 2O+ CO 2↑ 注意:Na 2O 2 + Na 2SO 3 + H 2O = 2 NaOH + Na 2SO 4 (08年) 2NaCl (熔化)2 Na + Cl 2↑(06年)NaOH +H 2S = NaHS + H 2O2NaOH +H 2S = Na 2S +2 H 2O (05年)NH 3 + CO 2 + NaCl + H 2O = NaHCO 3 + NH 4Cl ↓(05年、联合制碱法) 4Li + O 22Li 2O2Na+2H 2O +CuSO 4 = Na 2SO 4 + Cu(OH)2 ↓+ H 2↑ 6Na+6H 2O +2 FeCl 3 = 6NaCl + 2Fe(OH)3 ↓+ 3H 2↑ 3Na 2O 2 +6 FeCl 2 +6H 2O= 6NaCl + 2FeCl 3+ 4Fe(OH)3 ↓ Na 2O 2 + H 2S = S ↓+ 2 NaOH Na 2O 2 + SO 2 = Na 2SO 4 2Na + S = Na 2S一、碱金属Cl 2NaClOHClNH 4ClO 2HClOCa(ClO)2NaClAgClPCl 3 PCl 5CuCl 2FeCl 3FeCl 2①○2 ○3 ○4 ○5 ○7○9 ○10 ○11 ○12 ○13 ○16 ○14○15 ○17 ○18 ○19 ○20 ○21 ○22 ○23 ○24 ○25 ○26二、卤素○1Cl 2 +H 2 2HCl②4HCl(浓)+MnO 2MnCl 2+Cl 2↑+2H 2O (氯气的实验室制法)○3 Cl 2 + 2Na 2NaCl ○42NaCl 2Na +Cl 2↑ ○5 Cl 2 +2NaOH=NaClO+ NaCl+H 2O (氯气的尾气处理) ⑥ NaClO + 2HCl(浓) = Cl 2↑ + NaCl + H 2O○7NaClO+H 2O HClO+NaOH ○9 Cl 2 + H 2O = HCl + HClO ○10 2Cl 2 +2Ca(OH)2=CaCl 2+Ca(ClO)2+ H 2O (漂白粉的工业制取) ○11 Ca(ClO)2 + H 2O+ CO 2= CaCO 3↓+2 HClO ○122 HClO 2HCl + O 2↑ ○13 HCl +NaOH = NaCl + H 2O ○14 2NaCl +H 2SO 4(浓) Na 2SO 4 +2HCl ↑( HCl 的实验室制法 ) ○15 NaCl + AgNO 3 = AgCl ↓ + NaNO 3 ○16 HCl + AgNO 3 = AgCl ↓ + HNO 3 ○17 HCl +NH 3 = NH 4Cl (白烟) ○18Fe + 2HCl = FeCl 2 + H 2↑ ○19 2Fe +3Cl 2 2 FeCl 3 (棕色的烟、黄色溶液) ○20Cu +Cl 2 CuCl 2 (棕黄色的烟、蓝绿色溶液) ○21 2P +5Cl 2 2PCl 5 ○222P +3 Cl 2 2PCl 3 ○23 PCl 3+ Cl 2 = PCl 5 注意:2F 2+2 H 2O = 4HF + O 2 Cl 2 + 2NaBr = 2 NaCl + Br 2 Cl 2 + 2NaI = 2 NaCl +I 2 Br 2 + 2NaI = 2 Na Br +I 2 NaBr + AgNO 3 = AgBr ↓(浅黄色)+ NaNO 3 NaI + AgNO 3 = AgI ↓(黄色) + NaNO 3 5 Cl 2 + I 2 + 6H 2O = 2HIO 3 + 10 HCl HClO + SO 2 + H 2O = H 2SO 4 + 2 HClS SO 2 SO 3 Na 2SO 4BaSO 4CuSH 2SH 2SO 3H 2SO 4Cu 2S FeSFeS 2①○3 ○2 ○4 ○5 ○6 ○7 ○8 ○9 ○10 ○11 ○12 ○13 ○14 ○15 ○16 ○17 CuSO 4○18 ○19 ○20 ○21 ○22 三、氧族元素○1 Fe+S FeS ○22 Cu+S Cu 2S ○3 H 2 + S H 2S FeS + 2 HCl = H 2S ↑ + FeCl 2 ○4 H 2S H 2 + S ;2H 2S +O 2 =2 H 2O +2 S ↓ ○5 H 2S +CuSO 4= H 2SO 4+CuS ↓ ○62H 2S + 3O 2 2 H 2O + 2SO 2(完全燃烧) ○7 S +O 2 2SO 2 ○8 2H 2S + SO 2=2 H 2O +3 S ↓ ○94FeS + 7O 2 2 Fe 2O 3 + 4SO 2 ○104FeS 2 + 11O 2 2 Fe 2O 3 + 8SO 2 (工业制取SO 2) ○11 SO 2 + H 2O = H 2SO 3 ○12 Na 2O 2+ SO 2= Na 2SO 4 ○13 ○14 2 SO 2 + O 2 2SO 3 ○15 SO 3+ H 2O= H 2SO 4 ○16 SO 2 + 2 H 2O + X 2 = H 2SO 4 + 2HX (X=Cl ,Br ,I ) ○172H 2SO 4 + Cu Cu SO 4 + SO 2↑+ 2H 2O Na 2SO 3 + H 2SO 4(浓)=N a 2 SO 4 + SO 2↑+ 2H 2O 2H 2SO 4 + CCO 2 ↑+ 2SO 2↑+ 2H 2O○18 H 2SO 3 +Cl 2 + H 2O = H 2SO 4+ 2HCl ○19 H 2SO 4+Cu(OH)2= Cu SO 4+ 2H 2O ○20 H 2SO 4+ 2NaOH = Na 2SO 4 + 2H 2O ○21 H 2SO 4+BaCl 2= BaSO 4↓+ 2HCl ○22 Na 2SO 4 + Ba(OH)2 = BaSO 4↓+ 2NaOH 注意:SO 2 + 2 H 2O +Br 2 = H 2SO 4 + 2H BrSO 2 +Ca(OH) 2 = CaSO 3 ↓ + H 2O (SO 2不足) 2SO 2 +Ca(OH) 2 = Ca(HSO 3)2 (SO 2过量)2 FeCl 3+ H 2S = S ↓+ 2 FeCl 2 + 2HCl H 2SO 4(浓)+2HBr===SO 2↑+Br 2↑+2H 2O 2 FeCl3 + SO 2 + 2H 2O = 2 FeCl 2 + H 2SO4 + 2HClSO 2 + 2NaOH = Na 2SO 3 + H 2O (SO 2不足 、吸收SO 2) 2Na 2SO 3 + O 2 = 2 Na 2SO 4 3O 2 O 32H 2O 22H 2O+ O 2↑ H 2SO 3+H 2O 2===H 2SO 4+H 2OO 3 + 2KI + H 2O = 2KOH +I 2+ O 2(使湿润的淀粉KI 试纸变蓝) Cu SO 4·5H 2OCu SO 4 + 5H 2O○1 Si +O2 SiO 2 ○2 SiO 2 + 2C Si + 2CO ↑(工业制单质硅)○3 SiO 2 +Na 2CO 3 Na 2SiO 3 +CO 2 ↑ SiO 2+2NaOH===Na 2SiO 3+H 2O (强碱缓慢腐蚀玻璃)○4 SiO 2 +CaCO 3 CaSiO 3 +CO 2 ↑ ○5 H 2SiO 3 SiO 2 +H 2O ○6 Na 2SiO 3 +2CO 2(过量)+ H 2O = H 2SiO 3↓+2 NaHCO 3 ○7 H 2SiO 3 +2NaOH = Na 2SiO 3+H 2O ○8 2Si +2NaOH+2H 2O = Na 2SiO 3 +2H 2↑ ○9 Si +2F 2= SiF 4 ○10 SiO 2 + 2C Si + 2CO ↑ ○11 2C+O 2(少量) 2CO ○12 CaO + 3 C CaC 2 + CO ↑ ○13CO 2+Mg 2MgO+C ○14 C + O 2(过量) CO 2 ○15 CaC 2+2H 2O=Ca(OH)2+C 2H 2↑ ○16○17 CO 2+ H 2O H 2CO 3 ○18 2CO 2+ Ca(OH)2=Ca(HCO 3)2 ○19 Ca(HCO 3)2 +2HCl = CaCl 2+2 CO 2↑+2 H 2O ○20 CO 2+ Ca(OH)2=CaCO 3↓+ H 2O ○21 CaCO 3+2HCl=CaCl 2+ CO 2↑+ H 2O ; CaCO 3 CaO+ CO 2↑ ○22 CaCO 3+ CO 2+ H 2O= Ca(HCO 3)2 ○23 Ca(HCO 3)2 CaCO 3+ CO 2↑+ H 2O ○24 CaCO 3 CaO+ CO 2↑ ○25 CaO+ H 2O= Ca(OH)2 注意:Na 2SiO 3 + 2HCl = H 2SiO 3↓+2 Na ClNa 2CO 3 + SO 2 = Na 2SO 3 + CO 2 (吸收SO 2、SO 2的尾气处理) C+ H 2O CO ↑+ H 2H 2SiO 3 SiO 2 SiC CO 2CaCO 3 CaSiO 3SiF 4H 2CO 3 COCa(HCO 3)2Na 2SiO 3CaOCaC 2Ca(OH)2○2 ○4 ○5 ○6 ○7 ○8 ○9 ○10 ○11 ○12 ○13 ○14 ○15 ○16 ○17 ○18 ○19 ○20 ○21 ○22 ○1 ○3 ○23 ○24 ○25 四、碳族元素△△△△五、氮族元素○1 N 2 + O 2 2 NO ○2 ○3 ④ Mg 3N 2+6H 2O=3Mg(OH)2+2NH 3↑ ○5 NH 3 + HCl===NH 4Cl○6 NH 4Cl NH 3 ↑+ HCl ↑ NH 4Cl + NaOH △ NH 3↑ + H 2O +Na Cl 2NH 4Cl + Ca(OH)2 2NH 3↑+2H 2O +Ca Cl 2 ( 实验室制氨气)○7 NH 3 + H 2O NH 3·H 2O NH 4+ + OH - ○8 4 NH 3 + 5 O 2 4 NO + 6 H 2O ○9 2 NO + O 2 == 2 NO 2 ○10 3NO 2 + H 2O == 2HNO 3 + NO ○11 2 NO 2 == N 2O 4 (加压、降温) N 2O 4 == 2 NO 2 (降压、升温) ○12 3NO 2 + H 2O == 2HNO 3 + NO 4NO 2 + 2H 2O + O 2 == 4HNO 3 ○13 Cu+4HNO 3(浓)==Cu(NO 3)2+2NO 2↑+2H 2OC + 4HNO 3(浓) △CO 2↑ + 4NO 2↑ + 2H 2OAl + 6HNO 3(浓) △Al (NO 3)3+ 3NO 2↑ + 3H 2OFe + 6HNO 3(浓) △Fe (NO 3)3+ 3NO 2↑ + 3H 2O (Fe 不足)○14 3Cu+8HNO 3(稀)== 3Cu(NO 3)2 + 2NO ↑ + 4H 2O 8HNO 3(稀)+3Fe (过量)===3Fe(NO 3)2+2NO ↑+4H 2O○15 HNO 3 + NH 3 === NH 4NO 3 ○16 H 2SO 4(浓)+NaNO 3===NaHSO 4+HNO 3 ○17 HNO 3 + NaOH === NaNO 3+ H 2O 注意:NH 3 + CO 2+H 2O === NH 4HCO 3 2NH 3 + CO 2+H 2O === (NH 4)2CO 3NH 4HCO 3NH 3 ↑+ CO 2↑+H 2O (NH 4)2CO 32NH 3 ↑+ CO 2↑+H 2O 2NH 3+H 2SO 4===(NH 4)2SO 4 (氨气不用浓硫酸干燥) 4NO+3O 2+2H 2O 错误!未找到引用源。
(完整版)高中化学方程式大全完美打印版

高中无机化学方程式§1◆碱金属及碱土金属元素 4Li+ O 22Li 2O (常温、点燃产物相同)4Na+O 2===2Na 2O Na 2O 2+2Na =2Na 2O(此反应用于制备Na 2O ) 2Na 2O+ O 2 Na 2O 24Na+2O 22Na 2O 2 K+ O 2KO 2 2Na+S===Na 2S (加热可以爆炸)2Na+2H 2O===2NaOH+H 2↑ (Na 不能把金属从水溶液中置换出来,除了酸,一般是先和水反应) 2Na+2NH 3===2NaNH 2+H 2↑ 4Na+TiCl 4(熔融)===4NaCl+Ti Na+KCl(熔融)===NaCl+K↑ Na 2O+H 2O===2NaOH (与下式对比,同物质的量设计反应浓度相同题) 2Na 2O 2+2H 2O===4NaOH+O 2↑(歧化反应,水不是氧化剂或还原剂)( 此反应分两步:Na 2O 2+2H 2O===2NaOH+H 2O 2 2H 2O 2===2H 2O+O 2。
使酚酞溶液先红后退色 ) Na 2O+CO 2===Na 2CO 3 (碱性氧化物与酸性氧化物生成盐)2Na 2O 2+2CO 2===2Na 2CO 3+O 2(无↑) Na 2CO 3+HCl===NaHCO 3+NaCl NaHCO 3+HCl===NaCl+H 2O+CO 2↑Na 2CO 3+2HCl===2NaCl+ H 2O+ CO 2↑ 2NaHCO 3Na 2CO 3+ H 2O+ CO 2↑(考查试剂变质,类似有Na 2SO 3变质)NaHCO 3 + NaOH== Na 2CO 3 + H 2O (易考离子方程式书写,强调不会生成CO 2) Ca(HCO 3)2 + NaOH (少)==CaCO 3↓+ H 2O+NaHCO 3 Ca (HCO 3)2 + 2NaOH (多)==CaCO 3↓+ 2H 2O+Na 2CO 3 Ca(OH)2 + NaHCO 3(少)==CaCO 3↓+ H 2O+ NaOH Ca (OH)2 + 2NaHCO 3(多)== CaCO 3↓ + 2H 2O+Na 2CO 3NaHSO 4 +Ba (OH )2 ==BaSO 4↓ + H 2O+ NaOH(恰好完全生成沉淀) 2NaHSO 4 +Ba(OH )2 ==BaSO 4↓ + 2H 2O+ Na 2SO 4(恰好溶液呈中性) 2NH 4HCO 3 + 2NaOH(少)== 2H 2O+Na 2CO 3 +(NH 4)2CO 3反应现象对比不同,Na 2CO 3两阶段反应NaHCO 3与NaHCO 3都可产生CO 2条件不同,产物不同 易考离子方程式NH 4HCO 3 + 2NaOH (多)== Na 2CO 3 +NH 3↑+2H 2O2Ca(OH ) 2 + Mg(HCO 3)2 == Mg (OH)2↓+2CaCO 3↓ + 2H 2O(不是生成 MgCO 3) Na 2CO 3+ H 2O+ CO 2 = 2NaHCO 3Na 2CO 3(饱和)+ H 2O+ CO 2 = 2NaHCO 3↓ Na 2SO 4+H 2SO 4==2NaHSO 42NaOH+ CO 2 (少量)== Na 2CO 3 + H 2ONaOH+ CO 2(多量)== NaHCO 3CO 2+Ca (OH)2(过量)===CaCO 3↓+H 2O CaCO 3+H 2O +CO 2=Ca (HCO 3)2 2CO 2(过量)+Ca(OH)2===Ca(HCO 3)22NaOH+SO 2(少量)===Na 2SO 3+H 2O NaOH+SO 2(足量)===NaHSO 3 NaOH+HCl===NaCl+H 2O NaOH+H 3PO4===NaH 2PO4+H 2O 2NaOH+H 3PO4===NaHPO 4+2H 2O 3NaOH+H 3PO 4===Na 3PO 4+3H 2ONaOH+H 2S (足量)===NaHS+H 2O 2NaOH+H 2S (少量)===Na 2S+2H 2O3Cl 2+6KOH (热,浓)===5KCl+KClO 3+3H 2O 3S+6NaOH (浓)===2Na 2S+Na 2SO 3+3H 2O 4P+3KOH (浓)+3H 2O===PH 3↑+3KH 2PO 2Na 2O+2HCl===2NaCl+H 2O Na 2O+SO 3===Na 2SO 4 CaCO 3CaO+CO 2↑(必须注明高温或煅烧,写加热不给分) MgCO 3MgO+CO 2↑2Fe (OH )3 Fe 2O 3 + 3H 2O (实验题或推断题,Fe (OH)2在空气中加热因氧化也得红棕色Fe 2O 3 ) Mg (OH )2 MgO+ H 2O Cu(OH )2CuO+ H 2O2Al (OH)3Al 2O 3 + 3H 2O Hg(OH )2==== HgO + H 2O2NaOH + CuSO 4 ==Cu(OH )2↓+ Na 2SO 4(蓝色沉淀)3NaOH + FeCl 3 ==== Fe (OH )3↓ + 3NaCl(红褐色沉淀)较易联合在一起考查计算,反应物介于2:1和1:1之间,5种情况,4种结果,或考查图像题向NaOH 与Ca(OH )2混合溶液中通CO 2分阶歧化及碱性条件下离子共存NaCl +CO 2+NH 3 + H 2O==NaHCO 3↓+N H 4Cl (侯德榜制碱法,考查先通NH 3后通CO 2) NaH+H 2O =NaOH+H 2↑ 4NaH+TiCl 4=Ti+4NaCl+2H 2 CaH 2+2H 2O =Ca (OH)2+2H 2↑ §2卤族元素 Cl 2+Cu CuCl 2 棕黄色烟.溶液浓是绿色,稀是蓝绿色或蓝色。
高中化学方程式大全(可打印版)

第一章卤素第一节氯气L 2Na+a. >2Naa2、Cu +6 址》a】cr■J3、2Fe + 3C12' " >2FeCl34、H2+CI2 EE >2HC15、2P + 3CL >2PC136、PCI3+CI2 1旳57、Cl?+H2OTHCI+HC1O8、2Ca (OH),+2C1, TCa (CIO ),+CaCU + 2H,O9、Ca (C1O)2 +CO2 +H2O->CaCO3 +2HCO10、2NaOH +C1 T T NaClO + NaG + HQ11、4HQ +MnO2^-^MnQ2+2H2O + a2 T12、2KMnO4+16HG (浓)t ZMnQ? + 2KC1+50? T+8比Oword.13、2HC1O 见光»2HC1 +O.第二节氯化氢14、NaQ +H2SO4(浓)t NaHSO4 + HQ T15、NaHSO 4 + NaQ Na2SO4 + HQ T16、2NaQ +H2SO4(浓)-^Na2SO4+2Ha T (14、15 结合)17、HQ+AgNC)3 t AgCll+HNO ]18、NaQ + AgNO3 T AgCl I +NaNO 319、KQ + AgNO. AgG i +KNO 320、2Ha+CaCO3 CaQ 2+H2O + CO2 T第三节氧化还原反应21、CuO + H2」~^Cu+比022、C + 4HNO3 ^CO2 T+4NO2 T+2H2O23、4Zn + 10HNO3(极稀)-^4Zn (NO5)2 + NH4NO3+3H2O 24、11P +15Q1SO 4 + 24H.O T 5C U3P + 6H3PO4 + 15H2SO425.KQO 3 + 6HG (浓)-> 3C1? 丁KC1+3比026、4Mg + 10HNO3(极稀)-^->4Mg (NO3)2 + NH4NO3+3H2O27 、K2Cr2O7 +6Fe3O4 +31H2SO4 ^Cr2(SO4)3+9Fe2(SO4)3+K2SO428、2KNO3+3C + S->K2S+N2 T+3CO2 T第四节卤族元素29、H2 + F2—> 2HF30、H2 + Br2 t 2HBr31、H^+Ij —> 2HI■厶32、2NaBr +G2—> 2NaG + Br233、2KI+C1: T2KC1 + —34、2KI + Br2■-> 2KBr +1235、NaBr + AgNO3—> AgBr J +NaNO 336、KI + AgNO3 -> Agl I +KNO 3>2Ag+ Br 2第二章摩尔反应热第一节摩尔38、 C + O 2 - CO?+ 31HQ J39、 Mg + 2HG -^MgG 2+H 2 T第二节气体靡尔体积40、 Zn + 2HQ T ZnCl 2 + H 2第三节物质的量浓度41、 2NaOH + H2SO4 t NazSC^ + 2比0第四节反应热42、 C (固)+0 = (气)点燃气)+393・5kJ ■ ■43、 2H 2(气)+0,气)T 2HQ (气)+483・6kJ 44、 2H,气)+0,气)T 2HQ (液)+571・6kJ 45、 C (固)+HQ (气)(气)+H 、(气)—131・3kJ第三章硫硫酸第一节硫光照 37、2AgBr46、2Cu+S »Cu $47 Fe + S— FeS48、S + H°」~>H$■厶49、S + C >CS250、S + O2>SO251、3S + 6KOH^-^2K2S + K2SO4+3H2O 第二节硫的氢化物和氧化物52、H2S^-^H2+S^53、2H2S + 3O2(足),iff- >2H2O + 2SO254、2H2S + O2(不足)点燃 >2比O + 2SI55、2H,S + SO,点燃 >2H,O + 3Sl■ ■ ■56> H“S + Bi\ —> S >t +2HBr57、FcS + 2HCl ->FcCh+H$T■ ■58、CuSO4 + H2S -> CuS 4< +H2SO459、PbAs+H°S—>PbSl+2HAc■■word.60、H2S + NaOH ->NaHS + H2O61、NaHS + NaOH TNa?S + HQ62、H^S + 2NaOH t Na:»S + 2HQ (60、61 结合)63、比S + 2FCCI3->Sl+2FcC12+2HC164、H2SO4(稀)+FCSTFCSO4+H2ST65、SO2 + H2O O H2SO366、2SO. +O. < -^5- >2SO^67、SO3+H2O->H2SO468、Na2SO3+H2SO4 -> Na2SO4 + H2O+ SO2 T69、SO2+2NaOH Na2SO3 +H2O70、SO2+CaO ->CaSO 37k SO2+2Ca (OH)2->CaSO3i+H2O 72、SO2+CaSO3 + H2O^Ca (HSO3)273、SO2+2H2S-^3S>L+2H2O74、SO»>+Q•> + 2H-)O —> 2HC1 + H-)SO<75、SO^+Br, +2HjO —> 2HBr + H^SO,76、5SO2+2H2O + 2KMnO4 ^MnSO4+K2SO4 +2H2SO4 第三节硫酸的工业制法77、4FeS2 +11O2>2Fe2O3 +8SO, T78、2SO2+O2< >2SO379、H2O + SO3 TH2SO4第四节硫酸硫酸盐80、C + 2H2SO4(浓)—^CX)2 ? +2SO, T +2H,O81、S + 2H2SO4(浓)-^3SO2 T+2比082、P + H2SO4(浓)-^H?PO4 +SO2 T+2H2O83、H,S + H,SO4(浓)-^S + SO, +2H.O84、Cu +2H2SO4(浓)-^aiSO4+SO2 T+2H2O85、BaCl 2 + H2SO4—> BaSO4 I +2HC186、BaG = + Na ^SO4—» BaSO4 I +2NaCl87、BaCl 2 + Na 2CO ? t Ba8 3I +2NaCl88、BaCO3+2Ha -> BaG 2 + H2O + CO2 T89、BaCO3+2HNO3 -> Ba (NO3)2 +H2O + CX)2 T90、Na2CO3 + H2SO3 -> Na2S + H2O + CX)2 T91、2H2SO3+O2 ^-2H2SO492、2Na2SO3 +O2 -»2Na2SO493、2CaSO 3 + O、T 2CaSO 494、2Fe + 6H2SO4(浓)-^Fe2(SO4)3 +3SO2 T+6H2O95、2NaBr+2H2SO4(浓)-^Br2+SO2 T+Na2SO4 + H2O96、2NaQ +H2SO4(浓)-^Na2SO4+2HG T97、C{]H22O[}>12C + 11H2O第四章碱金属第一节钠98、4Na +O2—> 2Na2O99、2Na +O-> TNaQ。
高中化学方程式大全全)883_KB

高考总复习之高中化学方程式总结第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓)13、2O HCl 2HClO 2+−−→−见光 第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合)17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温 50、22SO O S −−→−+点燃51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物 52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足)55、↓+−−→−+S 3O H 2SO S H 2222点燃 56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+ 64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温 78、3OV 22SO 2O SO 252∆−−→←+ 79、4232SO H SO O H →+第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓) 82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+86、NaCl 2BaSO SO Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨 102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃 123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
整理高中化学方程式大全【打印版】

整理高中化学方程式大全【打印版】文件编号: E6-39-C8-B3-9F整理人尼克高中化学方程式大全打印版高中常见化学方程式带*为非必背内容一、体现单质的氧化性1.非金属单质的氧化性F2 + H2===2HF(反应现象)2F2 +2H2O ===4HF+O2(体现F的非金属性强于O)Cl2 +H2===2HCl(反应情况;工业制盐酸)3Cl2 +2Fe 2FeCl3(体现氯气的强氧化性;现象:黄烟)Cl2 +2FeCl2 === 2FeCl3(将Fe2+→Fe3+;体现Cl2氧化性大于Fe3+;离子方程式)Cl2+Cu CuCl2(体现氯气的强氧化性;现象:黄烟)2Cl2+2NaBr === 2NaCl+Br2(体现非金属性:Cl>Br;海水提溴;离子方程式)Cl2 +2NaI === 2NaCl+I2(体现非金属性:Cl>I;海带提碘;离子方程式)Cl2+SO2 +2H2O === H2SO4 +2HCl(混合后漂白性减弱,尾气处理)Br2+SO2 +2H2O===H2SO4+2HBr(Br2水褪色;SO2还原性;)2O2 +3Fe Fe3O4(现象:剧烈燃烧,火星四射,生成黑色固体;产物的特点)S+Fe FeS(低价产物;产物特征)S+2Cu Cu2S(低价产物;产物特征)N2+3H22NH3(工业制备NH3;N2、NH3的电子式)2.含氧酸的氧化性2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O(浓硫酸的强氧化性)2H2SO4(浓)+C CO2↑+2SO2↑+2H2O(浓H2SO4的强氧化性;蔗糖发泡)2H2SO4(浓)+S===3SO2↑+2H2OH2SO4+Fe(Al) 室温下钝化(浓H2SO4的强氧化性)6H2SO4(浓)+2Fe Fe2(SO4)3+3SO2↑+6H2O(破坏钝化后的反应,加热)4HNO3(浓)+C===CO2↑+4NO2↑+2H2O4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O8HNO3(稀)+3Cu===3Cu(NO3)2+2NO↑+4H2OFe2++2H++NO3-=Fe3++NO2↑+H2O(Fe2+与NO3-在酸性条件下不能共存)3.高价盐的氧化性2FeCl3+Fe===3FeCl2(离子方程式)2FeCl3+Cu===2FeCl2+CuCl2(制作电路板;离子方程式)2FeCl3+2KI===2FeCl2+2KCl+I2(Fe3+与I-不能共存)二、体现单质的还原性1.非金属的还原性S+O2 SO2(工业制取SO2)放电N2+O2 2NO(条件;打雷;汽车尾气;高压静电等)2C+O2(少量)2CO(氧气不足)C+O2(足量)CO2(氧气过量)C+CO22CO(有C参加反应,吸热反应)C+H2O CO+H2(生成水煤气;吸热反应)*C+MgO Mg+2CO (Mg的冶炼)*2C+SiO Si+2CO(C少量、工业制得粗硅)*【Si(粗)+2Cl2SiCl4 ;SiCl4+2H2Si(纯)+4HCl(工业提纯Si)】3H2+Fe2O32Fe+3H2O (制还原铁粉)4H2+Fe3O43Fe+4H2O2.金属单质(Na、Al、Fe、Cu)的还原性4Na+O2===2Na2O(Na在空气中放置的颜色变化)2Na2O+O2Na2O2(转化,颜色:淡黄色)2Na+O Na2O2(焰色反应;电子式)2Na+2H2O===2NaOH+H2↑(实验现象;离子方程式;同族置换;Na着火的扑灭方法;Na的保存)*4Na+TiCl4(熔融)4NaCl+Ti(Ti的冶炼;体现Na的强还原性)Mg+2H2O Mg(OH)2+H2↑(滴入酚酞变红,常温不反应)4Al+3O2===2Al2O3(钝化、钝化是化学变化)4Al+3MnO22Al2O3+3Mn(铝热反应、冶炼Mn)2Al+Fe2O3Al2O3+2Fe(铝热反应、冶炼Fe)2Al+6H2SO4(浓) Al2(SO4)3+3SO2↑+6H2O(加热钝化消除)(Al、Fe在冷、浓的H2SO4、HNO3中钝化)2Al+3H2SO4===Al2(SO4)3+3H2↑(Al的两性;离子方程式)2Al+2NaOH+2H2O===2NaAlO2+3H2↑(Al可溶于强碱液;离子方程式;量关系)2Fe+3Br2===2FeBr3(对比Fe与I2反应,生成三价铁)Fe+I2===FeI2(对比Fe与Br2反应,生成二价铁)3Fe+4H2O(g)Fe3O4+4H2(实验;产物)3.化合物的还原性4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O(Cl2实验室制法;离子方程式)*16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O(Cl2实验室制法;离子方程式)*2NH3+3CuO3Cu+N2+3H2O(体现NH3的还原性;现象)2NH3+3Cl2===N2+6HCl(体现非金属性:Cl>N)8NH3+3Cl2===N2+6NH4Cl(氯气过量;现象:产生白烟;用途:检查氯气管道泄漏)4NH3+3O2(纯氧)2N2+6H2O(体现非金属性:O>N)4NH3+5O24NO+6H2O(工业用途,氨气的催化氧化)2SO2+O22SO3(用途:工业制硫酸;可逆反应)*2SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应,形成酸雨)2NO+O2===2NO2(制备HNO3;无色变红棕色)*NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)CO+CuO Cu+CO2(固体颜色变化;除去CO气体;冶炼金属)3CO+Fe2O32Fe+3CO2(工业炼铁)*3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O(硝酸不能用来制备SO2)2Na2SO3+O2===2Na2SO4(药品保存)*6FeO+O22Fe3O4(FeO不稳定)*FeO+4HNO3===Fe(NO3)3+NO2↑+2H2O4Fe(OH)2+O2+2H2O===4Fe(OH)3(白色沉淀迅速转变为灰绿色,最后变为红褐色)*Cu2S+O22Cu+SO2(火法炼Cu)H2O2+2I-+2H+===I2+2H2O(海带提I2)三、歧化反应Cl2+H2O===HCl+HClO(Cl2具有漂白性、可用来消毒的原因;Cl2可用排饱和食盐水收集;离子方程式)Cl2+2NaOH===NaCl+NaClO+H2O(制漂白粉;吸收Cl2;离子方程式)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O(制漂白粉;离子方程式)*3C+SiO2SiC+2CO(C足量,制备金刚砂)2Na2O2+2CO2===2Na2CO3+O2(潜艇供O2;实验中将CO2转变成O2;电子转移)2Na2O2+2H2O===4NaOH+O2↑3NO2+H2O===2HNO3+NO(NO2被水吸收制HNO3;NO2不是硝酸酐;不能全部被吸收)四、化合、复分解反应SO2+H2O H2SO3(SO2溶于水;SO2为H2SO3的酸酐)SO3+H2O===H2SO4(工业制H2SO4;SO3为H2SO4的酸酐)N2O5+H2O===2HNO3(N2O5为HNO3的酸酐)Na2O+H2O===2NaOH (极活泼金属氧化物和水反应生成碱)NH3+HCl===NH4Cl(现象:产生白烟;互相检验)NH3+HNO3===NH4NO3(现象:白烟;互相检验)2NH3+H2SO4===(NH4)2SO4SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(离子方程式;类比)(这是硫酸厂回收SO2的反应:先用氨水吸收SO2,再用H2SO4处理:2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(也可用石灰乳吸收SO2;不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO2+2NaOH===Na2SO3+H2O(实验室吸收SO2)SO2+H2O+2NaOH===2NaHSO3(SO2过量)*SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3(理解上述两个反应的原理,类比SO2)CO2+Ca(OH)2(过量)===CaCO3↓+H2O(鉴别CO2)2CO2(过量)+Ca(OH)2===Ca(HCO3)2(类比上两个反应)SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃;碱性物质试剂瓶的塞子不能用玻璃塞;铝土矿提纯;离子方程式;硅酸钠水溶液俗名水玻璃)Al2O3+6H+===2Al3++3H2OAl2O3+2OH-===2AlO2-+H2O (Al2O3是两性氧化物;离子方程式)FeO+2H+===Fe2++2H2O(原理;离子方程式)Fe2O3+6H+===2Fe3++3H2O(原理;离子方程式)2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑(实验室制NH3)FeCl2+2NaOH ===Fe(OH)2↓+2NaCl(离子方程式)AlCl3+3NaOH ===Al(OH)3↓+3NaCl (NaOH不足;生成白色沉淀;离子方程式)AlCl3+4NaOH ===NaAlO2+3NaCl (NaOH 过量;白色沉淀溶解;离子方程式)Al(OH)3 +3H+===Al3++3H2OAl(OH)3 +NaOH ===NaAlO2+2H2O (Al(OH)3的两性;离子方程式)NH4Cl +NaOH NaCl+NH3↑+H2O(铵盐的检验,生成有刺激性气味的气体)MgCl2+2NH3·H2O===Mg(OH)2↓+2NH4Cl(氨水的碱性)AlCl3+3NH3·H2O=== Al(OH)3↓+3NH4Cl [制备Al(OH)3;离子方程式;不能进一步反应] FeCl3+3NH3·H2O===Fe(OH)3↓+3NH4ClCO2+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3NaAlO2+HCl+H2O===Al(OH)3↓+NaCl (HCl不足;生成白色沉淀;离子方程式)NaAlO2+4HCl===AlCl3↓+NaCl+2H2O (HCl 过量;白色沉淀溶解;离子方程式)CO2+C6H5ONa+H2O===C6H5OH+NaHCO3(CO2气体可使C6H5ONa溶液变浑浊;只能生成NaHCO3;证明酸性:H2CO3>C6H5OH;强酸换弱酸规律)Na2CO3+HCl===NaCl+NaHCO3(离子方程式;盐酸不足;互相滴加现象)Na2CO3+2HCl===H2O+CO2↑+2NaCl(离子方程式;盐酸过量;强酸换弱酸规律;分步反应)Na2SiO3+2HCl===H2SiO3↓+2NaCl(离子方程式;强酸换弱酸规律)NaHCO3+HCl===NaCl+H2O+CO2↑(离子方程式;中和胃酸)3NaHCO3+AlCl3===Al(OH)3↓+3CO2↑+3NaCl(泡沫灭火器工作原理;双水解反应)4HF+SiO2===SiF4↑+2H2O(SiO2的特性;雕刻玻璃;HF弱酸,酸性小于H2CO3)*NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(原理;此反应用于工业制备小苏打,苏打;试剂通入的顺序)SiO2+CaO CaSiO3SO3+CaO === CaSO4(酸性氧化物与碱性氧化物反应)五、不稳定性光2HClO 2HCl+O2↑(久置氯水的漂白性减弱)NH3·H2O NH3↑+H2O2H2O2H2O+O2↑(H2O2的电子式;不稳定性;电子转移;用途)H2SiO SiO2+H2O (难溶酸加热生成同价态的非金属氧化物和H2O)Mg(OH)2 MgO+H2O2Al(OH)Al2O3+3H2O2Fe(OH)Fe2O3+3H2OCu(OH)2 CuO+H2O (以上反应:难溶性碱加热生成同价态的金属氧化物和H2O)NH4Cl NH3+HCl(不能用来制备NH3;铵盐都不稳定)NH4HCO NH3↑+H2O↑+CO2↑(碳铵不稳定)2KMnO K2MnO4+MnO2+O2↑(实验室制备O2)2KClO2KCl+3O2↑(实验室制备O2)2NaHCO Na2CO3+H2O+CO2(碳酸氢盐不稳定;除杂:Na2CO3中含NaHCO3)Ca(HCO3)CaCO3+H2O+CO2(碳酸氢盐不稳定,受热分解成碳酸盐和H2O和CO2)CaCO3CaO+CO2↑2HgO 2Hg+O2↑2Ag2O 4Ag+O2↑六、电解MgCl2(熔融) Mg+Cl2↑2Al2O3(熔融) 4Al+3O2↑2NaCl(熔融) 2Na+Cl2↑2NaCl+2H2O 2NaOH+Cl2↑+H2↑(氯碱工业;电解饱和食盐水)电解溶液需具体问题具体分析七、水解反应Al3++3H2O Al(OH)3+3H+(铝盐显酸性;明矾净水)Fe3++3H2O Fe(OH)3+3H+(铁盐显酸性;铁盐净水)NH4++H2O NH3·H2O+H+(按盐水溶液显酸性)CO32-+H2O HCO3-+OH-(Na2CO3溶液显碱性;纯碱去污)CaSO4+Na2CO3 === CaCO3+Na2SO4(锅炉除水垢)3Mg(OH)2+2Fe3+ ===2 Fe(OH)3↓+3Mg2+(生成更难溶的物质)八、原电池钢铁的析氢腐蚀负极正极总反应钢铁的吸氧腐蚀负极正极总反应整理丨尼克本文档信息来自于网络,如您发现内容不准确或不完善,欢迎您联系我修正;如您发现内容涉嫌侵权,请与我们联系,我们将按照相关法律规定及时处理。
高中化学方程式大全打印版

高中化学方程式大全打印版(1) 硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl(2) 碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl(3) 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑(4) 木炭还原氧化铜: 2CuO + C(高温) 2Cu + CO2↑(5) 氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+2NaCl(6) 氧化物的反应a) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Ob) 氧化钙与水反应:CaO + H2O = Ca(OH)2c) 氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2Od) 氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2Oe) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl(7) Na的化学反应方程式a) 钠在空气中燃烧:4Na + O2 = 2Na2Ob) 钠与氧气反应: 2Na + O2 △ Na2O2 过氧化钠c) 过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑d) 过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2e) 钠与水反应:2Na + 2H2O = 2NaOH + H2↑(8) Fe及化合物的化学反应方程式a) 铁与水蒸气反应:3Fe + 4H2O(g) = 高温=F3O4 + 4H2↑b) 铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cuc) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Od) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCle) 硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4f) 氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 =4Fe(OH)3g) 氢氧化铁加热分解:2Fe(OH)3 △ Fe2O3 + 3H2O↑h) 三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2i) 氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3(9) Al及其化合物的化学反应方程式a) 铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑b) 实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH3)2SO4c) 氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2Od) 氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2Oe) 氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2Of) 二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2Og) 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑h) 二氧化硅与氧化钙高温反应:SiO2 + CaO 高温 CaSiO3i) 二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2Oj) 往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓k) 硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓(10) Cl及其化合物的反应方程式a) 氯气与金属铁反应:2Fe + 3Cl2 点燃 2FeCl3b) 氯气与金属铜反应:Cu + Cl2 点燃 CuCl2c) 氯气与金属钠反应:2Na + Cl2 点燃 2NaCld) 氯气与水反应:Cl2 + H2O = HCl + HClOe) 次氯酸光照分解:2HClO 光照 2HCl + O2↑g) 氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2Oh) 盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3i) 漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO(11) N及其化合物的反应方程式a) 氮气与氧气在放电下反应:N2 + O2 放电 2NOb) 一氧化氮与氧气反应:2NO + O2 = 2NO2c) 二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NOd) 二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂2SO3e) 三氧化硫与水反应:SO3 + H2O = H2SO4(12) 氨及其反应方程式a) 氨水受热分解:NH3·H2O △ NH3↑ + H2Ob) 氨气与氯化氢反应:NH3 + HCl = NH4Clc) 氯化铵受热分解:NH4Cl △ NH3↑ + HCl↑d) 碳酸氢氨受热分解:NH4HCO3 △ NH3↑ + H2O↑ + CO2↑e) 硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ + NaNO3 + H2Of) 氨气的实验室制取:2NH4Cl + Ca(OH)2 △ CaCl2 + 2H2O + 2NH3↑g) 氯气与氢气反应:Cl2 + H2 点燃 2HClh) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O。
高考必考化学方程式汇总(适合打印)

高考必考化学方程式汇总(适合打印)————————————————————————————————作者:————————————————————————————————日期:2高考化学方程式大全一、非金属单质(F2、Cl2、O2、S、N2、P、C、Si)(1)、氧化性F2 + H2=2HF (冷暗处爆炸)2F2 +2H2O=4HF+O2F2 +2NaX=2NaX+Cl2(熔融,不能是溶液)Cl2 +H2=2HCl (光照或点燃)Cl2 +2Na点燃2NaCl3Cl2 +2Fe点燃2FeCl3Cl2 +2FeCl2=2FeCl3Cl2+Cu点燃CuCl22Cl2+2NaBr=2NaCl+Br2Cl2 +2NaI =2NaCl+I2Cl2 +Na2S=2NaCl+S↓Cl2+SO2 +2H2O=H2SO4 +2HCl2O2 +3Fe点燃Fe3O4S+H2△H2SS+Fe△FeSS+2Cu△Cu2S3S+2Al△Al2S3N2+3H2催化剂高温高压2NH3N2+3Mg△Mg3N2P4+6H2△4PH3(2)、还原性S+O2点燃SO2N2+O2=2NO(放电)4P+5O2点燃P4O10(常写成P2O5)2C+O2(少量)点燃2COC+O2(足量)点燃CO2C+H2O高温CO+H2(生成水煤气)2C+SiO2△Si+2CO(制得粗硅)Si+2NaOH+H2O=Na2SiO3+2H2↑(3)、歧化Cl2+H2O=HCl+HClO(加酸抑制歧化、加碱或光照促进歧化)Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热、浓)=5KCl+KClO3+3H2O 3S+6NaOH△2Na2S+Na2SO3+3H2O3C+CaO电炉CaC2+CO↑3C+SiO2电炉SiC+2CO↑二、金属单质(Na、Mg、Al、Fe)- 1 -(1)、还原性4Na+O2=2Na2O2Na2O+O2△2Na2O22Na+2H2O=2NaOH+H2↑Mg+2H2O△Mg(OH)2+H2↑2Mg+CO2点燃2MgO+C2Al+3Cl2△2AlCl34Al+3O2点燃2Al2O3(钝化)4Al+3MnO2高温2Al2O3+3Mn2Al+Cr2O3高温Al2O3+2Cr2Al+Fe2O3高温Al2O3+2Fe2Al+3FeO△Al2O3+3FeAl+4HNO3(稀)=Al(NO3)3+NO↑+2H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Fe+3Br2=2FeBr3Fe+I2△FeI2Fe+S△FeS3Fe+4H2O(g)高温Fe3O4+4H2三、非金属氢化物(HF、HCl、H2O、H2S、NH3)(1)、还原性4HCl(浓)+MnO2△MnCl2+Cl2+2H2O16HCl+2KMnO4=2KCl+2MnCl2+5Cl2+8H2O 2H2O+2F2=4HF+O22H2S+3O2(足量)=2SO2+2H2O2H2S+O2(少量)=2S+2H2O2H2S+SO2=3S+2H2OH2S+H2SO4(浓)=S↓+SO2+2H2O2NH3+3CuO△3Cu+N2+3H2O2NH3+3Cl2=N2+6HCl8NH3+3Cl2=N2+6NH4Cl4NH3+3O2(纯氧)点燃2N2+6H2O4NH3+5O2催化剂△4NO+6H2O4NH3+6NO催化剂△5N2+6HO(用氨清除NO) NaH+H2O=NaOH+H2(2)、酸性H2S+FeCl2=不反应(3)、碱性NH3+HCl=NH4Cl(白烟)NH3+HNO3=NH4NO3(白烟)NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl (侯氏制碱法)(此反应用于工业制备小苏打、苏打)(4)、不稳定性2HI△H2+I22H2O电解2H2↑+O2↑- 2 -2H2O2=2H2O+O2↑H2S△H2+S四、非金属氧化物(1)、低价态的还原性2SO2+O2催化剂△2SO32SO2+O2+2H2O=2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O=H2SO4+2HClSO2+Br2+2H2O=H2SO4+2HBrSO2+I2+2H2O=H2SO4+2HINO+NO2+2NaOH=2NaNO2+H2O(用于制硝酸工业中吸收尾气中的NO和NO2)CO+CuO△Cu+CO23CO+Fe2O3△2Fe+3CO2CO+H2O催化剂△CO2+H2(2)、氧化性SO2+2H2S=3S+2H2O2Mg + CO2点燃2MgO+C(CO2不能用于扑灭由Mg、Ca、Ba、Na、K等燃烧的火灾) (3)、与水的作用SO2+H2O=H2SO3SO3+H2O=H2SO43NO2+H2O=2HNO3+NO(4)、与碱性物质的作用SO2+2NH3+H2O=(NH4)2SO3SO2+ (NH4)2SO3+H2O=2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2、再用H2SO4处理2NH4HSO3+H2SO4=(NH4)2SO4+2H2O+2SO2↑生成的硫酸铵作化肥、SO2循环作原料气)SO2+Ca(OH)2=CaSO3↓+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别) CO2+2NaOH(过量)=Na2CO3+H2OCO2(过量)+NaOH=NaHCO3CO2+Ca(OH)2(过量)=CaCO3↓+H2O2CO2(过量)+Ca(OH)2=Ca(HCO3)2CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3CO2+C6H5ONa+H2O=C6H5OH+NaHCO3SiO2+2NaOH=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3高温Na2SiO3+CO2↑SiO2+CaCO3高温CaSiO3+CO2↑五、金属氧化物(1)、低价态的还原性FeO+4HNO3=Fe(NO3)3+NO2↑+2H2O(2)、氧化性Fe2O3+3H2=2Fe+3H2O (制还原铁粉)- 3 -Fe3O4+4H2△3Fe+4H2O(3)、与水的作用Na2O+H2O=2NaOH2Na2O2+2H2O=4NaOH+O2↑(此反应分两步Na2O2+2H2O=2NaOH+H2O2 ;2H2O2=2H2O+O2↑. H2O2的制备可利用类似的反应BaO2+H2SO4(稀)=BaSO4+H2O2)(4)、与酸性物质的作用Na2O+SO3=Na2SO4Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl+H2O2Na2O2+2CO2=2Na2CO3+O2Al2O3+3H2SO4=Al2(SO4)3+3H2O(Al2O3是两性氧化物Al2O3+2NaOH=2NaAlO2+H2O)FeO+2HCl=FeCl2+3H2OFe2O3+6HCl=2FeCl3+3H2OFe3O4+8HCl(浓)△FeCl2+2FeCl3+4H2O六、含氧酸(1)、氧化性HClO+H2SO3=H2SO4+HCl2H2SO4(浓)+C△CO2↑ +2SO2↑+2H2O2H2SO4(浓)+S=3SO2↑+2H2O2H2SO4(浓)+Cu△CuSO4+SO2↑+2H2OH2SO4(浓)+2HBr△SO2+Br2+2H2OH2SO4(稀)+Fe=FeSO4+H2↑2H2SO3+2H2S=3S↓+2H2O4HNO3(浓)+C△CO2↑+4NO2↑+2H2O* 6HNO3(浓)+S=H2SO4+6NO2↑+2H2O6HNO3+Fe=Fe(NO3)3+3NO2↑+3H2O4HNO3+Fe=Fe(NO3)3+NO↑+2H2O(2)、还原性H2SO3+X2+H2O=H2SO4+2HX (X表示Cl2、Br2、I2) 2H2SO3+O2=2H2SO4H2SO3+H2O2=H2SO4+H2O5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HCl(3)、酸性H2SO4(浓)+NaCl△NaHSO4+HCl↑H2SO4(浓) +2NaCl Na2SO4+2HClH2SO4(浓)+NaNO3△NaHSO4+HNO3↑(微热)(4)、不稳定性2HClO=2HCl+O2↑(见光或受热分解)4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)七、碱(1)、低价态的还原性4Fe(OH)2+O2+2H2O=4Fe(OH)3强热- 4 -(2)、与酸性物质的作用2NaOH+SO2(少量)=Na2SO3+H2ONaOH+SO2(足量)=NaHSO32NaOH+SiO2=Na2SiO3+H2O2NaOH+Al2O3=2NaAlO2+H2O2NaOH+Cl2=NaCl+NaClO+H2ONaOH+HCl=NaCl+H2ONaOH+H2S(足量)=NaHS+H2O2NaOH+H2S(少量)=Na2S+2H2O3NaOH+AlCl3=A l(O H)3↓+3NaClNaOH+Al(OH)3=NaAlO2+2H2ONaOH+NH4Cl△NaCl+NH3↑+H2O(3)、不稳定性Mg(OH)2△MgO+H2O2Al(OH)3△Al2O3+3H2O2Fe(OH)3△Fe2O3+3H2OCu(OH)2△CuO+H2O八、盐(1)、氧化性2FeCl3+Fe=3FeCl22FeCl3+Cu=2FeCl2+CuCl2 (用于雕刻铜线路版)2FeCl3+Zn=2FeCl2+ZnCl22FeCl3+H2S=2FeCl2+2HCl+S↓2FeCl3+2KI=2FeCl2+2KCl+I2(2)、还原性2FeCl2+Cl2=2FeCl3(3)、与碱性物质的作用MgCl2+2NH3·H2O=Mg(OH)2↓+NH4ClAlCl3+3NH3·H2O=Al(OH)3↓+3NH4ClFeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl(4)、与酸性物质的作用Na2CO3+HCl=NaHCO3+NaClNaHCO3+HCl=NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl 3Na2CO3+2FeCl3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl 3NaHCO3+AlCl3=Al(OH)3↓+3CO2↑3NaHCO3+FeCl3=Fe(OH)3↓+3CO2↑3Na2S+Al2(SO4)3+6H2O=2Al(OH)3↓+3H2S↑3NaAlO2+AlCl3+6H2O=4Al(OH)3↓(5)、不稳定性Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2ONH4HCO3=NH3+H2O+CO22KMnO4△K2MnO4+MnO2+O2↑2KClO3△2KCl+3O2↑2NaHCO3△Na2CO3+H2O+CO2↑Ca(HCO3)2△CaCO3+H2O+CO2↑CaCO3高温CaO+CO2↑- 5 -九、其他方程式AlCl3 + 4NaOH = NaAlO2 + 3NaCl +2H2OAl4C3 + 12H2O = 4Al(OH)3↓ + 3CH4↑(碳化物氮化物的水解)AgNO3 + NaCl =AgCl↓ + NaNO32AgCl=2Ag + Cl2↑(见光或受热)2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HClBaCl2 + H2SO4= BaSO4↓ + 2HClSOCl2 + H2O = 2HCl + SO2↑6NO + 4NH3催化剂△5N2 + 6H2O28、3Fe2+ + NO3― + 4H+= 3Fe3+ + NO↑ + 2H2O29、2S2― + SO32― +6H+=3S↓ + 3H2O33、Fe2O3 + 6H+ +2I―= 2Fe2+ + I2 + 3H2O34、Al3+ + 3HCO3―= Al(OH)3↓+ 3CO2↑35、2H+ + [Ag(NH3)2]+= Ag+ + 2NH4+36、HS― + OH―= S2― + H2O38、Cr2O72― + 6Fe2+ + 14H+= 2Cr3+ + 6Fe3+ + 7H2O39、2I― + Cl2= 2Cl― + I241、2Fe2+ + 4Br― + 3Cl2= 2Fe3+ + 2Br2 + 6Cl―42、2MnO4― + 5H2O2 + 6H+= 2Mn2+ + 8H2O + 5O2↑44、3Ca2+ + 6H2PO4― + 12OH―=Ca3(PO4)2 ↓ + 12H2O + 4PO43―45、4H+ + NO3― + 3Fe2+= 3Fe3+ + NO↑ + 2H2OFe3+ + SCN―= [Fe(SCN)]2+46、2Na + 2H2O = 2Na+ + 2OH― + H2↑Fe2+ + 2OH―= Fe(OH)2↓4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)347、S2O32― + 2H+=S↓ + SO2 + H2O51、对KCl溶液,阳极:2Cl - 2e = Cl2↑阴极:2H + 2e = H2↑对CuSO4溶液,阳极:4OH - 4e = 2H2O + O2↑阴极:2Cu2+ + 4e = 2Cu2NaCl + 2H2O电解2NaOH + H2↑+ Cl2↑2NO + O2 = 2NO22H2O22H2O + O2↑有机化学反应方程式:1、甲烷的主要化学性质(1)氧化反应CH4(g)+2O2(g)−−→−点燃CO2(g)+2H2O(l)(2)取代反应2、乙烯的乙烯的主要化学性质- 6 -- 7 -(1)氧化反应:C 2H 4+3O 2 −−→−点燃2CO 2+2H 2O(2)加成反应乙烯还可以和氢气、氯化氢、水等发生加成反应。
(2021年整理)高中化学方程式大全(完整版)

高中化学方程式大全(完整版)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学方程式大全(完整版))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学方程式大全(完整版)的全部内容。
第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓)13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆ 22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃 43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆ 47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆ 49、2CS C S −−→−+高温50、22SO O S −−→−+点燃51、O H 3SO K S K 2KOH 6S 32422++−→−+∆ 第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足) 54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合)63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3O V 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3O V 22SO 2O SO 252∆−−→←+ 79、4232SO H SO O H →+第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓)82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+86、NaCl 2BaSO SO Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓)95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SO H 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆ 113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)( 120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
(word完整版)高中化学方程式大全(绝对全)883KB,文档

高中化学方程式总结高考总复习之高中化学方程式总结化学第一册第一章卤素第一节氯气1、2Na Cl 2点燃2NaCl2、Cu Cl点燃CuCl 2 23、2Fe3Cl 2点燃2FeCl34、H2Cl点燃〔光照〕2HCl25、2P3Cl 2点燃2PCl36、PCl3Cl 2PCl 57、Cl2H 2 O HCl HClO8、2Ca〔OH〕22Cl 2Ca〔 ClO 〕2CaCl 22H 2O9、Ca〔ClO〕2CO2 H 2O CaCO 32HClO10、2NaOH Cl2NaClO NaCl H 2 O11、4HCl MnO 2MnCl 2 2H 2 O Cl 212、2KMnO416HCl 〔浓〕2MnCl 22KCl5Cl 28H 2 O13、2HClO 见光2HCl O 2第二节氯化氢14、NaCl H 2SO〔4浓〕NaHSO 4HCl15、NaHSO4NaCl Na 2SO4HCl16、2NaCl H 2SO〔4浓〕Na 2 SO42HCl〔 14、15 结合〕17、HCl AgNO 3AgCl HNO 318、NaCl AgNO 3AgCl NaNO 319、KCl AgNO 3AgCl KNO 320、2HCl CaCO 3CaCl 2H 2 O CO 2第三节氧化复原反响21、CuO H 2Cu H 2O22、C4HNO 3CO 24NO 22H 2O23、4Zn10HNO 〔3极稀〕4Zn〔 NO 3〕2NH 4NO 33H 2O24、11P15CuSO424H2O5Cu 3 P6H 3PO415H 2SO 425、KClO36HCl 〔浓〕3Cl 2KCl3H 2O26、4Mg〔极稀〕4Mg〔〕NH 4NO 33H 2O 10HNO 3NO 3227、K2Cr 2 O 76Fe3O 431H 2SO 4Cr〔 SO 〕9Fe〔 SO 〕 K 2 SO4 31H2O2 4 32 4 328、2KNO33C S K2S N 23CO 2第四节卤族元素29、H2F22HF30、H2Br22HBr31、H2I 22HI32、2NaBr Cl 22NaCl Br 233、2KI Cl34、2KI Br 222KCl I2KBr I2235、NaBr AgNO3AgBr NaNO 336、KI AgNO3AgI KNO 337、2AgBr光照2Ag Br 2第二章摩尔反响热第一节摩尔38、 C O 2 CO 239、 Mg 2HCl MgCl 2H 2第二节 气体摩尔体积40、 Zn 2HCl ZnCl 2H 2第三节物质的量浓度41、 2NaOH H 2SO 4Na 2SO 4 2H 2O第四节反响热42、 C 〔固〕 O 〔气〕2 点燃CO 〔气〕243、 2H 〔气〕2 O 〔气〕2 2H 2 O 〔气〕 44、 2H 〔气〕2 O 〔气〕2 2H 2 O 〔液〕45、 C 〔固〕 H 2 O 〔气〕CO 〔气〕 H 〔2气〕第三章硫 硫酸第一节硫46、 2Cu SCu 2S47、 Fe S FeS48、 S H 2H 2S49、 SC高温CS 250、 S O 2 点燃SO 251、 3S 6KOH2K 2S K 2SO 43H 2O第二节硫的氢化物和氧化物52、 H 2SH 2 S53、 2H 2S 3O 2 (足〕点燃2H 2O2SO 254、 2H 2SO 2( 缺乏〕点燃2H 2O 2S55、 2H 2SSO点燃2H 2O 3S 256、 H 2S Br 2S2HBr57、FeS2HCl FeCl 2H 2 S58、CuSO4H 2S CuS H 2SO459、PbAc2H 2S PbS2HAc60、H2S NaOH NaHS H 2 O61、NaHS NaOH Na 2 S H 2O62、H2S2NaOH Na 2S2H 2 O 〔60、61结合〕63、H2S2FeCl 3S2FeCl 22HCl64、H2SO〔4稀〕FeS FeSO4H 2 S65、SO2H 2OH 2SO366、2SO2V 2O52SO3 O 267、SO3H 2O H2SO468、Na2SO 3H 2SO4Na 2SO 4H 2O SO269、SO22NaOH Na 2SO3H 2O70、SO2CaO CaSO371、SO22Ca〔 OH 〕CaSO3H2O272、SO2CaSO3H 2O Ca〔HSO 3〕273、SO22H 2S3S2H 2O74、SO2Cl 22H 2O2HCl H2SO475、SO2Br22H 2O2HBr H 2SO476、5SO22H2O2KMnO 4MnSO 4 K 2 SO 4 2H 2 SO4第三节硫酸的工业制法77、4FeS211O 2高温2Fe2O38SO278、2SO2O 2V 2O52SO379、H2O SO3H2SO4第四节硫酸硫酸盐80、C 2H 2SO〔4浓〕CO 22SO 22H 2O81、S 2H2SO〔4浓〕3SO 22H 2O82、P H 2SO〔4浓〕H3PO4 SO22H 2O83、H2S H2SO〔4浓〕S SO22H 2O84、Cu2H 2 SO〔4浓〕CuSO 4SO22H 2O85、BaCl2H 2SO4BaSO 42HCl86、BaCl2Na 2 SO4BaSO42NaCl87、BaCl2Na 2 CO3BaCO 32NaCl88、BaCO32HCl BaCl 2H 2 O CO 289、BaCO32HNO 3Ba〔 NO 3〕2H 2O CO 290、Na2CO3H 2SO3Na 2 S H2O CO291、2H2SO3O 22H 2SO 492、2Na2SO3O 22Na 2 SO493、2CaSO3O 22CaSO494、2Fe 6H 2SO〔4浓〕Fe〔2 SO 4〕3 3SO 26H 2O95、2NaBr2H 2 SO〔4浓〕Br 2SO2Na 2SO4 H 2O96、2NaCl H 2SO〔4浓〕Na 2 SO 4 2HCl97、C11H22O11浓H 2SO412C11H 2O第四章碱金属第一节钠98、4Na O 22Na 2 O100、2Na Cl点燃2NaCl2101、2Na S研磨Na 2S102、2Na2H 2O2NaOH H 2103、2Na2H 2O CuSO 4Cu〔 OH 〕2 Na 2 SO4 H 2第二节钠的氧化物104、Na2O H 2 O2NaOH105、2Na2O22H 2O4NaOH O 2106、Na2O CO 2Na 2 CO 3107、2Na2O22CO 22Na 2CO 3O 2108、Na2O2HCl2NaCl H 2 O109、Na2O24HCl4NaCl2H 2O O 2110、Na2CO32HCl2NaCl CO 2H 2 O111、NaHCO3HCl NaCl CO 2H 2 O112、2NaHCO3Na 2 CO 3CO 2H 2 O113、NaHCO3NaOH Na 2 CO 3H 2 O114、2NaHCO3Ca 〔OH〕〔少量〕CaCO 3Na 2 CO 3 2H 2 O 2115、NaHCO3〔〕〔足量〕CaCO 3NaOH H 2 O Ca OH2116、Na2CO3BaCl 2BaCO 32NaCl 117、Na2CO3CaCl 2CaCO 32NaCl118、Ca 〔HCO〕2HCl CaCl 22CO 22H 2O3 2119、Ca〔HCO3〕22NaOH CaCO 3Na 2 CO 3 2H 2 O 120、NaHSO3HCl NaCl SO2H 2 O第三节碱金属元素121、4Li点燃2Li 2 O O 2122、K O点燃KO 22123、2M X 22MX 〔M表示氧族元素,X代表卤族元素〕124、2M H 22MH125、2M2H 2O2MOH H 2第五章物质结构元素周期律本章内容、性质特别,所有化学反响方程式均融在其他章节中。
(word完整版)高中化学方程式大全(高考必备),推荐文档

目录一、高一化学方程式总结 (2)二、氯的化学方程式: (4)三、氯的离子方程式: (4)四、铝的化学反应方程式 (5)五、铜的化学反应方程式 (6)六、铁的化学方程式 (6)七、高中常用的离子方程式 (7)一、高一化学方程式总结(1) 硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl(2) 碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl(3) 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑(4) 木炭还原氧化铜: 2CuO + C(高温)2Cu + CO2↑(5) 氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl(6) 氧化物的反应a) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Ob) 氧化钙与水反应:CaO + H2O = Ca(OH)2c) 氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2Od) 氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2Oe) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl(7) Na的化学反应方程式a) 钠在空气中燃烧:4Na + O2 = 2Na2Ob) 钠与氧气反应:2Na + O2 △ Na2O2 过氧化钠c) 过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑d) 过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2e) 钠与水反应:2Na + 2H2O = 2NaOH + H2↑(8) Fe及化合物的化学反应方程式a) 铁与水蒸气反应:3Fe + 4H2O(g) = 高温=F3O4 + 4H2↑b) 铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cuc) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Od) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCle) 硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4f) 氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3g) 氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O↑h) 三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2i) 氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3(9) Al及其化合物的化学反应方程式a) 铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑b) 实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH3)2SO4c) 氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2Od) 氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2Oe) 氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2Of) 二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2Og) 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑h) 二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3i) 二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2Oj) 往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓ k) 硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓(10) Cl及其化合物的反应方程式a) 氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl3b) 氯气与金属铜反应:Cu + Cl2 点燃CuCl2c) 氯气与金属钠反应:2Na + Cl2 点燃2NaCld) 氯气与水反应:Cl2 + H2O = HCl + HClOe) 次氯酸光照分解:2HClO 光照2HCl + O2↑f) 氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2Og) 氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2Oh) 盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3i) 漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO(11) N及其化合物的反应方程式a) 氮气与氧气在放电下反应:N2 + O2 放电2NOb) 一氧化氮与氧气反应:2NO + O2 = 2NO2c) 二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NOd) 二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂2SO3e) 三氧化硫与水反应:SO3 + H2O = H2SO4(12) 氨及其反应方程式a) 氨水受热分解:NH3·H2O △NH3↑ + H2Ob) 氨气与氯化氢反应:NH3 + HCl = NH4Clc) 氯化铵受热分解:NH4Cl △NH3↑ + HCl↑d) 碳酸氢氨受热分解:NH4HCO3 △NH3↑ + H2O↑ + CO2↑e) 硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △NH3↑ + NaNO3 + H2Of) 氨气的实验室制取:2NH4Cl + Ca(OH)2 △CaCl2 + 2H2O + 2NH3↑g) 氯气与氢气反应:Cl2 + H2 点燃2HClh) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑ + Na2SO4 + 2H2Oi)(13) S及其化合物的化学反应方程式a) SO2 + CaO = CaSO3b) SO2 + 2NaOH = Na2SO3 + H2Oc) SO2 + Ca(OH)2 = CaSO3↓ + H2O d) SO2 + Cl2 + 2H2O = 2HCl + H2SO4e) SO2 + 2H2S = 3S + 2H2Of) 二氧化硫与水反应:SO2 + H2O ≈ H2SO3g) 浓硫酸与铜反应:Cu + 2H2SO4(浓) △CuSO4 + 2H2O + SO2↑h) 浓硫酸与木炭反应:C + 2H2SO4(浓) △CO2 ↑+ 2SO2↑ + 2H2Oi) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑ + Na2SO4 + 2H2Oj)(14) N及其化合物的反应方程式a) NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2Ob) 浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑c) 稀硝酸与铜反应:3Cu + 8HNO3(稀) △3Cu(NO3)2 + 4H2O + 2NO↑(15) 硅Si的反应方程式冶炼纯硅a) Si + 2F 2 = SiF4 b ) Si + 2NaOH + H2O = NaSiO3 +2H2↑b) 硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉 Si + 2CO (石英沙)(焦碳)(粗硅)c) 粗硅转变为纯硅:Si (粗) + 2Cl2 △ SiCl4 SiCl4 + 2H2 高温== Si (纯)+ 4HCl 二、 氯的化学方程式:1)C l2+SO2+ 2H2O = H2SO4+2HCl2)2HCl = H2+Cl23)2NH3+3Cl2 = N2+6HCl4)8NH3+3Cl2 = N2+6NH4Cl5)S i(粗)+2Cl2 = SiCl46)C +2Cl2 = CCl47)C l2 +H2 = 2HCl8)3Cl2 +2P = 2PCl39)C l2 +PCl3 = PCl510)C l2 +2Na = 2NaCl11)3Cl2 +2Fe = 2FeCl312)C l2 +2FeCl2 = 2FeCl313)C l2+Cu = CuCl214)2Cl2+2NaBr = 2NaCl+Br215)C l2 +2NaI = 2NaCl+I216)5Cl2+I2+6H2O = 2HIO3+10HCl17) l2 +Na2S = 2NaCl+S 18) l2 +H2S = 2HCl+S 19) l2+SO2 +2H2O = H2SO4 +2HCl 20) l2 +H2O2 =2HCl+O2 21) KClO3与浓HCl 发生如下反应: KClO3+6HCl→KCl+3Cl2↑+3H2O, 该反应中被氧化的氯元素与被还原的氯元素的质量比是: D A.6:1 B.1:6 C.3:1 D.5:1 1个Cl 由-1 到-1,未变。
高考常考化学方程式(全)(2021年整理)

高考常考化学方程式(全)(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高考常考化学方程式(全)(word 版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高考常考化学方程式(全)(word版可编辑修改)的全部内容。
中学化学常用方程式大全总目录一、无机化学方程式二、热化学方程式三、有机反应方程式四、离子方程式五、电极方程式-—--———-—--------—-—-—-——--—--—-——-——-----—-—--—---——-——-—-———--——--———————--—-——————-———分目录表一、无机化学方程式 (11)A (11)Ag (11)Al (11)As (12)B (12)Ba (12)Be (13)Br (13)C (13)Ca (8)Cl (15)Cu (15)F (16)F2 (16)Fe (10)H (11)H2 (11)Hg (18)HF (18)HCl (18)HBr (12)HI (12)H2O (12)H2O2 (19)H2S (19)H2CO3 (13)HClO (13)HNO3 (13)H3PO4 (13)H2SO3 (14)H2SO4 (14)K (15)K (15)K2O、K2O2 (23)KOH (23)K2CO3 (23)KHCO3 (16)KClO3 (16)KI (16)KAl(SO4)2 (16)KMnO4 (16)KSCN (24)KH (24)L (24)Li (24)Li2O (17)LiOH (17)Li2CO3 (17)LiHCO3 (17)M (17)Mg (17)MgO (25)Mg(OH)2 (25)Mg(HCO3)2 (18)MgSO4 (18)MnO2 (18)N (18)N2 (18)NO、NO2、N2O5 (18)NH3 (26)NH4HCO3、(NH4)2CO3 (19)NH4Cl (19)NH4NO3 (27)(NH4)2SO3、(NH4)2SO4 (27)Na、Na2O、Na2O2 (20)NaH (20)NaOH (20)NaAlO2 (21)NaCl、NaClO、NaBr、NaI (21)Na2CO3、NaHCO3 (21)NaNO3、NaNO2 (30)Na3PO4、NaH2PO4、Na2HPO4 (22)Na2S、NaHS (22)Na2SO4、Na2SO3、Na2S2O3 (22)Na2SiO3 (22)O (22)O2 (22)O3 (23)P (23)P (23)P2O3、P2O5 (24)Pb、PbO2 (24)(CH3COO)2Pb (24)R (24)S (24)S (24)SO2 (25)SO3 (25)Si (25)SiO2 (25)Z (26)Zn (26)ZnO (26)Zn(OH)2 (26)二、热化学方程式 (26)B (26)C (26)N (28)P (28)S (28)三、有机反应方程式 (28)(一)烷烃 (28)(二)烯烃 (28)(三)炔烃 (29)(四)芳香烃 (29)(五)石油 (29)(六)卤代烃 (29)(七)醇类 (30)(八)酚类 (30)(九)醛类 (30)(十)羧酸 (31)(十一)糖类 (31)(十二)酯、油脂 (31)(十三)氨基酸 (32)四、离子方程式 (32)A (32)Al (32)Ag (33)As (34)Ba (34)Br (34)C (34)CO32—、CO2 (34)Ca (35)Cl (35)CN (36)Cr (36)Cu (36)C x H y O z (36)F (37)F2 (37)Fe (37)H (38)H+ (38)H2O (38)H2O2 (38)H2CO3系列 (38)H3PO4系列 (39)H2S系列 (39)H2SO3系列 (40)I (40)M (41)Mg (41)Mn (41)N (41)Na (41)NN3系列 (41)NO2—、NO3- (42)O (42)P (42)S (43)S (43)Si (44)Z (44)五、电极方程式 (44)(一)原电池电极方程式 (44)1.Cu─H2SO4─Zn原电池 (44)2.Cu─FeCl3─C原电池 (45)3.钢铁在潮湿的空气中发生吸氧腐蚀 (45)4.氢氧燃料电池(中性介质) (45)5.氢氧燃料电池(酸性介质) (45)6.氢氧燃料电池(碱性介质) (45)7.铅蓄电池(放电) (45)8.Al─NaOH─Mg原电池 (45)9.CH4燃料电池(碱性介质) (46)10.熔融碳酸盐燃料电池 (46)11.银锌纽扣电池(碱性介质) (46)(二)电解电极方程式 (46)1.电解CuCl2溶液 (46)2.电解精炼铜 (46)3.电镀铜 (46)4.电解饱和食盐水 (46)5.电解HCl溶液 (47)6.电解NaOH溶液 (47)7.电解H2SO4溶液 (47)8.电解KNO3溶液 (47)9.电解CuSO4溶液 (47)10.电解AgNO3溶液 (47)11.铅蓄电池(充电) (47)正文部分一、无机化学方程式AAgAg+2HNO3(浓)====AgNO3+NO2↑+H2O 2AgCl====2Ag + Cl2↑(见光或受热)AgNO3+ NaCl ==== AgCl↓+ NaNO3 AgNO3+NaBr==== AgB r↓+NaNO3AgNO3+ NaI ==== AgI↓+ NaNO3Ag3PO4+3HNO3====H3PO4+3AgNO3Al4Al+3O2点燃2Al2O3(纯氧) 2Al+3S△Al2S32Al+3Cl2△2AlCl3 4Al+3MnO2高温2Al2O3+3Mn2Al+Cr2O3高温Al2O3+2Cr2Al+Fe2O3高温Al2O3+2Fe 2Al+3FeO△Al2O3+3Fe2Al + 6HCl====2AlCl3 + 3H2↑ 2Al+3H2SO4====Al2(SO4)3+3H2↑2Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2OAl+4HNO3(稀)====Al(NO3)3+NO↑+2H2O (Al、Fe在冷、浓的硫酸、硝酸中钝化)2Al+2NaOH+2H 2O====2NaAlO 2+3H 2↑Al 2O 3、Al (OH)3()232424232322Al O 3H SO Al SO 3H O A l O 2NaOH 2NaAlO H O +====+⎫⎬+====+⎭(Al 2O 3是两性氧化物) 2Al (OH )3△ Al 2O 3+3H 2O Al(OH)3+3HCl====AlCl 3+3H 2O 2Al (OH)3+3H 2SO 4====Al 2(SO 4)3+6H 2O Al(OH)3+NaOH====NaAlO 2+2H 2O铝盐AlCl 3+3NaOH====Al (OH )3↓+3NaCl AlCl 3+3NH 3·H 2O====Al(OH )3↓+3NH 4Cl2AlCl 3+3Na 2CO 3+3H 2O====2Al(OH)3↓+3CO 2↑+6NaClAlCl 3+3NaHCO 3====Al(OH)3↓+3CO 2↑+3NaCl AlCl 3+3NaAlO 2+6H 2O====4Al (OH )3↓+3NaClAlCl 3+4NaOH====NaAlO 2 + 3NaCl +2H 2OAl 2(SO 4)3+3Na 2S+6H 2O====2Al(OH)3↓+3H 2S ↑+3 Na 2SO 4 Al 4C 3+12H 2O ==== 4Al(OH )3↓+3CH 4↑AsAs 2O 3 + 6Zn + 12HCl ==== 2AsH 3↑+6ZnCl 2 + 3H 2O3As 2S 3 + 28HNO 3(稀) + 4H 2O ==== 6H 3AsO 4 + 9H 2SO 4+28NO↑ As 2S 3 + 28HNO 3(浓) ==== 2H 3AsO 4 + 3H 2SO 4+ 28NO 2↑+8H 2OB BaBa(OH)2 + CO 2 ====BaCO 3↓+ H 2O Ba (OH )2 + 2CO 2(过量) ====Ba(HCO 3)2Ba(OH )2+ H 2SO 4 ==== BaSO 4↓+ 2H 2O 3Ba(OH)2+2H 3PO 4====Ba 3(PO 4)2↓+6H 2O BaCl 2 + H 2SO 4 ==== BaSO 4↓+ 2HClBaCl2+Na2SO4==== BaSO4↓+2NaClBaCO3+2HCl====BaCl2+CO2↑+H2O BaCO3+2HNO3====Ba(NO3)2+CO2↑+H2OBaO2+H2SO4(稀)====BaSO4↓+H2O2BeBe+2HCl====BeCl2+H2↑ Be+2NaOH ====Na2BeO2+H2↑BeCl2+2NaOH====Be(OH)2↓+2NaCl Be(OH)2+2HCl====BeCl2+2H2O Be(OH)2+2NaOH====Na2BeO2+2H2OBrBr2+H2△2HBr 3Br2+ 2Fe ====2FeBr3Br2+ 2FeBr2====2FeBr3 Br2+ 2NaI====2NaBr + I2Br2+ 2HI====2HBr + I2Br2+ H2O ==== HBr + HBrO Br2+ 2NaOH ==== NaBr + NaBrO+H2OBr2+SO2 +2H2O====H2SO4 +2HBr Br2+H2S====S↓+2HBrCCC+2F2点燃CF4C+2Cl2点燃CCl42C+O2(少量)点燃2COC+O2(足量)点燃CO2C+CO2高温2COC+H2O高温CO+H2(生成水煤气)2C+SiO2高温Si+2CO↑(制得粗硅)C+Si△SiC(金刚砂) C +2S△CS23C+CaO电炉CaC2+CO↑3C+SiO2电炉SiC+2CO↑C+2H2SO4(浓)△2↑+2SO2↑+2H2OC +4HNO3(浓)△CO2↑+4NO2↑+2H2O2CO+O2点燃2CO2CO+CuO高温Cu+CO23CO+Fe2O3高温2Fe+3CO2CO+H2O高温CO2+H2CO2+2Mg点燃2MgO+CCO 2+H2O====H2CO3CO2+2NaOH(过量)====Na2CO3+H2OCO2(过量)+NaOH====NaHCO3CO2+Ca(OH)2(过量)====CaCO3↓+H2O2CO2(过量)+Ca(OH)2====Ca(HCO3)2CO2+2NaAlO2+3H2O====2Al(OH)3↓+Na2CO3CO2+C6H5ONa+H2O====C6H5OH+NaHCO3CO2+Na2O====Na2CO32CO2+2Na2O2====2Na2CO3+O2CO2+NH3+NaCl+H2O====NaHCO3↓+NH4Cl(侯氏制碱法)CaCaO+H2O====Ca(OH)2 CaO+SiO2高温CaSiO32Ca(OH)2+2Cl2====CaCl2+Ca(ClO)2+2H2O Ca(OH)2+SO3====CaSO4↓+H2O CaCO3+2HNO3====Ca(NO3)2+H2O+CO2↑(用HNO3和浓硫酸不能制备H2S、HI、HBr等还原性气体)CaCO3+SiO2高温CaSiO3+CO2↑CaF2+H2SO4(浓)====CaSO4+2HF↑Ca3(PO4)2+3H2SO4(浓)====3CaSO4+2H3PO4 Ca3(PO4)2+2H2SO4(浓)====2CaSO4+Ca (H2PO4)2Ca3(PO4)2+4H3PO4====3Ca(H2PO4)2(重钙)CaH2+2H2O====Ca(OH)2+2H2↑ClCl2 +H2 ====2HCl (光照或点燃) Cl2 +2Na2NaCl3Cl2 +2P2PCl3 Cl2 +PCl3PCl53Cl2 +2Fe2FeCl3 Cl2+Cu CuCl2Cl2 +2FeCl2 ====2FeCl3 Cl2+2NaBr====2NaCl+Br2Cl2 + 2KI ====2KCl + I2 * 5Cl2+I2+6H2O====2HIO3+10HClCl2 +Na2S====2NaCl+S↓ Cl2 +H2S====2HCl+S↓Cl2+SO2 +2H2O====H2SO4 +2HCl Cl2+H2SO3+ H2O====H2SO4+2HClCl2+H2O====HCl +HClO Cl2 +H2O2 ====2HCl+O2Cl2+2NaOH ====NaCl+NaClO+H2O 2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)O2+2H23Cl2 +6KOH(热、浓)====5KCl+KClO3+3H2OCu2Cu +O2△2CuO 2Cu +S △Cu2S Cu+ Cl2 CuCl2 3CuO+2NH3△3Cu+N2+3H2OCuO+2HCl====CuCl2+H2O CuO+H2SO4====CuSO4+H2OCu(OH)2+2HCl====CuCl2+2H2O Cu(OH)2+H2SO4====CuSO4+2H2OCu(OH)2△CuO + H2OCuCl2+H2S====CuS↓+2HCl CuCl2+2NaOH====Cu(OH)2↓+2NaCl CuSO4+H2S====CuS↓+H2SO4 CuSO4+2NaOH====Cu(OH)2↓+Na2SO4CuSO4+Ba(OH)2====Cu(OH)2↓+BaSO4↓CaC2CaC2+2H2O====C H≡CH↑+Ca(OH)2FF2F2 + H2====2HF 2F2 + 2H2O====4HF + O2Fe2Fe+ 3Cl2点燃2FeCl3 3Fe+2O2点燃Fe3O4Fe+S△2====2FeBr3Fe+I2△FeI2 3Fe+4H2O(g)高温Fe3O4+4H2Fe+2HCl====FeCl2+H2↑ Fe+CuCl2====FeCl2+Cu Fe+SnCl4====FeCl2+SnCl2Fe + H2S====FeS+H2↑2Fe +6H2SO4(浓)====Fe2(SO4)3+3SO2↑+6H2OFe +H2SO4(稀)====FeSO4+H2↑Fe +6HNO3====Fe(NO3)3+3NO2↑+3H2OFe +4HNO3====Fe(NO3)3+NO↑+2H2O8Fe +30HNO3====8Fe(NO3)3+3N2O↑+15H2O10Fe +36HNO3====10Fe(NO3)3+3N2↑+18H2O8Fe +30HNO3====8Fe(NO3)3+3NH4NO3+9H2OFe(Al) +H2SO4(浓)室温下钝化Fe +(CH3COO)2Cu====Cu+(CH3COO)2Fe3FeO + 2Al高温Al2O3+3Fe 6FeO+O2△2Fe3O4FeO+4HNO3====Fe(NO3)3+NO2↑+2H2OFe2O3Fe2O3 +2Al高温Al2O3+2Fe Fe2O3 +3CO高温2Fe+3CO2Fe2O3+3H2△2Fe+3H2O (制还原铁粉) Fe2O3+6HCl====2FeCl3+3H2OFe3O4Fe3O4+4H2△3Fe+4H2O Fe3O4+8HCl(浓)△2+2FeCl3+4H2O Fe(OH)2、Fe(OH)34Fe(OH)2 +O2+2H2O====4 Fe(OH)3 2Fe(OH)3△Fe2O3+3H2OFeCl22FeCl2 + Cl2====2FeCl3 FeCl2+Mg====Fe+MgCl2FeCl32FeCl3+Fe====3FeCl2 2FeCl3+Cu====2FeCl2+CuCl2(用于雕刻铜线路板)2FeCl3+H2SO3+H2O====H2SO4+2FeCl2+2HCl2FeCl3+Zn====2FeCl2+ZnCl2 2FeCl3+H2S====2FeCl2+2HCl+S↓2FeCl3+2KI====2FeCl2+2KCl+I2FeCl3+3NH3·H2O====Fe(OH)3↓+3NH4Cl2FeCl3+3Na2CO3+3H2O====2Fe(OH)3↓+3CO2↑+6NaClFeCl3+3NaHCO3====Fe(OH)3↓+3CO2↑+3NaCl2FeCl3+ SO2+ 2H2O ==== 2FeCl2+ H2SO4+ 2HClFeCl3 + 3KSCN ====Fe(SCN)3 + 3KClFeSFeS + 2HCl====FeCl2 + H2S↑ FeS + H2SO4====FeSO4 + H2S↑其它Fe化合物4FeS2 + 11O2点燃 2Fe2O3+ 8SO2Fe2(SO4)3+2Ag====2FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应HH2H2 +F2 ==== 2HF (冷暗处爆炸)H2+Cl2 ====2HCl (光照或点燃)3H2+N2催化剂2NH3 H2+S△H2S高温、高压6H2+P4△4PH3 2H2+SiCl4△Si(纯)+4HClH2+2Na====2NaH3H2+Fe2O3△2Fe+3H2O (制还原铁粉)4H2+Fe3O4△3Fe+4H2O 2H2 +SiO2△2OHg3Hg + 8HNO3(稀)====3Hg(NO3)2+ 2NO↑+ 4H2OHg + 4HNO3(浓)====Hg(NO3)2 + 2NO2↑+ 2H2OHF4HF+SiO2====SiF4↑+2H2OHCl6HCl +2Al====2AlCl3+3H2↑ 2HCl +Fe====FeCl2+H2↑4HCl(浓)+MnO2△MnCl2+Cl2↑+2H2O 4HCl(g)+O2△2Cl2+2H2O16HCl+2KMnO4====2KCl+2MnCl2+5Cl2↑+8H2O14HCl+K2Cr2O7====2KCl+2CrCl3+3Cl2↑+7H2O HCl +NH3====NH4Cl(白烟)2HCl +FeO====FeCl2+H2O 6HCl +Fe2O3====2FeCl3+3H2O8HCl(浓) +Fe3O4△2+2FeCl3+4H2O HCl +Na3PO4====Na2HPO4+NaCl HCl +Na2HPO4====NaH2PO4+NaCl HCl +NaH2PO4====H3PO4+NaClHCl +Na 2CO 3====NaHCO 3+NaCl HCl +NaHCO 3====NaCl+H 2O+CO 2↑HBrHBr + NaOH====NaBr + H 2O 2HBr + Cl 2====2HCl + Br 2HI2HI△H 2+I 22HI + Cl 2====2HCl + I 2 HI + NaOH====NaI + H 2OH 2O2F 2 +2H 2O====4HF+O 2 Cl 2+H 2O====HCl+HClO 2Na+2H 2O====2NaOH+H 2↑ Mg+2H 2O △Mg(OH )2+H 2↑3Fe+4H 2O (g)高温Fe 3O 4+4H 2 2H 2O电解2H 2↑+O 2↑SO 2+H 2O====H 2SO 3 SO 3+H 2O====H 2SO 4 3NO 2+H 2O====2HNO 3+NO N 2O 5+H 2O====2HNO 3P 2O 5+H 2O(冷)====2HPO 3 P 2O 5+3H 2O(热)====2H 3PO 4 CO 2+H 2O====H 2CO 3H 2O 22H 2O 22 MnO△2H 2O+O 2↑ H 2O 2 + Cl 2====2HCl+O 25H 2O 2 + 2KMnO 4 + 6HCl ====2MnCl 2 + 2KCl + 5O 2↑+ 8H 2OH 2SH 2S + Cl 2====2HCl+S↓ H 2S + Mg====MgS+H 22H 2S+3O 2(足量)====2SO 2+2H 2O 2H 2S+O 2(少量)====2S↓+2H 2O 2H 2S+SO 2====3S↓+2H 2O H 2S+H 2SO 4(浓)====S ↓+SO 2+2H 2O H 2S△H 2+S↓ 3H 2S+2HNO 3(稀)====3S ↓+2NO+4H 2O5H2S+2KMnO4+3H2SO4====2MnSO4+K2SO4+5S↓+8H2O* 3H2S+K2Cr2O7+4H2SO4====Cr2(SO4)3+K2SO4+3S↓+7H2O* H2S+4Na2O2+2H2O====Na2SO4+6NaOHH2S+Fe====FeS+H2 H2S+CuCl2====CuS↓+2HCl H2S+HgCl2====HgS↓+2HCl H2S +4NO2====4NO+SO3+H2O H2CO3H2CO3====CO2↑+H2OHClO2HClO====2HCl + O2↑HNO33HNO3+Ag3PO4====H3PO4+3AgNO3Al+4HNO3(稀)====Al(NO3)3+NO↑+2H2O3As2S3+ 28HNO3+ 4H2O ==== 6H3AsO4+ 9H2SO4+ 28NO↑4HNO3(浓)+C △CO2↑+4NO2↑+2H2O2HNO3+CaCO3====Ca(NO3)2+H2O+CO2↑6HNO3+Fe====Fe(NO3)3+3NO2↑+3H2O4HNO3+Fe====Fe(NO3)3+NO↑+2H2O30HNO3+8Fe====8Fe(NO3)3+3N2O↑+15H2O36HNO3+10Fe====10Fe(NO3)3+3N2↑+18H2O30HNO3+8Fe====8Fe(NO3)3+3NH4NO3+9H2OFeO+4HNO3====Fe(NO3)3+NO2↑+2H2O3H2S+2HNO3(稀)====3S↓+2NO+4H2O4HNO3====4NO2↑+O2↑+2H2O (见光或受热分解)NH3+HNO3====NH4NO3 (白烟)(用HNO3和浓硫酸不能制备H2S、HI、HBr,而SO2可用浓硫酸制备)3Na2S+8HNO3(稀)====6NaNO3+2NO↑+3S↓+4H2O3Na2SO3+2HNO3(稀)====3Na2SO4+2NO↑+H2O * 5HNO3(浓)+P====H3PO4+5NO2↑+H2OP4+20HNO3(浓)====4H3PO4+20NO2↑+4H2OS+6HNO3(浓)====H2SO4+6NO2↑+2H2O3S+4HNO3(稀)====3SO2↑+4NO↑+2H2OH3PO44H3PO4+Ca3(PO4)2====3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr====NaH2PO4+HBr↑H3PO4(浓)+NaI====NaH2PO4+HI↑H2SO3H2SO3+X2+H2O====H2SO4+2HX(X2表示Cl2、Br2、I2)2H2SO3+O2====2H2SO4H2SO3+H2O2====H2SO4+H2O5H2SO3+2KMnO4====2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O====H2SO4+2FeCl2+2HClH2SO3====H2O+SO2↑H2SO3+2H2S====3S↓+3H2OH2SO4Zn +H2SO4====ZnSO4+H2↑Fe +H2SO4====FeSO4+H2↑Mg+H2SO4====MgSO4+H2↑2Al+3H2SO4====Al2(SO4)3+3H2↑2Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2O 2NH3+H2SO4====(NH4)2SO4H2S+H2SO4(浓)====S↓+SO2+2H2OP2O5+3H2SO4(浓)====2H3PO4+3SO3BaO2+H2SO4(稀)====BaSO4+H2O2Na2O2+H2SO4(冷、稀)====Na2SO4+H2O2MgO+H2SO4====MgSO4+H2OAl2O3+3H2SO4====Al2(SO4)3+3H2O2H2SO4(浓)+C△CO2↑+2SO2↑+2H2O2H2SO4(浓)+S====3SO2↑+2H2OH2SO4(浓)+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe====Fe2(SO4)3+3SO2↑+6H2O2H2SO4(浓)+Cu△4+SO2↑+2H2OH2SO4(浓)+2HBr△SO2+Br2+2H2OH2SO4(浓)+2HI△SO2+I2+2H2OH2SO4(浓) +CaF2====CaSO4+2HF↑H2SO4(浓)+NaCl△4+HCl↑H2SO4(浓) +2NaCl强热Na2SO4+2HCl↑H2SO4(浓)+NaNO3△NaHSO4+HNO3↑(微热)3H2SO4(浓)+Ca3(PO4)2====3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2====2CaSO4+ Ca(H2PO4)2 II2 + H2△ 2HII2 +Fe△ FeI2I2 + 2NaOH ====NaI + NaIO +H2OK KK + O 2△KO 22K + 2H 2O====2KOH + H 2↑K 2O 、K 2O 2K 2O + H 2O====2KOH K 2O + CO 2====K 2CO 3 2K 2O 2 + 2CO 2====2K 2CO 3 +O 2 2K 2O 2 + 2H 2O====4KOH +O 2↑KOH2KOH +CO 2====K 2CO 3 +H 2O KOH +CO 2====KHCO 3K 2CO 3K 2CO 3 +2HCl====2KCl + CO 2↑+ H 2O K 2CO 3 +CaCl 2====CaCO 3↓+ 2KCl K 2CO 3 +2AgNO 3====Ag 2CO 3↓+ 2KNO 3KHCO 3KHCO 3 +HCl====KCl + CO 2↑+ H 2O 2KHCO 3△2CO 3 + CO 2↑+ H 2OKClO 32KClO 32 MnO △2KCl + 3O 2↑KClO 3 +6HCl====KCl +3Cl 2↑ + 3H 2OKI2KI + Cl 2====2KCl + I 2KI + AgNO3====AgI↓+ KNO3KAl(SO4)22KAl(SO4)2 + 6NaOH====K2SO4 +3Na2SO4 + 2Al(OH)3↓2KAl(SO4)2 + 3Ba(OH)2====K2SO4 + 3BaSO4↓+ 2Al(OH)3↓KAl(SO4)2 + 2Ba(OH)2====KAlO2 +2BaSO4↓+2H2OKMnO42KMnO4△2MnO4 + MnO2 + O2↑2KMnO4 +16HCl====2KCl + 2MnCl2 +5Cl2↑+ 8H2O2KMnO4 + 5H2O2 + 6HCl====2KCl + 2MnCl2 +5O2↑+ 8H2O KSCN3KSCN + FeCl3====Fe(SCN)3 + 3KClKHKH + H2O====KOH + H2↑LLi4Li + O2△2Li2O2Li + 2H2O====2LiOH + H2↑Li2OLi2O + CO2====Li2CO3Li2O + H2O====2LiOHLiOH2LiOH +CO2====Li2CO3↓ +H2OLiOH +CO2====LiHCO3Li2CO3Li2CO3 +2HCl====2LiCl + CO2↑+ H2OLiHCO3LiHCO3 +HCl====LiCl + CO2↑+ H2O2LiHCO3△Li2CO3 + CO2↑+ H2OMMg2Mg+O2点燃2MgO Mg + 2H2O△2Mg(OH)2 + H2↑Mg + Cl2点燃MgCl2 2Mg +CO2点燃2MgO+CMg + S ==== MgS Mg + Br2 ==== MgBr2Mg +2HCl ====MgCl2 + H2↑ Mg + H2SO4 ==== MgSO4 + H2↑2Mg+TiCl4(熔融)====Ti+2MgCl2MgOMgO + 2HCl====MgCl2 +H2OMgO + H2O====Mg(OH)2↓Mg(OH)2Mg(OH)2 + 2HCl====MgCl2 +2H2OMgCO3MgCO3 +2HCl====MgCl2 + CO2↑+ H2OMgCO3 +H2O △(OH)2↓+ CO2↑MgCO3△ CO2↑+ MgOMg(HCO3)2Mg(HCO3)2 + 2HCl====MgCl2 + 2CO2↑+ 2H2OMg(HCO3)2△Mg(OH)2↓+ 2CO2↑MgSO4MgSO4 + Ba(OH)2====Mg(OH)2↓ + BaSO4↓MgSO4 + 2NaOH====Mg(OH)2↓ + Na2SO4MnO2MnO2 + 4HCl(浓)△MnCl2 + Cl2↑+ 2H2ONN2N2+3H22NH3 N2+O2 2NON2+3Mg点燃Mg3N2 N2+6Na====2Na3NNO、NO2、N2O52NO+O2====2NO2NO+NO2+2NaOH====2NaNO2+ H2O (用于制硝酸工业中吸收尾气中的NO和NO2)5N2+ 6H2O6NO + 4NH3催化剂△NO2+2KI+H2O====NO+I2+2KOH (不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S====4NO+SO3+H2ONO2 + SO2====SO3+NO3NO2+H2O====2HNO3+NON2O5+H2O====2HNO3NH32NH3+3CuO△3Cu+N2+3H2O2NH3+3Cl2====N2+6HCl8NH3+3Cl2====N2+6NH4Cl4NH3+3O2(纯氧)点燃2N2+6H2O4NH3+5O2催化剂4NO+6H2O△5N2+6H2O(用氨清除NO)4NH3+6NO催化剂△NH3+HCl====NH4Cl(白烟)NH3+HNO3====NH4NO3(白烟)2NH3+H2SO4====(NH4)2SO4NH3+NaCl+H2O+CO2====NaHCO3↓+NH4Cl(侯氏制碱法) 2NH3+SO2+H2O====(NH4)2SO3NH3·H2O △NH3↑+H2ONH 3 + H2O NH3·H2O NH4+ + OH—NH4HCO3、(NH4)2CO3NH4HCO3△NH3↑+H2O↑+CO2↑(NH4)2CO3△2NH3↑+H2O↑+CO2↑NH4ClNH4Cl△NH3+HCl2NH4Cl + Ca(OH)2△CaCl2 + 2NH3↑+ 2H2ONH4Cl + NaOH △ NaCl + NH3↑+ H2ONH4Cl + NaOH ====NaCl + NH3·H2ONH4NO3NH4 NO3 + NaOH ====NaNO3 + NH3·H2ONH4 NO3 + NaOH △ Na NO3 + NH3↑ + H2O5NH4NO32HNO3 + 4N2↑ + 9H2O(NH4)2SO3、(NH4)2SO4(NH4)2SO3+SO2+H2O====2NH4HSO3(NH4)2SO4 + 2NaOH ====Na2SO4 + 2 NH3·H2O (NH4)2SO4 + 2NaOH △ Na2SO4 + 2NH3↑ + 2H2ONa、Na2O、Na2O24Na+O2====2Na2O 2Na+O2点燃Na2O2 Cl2 +2Na点燃2NaCl 2Na+S====Na2S(爆炸) 2Na+2H2O====2NaOH+H2↑ 2Na+H2△2NaH2Na+2NH3====2NaNH2+H2 4Na+TiCl4(熔融)====4NaCl+TiNa2O+H2O====2NaOH 2Na2O+O2△2O2 Na2O+SO3====Na2SO4Na2O+CO2====Na2CO3 Na2O+2HCl====2NaCl+H2ONa2O2+2Na====2Na2O (此反应用于制备Na2O)2Na2O2+2H2O====4NaOH+O2↑ (此反应分两步Na2O2+2H2O====2NaOH+H2O2;2H2O2====2H2O+O2↑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精品“正版”资料系列,由本公司独创。
旨在将“人教版”、”苏教版“、”北师 大版“、”华师大版“等涵盖几乎所有版本的教材教案、课件、导学案及同步练习和 检测题分享给需要的朋友。
本资源创作于2020年8月,是当前最新版本的教材资源。
包含本课对应 内容,是您备课、上课、课后练习以及寒暑假预习的最佳选择。
高考总复习之高中化学方程式总结化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓)13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHSO SO H NaCl 442(浓)15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+ 18、33NaNO AgCl AgNO NaCl +↓→+ 19、33KNO AgCl AgNO KCl +↓→+ 20、↑++→+2223CO O H CaCl CaCO HCl 2 第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2 第四节 卤族元素 29、HF 2F H 22→+ 30、HBr 2Br H 22→+ 31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+ 33、22I KCl 2Cl KI 2+→+ 34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔 38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg 第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+ 第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+ 第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22SO O S −−→−+点燃 51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃56、HBr 2S Br S H 22+↓→+ 57、↑+→+S H FeCl HCl 2FeS 22 58、4224SO H CuS S H CuSO +↓→+ 59、HAc 2PbS S H PbAc 22+↓→+ 60、O H NaHS NaOH S H 22+→+ 61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3O V 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na 69、O H SO Na NaOH 2SO 2322+→+ 70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++ 75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++ 第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3O V 22SO 2O SO 252∆−−→←+ 79、4232SO H SO O H →+ 第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓) 82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+ 86、NaCl 2BaSO SO Na BaCl 4422+↓→+ 87、NaCl 2BaCO CO Na BaCl 3322+↓→+ 88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na 91、42232SO H 2O SO H 2→+ 92、42232SO Na 2O SO Na 2→+ 93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓)95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+ 99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)( 第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2 106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+ 108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na 110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+ 117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)( 119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+ 第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
第六章 氮和磷第二节 氮气126、232N Mg N Mg 3−−→−+点燃127、322NH 2H N 催化剂高温高压−−−→←+ 128、NO 2O N 22−−→−+放电129、22NO 2O NO 2→+ 130、422O N NO 2⇔131、NO HNO 2O H NO 3322+→+ 132、322HNO 4O H 2O 3NO 4→++ 133、3222HNO 4O H 2O NO 4→++ 第三节 氨 铵盐134、Cl NH HCl NH 43→+ 135、3433NO NH HNO NH →+136、O H 6NO 4O 5NH 4223+−−→−+∆催化剂137、O H N O NH 2223+−−→−+点燃(纯) 138、O H 2CaCl NH 2OH Ca Cl NH 22324++↑−→−+∆)( 139、↑+↑−→−∆HCl NH Cl NH 34(固) 140、Cl NH HCl NH 43→+141、↑++↑−→−∆22334CO O H NH HCO NH 142、O H 2SO Na NH 2NaOH 2SO NH 2423424++↑−→−+∆)( 第四节 硝酸143、O H 2O NO 4HNO 42223++↑−−→−光或热144、O H 2NO 2NO Cu HNO 4Cu 22233+↑+→+)((浓) 145、O H 4NO 2NO Cu 3HNO 8Cu 32233+↑+→+)((稀)145、O H 2NO 4CO HNO 4C 2223+↑+↑→+146、↑+−→−+∆34423HNO NaHSO SO H NaNO (浓) 147、kJ 907O H 6NO 4O 5(NH 42RhPt 23++−−→−+-(气)(气)(气)气)高温高压 148、kJ 113NO 2O NO 222+→+(气)(气)(气) 149、kJ 136NO HNO 2O H NO 3322++→+(气)(液)(液)(气) 150、O H NaNO 2NaOH 2NO NO 222+→++ 第六节 磷 磷酸151、32PCl 2Cl 3P 2−−→−+点燃152、52PCl 2Cl 5P 2−−→−+点燃 153、3252HPO O H O P −−→−+冷水 154、43252PO H 2O H 3O P −−→−+热水155、↓+−→−+∆44342243CaSO 3PO H 2SO H 3PO Ca (浓))( 156、↓+−→−+∆424242243CaSO 2PO H Ca SO H 2PO Ca )((浓))(157、24243243PO H Ca 3PO H 4PO Ca )((浓))(→+化学 第二册第一章 硅第二节 硅及其重要的化合物158、22SiO O Si −→−+∆159、↑+→++2322H 2SiO Na O H NaOH 2Si160、↑+−−→−+CO 2Si C 2SiO 2高温161、32CaSiO CaO SiO −−→−+高温 162、O H SiO Na NaOH 2SiO 2322+→+ 163、O H 2SiF HF 4SiO 242+→+164、NaCl 2SiO H O H HCl 2SiO Na 44232+↓→++ 165、O H SiO H SiO H 23244+−−−→−干燥空气166、32322232CO Na SiO H O H CO SiO Na +↓→++ 第三节 硅酸盐工业简述167、↑+−−→−+232232CO SiO Na SiO CO Na 高温 168、↑+−−→−+2323CO CaSiO SiO CaCO 高温第二章 镁 铝第二节 镁和铝的性质169、MgO 2O Mg 22−−→−+点燃170、322O Al 2O 3Al 4−→−+∆171、↑+→++222H 3NaAlO 2O H 2NaOH 2Al 2172、22MgCl Cl Mg −−→−+点燃173、32AlCl 2Cl 3Al 2−−→−+点燃174、232N Mg N Mg 3−−→−+点燃 175、32S Al S 3Al 2−−→−+点燃176、Cu MgSO CuSO Mg 44+→+177、Hg 3NO Al 2NO Hg 3Al 23323+→+)()( 178、↑+−−→−+222H OH Mg O H 2Mg )(沸水179、↑+−−→−+∆232H 3OH Al 2O H 6Al 2)(沸水180、C MgO 2CO Mg 22+−−→−+点燃181、Fe 2O Al O Fe Al 23232+−−→−+高温 182、V 6O Al 5O V 3Al 103252+−−→−+高温 183、W O Al WO Al 2323+−−→−+高温 184、Cr 2O Al O Cr Al 23232+−−→−+高温 第三节 镁和铝的重要化合物185、↑+−−→−23CO MgO MgCO 煅烧186、O H MgO OH Mg 22+−→−∆)( 187、22OH Mg O H MgO )(缓慢−−→−+188、32MgSiO SiO MgO −−→−+高温189、↓+→+2222OH Mg CaCl OH Ca MgCl )()(190、↑+−−→−22Cl Mg MgCl 熔融电解191、↑+−−→−232O 3Al 4O Al 电解冰晶石192、O H 3AlCl 2HCl 6O Al 2332+→+193、O H 3SO Al SO H 3O Al 23424232+→+)(194、O H NaAlO 2NaOH 2O Al 2232+→+195、424323342SO NH 3OH Al 2O H NH 6SO Al )()()(+↓→⋅+ 196、O H 3O Al OH Al 22323+−→−∆)( 197、O H 3AlCl HCl 3OH Al 233+→+)(198、O H 6SO Al SO H 3OH Al 22342423+→+)()(199、O H 2NaAlO NaOH OH Al 223+→+)( 第四节 硬水及其软化200、23223HCO Ca O H CO CaCO )(→++ 201、O H CO CaCO HCO Ca 22323+↑+↓−→−∆)( 202、O H CO MgCO HCO Mg 22323+↑+↓−→−∆)( 203、O H 2CaCO 2OH Ca HCO Ca 23223+↓→+)()(204、O H 2OH Mg CaCO 2OH Ca 2HCO Mg 223223+↓+↓→+)()()(205、4224CaSO OH Mg OH Ca MgSO +↓→+)()( 206、423324SO Na CaCO CO Na CaSO +↓→+第三章 铁第一节 铁和铁的化合物 207、432O Fe O 2Fe 3−−→−+点燃208、FeS S Fe −→−+∆209、32FeCl 2Cl 3Fe 2−→−+∆210、2432H 4O Fe O H 4Fe 3+−−→−+高温(气) 211、↑+→+22H FeCl HCl 2Fe212、Cu SO Fe SO Cu Fe 2424+→+)()(213、O H FeCl HCl 2FeO 22+→+ 214、O H 3FeCl 2HCl 6O Fe 2332+→+215、4224SO Na OH Fe NaOH 2FeSO +→+)( 216、NaCl 3OH Fe NaOH 3FeCl 33+↓→+)( 217、3222OH Fe 4O H 2O OH Fe 4)()(→++218、O H FeO OH Fe 22+−→−∆)(219、O H 3O Fe OH Fe 22323+−→−∆)( 220、O H 2FeCl HCl 2OH Fe 222+→+)( 221、O H 3FeCl HCl 3OH Fe 233+→+)( 222、O H Fe H FeO 22+→+ 223、O H 3Fe 2H 3O Fe 2232+→+ 224、O H 4Fe 3H 4O Fe 2243+→+225、O H 2NO NO Fe HNO 4Fe 2333+↑+→+)((稀)第二节 炼铁和炼钢226、232CO 3Fe 2CO 3O Fe +−−→−+高温 227、↑+−−→−23CO CaO CaCO 高温228、FeO 2O Fe 22−−→−+高温229、2SiO Fe 2FeO 2Si +−−→−+高温230、MnO Fe FeO Mn +−−→−+高温231、CO Fe FeO C +−−→−+高温232、32O Al Fe 3FeO 3Al 2+−−→−+高温233、243PO Ca Fe 5CaO 3FeO 5P 2)(高温+−−→−++第四章 烃第二节 甲烷234、↑+−−→−+∆432CaO3CH CO Na NaOH COONa CH 235、O H 2CO O 2CH 2224+−−→−+点燃236、HCl Cl CH Cl CH 324+−→−+光237、HCl Cl CH Cl Cl CH 2223+−→−+光 238、HCl CHCl Cl Cl CH 3222+−→−+光 239、HCl CCl Cl CHCl 423+−→−+光240、24H 2C CH +−−→−高温第四节 乙烯241、O H CH CH OH CH CH 222C17023+↑=−−→−--。
