六、有关硅及其重要化合物化学方程式小结
硅及其化合物

分子筛——合成铝硅酸盐
自然界中存在的某些硅酸盐和铝硅酸盐具有笼形三维结构,可以有选择地吸附一定大小的分子,称为沸石分子筛。优点:分子筛的选择性远远高于活性炭等吸附剂
三、二氧化硅和晶体硅的比较
二 氧 化 硅
晶 体 硅
相 同 点
不 同 点
晶 体 结 构
物 理 性 质
化 学 性 质
202X
单击此处添加副标题
硅及其化合物
汇报人姓名
汇报日期
硅
硅酸
单质
硅酸盐
化合物
03
单击此处添加文本
晶体硅
单击此处添加文本
无定形硅
05
单击此处添加文本
二氧化硅
单击此处添加文本
CONTENTS
目录
单质硅
物理性质 晶体硅为灰黑色黑色固体,熔沸点高,硬度大。属原子晶体
(2)硅的化学性质
常温下,化学性质不活泼,不与强酸,强氧化剂反应,可于一些非金属单质,氟化氢,强碱反应
+2F2===SiF4
03
04
Si+2Cl2===SiCl4
05
06
与非金属的反应
07
Si+2NaOH+H2O===NaSiO3+H2
01
Si+4HF===SiF4 +2H2
02
与HF的反应
与强碱的反应
(3) 单质硅的制法
”
SiO2+2C===Si+2CO
与碱反应
SiO2+2NaOH===Na2SiO3+H2O
与盐反应
SiO2+Na2CO3===Na2SIO3+CO2
高中化学——非金属及化合物知识点总结

高中化学——非金属及化合物知识点总结一、硅及其化合物(一)硅1、硅的存在和物理性质(1)存在:只以化合态存在,主要以SiO2和硅酸盐的形式存在于地壳岩层里,在地壳中含量居第二位。
(2)物理性质:晶体硅是一种灰黑色固体,具有金属光泽,硬而脆的固体,熔沸点较高,能导电,是良好的半导体材料。
2、硅的化学性质3、用途:制造半导体、计算机芯片、太阳能电池。
(二)CO2和SiO2的比较(三)硅酸及硅酸盐1、硅酸(1)物理性质:与一般的无机含氧酸不同,硅酸难溶于水。
(2)化学性质:①弱酸性:是二元弱酸,酸性比碳酸弱,与NaOH溶液反应的化学方程式为:②. 不稳定性:受热易分解,化学方程式为:(3)制备:通过可溶性硅酸盐与其他酸反应制得,如Na2SiO3溶液与盐酸反应:(4)用途:硅胶可用作干燥剂、催化剂的载体等。
2、硅酸盐定义:硅酸盐是由硅、氧、金属所组成的化合物的总称。
(1)硅酸盐结构复杂,一般不溶于水,性质很稳定。
通常用氧化物的形式来表示其组成。
例如:硅酸钠Na2SiO3(Na2O·SiO2),高岭石Al2Si2O5(OH)4(Al2O3·2SiO2·2H2O)。
书写顺序为:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。
注意事项:① 氧化物之间以“·”隔开;②计量数配置出现分数应化为整数。
(2)硅酸钠:Na2SiO3,其水溶液俗名水玻璃,是一种无色粘稠液体,是一种矿物胶,用作黏合剂和木材防火剂。
(四)常见无极非金属材料及其主要用途(五)总结提升1、硅(1)硅的非金属性弱于碳,但碳在自然界中既有游离态又有化合态,而硅却只有化合态。
(2)硅的还原性强于碳,但碳能还原SiO2产生,但Si能跟碱溶液作用放出(3)非金属单质跟碱溶液作用一般无H2H:2(4)非金属单质一般不跟非氧化性酸反应,但硅能跟氢氟酸反应。
(5)非金属单质一般为非导体,但硅为半导体。
2、二氧化硅(1)非金属氧化物的熔沸点一般较低,但SiO2的熔点却很高。
高中化学与硅有关的方程式

高中化学与硅有关的方程式篇一:硅和硅的化合物方程式硅和硅的化合物1、硅和氢氧化钠溶液反应的化学方程式:Si + 2NaOH + H2O = Na2SiO3 + 2H2 ↑2、硅和氢氧化钠溶液反应的离子方程式:Si +2OH— + H2O= SiO32—+ 2H2 ↑3、硅和氢氟酸反应的化学方程式:Si + 4HF= SiF4↑ + 2H2↑4、保存氢氧化钠溶液的试剂瓶不用玻璃瓶的原因:SiO2 + 2NaOH = Na2SiO3 + H2O5、用氢氟酸刻蚀玻璃的原理:SiO2 + 4HF= SiF4↑+ 2H2O6、制玻璃的反应原理:SiO2 + Na2CO3 = Na2SiO3 + CO2↑(高温条件自己写) SiO2 +CaCO3 = CaSiO3 + CO2↑(高温条件自己写)7、制粗硅的反应原理:2C + SiO2 = Si + 2 CO↑(高温条件自己写)8、制硅酸的反应方程式:(写三个反应)Na2SiO3 + 2HCl= 2NaCl + H2SiO3(胶体)Na2SiO3 + CO2(少)+H2O = Na2CO3 + H2SiO3(胶体) Na2SiO3 + 2CO2(多)+2H2O = 2NaHCO3 + H2SiO3(胶体)9、二氧化硅和氧化钙反应:SiO2 + CaO = CaSiO3 (高温条件自己写)10、二氧化硅在自然界的存在形态有硅石。
说出二氧化硅的一种用途制光导纤维。
11、陶瓷的原料,制玻璃的原料是制水泥的原料以黏土和石灰石为主要原料,在加入适量的石膏12、说出硅的两点用途:硅酸的主要用途制硅胶干燥剂硅酸钠的主要用途木材防火剂篇二:硅和氯的化学方程式(完整版)非金属及其化合物的方程式集锦一、硅及其化合物的相互转化1、二氧化硅与氢氟酸反应:SiO2+ 4HF =SiF4 ↑+2 H2O二氧化硅与氢氧化钠溶液反应:SiO2+ 2NaOH =Na2SiO3+ H2O离子方程式:SiO2+2 OH- =SiO2-3+H2O二氧化硅与氧化钙高温反应:SiO2+ CaO高温CaSiO3工业制玻璃原理:SiO2 + Na2CO3 2SiO3+ CO2↑SiO2 + CaCO33+ CO2↑ 2、硅酸钠溶液中通入二氧化碳:Na2SiO3+H2O+CO2= Na2CO3+ H2SiO3↓离子方程式:SiO2-2-3 +H2O+CO2= CO3+ H2SiO3 ↓硅酸钠与盐酸反应:Na2SiO3 +2HCl = 2NaCl + H2SiO3 ↓离子方程式:SiO2-3 +2H+ = H2SiO3 ↓ 硅酸受热分解:H2SiOSiO2+ H2O3、粗硅的制取:SiO2 + 2C Si + 2CO↑ 粗硅的提纯:Si+2Cl4SiCl4+2HSi +4HCl4、硅单质与O2 、F2、HF、NaOH溶液:Si + 2F2 = SiF4Si + 4HF = SiF4 + 2H2↑Si + 2NaOH + H2O = Na2SiO3 +2H2↑ Si +O2点燃SiO2二、氯及其化合物的相互转化1、氯气与金属反应:2Na +Cl点燃2点燃2NaCl(黄色火焰,产生白烟)Cu +Cl2(产生棕黄色烟)2Fe +3Cl2点燃CuCl22FeCl3(产生棕黄色烟)2.氯气与非金属单质反应:H2 +Cl2点燃2HCl(安静燃烧,苍白色火焰,瓶口有白雾产生,并且产生有刺激性气味的气体)H2 +Cl2HCl(发生爆炸,瓶口有白雾产生) 3Cl点燃2+2P2PCl3(小液滴)PCl点燃3+Cl2PCl5(固体小颗粒)3.氯气与水反应:Cl2 + H2O = HCl + HClO离子方程式:Cl+-2 + H2O = H+Cl+HClO 4.HClO光照下分解:2HClO2↑ 5.制漂白液(或氯气尾气处理):Cl2 + 2NaOH = NaCl + NaClO + H2O离子方程式:Cl-2 + 2OH- = Cl- + ClO + H2O6. 制漂白粉(或漂粉精):2Cl2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H2O7.漂白粉的使用原理:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO离子方程式:Ca2++2ClO-+H2O+CO2=CaCO+ 2HClO 漂白粉长期置露在空气中失效:Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO ,2HClO8.实验室制氯气:4HCl(浓)+MnOMnCl2+Cl2↑+2H2O离子方程式:4H++2Cl-+MnO2+Mn+Cl2↑+2H2O9. 氯气与还原性物质反应a. Cl-2+2NaBr=2NaCl+Br2 离子方程式:Cl2+2Br=2Cl-+Br2b. Cl--2 +2 K I =2 KCl+I2离子方程式:Cl2 +2 I =2 Cl+I2 c. Br--2 +2 K I =2 K Br+I2离子方程式:Br2 +2 I =2Br+I2d. Cl2+H2S =S↓+2HCle. FeCl2+2+Cl2 =2FeCl3 离子方程式:Fe+Cl2 =2Fe3++Cl-f. 2H2O+SO2+Cl2 =2HCl+H2SO4离子方程式:2H+-2-2O+SO2+Cl2 =4H+2Cl+SO4篇三:高一化学方程式——硅4、硅及其化合物的转化关系4 ①Si+O2④△SiO2①②SiO2+2C高温Si+2CO↑(制取粗硅)2 CaSiO 3※③SiO2+4HF = SiF4↑+2H2O(刻蚀玻璃)②④Si+4HF = SiF4↑+2H2↑Na 2SiO3 H2 3 ⑤SiO2+CaOSiO2+2NaOH = Na2SiO3+H2O(SiO2是酸性氧化物)2+CaCO3 SiO2+2OH-= SiO32-+H2O (装NaOH的试剂瓶不可以用玻璃塞)SiO2+Na2CO3高温⑦⑧CaSiO3高温CaSiO3+CO2↑Na2SiO3+CO2↑ (Na2SiO3是粘合剂)※⑦Na2SiO3+2HCl = H2SiO3↓+2NaCl SiO32-+2H+= H2SiO3↓(白色胶状沉淀)(硅胶可以用作干燥剂)※⑦Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3或Na2SiO3+2H2O+2CO2=H2SiO3↓+2NaHCO3SiO32-+H2O+CO2=H2SiO3↓+CO32-或SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-(强酸制弱酸,SiO2不能和H2O反应制硅酸)⑧H2SiO3+2NaOH = Na2SiO3+2H2O ⑨H2SiO3△2O+SiO2H2SiO3+2OH-= SiO32-+2H2O ※⑩Si+NaOH +H2O=Na2SiO3+H2↑ 5、氯及其化合物的转化关系①2Fe+3Cl2 2点燃2FeCl3 (棕黄色的烟)②Cu+Cl2 CuCl2 (棕黄色的烟)⑤3+Cu = 2FeCl2+CuCl2③2FeCl+④Cl 2 NaClO 2Fe3+Cu = 2Fe2++点燃④H2+Cl22HCl(苍白色火焰,光照时发生爆炸)或光照CuCl2 ③FeCl3△※⑤MnO2+4HCl(浓) MnCl2+Cl2↑+2H2OMnO2+4H++2Cl-Mn2++Cl2↑+2H2O光照※⑥Cl2+H2O = HCl+HClO(次氯酸是弱酸)※⑦2HCl +O2↑ Cl2+H2O = H++Cl-+HClO 2HClO 光照2H++2Cl-+O2↑※⑧Cl2+2NaOH = NaCl+NaClO+H2O⑨2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O工业制漂白粉用石灰乳Cl2+2OH-= Cl-+ClO-+H2O※⑩Ca(ClO)2+H2O+CO2 = CaCO3↓+2HClO或Ca(ClO)2+2HCl = CaCl2+2HClOCa2++2ClO-+H2O +CO2= CaCO3↓+2HClO或ClO-+H+= HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO2:Ca(ClO)2+2H2O+2CO2 = Ca(HCO3)2+2HClO ClO-+H2O+CO2 = HCO3-+HClO△点燃相关热词搜索:方程式高中化学高中化学方程式大全有关硅的化学方程式。
高三化学方程式总结:硅及其化合物方程式

方程式6 硅及其化合物方程式1. Si与氧气反应的化学方程式:Si + O2高温SiO22.Si与氟气反应的化学方程式:Si + 2F2∆SiF43. Si与Cl2反应的化学方程式:Si + 2Cl2高温SiCl44. Si与NaOH溶液反应化学方程式:Si + 2NaOH + H2O =Na2SiO3 + 2H2 ↑离子方程式:Si + 2OH- + H2O =SiO32- + 2H2 ↑5.Si与HF反应化学方程式:Si + 4HF = SiF4↑ + 2H2↑6.工业制粗硅的化学方程式:SiO2 + 2C高温Si + 2CO↑7.工业由SiCl4制纯硅的化学方程式:SiCl4 + 2H2高温Si + 4HCl8.SiO2与氢氟酸反应的化学方程式:SiO2 + 4HF = SiF4↑ + 2H2O9.SiO2与碱性氧化物(CaO)反应的化学方程式:SiO2 + CaO 高温CaSiO310.SiO2与石灰石反应的化学方程式:S iO2 + CaCO3高温CaSiO3 + CO2↑11.SiO2与强碱NaOH溶液反应的化学方程式:SiO2 + 2NaOH = Na2SiO3 + H2O离子方程式:SiO2 + 2OH -= SiO32-+ H2O12.工业制玻璃的两个反应化学方程式:SiO2 + CaCO3高温CaSiO3 + CO2↑SiO2 + Na2CO3高温Na2SiO3 + CO2↑13.H2SiO3与强碱NaOH溶液的反应:化学方程式:H2SiO3+2NaOH=Na2SiO3+ H2O离子方程式:H2SiO3+2OH-=SiO32-+ H2O14.硅酸的热稳定性很弱,受热分解:化学方程式:H2SiO3∆H2O + SiO215.向硅酸钠溶液中通入足量的CO2的反应:化学方程式:Na2SiO3 + 2CO2 + 2H2O =H2SiO3↓+2NaHCO3离子方程式:SiO32- + 2CO2 + 2H2O =H2SiO3↓+2HCO3-16.向硅酸钠溶液中通入少量的CO2的反应:化学方程式:Na2SiO3 + CO2 + H2O=H2SiO3↓+Na2CO3离子方程式:SiO32- + CO2 + H2O=H2SiO3↓+CO32-17. 向硅酸钠溶液中滴加稀盐酸的反应:化学方程式:Na2SiO3 + 2HCl =H2SiO3↓+2NaCl离子方程式:SiO32- + 2H+=H2SiO3↓方程式7 铝及其化合物方程式1.铝在氧气中燃烧化学方程式4Al + 3O2点燃2Al2O32.铝在氯气中燃烧化学方程式2Al + 3Cl2点燃2AlCl33.铝与硫共热化学方程式2Al + 3S2AlCl34.铝和盐酸反应化学方程式2Al + 6HCl = 2AlCl3 + 3H2↑离子方程式2Al + 6H+ = 2Al3++ 3H2↑硅、铝方程式1。
硅知识点总结

硅及其化合物年月日硅元素在地壳中的含量排第二,在自然界中没有游离态的硅,只有以化合态存在的硅,常见的是二氧化硅、硅酸盐等。
硅的原子结构示意图为,硅元素位于元素周期表第三周期第ⅣA族,硅原子最外层有4个电子,既不易失去电子又不易得到电子,主要形成四价的化合物。
1、单质硅〔Si〕:〔1〕物理性质:有金属光泽的灰黑色固体,熔点高,硬度大。
〔2〕化学性质:①常温下化学性质不生动,只能跟F2、HF和NaOH溶液反响。
Si+2F2=SiF4Si+4HF=SiF4↑+2H2↑Si+2NaOH+H2O=Na2SiO3+2H2↑②在高温条件下,单质硅能与O2和Cl2等非金属单质反响。
Si+O2高温SiO2Si+2Cl2高温SiCl4〔3〕用途:太阳能电池、计算机芯片以及半导体材料等。
〔4〕硅的制备:工业上,用C在高温下复原SiO2可制得粗硅。
SiO2+2C=Si(粗)+2CO↑Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(纯)+4HCl2、二氧化硅〔SiO2〕:〔1〕SiO2的空间结构:立体网状结构,SiO2直接由原子构成,不存在单个SiO2分子。
〔2〕物理性质:熔点高,硬度大,不溶于水。
〔3〕化学性质:SiO2常温下化学性质很不生动,不与水、酸反响〔氢氟酸除外〕,能与强碱溶液、氢氟酸反响,高温条件下可以与碱性氧化物反响:①与强碱反响:SiO2+2NaOH=Na2SiO3+H2O〔生成的硅酸钠具有粘性,所以不能用带磨口玻璃塞试剂瓶存放NaOH溶液和Na2SiO3溶液,预防Na2SiO3将瓶塞和试剂瓶粘住,打不开,应用橡皮塞〕。
②与氢氟酸反响[SiO2的特性]:SiO2+4HF=SiF4↑+2H2O〔利用此反响,氢氟酸能雕刻玻璃;氢氟酸不能用玻璃试剂瓶存放,应用塑料瓶〕。
③高温下与碱性氧化物反响:SiO2+CaO高温CaSiO3〔4〕用途:光导纤维、玛瑙饰物、石英坩埚、水晶镜片、石英钟、仪器轴承、玻璃和建筑材料等。
必修一化学方程式总结

必修一化学方程式汇总一、钠及其化合物钠单质1、常温下,钠在空气中被缓慢氧化:4Na + O2 == 2Na2O(白色固体)2、加热或点燃下,钠与氧气反应:2Na + O2Na2O2(淡黄色固体)3、钠投入水中(现象:浮、熔、游、响、红):2Na + 2H2O == 2NaOH + H2↑4、钠投入盐酸或硫酸氢钠溶液:2Na + 2HCl == 2NaCl + H2↑2Na + H2SO4 == Na2SO4 + H2↑离子反应均为:2Na + 2H+ == 2Na+ + H2↑5、钠投入硫酸铜溶液(钠无法从溶液中置换其它金属单质)钠与水先反应: 2Na + 2H2O == 2NaOH + H2↑生成的氢氧化钠再与盐反应: 2NaOH+ CuSO4 == Cu(OH)2↓ + Na2SO4总反应:2Na + 2H2O + CuSO4 == Cu(OH)2↓ + Na2SO4 + H2↑氧化钠和过氧化钠1、氧化钠和水反应:Na2O + H2O == 2NaOH2、氧化钠和二氧化碳反应:Na2O + CO2 == Na2CO33、氧化钠和盐酸反应:Na2O + 2HCl == 2NaCl + H2O4、过氧化钠和水反应: 2Na2O2 + 2H2O == 4NaOH + O2↑5、过氧化钠和二氧化碳反应: 2Na2O2 + 2CO2 == 2Na2CO3 + O26、过氧化钠和盐酸反应:2Na2O2 + 4HCl == 4NaCl + 2H2O + O2↑7、氧化钠受热可与氧气反应生成过氧化钠:2Na2O + O22Na2O2氢氧化钠氢氧化钠俗称烧碱、苛性钠、火碱。
易溶于水,水溶液显强碱性1、氢氧化钠与酸反应:NaOH + HCl == NaCl + H2ONaOH + CH3COOH == CH3COONa + H2O2、氢氧化钠与酸性氧化物反应:NaOH溶液中通入少量CO2:2NaOH + CO2 = Na2CO3 + H2ONaOH溶液中通入过量CO2:NaOH + CO2 = NaHCO3碳酸钠和碳酸氢钠1、碳酸钠俗称纯碱、苏打。
有关硅及其重要化合物化学方程式小结

有关硅及其重要化合物化学方程式小结1、Si
(1)与氧气反应
(2)与氯气反应
(与氢氧化钠溶液反应
2、SiO2
(1)与氧化钙反应
(2)与氢氧化钠溶液反应
(3)与氢氟酸反应
(4)与碳酸钠反应
(5)与碳酸钙反应
(6)与碳单质反应
3、H2SiO3
(1)与氢氧化钠溶液反应
(2)受热分解
4、Na2SiO3
(1)与稀硫酸反应
(2)与二氧化碳和水反应
有关硅及其重要化合物化学方程式小结 有关硅及其重要化合物化学方程式小结1,si (1)与氧气反应 (2)与氯气反应 (3)与氟气反应 (4)与氢氟酸反应 (5)与氢氧化钠溶液反应 2,sio2 (1)与氧化钙反应 (2)与氢氧化钠溶液反应 (3)与氢氟酸反应 (4)与碳酸钠反应 (5)与碳酸钙反应 (6)与碳单质反应 3,h2sio3 (1)与氢氧化钠溶液反应 (2)受热分解 4,na2sio3 (1)与稀硫酸反应 (2)与二氧化碳和水反应
硅化学方程式

硅及其化合物序反应物及反应条件化学反应方程式离子反应方程式1 硅在氧气中加热Si + O2△ SiO2×2 硅和氟气反应Si + 2F2 = SiF4×3 硅和氢氟酸反应Si + 4HF = SiF4+2H2×4 硅和氢氧化钠溶液反应Si + 2NaOH + H2O = Na2SiO3+2H2↑Si + 2OH-+ H2O = SiO32-+2H2↑5 二氧化硅和氢氧化钠溶液反应SiO2+ 2NaOH = Na2SiO3+ H2O SiO2+ 2OH- = SiO32- + H2O6 二氧化硅和氢氟酸反应SiO2 + 4HF = SiF4↑ + 2H2O SiO2+ 4HF = SiF4↑ + 2H2O7 硅酸钠和稀盐酸反应Na2SiO3+ 2HCl = 2NaCl + H2SiO3↓2H+ + SiO32- =H2SiO3↓8 硅酸钠溶液通入二氧化碳Na2SiO3+ CO2+ H2O = Na2CO3+ H2SiO3↓SiO32- + CO2+ H2O = CO32-+H2SiO3↓9 工业上用二氧化硅制取单质硅SiO2+ 2C 高温电炉Si + 2CO↑×10 碳酸钠和二氧化硅高温下反应SiO2+ Na2CO3高温Na2SiO3+ CO2↑×11 碳酸钙和二氧化硅高温下反应SiO2+ CaCO3高温CaSiO3+ CO2↑×硅酸盐产品生产条件生产设备生产原理化学成分12 水泥高温水泥回转窑3CaO·SiO2、3CaO·Al2O3、2CaO·SiO213 玻璃高温玻璃窑Na2CO3+SiO2=Na2SiO3+CO2↑CaCO3+SiO2=CaSiO3+CO2↑Na2O·CaO·6SiO214 陶瓷高温窑炉氧化硅、氧化铝、、氧化钠、、氧化镁、、氧化钛等15 俗名硅石石英水晶玛瑙刚玉16 主要化学成分SiO2SiO2SiO2SiO2Al2O3合金生铁钢熟铁合金钢青铜黄铜白铜铝合金主要成分Fe、C Fe、C Fe、C Fe、C Cu、Sn Cu、Zn Cu、Ni、Zn Al 合金的特点良好的物理、化学和机械性能;硬度大、熔点低。
硅和硅的化合物方程式

硅和硅的化合物
1、硅和氢氧化钠溶液反应的化学方程式:
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
2、硅和氢氧化钠溶液反应的离子方程式:
Si +2OH—+ H2O= SiO32—+ 2H2↑
3、硅和氢氟酸反应的化学方程式:
Si + 4HF= SiF4↑ + 2H2↑
4、保存氢氧化钠溶液的试剂瓶不用玻璃瓶的原因:
SiO2 + 2NaOH = Na2SiO3 + H2O
5、用氢氟酸刻蚀玻璃的原理:
SiO2 + 4HF= SiF4↑+ 2H2O
6、制玻璃的反应原理:
SiO2 + Na2CO3 = Na2SiO3 + CO2↑(高温条件自己写)
SiO2 +CaCO3 = CaSiO3 + CO2↑(高温条件自己写)
7、制粗硅的反应原理:
2C + SiO2 = Si + 2 CO↑(高温条件自己写)
8、制硅酸的反应方程式:(写三个反应)
Na2SiO3 + 2HCl= 2NaCl + H2SiO3(胶体)
Na2SiO3 + CO2(少)+H2O = Na2CO3 + H2SiO3(胶体)
Na2SiO3 + 2CO2(多)+2H2O = 2NaHCO3 + H2SiO3(胶体)
9、二氧化硅和氧化钙反应:
SiO2 + CaO = CaSiO3 (高温条件自己写)
10、二氧化硅在自然界的存在形态有结晶型和无定形,统称为硅石。
说出二氧化硅的一种用途制光导纤维。
11、陶瓷的原料黏土,制玻璃的原料是石灰石、纯碱和石英,制水泥的原料以黏土和石灰石为主要原料,在加入适量的石膏12、说出硅的两点用途:计算机芯片和硅太阳能电池
硅酸的主要用途制硅胶干燥剂硅酸钠的主要用途木材防火剂。
化学第四章非金属及其化合物化学方程式总结

第四章非金属及其化合物方程式总结----------加粗的是对应的离子方程式一、硅及其化合物1、硅单质物理性质:有金属光泽的灰黑色固体,熔点高,硬度大,质地脆,导电性介于导体和绝缘体之间。
化学性质:常温下化学性质稳定硅的还原性:Si(粉)+O2SiO2粗硅的制取:2C+SiO2Si+2CO(制得粗硅)粗硅的提纯:Si(粗)+2Cl2SiCl4SiCl4+2H2=Si(纯)+4HCl硅与强碱的反应:Si+2NaOH+H2O =Na2SiO3+2H2↑ 2OH-+ Si+H2O =SiO32–+H2↑硅与氢氟酸反应:4HF+Si=SiF4↑+2H2↑硅的用途:硅可制造集成路、电子芯片、太阳能电池板等。
2、二氧化硅及硅酸存在:结晶形和无定形。
通称硅石。
性质:化学性质稳定,除氢氟酸外,一般不与其他酸反应,可以与强碱、碱性氧化物发生反应,属酸性氧化物。
用途:SiO2是光导纤维的主要原料,以SiO2为主要原料的物质大多都有石英某某、水晶某某;玛瑙某某。
①Si(粉)+O2SiO2②与碱性氧化物反应:SiO2+CaO CaSiO3③与碱的反应:SiO2+2NaOH=Na2SiO3+H2O OH-+SiO2=SiO32–+H2O④硅酸盐与酸生成硅酸的反应:Na2SiO3+2HCl=H2SiO3(胶体)+NaCl SiO32-+2H+=H2SiO3(胶体)Na2SiO3+CO2+2H2O=H2SiO3↓+Na2CO3SiO32-+CO2+H2O=H2SiO3↓+CO32-⑤与氢氟酸反应:SiO2+4HF =SiF4↑+2H2O硅酸易受热分解:H2SiO3 SiO2↓+H2O3、硅酸盐硅酸盐是由硅、氧和金属组成的化合物的总称,在自然界分布极广,种类极多,是一类结构复杂的固体物质,大多不溶于水,化学性质很稳定。
硅酸钠:(最简单的硅酸盐)可溶于水,其水溶液俗称水玻璃,可做粘合剂和防火剂,是制备硅胶和木材防火剂等的原料。
制备途径:SiO2+2NaOH=Na2SiO3+H2O OH-+SiO2=SiO32–+H2O(贮存NaOH溶液的试剂瓶要用橡胶塞)常见的硅酸盐产品:陶瓷、玻璃、水泥二、氯及其化合物1、氯气(Cl2)Cl2的制取:原理:4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O4H++2Cl–+MnO2Mn2++Cl2↑+2H2O发生装置:固液加热型实验装置:(见右图)气体收集装置:向上排空气法(或排饱和食盐水法)尾气处理装置:用碱液(NaOH)吸收物理性质:①黄绿色②气体③有刺激性气味④有毒⑤密度比空气大⑥2:1体积溶于水⑦易液化化学性质:a、与水(H2O)的反应:Cl2 + H2O = HCl + HClO Cl2 + H2O = H++Cl—+ HCl 用途:可用于自来水的杀菌、消毒新制氯水中的粒子:Cl2;H2O;HClO;H+;Cl-;ClO-;OH-(少量)久置氯水中的粒子:H+;Cl-;H2O;OH-(少量)b、与碱反应:氯气+碱==氯酸盐+次氯酸盐+水(此反应中氯气既作氧化剂又作还原剂)与NaOH反应:Cl2+2NaOH=NaCl+NaClO+H2O Cl2+2OH–=Cl–+ClO–+H2O(产物NaClO:漂白液的主要成分)与Ca(OH)2反应:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl2+2OH–=Cl–+ClO–+H2O(产物Ca(ClO)2:漂白粉、漂白精的主要成分)注:漂白粉产生作用的原因:Ca(ClO)2+CO2+H2O= 2HClO +CaCO3↓且次氯酸易分解(现制现用):2HClO2HCl+O2↑c、与金属的反应:与Na的反应:2Na+ Cl22NaCl 现象:有黄光,燃烧,产生白烟与Fe的反应:3Cl2+2Fe2FeCl3现象:燃烧,产生棕黄色的烟与Cu的反应:Cu + Cl2CuCl2现象:燃烧,产生棕黄色的烟d、与非金属的反应:与H2的反应:H2+Cl22HCl现象:H2在Cl2中燃烧,产生苍白色火焰2、氯离子(Cl-)的检验原理:Ag++Cl- = AgCl试剂:AgNO3溶液和稀硝酸(HNO3)操作:(加稀硝酸的作用是除去干扰离子:CO32-)方法一:在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
硅及其化合物方程式
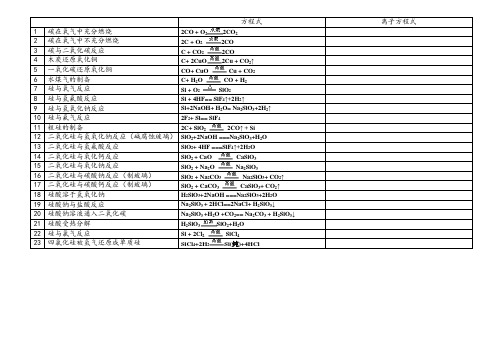
方程式离子方程式1 碳在氧气中充分燃烧2CO + O2CO222 碳在氧气中不充分燃烧2C + O22CO3 碳与二氧化碳反应 C + CO2CO24 木炭还原氧化铜C+ 2CuO2Cu + CO↑25 一氧化碳还原氧化铜CO+ CuO Cu + CO26 水煤气的制备C+ HO CO + H227 硅与氧气反应Si + O2SiO28 硅与氢氟酸反应Si + 4HF== SiF4↑+2H2↑9 硅与氢氧化钠反应Si+2NaOH+ H2O= Na2SiO3+2H2↑10 硅与氟气反应2F2+ Si== SiF411 粗硅的制备2C+ SiO2CO↑ + Si212 二氧化硅与氢氧化钠反应(碱腐蚀玻璃)SiO2+2NaOH ===Na2SiO3+H2O13 二氧化硅与氢氟酸反应SiO2+ 4HF ===SiF4↑+2H2O14 二氧化硅与氧化钙反应SiO+ CaO CaSiO3215 二氧化硅与氧化钠反应SiO+ Na2O Na2SiO3216 二氧化硅与碳酸钠反应(制玻璃)SiO+ Na2CO3Na2SiO3+ CO2↑217 二氧化硅与碳酸钙反应(制玻璃)SiO+ CaCO3CaSiO3+ CO2↑218 硅酸溶于氢氧化钠H2SiO3+2NaOH ===Na2SiO3+2H2O19 硅酸钠与盐酸反应Na2SiO3 + 2HCl==2NaCl+ H2SiO3↓20 硅酸钠溶液通入二氧化碳Na2SiO3 +H2O +CO2== Na2CO3 + H2SiO3↓21 硅酸受热分解H2SiO3SiO2+H2O22 硅与氯气反应Si + 2ClSiCl4223 四氯化硅被氢气还原成单质硅SiCl+2H2Si(纯)+4HCl4。
硅及其化合物知识总结

硅及其化合物知识总结1.硅单质(Si)(1)存在:硅是一种亲氧元素,在自然界中以化合态存在,在地壳中的含量仅次于氧。
(2)物理性质:晶体硅是灰黑色固体,硬度大,熔、沸点高,具有金属光泽。
(3)化学性质:常温下能与F 2、HF 、NaOH 反应;加热时能与H 2化合生成不稳定的氢化物SiH 4,还能与Cl 2、O 2化合分别生成SiCl 4、SiO 2。
涉及的化学方程式如下:2:Si +O 2=====△SiO 22:Si +2F 2===SiF 42:Si +2Cl 2=====△SiCl 4②与氢氟酸反应:Si +4HF===SiF 4↑+2H 2↑。
③与NaOH 溶液反应:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑(4)用途:①良好的半导体材料;②太阳能电池;③计算机芯片。
(5)高纯硅的制备①SiO 2+2C=====高温Si(粗)+2CO ↑(1800~2000℃)②③2.二氧化硅(SiO 2)(1)存在与形态SiO 2的存在形态有结晶形和无定形两大类。
自然界中的二氧化硅,存在于沙子、水晶、玛瑙,石英等中。
(2)结构SiO 2是由Si 原子和O 原子按个数比1∶2直接构成的立体网状结构的晶体。
(3)二氧化硅与二氧化碳都是酸性氧化物,二者的性质与用途比较性质与用途二氧化硅二氧化碳物理性质硬度大,熔、沸点高,不溶于水熔、沸点低,可溶于水化学性质与水反应不反应CO 2+H 2OH 2CO 3与酸反应(只与HF 反应)氢氟酸用于刻蚀玻璃:SiO 2+4HF===SiF 4↑+2H 2O不反应与碱反应(如NaOH)SiO 2+2NaOH===Na 2SiO 3+H 2O(盛碱液的试剂瓶不能用玻璃塞)CO 2+2NaOH===Na 2CO 3+H 2O 或CO 2+NaOH===NaHCO 3与盐反应(如Na 2CO 3)SiO 2+Na 2CO 3=====高温Na 2SiO 3+CO 2↑CO 2+Na 2CO 3+H 2O===2NaHCO 3与碱性氧化物反应与CaO 反应:SiO 2+CaO=====高温CaSiO 3与Na 2O 反应:CO 2+Na 2O===Na 2CO 3与碳反应2C +SiO 2=====高温Si +2CO ↑C +CO 2=====高温2CO 主要用途制光学仪器、石英玻璃;水晶和玛瑙可制作饰品;常用来制造通讯材料——光导纤维;以SiO 2为主要成分的沙子是基本的建筑材料化工原料、灭火剂;干冰用作制冷剂,人工降雨3.硅酸(H 2SiO 3)(1)物理性质:难溶于水的白色胶状物质。
硅及其重要化合物

调节水泥的硬化速度
二、硅单质
1、硅的物理性质:
灰黑色有金属光泽的晶体,熔沸点 高,硬度大。
2、晶体硅的结构:
正四面体空间网状结构。
硅原子
3、化学性质
硅单质在常温下化学性质稳定,与氧气、 氯气、硝酸、硫酸等物质都很难发生反应, 但能与氟气、氢氟酸、强碱反应。
在加热时能跟O2等物质发生反应。常作 为还原剂。
①与F2反应 Si + 2F2 = SiF4
制取纯硅:
高温
Si+2Cl2 =
SiCl4 (液态)
高温
SiCl4+2H2 = Si+4HCl
一、二氧化硅
1、存在形式
沙子、石英、水晶、硅藻土等。
2、 物理性质
熔沸点高,硬度大,不溶于水的固体,不 导电。
3、 SiO2的化学性质
常温下,性质稳定,不与水,酸(除氢氟酸 外)反应。但能与单质氟、和强碱溶液,碱性 氧化物反应,属酸性氧化物。
②与HF反应 Si + 4HF = SiF4↑+ 2H2↑ ③与碱反应
Si + H2O + 2NaOH = Na2SiO3 + 2H2↑ ④与O2等非金属反应
△ Si + O2 = SiO2 Si + C =高=温SiC(金刚砂)
4、硅的制取: 高温 制取粗硅:SiO2+2C = Si+2CO↑
粗硅在高温下跟氯气 反应生成一种液态物质。 经蒸馏提纯后,再用氢气还原制得纯硅。
SiO2 + 2F2 = SiF4 + O2
SiO2 + 4HF = SiF4 ↑ + 2H2O(雕刻玻璃)
硅及其化合物方程式

方程式离子方程式1碳在氧气中充分燃烧2CO + O22CO22碳在氧气中不充分燃烧2C + O22CO3碳与二氧化碳反应 C + CO22CO4木炭还原氧化铜C+ 2CuO2Cu + CO2↑5一氧化碳还原氧化铜CO+ CuO Cu + CO26水煤气的制备C+ H2O CO + H27硅与氧气反应Si + O2 SiO28硅与氢氟酸反应Si + 4HF== SiF4↑+2H2↑9硅与氢氧化钠反应Si+2NaOH+ H2O= Na2SiO3+2H2↑10硅与氟气反应2F2+ Si== SiF411粗硅的制备2C+ SiO22CO↑ + Si12二氧化硅与氢氧化钠反应(碱腐蚀玻璃)SiO2+2NaOH ===Na2SiO3+H2O13二氧化硅与氢氟酸反应SiO2+ 4HF ===SiF4↑+2H2O14二氧化硅与氧化钙反应SiO2 + CaO CaSiO315二氧化硅与氧化钠反应SiO2 + Na2O Na2SiO316二氧化硅与碳酸钠反应(制玻璃)SiO2 + Na2CO3 Na2SiO3+ CO2↑17二氧化硅与碳酸钙反应(制玻璃)SiO2 + CaCO3 CaSiO3+ CO2↑18硅酸溶于氢氧化钠H2SiO3+2NaOH ===Na2SiO3+2H2O19硅酸钠与盐酸反应Na2SiO3 + 2HCl==2NaCl+ H2SiO3↓20硅酸钠溶液通入二氧化碳Na2SiO3 +H2O +CO2== Na2CO3 + H2SiO3↓21硅酸受热分解H2SiO3SiO2+H2O22硅与氯气反应Si + 2Cl2 SiCl423四氯化硅被氢气还原成单质硅SiCl4+2H2Si(纯)+4HCl。
硅化学方程式

二氧化硅和氢氧化钠溶液反应
SiO2+ 2NaOH = Na2SiO3+ H2O
SiO2+ 2OH-= SiO32-+ H2O
6
二氧化硅和氢氟酸反应
SiO2+ 4HF = SiF4↑+ 2H2O
SiO2+ 4HF = SiF4↑+ 2H2O
7
硅酸钠和稀盐酸反应
Na2SiO3+ 2HCl = 2NaCl + H2SiO3↓
×
11
碳酸钙和二氧化硅高温下反应
SiO2+ CaCO3高温CaSiO3+ CO2↑
×
硅酸盐产品
生产条件
生产设备
生产原理
化学成分
12
水泥
高温
Hale Waihona Puke 水泥回转窑3CaO·SiO2、3CaO·Al2O3、2CaO·SiO2
13
玻璃
高温
玻璃窑
Na2CO3+SiO2=Na2SiO3+CO2↑
CaCO3+SiO2=CaSiO3+CO2↑
2H++ SiO32-=H2SiO3↓
8
硅酸钠溶液通入二氧化碳
Na2SiO3+ CO2+ H2O = Na2CO3+ H2SiO3↓
SiO32-+ CO2+ H2O = CO32-+ H2SiO3↓
9
工业上用二氧化硅制取单质硅
SiO2+2C高温电炉Si + 2CO↑
×
10
碳酸钠和二氧化硅高温下反应
SiO2+Na2CO3高温Na2SiO3+CO2↑
高中化学硅的化学方程式总结

高中化学硅的化学方程式总结1、与单质反应Si + O₂ == SiO₂,条件:加热Si + 2F₂ == SiF₄Si + 2Cl₂ == SiCl₄,条件:高温2、高温真空条件下可以与某些氧化物反应2MgO + Si=高温真空 =Mg(g)+SiO₂(硅热还原法炼镁)3、与酸反应只与氢氟酸反应:Si + 4HF == SiF₄↑ + 2H₂↑4、与碱反应Si + 2OH⁻+ H₂O == SiO₃²⁻+ 2H₂↑(如NaOH,KOH)5、其他相关方程式Si + 2OH⁻ + H₂O == SiO₃²⁻+ 2H₂↑Si+2F₂== SiF₄Si+4HF== SiF₄↑+2H₂↑SiO₂ + 2OH⁻== SiO₃²⁻+ H₂OSiO₃²⁻+ 2NH₄⁺+ H₂O == H₄SiO₄↓ + 2NH₃↑SiO₃²⁻+ CO₂ + 2H₂O == H₄SiO₃↓+ CO₃²⁻SiO₃²⁻+ 2H⁺== H₂SiO₃↓SiO₃²⁻+2H⁺+H₂O == H₄SiO₄↓H₄SiO₄ == H₂SiO₃ + H₂O3SiO₃²⁻+ 2Fe³⁺== Fe₂(SiO₃)₃↓3SiO₃²⁻+2Al³⁺==Al₂(SiO₃)₃↓Na₂CO₃ + SiO₂ =高温= Na₂SiO₃ + CO₂↑扩展资料硅是一种类金属元素,化学符号为Si,原子序数为14,属于元素周期表上的IVA族。
硅原子有4个外围电子,与同族的碳相比,硅的化学性质相对稳定,活性较低。
硅是极为常见的一种元素,然而它极少以单质的形式存在于自然界,而是以复杂的硅酸盐或二氧化硅等化合物形式广泛存在于岩石、砂砾、尘土之中。
在宇宙储量排名中,硅位于第八名。
