达卡他韦片使用说明书
丙肝新药索非布韦、达卡他韦

丙肝新药索非布韦、达卡他韦索非布韦索非布韦(英文名Sofosbuvir,商品名Sovaldi)是吉利德公司开发用于治疗慢性丙肝的新药,于2013年12月6日经美国食品药品监督管理局(FDA)批准在美国上市,2014年1月16日经欧洲药品管理局(EMEA)批准在欧盟各国上市。
该药还未在中国上市,只能去国外医院获得。
索非布韦是首个无需联合干扰素就能安全有效治疗某些类型丙肝的药物。
临床试验证实针对1和4型丙肝,该药物联合聚乙二醇干扰素和利巴韦林的总体持续病毒学应答率高达(SVR)90%;针对2型丙肝,该药物联合利巴韦林的SVR为89%-95%;针对3型丙肝,该药物联合利巴韦林的SVR为 61%-63%。
值得一提的是,索非布韦的临床试验还包含了一些丙肝合并肝硬化的患者,疗效也较显著。
达卡他韦达卡他韦(英文名Daclatasvir)是英国和日本上市的一种治疗丙肝药物,效果和治疗周期与索非布韦较为相似。
据悉,美国正在研究达卡他韦的联合用药,目前还没有相关的上市消息。
达卡他韦与索非布韦用法及疗效对比:表一:表二:什么是丙型肝炎?丙型肝炎(丙肝)是一种传染性肝脏疾病,严重程度不一,轻度丙肝只出现轻微症状,持续数周,重度丙肝则损害肝脏,持续终身。
丙肝源于丙型肝炎病毒(HCV)感染,主要通过接触感染者血液传播。
丙肝可分为急性与慢性。
急性丙肝病毒感染:指丙肝病毒感染后最初6个月内的急性病。
对于大多数人来说,急性感染通常会转变为慢性感染。
慢性丙肝病毒感染:指丙肝病毒长期存留在人体内的慢性病。
丙肝病毒感染可以持续终生,引起严重的肝脏疾病,如肝硬化与肝癌。
作为RNA病毒,HCV的基因组具有高度变异特性。
利用现代遗传分类方法,可将HCV分为6个基因型和80多个亚型。
我国流行的HCV有1、2、3和6四种基因型,以1b和2a型为主。
丙肝如何传播?丙肝一般通过血液传播,即丙肝病毒感染者的血液进入未传染者的血液中。
人们可能在进行以下活动时感染上丙肝病毒:➢共用针头、注射器或其他药物注射仪器➢在医疗卫生场所受针刺伤➢丙肝病毒的母婴传播少见的感染途径:➢共用可能接触到他人血液的私人物品,如刮胡刀与牙刷➢与丙肝病毒感染者进行性接触丙肝的长期影响有哪些?丙肝病毒感染者中:75%-85%会发展成慢性丙肝病毒感染60%-70%会发展为慢性肝病5%-20%会在20-30年间发展为肝硬化1%-5%会死于肝硬化或肝癌丙肝是否需要治疗?丙肝患者有可能自愈,约15%-25%的丙肝患者不经过治疗可以将体内的病毒清除,但大部分患者是无法自愈会发展成慢性丙肝,因此是需要治疗的。
了解日本丙肝新药达卡他韦

告诉你如何购买日本丙肝新药达卡他韦2015年6月26日孟先生拿着最新的检查报告来到杭州与五舟交流,五舟蒋医生向孟先生介绍了目前对于I型丙肝患者的几种国外主要疗法,几种疗法中治愈率最高的治疗方案为索非布韦+达卡他韦的联合用药,即“欧盟组合”。
对于孟先生这类I型丙肝患者,该治疗方案目前治愈率达98%以上。
孟先生经过考虑后决定与五舟签约合作医院日本大阪凤凰医院的专家教授进行远程视频会诊。
日本专家教授远程视频会诊是指,为了减少患者舟车劳累坐着飞机才能接受到国外的先进医疗的痛苦,真正的实现利用现代网络,把国外的医生请进“家”。
孟先生是一位来自安徽合肥的患者。
20年前因尿毒症行过肾移植术,当时在手术期间有透析、输血史。
三年后孟先生在做复查时发现丙肝抗体阳性,被确诊为丙肝病患者。
近20年来孟先生一直在当地医院进行抗病毒治疗,在经过各式的丙肝治疗都没有起色的情况下,孟先生曾经一度对生活失去了信心。
最近,孟先生正在当地医院住院治疗中,国内主治医生介绍国外已经有最新型的丙肝口服治疗药物,治愈率极高,给国内的很多丙肝患者带来了福音。
2015年6月17日孟先生在朋友的介绍下,首次来到五舟对国外治疗丙肝的情况进行了咨询。
孟先生在病房视频会诊中孟先生最初咨询国外丙肝新药治疗时还没有测过自己是哪种丙肝基因分型。
孟先生随后听从五舟蒋医生建议,在当地医院进行了丙肝的各项相关检查,包括:最新的病毒量、基因型和最新肝功能、血常规等检查。
2015年6月26日孟先生拿着最新的检查报告来到杭州与五舟交流,五舟蒋医生向孟先生介绍了目前对于I型丙肝患者的几种国外主要疗法,几种疗法中治愈率最高的治疗方案为索非布韦+达卡他韦的联合用药,即“欧盟组合”。
对于孟先生这类I型丙肝患者,该治疗方案目前治愈率达98%以上。
孟先生经过考虑后决定与五舟签约合作医院日本大阪凤凰医院的专家教授进行远程视频会诊。
日本专家教授远程视频会诊是指,为了减少患者舟车劳累坐着飞机才能接受到国外的先进医疗的痛苦,真正的实现利用现代网络,把国外的医生请进“家”。
抗癫痫药物使用
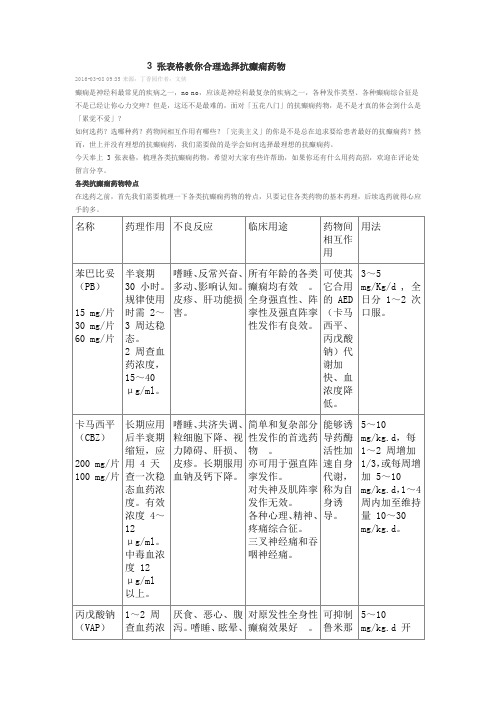
对失神及肌阵挛发作无效。
各种心理、精神、疼痛综合征。
三叉神经痛和吞咽神经痛。
能够诱导药酶活性加速自身代谢,称为自身诱导。
5~10 mg/kg.d,每 1~2 周增加 1/3,或每周增加 5~10 mg/kg.d,1~4 周内加至维持量 10~30 mg/kg.d。
丙戊酸钠(VAP)
VPA、TPM、CZP
LEV
CBZ、OXC 可能加重
伴枕部爆发活动的儿童良性癫痫
VPA、CBZ、LTG、OXC
LEV、TPM
儿童失神癫痫
VPA、LTG、ESM(乙琥胺)
LEV、TPM
CBZ、OXC、PHT(苯妥英钠)可能加重
青少年肌阵挛
VPA、LTG
LEV、CZP
CBZ、OXC、PHT(苯妥英钠)可能加重
婴儿痉挛症
ACTH、VPA、CZP
CZP、VPA、TPM
CBZ、OXC
兰诺克斯综合征(LGS)
VPA、TPM、LTG
CZP、LEV
CBZ、OXC
根据发作类型选药
发作类型
一线药物
二线药物
可能加重
强直-阵挛发作
VPA
LEV、TPM
失神发作
VPA、LTG
TPM
CBZ、OXC、TPM
肌阵挛发作
VPA、TPM
地西泮
10 mg/支
易激惹,肌张力低下,镇静,呼吸暂停,低血压,心跳停止。
各型癫痫持续状态的首选用药。
开始剂量 0.2~0.3 mg/kg ,注射速度不超过 2 mg/min , 一次用量不超过 10 mg。必要时 15~30分钟可重复一次。
根据癫痫综合征选药
发作类型
说明书索菲布韦

说明书索菲布韦篇一:索菲布韦详细说明书20XX中文版SOVALDITM 片,为口服使用美国初次批准:20XX适应证和用途SOVALDI是一种丙型肝炎病毒核苷酸类似物NS5B聚合酶抑制剂适用为慢性丙型肝炎感染的治疗作为组合抗病毒治疗方案的一个组分。
(1)SOVALDI疗效已在有HCV基因型1,2,3或4感染受试者中被确定,包括有肝细胞癌符合米兰[Milan]标准和有HCV/HIV-1共-感染受试者。
剂量和给药方法(1)一片400 mg片每天1次有或无食物服用。
(2)应与利巴韦林[ribavirin]联用或与聚乙二醇化干扰素[pegylated干扰素]和利巴韦林联用为CHC的治疗。
建议联合治疗:(3)SOVALDI与利巴韦林联用共24周干扰素不合格可被考虑为被基因型1感染CHC患者。
(4)在有肝细胞癌等待肝移植直至48周或直至肝移植患者应被与联用利巴韦林为CHC的治疗,以先发生为准。
(5)对有严重肾受损或肾病终末期患者不能建议剂量。
剂型和规格片:400 mg。
禁忌证(1)当与聚乙二醇干扰素α/利巴韦林或单独利巴韦林联用时,对聚乙二醇干扰素α和/或利巴韦林的所有禁忌证也都应用于SOVALDI联合治疗。
(2)因为利巴韦林可能引起出生缺陷和胎儿死亡,在妊娠妇女和男性其女性伴侣妊娠时禁忌SOVALDI与聚乙二醇干扰素α/利巴韦林或利巴韦林联用。
警告和注意事项妊娠:利巴韦林可能致出生缺陷和胎儿死亡和动物研究已证明干扰素有流产效应;女性患者和男性患者的女性伴侣避免妊娠。
治疗开始前患者必须有一个阴性妊娠测试,使用至少2种有效非激素避孕方法和每月妊娠测试。
不良反应SOVALDI与利巴韦林联用观察到最常见不良事件是疲乏和头痛。
SOVALDI与聚乙二醇干扰素α和利巴韦林联用观察到最常见不良事件是疲乏,头痛,恶心,失眠和贫血。
为报告怀疑不良反应,联系Gilead Sciences,Inc.电话1-800-GILEAD-5或FDA电话1-800-FDA-1088或/medwatch.药物相互作用药物是强肠道P-gp诱导剂可能改变sofosbuvir的浓度。
他达那非片剂说明书

他达那非片剂说明书-Eli Lilly and Company Limited 【药品名称】他达拉非片【英文名】Tadalafil Tablet【汉语拼音】Tadalafei Pian【商品名】希爱力【主要成分】他达拉非【结构式及分子式、分子量】分子式:C22H19N3O4分子量:389.41【性状】10mg片为淡黄色,杏仁状,一面标有“C10”字样。
【药理毒理】药物治疗组:药物用于勃起功能障碍(ATC编码G04BE)。
他达拉非是环磷酸鸟苷(cGMP)特异性磷酸二酯酶5(PDE5)的选择性、可逆性抑制剂。
当性刺激导致局部释放一氧化氮,PDE5受到他达拉非抑制,使阴茎海绵体内cGMP水平提高。
这导致平滑肌松弛,血液流入阴茎组织,产生勃起。
如无性刺激,他达拉非不发生作用。
体外研究显示他达拉非是PDE5的选择性抑制剂。
PDE5是存在于阴茎海绵体平滑肌、血管和内脏平滑肌、骨骼肌、血小板、肾脏、肺和大脑内的一种酶。
他达拉非对PDE5的作用比对其他磷酸二酯酶的作用强。
他达拉非对PDE5的作用比对心脏、脑、血管、肝和其他脏器中发现的PDE1、PDE2、PDE4等的作用强10,000倍以上。
他达拉非对PDE5的作用比对心脏、血管中发现的PDE3的作用强10,000倍以上。
对PDE5的选择性超过PDE3很重要,因为PDE3与心肌收缩力有关。
此外,他达拉非对PDE5的作用强度是对PDE6的近700倍,后者存在于视网膜,参与光传导。
他达拉非对PDE5的作用强度比对PDE7-10高10,000倍以上。
1054名患者在家参与的三项研究确定了患者对他达拉非的反应时间。
与安慰剂相比,本品被证实在服药后短至16分钟,长达36小时内对勃起功能、进行成功性交的能力、达到和维持成功性交的勃起的能力均有统计学意义上的显著改善。
与安慰剂比较,健康受试者服用他达拉非后卧位收缩压和舒张压(平均最大降幅分别为1.6/0.8mmHg)和在站立位收缩压和舒张压(平均最大降幅分别为0.2/4.6mmHg)均无显著差别,心率无显著变化。
多替阿巴拉米片说明书

多替阿巴拉米片说明书【药品名称】通用名称:多替阿巴拉米片商品名称:绥美凯®;TRIUMEQ®英文名称:Dolutegravir Sodium, Abacavir Sulfate and Lamivudine Tablets汉语拼音:Duoti Aba Lami Pian【成份】本品为复方制剂,每片含多替拉韦钠(以多替拉韦计)50mg、硫酸阿巴卡韦(以阿巴卡韦计)600mg和拉米夫定300mg。
【性状】本品为薄膜衣片,除去包衣后显白色或类白色。
【适应症】本品适用于治疗感染人类免疫缺陷病毒(HIV)的成人和12岁以上青少年(体重至少为40 kg)。
在感染HIV患者中,无论患者人种如何,开始使用含阿巴卡韦的产品治疗前,应当筛查是否携带HLA-B*5701等位基因。
如果已知患者携带HLA-B*5701等位基因,不应当服用含有阿巴卡韦成份的产品。
【规格】每片含多替拉韦钠(以多替拉韦计)50mg、硫酸阿巴卡韦(以阿巴卡韦计)600mg和拉米夫定300mg。
【用法用量】本品应在具有HIV感染治疗经验的医师指导下服用。
剂量成人和青少年(体重至少为40 kg)对于成人和青少年,本品的推荐剂量为每次一片,每天一次。
如果成人或青少年的体重低于40 kg,不应当给予本品,因为本品是固定剂量片剂,不能减少剂量。
本品是固定剂量片剂,不能用于需要剂量调整的患者。
如果需要停用活性成分之一或对其实施剂量调整,可以使用单独的多替拉韦、阿巴卡韦或拉米夫定制剂。
在这些情况下,医师应当参考这些药品各自的产品信息。
漏服如果患者漏服一次本品,并且离下次服药还有4小时以上,应当尽快服用本品。
如果离下次给药不到4小时,患者不应当服用已漏服药物,只需重新恢复平常的给药计划即可。
老年患者在年龄大于等于65岁的患者中,多替拉韦、阿巴卡韦和拉米夫定的用药数据有限。
没有证据表明,老年患者需要与年轻成人患者不同的剂量(见【药代动力学】)。
达卡他韦药物说明书

一、适应症及用途
是丙型肝炎病毒(HCV)NS5A抑制剂,适用于基因3型感染慢性丙型肝炎感染的治疗。
使用限制:肝硬化患者中持续病毒学应答(SVR)率降低。
二、剂量和给药方法
λ每日一次60mg,结合索非布韦,空腹或与食物一起口服。
λ推荐治疗时间:12周。
λ剂量修正:使用强CYP3A抑制剂时减少剂量为30毫克,每日一次;使用中度CYP3A诱导剂时增加剂量至90毫克,每日一次。
三、剂型和规格
药片:60毫克和30毫克
四、注意事项
在与索非布韦和胺碘酮合用时,会发生心动过缓:服用胺碘酮与索非布韦和另一个HCV直接抗病毒药物(包括:达卡他韦)的患者可能发生严重的症状性心动过缓,特别是在患者同时服用β受试者阻滞剂或患有心脏疾病和/或晚期的肝病
时。
不推荐达卡他韦与胺碘酮和索非布韦同时服用。
对于没有其它治疗方案的患者,建议心脏监测。
五、不良反应
观察到索非布韦联合达卡他韦的最常见不良反应(≥10%)为头痛和疲劳。
六、药物相互作用
药物相互作用:同时服用达卡他韦可以改变其它药的浓度,而其他药物的浓度可以改变达卡他韦的浓度。
在使用禁用药物和其它潜在的药物相互作用之前,参考完整的处方信息。
七、特殊人群用药
对于妊娠、哺乳期妇女、儿童、老年人、肾功能损害者、肝功能损害者用药安全性和有效性请参看完整版说明书。
(丙通沙)(吉三代)索磷布韦维帕他韦片)-药品说明书
(丙通沙)(吉三代)ห้องสมุดไป่ตู้磷布韦维帕他韦片
药品规格:
28片
生产企业:
Gilead Sciences Ireland UC
用法用量:
Epclusa的推荐剂量为每日一次,每次口服一片,随食物或不随食物服用(参见【药代动力学】)。详情请见说明书。
分类:
化学药品
类型:
处方药
适应症:
本品用于治疗成人慢性丙型肝炎病毒(HCV)感染(参见【用法用量】、【注意事项】和【药理毒理】)。
相关疾病:
说明书:
商品名称:索磷布韦维帕他韦片
通用名称:索磷布韦维帕他韦片
主要成份:本品为复方制剂,其组份为:每片含400mg索磷布韦和100mg维帕他韦。
适应症:本品用于治疗成人慢性丙型肝炎病毒(HCV)感染(参见【用法用量】、【注意事项】和【药理毒理】)。
不良反应:-
禁忌:-
注意事项:警告:HCV和HBV合并感染患者中的乙型肝炎病毒再激活风险在开始EPCLUSA治疗前对所有患者进行当前或既往乙型肝炎病毒(HBV)感染迹象检测。已在正接受或已完成HCV直接作用抗病毒药物治疗及未接受HBV抗病毒治疗的HCV/HBV合并感染患者中报告了HBV再激活。一些病例导致了暴发性肝炎、肝衰竭和死亡。在HCV治疗和治疗后随访期间监测HCV/HBV合并感染患者是否出现肝炎发作或HBV再激活。根据临床指征对HBV感染实施适当的患者管理。Epclusa不应与含索磷布韦的其他药品同时给药。详情请见说明书。
药物相互作用:-
贮藏:置阴凉干燥处
备注:内容来源公开平台,仅供参考,详情以包装内说明书为准。
达卡他韦

2015年8月,达卡他韦(daclatasvir)这款口服小分子直接抗病毒药,再次成为丙肝治疗领域的焦点.
蒙特利尔,8月20日,加拿大卫生部正式批准施贵宝生产的(daclatasvir)用于治疗慢性丙型肝炎感染。
批准包括用于治疗成人患者的丙型肝炎基因1型和2型的代偿期肝病包括肝硬化和符合条件的代偿期肝病包括肝硬化3型患者的治疗,为加拿大医生治疗这些患者提供新的选择。
作为丙肝DAAs界的宠儿,达卡他韦和另一款DAAs药物索菲布韦(sofosbuvir),被誉为丙肝治疗领域的双星。
这两款药物的联合使用方案,在2015年7月24日,被美国食品药品监督管理局(FDA)正式批准适用于慢性丙型肝炎治疗,尤其对难治疗基因3型适用。
daclatasvir达卡他韦是第一个已经证明安全性和有效性,治疗基因3型丙型肝炎病毒感染的口服型药物,不需要干扰素和利巴韦林联合。
因为达卡他韦分子结构简单,手性位点较少,分子空间结构具有一定的灵活性,在丙肝病毒NS5A
蛋白氨基酸序列产生变异时,达卡他韦更有可能保持NS5A蛋白抑制剂作用。
在2015年4月的欧洲肝病大会上,达卡他韦联合索菲布韦的治疗方案就已经被EASL认定对特别难治疗的丙肝3型有良好疗效,并推出了权威的丙肝的推荐治疗方案”欧盟组合(daclatasvir+sofosbuvir)“。
老挝卫生部也在2015年5
月份批准了索菲尼(sofosbuvir)+达可汀纳(daclatasvir)在老挝上市。
如今达卡他韦已经被世界众多权威的卫生部们公认为丙肝治疗领域的最安全有效的DAAs药物,达卡他韦联合索菲布韦的治疗方案也将逐步在全球推广,人类战胜丙肝的日子即将到来!。
达卡他韦

达卡他韦Daklinza达卡他韦是第一个药物已显示安全性和疗效治疗基因型3HCV感染无需共同给予干扰素[interferon]或利巴韦林[ribavirin],FDA的药品评价和研究中心抗微生物产品室主任说:“今天的批准对有基因型3HCV患者提供一个新选择,包括那些不能耐受利巴韦林患者。
”DAKLINZA达卡他韦是一种丙型肝炎病毒(HCV)NS5A抑制剂适用为与索非布韦[sofosbuvir]使用为慢性HCV基因型3感染的治疗。
剂量⑴60mg 口服每天1次有或无食物与索非布韦联用。
⑵推荐治疗时间:12周。
⑶剂量修饰与强CYP3A抑制剂减低剂量至30 mg每天1次和与中度CYP3A诱导剂增加剂量至90mg每天1次。
CYP3A的强诱导剂,包括苯妥英钠[phenytoin],卡马西平[carbamazepine],利福平[rifampin],和圣约翰草[St. John’s wort.]。
(4)警告和注意事项布韦和胺碘酮共同给药:在服用胺碘酮与索非布韦联用与另一个HCV直接作用药物患者可能发生严重症状性心动过缓,包括DAKLINZA达卡他韦(daclatasvir),尤其是还接受β受体阻滞剂或那些具有潜在心脏合并症和/或晚期肝病患者。
建议胺碘酮与DAKLINZA与索非布韦联用不要共同给药。
建议在无另外治疗选择患者中监视心脏(5.2,6.2,7.3)。
DAKLINZA与索非布韦联用观察到最常见不良反应(≥10%)是头痛和疲乏。
(6.1)报告怀疑不良反应,联系Bristol-Myers Squibb电话1-800-721-5072或FDA电话1-800-FDA-1088或/medwatch.药物相互作用药物相互作用:DAKLINZA的共同给药可能改变其他药物的浓度和其他药物可能改变daclatasvir的浓度。
对禁忌药物和其他潜在药物-药物相互作用使用前咨询完整处方资料。
(2.2,4,5.1,7,12.3)适应证和用途DAKLINZA是适用为与索非布韦使用为有慢性丙型肝炎病毒(HCV)基因型3感染患者的治疗[见剂量和给药方法(2)和临床研究(14)]。
他达拉非片正确服用方法

他达拉非片正确服用方法
达拉非片是一种用于治疗艾滋病患者的抗病毒药物。
正确服用方法如下:
1. 按照医生的指示服用药物,不要自行调整剂量或停药。
2. 每天定时服用药物,最好在同一时间服用,这有助于提高药物的吸收和稳定血药浓度。
3. 口服药物时,可以选择空腹服用或餐后服用,但要避免与高脂肪食物同时服用,因为这可能会影响药物的吸收。
4. 如果因任何原因忘记服用一次剂量,应尽快补充。
然而,如果接近下一次剂量服用时间,则应跳过遗漏的剂量,继续按照正常的剂量时间表服用。
不要双倍服用,以弥补遗漏的剂量。
5. 如果正在使用其他药物,请告知医生,因为某些药物可能与达拉非片发生相互作用,影响疗效或增加不良反应的风险。
6. 在服用达拉非片期间,定期进行血液检查和其他相关检查,以便评估药物的疗效和监测任何可能的副作用。
7. 长期使用达拉非片时,应遵循医生的建议进行定期复查,确保药物仍然适合患者并维持治疗效果。
请注意,这只是一般的使用建议。
每个人的具体情况可能不同,所以请务必遵循医生的指示和药品说明书上的说明。
恩替卡韦片说明书

恩替卡韦片说明书药品名称通用名称:恩替卡韦片商品名称:_____英文名称:Entecavir Tablets汉语拼音:Entikawi Pian成份本品主要成份为恩替卡韦。
性状本品为薄膜衣片,除去包衣后显白色或类白色。
适应症本品适用于病毒复制活跃,血清丙氨酸氨基转移酶(ALT)持续升高或肝脏组织学显示有活动性病变的慢性成人乙型肝炎的治疗。
规格05mg/片;1mg/片用法用量患者应在有经验的医生指导下服用本品。
推荐剂量:成人和 16 岁及以上的青少年口服本品,每天一次,每次 05mg。
拉米夫定治疗时发生病毒血症或出现拉米夫定耐药突变的患者为每天一次,每次 1mg。
本品应空腹服用(餐前或餐后至少 2 小时)。
肾功能不全的患者:肌酐清除率<50ml/min,包括血透析或 CAPD的患者,建议调整恩替卡韦的给药剂量。
肝功能不全患者:无需调整用药剂量。
不良反应在国外进行的研究中,本品最常见的不良事件有:头痛、疲劳、眩晕、恶心。
拉米夫定治疗的患者普遍出现的不良事件有:头痛、疲劳、眩晕。
在这 4 项研究中,分别有 1%的恩替卡韦治疗的患者和 4%拉米夫定治疗的患者由于不良事件和实验室检测指标异常而退出研究。
在中国进行的临床试验中,最常见的不良事件有:ALT 升高、疲劳、眩晕、恶心、腹痛、腹部不适、上腹痛、肝区不适、肌痛、失眠和风疹。
这些不良事件多为轻到中度。
禁忌对恩替卡韦或制剂中任何成份过敏者禁用。
注意事项1、患者应在医生的指导下服用恩替卡韦,并告知医生任何新出现的症状及合并用药情况。
2、应告知患者如果停药有时会出现肝脏病情加重,所以应在医生的指导下改变治疗方法。
3、使用恩替卡韦治疗并不能降低经性接触或污染血源传播 HBV 的危险性。
因此,需要采取适当的防护措施。
4、开始治疗前,需要对患者进行人类免疫缺陷病毒(HIV)抗体的检测。
如果患者感染了 HIV 而未接受有效的 HIV 药物治疗,恩替卡韦可能会增加对 HIV 药物治疗耐药的机会。
印度达卡他韦副作用及处理方法

达卡他韦副作用及处理方法
本文由印康源海外医疗整理提供,达卡他韦(原研厂家名称Daklinza)是一种抗病毒药物,主要用于治疗成年患者基因型1和基因型3慢性丙型肝炎,通常结合索非布韦一起使用。
达卡他韦常见的副作用及处理方法:
头痛(14%)
-保持足够的液体摄入
-保持室内灯光昏暗,戴太阳镜,或留在阴暗的房间
-尽量休息
-有时医生会根据患者情况建议服用对乙酰氨基酚(Tylenol®)
疲劳(14%)
-尝试缓和的运动,如步行或有氧运动
-保持足够的液体摄入
-白天小睡一会儿
-减少工作量
-每天吃营养均衡的食物
恶心(8%)
-少食多餐
-避免接触带有气味的食物,太热的食物容易散发味道
-吃健康食物避免油腻,辛辣,酸性或甜食
-试着吃一点生姜类食物,如姜茶
-吃一些饼干或烤面包
-医生可能会开非处方抗酸药或其他药物
腹泻(5%)
-吃纤维含量高的食物如香蕉,苹果酱和白吐司
-避免辛辣或酸性的食物(如柑橘)
-腹泻后应避免乳制品2-3天
-保持足够的液体摄入量(不含咖啡因的液体•)
-医生可能会推荐洛哌丁胺(Imodium®),甲基纤维素(Citrucel)或欧车前(Metamucil)。
药物达卡他韦(Daclatasvir)合成检索总结报告

药物达卡他韦(Daclatasvir)合成检索总结报告
一、达卡他韦(Daclatasvir)简介
达卡他韦(Daclatasvir)于2015年7月24日在美国上市。
达卡他韦(Daclatasvir)是HCV非结构蛋白5A(NS5A)抑制剂,其与索非布韦联用,用于治疗基因型3慢性丙型肝炎(HCV)感染。
达卡他韦(Daclatasvir)不良反应有:头疼和疲劳。
达卡他韦(Daclatasvir)分子结构式如下:
英文名称:Daclatasvir
中文名称:达卡他韦
CAS:1009119-64-5
英文名称:Daclatasvir dihydrochloride
中文名称:达卡他韦二盐酸盐
CAS:1009119-65-6
本文主要对达卡他韦(Daclatasvir)的合成路线、关键中间体的合成方法及实验操作方法进行了文献检索并作出了总结。
二、达卡他韦(Daclatasvir)合成路线
三、达卡他韦(Daclatasvir)合成检索总结报告(一) 达卡他韦(Daclatasvir)中间体2的合成
(二) 达卡他韦(Daclatasvir)中间体3的合成方法一
(三) 达卡他韦(Daclatasvir)中间体3的合成方法二
(四) 达卡他韦(Daclatasvir)中间体6的合成。
盐酸达卡他韦片(商品名:DAKLINZA)2016.02.05

10 11 12
13 14
16 17
8.4 Pediatric Use 8.5 Geriatric Use 8.6 Renal Impairment 8.7 Hepatic Impairment OVERDOSAGE DESCRIPTION CLINICAL PHARMACOLOGY 12.1 Mechanism of Action 12.2 Pharmacodynamics 12.3 Pharmacokinetics 12.4 Microbiology NONCLINICAL TOXICOLOGY 13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility CLINICAL STUDIES 14.1 Description of Clinical Trials 14.2 Clinical Trials in HCV Genotype 3 (ALLY-3) 14.3 Clinical Trials in HCV/HIV Coinfected Subjects (ALLY-2) 14.4 Clinical Trials in Subjects with Child-Pugh A, B, or C Cirrhosis or with HCV Recurrence after Liver Transplantation (ALLY-1) HOW SUPPLIED/STORAGE AND HANDLING PATIENT COUNSELING INFORMATION
HIGHLIGHTS OF PRESCRIBING INFORMATION These highlights do not include all the information needed to use DAKLINZA safely and effectively. See full prescribing information for DAKLINZA. DAKLINZA (daclatasvir) tablets, for oral use Initial U.S. Approval: 2015 ---------------------------RECENT MAJOR CHANGES-------------------------- Indications and Usage (1) 2/2016 Dosage and Administration, Testing Prior to Initiation of Therapy (2.1) 2/2016 Dosage and Administration, Recommended Dosage (2.2) 2/2016 Contraindications (4) 2/2016 Warnings and Precautions, Risks Associated with Ribavirin Combination Treatment (5.3) 2/2016 ---------------------------INDICATIONS AND USAGE--------------------------- DAKLINZA is a hepatitis C virus (HCV) NS5A inhibitor indicated for use with sofosbuvir, with or without ribavirin, for the treatment of chronic HCV genotype 1 or 3 infection. (1) Limitations of Use: • Sustained virologic response (SVR12) rates are reduced in genotype 3 patients with cirrhosis receiving DAKLINZA in combination with sofosbuvir for 12 weeks. (14) -----------------------DOSAGE AND ADMINISTRATION---------------------- • Testing prior to initiation: HCV genotype 1a with cirrhosis, consider testing for the presence of virus with NS5A resistance-associated polymorphisms. (2.1) • 60 mg taken orally once daily with or without food in combination with sofosbuvir with or without ribavirin. (2.2) • Recommended treatment duration: 12 weeks. (2.2) • Dose modification: Reduce dosage to 30 mg once daily with strong CYP3A inhibitors and increase dosage to 90 mg once daily with moderate CYP3A inducers. (2.3)
2017印度索非布韦达卡他韦说明书图片

2017印度索非布韦达卡他韦说明书图片本文由印康源整理提供药品中文名称索非布韦药品英文<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt">Sofosbuvir原研厂家<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt">美国吉利德公司(Gilead)原研厂家品牌<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt">Sovaldi美国售价<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt">2万美金/盒香港售价<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt">同上上市时间<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt">2013.12.6经美国FDA批准上市(目前国内未上市)印度厂家名称<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt">NATCO或Mylan印度品牌名称<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt">Hepcinat印度售价<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt">15000卢比(1500人民币)规格/包装<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt">400mg,28片装服用剂量<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt:solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt;height:3.5pt">每日1片,12-24周服用方法<td width="72%" valign="top"style="width:72.12%;border-top:none;border-left:none;border-bottom:solid black1.0pt;mso-border-bottom-themecolor:text1;border-right:solid black1.0pt;mso-border-right-themecolor:text1;mso-border-top-alt: solidblack .5pt;mso-border-top-themecolor:text1;mso-border-left-alt: solid black .5pt;mso-border-left-themecolor:text1;mso-border-alt:solid black .5pt;mso-border-themecolor:text1;padding:0cm 5.4pt 0cm 5.4pt;height:3.5pt">空腹或者伴随食物服用。
他达拉非片说明书 请仔细阅读说明书并在医师指导下使用

【孕 妇 及 哺 乳 期 妇 女 用 药】 本品不用于妇女。未在妊娠妇女中进行他达拉非的研究。动物研究没有表明本品对妊娠,胚胎/胎 儿发育以及分娩和出生后发育有直接或间接的有害影响。
【儿 童 用 药】 18 岁以下者不得服用本品。
【老 年者 用 药】 健康老年受试者(65 岁或以上)口服他达拉非清除率较低,使得 AUC 比 19-45 岁的健康受试者高 25%。这一年龄的影响无临床意义,且无须调整剂量。 【药 物 相 互 作 用】 下述的相互作用研究中使用了 10mg 和/或 20mg 他达拉非。由于研究中使用的剂量是 10mg 他达拉 非,因此临床上使用较大剂量时,不能完全排除临床上发生有关的药物相互作用。 其他药物对他达拉非的作用 他达拉非主要通过 CYP3A4 代谢。与单用他达拉非的 AUC 值和 Cmax 相比,CYP3A4 的选择性抑制剂 酮康唑(每天 200mg)可使他达拉非(10mg)的暴露量(AUC)增加 2 倍,Cmax 增加 15%。酮康唑(每 天 400mg)可使他达拉非(20mg)的暴露量(AUC)增加 4 倍,Cmax 增加 22%。蛋白酶抑制剂利托那韦 (200mg,每天 2 次)是 CYP3A4、CYP2C9、CYP2C19 和 CYP2D6 抑制剂,可使他达拉非(20mg)的暴露 量(AUC)增加 2 倍,对 Cmax 没有影响。尽管尚未进行特殊的相互作用研究,其他的蛋白酶抑制剂,
【性 状】 20mg 片为黄色,杏仁状,一面标有“C20”字样。 【适 应 症】 治疗男性勃起功能障碍。需要性刺激以使本品生效。他达拉非不能用于女性。 【规 格 】 20mg
【用 法 用 量】 口服 用于成年男性 本品的推荐剂量为 10mg,在进行性生活之前服用,不受进食的影响。如果服用 10mg 效果不显 著,可以服用 20mg。可至少在性生活前 30 分钟服用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
达卡他韦Daklinza(daclatasvir)片使用说明书2015年第一版1 适应证和用途DAKLINZA是适用为与索非布韦使用为有慢性丙型肝炎病毒(HCV)基因型3感染患者的治疗[见剂量和给药方法(2)和临床研究(14)]。
使用的限制:●在HCV基因型3-感染有硬化患者接受DAKLINZA与索非布韦联用共12周,持续病毒学反应(SVR)率减低。
[见临床研究(14)].2 剂量和给药方法2.1 推荐剂量DAKLINZA的推荐剂量是60 mg,口服,每天1次与索非布韦联用共12周。
DAKLINZA 可有或无食物服用。
尚未确定对有硬化患者DAKLINZA和索非布韦的最佳时间[见临床研究(14)]。
对索非布韦特异性推荐剂量,参考相关处方资料。
2.2 由于药物相互作用剂量修饰对与DAKLINZA共同给药前其他药物参考药物相互作用和禁忌证节。
细胞色素P450酶3A(CYP3A的强抑制剂:减低DAKLINZA剂量至30 mg每天1次当与强CYP3A抑制剂共同给药时用30 mg片[见药物相互作用(7)]。
中度CYP3A诱导剂:当共同给药与中度CYP3A诱导剂增加DAKLINZA的剂量至90 mg每天1次利用适当的片组合(三片30 mg片或一片60 mg和一片30 mg片) [见药物相互作用(7)]。
强CYP3A诱导剂:DAKLINZA是禁忌与强CYP3A诱导剂联用[见禁忌证(4)]。
建议对不良反应不减低DAKLINZA剂量。
2.3 治疗的终止一例接受DAKLINZA与索非布韦患者如永久地终止索非布韦,然后DAKLINZA也应被终止。
3 剂型和规格● 片:60 mg daclatasvir(等于66 mg daclatasvir二盐酸盐),浅绿色,双凸,五边形,和一侧凹陷有“BMS”和另一侧“215”。
● 片:30 mg daclatasvir(等于33 mg daclatasvir二盐酸盐),绿色,双凸,五边形,和一侧凹陷有“BMS”和另一侧“213”。
4 禁忌证● DAKLINZA是禁忌与强烈地诱导CYP3A药物联用和,从而,可能导致DAKLINZA 的较低暴露和丧失疗效。
禁忌药物包括,但不限于在表1中列举[见药物相互作用(7)和临床药理学(12.3)]。
5 警告和注意事项5.1由于药物相互作用不良反应或丧失病毒学反应的风险DAKLINZA和其他药物的同时使用可能导致已知或潜在地显著药物相互作用,其中有些可能导致以下[见禁忌证(4)和药物相互作用(7)]:● 丧失DAKLINZA的治疗效应和发生耐药性可能,● 同时药物或DAKLINZA的剂量调整,● 来自同时药物或DAKLINZA更大暴露临床上显著不良反应可能性。
见表1由于丧失疗效和发生耐药性可能禁忌与DAKLINZA药物[见禁忌证(4)]。
见表3对预防或处理其他其他可能性步骤和已知显著药物相互作用[见药物相互作用(7)]。
DAKLINZA治疗前和期间考虑对药物相互作用潜能,DAKLINZA治疗期间审查同时用药,和监视伴随同时药物不良反应。
5.2 当共同给药与索非布韦和胺碘酮严重症状性心动过缓当胺碘酮是与索非布韦联用与另外一个HCV直接作用抗病毒药,包括 DAKLINZA 共同给药时曾报道症状性心动过缓的上市后病例和需要起搏器干预病例。
一例在接受一个含索非布韦方案患者(ledipasvir/索非布韦)报道致命性心脏骤停。
心动过缓一般地发生在小时至天内,但曾观察到直至开始HCV治疗后2周。
还服用β受体阻滞剂患者或患有心脏合并症和/或晚期肝病患者可能是处在与胺碘酮的共同给药对症状性心动过缓风险增加。
HCV治疗的终止后心动过缓一般解决。
不知道这个心动过缓效应的机制。
建议胺碘酮不与DAKLINZA与索非布韦联用的共同给药。
对服用胺碘酮无另外治疗选择患者和将被与DAKLINZA和索非布韦共同给药:● 与患者商讨关于严重症状性心动过缓的风险。
● 建议共同给药的头48小时监视患者情况,其后应在每天基础上门诊患者或自我-监视心率直至至少治疗头2周。
正在服用索非布韦与DAKLINZA联用患者由于无其他治疗选择需要开始胺碘酮治疗应进行相似心脏监视如上概述。
由于胺碘酮的长消除半衰期,开始索非布韦与DAKLINZA联用之前患者终止胺碘酮还应进行上述相似的心脏监视。
发生心动过缓体征或症状患者应寻求立即医学评价。
症状可能包括接近-昏厥或昏厥,眩晕或头重脚轻,乏力,软弱,过度劳累,气短,胸痛,混乱,或记忆问题[见不良反应(6.2)和药物相互作用,表3(7.3)]。
6 不良反应在说明书其它处描述以下严重不良反应:● 当与索非布韦和胺碘酮共同给药严重症状性心动过缓[见警告和注意事项(5.2)]。
6.1 临床试验经验因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在临床试验约1900例有慢性HCV感染受试者曾被用推荐剂量DAKLINZA与其它抗-HCV药物联用治疗。
在ALLY-3试验中,152例未治疗过和经历治疗有HCV基因型3感染受试者被用DAKLINZA 60 mg每天1次与索非布韦联用治疗共12周。
最常见不良反应(频数10%或更大)是头痛和疲乏。
所有不良反应严重程度是轻度至中度。
一例受试者经受严重不良事件被认为与DAKLINZA无关,和没有受试者为不良事件终止治疗。
表2中展示不良反应被认为至少可能与治疗有关和发生在频数5%或更大。
实验室异常脂肪酶升高:在ALLY-3中2%受试者观察到暂时,无症状脂肪酶升高大于正常上限(ULN) 3倍。
6.2 上市后经验心脏病:在开始服用胺碘酮与索非布韦联用与另一个 HCV直接作用抗病毒药,包括DAKLINZA治疗患者曾报道严重症状性心动过缓[见警告和注意事项(5.2)和药物相互作用(7.3)]。
7 药物相互作用7.1 对其他药物影响DAKLINZA潜能Daclatasvir是CYP3A的底物。
因此,中度或强诱导剂 of CYP3A may decrease the plasma levels和therapeutic effect of daclatasvir [见剂量和给药方法(2.2),禁忌证(4),和表3]。
CYP3A的强抑制剂(如,克拉霉素[clarithromycin],伊曲康唑[itraconazole],酮康唑[ketoconazole],利托那韦[ritonavir])可能增加daclatasvir的血浆水平[见剂量和给药方法(2.2)和表3]。
7.2对DAKLINZA影响其他药物潜能Daclatasvir是一种P-糖蛋白转运蛋白(P-gp),有机阴离子转运多肽(OATP)1B1和1B3,和乳癌耐药性蛋白(BCRP)的抑制剂。
DAKLINZA的给药可能增加对P-gp,OATP 1B1或1B3,或BCRP的底物医药产品的全身暴露,可能增加或延长它们的治疗作用或不良反应(见表3)。
7.3 已确定和潜在地显著药物相互作用对索非布韦药物相互作用资料参考处方资料。
应该遵循最保守的建议。
表3提供DAKLINZA和其他药物间对已确定或潜在地显著药物相互作用的临床建议[见禁忌证(4)]。
在浓度临床上相关增加以“↑” 指示和临床上相关减低以“↓” 指示[对药物相互作用数据,见临床药理学(12.3)].7.4 与DAKLINZA无临床上意义相互作用药物根据药物相互作用试验的结果[见临床药理学(12.3)],对环孢霉素[cyclosporine],艾司西酞普兰[艾司西酞普兰],炔雌醇/诺孕酯[ethinyl estradiol/norgestimate],美沙酮[methadone],咪达唑仑[midazolam],他克莫司[tacrolimus],或替诺福韦[tenofovir]与daclatasvir的同时使用未观察到暴露临床相关变化。
与环孢霉素,艾司西酞普兰,法莫替丁[famotidine],奥美拉唑[omeprazole],索非布韦,他克莫司,或替诺福韦未观察到daclatasvir 暴露中临床相关变化。
对daclatasvir或以下同时药物:peg干扰素α,利巴韦林,或抗酸药期望无临床上相关相互作用。
8 特殊人群中使用8.1 妊娠风险总结不能得到在妊娠妇女用DAKLINZA数据告知药物关联风险。
在大鼠和兔中动物生殖研究,在器官形成期间口服给予daclatasvir剂量为人推荐剂量(RHD) 60 mg 产生暴露分别至6和22倍,未观察到胎儿危害的证据。
但是,在大鼠和兔中在母体毒性剂量,为人在RHD 60 mg产生暴露分别33和98倍时观察到胚胎胎儿毒性[见数据]。
对一位妊娠妇女处方DAKLINZA时考虑DAKLINZA的获益和风险。
在美国一般人群,在临床上认可妊娠中主要出生缺陷和流产的估计背景风险分别为2%至4%和15%至20%。
数据动物数据对妊娠大鼠在怀孕第6至15天口服给予Daclatasvir剂量0,50,200,或1000 mg/kg/day。
在剂量200和1000 mg/kg/day注意到母体毒性(死亡率,不良临床体征,体重减轻,和食耗量减低)。
在子代中,在200和1000 mg/kg剂量观察到胎脑,颅,眼,耳,鼻,唇,腭,或肢体畸形。
1000 mg/kg的剂量伴随有深度胚胎致死率和降低胎儿体重。
注意到在50 mg/kg/day无畸形。
在妊娠雌性在50 mg/kg/day全身暴露是较高于在人RHD 6-倍。
在兔中,daclatasvir是在怀孕期间第7至19天开始地给予在剂量0,40,200,或750 mg/kg/day。
由于载体毒性Daclatasvir给药修饰研究期间分别至剂量20,99,和370 mg/kg/day。
在剂量200/99和750/370 mg/kg/day注意到母体毒性有不良临床征象和体重和食耗量严重减低。
多个母兽在750/370 mg/kg/day时发生死亡和安乐死。
在200/99 mg/kg/day,胎儿效应包括胚胎胎儿致死率增加,胎重减低,和肋骨以及头部和头骨胎儿畸形发生率增加。
注意到兔在40/20mg/kg/day时无畸形。
在40/20 mg/kg/day时全身暴露(AUC)是22-倍较高于在人RHD时暴露。
在一项围产期发育研究中,daclatasvir是给予从怀孕第6天至哺乳第20天口服剂量0,25,50,或100 mg/kg/day,在100 mg/kg/day母体毒性包括死亡率和难产;发育毒性包括围产期和新生儿阶段中子代生存略微减低和出生体重减低持续直至成年。
在剂量直至50 mg/kg/day没有母体也没有发育毒性。
在这个剂量的全身暴露(AUC)是3.6-倍较高于人RHD暴露。
