组培苗的炼苗方法图文稿
组培苗工厂化生产的工艺流程
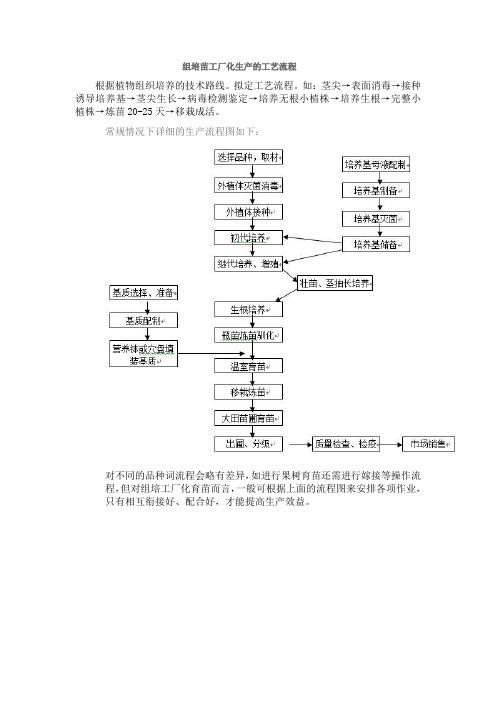
对不同的品种词流程会略有差异,如进行果树育苗还需进行嫁接等操作流程,但对组培工厂化育苗而言,一般可根据上面的流程图来安排各项作业,只有相互衔接好、配合好,才能提高生产效益。
常规情况下详细的生产流程图如下对不同的品种词流程会略有差异如进行果树育苗还需进行嫁接等操作流程但对组培工厂化育苗而言一般可根据上面的流程图来安排各项作业只有相互衔接好配合Байду номын сангаас才能提高生产效益
组培苗工厂化生产的工艺流程
根据植物组织培养的技术路线。拟定工艺流程。如:茎尖→表面消毒→接种诱导培养基→茎尖生长→病毒检测鉴定→培养无根小植株→培养生根→完整小植株→炼苗20-25天→移栽成活。
组培苗的炼苗方法之欧阳法创编

试管苗的炼苗和移栽一、二、目的要求熟练掌握组培苗移栽驯化技术。
三、用品1、材料:生根组培苗;2、器具用品:镊子;水盆;蛭石、珍珠岩、草木灰;育苗盘;喷雾器;竹签等。
三、方法与步骤(一)练苗将生根的组培苗从培养室取出,将培养瓶移到室外遮阴蓬或温室中进行强光闭瓶练苗5~20天左右,遮阴度宜为50%~70%。
然后打开瓶口,再放置3~7天。
(二)基质灭菌将蛭石、珍珠岩和草木灰分别用聚丙烯塑料袋装好,在高压灭菌锅中灭菌20分钟,或者采用高温干热灭菌法灭菌,灭菌后冷却备用。
(三)育苗盘准备取干净的育苗盘,将蛭石和珍珠岩按1:1混合,然后倒入育苗盘中,用木板刮平。
将育苗盘放入1-2cm深的水槽中,使水分浸透基质,然后取出备用。
(四)试管苗脱瓶用镊子将试管苗轻轻取出,放入清水盆中,小心洗去根部琼脂,然后涝出,放入干净的小盆中。
(五)移栽用竹签在基质上打孔,将小苗栽入育苗穴盘中,轻轻覆盖、压实。
待整个穴盘栽满后用喷雾器喷水浇平。
最后将育苗盘摆入到驯化室中,正常管理。
四、作业记录试管苗移栽驯化步骤,统计移栽成活率。
解释:1、闭瓶强光练苗。
当生根后或根系得到基本发育后,将培养瓶移到室外遮阴蓬或温室中进行强光闭瓶练苗5~20天左右,遮阴度宜为50%~70%。
2、开瓶强光练苗。
将培养容器的盖子或塞打开,在自然光下进行开瓶练苗3~7天,正午强光或南方光照较强地区要注意采取措施如用阴蓬或温室避免灼伤小苗。
如果在开盖容器中培养不超过1周,一般不会引起含蔗糖培养基的污染问题。
开瓶炼苗可以分阶段进行,即首先松盖(或塞)一两天,然后部分开盖一两天,最后完全揭去盖。
这种方法在相对湿度十分低的屋内特别有好处。
培养容器的开口大小也影响开盖的速度,开口大的瓶盖应比开口小的瓶盖除去的速度慢一些。
3、试管苗的移栽。
试管苗移栽是组织培养过程的重要环节,这个工作环节做不好,就会造成前功尽弃。
试管苗从琼脂培养基中移出时要用长镊子小心取出,彻底清洗干净根部(因为残留的蔗糖和营养会成为潜在的致病微生物的生长培养基,洗不净容易引起移栽苗烂根死亡),并且避免损坏根系。
大樱桃组培苗炼苗技术

大樱桃组培苗炼苗技术摘要:根据大樱桃的生物学特性,通过多年大樱桃组培试管苗炼苗的试验,总结出了大樱桃组培试管苗炼苗前后的一系列管理技术。
结果表明,试管苗炼苗基质的选择、试管苗温室驯化生根壮苗与开瓶炼苗这3个阶段的工作非常重要。
基质选用细沙与蛭石6:4混合为宜,试管苗温室训化生根壮苗与开瓶炼苗时间以10~15d为宜,移入沙床后定期喷洒营养液和杀菌液,按照此方法进行试管苗炼苗可获得很高的成活率。
关键词:大樱桃;组培;炼苗;技术方法试管苗的炼苗移栽是组织培养过程中重要的环节,这个环节最需要的是操心和细心,即对大棚温湿度操心,对瓶苗移栽各管理环节的细心,若稍有疏忽,则会造成大批幼苗死亡,使整个组培工作前功尽弃,造成巨大的损失。
通过几年的实践,总结出了大樱桃试管苗炼苗的关键技术,从试管苗炼苗基质的选择、试管苗温室驯化生根壮苗与开瓶炼苗这3个阶段进行了详细介绍,为天水市优良大樱桃品种的工厂化生产提供了科学依据和技术支持。
1苗床及基质的选择1.1苗床的制作苗床在日光温室内要做成凹畦,长6m,宽2m,畦深15~20cm为宜,将畦整平拍实后,喷洒杀虫剂500倍液,在畦内将细砂、蛭石混匀后用木板刮平,并用800倍液多菌灵液将沙床洒透,在畦上搭建小拱棚,可用扁竹或圆竹搭建,高度保持在1.50m 左右,上遮盖遮阳网。
1.2栽种试管苗的基质栽种试管苗的基质要具备透气、保湿、容易灭菌处理、不利于杂菌滋生的特点,选用珍珠岩、炉渣、蛭石、锯末、草炭土等多种基质进行试验,结果表明,最适合大樱桃组培苗生长的基质为:细沙与蛭石6:4混合,细砂为颗粒为0.10~0.20mm 的面砂。
2试管苗的移栽方法2.1试管苗的驯化试管苗从培养架上长好后,将试管苗小心从培养架上取下,要轻取轻放,迅速转移到日光温室中,在日光温室中将瓶苗均匀地摆在地上,温度控制在15~25℃,光照强度为3 000Lx,每天中午在瓶苗周围喷洒多次雾水,达到保湿降温的效果,移到自然光下2~4d,让试管苗逐渐接受强光照射。
红叶石楠组培苗生根炼苗技术学习

红叶石楠组培苗生根炼苗技术学习一.实施方法一:瓶外生根(详见红叶石楠研究1)土壤基质和生根剂是影响芽苗瓶外生根率的关键因素,以珍珠岩为基质、以浓度50 mg·L 生根粉ABT浸沾芽苗30 min是获得最高瓶外生根率的理想组合。
1.限制因子:①土壤基质、生根剂种类、浓度及处理时间都直接影响着红叶石楠继代芽苗的瓶外生根率。
②木质化或半木质化插穗是红叶石楠硬枝扦插技术的关键。
同理,红叶石楠瓶外生根的“微型穗条”木质化程度也影响着瓶外生根率。
经过自然散射光炼苗培养的继代芽苗可获得81%的瓶外生根率。
③光、温、湿、气流等环境条件及水肥管理是红叶石楠瓶外生根成败的重要因素。
红叶石楠芽苗瓶外扦插后生根前喷清水、诱导生根后追施B5培养基配方的大量元素能显著提高了瓶外生根率及苗高。
假设瓶外生根的光、温、湿等环境条件可调控,芽苗瓶外扦插也如同瓶内诱导生根培养不受时间、季节限制。
2.实验方法:①材料的选择:选用红叶石楠“鲁宾斯”品种,在B5+BA 2.0 mg·L-1+NAA 0.5 mg·L-1+GA3 0.1 mg·L-1培养基上经多次继代增殖培养的继代丛生芽苗,在继代培养室(继代培养室以日光灯为光源,光强约为1 500~2 000 lx)培养40 d 或在炼苗室培养15-20 d,高3.0 cm芽苗作为瓶外生根试验的“微型扦穗”,芽条基部扦入基质深度约为0.8~1.0 cm为宜。
②栽培基质与激素的筛选:试验选用珍珠岩作土壤基质,将其装入塑料穴盘(每个穴盘49个穴),用0.15%-0.2%的高锰酸钾消毒基质,覆盖薄膜24 h后即可使用。
继代芽苗基部切口浸泡处理选用ABT,激素浓度为50 mg·L-1,,激素浸泡处理时间设为30 min,35 d后统计芽苗生根率。
土壤基质和生根促进剂的选择是组培继代芽苗瓶外生根的关键,珍珠岩的保水透气性更适合红叶石楠组培苗瓶外生根,生根粉ABT1#不仅生根率高,芽苗切口愈伤组织不明显,且根系较为发达,平均单株主根达3~4条。
组培苗炼苗移栽的步骤和方法

组培苗炼苗移栽的步骤和方法嘿,你问组培苗炼苗移栽的步骤和方法啊?这事儿咱可得好好唠唠。
第一步呢,得先让组培苗适应一下外面的环境。
就像一个一直待在温室里的小孩,突然要出去面对外面的世界,得有个过渡阶段不是?把组培苗从培养室里拿出来,放在一个光线比较弱、温度和湿度相对稳定的地方,让它先缓缓。
这就好比让小孩先在门口站一会儿,感受一下外面的空气。
第二步,慢慢增加光照。
可不能一下子就把它扔到太阳底下暴晒哦,那不得把小苗给晒蔫了。
就像让小孩慢慢适应外面的阳光一样,从一点点光开始,逐渐增加。
可以先放在有散光的地方,让它适应适应。
第三步,降低湿度。
组培苗在培养室里的时候湿度可高了,出来后得让它适应正常的空气湿度。
可以把盖子或者保鲜膜啥的慢慢打开一点,让空气流通起来,让小苗逐渐适应干燥一点的环境。
就像小孩不能一直待在潮湿的地方,得适应正常的生活环境。
第四步,就是移栽啦。
准备好合适的土壤,要疏松透气哦,不能像泥巴块一样硬邦邦的。
把小苗轻轻地从培养容器里拿出来,小心别伤到它的根。
就像抱小孩一样,得温柔点。
然后把小苗种到土里,轻轻盖上土,别压得太紧。
移栽完后也不能大意哦。
要注意浇水,不能太多也不能太少。
就像给小孩喝水一样,得适量。
还得注意温度,不能太冷也不能太热。
要是温度不合适,小苗会不开心的。
我给你举个例子哈。
我有个朋友,他第一次移栽组培苗的时候,可着急了。
直接把小苗从培养室里拿出来就种到土里,也不管光照和湿度。
结果小苗都快死了。
后来他按照我说的方法,一步一步来,先让小苗适应环境,慢慢增加光照,降低湿度,最后再移栽。
现在他的组培苗长得可好了,绿油油的,可精神了。
你看,组培苗炼苗移栽得有耐心,不能瞎搞。
种苗概况及炼苗指导

种苗概况及炼苗指导
一、种苗概况
二、炼苗方法
1、将适合炼苗的袋苗放在阴凉有自然散射光的地方(如走廊,有遮阴网覆盖的苗圃等,切忌日光直射),封闭炼苗10天。
2、10天后剪开炼苗袋,开袋炼苗2-3天。
3、种于炼苗基质内炼苗。
①炼苗基质用经过腐熟处理的椰丝,使用前用百菌清/多菌灵(800-1000倍液)浸泡24小时,。
②将经过开袋炼苗的生根组培苗从袋子里取出,柔和流水冲净根部基质后,使用
0.1%高锰酸钾水溶液浸泡小苗5分钟,然后用清水泡洗2-3次,至水无红色时将小苗捞出置于阴凉处沥水,于12小时内种完(也可以清水洗净后用百菌清倍液1000浸泡10分钟后移栽)。
浸苗捞苗的动作要轻柔,以防伤根。
③炼苗容器采用底部有排水孔的穴盘,每穴口径5厘米,第一次使用的干净穴盘可不用消毒,重复使用的穴盘则需要经过消毒使用。
种植时左手拿苗,右手抓一把经过除菌处理的湿润椰丝,包裹住小苗根部,轻捏使其成团,然后将椰丝团塞入穴盘。
椰丝的用量以能轻易塞入穴盘,塞入后与穴盘上沿相平为准。
过少保水能力差,过多或捏太实会导致根部不透气,影响小苗生长。
④种完浇定根水一次。
置于荫棚内,炼苗前4周遮阴要达到50%~90%,并采用喷雾洒水保持一定的湿度(85%左右),之后逐渐降低湿度和增强光照。
⑤成活后每周施两次花多多1000倍液,施肥结合浇水进行。
四个月后,当苗高长到20厘米,有两个以上原球茎时即可移栽定植。
组织培养 植物组织培养基本操作

一、培养基的成分 培养基一般包括无机盐、有机化合物和生长调
节剂三大基本组成成分。 1、无机盐类 功能 离体组织生长发育的基本成分
根据植物对必需元素需要的量,可以分为以下两 类:
2020/3/24
大量元素—植物所需元素的使用量一般在每升几十 -几千毫克,有C、H、O、N、P、K、Ca、Mg、S。
盐酸硫胺素-VB1、盐酸吡哆醇-VB6、烟酸-Vpp、 生物素-VH、维生素C-Vc。
⑶肌醇 功能 促进糖的转化、维生素和激素的利用,对 胚状体和芽的形成有良好影响。 用量一般50-100mg/L。
2020/3/24
⑷腺嘌呤 合成各种细胞分裂素的前体物质之一,利于细 胞分裂,促进芽的形成和生长。 ⑸氨基酸 蛋白质的成分,是有机氮化合物,常用甘氨酸 和多种氨基酸混合物如水解酪蛋白、水解乳蛋白。 ⑹其它复合成分 成分尚不清楚的天然提取物,如椰乳、香蕉汁、 酵母提取液、番茄汁、麦芽糖等。
休眠以及诱导单性结实等。 与生长素协调作用对形成层分化有影响,刺激体细胞
胚进一步发育成植株。 有20多种,目前主要是赤霉酸GA3。
2020/3/24
4、水 离体培养中,既是培养基营养成分的溶剂,又
是培养基的重要组成部分,占培养基成分的95%。 原生质体培养、细胞培养及分生组织培养一般
应用双蒸水或超纯水 大批量快速繁殖培养,可用一般蒸馏水或纯净
水。
2020/3/24
5、其它附加成分 ⑴琼脂
功能 来自海藻的多糖类物质,组织培养中 最常用作凝固剂,是最方便、最好的凝固剂和支 持物。
常用量0.6%-1.0%,不是培养基必需成分。 卡拉胶 海藻提取物,含杂质少纯度更高, 凝固后培养基透明,利于材料观察。
2020/3/24
蓝莓组培苗移栽炼苗技术

12 渗 透层设 置 .
渗 透 层 处 于组 培 苗床 的负 一 层 , 一 由
cca) aee 越桔 属 ( a i oee 植 物 , 世 界第 三 代 高 级 水 Vc n da) ci 是
果, 具有很 高 的经 济 价 值 和 较 大 发 展 空 间 的一 种 新 型 果 树 。组 织培养 快速育 苗技 术 的研 究推广 , 于 大规 模 的繁 对
Ke r s B u b ry is e c l r ;R f e s e l g;S b tae r t y wo d : l e e r ;T su ut e u e n e di i n u srt ai o
蓝莓 ( leer) Bu br 又名 越桔 、 y 蓝浆 果 , 杜 鹃花科 ( r 属 Ei —
殖 蓝莓 苗 , 引种 国外 优 秀新 品 种 , 短 蓝莓 成 品 苗 的繁 殖 缩 周 期 , 受地理 环境 和地 区性 季 节 的 限制 , 以在很 短 的 不 可 时 间里 , 速 我 国蓝 莓 产 业 的发 展 有 着 非 常深 远 的 , 以免影响基
质 的使用 时 间。 13 人工基质 配置 蓝 莓 的根 系 是 须根 系 , . 比较适 合 生 长在疏松 多孔 、 富含有机 质 、 的人 工基 质 中 , 酸性 一般情 况
组培苗的炼苗实验报告

组培苗的炼苗实验报告实验目的:炼制组培苗并评估其成功率。
实验原理:组培法是植物的无性繁殖方法之一,通过将植物的组织培养于培养基中进行营养和生长,进而繁殖整株植物。
组培苗的制备主要包括以下几个步骤:消毒表面,切取外植体,培养基配制,培养和生长。
实验材料:- 植物外植体:可以选择来自植物茎、叶或芽尖等部位的组织。
- 培养基:包括基础培养基和添加适当激素的生长调控培养基。
实验步骤:1. 消毒表面:将外植体放入70%乙醇中浸泡5分钟,随后转移到稀释过的漂白粉溶液(5%漂白粉)中浸泡20分钟,最后用去离子水冲洗3次。
2. 切取外植体:使用对显微镜进行消毒的工具,如刀片、剪刀等,将外植体切取为适当大小。
3. 培养基配制:根据实验需要,制备基础培养基和添加适当激素的生长调控培养基。
4. 培养和生长:将切好的外植体放入装有培养基的培养皿中,密封好并置于适宜的温度和光照条件下进行培养和生长。
实验结果:根据实验设置的不同条件和培养基的配制,可得到不同的组培苗结果。
观察生长情况,记录外植体的存活率和苗种的生长状况。
实验讨论和结论:通过实验观察结果和记录的数据,可以评估组培苗的制备成功率,并对不同因素对组培苗生长的影响进行分析和讨论。
根据实验结果,可以得出对于特定植物的组培苗制备的最佳条件,以便在实际繁殖中应用。
实验注意事项:1. 实验操作需在无菌条件下进行,避免外界微生物的污染。
2. 使用消毒工具时,进行充分的消毒,以避免传播病原体。
3. 培养基的配制需要保证成分的准确和均匀混合,以保证培养基的质量。
4. 培养皿的密封和温湿度的控制对于组培苗的生长至关重要。
5. 在实验过程中,及时观察和记录外植体的变化和苗种的生长情况,以帮助分析结果和得出结论。
实验补充说明:实验中可以进行不同因素的处理,如不同激素浓度的应用、不同外植体来源的比较等,以探究其对组培苗的影响。
同时,可以结合其他方法,如细胞学观察、遗传学分析等,进一步研究组培苗的性状和品质。
植物组织培养基本操作图解ppt课件

3、剪好的茎尖
37
4、倒入70%酒精处理1分钟
38
5、倒去酒精
39
6、倒入消毒液(一般为升汞)处理15分钟
40
7、倒去消毒液
41
8、无菌水冲洗5次
42
9、取出茎尖
43
10、在滤纸上吸干水分
44
11 、 双 目 解 剖 镜 下 解 剖 茎 尖
45
目镜
放大倍数 旋钮 物镜
底光源开关 解剖载物台
→灭菌的滤纸上吸干→放入灭菌的培养皿。
2、在双目解剖镜下,用灭菌的解剖针剥去幼叶露 出生长锥,挑取带着两至三个叶原基的生长锥。 移到盛有B5培养基的培育皿中,诱导愈伤组织形 成,用封口膜将培养皿封好。
3、在恒温培养箱中,26℃下,培养六周,可形成
簇生芽丛。
34
1、幼苗形态
35
2、剪取茎尖
茎尖
36
2、在光照培养箱中,25℃下,16小 时光照,培养两周,可形成愈伤组 织。
28
1、将苗剪出伤口
29
2、剪好的叶片和茎段
30
3、打开培养皿
31
5、愈伤组织接种
32
6、培养皿封口
33
三、苗的茎尖培养
1、取幼苗10株,剪取1cm左右的茎尖→浸入70%
的酒精1分钟→消毒液中15分钟→无菌水冲洗5次
显 微 解 剖 镜 焦距旋钮 使 用
上光源调节
图解 旋钮
46
——
13 、 幼 苗 形 态 生 长 点
17
14、剪取茎段
18
15、剪好的苗
19
培养皿的拿法
20
16、茎段接种a
21
17、茎段接种b
植物的组织培养技术ppt

[答案] (1)无机盐 生长素 (2)植物细胞的全能性 有丝分裂 分化 (3)培养基 芽发育成叶,叶肉细胞中叶 绿素的合成需要光照条件 (4)选择性表达 (5)接种要在酒 精灯火焰旁进行
[典例3] 某二倍体植物是杂合体,下图为其花药中未 成熟花粉在适宜的培养基上培养产生完整植株的过程。请 据图回答:
(1)图中①表示的是该花粉培养过程中的________过程, ②表示的是________过程,X代表的是________,③表示的 是________过程,④表示的是诱导________过程。
答案:(1)大量元素 微量元素 细胞分裂素 (2)IAA浓度 再 生丛芽外植体的比率(m)和再生丛芽外植体上的丛芽平均数(n) 0~0.5 mg·L-1 (3)1 (4)6-BA
3.(2009·山东高考)人参是一种名贵中药材,其有效成分主 要是人参皂苷。利用细胞培养技术生产人参皂苷的大致 流程如下:
①按照不同的顺序使用这两类激素,会得到不同的实验
结果(如下表):
使用顺序
实验结果
先使用生长素,后使用细胞 有利于细胞分裂,但细胞
分裂素
不分化
先使用细胞分裂素,后使用 生长素
细胞既分裂又分化
同时使用
分化频率提高
②当同时使用这两类激素时,两者用量的比例影响植物 细胞的发育方向。
①高:利于根的分化、抑制芽的形成 细生胞长分素裂用素量用量的比值②低:利于芽的分化、抑制根的形成
基本过程
点
生根移栽,培养过程均需无菌操作
影响因素 不同 选材 点 生殖方式
水稻组织培养

[3]倪晋山,1985. 植物生理学实验手册(薛应龙主编),上海科 学技术出版社,63-64
水稻组织培养
实验原理
植物组织培养主要利用了植物细胞的全能性,细胞全能性 (toti potency)就是指每个生活的细胞中都包含有产生一个 完整机体的全套基因,在适宜的条件下,细胞具有形成一 个新的个体的潜在能力。
材料
选取水稻种子( 干种子或是湿种子均可)作为植物组织培养 的外植体
仪器
电子天平、酸度计、微量移液器、电炉、培养瓶、培养皿、烧杯、量 筒、移液管、容量瓶、玻璃棒、试剂瓶、超净工作台、剪刀、镊子、 照度计、摇床、灭菌锅
水稻种子做组织培养的优点
操作简单,节省时间
水稻外植体小,进行表面消毒后不易染菌,愈伤组织诱导率较高
水稻种子保存容易且存活时间更长,可以随时取材实验
参考文献
[1]盛玉婷. 2008. 植物组织培养技术及应用进展( 安徽农学通报, 14 (9) :45~47 [2]张志良,翟伟菁. 2003. 植物生理学实验指导( 北京: 高等教育出 版社,326~327
实验结果
根据上述培养基配方所建立起来的水稻植株再生体系,愈伤组织诱导 率)芽分化率及生根率均较高。水稻种子在诱导培养中培养10天左右, 从水稻芽的基部长出淡黄色)呈细小颗粒状的愈伤组织( 图 A)
(水稻种子在诱导培养中所得到的愈伤组织)
将愈伤组织转入分化芽的培养基后约7天,开始出现绿点并逐渐增多 ( 图 B)
(绿色幼苗在分化根的培养基中生出的根)
当水稻组培苗长高至 3~5cm时,即可进行炼苗,将三角瓶 口打开放置室温下,一定避免强光直射,炼苗 3 天左右即 可进行移栽( 图 F)
(炼苗及移栽成活的水稻再生植株)
组培苗的炼苗方法

组培苗的炼苗方法组培苗是通过利用组织培养技术培育出的一种植物苗种。
相比传统的播种繁殖,组培苗具有无污染、无草害、无虫害等优点,因此在现代农业生产中得到广泛应用。
下面将详细介绍组培苗的炼苗方法。
首先,组培苗的炼苗过程可以分为材料准备、组织分离、培养基配制、组织培养和苗期管理等步骤。
材料准备阶段是组培苗炼苗的关键。
首先需要选择适合的母本植物作为材料,并确保母本植物没有太大的生长病害。
其次,需要准备好无菌工作所需的器皿、培养基、无菌器械等。
组织分离是组培苗炼苗的第一步。
方法通常有叶片、茎尖、根尖等。
首先将母本植物的新鲜叶片、茎尖或根尖取下,并在清洁工作台上进行处理。
处理的步骤包括将材料表面清洗、用消毒液浸泡一段时间、反复漂洗等,以确保材料的无菌性。
培养基配制是组培苗炼苗的必要步骤。
培养基是提供植物生长所需营养和激素的基质。
常用的培养基包括MS培养基、WPM培养基等。
在配制培养基时,需要根据所选择的植物品种和组织类型来确定具体的成分配比,并将各成分按照一定比例加入到蒸馏水中,搅拌均匀后进行调节pH值和加热杀菌处理,最后装入培养器皿中待用。
组织培养是组培苗炼苗的核心过程。
首先将经过处理的组织材料切割成适当大小的组织块或组织片,然后将其分别置于装有培养基的无菌器皿中。
接下来,将这些器皿密封,并放入恒温培养室进行培养。
培养条件通常为温度25-28℃、光照强度1500-3000勒克斯、光照周期12-16小时。
苗期管理是组培苗炼苗的后续工作。
在组培苗生长过程中,需要定期观察苗的生长情况,检查有无病害和污染现象,并进行适当的处理。
同时,还需要掌握适当的灌溉和通风方法,以维持适宜的湿度和气体交换条件。
总结一下,组培苗的炼苗方法包括材料准备、组织分离、培养基配制、组织培养和苗期管理等步骤。
通过科学严谨的操作,能够获得无菌、健壮的组培苗,为农业生产提供良好的苗源。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
组培苗的炼苗方法集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
试管苗的炼苗和移栽
一、目的要求
熟练掌握组培苗移栽驯化技术。
二、用品
1、材料:生根组培苗;
2、器具用品:镊子;水盆;蛭石、珍珠岩、草木灰;育苗盘;喷雾器;竹签等。
三、方法与步骤
(一)练苗将生根的组培苗从培养室取出,将培养瓶移到室外遮阴蓬或温室中进行强光闭瓶练苗5~20天左右,遮阴度宜为50%~70%。
然后打开瓶口,再放置3~7天。
(二)基质灭菌将蛭石、珍珠岩和草木灰分别用聚丙烯塑料袋装好,在高压灭菌锅中灭菌20分钟,或者采用高温干热灭菌法灭菌,灭菌后冷却备用。
(三)育苗盘准备取干净的育苗盘,将蛭石和珍珠岩按1:1混合,然后倒入育苗盘中,用木板刮平。
将育苗盘放入1-2cm深的水槽中,使水分浸透基质,然后取出备用。
(四)试管苗脱瓶用镊子将试管苗轻轻取出,放入清水盆中,小心洗去根部琼脂,然后涝出,放入干净的小盆中。
(五)移栽用竹签在基质上打孔,将小苗栽入育苗穴盘中,轻轻覆盖、压实。
待整个穴盘栽满后用喷雾器喷水浇平。
最后将育苗盘摆入到驯化室中,正常管理。
四、作业
记录试管苗移栽驯化步骤,统计移栽成活率。
解释:
1、闭瓶强光练苗。
当生根后或根系得到基本发育后,将培养瓶移到室外遮阴蓬或温室中进行强光闭瓶练苗5~20天左右,遮阴度宜为
50%~70%。
2、开瓶强光练苗。
将培养容器的盖子或塞打开,在自然光下进行开瓶练苗3~7天,正午强光或南方光照较强地区要注意采取措施如用阴蓬
或温室避免灼伤小苗。
如果在开盖容器中培养不超过1周,一般不会引起含蔗糖培养基的污染问题。
开瓶炼苗可以分阶段进行,即首先松盖(或塞)一两天,然后部分开盖一两天,最后完全揭去盖。
这种方法在相对湿度十分低的屋内特别有好处。
培养容器的开口大小也影响开盖的速度,开口大的瓶盖应比开口小的瓶盖除去的速度慢一些。
3、试管苗的移栽。
试管苗移栽是组织培养过程的重要环节,这个工作环节做不好,就会造成前功尽弃。
试管苗从琼脂培养基中移出时要用长镊子小心取出,彻底清洗干净根部(因为残留的蔗糖和营养会成为潜在的致病微生物的生长培养基,洗不净容易引起移栽苗烂根死亡),并且避免损坏根系。
之后直接移栽或使用0.1%~0.3%的高锰酸钾或多菌灵等杀菌剂溶液中清洗,然后用清水清洗后移入苗床或盆钵,也可用水清洗后用多菌灵溶液浸泡10~30分钟后移栽,栽后淋足定根水。
炼苗在塑料薄膜(或玻璃)温室内或遮阴网室内进行,使用温室或温棚时应注意设置通风口,防止浇水后高温引起萎蔫及高湿引起烂苗。
生长基质应当具有适合的pH值、多空隙、良好的排水和通气性能,如一般用珍珠岩、蛭石、草炭土或腐殖土比例为1:1:0.5。
也可用砂子:草炭土或腐殖土为1:1。
这些基质在使用前应高压灭菌,或用至少小时烘烤来消灭其中的微生物。
由于移出的试管小植株极容易感染病,所以生长环境的卫生状况和病害防治对移栽能否成功十分关键。
通常对生长基质、培养容器和苗床进行消毒处理,采用新的培养容器或聚乙烯薄膜效果都很好,必要时可喷施稀的杀菌剂。
4、移栽后的管理。
移出的试管苗一般在炼苗前4周遮阴要达到50%~90%,并采用喷雾洒水保持一定的湿度(85%左右),之后逐渐降低湿度和增强光照。
湿度降低幅度及光照增加量依不同植物而定,总体上应促使老叶缓慢衰退并同时产生新叶。
如果降低或增加过快,会使叶片褪绿和灼伤,缓苗期延长,甚至导致移栽苗死亡。
但是,只要小植株能够忍受,尽可能高的光照水平是有利的。
温度不应低于20℃,最好达到25~30℃。
但温度湿度过高易于滋生杂菌,造成苗霉烂或根茎处腐烂,因此应对温度加以控制。
遮阴和调节湿度(喷雾或塑料薄膜覆盖)也有助于控制温度。
在炼苗时可适当施用大量和微量元素,如采用1/4或
1/2?MS培养基溶液。
移栽后定期施肥才能保持苗木旺盛生长,具体施肥方法(顶部喷施或掺入基质)与施肥量随不同植物而异。
移栽一般在春季进行,如果在北方早春或冬季较冷的时节,可能需要对移栽苗床下铺电线进行加温,促进根系功能的恢复,直至新叶形成为止。
对于较难移栽的植物,可先经沙床或营养盘移栽后,再移至营养袋中培育壮苗,也可直接移入营养袋中。
直到长成一定规格(一定的高度、粗度和新叶数)和无病害的壮苗后,在大田中定植。
也可不进行体外生根培养,直接将试管外或瓶外生根与炼苗相结合,也就是对无根苗进行直接移栽。
这种方法对某些植物行之有效,并可大大节约成本,所需要的环境条件与生根试管苗的炼苗要求相同,特别需要注意湿度、光照和温度。
在向生根基质移植前,有时需要经生长素诱导生根处理。
