新药研发相关知识详细介绍(ppt 44页)
合集下载
新药研发PPT幻灯片课件

• 在体内通过酶解而重新释放出母体化合物发挥作用。
31
3. 孪药设计
• 孪药,是指将两个相同或不同的先导化合物或药物经共价键连 接缀合成的新分子,在体内代谢生成以上两分子药物而产生协 同作用,增强活性或产生新的药理活性,或者提高作用的选择 性。
• 如果在体内可代谢为原来的构成成分,也被看作是前体药物。 • 常应用拼合原理。
入地研究中。 11
随机与逐一筛选 及意外发现先导化合物
随机与逐一筛选及意外发现曾是获得先导化合 物的最大来源,目前仍为一个可靠来源。其方式为 对从特有或稀有植物、海洋生物、微生物代谢产物 以及低等动植物体内分离天然生物活性成分,对有 机化工产品及其中间体进行普筛,虽然有相当大的 盲目性,但却可以得到新结构类型或新作用特点的 先导化合物。
6
从天然活性物质中 筛选获得先导化合物
在药物发展的早期阶段,利用天然产物作为治疗手 段几乎是唯一的源泉。时至今日,从动植物和微生物体 内分离鉴定具有生物活性物质,仍然是先导物甚至是药 物的重要组成部分。因所获得天然活性物质的来源不同, 又划分为三种途径:
从陆地上动植物体内提取、分离天然活性物质获得先导化 合物
10
实例分析
青蒿素(Artemisin分in析e):是这从是黄利用天然植物发掘先 花蒿植物(ACrH3temis导ia物,an开nu发le药)分物的一个典型H例子CH。3 天 H离对氯3C 的恶喹O含性耐OO有 疟 药O 过原株氧虫具CH键作有3 的用抑然 疟 明 内倍快制青作 : 酯半,作蒿用 过 经萜特用素复 氧 硼内别,发 键 氢的酯 是对缺率 还 化,对人点较原钠是高成还H3。醚原生C 物构键成OH利效,半OO用关活缩O 系性醛度低研丧仍和究失保HH 抗表。持 体型毒的R为=还性抗-原H很 疟O青低先蒿R,导素因化而合活 或 性成物性 酯 明为,, 化 显新利半 成 提结用缩 青 高构 对醛 蒿 ,类其的酰药羟酯物基等动甲化力醚合学青化物性蒿O成,质素蒿生也甲物有CH醚活所3 进抗为行疟R=蒿结药-甲C构 。H醚3改造开发改 但了善青很,蒿多这素有作些效化为的合抗物疟先均已导发化展合物成药仍物在,深
31
3. 孪药设计
• 孪药,是指将两个相同或不同的先导化合物或药物经共价键连 接缀合成的新分子,在体内代谢生成以上两分子药物而产生协 同作用,增强活性或产生新的药理活性,或者提高作用的选择 性。
• 如果在体内可代谢为原来的构成成分,也被看作是前体药物。 • 常应用拼合原理。
入地研究中。 11
随机与逐一筛选 及意外发现先导化合物
随机与逐一筛选及意外发现曾是获得先导化合 物的最大来源,目前仍为一个可靠来源。其方式为 对从特有或稀有植物、海洋生物、微生物代谢产物 以及低等动植物体内分离天然生物活性成分,对有 机化工产品及其中间体进行普筛,虽然有相当大的 盲目性,但却可以得到新结构类型或新作用特点的 先导化合物。
6
从天然活性物质中 筛选获得先导化合物
在药物发展的早期阶段,利用天然产物作为治疗手 段几乎是唯一的源泉。时至今日,从动植物和微生物体 内分离鉴定具有生物活性物质,仍然是先导物甚至是药 物的重要组成部分。因所获得天然活性物质的来源不同, 又划分为三种途径:
从陆地上动植物体内提取、分离天然活性物质获得先导化 合物
10
实例分析
青蒿素(Artemisin分in析e):是这从是黄利用天然植物发掘先 花蒿植物(ACrH3temis导ia物,an开nu发le药)分物的一个典型H例子CH。3 天 H离对氯3C 的恶喹O含性耐OO有 疟 药O 过原株氧虫具CH键作有3 的用抑然 疟 明 内倍快制青作 : 酯半,作蒿用 过 经萜特用素复 氧 硼内别,发 键 氢的酯 是对缺率 还 化,对人点较原钠是高成还H3。醚原生C 物构键成OH利效,半OO用关活缩O 系性醛度低研丧仍和究失保HH 抗表。持 体型毒的R为=还性抗-原H很 疟O青低先蒿R,导素因化而合活 或 性成物性 酯 明为,, 化 显新利半 成 提结用缩 青 高构 对醛 蒿 ,类其的酰药羟酯物基等动甲化力醚合学青化物性蒿O成,质素蒿生也甲物有CH醚活所3 进抗为行疟R=蒿结药-甲C构 。H醚3改造开发改 但了善青很,蒿多这素有作些效化为的合抗物疟先均已导发化展合物成药仍物在,深
新药研制与开发PPT课件

先导化合物发现途径 Nhomakorabea01
高通量筛选
虚拟筛选
02
03
组合化学
利用高通量技术从大量化合物库 中筛选出具有活性的先导化合物。
基于计算机模拟技术预测化合物 与靶点的相互作用,提高筛选效 率。
通过化学合成方法制备具有结构 多样性的化合物库,增加发现机 会。
候选药物优化策略
结构优化
01
通过化学修饰、构效关系分析等手段提高候选药物的活性及选
新药分类
中药、天然药物注册分类,化学 药品注册分类,生物制品注册分 类。
国内外新药研发现状
国内新药研发现状
近年来我国新药研发虽取得显著进展 ,但创新能力仍显不足,药品研发低 水平重复现象比较严重,存在“多、 小、散、乱”的状况。
国外新药研发现状
发达国家由于药品研发基础好、技术 先进,在新药研发领域处于领先地位 ,其研发的新药数量和质量都远高于 我国。
保密技术运用
采用加密技术、访问控制技术等手段, 确保商业秘密不被泄露。
泄密应急处理
制定泄密应急预案,及时采取补救措 施,降低损失。
市场推广策略制定
市场调研
产品定位
了解目标市场、竞争对手、客户需求等信 息,为制定推广策略提供依据。
根据产品特点和市场需求,明确产品的目 标用户和市场定位。
推广渠道选择
营销策略制定
辅料选择
选择适宜的辅料,提高制剂的稳 定性和生物利用度,同时降低不 良反应的发生。
处方优化
通过对比实验和数据分析,对制 剂处方进行优化,提高产品质量 和生产效率。
质量标准建立及稳定性考察
1 2
质量标准制定
根据药物的性质和临床需求,制定合理的质量标 准,包括鉴别、检查、含量测定等项目。
高通量筛选
虚拟筛选
02
03
组合化学
利用高通量技术从大量化合物库 中筛选出具有活性的先导化合物。
基于计算机模拟技术预测化合物 与靶点的相互作用,提高筛选效 率。
通过化学合成方法制备具有结构 多样性的化合物库,增加发现机 会。
候选药物优化策略
结构优化
01
通过化学修饰、构效关系分析等手段提高候选药物的活性及选
新药分类
中药、天然药物注册分类,化学 药品注册分类,生物制品注册分 类。
国内外新药研发现状
国内新药研发现状
近年来我国新药研发虽取得显著进展 ,但创新能力仍显不足,药品研发低 水平重复现象比较严重,存在“多、 小、散、乱”的状况。
国外新药研发现状
发达国家由于药品研发基础好、技术 先进,在新药研发领域处于领先地位 ,其研发的新药数量和质量都远高于 我国。
保密技术运用
采用加密技术、访问控制技术等手段, 确保商业秘密不被泄露。
泄密应急处理
制定泄密应急预案,及时采取补救措 施,降低损失。
市场推广策略制定
市场调研
产品定位
了解目标市场、竞争对手、客户需求等信 息,为制定推广策略提供依据。
根据产品特点和市场需求,明确产品的目 标用户和市场定位。
推广渠道选择
营销策略制定
辅料选择
选择适宜的辅料,提高制剂的稳 定性和生物利用度,同时降低不 良反应的发生。
处方优化
通过对比实验和数据分析,对制 剂处方进行优化,提高产品质量 和生产效率。
质量标准建立及稳定性考察
1 2
质量标准制定
根据药物的性质和临床需求,制定合理的质量标 准,包括鉴别、检查、含量测定等项目。
新药研发过程PPT(共 38张)

人文关怀、专注药研—黄从海博士与大家共勉
新药的分类(SFDA)
生物制品注册分类
1. 未在国内外上市销售的生物制品。 2. 单克隆抗体。 3. 基因治疗、体细胞治疗及其制品。 4. 变态反应原制品。 5. 由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。 6. 由已上市销售生物制品组成新的复方制品。 7. 已在国外上市销售但尚未在国内上市销售的生物制品。 8. 含未经批准菌种制备的微生态制品。 9. 与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺 失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。 10. 与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。 11. 首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取或者发 酵技术等)。 12. 国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的 制品。 13. 改变已上市销售制品的剂型但不改变给药途径的生物制品。 14. 改变给药途径的生物制品(不包括上述12项)。 15. 已有国家药品标准的生物制品。
人文关怀、专注药研—黄从海博士与大家共勉
新药开发的一般程序
待测样品(天然、合成或生物工程产物) 初筛
有活性
生物型(体外、体内) 无活性
化学部分
工艺路线 质量标准
药效学
临床前药理
制剂部分
一般药理学 毒理学
剂型、含量标准、 稳定性、溶出度 药动学 生物利用度
临床试验评价
Ⅰ期
Ⅱ期
Ⅲ期
Ⅳ期
人文关怀、专注药研—黄从海博士与大家共勉
人文关怀、专注药研—黄从海博士与大家共勉
新药的分类(SFDA)
生物制品注册分类
1. 未在国内外上市销售的生物制品。 2. 单克隆抗体。 3. 基因治疗、体细胞治疗及其制品。 4. 变态反应原制品。 5. 由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。 6. 由已上市销售生物制品组成新的复方制品。 7. 已在国外上市销售但尚未在国内上市销售的生物制品。 8. 含未经批准菌种制备的微生态制品。 9. 与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺 失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。 10. 与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。 11. 首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取或者发 酵技术等)。 12. 国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的 制品。 13. 改变已上市销售制品的剂型但不改变给药途径的生物制品。 14. 改变给药途径的生物制品(不包括上述12项)。 15. 已有国家药品标准的生物制品。
人文关怀、专注药研—黄从海博士与大家共勉
新药开发的一般程序
待测样品(天然、合成或生物工程产物) 初筛
有活性
生物型(体外、体内) 无活性
化学部分
工艺路线 质量标准
药效学
临床前药理
制剂部分
一般药理学 毒理学
剂型、含量标准、 稳定性、溶出度 药动学 生物利用度
临床试验评价
Ⅰ期
Ⅱ期
Ⅲ期
Ⅳ期
人文关怀、专注药研—黄从海博士与大家共勉
人文关怀、专注药研—黄从海博士与大家共勉
中药新药研发流程基础知识PPT

月满则缺,物极必反。 微量的蛇毒可以治疗心脏疾病,
但是过多的剂量则是致命的;同 样的道理,吗啡可以缓解疼痛, 过量服用药理学是研究药物与机体相互作 用及其规律的机制。
药理学的方法是实验性的,即在 严格控制的条件下观察药物对机 体或其组成部分的作用规律并分 析其客观作用原理。
一、中药新药研发过程
药材辅料
中药研发流程图
药学提取 工艺
小试3
药学成型
批
摸索质量
工艺
标准
大生产一批 主要药效学
中试3批
建立质量标 准草案
稳定性三因素 试验
包 装
稳定性加速及 长期实验
急毒
长毒
临床
临床批件
生产批件
1、调研
2、立项
3、实验室研究
工艺制备研究 提取工艺设计 提取工艺实验 成型工艺设计 成型工艺实验 三批小样实验 放大处方量实验 试制三批小样,确定工艺
中药研发基础知识
中药新药分类:
1、未在国内外上市销售的药品. 2、改变给药途径且尚未在国内外上市销售的制剂 3、已在国外上市销售但尚未在国内上市销售的药品 4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不
改变其药理作用的原料药及其制剂 5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂 6、已有国家药品标准的原料药或者制剂
的反应,开始确定 其副作用。
Ⅱ期:对药品或治 疗的研究扩大到规 模较大的患者人群 (100-300人),取得 效果的初步证据, 对其安全性展开进 一步的评估。如果 获得效果证据并且 风险可以接受,则 进入下一阶段。
6、临床研究
Ⅲ期:在此阶段,将候 选药物扩大到大规模的 患者人群(1,000-3,000人 ),进一步测试其效果, 监测其副作用。在某些 情况下,如可行,将与 治疗标准进行对比。
但是过多的剂量则是致命的;同 样的道理,吗啡可以缓解疼痛, 过量服用药理学是研究药物与机体相互作 用及其规律的机制。
药理学的方法是实验性的,即在 严格控制的条件下观察药物对机 体或其组成部分的作用规律并分 析其客观作用原理。
一、中药新药研发过程
药材辅料
中药研发流程图
药学提取 工艺
小试3
药学成型
批
摸索质量
工艺
标准
大生产一批 主要药效学
中试3批
建立质量标 准草案
稳定性三因素 试验
包 装
稳定性加速及 长期实验
急毒
长毒
临床
临床批件
生产批件
1、调研
2、立项
3、实验室研究
工艺制备研究 提取工艺设计 提取工艺实验 成型工艺设计 成型工艺实验 三批小样实验 放大处方量实验 试制三批小样,确定工艺
中药研发基础知识
中药新药分类:
1、未在国内外上市销售的药品. 2、改变给药途径且尚未在国内外上市销售的制剂 3、已在国外上市销售但尚未在国内上市销售的药品 4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不
改变其药理作用的原料药及其制剂 5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂 6、已有国家药品标准的原料药或者制剂
的反应,开始确定 其副作用。
Ⅱ期:对药品或治 疗的研究扩大到规 模较大的患者人群 (100-300人),取得 效果的初步证据, 对其安全性展开进 一步的评估。如果 获得效果证据并且 风险可以接受,则 进入下一阶段。
6、临床研究
Ⅲ期:在此阶段,将候 选药物扩大到大规模的 患者人群(1,000-3,000人 ),进一步测试其效果, 监测其副作用。在某些 情况下,如可行,将与 治疗标准进行对比。
新药研发相关知识详细介绍PPT(44张)

新 药 申 报 流 程
3.4 上市及监测
IV期临床研究和上市后监测 理解药物的作用机理和范围; 研究药物可能的新的治疗作用; 说明需要补充的剂量规格
新药开发研究分为临床前研究和临床研究两个阶段。
新药开发研究示意图
临床前研 究
候选化合 物
临床前研究
临床研究
药物质量研究 药物制剂研究 药效学评价 药物代谢评价 药物安全评价
IV 期临床试验
临床候选 新药
III 期临床试验 II 期临床试验
I 期临床试验
新药
3.1 临床前研究
3.1.1 药学研究: 化学原料药要确证药物的化学结构;多组分药物,
2.2 以现有的药物为新药研究基础
优点:
成功率大。 改善药物的吸收,减少药物的毒副作用,减少耐受性,使
药物长效,速效,高效为研究目标。 天然药物的结构简化的代用品,还可以降低药物的成本。
近年来随着生理生化机制的了解,得到了一些疾病治疗的突破性的药
物,称原型药物(Prototype Drug)。随之出现了大量的“Me-too” 药物。“Me-too”药物特指具有自己知识产权的药物,其药效和同类的突
中药讲究炮制,讲究药物四性五味和归经。 中药多用复方,讲究君臣佐使。
中药现代化
定义:在中医药理论的指导下,以现代科学技术为手段,研究中药疗效的
物质基础,发现中药的有效成分,阐明中药的作用机制,并在中药有效成 分研究的基础上,制定出国际上认可的中药质量标准;同时,要加强中药 新剂型的研究,健全现代化的中药研发和生产管理体制,使之符合国际上 认可的GAP、GLP、GMP、GCP、GSP等管理规范。
C.呼吸系统:给药后呼吸频率、幅度和节律变化。
新药研发基本知识.ppt

me better
三、国内外新药研发现状
me too和me better
雷尼替丁 雷尼替丁比西咪替丁作用强5-8 倍,副作用却比西咪替丁小
西咪替丁
法莫替丁 法莫替丁比西咪替丁药效高30100倍
三、国内外新药研发现状
我国的新药
目前我国自主研发、获得国际承认的创新药物仅两个: 上世纪50年代开发的二巯基丁二酸钠 上世纪60年代开发的青蒿素
二、新药研发程序
美国的新药定义
是指一种“新的化合物”出现,并 且“该药的治疗成分从未通过任何成员 国或地区的法律认可”。
我国的新药定义
未曾在中国境内上市销售的药品, 已上市的药品改变剂型、改变给药途径、 增加新适应症或制成新的复方制剂,亦 按新药管理。
真正意义上的新药
是指拥有全球专利或在全世界都没 有上市过的新化学实体(NCE) 新药。它 不包括现存化合物的新型盐类、前药、 代谢物和酯类,也不包括组合产品。
二、新药研发程序
反应停事件 沙利度胺,海豹肢畸形 1957-1962, 15000婴儿受害
二、新药研发程序
临床研究
临床研究是评价侯选药物能否成为一个新药的最终的标准 新药临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期
三、国内外新药研发现状
新药研发特点:费用多,投入高,时间长
5000个
250个
10个
1个
黄花蒿
O O
O
O
O
青蒿素
疟疾
三、国内外新药研发现状
2011年9月,中国女药学家屠呦呦因创制新型抗疟药——— 青蒿素和双氢青蒿素的贡献,获得被誉为诺贝尔奖“风向 标”的拉斯克奖。这是中国生物医学界迄今为止获得的世 界级最高奖。
先导化合物的筛选
三、国内外新药研发现状
me too和me better
雷尼替丁 雷尼替丁比西咪替丁作用强5-8 倍,副作用却比西咪替丁小
西咪替丁
法莫替丁 法莫替丁比西咪替丁药效高30100倍
三、国内外新药研发现状
我国的新药
目前我国自主研发、获得国际承认的创新药物仅两个: 上世纪50年代开发的二巯基丁二酸钠 上世纪60年代开发的青蒿素
二、新药研发程序
美国的新药定义
是指一种“新的化合物”出现,并 且“该药的治疗成分从未通过任何成员 国或地区的法律认可”。
我国的新药定义
未曾在中国境内上市销售的药品, 已上市的药品改变剂型、改变给药途径、 增加新适应症或制成新的复方制剂,亦 按新药管理。
真正意义上的新药
是指拥有全球专利或在全世界都没 有上市过的新化学实体(NCE) 新药。它 不包括现存化合物的新型盐类、前药、 代谢物和酯类,也不包括组合产品。
二、新药研发程序
反应停事件 沙利度胺,海豹肢畸形 1957-1962, 15000婴儿受害
二、新药研发程序
临床研究
临床研究是评价侯选药物能否成为一个新药的最终的标准 新药临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期
三、国内外新药研发现状
新药研发特点:费用多,投入高,时间长
5000个
250个
10个
1个
黄花蒿
O O
O
O
O
青蒿素
疟疾
三、国内外新药研发现状
2011年9月,中国女药学家屠呦呦因创制新型抗疟药——— 青蒿素和双氢青蒿素的贡献,获得被誉为诺贝尔奖“风向 标”的拉斯克奖。这是中国生物医学界迄今为止获得的世 界级最高奖。
先导化合物的筛选
新药研究及开发概述PPT学习课件

药品的注册申请还包括对已有国家标准药品的 申请。
化学药品的注册分类分为六大类
31
(一)未在国内外上市销售的药品
1.通过合成或半合成的方法制得的原料药及 其制剂;
2.天然物质中提取或者通过发酵提取的新的 有效单体及其制剂;
3.用拆分或者合成等方法制得的已知药物中 的光学异构体及其制剂;
4.将已上市销售的多组分药物制备为较少组 分的药物;
5.新的复方制剂。
32
(二)改变给药途径且尚未在国 内外上市销售的制剂
33
(三)已在国外上市销售但尚未 在国内上市销售的药品
1.已在国外上市销售的原料药及其制剂; 2.已在国外上市销售的复方制剂; 3.改变给药途径并已在国外上市销售的制剂。
因此要求药物在治疗剂量范围内,不产生严重 的毒性反应,不产生或较少产生副作用。
24
(二)药物的纯度
药物有效成分的含量是反映药物纯度的重 要标志,而药物中存在的杂质直接影响到药物 的疗效和并可能导致毒副作用的产生。
25
药物的杂质(Impurity of Drugs)
指在生产、贮存过程中引进或产生的药物 以外的其它化学物质,包括由于分子手性的存 在而产生的非治疗活性的光学异构体。
11
临床前研究需解决的问题有
(1)所研究的药物有确定的药效学作用; (2)在动物中进行了药物的吸收试验且其结果
可行; (3)动物中进行的药物吸收、代谢和排泄研究
和人体中所预期的结果相似; (4)药物有较少的活性代谢物; (5)有明确的新药代谢的动力学研究; (6)三致试验和急性、亚急性、长期毒理试验,
5
新药研究与开发过程
研究计划的确立-药源-筛选-临床前研 究(I,II)-IND(investigating new drug) 申请-I期临床-II期临床-III期临床-新药申 请(NDA)- 获批,注册上市
化学药品的注册分类分为六大类
31
(一)未在国内外上市销售的药品
1.通过合成或半合成的方法制得的原料药及 其制剂;
2.天然物质中提取或者通过发酵提取的新的 有效单体及其制剂;
3.用拆分或者合成等方法制得的已知药物中 的光学异构体及其制剂;
4.将已上市销售的多组分药物制备为较少组 分的药物;
5.新的复方制剂。
32
(二)改变给药途径且尚未在国 内外上市销售的制剂
33
(三)已在国外上市销售但尚未 在国内上市销售的药品
1.已在国外上市销售的原料药及其制剂; 2.已在国外上市销售的复方制剂; 3.改变给药途径并已在国外上市销售的制剂。
因此要求药物在治疗剂量范围内,不产生严重 的毒性反应,不产生或较少产生副作用。
24
(二)药物的纯度
药物有效成分的含量是反映药物纯度的重 要标志,而药物中存在的杂质直接影响到药物 的疗效和并可能导致毒副作用的产生。
25
药物的杂质(Impurity of Drugs)
指在生产、贮存过程中引进或产生的药物 以外的其它化学物质,包括由于分子手性的存 在而产生的非治疗活性的光学异构体。
11
临床前研究需解决的问题有
(1)所研究的药物有确定的药效学作用; (2)在动物中进行了药物的吸收试验且其结果
可行; (3)动物中进行的药物吸收、代谢和排泄研究
和人体中所预期的结果相似; (4)药物有较少的活性代谢物; (5)有明确的新药代谢的动力学研究; (6)三致试验和急性、亚急性、长期毒理试验,
5
新药研究与开发过程
研究计划的确立-药源-筛选-临床前研 究(I,II)-IND(investigating new drug) 申请-I期临床-II期临床-III期临床-新药申 请(NDA)- 获批,注册上市
新药研发相关知识介绍45页PPT

43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
4没有不老的誓言,没有不变的承 诺,踏 上旅途 ,义无 反顾。 40、对时间的价值没有没有深切认识 的人, 决不会 坚韧勤 勉。
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
新药研发相关知识介绍
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
4没有不老的誓言,没有不变的承 诺,踏 上旅途 ,义无 反顾。 40、对时间的价值没有没有深切认识 的人, 决不会 坚韧勤 勉。
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
新药研发相关知识介绍
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
新药研发PPT幻灯片课件

8
从海洋生物发现生物活性物质获得先导化合物
这是取得天然活性物质的重要途径。例如从海洋 中采集的海鞘类、贝类、海绵等的海洋无脊椎动物, 以及硅藻、蓝藻、绿藻类的海洋浮游生物,生息在 海洋里面的菌类等等都是科学家寻求生物活性物质 的很好材料。
9
从微生物的代谢产物中 发现生物活性物质获得先导化合物
这也是一条非常普遍和重要的发现先导化合物的途径。自 1928年弗莱明发现青霉素以来,数以千计的微生物代谢产物 被发现有生物活性物质,如洛伐他汀(Lovastatin)是从土 曲霉菌的发酵产物中分离出的一种胆固醇生物合成抑制剂。 尤其在当今的后基因组时代,科学家能够利用微生物的基因 情报对微生物进行改良,从而能够控制微生物的发酵过程, 最有效的产生出所需要种类的发酵产物。
6
从天然活性物质中 筛选获得先导化合物
在药物发展的早期阶段,利用天然产物作为治疗手 段几乎是唯一的源泉。时至今日,甚至是药 物的重要组成部分。因所获得天然活性物质的来源不同, 又划分为三种途径:
从陆地上动植物体内提取、分离天然活性物质获得先导化 合物
02
03
04
05
06 Regulatory
concept
approval
靶点选择 Target selec
先导发现 Lead finding
临床前开发 Preclinical development
药物发明
开发
4
Discovery
Development
先导化合物
又称原型药,是指通过各种途径和方法 得到的具有独特结构且具有一定生物活性 的化合物。
13
实例分析
吲哚美辛类非甾体抗炎药的发现过程
分在析人:体炎炎症症的的重重要要介介质质55-羟色胺的功功能能被被揭揭示示后后,, 人可类以希考望虑能以以5-此羟作色为胺出作发为点先寻导找化治合疗物各,种从原因寻引找起其的拮炎抗 症物的为药出物发。点特开别发是药发物现。风而湿拮性抗关物节的炎结病构人应的尿与中5-,羟有色大胺 量相的似色,氨特酸别的是代发谢现产风物湿,性便关合节成炎了病大人量的含尿吲中哚环,的有化大合量 物的,色从氨中酸筛的选代出谢吲产哚物美,辛更(I进nd一om步et证ha实ci设n 计消拮炎痛抗)物作应为以 解含热吲镇哚痛环和化关合节物炎为治先疗导药物。,为于了是消合除成或了减大轻对量胃含肠吲道哚刺环 激的的化副合作物用,,选经择结出构吲改哚造美,辛又。开消发除了或吲减哚轻美辛吲类哚的美舒辛林的 酸副(作Su用li,nd但ac不)。能分改析变这其样活工性作,的必基须本保思留路其。基本结构, 所以开发了吲哚美辛的电子等排物舒林酸。
从海洋生物发现生物活性物质获得先导化合物
这是取得天然活性物质的重要途径。例如从海洋 中采集的海鞘类、贝类、海绵等的海洋无脊椎动物, 以及硅藻、蓝藻、绿藻类的海洋浮游生物,生息在 海洋里面的菌类等等都是科学家寻求生物活性物质 的很好材料。
9
从微生物的代谢产物中 发现生物活性物质获得先导化合物
这也是一条非常普遍和重要的发现先导化合物的途径。自 1928年弗莱明发现青霉素以来,数以千计的微生物代谢产物 被发现有生物活性物质,如洛伐他汀(Lovastatin)是从土 曲霉菌的发酵产物中分离出的一种胆固醇生物合成抑制剂。 尤其在当今的后基因组时代,科学家能够利用微生物的基因 情报对微生物进行改良,从而能够控制微生物的发酵过程, 最有效的产生出所需要种类的发酵产物。
6
从天然活性物质中 筛选获得先导化合物
在药物发展的早期阶段,利用天然产物作为治疗手 段几乎是唯一的源泉。时至今日,甚至是药 物的重要组成部分。因所获得天然活性物质的来源不同, 又划分为三种途径:
从陆地上动植物体内提取、分离天然活性物质获得先导化 合物
02
03
04
05
06 Regulatory
concept
approval
靶点选择 Target selec
先导发现 Lead finding
临床前开发 Preclinical development
药物发明
开发
4
Discovery
Development
先导化合物
又称原型药,是指通过各种途径和方法 得到的具有独特结构且具有一定生物活性 的化合物。
13
实例分析
吲哚美辛类非甾体抗炎药的发现过程
分在析人:体炎炎症症的的重重要要介介质质55-羟色胺的功功能能被被揭揭示示后后,, 人可类以希考望虑能以以5-此羟作色为胺出作发为点先寻导找化治合疗物各,种从原因寻引找起其的拮炎抗 症物的为药出物发。点特开别发是药发物现。风而湿拮性抗关物节的炎结病构人应的尿与中5-,羟有色大胺 量相的似色,氨特酸别的是代发谢现产风物湿,性便关合节成炎了病大人量的含尿吲中哚环,的有化大合量 物的,色从氨中酸筛的选代出谢吲产哚物美,辛更(I进nd一om步et证ha实ci设n 计消拮炎痛抗)物作应为以 解含热吲镇哚痛环和化关合节物炎为治先疗导药物。,为于了是消合除成或了减大轻对量胃含肠吲道哚刺环 激的的化副合作物用,,选经择结出构吲改哚造美,辛又。开消发除了或吲减哚轻美辛吲类哚的美舒辛林的 酸副(作Su用li,nd但ac不)。能分改析变这其样活工性作,的必基须本保思留路其。基本结构, 所以开发了吲哚美辛的电子等排物舒林酸。
《新药研制与开发》课件

《新药研制与开发》ppt课件
目录
• 新药研制概述 • 新药发现与靶点验证 • 临床前研究与药学研究 • 新药临床试验与审批上市 • 新药上市后的监测与评价
01
新药研制概述
新药的定义与分类
总结词
明确新药的定义,了解新药的分类标 准。
详细描述
新药是指未被批准上市的药物,包括 创新药物和改良型药物。根据新药的 来源和特点,可以分为化学药、生物 药和中成药等不同类型。
试验提供科学依据。
药学研究还需要进行药物制剂的工艺验证和质量控制 ,以确保药物制剂的稳定性和一致性。
药学研究是新药研制过程中的重要阶段,主要 涉及药物的理化性质、药效学、药代动力学等 方面的研究。
药学研究需要综合考虑药物的稳定性、安全性和 有效性,以确保药物在临床应用中的安全性和有 效性。
药效学研究
药代动力学研究还需要进行药 物相互作用的研究,以了解药 物与其他药物或食物相互作用 的可能性。
04
新药临床试验与审批上市
Ⅰ期临床试验
总结词
初步安全性评估
总结词
小规模试验
详细描述
Ⅰ期临床试验是新药研发的早期阶段,主要目的是评估新 药在人体中的安全性和耐受性,确定药物的有效剂量范围 ,以及初步探索药物的治疗效果。
药物体外活性评价
细胞模型
建立靶点相关的细胞模型,模拟药物作用环境,评估候选药物在细胞水平上的活性。
药效学评价
通过药效学实验,如细胞增殖、凋亡、信号转导等实验,对候选药物的疗效和作用机制进行评估。
03
临床前研究与药学研究
药学研究
药学研究的目标是确定药物的剂型、给药途径 、制备工艺和质量控制标准等,为后续的临床
据。
药物经济学评价
目录
• 新药研制概述 • 新药发现与靶点验证 • 临床前研究与药学研究 • 新药临床试验与审批上市 • 新药上市后的监测与评价
01
新药研制概述
新药的定义与分类
总结词
明确新药的定义,了解新药的分类标 准。
详细描述
新药是指未被批准上市的药物,包括 创新药物和改良型药物。根据新药的 来源和特点,可以分为化学药、生物 药和中成药等不同类型。
试验提供科学依据。
药学研究还需要进行药物制剂的工艺验证和质量控制 ,以确保药物制剂的稳定性和一致性。
药学研究是新药研制过程中的重要阶段,主要 涉及药物的理化性质、药效学、药代动力学等 方面的研究。
药学研究需要综合考虑药物的稳定性、安全性和 有效性,以确保药物在临床应用中的安全性和有 效性。
药效学研究
药代动力学研究还需要进行药 物相互作用的研究,以了解药 物与其他药物或食物相互作用 的可能性。
04
新药临床试验与审批上市
Ⅰ期临床试验
总结词
初步安全性评估
总结词
小规模试验
详细描述
Ⅰ期临床试验是新药研发的早期阶段,主要目的是评估新 药在人体中的安全性和耐受性,确定药物的有效剂量范围 ,以及初步探索药物的治疗效果。
药物体外活性评价
细胞模型
建立靶点相关的细胞模型,模拟药物作用环境,评估候选药物在细胞水平上的活性。
药效学评价
通过药效学实验,如细胞增殖、凋亡、信号转导等实验,对候选药物的疗效和作用机制进行评估。
03
临床前研究与药学研究
药学研究
药学研究的目标是确定药物的剂型、给药途径 、制备工艺和质量控制标准等,为后续的临床
据。
药物经济学评价
2024年创新药物研发过程介绍PPT课件

03
加强与伦理委员会和监管机构的沟通,确保试验的顺利进行 。
29
市场环境挑战及拓展思路
市场竞争
深入了解市场需求和竞争态势,制定差异化的研发策略。
加强与产业链上下游企业的合作,形成竞争优势。
2024/2/29
30
市场环境挑战及拓展思路
融资渠道拓展
寻求多元化的融资渠道,包括政府资金、风险投资、产业基金等。
观察指标
主要关注药物的疗效、剂量反应关系、安全性等。
2024/2/29
17
III期临床试验
01
研究目的
确证新药在目标患者群体中的疗 效和安全性,为药品注册提供充 分依据。
试验设计
02
03
观察指标
采用大规模、多中心、随机、双 盲、安慰剂或阳性药物对照的方 法。
主要关注药物的疗效、安全性、 生活质量等,同时收集药物经济 学数据。
长期毒性试验
观察药物在长时间连续给予后对实验动物的毒性反应,评估药物 的潜在危害。
特殊毒性试验
包括生殖毒性、遗传毒性、致癌性等特殊毒性试验,全面评估药 物的安全性。
13
药代动力学研究
研究药物在体内的分布情况,包 括药物在各组织器官中的浓度。
研究药物及其代谢产物在体内的 排泄途径和排泄速率,了解药物 的消除过程。
创新药物研发过程介绍PPT课件
2024/2/29
1
目录
2024/2/29
• 创新药物研发概述 • 药物发现与筛选 • 临床前研究 • 临床试验 • 生产与质量控制 • 创新药物研发挑战与对策
2
01
创新药物研发概述
Chapter
2024/2/29
3
创新药物定义与分类
加强与伦理委员会和监管机构的沟通,确保试验的顺利进行 。
29
市场环境挑战及拓展思路
市场竞争
深入了解市场需求和竞争态势,制定差异化的研发策略。
加强与产业链上下游企业的合作,形成竞争优势。
2024/2/29
30
市场环境挑战及拓展思路
融资渠道拓展
寻求多元化的融资渠道,包括政府资金、风险投资、产业基金等。
观察指标
主要关注药物的疗效、剂量反应关系、安全性等。
2024/2/29
17
III期临床试验
01
研究目的
确证新药在目标患者群体中的疗 效和安全性,为药品注册提供充 分依据。
试验设计
02
03
观察指标
采用大规模、多中心、随机、双 盲、安慰剂或阳性药物对照的方 法。
主要关注药物的疗效、安全性、 生活质量等,同时收集药物经济 学数据。
长期毒性试验
观察药物在长时间连续给予后对实验动物的毒性反应,评估药物 的潜在危害。
特殊毒性试验
包括生殖毒性、遗传毒性、致癌性等特殊毒性试验,全面评估药 物的安全性。
13
药代动力学研究
研究药物在体内的分布情况,包 括药物在各组织器官中的浓度。
研究药物及其代谢产物在体内的 排泄途径和排泄速率,了解药物 的消除过程。
创新药物研发过程介绍PPT课件
2024/2/29
1
目录
2024/2/29
• 创新药物研发概述 • 药物发现与筛选 • 临床前研究 • 临床试验 • 生产与质量控制 • 创新药物研发挑战与对策
2
01
创新药物研发概述
Chapter
2024/2/29
3
创新药物定义与分类
新药研发的过程PPT演示课件
Ⅳ期临床试验目的是考察在广泛使用的条件下药物的疗效和
不良反应,评价新药在普通或特征人群中使用的利益与风险
关系,改进给药剂量。2004年默克公司的万络和辉瑞公司的
塞来考昔,抗关节炎药物被公司自动收回。
•6
•7
•8
•9
•10
•ቤተ መጻሕፍቲ ባይዱ1
•12
•13
•14
3)基于结构药物设计:活性构象、药效构象、药效基团、
分子模拟、QSAR方法、虚拟筛选方法等等。
二、先导化合物的优化
基团替换;结构简化;模仿药物;前药、软药、孪药原理;
拼合原理、生物电子等排、骨架迁越、五倍率等。
三、临床前药理、药代等
四、临床
•3
1)先导化合物的发现
通过各种途径、方法或手段获
得的具有一定生物活性的新的
结构类型化学物。
2)先导化合物结构优化
对先导化合物做进一步的结构
进行修饰和改造 ,提高活性和
特异性,改善药代动力学特性,
衍生出选择性高、安全性好、
活性大 性大的新的药物。
•4
3)新药临床前研究
需要做普通的、全面的、必需的试验
研究内容包括:
1)药物的理化性质
2)药理学、
3)药效动力学
4)药代动力学
•1
新药研发的过程
1)先导化合物的发现
2)先导化合物的优化
3)新药临床前研究
4)新药临床研究与应用
•2
一、先导化合物的发现
1、传统方法:随机筛选/偶然发现;天然来源/合成物的随
机筛选与意外发现;药理筛选与意外发现等等。
2、现代方法——合理药物设计法
1)组合化学与高通量筛选。
不良反应,评价新药在普通或特征人群中使用的利益与风险
关系,改进给药剂量。2004年默克公司的万络和辉瑞公司的
塞来考昔,抗关节炎药物被公司自动收回。
•6
•7
•8
•9
•10
•ቤተ መጻሕፍቲ ባይዱ1
•12
•13
•14
3)基于结构药物设计:活性构象、药效构象、药效基团、
分子模拟、QSAR方法、虚拟筛选方法等等。
二、先导化合物的优化
基团替换;结构简化;模仿药物;前药、软药、孪药原理;
拼合原理、生物电子等排、骨架迁越、五倍率等。
三、临床前药理、药代等
四、临床
•3
1)先导化合物的发现
通过各种途径、方法或手段获
得的具有一定生物活性的新的
结构类型化学物。
2)先导化合物结构优化
对先导化合物做进一步的结构
进行修饰和改造 ,提高活性和
特异性,改善药代动力学特性,
衍生出选择性高、安全性好、
活性大 性大的新的药物。
•4
3)新药临床前研究
需要做普通的、全面的、必需的试验
研究内容包括:
1)药物的理化性质
2)药理学、
3)药效动力学
4)药代动力学
•1
新药研发的过程
1)先导化合物的发现
2)先导化合物的优化
3)新药临床前研究
4)新药临床研究与应用
•2
一、先导化合物的发现
1、传统方法:随机筛选/偶然发现;天然来源/合成物的随
机筛选与意外发现;药理筛选与意外发现等等。
2、现代方法——合理药物设计法
1)组合化学与高通量筛选。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验动物,耗资巨大。
周期长:现一般认为得到一个新药需合成上万
个化合物,耗资数亿美元,时间10-12年。
风险高 利润高 竞争激烈
全球生物和医药业年产值2000亿美元,其中R&D费用在 130亿美元。
新药开发成功率约为1/10000。从研发到市场准入平均花 时4800个工作日,耗资3亿美元。
破性的药物相当。这种旨在避开“专利”药物的产权保护的新药研究,大 都以现有的药物为先导物进行研究。例如兰索拉唑及其它的拉唑的研究是 以奥美拉唑为先导物的,其活性比奥美拉唑活性更强。
青霉菌
青霉素
从天然产物中发现-动物
从蛇毒得到的a-Bungrotoxin可与乙酰胆碱结合, 从Puffer鱼得到的Tetrodotoxin可阻断钠通道, 从蜂毒中得到的Apamis可阻断钙离子通道,而激活钾
离子通道。
水蛭
从天然产物中发现-海洋生物
还是一个待开拓的新的药物的研究资源
2.2 以现有的药物为新药研究基础
新药研发相关知识介绍
主要内容
1. 新药研究开发的基本概念 2. 新药发现 3. 新药开发
1. 新药研究开发相关概念
药品:
指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机 能,并规定有适应症、用法和用量的物质。
药物的基本属性:
安全性、有效性、稳定性、可控性
新药:
指(我国)未生产过的药品。已生产的药品改变剂型、改变给药 途径、增加新适应症或制成新的复方制剂,亦按新药管理。
新药注册分类: 中药天然矿物→生药→汤剂、酒剂、 散剂、膏剂
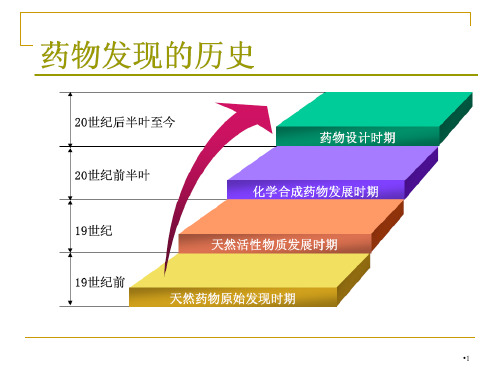
→酊剂、醑剂、 浸膏
18世纪中期,开始用动物实验对药物进行毒性测试。 19世纪后期,化学工业发展,为新药研究奠定基础。 20世纪40-60年代是新药研究的黄金时代。
40年代:青霉素、链霉素、磺胺 50年代:利血平,奋乃静 60年代:维拉帕米、山莨菪碱、胺碘酮 60年代后期:β-受体阻滞剂 70年代以末:新药开发速度减慢
中医药有系统而又完整的理论,有浩瀚的文献,遣方用药有规 律可循。
传统中药有悠久的临床使用基础,5000年历史,疗效直接从 人体上取得
传统中药研究资源十分丰富 我国天然药物共有12807种之多。其中植物药为11146种 ,动 物药1581种,矿物药80种,有完整记载的处方10万余首,剂 型43种,中成药5000余种
优点:
成功率大。 改善药物的吸收,减少药物的毒副作用,减少耐受性,使药
物长效,速效,高效为研究目标。 天然药物的结构简化的代用品,还可以降低药物的成本。
近年来随着生理生化机制的了解,得到了一些疾病治疗的突破性的药物,
称原型药物(Prototype Drug)。随之出现了大量的“Me-too”药 物。“Me-too”药物特指具有自己知识产权的药物,其药效和同类的突
我国唯一一个在世界上获得认可的药物——青蒿素
黄花蒿
O O
O
O
O
青蒿素
疟疾
中药传统剂型: 汤、丸、散、膏、酒
缺点:
成分不清; 药效不明; 质量不可控; 剂型难以现代化。
日本和韩国的中药和天然植物药 销售量占全世界的前两位,原料 75%从我国购买,在国际市场上 覆盖率为80%。
中药作为天然药物的独特优势
中药讲究炮制,讲究药物四性五味和归经。 中药多用复方,讲究君臣佐使。
中药现代化
定义:在中医药理论的指导下,以现代科学技术为手段,研究中药疗效的
物质基础,发现中药的有效成分,阐明中药的作用机制,并在中药有效成 分研究的基础上,制定出国际上认可的中药质量标准;同时,要加强中药 新剂型的研究,健全现代化的中药研发和生产管理体制,使之符合国际上 认可的GAP、GLP、GMP、GCP、GSP等管理规范。
从天然产物中发现-植物
白藜芦醇
C6H5
Ph2
O
Ph3
C6H5 O
18
AcO
10 11
9 O19
OH
2'
12
N 3' 1' O 13 15
H OH
14 1
HO
2
17
16
H
8 3
7
H
4
6 5
20
O
Ph1 C6H5
O AcO
O
Paclitaxel (Taxol)
从天然产物中发现-微生物
青霉素、链霉素、氯霉素、土霉素、红霉素等重要的 抗感染药物。
临床实验
I 期 II 期
批政
III 期
府 审
新 药 证 书
平均约15年
IV 期
化学研究
药理筛选 急性毒性研究
深入药理研究 临床研究及 慢性毒性研究
新药研发涉及的学科
药物化学 天然药物化学 生化药学 药理学 毒理学 药剂学 制药工艺学 药物分析化学
新药研发特点
投资高:需要合成大量的化合物,耗用大量的
中药现代化的核心是创新和发展,其内容包括原药材的现代化、中药剂 型现代化、中药质量标准现代化、中药生物技术现代化、中医药理论现 代化和中医药信息现代化。
植物细胞大规模培养技术:中药材标准化生产!
道路是曲折的,前途是光明的! 路漫漫其修远兮,吾将上下而求索!
新药研发流程
新药发现
新药开发
发现
临床前 研究
世界新药研发(上市)速度
60年代 70年代 80年代 90年代
844个 665个 518个 约400个
世界新药类别分布
抗感染药 20.78% 心血管药 18.83% 抗肿瘤药 13.96% 神经精神药 10.39%
世界十大制药公司排行榜
1. Pfizer(辉瑞)美国 2. Johnson&Johnson(强生)美国 3. sanofi-aventis(赛诺菲-安万特)德国,法国 4. Novartis(诺华)瑞士 5. GlaxoSmithKline(葛兰素史克)英国 6. Roche(罗氏)瑞士 7. MSD(默沙东/默克)美国 8. Astrazeneca(阿斯利康)瑞典,英国 9. Wyeth(惠氏)美国 10. Abbott(雅培)美国
2. 新药发现
➢ 从天然产物中发现—药物的提取分离—天然药物化学 ➢ 从现有药物改进—药物合成—药物化学 ➢ 药物筛选—药理学 ➢ 根据生理病理机制设计—药理学 有些新药的发现是几个途径综合的结果
2.1 天然产物
天然产物来源
植物 动物 微生物 海洋生物 矿物
天然生物活性物质的特点
新颖的结构类型(分子多样性) 独特的药理活性 资源有限及地域性差异 有效成分含量很低 大多数结构复杂,作用强度不同
周期长:现一般认为得到一个新药需合成上万
个化合物,耗资数亿美元,时间10-12年。
风险高 利润高 竞争激烈
全球生物和医药业年产值2000亿美元,其中R&D费用在 130亿美元。
新药开发成功率约为1/10000。从研发到市场准入平均花 时4800个工作日,耗资3亿美元。
破性的药物相当。这种旨在避开“专利”药物的产权保护的新药研究,大 都以现有的药物为先导物进行研究。例如兰索拉唑及其它的拉唑的研究是 以奥美拉唑为先导物的,其活性比奥美拉唑活性更强。
青霉菌
青霉素
从天然产物中发现-动物
从蛇毒得到的a-Bungrotoxin可与乙酰胆碱结合, 从Puffer鱼得到的Tetrodotoxin可阻断钠通道, 从蜂毒中得到的Apamis可阻断钙离子通道,而激活钾
离子通道。
水蛭
从天然产物中发现-海洋生物
还是一个待开拓的新的药物的研究资源
2.2 以现有的药物为新药研究基础
新药研发相关知识介绍
主要内容
1. 新药研究开发的基本概念 2. 新药发现 3. 新药开发
1. 新药研究开发相关概念
药品:
指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机 能,并规定有适应症、用法和用量的物质。
药物的基本属性:
安全性、有效性、稳定性、可控性
新药:
指(我国)未生产过的药品。已生产的药品改变剂型、改变给药 途径、增加新适应症或制成新的复方制剂,亦按新药管理。
新药注册分类: 中药天然矿物→生药→汤剂、酒剂、 散剂、膏剂
→酊剂、醑剂、 浸膏
18世纪中期,开始用动物实验对药物进行毒性测试。 19世纪后期,化学工业发展,为新药研究奠定基础。 20世纪40-60年代是新药研究的黄金时代。
40年代:青霉素、链霉素、磺胺 50年代:利血平,奋乃静 60年代:维拉帕米、山莨菪碱、胺碘酮 60年代后期:β-受体阻滞剂 70年代以末:新药开发速度减慢
中医药有系统而又完整的理论,有浩瀚的文献,遣方用药有规 律可循。
传统中药有悠久的临床使用基础,5000年历史,疗效直接从 人体上取得
传统中药研究资源十分丰富 我国天然药物共有12807种之多。其中植物药为11146种 ,动 物药1581种,矿物药80种,有完整记载的处方10万余首,剂 型43种,中成药5000余种
优点:
成功率大。 改善药物的吸收,减少药物的毒副作用,减少耐受性,使药
物长效,速效,高效为研究目标。 天然药物的结构简化的代用品,还可以降低药物的成本。
近年来随着生理生化机制的了解,得到了一些疾病治疗的突破性的药物,
称原型药物(Prototype Drug)。随之出现了大量的“Me-too”药 物。“Me-too”药物特指具有自己知识产权的药物,其药效和同类的突
我国唯一一个在世界上获得认可的药物——青蒿素
黄花蒿
O O
O
O
O
青蒿素
疟疾
中药传统剂型: 汤、丸、散、膏、酒
缺点:
成分不清; 药效不明; 质量不可控; 剂型难以现代化。
日本和韩国的中药和天然植物药 销售量占全世界的前两位,原料 75%从我国购买,在国际市场上 覆盖率为80%。
中药作为天然药物的独特优势
中药讲究炮制,讲究药物四性五味和归经。 中药多用复方,讲究君臣佐使。
中药现代化
定义:在中医药理论的指导下,以现代科学技术为手段,研究中药疗效的
物质基础,发现中药的有效成分,阐明中药的作用机制,并在中药有效成 分研究的基础上,制定出国际上认可的中药质量标准;同时,要加强中药 新剂型的研究,健全现代化的中药研发和生产管理体制,使之符合国际上 认可的GAP、GLP、GMP、GCP、GSP等管理规范。
从天然产物中发现-植物
白藜芦醇
C6H5
Ph2
O
Ph3
C6H5 O
18
AcO
10 11
9 O19
OH
2'
12
N 3' 1' O 13 15
H OH
14 1
HO
2
17
16
H
8 3
7
H
4
6 5
20
O
Ph1 C6H5
O AcO
O
Paclitaxel (Taxol)
从天然产物中发现-微生物
青霉素、链霉素、氯霉素、土霉素、红霉素等重要的 抗感染药物。
临床实验
I 期 II 期
批政
III 期
府 审
新 药 证 书
平均约15年
IV 期
化学研究
药理筛选 急性毒性研究
深入药理研究 临床研究及 慢性毒性研究
新药研发涉及的学科
药物化学 天然药物化学 生化药学 药理学 毒理学 药剂学 制药工艺学 药物分析化学
新药研发特点
投资高:需要合成大量的化合物,耗用大量的
中药现代化的核心是创新和发展,其内容包括原药材的现代化、中药剂 型现代化、中药质量标准现代化、中药生物技术现代化、中医药理论现 代化和中医药信息现代化。
植物细胞大规模培养技术:中药材标准化生产!
道路是曲折的,前途是光明的! 路漫漫其修远兮,吾将上下而求索!
新药研发流程
新药发现
新药开发
发现
临床前 研究
世界新药研发(上市)速度
60年代 70年代 80年代 90年代
844个 665个 518个 约400个
世界新药类别分布
抗感染药 20.78% 心血管药 18.83% 抗肿瘤药 13.96% 神经精神药 10.39%
世界十大制药公司排行榜
1. Pfizer(辉瑞)美国 2. Johnson&Johnson(强生)美国 3. sanofi-aventis(赛诺菲-安万特)德国,法国 4. Novartis(诺华)瑞士 5. GlaxoSmithKline(葛兰素史克)英国 6. Roche(罗氏)瑞士 7. MSD(默沙东/默克)美国 8. Astrazeneca(阿斯利康)瑞典,英国 9. Wyeth(惠氏)美国 10. Abbott(雅培)美国
2. 新药发现
➢ 从天然产物中发现—药物的提取分离—天然药物化学 ➢ 从现有药物改进—药物合成—药物化学 ➢ 药物筛选—药理学 ➢ 根据生理病理机制设计—药理学 有些新药的发现是几个途径综合的结果
2.1 天然产物
天然产物来源
植物 动物 微生物 海洋生物 矿物
天然生物活性物质的特点
新颖的结构类型(分子多样性) 独特的药理活性 资源有限及地域性差异 有效成分含量很低 大多数结构复杂,作用强度不同
