高聚物的溶液性质-2高聚物的溶解和溶剂的选择
第三章 高分子的溶液性质

3、高分子溶液的混合自由能 ΔFM= ΔHM-TΔSM=RT(n1ln φ1+n2ln φ2+ χ1n1φ2) 溶液中溶剂的化学位变化和溶质的化学位变化Δμ1、 Δμ2
分别为:
Δμ1 =RT[lnφ1+(1-1/x)φ2+χ1φ22] Δμ2 = RT[lnφ2+(x-1)φ1+xχ1φ12] lnp1/p10= Δμ1/RT= ln(1-φ2)+(1-1/x)φ2+χ1φ22 注意:由高分子溶液蒸汽压p1和纯溶剂蒸汽压p10的测量
4、混合溶剂, δ混= Φ1 δ1 + Φ2 δ2,有时混合溶剂的溶
解能力强于纯溶剂。
第二节 高分子溶液的热力学性质
理想液体的概念:溶液中溶质分子间、溶剂分子 间和溶剂溶质分子间的相互作用能均相等,溶 解过程没有体积的变化,也没有焓的变化。 理想溶液实际上是不存在的,高分子溶液与 理想溶液的偏差在于两个方面:一是溶剂分子 之间、高分子重复单元之间以及溶剂与重复单 元之间的相互作用能都不相等,因此混合热不 为零;二是高分子具有一定的柔顺性,每个分 子本身可以采取许多构象,因此高分子溶液中 分子的排列方式比同样分子数目的小分子溶液 的排列方式多,即其混合熵高于理想溶液的混 合熵。
2、对于真实的高分子在溶液中的排斥体积分为两部分:外排 斥体积和内排斥体积。外排斥体积是由于溶剂与高分子链段的 作用能大于高分子链段之间的作用能,高分子被溶剂化而扩张, 使两个高分子不能相互靠近而引起的;内排斥体积是由于高分 子有一定的粗细,链的一部分不能同时停留在已为链的另一部 分所占据的空间所引起的。当溶液无限稀释时,外排斥体积可 以接近零,而内排斥体积永远不为零。如果链段比较刚性或链 段之间排斥作用比较大,则内排斥体积为正;相反,链相互接 触的两部分体积可以小于它们各自的体积之和,则内排斥体积 为负。这种内排斥体积为负的链称为坍陷线团。
粘度法测定高聚物的相对分子质量

粘度法测定高聚物的相对分子质量粘度法是一种常用的方法来测定高聚物(聚合物)的相对分子质量。
它基于高聚物分子在溶液中的流动性质与分子质量之间的关系。
在进行粘度法测定之前,需要确定合适的实验条件和测定原理。
一、实验条件1.选择合适的溶剂:溶剂应具有与高聚物相容性好、可对高聚物进行良好的溶解以及测量粘度的条件。
(例如,对于聚乙烯醇,水是常用的溶剂)2.控制温度:温度会对粘度值产生较大影响,因此需要在恒温条件下进行实验。
3.粘度计的选择:常用的粘度计有奈米粘度计、卡诺粘度计、光纤旋光粘度计等。
需根据具体情况选择合适的粘度计。
二、测定原理高聚物在溶液中的流动性质与其相对分子质量有关,分子量较大的高聚物流动性较差,因此溶液的粘度值会随着高聚物分子量的增大而增大。
粘度法通过测量高聚物溶液的粘度值,从而间接推算出高聚物的相对分子质量。
三、实验步骤1.准备高聚物溶液:根据所选溶剂的配比,将一定质量的高聚物溶解于溶剂中,并彻底搅拌,直到高聚物完全溶解。
2.校正粘度计:用纯溶剂测量粘度计的零点,然后用标准物质(例如苯酚、萘酚等)来校正粘度计,以确保测量结果的准确性。
3.测量粘度:将装有高聚物溶液的容器放置在保持恒温的温水槽中,保持一定的温度,并等待溶液充分平衡。
然后将准备好的粘度计浸入溶液中,并等待一段时间让溶液与粘度计达到热平衡。
之后,开始测量粘度。
通常,需要测量多个时间点的粘度值,以获取精确的结果。
4.重复测量:进行多次测量以确认结果的准确性,并计算平均值。
5.构建标准曲线:根据已知分子量的标准品制备溶液,并测量其粘度值。
将不同分子量的标准品的粘度值与相对分子质量进行绘图,得到标准曲线。
6.根据标准曲线计算未知样品的相对分子质量:通过测量未知样品的粘度值,并根据标准曲线拟合计算得到样品的相对分子质量。
四、注意事项1.在测量前要完全溶解样品,以避免溶液中存在固体颗粒影响测量结果。
2.测量过程中要保持恒温环境,温度的变化会对粘度值产生较大的影响。
第三章 (1) 高分子材料的物理化学性质

19
(ii)pH敏感水凝胶 :pH敏感性水凝胶是体积随环境pH值、 离子强度变化的高分子凝胶。这类凝胶大分子网络中具有可解 离成离子的基团,其网络结构和电荷密度随介质pH值的变化而 变化,并对凝胶的渗透压产生影响;同时因为网络中添加了离 子,离子强度的变化也引起体积变化。 一般来说,具有pH值响应性的水凝胶都是含有酸性或碱性侧 基的大分子网络,即聚电解质水凝胶。随着介质pH值、离子强 度的改变,酸、碱基团发生电离,导致网络内大分子链段间氢 键的解离,引起不连续的溶胀体积变化。
18
热可逆性水凝胶 有些聚合物水溶液在室温下呈自由流动的液态 而在体温下呈凝胶态,即形成热可逆性水凝胶(TGR)。这一体系 能够较容易地对特定的组织部位注射给药,在体内环境下很快形 成凝胶。而且这种给药系统的制备较简单,只需将药物与聚合物 水溶液进行简单地混合。 如:聚环氧乙烷(PEO)与聚环氧丙烷(PPO)嵌段共聚物是已被批 准用于药用辅料的高分子,商品名叫普流罗尼(Pluronic)或泊洛沙 姆(Poloxamer),依据其结构和浓度,这类聚合物存在两个临界相 转变温度,即溶液-凝胶转变温度(相当于LCST)和凝胶-溶液转变 温度,在这两个温度之间其水溶液呈现凝胶状态。利用这类共聚 物水溶液低温溶液状态混合药物,尤其是生物类药物,注人体内 形成凝胶,从而实现控制药物释放同时保护药物活性的功能。
高分子物理课件 高分子的溶液理论

分子间作用力大,所以溶解要比非晶聚合 物困难得多。 ② 溶解有两个过程:首先吸热,分子链开始 运动,晶格被破坏。然后被破坏晶格的聚 合物与溶剂发生作用,同非晶聚合物一样, 先发生溶胀,再溶解。
2. 非极性结晶聚合物的溶解(要加热) (1)这类聚合物一般是由加聚反应生成的,如
Clausius 公式克拉佩龙Clapeyron方程 (热力
学第二定律在两相平衡中的应用)计算:
• ①先求得
dP dT
T(VHgHV(VVl摩) 尔蒸发VVH热glV — — —)— — —摩 溶 溶尔 剂 剂蒸 气 气发 化 化热后前得得体体积积
• ②再根据热力学第一定律换算成
E HV P(Vg Vl )
Fi Fi
2
i
V
i M0
V——重复单元的摩尔体积 M0——重复单元的分子量 Ρ——密度
由聚合物的各种基团的摩尔相互作用常数E来 计算。 ( E查表得到)
2
E ' V~2
E '
M0
• 在选择溶剂时还可采用混合溶剂,效果很好 • 混合溶剂的溶度参数 M A A B B
A ——A溶剂的体积分数
高分子物理
第三章 高分子溶液
➢第一节 概述 ➢第二节 高聚物的溶解
1-1 溶解过程 1-2 溶剂的选择
➢第三节 高分子溶液的热力学
2-1 理想溶液热力学 2-2 高分子溶液与理想溶液的偏差 2-3 高分子溶液理论
第一节 概述
一.重要性 高分子溶液是生产实践和科学研究均要碰到的问题 生产实践中: ①浓溶液——油漆,涂料,胶粘剂,纺丝液,制备 复合材料用到的树脂溶液(电影胶片片基),高聚 物/增塑剂浓溶液等。 ②稀溶液——分子量测定及分子量分级(分布)用 到的稀溶液。
第三章 高分子的溶液性质

• 在选择溶剂时还可采用混合溶剂,效果很好 • 混合溶剂的溶度参数 M A A B B
A ——A溶剂的体积分数
B ——B溶剂的体积分数
B ——B的溶度参数
A ——A的溶度参数
二、极性相似原则:相似者易相溶(定性)
极性大的溶质溶于极性大的溶剂
对于小分子
极性小的溶质溶于极性小的溶剂 溶质和溶剂极性越近,二者越易互溶
一、理想溶液的热力学
高分子稀溶液是热力学稳定体系,溶液的 性质不随时间而变化,因此,我们可以用 热力学方法研究高分子稀溶液,用热力学 函数来描述高分子稀溶液的许多性质。 物化中讨论气体性质时,为叙述方便,引 入了理想气体的概念,同样,在讨论溶液 性质时,为叙述方便,我们也要引入理想 溶液的概念,但理想溶液和理想气体一样 实际上是不存在的。
M0 104
Hildebrand公式只适用于非极性的溶质和溶剂 的互相混合 对于极性高聚物、能形成分子间氢键的高聚物, Hildebrand不适用!另外有修正公式
Байду номын сангаас
H m Vm 1 2 [(1 2 ) (1 1 ) ]
2 2
例:PAN不能溶解于与它δ值相近的乙醇、甲醇 等。因为PAN极性很强,而乙醇、甲醇等溶剂 极性太弱了。 又例:PS不能溶解在与它δ值相近的丙酮中, 因为PS弱极性,而丙酮强极性。 • 所以溶度参数相近原则不总是有效的
M
VM——溶液总体积 1 ——溶剂的体积分数 2 ——溶质的体积分数 1 ——溶剂的溶度参数 2 ——溶质的溶度参数
3、溶度参数
分子间作用力用内聚能密度衡量 E 内聚能密度 V:为分子的体积 V E:为一个分子的气化能,是该分子从纯态解离 必须破坏的其相邻分子相互作用的能量 E/V:单位体积纯态中分子间相互作用能,故被 称为内聚能密度 定义溶度参数为内聚能密度的平方根
第三章-高分子的溶液性质课件

1
2
1
2
1 1 1+2 2 2=1 2 1+2 1 2
1
2
1
2
始态
终态
混合过程:0.5 [1—1] + 0.5 [2—2] = [1—2]
式中符号1表示溶剂分子,符号2表示高分子的一 个链段,符号[1—1] 、[2—2] 、[1—2]分别表示相邻 的一对溶剂分子,相邻的一对链段和相邻的一个溶剂 与链段对。
第一节 高聚物的溶解
一、高聚物溶液过程的特点
溶解:溶质分子通过分子扩散与溶剂分子均匀混合成 为分子分散的均相体系。
由于高聚物结构的复杂性,它的溶解要比小分子的溶 解缓慢而复杂得多,高聚物的溶解一般需要几小时、 几天、甚至几个星期。
高聚物的溶解过程分为两个阶段:
⑴溶胀:溶剂分子渗入高聚物内部,使高聚物体积 膨胀。
生成一对[1—2]时能量的变化: 式中ε11、ε22、ε12分别表示他们的结合能 如果溶液中形成了P12 对 [1—2] 分子,混合时没有体 积的变化,则高分子溶液混合热△HM
(3-19)
式中c1称为Huggins 参数,反映高分子与溶剂混合时 相互作用能的变化。 c1kT表示当一个溶剂分子放到 高聚物中去时引起的能量变化。
(3-10)
(3-11)
(3-12)
式中,p1和p10分别表示溶液中溶剂的蒸气压和纯溶剂 在相同温度下的蒸气压;N是分子数目,X是摩尔分 数,下标1和2分别指溶剂和溶质,k是波尔兹曼常数
高分子溶液与理想溶液的热力学性质的偏差:
⑴ 溶剂分子之间、高分子重复单元之间以及溶剂与高 分子重复单元之间的相互作用都不可能相等,所以混 合热△HiM≠0 ;
DFM = DHM – T DSM
高分子溶液性质及其应用

第八章高分子溶液性质及其应用第一部分内容简介§高分子的溶解一.溶解的过程:非交联高聚物:溶胀溶解;结晶高聚物:晶区破坏→再溶解交联高聚物:只溶胀特点:(1) 溶胀→溶解,对结晶高聚物则是先(2) 溶解时间长二.溶剂的选择原则1. 极性相近原则: 非极性体系PS :苯甲苯丁酮2. 溶度参数相近原则: δ=(ΔE/V)1/2△Fm=△Hm-T△Sm<0T>0,△Sm>0,则△Hm<T「△Sm「△Hm=Vφ1φ2〔(△E/V1)1/2-(△E/V2)1/2〕2V 总体积φ1 φ2 体积分数令(△E/V)1/2=δ则△Hm=Vφ1φ2(δ1-δ2)2若「δ1-δ2「→0 则△Hm越小△Hm-T△Sm<0对于混合溶剂δ=φAδA+φ2δB3.溶剂化原则—广义的酸碱原则如PAN-26(δ=)不溶于乙醇(δ=26)而能溶于甲基甲酰胺—C(O)—NH2—因为C—C(CN)—和CH3—CH2(OH)—都是亲电基团亲核(碱)基团有:CH 2NH 2>C 6H 6NH 2>—CO —N(CH 3)2>—CO —NH>PO 4 >—CH 2—CO —CH 2>CH 2—O —CO —CH 2>—CH 2—O —CH 2—亲电(酸) 基团有:—SO 2OH>—COOH>—C 6H 4OH>—CH(CN)—>—C(NO 2)—>—C(Cl)—Cl> —C(Cl)—§ 高分子稀溶液热力学理想溶液性质△S mi =-R(N 1lnx 1+N 2lnx 2) △H mi =o△F mi =RT(n 1lnx 1+n 2lnx 2)高分子稀溶液(Flory-Huggin 理论)假设(1) 每个溶剂分子和链段占有格子的几率相同 (2)高分子链是柔性的,所有构象能相同思路: △μ→△F →△S m = △H m =一、△S m 的求法设溶剂分子数为N 1链,大分子数为N 2 每个链段数为x 则格子总数为N=N 1+xN 2若已放入i 个链,则i +1个链的放法数为w i +1第1个链段放法为 N-iN 2 第2个链段放法为 NiN N z12--第3个链段放法为Nxj N z 2)1(---第x 个链段放法为Nx xj N z 1)1(+---则i+1个链段放法为1x 2)1(1-+-=+Nz z Wi x N I 个大分子总的放法为 n=∏-=+1122!1N i i w N =!!)1(!12)1(22xN N N N z N x N --- S 溶液=kln n=-k[N 1lnez x N xN N N N xN N N 1ln )1(ln 12212221---+++N 1=0时 S 溶质=-k(N 2lnx+(x+1)N 2lnez 1-) △S m =S 溶液-(S 溶质+S 溶剂)=-k (N 1ln2122211ln xN N xN N xN N N +++)△S m =-R(n 1ln φ1+ n 2ln φ2)二、△H m 的求法△Hm=P 12△ε12 △ε12=ε12-(21ε11+ε12) P 12=[(z-2)x+2]N 2211xN N N +=(z-2)N 1φ2X 1=Tz )2(-△ε12 △H m =RTx 1n 1φ2(1)ΔSm=-R(n 1ln φ1+ n 2ln φ2)其中φ1=211xN N N + φ2=212xN N xN +(2)△Hm=RTX 1n 1φ2 其中X 1=RTz 12)2(ε∆-三、△F m =△H m -T ΔS m=RT[n 1ln φ1+ n 2ln φ2 +n 1X 1φ2 ]四、△μ1的求法△μ1=[P Tn n Fm 2])(1∂∆∂ = RT[ln φ1+ )11(x-ln φ2 +X 1φ2 2] ln φ1= ln(1-φ2)=- φ2-(1/2)φ22△μ1= RT[(-1/X)ln φ2 +X 1-21φ2 2] 而理想溶液 △μ1I =-RTX 2=-RTN 2=-xRTφ2 超额化学位 △μ1E =△μ1-△μ1I△μ1E =RT(X 1-21)φ22 溶解过程判据 五、Θ温度的定义X 1-21=Κ1-Ψ1 Κ1:热参数Ψ1:熵参数定义 Θ=11ψK T/Θ=11K ψΘ温度即为热参数等于熵参数的温度 § 相分离原理∵ 化学位 △μ1/(RT)→φ2 的关系: △μ1=-RT[x 1φ2-(X-21)φ22]产生相分离可能性 (1) φ2↑→φ2c (2) X 1↑→X 1c (3) T ↓→T 1cTP )(221φμ∂∆∂=0 φ2c =x10)(2212=∂∆∂TP φμ X 1c =x121+由X 1-21=Ψ1()1-Tθ当X 1= X 1c 时 T c =)111(1xψ+Θ 相分离时 φ2c =x1X 1c =x121+ T c =)111(1xψ+Θ § 膜渗透压法测分子量纯溶剂的化学位是溶剂在标准状态下的化学位, 为纯溶剂的蒸汽压溶液中溶剂的化学位p 1为纯溶剂的蒸汽压溶液中溶剂化学位与纯溶剂中化学位之差为对于恒温过程有如果总压力的变化值为根据Van’t Hoff方程,对于小分子而言而高分子不服从Raoult定律,则有将Flory-Huggins稀溶液理论中溶剂中化学位表达式代入把展开,在稀溶液中远小于1因为定义第二维利系数为第二维利系数可量度高分子链段与链段之间以及高分子与溶剂之间相互作用的大小。
高分子物理(北京化工大学)3-1ppt课件

压比同数量的小分子溶液小得多。只有当溶液处于 状态或浓
度趋于零时,高分子溶液才体现出理性溶液的性质。
本讲内容: 第一节 高聚物的溶解 •高聚物溶解过程的特点 •高聚物溶解过程的热力学解释 •溶剂的选择
第二节 高分子溶液的热力学性质 •小分子理想溶液的热力学
9
3.1 The solution of polymers 聚合物的溶解
The process of solution 溶解过程
(1) 非晶态聚合物的溶胀和溶解
VMi 0
溶液中溶质分子间,溶剂分子间, 溶质和溶剂分子间的相互作用是 相等的。
溶解过程中没有体积变化,也无 热量变化,溶液的蒸汽压服从 Raoult law.
H
i M
0
M – mixing i - ideal
22
X1
N1 N1 N2
N1 – the mole number of solvent N2 – the mole number of solution
HM 12[1 2 ]2VM
Hildebrand J., Scott R.L., Solubility of Nonelectrolytes, Reinhold Publishing Corporation, New York, Chapter 7 (1949)
1, 2 – 分别为溶剂和高分子的体积分数
The mixing entropy of the ideal solution
高聚物论文-聚合物的溶解以及溶度参数的意义

聚合物的溶解以及溶度参数的意义高分子溶液是人们在生产实践和科学研究中经常遇到的对象。
例如,纤维工业中的溶液纺丝、塑料工业中的增塑以及像油漆、涂料和胶粘剂的配制等,都属于高分子浓溶液的范畴,而对于高分子溶液热力学性质的研究(如高分子—溶剂体系的混合热、混合熵、混合自由能)、动力学性质的研究(如高分子溶液的沉降、扩散、粘度)以及高聚物的分子量和分子量分布、高分子在溶液中的形态和尺寸、高分子的相互作用(包括高分子链段间和链段与溶剂分子间的相互作用)等的研究,所用溶液的浓度一般在1%以下,属于高分子稀溶液的范畴。
所谓溶解,是指溶质分子通过扩散与溶剂分子均匀混合成分散的均相体系,一般情况下,高聚物的溶解过程比小分子物质的溶解过程要缓慢的多。
这是由于高聚物分子与溶剂分子的尺寸相差悬殊,两者的分子运动速度存在着数量级的差别,因此溶剂分子能很快渗入高聚物,而高分子向溶剂的扩散却非常缓慢,因此高聚物的溶解过程要经历两个阶段:溶胀和溶解。
由于高聚物结构的复杂性:(1)分子量大并具有多分散性;(2)高分子链的形状有线形的、支化的和交联的;(3)高分子的聚集态存在有非晶态或晶态结构,所以高聚物的溶解过程比起小分子物质的溶解要复杂许多。
在高聚物与溶剂接触初期,由于高分子链很长,高分子间相互缠结,作用力很大,不易移动,所以高分子不会向溶剂中扩散。
但是高分子链具有柔性,链段由于热运动而产生空穴,这些空穴很快就被从溶剂中扩散而来的溶剂小分子所占据,高聚物体积胀大(溶胀)。
此时,整个高分子链还不能摆脱相互之间的作用而向溶剂分子中扩散。
不过,随着溶胀的继续进行,溶剂分子不断向高聚物内层扩散,必然就有愈来愈多的链单元与溶剂分子混合,使得高分子链间的距离逐渐增大,链间的相互作用力逐渐减少,致使愈来愈多的链单元可以松动。
当整个高分子链中的所有链单元都已摆脱相邻分子链间的作用,整链就松动了,就可以发生缓慢向溶剂中的扩散运动,高分子与溶剂分子相混合,最后完成溶解过程,形成均一的高分子溶液。
高分子溶液性质

多分散性:聚合物通常由一系列相对分子量不同
的大分子同系物组成的混合物,用以表达聚合物
的相对分子量大小并不相等的专业术语叫多分散
性。
整理课件
9
①高分子与溶剂分子尺寸相差大。两者的分 子运动速度存在差异,溶剂分子能比较快 的渗透进入高聚物,而高分子向溶剂扩散 速度却慢的多,结果是溶剂先进入高聚物 内部,使高分子体积膨胀,即溶胀,然后 是高分子均匀分散在溶剂中,形成完全溶 解的分子分散的均相体系。
高分子溶液性质
整理课件
1
第一节 概述
一、高分子溶液 1.高分子溶液:高聚物以分子状态分散在溶液中所
形成的混合物。 举例:PVC溶于THF /NR 溶于甲苯 2.浓溶液与稀溶液 高分子溶液性质随浓度不同有很大变化,据此将高
分子溶液分为浓溶液和稀溶液。 稀溶液:一般认为高分子溶液的浓度在5%以下者
内聚 E能 H VRT
CED
Hv RT v~
Hv :摩尔蒸发热
整理课件
47
④高聚物由于不能汽化(降解先于汽化),所 以高聚物的溶度参数不能采用上述方法求得。 通常用下面几种方法:
整理课件
48
a.Small估算法
2 v ~ E 1 2 E v ~ v ~ 1 2F v ~v ~ F i M 0 F i
整理课件
35
二、溶剂的选择
聚合物溶剂的选择,目前尚无很成熟 的理论,但在长期的生产实践和科学 研究中已总结出一些规律,这些规律 对聚合物溶剂的选择有一定的指导意 义。
1.极性相近原则
这是低分子化合物溶解时总结出来的一 个规律,在一定程度可指导高聚物选择 溶剂。即极性弱的高聚物溶于极性弱的 溶剂,极性强的高聚物溶于极性强的溶 剂。
聚合物的溶液性质
7.1 聚合物的溶液性质高分子溶液在高分子工业和科学研究中占有很重要的地位。
一般将浓度低于5%的称为稀溶液。
如用于测定分子量及其分布的溶液、高分子絮凝剂、高分子减阻剂等都是稀溶液;而纺丝用的溶液(>15%)、涂料与胶粘剂(>60%)等都是浓溶液。
对于稀溶液,人们的研究已经比较深入,已能定量或半定量地描述其性质;但对浓溶液,限于它的复杂性,人们的研究着重于应用方面,至今还没有很成熟的理论。
7.1.1分子间相互作用和溶度参数聚合物溶解在溶剂中形成溶液的过程,实质上是溶剂分子进入聚合物,拆散聚合物分子间作用力(称为溶剂化)并将其拉入溶剂中的过程。
聚合物分子间、溶剂分子间以及聚合物与溶剂分子间这三种分子间作用力的相对大小是影响溶解过程的关键的内在因素。
所以首先要讨论这些分子间作用力。
分子间作用力包括取向力、诱导力、色散力和氢键力,前三者又称为范德华力。
取向力是极性分子的永久偶极之间的引力,诱导力是极性分子的永久偶极与它在其他分子上引起的诱导偶极之间的相互作用力,色散力是分子瞬间偶极之间的相互作用力。
氢键力是极性很强的原子上的氢原子(带正电性),与另一电负性很大的原子上的孤对电子相互吸引而形成的一种键,例如:范德华力对一切分子都存在,没有方向性和饱和性,作用力约比化学键小1~2个数量级。
氢键力则具有方向性和饱和性,键能虽也比化学键小,但比范德华力大,因而氢键力的存在对于高分子的性质起很大的作用。
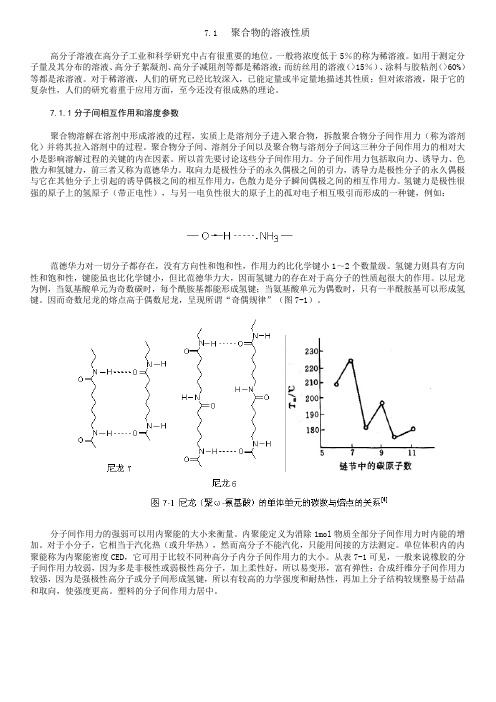
以尼龙为例,当氨基酸单元为奇数碳时,每个酰胺基都能形成氢键;当氨基酸单元为偶数时,只有一半酰胺基可以形成氢键。
因而奇数尼龙的熔点高于偶数尼龙,呈现所谓“奇偶规律”(图7-1)。
分子间作用力的强弱可以用内聚能的大小来衡量。
内聚能定义为消除1mol物质全部分子间作用力时内能的增加。
对于小分子,它相当于汽化热(或升华热),然而高分子不能汽化,只能用间接的方法测定。
单位体积内的内聚能称为内聚能密度CED,它可用于比较不同种高分子内分子间作用力的大小。
第三章高分子的溶液性质

第三章高分子的溶液性质高聚物以分子状态分散在溶剂中所形成的均相混合物称为高分子溶液,它是人们在生产实践和科学研究中经常碰到的对象。
高分子溶液的性质随浓度的不同有很大的变化。
就以溶液的粘性和稳定性而言,浓度在 1%以下的稀溶液,粘度很小而且很稳定,在没有化学变化的条件下其性质不随时间而变。
纺丝所用的溶液一般在15%以上,属于浓溶液范畴,其粘度较大,稳定性也较差,油漆或胶浆的浓度高达 60%,粘度更大。
当溶液浓度变大时高分子链相互接近甚至相互贯穿而使链与链之间产生物理交联点,使体系产生冻胶或凝胶,呈半固体状态而不能流动。
如果在高聚物中加入增塑剂,则是一种更浓的溶液,呈固体状,而且有—定的机械强度。
此外能相容的高聚物共混体系也可看作是一种高分子溶液。
高分子的溶液性质包括很多内容:热力学性质:溶解过程中体系的焓、熵、体积的变化,高分子溶液的渗透压,高分子在溶液中的分子形态与尺寸,高分子与溶剂的相互作用,高分子溶液的相分离等;流体力学性质:高分子溶液的粘度、高分子在溶液中的扩散和沉降等;光学和电学性质:高分子溶液的光散射,折光指数,透明性,偶极矩,介电常数等。
本章将着重讨论高分子溶液的热力学性质和流体力学性质。
第一节高聚物的溶解3.1.1 高聚物溶解过程的特点※高聚物的溶解过程要经过两个阶段,先是溶剂分子渗入高聚物内部,使高聚物体积膨胀,称为“溶胀”;然后才是高分子均匀分散在溶剂中,形成完全溶解的分子分散的均相体系。
对于交联的高聚,只能停留在溶胀阶段,不会溶解。
※溶解度与高聚物的分子量有关,分子量大的溶解度小,对交联高聚物来说,交联度大的溶胀度小,交联度小的溶胀度大。
※晶态高聚物的溶解比非晶态高聚物要困难得多:非晶态高聚物的分子堆砌比较松散,分子间的相互作用较弱,因此溶剂分子比较容易渗入高聚物内部使之溶胀和溶解。
晶态高聚物由于分子排列规整,堆砌紧密,分子间相互作用力很强,以致溶剂分子渗入高聚物内部非常困难。
第四章 高分子的溶液性质-2

(Z 1) N jx (x 1)
N
因此整个高分子链在N-xj个空格中的放置方法数为以上 各链段放置方法的乘积:
W j 1
Z(Z
1) x 2
(N
xj)(
N
xj N
1)(
N
xj N
2)
(
N
xj N
x
1)
W
j 1
Z 1 N
x1
(N (N
xj xj
1)! x)!
而总共N2条高分子链在N个空格中的放置方法为所有分 子链的放置方式的乘积
(1) HM 12[1 2 ]2 VM
1, 2 :分别为溶剂和高分子的体积分数 1, 2 :分别为溶剂和高分子的溶度参数
VM :混合后的体积
HM>0;越接近,HM越小,越有利于溶解的进行 对于聚合物而言:如果
1 2 1.7 ~ 2.0 (J/cm3)1/2,则聚合物不溶
Hildebrand公式适用于非极性或弱极性
1 N2 1
N2!
W j1
j 0
1
Z 1N2 (x1)
N!
N2! N
(N xN2 )!
(3) 溶液的熵值
S k ln
1
Z 1N2 (x1)
N!
N! Z 1N2 (x1)
N2! N
(N xN2 )! N1!N2! N
S k ln
k[N2
(x
1)
ln
Z 1 N
ln
N!
ln
(1) 研究高分子在溶液中的形态尺寸(柔顺性,支化 情况等)研究其相互作用(包括高分子链段间,链 段与溶剂分子间的相互作用)
(2) 热力学性质的研究(△Sm、△Hm、△Fm) (3) 动力学性质的研究(溶液的沉降,扩散,粘度等)
第三章_高分子的溶液性质

高分子物理 第三章高分子的溶液性质
16
11
多媒体动画应用示例:溶解与溶胀
高分子物理 第三章高分子的溶液性质
17
(二)高聚物溶解过程的热力学解释
溶解过程是溶质和溶剂分子的混合过程,在恒温恒压下, 过程能自发进行的必要条件是混合自由能ΔGm<0,即:
Fm H m TSm 0
(3-1)
⑥高分子溶解过程比小分子缓慢的多。
高分子物理 第三章高分子的溶液性质 9
4. 本章学习的主要内容
一、高分子的溶解和溶胀 二、高分子稀溶液的热力学理论 三、高分子溶液的相平衡和相分离 四、高分子浓溶液的性质
高分子物理 第三章高分子的溶液性质
10
3.1 聚合物的溶解过程和溶剂选择 溶解
溶质分子通过分子扩散与溶剂分子均匀混合成为分子分散 的均相体系。
②高分子溶解—-沉淀是热力学可逆平衡;胶体则为变 相非平衡,不能用热力学平衡,只能用动力学方法进行研究。
③高分子溶液的行为与理想溶液的行为相比有很大偏离。 原因:高分子溶液的混合熵比小分子理想溶液混合熵大 很多。
高分子物理 第三章高分子的溶液性质
8
④高分子溶液的粘度比小分子纯溶液要大得多, 浓度 1%~2%的高分子溶液粘度比纯溶剂大0.25~0.5% 粘度 为纯溶剂的15~20倍。 例5%的NR+苯为冰冻状态 原因:高分子链虽然被大量溶剂包围,但运动仍有相当 大的内摩擦力。 ⑤溶液性质有在分子量依赖性,而高分子的分子量多分 散性,增加了研究的复杂性。
26
3. 广义酸碱作用原则(溶剂化原则)
溶剂化作用: 是指溶质和溶剂分子之间的作用力大于溶质分 子之间的作用力,以致使溶质分子彼此分离而 溶解于溶剂中。 一般来说,溶解度参数相近原则适用于判断非极性或 弱极性非晶态聚合物的溶解性,若溶剂与高分子之间有强 偶极作用或有生成氢键的情况则不适用。例如聚丙烯腈的 δ=31.4,二甲基甲酰胺的δ=24.7,按溶解度参数相近 原则二者似乎不相溶,但实际上聚丙烯腈在室温下就可溶 于二甲基甲酰胺,这是因为二者分子间生成强氢键的缘故。 这种情况下,要考虑广义酸碱作用原则。
第二章:高分子溶液

3)交联高聚物的溶胀
交联高聚物只溶胀不溶解,可以吸收一定量的 溶剂而溶胀,形成凝胶。
交联高聚物的溶胀过程实际上是两种相反趋势 的平衡过程:
由于化学位的差异,溶剂 力图渗入高聚物内使体积 膨胀(从而引起三维分 子网的伸展)
交联点之间分子链的伸展 降低了它的构象熵值,引 起分子网的弹性收缩力, 力图使分子网收缩
如:PE,PP非晶部分与溶剂相互作用小,放出的热 量少,不足以使结晶部分发生相变,因而这类高聚 物需要升温才能溶解(通常要升温到熔点附近)。
例如:PP 在十氢萘中要升温到接近135℃(接近熔点)才 能很好的溶解。
对于非晶高聚物,溶解度与分子量有关。对于晶 态聚合物,溶解度不仅依赖于M,更重要的是与 结晶度有关。
高聚物溶解过程的有如下特点:
(1)高聚物的溶解要达到分子分散的均相体系,一 般需要较长时间;
即使是良溶剂也不 能一次完全克服高 分子间的内聚力
(2)溶解过程分两个阶段:先溶胀,后溶解
高聚物分子量巨大,分子的运动比小分子慢的多, 溶剂分子会很快扩散到高聚物内部,引起链段运动 ,高聚物体积膨胀,然后才是高分子均匀分散于溶 剂中,达到完全溶解。
高分子溶液的相分离 重点 难点
第一节:聚合物的溶解和溶剂选择(重点)
一、 聚合物溶解过程及其特点
由于高聚物结构的复杂性:
(1)分子量大而且具有多分散性 (2)分子的形状有线型、支化和交联 (3)高分子的凝聚态存在非晶态结构、 晶态结构、取向态、织态等
因此,高聚物的溶解现象比起小分子物质 的溶解要复杂得多。
亚浓 溶液
较浓 冻 胶 塑化高 高聚
溶液
聚物 物
15% 60% 增塑 本体
半固体 固 体
纺丝液
高分子物理-高分子的溶液性质

• 一、高分子溶液:高聚物以分子状态分散在溶剂中所形成
的均相混合物称为高分子溶液。
• 稀溶液:浓度在1%以下的,粘度很小而且很稳定,
在没有化学变化的条件下其性质不随时间而变。
• 亚浓溶液:高分子线团互相穿插交叠,整个溶液中
的链段分布趋于均一。
• 浓溶液:纺丝溶液,浓度一般在15%以上,其粘度
• ② δ1 和δ2 越接近, △H 越小,则越能满
足 △FM <0的条件,能自发溶解
4. 非极性聚合物溶度参数的确定
• ①查表 • ②实验测定——稀溶液粘度法 • ③计算(F:基团的摩尔引力常数)
Fi Fi
2
i
V
i M0
V——重复单元的摩尔体积 M0——重复单元的分子量 ρ——密度
4. 高分子溶液与理想溶液的偏差
• ①高分子间、溶剂分子间、高分子与溶剂分
子间的作用力不可能相等,因此溶解时,有 热量变化 。
• ②由于高分子由聚集态→溶剂中去,混乱度
变大,每个分子有许多构象,则高分子溶液 的混合熵比理想溶液要大得多。
二、 Flory-Huggins高分子溶液理论
Flory和Huggins从液体的似晶格模型出发,用 统计热力学的方法,推导出了高分子溶液的 混合熵,混合热和混合自由能的关系式。
• 推导中的假设:
• ①溶液中分子的排列也象晶体一样,是晶格
排列,每个溶剂分子占一个格子,每个高分 子占有相连的x个格子。所有高分子具有相 同的聚合度
• ②高分子链是柔性的,所有构象具有相同的
能量。
• ③溶液中高分子链段是均匀分布的(即链段
占有任意一个格子的几率相等)
3.2.1. 高分子的混合熵 SM
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
良溶剂:
溶剂分子对高分子链单元有很大的溶剂化作用
(相当于链单元间的相斥力),超过高分子链
单元间的内聚力,因而在这种溶剂中高分子线
团松散,呈扩张形态,末端距较大。
劣溶剂
溶剂分子与高分子链单元间的相互作用小,链
单元间的内聚力使线团紧缩,末端距较小。
良溶剂
劣溶剂
同一种高分子在不同性能溶剂中的 形态示意图
V1 1 2 1 RT
2
2
1 1 临界溶解条件: 1c 1 1 2 2 x
1 2 c
取: V1 100ml
2
RT 1 1 1 2 2V1 x
25 C
2
x
1 2 c 1.7(cal1/2∙cm-3/2)
3
R M
12
12
ip M
密集程度 PS:
a 1.05 g cm 1 :虚拟的单链密度
3
M
105 106
R nm
8.7 27.4
a 1
17 54
溶解前高聚物凝聚态结构的特点之二:
一根链上相隔较远的链单元间相互作用力 =相邻链的链单元间相互作用力(屏蔽) (链单元间无远程相互吸引或推拒的作用)
高聚物溶剂的选择原则:
1. 高聚物与溶剂的极性通常要相近
2. 溶度参数越是接近,溶解的可能性越大
3. 溶剂化相当于在高分子链间产生相斥力 4. 1 1 2 原则要慎用 5. 混合溶剂的溶解能力有时好于单一溶剂 6. 可以通过改变高分子结构以提高溶解性能
9.2.3 溶剂的良劣性 良溶剂
劣溶剂
高聚物
聚异丁烯 聚苯乙烯
溶剂
苯 环己烷
温度(℃)
27 27
1
0.50 0.44
甲苯 月桂酸乙酯
四氢呋喃 二氧六环 磷酸三丁酯 硝基苯
27 25
27 27 53 76 53 76 53 76 27 53 53 76 25 15-20 15-20 25 25
0.44 0.47
0.14 0.52 -0.65 -0.53 0.29 0.29 0.44 0.42 0.63 0.60 1.74 1.58 0.44 0.28 0.37 0.49 0.49
6.改变高分子结构
分子内氢键——刚性高分子 纤维素——难溶聚合物 改变其结构:硝化、酰化、磺化
改性后,溶解性能改善
高聚物溶剂的选择原则: 1. 极性相近原则 2. 内聚能密度相近原则 (即,溶度参数相近原则)
3. 溶剂化原则
4. 1 1 2 原则
5. 混合溶剂法
6. 改变高分子结构
两种可能性: (2)减小 H M 参见:内聚能密度相近原则
2. 内聚能密度相近原则
借用Hilderbrand公式:
H M
n1n2V1V2 n1V1 n2V2
E E 1 2 V1 V2
12 12
2
修正后用于高分子溶液:
V2 xV1
n1n2 xV1 H M n1 xn2 E E 1 2 V1 V2
12 12 2
溶度参数相近原则
E 定义:溶度参数 V n1n2 xV1 2 2 H M 1 2 n1V1V2 1 2 n1 xn2
聚氯乙烯
硝基甲烷
丙酮
丁酮 苯 四氯化碳 氯仿 二硫化碳 乙酸戊酯
天然橡胶
5.混合溶剂法
混合溶剂的溶解性能往往大于单一溶剂的性能 :分子间相互作用的一种量度 混合溶剂 ms 1 s1 2 s 2
能溶解高聚物的非溶剂混合物(δ为溶度参数,J1/2∙cm-3/2)
高聚物
氯丁橡胶 氯丁橡胶 丁苯橡胶 丁腈橡胶 丁腈橡胶
碳酸二丁酯
硝基甲烷 丙酮 乙醇
24.5
25.9 19.9 26.4
丁二烯亚胺
水 二硫化碳 乙醚
33.3
47.7 20.3 15.5
如何理解混合溶剂的性能?
溶度参数理论
高分子对某种溶剂的择优吸附
分子间相互作用
/jpkc/guo_jia_ji.html
O
但是,溶剂化并不是充分条件:
纤维素与氢氧化钠 解 纤维素与四乙基氢氧化胺 不能形成稳定晶 形成稳定晶格,阻碍溶
格,纤维素溶解于四乙基氢氧化胺
4. 1 1 2 原则
1 1 临界溶解条件:1c 1 1 2 2 x
当
2
x 时,
1 1 2
本原则要慎用
高分子-溶剂相互作用参数( 1)
注:交联度高的样品甚至不能溶胀。
(强硬的分子网络和失去柔顺性的链,溶剂分子难 以钻入链单元之间。)
结晶高聚物的溶解:
原则上:先熔融,再溶解 120℃: HDPE—四氢萘 135℃: HDPE—十氢萘 130℃: iso-PP—十氢萘
注意:并不是所有结晶高聚物都一定要在 其熔点附近才能溶解。
结晶高聚物的溶解:
xn2 其中: V2 n1 xn2
12
大多数高分子溶液的形成符合上述规律:
1 2 c 1.3 ~1.8(cal1/2∙cm-3/2)
1 2 c 2.6 ~ 3.7 (J1/2∙cm-3/2 )
H M n1V1 V2 1 2
2
H M 1RTn1V2
第9章 高聚物的溶液性能
——高聚物的溶解和溶剂的选择
主讲:朱平平
9.1 高聚物溶液(高分子溶液)性质的特点
高分子溶液与胶体溶液相比 高分子溶液与小分子溶液相比
9.2 高聚物的溶解和溶剂的选择
高聚物的溶胀与溶解 高聚物溶剂的选择及热力学分析 溶剂的良劣性
9.3 柔性链高聚物的溶液热力学性质
1 2 c 3.5(J1/2∙cm-3/2 )
大多数高分子溶液的形成符合上述规律:
1 2 c 2.6 ~ 3.7 (J1/2∙cm-3/2 )
例外: 聚丙烯腈 2 31.4(J1/2∙cm-3/2) 甲醇 1 29.6(J1/2∙cm-3/2) 二甲基甲酰胺 1 24.5(J1/2∙cm-3/2) 聚丙烯腈/二甲基甲酰胺
讨论:
非晶态的非极性高聚物,按照“溶度参数相近原
则”选择溶剂;
非晶态的极性高聚物,还要考虑极性相近;
晶态的非极性高聚物,参考“溶度参数相近原则” 选择溶剂,还需要提高温度破坏晶区规整结构才能 使溶解过程自发进行,通常是加热到高聚物熔点附 近; 对于晶态的极性高聚物,则不需要升高温度。
5. 混合溶剂法
6. 改变胶-苯、甲苯 聚苯乙烯-苯、甲苯、丁酮(弱极性) 聚乙烯醇-水、乙醇 聚丙烯腈-二甲基甲酰胺 虽有一定的指导意义,但比较笼统,在理 论上缺乏严格的依据。
溶解过程的自由能变化:
GM H M T SM
溶解过程自发进行的必要条件:
20.2 二氯甲烷 19.8
环己酮
18.6 三氯甲烷 19.0
四氢呋喃
问:四种小分子液体与两种高聚物的溶度参数都 很接近,都是它们的溶剂吗?
PVC-环己酮、四氢呋喃
PC—二氯甲烷、三氯甲烷
Cl C O O
H C H Cl C H O
H C Cl H
H3 C C CH3
室温下即可溶解:
聚酰胺类—间甲苯酚、甲酸、40%硫酸 PET—间甲苯酚、苯酚+四氯化碳、邻氯苯酚 聚乙烯醇—水 强极性高聚物在极性溶剂中的溶解
结晶高聚物的溶解:
结晶高聚物
缩聚物
分子间相互作用较强
加聚物
分子间相互作用较弱
溶解度取决于:分子量、结晶度
高聚物的溶胀与溶解
非晶态高聚物:先溶胀后溶解 交联高聚物的溶胀平衡:不能溶解,甚至 不溶胀 结晶高聚物
需要注意的几点:
溶度参数理论是Hildebrand溶度公式在高分子溶 液中的推广 Hildebrand溶度公式仅适用于非极性溶质和溶剂
的相互混合
溶度参数理论可适用于非极性或弱极性的非晶态
高聚物在极性相当的溶剂中的溶解
溶度参数的三个组分值:
p d h
2 2 2
2
p:极性力 d:色散力 h:氢键或其他特殊相互作用
高聚物/劣溶剂体系
内聚力使线团收缩, 值较小。 当内聚力达到一定程度时,高分子聚集,甚至从溶剂中沉淀 出来。
高聚物/溶剂体系(T=)
溶剂-链单元间的相互作用力=链单元间的内聚力, 无扰高斯线团。
交联高聚物的溶胀:
溶胀平衡:
溶剂的扩散力=分子网的弹性回缩力
溶胀程度与温度、溶剂以及交联度有关
每一根链呈高斯链无规线团形态 (仅取决于近程相互作用的大小)
h N G0 l , , cos ,sin
2 0
h M
2 0
G0
高分子溶液的形成:
高分子溶液:分子分散体系
凝聚在一起的高分子链 稀溶液中的一个个孤立的高分子
溶剂的作用:必须把一个个高分子链拆开来 (克服高分子之间的内聚力)
δ
16.7 16.7 16.5 19.2 19.2
非溶剂1
乙醚 己烷 戊烷 甲苯 甲苯
δ1
15.5 14.8 14.4 18.2 18.2
非溶剂2
乙酸乙酯 丙酮 乙酸乙酯 氰化乙酸乙酯 丙二酸二甲酯
δ2
18.6 19.9 18.6 23.3 21.0
聚丙烯腈
聚丙烯腈 聚氯乙烯 硝基纤维素
31.4
31.4 19.8 21.6
非极性高聚物:先熔融再溶解
极性高聚物:可以在室温下溶解
高聚物的溶解:
