两种中国凹顶藻属(Laurencia)海藻的化学成份及其生物活性研究
海草生物活性成分的研究进展

海草生物活性成分的研究进展黄丽丝;贺飞;王萍;漆淑华【期刊名称】《天然产物研究与开发》【年(卷),期】2012(024)009【摘要】This paper summarized the research progress of bioactive secondary metabolites from seagrasses. Their chemical constituents mainly included phenolics.flavonoids and diterpenoids,and biological activities included antibacterial, anb'oxidant,antiviral,cytotoxic,antialgal and antifouling activities,et al.%本文综述了海草中生物活性成分的研究进展,其化学成分类型主要是苯酚类、黄酮类和二萜类化合物,生物活性主要包括抗菌、抗氧化、抗病毒、细胞毒性、抑制海藻生长和抗污损等.【总页数】4页(P1319-1322)【作者】黄丽丝;贺飞;王萍;漆淑华【作者单位】中国科学院南海海洋研究所,广州510301;中国科学院研究生院,北京100049;中国科学院南海海洋研究所,广州510301;中国科学院南海海洋研究所,广州510301;中国科学院研究生院,北京100049;中国科学院南海海洋研究所,广州510301【正文语种】中文【中图分类】R284.2【相关文献】1.海草及海草场生态系统研究进展 [J], 王锁民;崔彦农;刘金祥;夏曾润2.鹰嘴豆生物活性成分及其功能研究进展 [J], 郭靖;于新;陈于陇;王萍3.汉麻籽生物活性成分及其应用研究进展 [J], 温林凤;刘果;宋明月;曹庸4.鹰嘴豆生物活性成分及其功能研究进展 [J], 郭靖;于新;陈于陇;王萍5.紫菜生物活性成分及其应用研究进展 [J], 江涛;费帆;方婷因版权原因,仅展示原文概要,查看原文内容请购买。
凹顶藻次级代谢产物及其生物活性和化学分类学研究

凹顶藻次级代谢产物及其生物活性和化学分类学研究凹顶藻属海藻在分类地位上属于红藻门、红藻纲、仙菜目、松节藻科,主要分布于热带、亚热带和温带海域的低潮线附近及深海部分,约135种,中国有20种以上。
凹顶藻次级代谢产物的结构类型主要包括倍半萜、二萜、三萜和C15-聚乙酰等,以卤代著称,并具有抗菌和细胞毒等多种生物活性。
本论文对近10年凹顶藻中分离鉴定的146个结构新颖的次级代谢产物及其生物活性和结构鉴定技术进行了总结,并对采自中国沿海的8种凹顶藻(马岛凹顶藻、俯仰凹顶藻、冈村凹顶藻、复生凹顶藻、齐腾凹顶藻、羽枝凹顶藻、三列凹顶藻和似瘤凹顶藻)的次级代谢产物进行了提取分离、结构鉴定、生物活性筛选和化学分类学探讨。
干燥并粉碎的凹顶藻样品分别进行有机溶剂提取,粗提物进行硅胶柱层析、凝胶Sephadex LH-20柱层析、制备薄层层析和高效液相色谱等方法分离纯化得单体化合物,利用超导核磁共振、质谱和红外光谱等现代谱学技术鉴定化合物的结构。
从上述8种凹顶藻中分离鉴定的化合物共计139个(部分化合物由不同种中多次分离鉴定),其中新化合物33个,新天然产物6个。
分离鉴定的化合物结构类型涵盖了倍半萜、二萜、三萜、C15-聚乙酰、吲哚和甾体类等,并且大多为卤代结构,其中新化合物中包括17个新倍半萜、4个新二萜、2个新聚醚三萜、5个新C15-聚乙酰、4个新多溴吲哚和1个新甾体,新天然产物中包括4个倍半萜和2个甲基环己二醇的同分异构体。
其中从马岛凹顶藻中分离鉴定26个化合物,发现新化合物8个,新天然产物2个;从俯仰凹顶藻中分离鉴定20个化合物,发现新化合物9个;从冈村凹顶藻中分离鉴定9个化合物,发现新化合物2个;从复生凹顶藻中分离鉴定30个化合物,发现新化合物5个,新天然产物2个;从齐腾凹顶藻中分离鉴定11个化合物,发现新化合物7个;从羽枝凹顶藻中分离鉴定9个化合物,发现新化合物1个;从三列凹顶藻中分离鉴定18个化合物,发现新化合物2个,新天然产物1个;从似瘤凹顶藻中分离鉴定16个化合物,发现新化合物5个,新天然产物1个。
海洋植物次级代谢产物

红藻的提取物寒天
寒天是红藻破壁技术的萃取物 卡路里很低, ,卡路里很低,含大量天然纤 维质(87%) (87%), 维质(87%),可减少醣分和胆 固醇的吸收,容易有饱足感, 固醇的吸收,容易有饱足感, 也有降低血压、胆固醇、 也有降低血压、胆固醇、预防 大肠癌等功用, 大肠癌等功用,很受减重族群 的喜爱。其成分以食物纤维- 的喜爱。其成分以食物纤维- 铁等成份居多, 钙、铁等成份居多,日本科学 家破译最古老植物基因, 家破译最古老植物基因,证实 红藻是地球最原始的植物。 红藻是地球最原始的植物。
2 Dolabellane型二萜
褐藻中还存在dolabellane型二萜化合物。 褐藻中还存在dolabellane型二萜化合物。例如 dolabellane型二萜化合物 Barbosa等 2003) : Barbosa等(2003)从采自巴西海域的褐藻 dolabellane型二 中分离得到一种dolabellane Dictyota pfaffii 中分离得到一种dolabellane型二 萜化合物。 萜化合物。 对海胆、 对海胆、鱼类等 海洋食草动物具 有拒食作用, 有拒食作用,是 D.pfaffii 的主要 次级代谢产物。 次级代谢产物。
为了对付海洋草食动物的大量吞食以维 护自身的生存繁衍, 护自身的生存繁衍,海藻大多能产生一 些很有特色的代谢物质, 些很有特色的代谢物质,这些活性物质 也是新药开发的重要来源, 也是新药开发的重要来源,对海藻中碳 水环合物、纤维素、维生素、 水环合物、纤维素、维生素、矿物质及 微量元素等化学成分的研究, 微量元素等化学成分的研究,特别是萜 特殊氨基酸、 类脂、甾体、 、特殊氨基酸、肽、类脂、甾体、脂肪 酸等类型等活性次级代谢产物的研究, 酸等类型等活性次级代谢产物的研究, 为海藻的药用开发提供了有价值的基础 资料。 资料。
中国凹顶藻类的研究

中国凹顶藻类的研究本文对中国沿海岸分布的凹顶藻类Laurencia complex(红藻门、松节藻科)进行了系统的分类研究。
紧跟国际上有关凹顶藻类的研究进展,吸收了最新的研究成果,根据藻体营养轴节围轴细胞的差异,把中国的凹顶藻属分别移入2个属,即凹顶藻属Laurencia,每营养轴节产生4个围轴细胞和软骨凹顶藻属Chondrophycus,每营养轴节产生2个围轴细胞。
对过去凹顶藻属两亚属的鉴定特征之一,四分孢子囊排列方式作了详细地观察,发现四分孢子囊的生长发育和排列一般有一定的规律性,总是从端部凹陷的四周向小枝的外周发展。
其平行或垂直排列与小枝的生长有关:无限生长型小枝的四分孢子囊与轴呈平行排列,有限生长型小枝的四分孢子囊与轴呈垂直排列。
因此,四分孢子囊排列仍然是一个十分重要的鉴定特征,其作用应该仅逊于围轴细胞。
结合最新的国际资料,利用中国科学院海洋研究所海洋生物标本馆保存的大量的标本(腊叶标本、液浸标本以及国外交换标本)以及作者几年来采集的标本,在藻体的外部形态、内部构造、生殖器官的特征等几方面,对中国凹顶藻类Laurencia complex进行了详细的的观察和研究。
文中对前人已经报道的中国凹顶藻属34个种及2个变种(其中只有25个种有标本可查)进行了进一步地确认,并对过去研究中存在的问题和错误进行了阐述和修正。
在此基础上,接受其中的30个种(包括1个待证实的种类)。
但保留在凹顶藻属的种类只有20个,即:1. 节枝凹顶藻Laurencia articulata Tseng,2. 红羽凹顶藻L. brongniartii J. Agardh,3. 凹顶藻L. chinensis Tseng,4. 复生凹顶藻L. composita Yamada,5. 俯仰凹顶藻L. decumbens Kuetz.,6. 加氏凹顶藻L. galtsoffii Howe,7. 香港凹顶藻L.hongkongensis Tseng, Chang, E.Z.Xia et B.M.Xia,8. 长枝凹顶藻L. longicaulis Tseng,9. 略大凹顶藻L. majuscula ( Harv.) Lucas,10. 马岛凹顶藻L. mariannensis Yamada,11. 黄色凹顶藻L. nipponica Yamada,12. 冈村凹顶藻L. okamurai Yamada,13. 羽枝凹顶藻L. pinnata Yamada,14. 赛氏凹顶藻L. silvai Zhang et B.M.Xia,15. 单叉凹顶藻L. subsimplex Tseng,16. 柔弱凹顶藻L. tenera C.K. Tseng,17. 三列凹顶藻L. tristicha C.K.Tseng, Chang, E.Z.Xia et B.M.Xia,18. 热带凹顶藻L. tropica Yamada,19. 细枝凹顶藻L. venusta Yamada,20. 轮枝凹顶藻L. verticillata Zhang et Xia)。
凹顶藻类组织培养研究

凹顶藻类组织培养研究
本课题以三种凹顶藻:冈村凹顶藻(Laurencia okamurai),三列凹顶藻(Laurencia tristicha),波状软骨凹顶藻(Chondrophycus undulatus)为实验材料,用藻体切段培养的方法研究了三种凹顶藻类藻体切段再生芽的形成及其再生过程中的极性。
并探索了光照,温度和盐度三种外界条件对三种凹顶藻藻段再生的影响。
发现三种凹顶藻藻体切段两端均能形成再生芽,并无明显极性;2 mm 以上的藻体切段在人工培养条件下不易死亡,能形成较多的再生芽;冈村凹顶藻与波状软骨凹顶藻的皮层与髓部细胞均能形成再生芽,三列凹顶藻的再生芽全部由皮层细胞形成;培养过程中藻体表面也能产生大量的再生芽;在实验室条件下,冈村凹顶藻的最适光照强度为53.55μmol photon m<sup>-2</sup>
s<sup>-1</sup>,最适温度为20℃,最适盐度为35;波状软骨凹顶藻的最适光照强度为53.55μmol photon m<sup>-2</sup> s<sup>-1</sup>,最适温度为20℃,最适盐度为30;三列凹顶藻的最适光照强度为53.55μmol photon
m<sup>-2</sup> s<sup>-1</sup>,最适温度为25℃,最适盐度为30。
藻段再生过程和三种外界条件对三种凹顶藻再生的影响研究为凹顶藻的人工培养体系提供了理论基础和依据。
2014年江西省优秀硕士学位论文名单
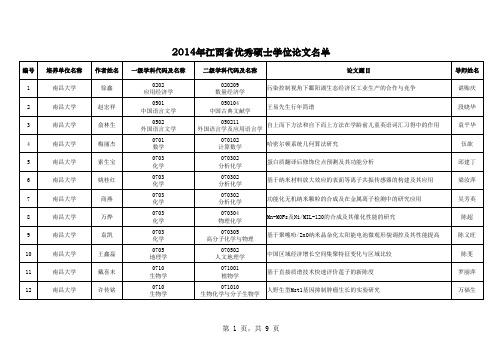
导师姓名 丁秋平 王宗德 薛芳森 霍光华 刘木华 刘木华 刘 勇 曾志将 黄建军 匡小平 万莹 李春根 胡援成
第 5 页,共 9 页
编号 65 66 67 68 69 70 71 72 73 74 75 76 77
培养单位名称 江西财经大学 江西财经大学 江西财经大学 江西财经大学 江西财经大学 江西财经大学 江西财经大学 江西财经大学 华东交通大学 华东交通大学 华东交通大学 华东交通大学 华东交通大学
2014年江西省优秀硕士学位论文名单
编号 1 2 3 4 5 6 7 8 9 10 11 12 培养单位名称 南昌大学 南昌大学 南昌大学 南昌大学 南昌大学 南昌大学 南昌大学 南昌大学 南昌大学 南昌大学 南昌大学 南昌大学 作者姓名 徐鑫 赵宏祥 俞林生 梅丽杰 索生宝 姚桂红 商燕 万烨 袁凯 王鑫磊 戴喜末 许传铭 一级学科代码及名称 0202 应用经济学 0501 中国语言文学 0502 外国语言文学 0701 数学 0703 化学 0703 化学 0703 化学 0703 化学 0703 化学 0705 地理学 0710 生物学 0710 生物学 二级学科代码及名称 020209 数量经济学 050104 中国古典文献学 论文题目 污染控制视角下鄱阳湖生态经济区工业生产的合作与竞争 王易先生行年简谱 导师姓名 谌贻庆 段晓华 袁平华 伍歆 邱建丁 梁汝萍 吴芳英 陈超 陈义旺 陈斐 罗丽萍 万福生
导师姓名 胡瑢华 于立新 闫洪 周南润 王玉皞 王信刚 刘成林 郑典模 黄冬根 张国文 刘伟 李宾公 吴磊
第 2 页,共 9 页
编号 26 27 28 29 30 31 32 33 34 35 36 37 38
培养单位名称 南昌大学 南昌大学 南昌大学 南昌大学 南昌大学 南昌大学 江西师范大学 江西师范大学 江西师范大学 江西师范大学 江西师范大学 江西师范大学 江西师范大学
三种中国南海无脊椎动物的化学成分及生物活性研究的开题报告

三种中国南海无脊椎动物的化学成分及生物活性研
究的开题报告
本文的主要研究内容为三种中国南海无脊椎动物的化学成分及生物活性。
无脊椎动物是海洋中最丰富和多样化的一类生物,包括海绵、海葵、海星、海螺、海胆等。
其中,我们选取了三种具有独特生物活性的无脊椎动物进行研究,分析其化学成分,探究其可能的药用价值,并对其生物活性进行初步评价。
第一种无脊椎动物为中国南海某种海绵(Sponge sp.),海绵是一类富含生物活性物质的无脊椎动物,在药物研究领域有着广泛的应用,例如海绵的生物碱为抗肿瘤和抗病毒药物的前体。
因此,我们将采用化学分离技术分离得到其主要化学成分,并通过生物活性实验检测其在抗肿瘤和抗病毒方面的活性。
第二种无脊椎动物为中国南海海蛇(Sea snake sp.),海蛇是一种富含多种多样的生物活性物质的海洋动物,并且其具有神经毒性和药理活性。
因此,我们将从海蛇的鳞片、皮肤、骨骼等组织中提取化合物,并对其进行化学成分分析和生物活性评估,探索其对神经系统的影响和可能的药用价值。
第三种无脊椎动物为中国南海某种海星(Starfish sp.),海星是一种常见的海洋底栖动物,其体内可以分离出多种生物活性物质,包括大量的皂类化合物、游离氨基酸等。
我们将对海星进行化学分析,鉴定其主要的化学成分,通过生物活性实验评价其药用价值,探究其在抗炎、抗肿瘤和抗氧化等方面的潜在应用。
总之,本文将运用化学分析技术和生物活性实验,深入探究中国南海三种无脊椎动物的化学成分及生物活性,并为其未来的药物应用和生物医学研究提供理论支持和实验依据。
我国海洋药物主要成分研究概况_

我国海洋药物主要成分研究概况( )关美君 丁 源(青岛药物研究所,青岛,266071)7 萜类(T erp eno ids)711 一萜类71111 海头红 从红藻海头红属P locam ium中分离出含卤单萜、环状多卤单萜及含氧卤代单萜等,多数具有抗菌活性,多卤代单萜能抑制H eL a癌细胞。
其中P locam adiene A能引起小鼠长时间的痉挛麻痹,可为实验研究骨髓反应机制的工具药。
从海头红属中分离得的单环或重排的单环卤代单萜具有镇静和平滑肌抑制作用,值得注意的本属卤代单萜的提取物可作为农药,对烟草天蛾、夜蛾和蚊幼虫均有抑杀作用,其抑杀作用强度超过沙蚕毒素的巴丹(Padan)。
[1] 71112 松香藻 红藻根叶藻科的松香藻P oritieria hone m ann ii在西沙和香港均有分布。
国外发现其多卤化单萜化合物H alom on 对一些不敏感的癌细胞具有选择性活性,现已进入临床前实验研究阶段。
71113 耳壳藻 从南海耳壳藻P ey ssonnelia cau lif era分离得一种高单萜的酯cau lilide 对艾氏腹水瘤(EA T)及S180肿瘤细胞的I C50分别为2.4和0.5m g m l[2]。
71114 海狸香 海狸又称河狸Castor f iber,尾基部有两个腺囊,其分泌物即称河狸香或海狸香,含有Α—龙脑,可供香料或供药用。
712 倍半萜类:据统计,现已知倍半萜约1000个。
71211 劳藻酚(L au rin tero l)、脱溴劳藻酚 从东海沿岸常见的异枝凹顶藻L au rencia in ter m d eia及冈村凹顶藻L.okam u ra i中分离所得,均有强的抗金葡球菌作用。
71212 柳珊瑚酸(Subergo rgin) 从南海柳珊瑚S uberg org ia sp.中分离出的三环十一烷倍半萜类分子式为C15H20O3的新物质,具有对胆碱酯酶选择性和可逆性的明显抑制作用,并有对神经毒剂的预防作用。
海洋生物活性物质萜类

在倍半萜、二萜及三萜化合物中主要以单卤代 为主,且含溴的几率大于氯。卤素主要分布在 苯环或饱和的六员环上,且往往卤原子的邻位 或对位有活化苯环的羟基存在。这可能与酚类 物质易发生卤代反应有关。饱和的六员环可能 是在生物代谢过程中由苯环还原所得。
③双环单萜
CH3 O
莰酮(樟脑) m.p 179 ℃ b.p 209 ℃
重要存在于樟脑树中,为无色闪光 结晶,易升华,有愉快香味。樟脑气味 有驱虫作用,可用于毛料衣物的纺蛀剂。 在医药上用作强化剂以及配制十滴水、 清凉油等。
倍半萜
在陆地植物体内常以醇、酮、内酯等形式存在于 挥发油中,多具有较强的香气和生物活性,根据结构 可分为链状倍半萜、单环倍半萜、双环倍半萜、三环 倍半萜等。
金合欢醇
OH
无色粘稠液体,b.p 125℃/66.5Pa,有铃兰气味, 存在于玫瑰油、茉莉油、合金欢油及橙花油中。是 一种珍贵的香料,用于配制高级香精;有保幼激素 活性,用于抑制昆虫的变态和性成熟。
O O
山道年
是由山道年花蕾中提取出 的无色结晶,m.p170℃,
不溶于水,易溶于有机溶剂。
过去是医药上常用的驱蛔
二倍半萜是海绵海绵中含量最丰富的萜类化合物分子通式为c线型的二倍半萜链一端有呋喃环二倍半萜新骨架的四环或五环二倍半萜海绵rcininoros中提取中性抗菌活约23以上的二倍半萜来自于海洋生物另一端带有特窗酸母体即内酯环五环二倍半萜链状二倍半萜抑制受精海星卵的细胞分裂罕见存在于澳大利亚大堡礁海绵strepsichordaialendenfeldi中图241海洋二倍半萜碳架图242海洋二倍半萜的变形碳架12降二倍半萜36高二倍半萜78双高二倍半萜9甲基重排二倍半萜角质海绵角质海绵sarcotragussppsarcotragusspp和沙海和沙海绵绵psammociniasppsammociniasp中二倍半萜的结中二倍半萜的结构与抗肿瘤活性的关系构与抗肿瘤活性的关系角质海绵和沙海绵同属网角海绵目多含链状二倍半萜其中多数具有呋喃环和羟基丁酸内酯结构单元或降解产物
海洋Penicillium属化学成分与生物活性的研究

第27卷第4期2011年8月哈尔滨商业大学学报(自然科学版)Journal of Harbin University of Commerce (Natural Sciences Edition )Vol.27No.4Aug.2011收稿日期:2011-02-29.作者简介:余玥(1986-),女,硕士,研究方向:海洋药物化学.海洋Penicillium 属化学成分与生物活性的研究余玥1,2,林文翰3(1.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨150076;2.国家教育部抗肿瘤天然药物工程研究中心,哈尔滨150076;3.北京大学天然药物及仿生药物国家重点实验室,北京100083)摘要:海洋微生物数量大,种类多,代谢产物多样化,构型奇特,很多具有很好的活性.由于海洋环境的特殊性,海洋微生物发展出其独特的代谢方式,有很多陆地微生物所未遇见过的新型代谢产物.青霉菌在海洋环境中被造就其独特的代谢方式,其生物活性与结构类别都与陆地青霉菌属有很大差异.根据化合物结构类型阐述了近年来在海洋中分离得到的青霉菌属代谢产物的研究概况.关键词:海洋青霉菌属;化学成分;生物活性中图分类号:R284文献标识码:A文章编号:1672-0946(2011)04-0517-07Study on chemical composition and bioactivity of marine penicillium genusYU Yue 1,2,LIN Wen-han 3(1.Research Center on Life Sciences and Environmental Sciences ,Harbin University of Commerce ,Harbin 150076,China ;2.Engineering Research Center of Natural Antineoplastic Drugs ,Ministry of Education ,Harbin 150076,China ;3.State Key Laboratory of Natural and Biomimetic Drugs ,Peking University ,Bei-jing 100083,China )Abstract :Marine microorganisms have a large quantity and variety ;the metabolites are di-verse with peculiar configurations ,many of which have fair activities.Because of the particu-larity of marine environment ,marine microorganisms have developed a unique metabolic pathway of their own ,and brought in a large number of new types of metabolites that have never been seen in the land microorganisms.Penicilliums form a unique metabolic pathway in the marine environment ,and its bioactivities and structure classifications differ a lot from that of land penicilliums genus.In this paper ,brief reviews of recent studies on penicilliums genus separated from the marine were provided according to the structure type of metabolites.Key words :marine penicilliums genus ;chemical constituents ;bioactivity海洋真菌是一类具有真核结构,能形成孢子,营腐生或寄生生活的海洋生物,包括来源于海洋的专性海洋真菌与来源于陆地或淡水,能在海洋生境中生长与繁殖的兼性海洋真菌.目前已发现的还具有产生理活性物质的海洋真菌有曲霉(Aspergil-lus )、青霉(Penicillium )、海壳霉(Corollospora )、长蠕孢属(Helminthosporium )、茎点霉(Phoma )、光黑壳属(Preussia )等.自从青霉素问世以来,微生物产生的活性代谢产物就成为开发新药的重要资源.对真菌Penicilli-um 属的研究较多,青霉属在属下分六个亚属:双轮亚属、篮状菌属、类曲霉亚属、正青霉属、青霉亚属、叉状亚属.其中,双轮亚属分14个种,篮状菌属分7个种,类曲霉亚属分25个种,正青霉属分9个种,青霉亚属分19个种,叉状亚属分22个种[1].有性态的是篮状菌属和正青霉属[2].发现其能够代谢多种此生代谢产物,主要有生物碱、萜类及聚酮类,还有一些其他类别的化合物[3].其中一些化合物有细胞毒活性,还有很好的抗菌,杀虫及抗虫的功效[4].本文按结构类型与代谢产物活性对近年来国内外学者在海洋中分离得到的青霉属化学成分有关研究进展进行介绍.1生物碱从海洋青霉菌中发现的众多生物碱中,主要结构类型有吲哚、喹啉、喹唑啉、吡咯、哌啶等常见的杂环生物碱,还有一些其他生物碱类化合物,这些生物碱均具有重要生物活性.1.1吲哚类生物碱在海洋Penicillium 属产生的生物碱中,萜类吲哚生物碱数量很多,从Penicillium Oxaline (1)中分离得到[5];从一种海藻中分离出来的Penicillium 属真菌中分离出七个吲哚类生物碱,其中两个为pe-nochalasinA (2)和D (3),它们对细胞P388表现出明显的细胞毒活性,ED 50值为3.2,2.1μg /mL [6].在海洋Penicillium 属产生的生物碱当中,萜类吲哚生物碱的数量很多.从寄生真菌Penicillium sp .中分离得到十个吲哚三萜生物碱,分别为shearinines A 、D -K 和paspalitrem A (4)以及一个吲哚二萜生物碱paspaline (5)shearinines ,A -K 在体外能阻断电导Ca -K 通道[7].从一种新的海洋Penicillium 霉菌中分离得到两个吲哚二萜生物碱thiersinies A(6)和B (7),在抗黏虫实验中,表现出显著活性,降低率为83%和84%[8].·815·哈尔滨商业大学学报(自然科学版)第27卷1.2喹啉类生物碱Communesin C 和D (8)是一种附生于海绵Axinella verrucosa 的真菌,从Penicillium sp.中首次分离得到[9];Penigequinolones A 和B (9 10)也是从真菌Penicillium sp.中分离所得[10].1.3喹唑啉类生物碱从Penicillium thymicola 中分离得到几个喹唑啉类生物碱(11 13)[11].1.4其他类型生物碱自Penicillium citrinum 分到吡咯类生物碱Scalusamide A -C (14 16),Scalusamide A 有较弱的抗菌活性,对Cryptococcus nepformans 和Micrococ-cus luteus 的MIC 值为16.7和33.37μg /mL [12];从Penicillium 属分离生物碱herquline A (17)[13];从Penicillium aurantiogriseum 中分离得到一个具有苯并二氮结构的生物碱anacine1A (18),具有抗虫活性,在抑制H.zea 幼虫蜕变实验中,抑制率为42%[14];自寄生菌Penicillium sp 分离得到Penicil-dones A -C (19 20)[15];分离自Penicillium citri-num 的生物碱Perinadine A 具有较弱的细胞毒活性,对鼠白细胞L1210的IC 50值为20μg /mL [16].·915·第4期余玥,等:海洋Penicillium 属化学成分与生物活性的研究2萜类2.1倍半萜Shim等人从Penicillium griseofulvum中分到五个倍半萜烯Penifulvins A-E(21 25),其具有一个新颖的二氧[5-6]壬烷四环结构[17-18].Penifulvin A在抗黏虫Spodopetera frugiperda的试验中表现出强抗虫活性,降低了74%的抑制率.2.2二萜从Penicillium sp.中分离得到一个二萜Brevi-one A(26)[19],另外还有四个二萜Brevione B E (27 30)[20].·025·哈尔滨商业大学学报(自然科学版)第27卷2.3二萜半萜从该属中分离得到的二萜半萜均为混合聚酮-萜类(meroterpenoid )结构,是分离得到萜类的主要成分.从Penicillium sp.中分离得到Peaustinoid A (31),具有四个六元环结构,Peaustinoid A 对Esch-erichia coli 和Bacilus sp.有中等抑菌活性[21].3大环内酯类来源于海洋微生物的大环内酯和聚醚类化合物一般都具有特殊结构和显著的生物活性,如抗肿瘤、抗菌、抗病毒等.目前发现的大环内酯和聚醚类化合物主要是从海绵和软体动物中分离的.但随着现代分离技术的提高,近来从深海极端微生物中也分离得到有意义的化合物.Patulolide A (32)和B (33)是从Penicillium urticae mutants 中分离得到两个科单大环内酯[22-23];从Penicillium 属中分离得到一系列含苯环的大环内酯(34 39).·125·第4期余玥,等:海洋Penicillium 属化学成分与生物活性的研究4聚酮类聚酮类是由C 2单位形成的脂肪酸、酚类、苯醌等化合物.海洋青霉属产生的此种化合物较多,而且结构多样,并没有固定的骨架.分离自Penicillium sp.的两个聚酮-萜preaustinoid A 和B对Escherichia coil ,Bacillus sp.及Staphylococcus au-reus 均有中等抑菌活性[24].在Penicillium expansum中分离出三个苯并吡喃化合物,具有抑菌作用,100μg /mL 时对Lasiodiplodia theobromae 菌体生长抑制率为76%,74%和69%[25].分离自Penicillium sp .JP -1的Penicillienone 及leptospha-erone C 具有细胞毒活性,Penicillienone 对细胞P388的IC 50值为1.38μg /mL ,leptosphaerone C 对细胞A -549的IC 50值为1.45μg /mL [26].从Penicillium citrinum F5中分离得一个具有苯并二氢呋喃结构的化合物(40),是氧化剂[27];从Penicillium citrinum 和Penicillium steckii 中分离得到两个化合物(41 42);从一株源自深水沉积物的Penicillium 真菌中分离出一个苯醌类化合物(43).5其他类型海洋Penicillium 属还产生了许多其他类型的代谢物,如:内酯类、环肽类、甾体、吡喃酮类等.5.1环肽类从Penicillium brevicompactum 中分离出环四肽brevigellin (44).5.2吡喃酮类该类化合物结构简单,分子质量小.一般有两种,一种为2-酮,如:citreopyrone (45)[28];一种为4-酮,如citreo -γ-pyrone (46)[29].在Penicillium expansum 中分离出三个苯并吡喃化合物,具有抑菌作用,100μg /mL 时对Lasiodiplodia theobromae 菌体生长抑制率为76%,74%和69%[30].5.3其他此外,从该属真菌中还分离出一个硫醇以及一些酰胺、胺类、酮等化合物.Ravenic Acid 有抗真菌活性,在25μg /mL 时能抑制青霉素及多种药物生长;7-deacetoxyyanuthone A 对该菌也有中等抑制作用,MIC 值为50μg /mL [31-36].·225·哈尔滨商业大学学报(自然科学版)第27卷6结语综上所述,青霉菌属在高压、高盐度、低养分、低温这样所谓生命的极限环境中,发展出了独特的代谢方式,这不仅保证了其可以在极端环境下生存,也提供了产生新型代谢产物的潜力.迄今为止,人们从海洋青霉菌中发现了许多具有药用价值的活性化合物,有力地推动了海洋天然产物化学的发展.参考文献:[1]孔华忠.中国真菌志(第三十五卷):青霉属及其相关性型属[M].北京:科学出版社,2007.[2]宋爱环,李红叶,刘小红,等.指状青霉(Penicillium digita-tum)原生质体制备和再生条件[J].农业生物技术学报,2004,12(2):197-201.[3]梁宗琦.真菌次生代谢产物多样性及其潜在应用价值[J].生物多样性,1999,7(2):145-150.[4]姜健,杨宝灵.海洋微生物生物活性物质的研究[J].云南大学学报,2004,26(6A):91-95.[5]韩妍妍,张亚娟,王维娜,等.海洋微生物是开发海洋药物的重要资源[J].海洋化学,2000,26(9):7-12.[6]XU M J,GESSNER,GUIDO,et al.Shearinines D-K,new indole triterpenoids from an endophytic Penicillium sp.(strainHKI0459)with blocking activity on large-conductance calcium-activated potassium channaels[J].Tetrahedron,2007,63(2):435-444.[7]LI C,GLOER,JAMES B,et al.Thiersinines A and B:novel antiinsectan indole diterpenoids from a new fungicolous Penicilli-um species(NRRL28147)[J].Organic Letters,2002,4(18):3095-3098.[8]JADULCO,RAQUEL,EDRADA,et al.New communesin de-rivatives from the fungus Penicillium sp.derived from the Medi-terranean sponge Axinella verrucosa[J].Journal of Natural Prod-ucts,2004,67(1):78-81.[9]KIMURA,YASUL,KUSANO,et al.Penigequinolones A and B,pollen-growth inhibitors produced by Penigequinolone A andB,pollen-growth inhibitors produces by Penicillium sp[J].Tetrahedron Letters,1996,37(28):4961-4964.[10]LARSEN,THOMAS O,FTYDENVANG,et al.UV-Guided I-solation of Alantrypinone,a Novel Penicillium Alkaloid[J].Journal of Natural Products,1998,61(9):1154-1157.[11]TSUDA,MASASHI,SASAKI,et al.Scalusamides A-C,new pyrrolidine alkaloids from the marine-derived fungus Penicilli-um citrinum[J].Journal of Natural Products,2005,68(2):273-276.[12]KAGATA,TOSHINORI,SHIGEMORI,et al.Coruscol A,a new metabolite from the marine-derived fungus Penicillium spe-cies[J].Journal of Natural Products,2000,63(6):886-887.[13]BOYES K,JANE M,GURNEY,et al.Anacine,a new benzo-diazepine metabolite of Penicillium aurantiogriseum producedwith other alkaloids in submerged fermentation[J].Journal ofNatural Products,1993,56(10):1707-17.[14]GE H M,SHEN,YAO,et al.Penicidones A-C,three cyto-toxic alkaloidal metabolites of an endophytic Penicillium sp[J].Phytochemistry,2008,69(2):571-576.[15]SHIM,SANG H,SWENSON,et al.Penifulvin A,a sesquiter-penoid-derived metabolite containing a novel dioxa[5,5,5,6]fenestranering system from a fungicolous isolate of Penicilliumgriseofulvum[J].Organic Letters,2006,8(6):1225-1228.[16]SASAKI,MAI,TSUDA,et al.Perinadine A,a Novel Tetra-cyclic Alkaioid from Marine-Derived Fungus Pencicllium citri-num[J].Organic Letters,2005,19(7):4261-4264.[17]SHIM,SANG H,GLOER,et al.Penifulvins B-E and a Sil-phinene Analogue:Sesquiterpenoids from a Fungicolous Isolateof Penicillium griseofulvum[J].Journal of Natural Products,2006,69(11):1601-1605.[18]DIERCKX.MACIAS,FRANCISCO A,et al.Allelochemicals from New Zealand fungi.(+)-Brevione A.The first memberof a novel family of bioactive spiroditerpenoids isolated from Peni-cillium brecicompactum[J].Tetrahedron Letters(2000),41(15),2683-2686.[19]TAKIKAWA,HIROSATO,IMAMURA,et al.Synthesis and absolute configuration of brevione B,an allelochemical isolatefrom Penicillium sp[J].Tetrahedron,2006,62(1):39-48.[20]GERIS S,REGINA M,RODRIGUES F,et al.Meroterpenes from Penicillium sp found in association with Melia azedarach[J].Phytochemistry,2002,61(8):907-912.[21]SEKIGUCHI,AugICHIET.Structure of patulolide A,a new macrolide from Penicillium urticae mtants[J].Tetrahedron Let-ters,1985,26(19):2341-2.[22]KALITA,DIPAK,KHAN A T,et al.Total synthesis of(R)-(+)-Patulolide A and(R)-(-)-Patulolide B:the mac-rolides isolated from Penicillium urticae mutant[J].Tetrahed-ron,1999,55(16):5177-5184.[23]CHEN,CHEN H,SHAW C Y.2,3,4-Trimethy1-5,7-dihydroxy-2,3-dihydroben-zofuran,a novel antioxidant,from Penicillium citrinum F5[J].Journal of Natural Products,2002,65(5):740-741.[24]GERIS S,REGINA M,REDRAGUES F,et al.Meroterpenes from Pencicllium sp.found in association with Melia azedarach[J].Phytochemistry,2002,61(8):907-912.[25]SASAKI M,TSUDA,MASASHI,et al.Perinadine A,a Novel Tetracyclic Alkaioid from Marine-Derived Fungus Penciclliumcitrinum[J].Organic Letters(2005),7(19),4261-4264.[26]LIN Z J,ZHU T X.Polyketides from Pencicllium sp.JP-1,anendophytic fungus associated with the mangrove plant Ae-giceras corniculatim[J].Phytochemistry,2008,69(5):1273-1278.[27]NIWA,MASATAKE.Isolation and structure of citreopyone,a metabolite of Penicillium citreo-viride Biourge[J].TetrahedronLetters,1980,46(21):4481-2.(下转527页)·325·第4期余玥,等:海洋Penicillium属化学成分与生物活性的研究油醚,氯仿,乙酸乙酯,正丁醇萃取,氯仿的极性比石油醚大些,可是在实验结果上可以看出清除能力的改变并不是变化很大,说明氯仿部位的清除能力没有随着极性的增大而增大.乙酸乙酯部位的清除能力明显比石油醚和氯仿部位的高,说明乙酸乙酯部位里的抗氧化成分比石油醚部位和氯仿部位的数目多或者活性强,极性部位正丁醇部位的清除能力没有随着极性的变大而增大,说明正丁醇部位的抗氧化成分少或者活性弱.水层的清除能力也没有乙酸乙酯部位的高,可能是水层的成分抗氧化能力弱的原因.VC的清除能力相对于其他部位来说很高,因为VC是抗氧化剂,在日常生活中可以用来预防氧化,由于其抗氧化作用明显、清除自由基显著,因此用VC作为对照组.由此,实验确定了野西瓜抗氧化活性部位为乙酸乙酯部位.接下来对乙酸乙酯部位进行单体化合物的分离与结构鉴定,共分离得到3个化合物,根据理化常数,光谱数据以及核对文献等手段,分别鉴定为化合物1长寿花糖苷,化合物2为琥珀酸,化合物3为水苏碱甲酯.在对3个单体化合物的抗氧化活性测定中发现,长寿花糖苷清除能力最强,并且其消除率高于乙酸乙酯部位,说明长寿花糖苷是乙酸乙酯部位的活性成分之一.参考文献:[1]新疆植物志编辑委员会.新疆植物志(第2卷,第2分册)[M].乌鲁木齐:新疆科技卫生出版社,1995:35.[2]GADGOLI C,MISHRA S H.Antihepatotoxic activity of p-me-thoxy benzoic acid from Capparis spinosa[J].J Ethnopharma-col,1999,66(2):187-192.[3]TESORIERE L,BUTERA D,GENTILE C,et al.Bioactive Components of Caper(Capparis spinosa L.)from Sicily andAntioxidant Effects in a Red Meat Simulated Gastric Digestion[J].J.Agric.Food Chem.2007,55,8465-8471.[4]EDDOIKS M,LEMHADRI A,MICHEL J B.Hyperlipidemic activity of aqueous extract of Capparis spinosa L.in normal and-diabetic rats[J].J Ethnopharmacol,2005,98(3):345-350.[5]于蕾,崔荣田,莫科,等.野西瓜总皂苷诱导人肝癌细胞HepG-2凋亡的初步研究[J].天津中医药,2008,25(6):509-511.[6]季宇彬,东方,高世勇,等.野西瓜多糖诱导人肝癌Hep-G -2细胞凋亡的实验研究[J].中草药,2008,39(9):1364-1366.[7]杨海帆,于蕾,庞琳琳,等.野西瓜正丁醇提取物的化学成分与抗肿瘤作用[J].哈尔滨商业大学学报:自然科学版,2009,25(3):264-267.[8]柳艳,李磊,赵鸿雁.丹酚酸B清除DPPH有机自由基活性及影响因素研究[J].时珍国医国药,2006,17(12):2406.[9]李红,张元湖.应用DPPH法测定苹果提取物的抗氧化能力[J].山东农业大学学报:自然科学版,2004,36(1):35-38[10]邱莉,刘红霞,姜志虎,等.酸浆茎叶中的四甲基环己烯型单萜苷类化合物[J].沈阳药科大学学报,2008,25(12):956-959.[11]于洋.刺山柑化学成分的研究[D].沈阳:沈阳药科大学,2007,14-20.[12]凌娜,于蕾,邹翔,等.野西瓜挥发油对人胃癌SGC -7901细胞的抑制[J].哈尔滨商业大学学报:自然科学版,2010,26(4):393-397.(上接523页)[28]NAKADA,TAKASHI,SUDO,et al.Two new metabolites of hybrid strains KO0201and0211derived from penicillium citreo-viride B.IFO6200and4692[J].Tetrahedron Letters,1999,40(37):6831-6834.[29]STIEILE,DONALD B,STIERLE,et al.New phomopsolides from a Penicillium sp[J].Journal of Natual Products,1995,41(36):7481-7485.[30]HE Guochun.A new antifungal metabolite from Pencicllium ex-pansum[J].Journal of Natural Products,2004,67(7):1084-1087.[31]HENSENS,OTTO D.Structure elucidation of restricticin,a no-vel antifungal agent from Penicillium restrictixt[J].Tetrahdron,1991,47(24):3915-24.[32]IWAMOTO,CHIKA,MINOURA,et al.Absolute stereostuc-tures of novel cytotoxic metabolites,penostatins A-E,from aPenicillium species separated from an Enteromorpha alga[J].Tetrahedron,1999,55(50):14353-14368.[33]MICHAEL,ADAM P,GRACE,et al.Ravenic Acid,a New Tetra Acid Isolated from a Cultured Microfungus,Penicillium sp[J].Journal of Natural Products,2002,65(9):1360-1362.[34]KIMURA,YASUO,MIZUNO,et al.Penienone and peni-hydrone,new plant growth regulators produced by he fungus,Penicillium sp.NO.13[J].Tetrahedron Letters,1997,38(3):469-472.[35]LI,X F,CHOI,HONG D,et al.New polyoxygenated farnesyl-cyclohexenones,deacetoxyyanuthone A and its hydro derivativefrom the marine-derived fungus Penicillium sp[J].Journal ofNatural Products,2003,66(11):1499-1500.[36]TAKAHASHI,CHIKA.Penostains,novel cytotoxic metabolites from a Pencicllium sp.seprarted from a green alga[J].Tetra-hedron Letters,1996,37(5):655-658.·725·第4期于蕾,等:野西瓜化学成分提取分离及抗氧化活性测定。
中国南海群海绵 Agelas mauritiana的化学成分研究

中国南海群海绵 Agelas mauritiana的化学成分研究方凤凯;汤华;刘宝姝;庄春林;孙鹏;张文【期刊名称】《药学实践杂志》【年(卷),期】2015(000)003【摘要】目的:对采自南中国海海域的群海绵(A gelas mauritiana)的化学成分进行研究。
方法采用硅胶色谱柱、Sephadex L H-20凝胶色谱柱、高效液相色谱等色谱方法,对 A gelas mauritiana正丁醇萃取物进行分离纯化;应用现代波谱技术对化合物进行化学结构鉴定;用M T T法对化合物进行体外人肺癌细胞株A549细胞生长抑制活性测试。
结果共分离得到8个化合物,分别鉴定为:agelasine A (1)、agelasine B (2)、epi-agelasine C (3)、(-)agelasine D (4)、agelasine E (5)、agelasine F (6)、(-)ageloxime D (7)、aurantiamide acetate (8)。
体外活性筛选中,这些化合物对A549显示出不同程度的生长抑制活性,化合物1~3的活性与阳性对照阿霉素相近。
结论化合物1、2、4、5、6、8为首次从该种海绵中分离得到。
首次选用A549对化合物1~7的活性进行评价,化合物2、3的显著生长抑制活性为进一步深入研究提供了依据。
%Objective To investigate the chemical constituents of marine sponge A gelas mauritiana collected from the South China Sea .Methods The n-butanol extract of marine sponge A gelas mauritiana was separated and purified by repeated column chromatography on silica gel ,Sephadex LH-20 ,and reversed-phase high-performance liquid chromatography (RP-HPLC) .The chemical structures of those obtained compounds were determined on the basis of spectroscopic analysis and com-parison withreported data .The tumor cell growth inhibitory activity of these compounds towards human lung carcinoma cells A549 was tested .Results Eight compounds were isolated ,including agelasine A (1) ,agelasine B (2) ,epi-agelasine C (3) , (-)agelasine D (4) ,agelasine E (5) ,agelasine F (6) ,(-)ageloxime D (7) and aurantiamide acetate (8) .These compounds dis-played different level of tumor cell growth inhibitory activity towards cell A 549 in vitro .Compounds 1-3 showed significant ac-tivity towards cellA549 ,being similar to that of the positive control ofadriamycin .Conclusion Compounds 1 ,2 ,4 ,5 ,6 ,8 were isolated for the first time from the sponge A gelas mauritiana .Cell A549 was selected for the first time for the activity evalua-tion of compounds 1~7 .Significant inhibition activity of compounds 2、3 may hold as a basis for further research .【总页数】5页(P242-245,274)【作者】方凤凯;汤华;刘宝姝;庄春林;孙鹏;张文【作者单位】第二军医大学药学院海洋药物研究中心,上海200433;第二军医大学药学院海洋药物研究中心,上海200433;第二军医大学药学院海洋药物研究中心,上海200433;第二军医大学药学院海洋药物研究中心,上海200433;第二军医大学药学院海洋药物研究中心,上海200433;第二军医大学药学院海洋药物研究中心,上海200433【正文语种】中文【中图分类】R284【相关文献】1.中国南海山海绵Mycale sp.的化学成分研究 [J], 孙佳宝;王淑萍;王洁;刘莉;韩兵男;林厚文2.群海绵Agelas sp.的化学成分研究 [J], 朱彦;焦伟华;孙华君3.中国南海海绵Axinella sp.中化学成分的研究 [J], 许娇娇;顾琼;王佳;赵川;段宏泉;乔卫;唐生安4.中国南海海绵Haliclona sp.中化学成分的研究 [J], 许娇娇;靳德军;王佳;祁菁;赵川;乔卫;段宏泉;唐生安5.中国南海海绵Ircinia sp.中化学成分的研究 [J], 王玲莉;于欢;张冬丽;乔卫;唐生安因版权原因,仅展示原文概要,查看原文内容请购买。
海南岛常见的大型底栖海藻

海南岛常见的大型底栖海藻王红勇;吴洪流;姚雪梅;冯永勤;文珍;谢桂连;彭惠【摘要】2000-2009年,对海南岛大型底栖海藻资源作了初步调查,发现常见红藻有51种,褐藻有17种,绿藻有15种.【期刊名称】《热带生物学报》【年(卷),期】2010(001)002【总页数】8页(P175-182)【关键词】海藻;底栖;海南岛【作者】王红勇;吴洪流;姚雪梅;冯永勤;文珍;谢桂连;彭惠【作者单位】海南大学,海洋学院,海南,海口,570228;海南大学,海洋学院,海南,海口,570228;海南大学,海洋学院,海南,海口,570228;海南大学,海洋学院,海南,海口,570228;海南大学,海洋学院,海南,海口,570228;海南大学,海洋学院,海南,海口,570228;海南大学,海洋学院,海南,海口,570228【正文语种】中文【中图分类】S932.7海南岛位于东经108°37'~111°05',北纬18°10'~20°10',西临北部湾,东部与南部濒临南海,北靠大陆,与雷州半岛只有琼州海峡一水之隔,海岸线长达1 618 km,有大小港湾68个。
海南岛地处热带,气候温和,年平均气温23~25℃。
全岛有157条河流流入大海,给沿海带来了大量的营养盐,海底有许多起伏成群的岩礁及珊瑚礁,优越的地理气候和环境条件形成了丰富的海藻资源。
为了摸清海南岛常见的大型底栖海藻资源现状,2000—2009年笔者对海南岛大型底栖海藻资源进行了实地调查,现将结果报道如下。
1 红藻门[1]Rhodophycophyta1.1 红藻纲Phodophyceae1.1.1 红毛菜亚纲[2-3]Bangiophycida红毛菜目[3]Bangiales红毛菜科Bangiaceae紫菜属Porphyra C.Ag广东紫菜Porphyra guangdongensis T seng et T.J.Chang分布于文昌、海口、澄迈、临高等地,生长在中高潮带的岩石上。
海洋生物学实验_海藻实验报告2

实验科目:海洋生物学实验实验题目:青岛沿海主要大型海藻分类鉴定实验时间:周日3-4节上课组号:周日3-4节第4组一、实验目的通过对青岛潮间带海藻的采集与分类鉴定,使学生熟悉主要海藻,掌握形态分类的基本方法。
了解常见海藻的生态分布及基本形态特征。
二、实验原理各种海藻不同的形态,结构特征。
三、实验材料及用品1.实验材料:采集新鲜海藻;2.实验器具:镊子,刀片,载玻片,盖玻片,滴管3.实验仪器:实体显微镜、光学显微镜4.鉴定参考资料:青岛沿岸主要大型海藻(PPT);《中国黄渤海海藻》等四、实验方法1.观察新鲜海藻的大小、叶状体、分枝、固着器等外部形态,叶状体上生殖器官(果孢子囊等)的有无等;2.切片观察海藻叶状体的横切面或纵切面细切片观察海藻叶状体的横切面或纵切面细胞结构,了解其内部结构;有繁殖孢子的观察孢子形态。
五、实验结果1. 蜈蚣藻Grateloupia filicina分类地位:红藻门真红藻纲隐丝藻目海膜科蜈蚣藻属蜈蚣藻主要特征:藻体直立,单尘或丛生,基部具小盘状固者器,紫红色,黏滑,主枝亚圆杆形或扁平,直径2-5mm,2-3次羽状分枝,下部分枝较长,上部的较短,小枝对生、互生或偏生,基部不溢缩,有的分枝在藻体表面生出,主枝不中空。
生态分布特性:生于外海及浪较大的中潮带岩石上或石沼中或大干潮线附近的岩礁上或低潮带石上和石沼中。
我国沿海均有分布。
2. 鼠尾藻Sargassum thunbergii分类地位:褐藻门圆子纲墨角藻目马尾藻科马尾藻属鼠尾藻主要特征:藻体黑褐色,形似鼠尾。
主干短粗,上长数条主枝。
主枝圆柱形,数条纵走浅沟。
轮生短小分枝,叶丝状,短小,全缘或有粗锯齿。
气囊小,纺锤形,顶尖,有细柄。
鼠尾藻的生活史类型属于二倍体单相世代,没有一般藻类植物的世代交替,缺少配子体阶段。
雌雄异株,自然繁殖方式有有性繁殖和营养繁殖两种。
生态分布特性:生长在中潮带岩石上或石沼中。
全年可见,生长盛期3—7月。
冈村凹顶藻和9种软体动物的代谢产物分析

冈村凹顶藻和9种软体动物的代谢产物分析海洋物种资源丰富,属于五个生物界、四十四个生物门,如此富饶的海洋物种资源为海洋天然产物的宝库。
海洋天然产物广泛来源于微生物与浮游生物、苔藓虫类、海藻(褐藻、绿藻、红藻)、海绵、腔肠动物、软体动物、棘皮动物、被囊动物等。
本文着眼于红藻和软体动物进行天然产物的探索。
凹顶藻属(Laurencia)约135种,其中中国有37种,是属于红藻门、红藻纲、仙菜目、松节藻科的海藻,主要分布于热带、亚热带和温带海区的潮间带附近及深海部分。
凹顶藻次级代谢产物数量众多,并且具有丰富的结构类型,主要包括倍半萜、二萜、三萜和C15-聚乙酰等,多半次级代谢产物含有卤素元素,其中一些凹顶藻次级代谢产物报道具有抗菌、细胞毒活性、拒食以及驱虫等多种生物活性。
本文对凹顶藻以近年来代谢产物的研究进展进行了综述,归纳例举了部分具有新颖构造、有生物活性的化合物。
本文中冈村凹顶藻(L.okamurai)样品采自中国广东湛江。
将干燥并粉碎的冈村凹顶藻样品用甲醇、二氯甲烷等有机溶剂进行提取,粗提取物再用乙酸乙酯进行萃取。
获得的乙酸乙酯相通过薄层层析、硅胶柱层析、凝胶柱层析(Sephadex LH-20)和半制备高效液相色谱(HPLC)等方法一步步分离提纯,最终得到单体化合物。
然后运用1H NMR、13C NMR和质谱等现代波谱技术来鉴定化合物的结构。
从广东湛江的冈村凹顶藻中共分离鉴定了2个化合物。
软体动物门有着巨大生物多样性,其下分为八个不同的纲。
软体动物为人类供应了丰富的资源,比如食品、贝壳、染料和药物。
在世界上的很多文化中,软体动物很长时间以来是一个具有医疗效果的产物的来源。
尽管有一些软体动物被壳,但大多数软体动物基本上都有柔软部分,且部分物种营滤食生活需大量接触含有细菌和微生物的海水,使其易于受到捕食者和病原体的侵害。
然而,软体动物像所有无脊椎动物一样,没有获得性免疫。
这表明软体动物必须发展替代防御策略,来保护自己免受微生物的侵袭。
中国南沙群岛卡拉凹顶藻化学成分研究

中国南沙群岛卡拉凹顶藻化学成分研究
钟永利
【期刊名称】《高等学校化学学报》
【年(卷),期】1996(17)2
【摘要】中国南沙群岛卡拉凹顶藻化学成分研究钟永利,苏镜娱,曾陇梅,阎素君,罗秉浩(中山大学化学系,广州,510275)关键词红藻,卡拉凹顶藻,木糖甙,β-十六烷基-D-吡喃木糖甙,胆甾醇凹顶藻(Laurencia)含有非常丰富的次生代谢产物,主要包括萜类和含...
【总页数】1页(P249)
【作者】钟永利
【作者单位】不详;不详
【正文语种】中文
【中图分类】Q949.2
【相关文献】
1.温州南麂海域冈村凹顶藻化学成分研究 [J], 赵凤;尹健;黄可新
2.瘤状软骨凹顶藻化学成分研究 [J], 苏华;朱校斌;袁兆慧;李敬;郭书举;韩丽君;史大永
3.凹顶藻属海藻化学成分研究进展 [J], 史大永;贺娟;许凤;袁兆慧;范晓;石建功;韩丽君
4.三列凹顶藻化学成分研究Ⅱ [J], 孙杰;韩丽君;杨润亚;史大永;袁兆慧;石建功
5.三列凹顶藻化学成分研究 [J], 孙杰;韩丽君;史大永;范晓;杨永春;石建功
因版权原因,仅展示原文概要,查看原文内容请购买。
《中国常见海洋红藻超微结构》内容简介

《中国常见海洋红藻超微结构》内容简介
佚名
【期刊名称】《上海水产大学学报》
【年(卷),期】2004(13)1
【总页数】1页(P40-40)
【关键词】《中国常见海洋红藻超微结构》;书评;海洋植物;红藻门;电子显微镜【正文语种】中文
【中图分类】Q949.29;G236
【相关文献】
1.三丁基锡对中国近海常见海洋微藻的毒性效应 [J], 谢永红;苏荣国;张丽笑;张传松;王修林
2.中国海洋红藻门新分类系统 [J], 丁兰平;黄冰心;王宏伟
3.中国海洋红藻——御前凹顶藻Laurencia Omaezakiana Masuda的形态与结构特征 [J], 丁兰平;黄冰心;曾呈奎;
4.中国海洋红藻——御前凹顶藻 Laurencia Omaezakiana Masuda的形态与结构特征 [J], 丁兰平;黄冰心;曾呈奎
5.中国海洋仙菜科(Ceramiaceae)新记录属——盖氏藻属Gayliella(红藻门)的分类研究 [J], 王艺晓; 姜晶晶; 丁兰平; 黄冰心; 刘美媛; 马鑫
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
两种中国凹顶藻属(Laurencia)海藻的化学成份及其生物活性
研究
凹顶藻属(Laurencia)海藻系红藻门,红藻纲,仙菜目,松节藻科,主要分布于热带和亚热带海域的低潮线附近及深海区,全球约135种,其中我国海域已查明的有31种。
凹顶藻属海藻富含结构新颖并具显著生物活性的次级代谢产物。
这些次级代谢产物按结构类型可分为C15乙酸原类、倍半萜、二萜、三萜、生物碱及甾体等六种类型,其中倍半萜和C15乙酸原类最为常见,该两类分子以卤代著称,并具有显著的抗菌、杀虫和细胞毒等多方面的生物活性。
在寻找具有生物活性的次级代谢产物过程中,我们对采集于中国浙江省南麂岛海域的冈村凹顶藻(L. okamurai)和复生凹顶藻(L. composite)进行了系统的化学成分及其生物活性研究。
两种新鲜凹顶藻属海藻样品分别用酒精提取,所得浸膏经乙醚萃取后用硅胶柱层析、凝胶Sephadex LH-20柱层析以及反相高效液相色谱(RP-HPLC)等多种层析方法共分离得到80单体化合物(6个化合物在2种凹顶藻中均分离得到),包括:68个倍半萜、5个二萜、1个三萜、5个脂肪酸类和1个甾体类。
化合物的结构及相对构型是在光谱学分析[核磁共振谱(NMR)、质谱(MS)、紫外光谱(UV)、红外光谱(IR)和旋光]、化学沟通及与报道的已知化合物数据比较的基础上确定的;其中1个得到了单晶X-衍射实验的证实;化合物的绝对构型是通过单晶x-衍射、化学转化及相应的生源途径确定的。
在这些化合物中,共发现了31个新结构化合物和1个新天然产物。
从冈村凹顶藻(L. okamurai)中共分离得到44个化合物,其中新结构化合物10个。
这些新化合物结构类型包括:7个倍半萜[4个月桂烷型3a-hydroperoxy-3-epiaplysin (1-11)、3β-hydroperoxyaplysin (1-13)、laurepoxyene (1-22)、
8,14-dibromoaplysin(1-23)、1个没药烷型(5S)-5-acetoxy-β-bisabolene (1-26)、1个laurokamurane型laurokamurene D(1-24)以及1个
seco-laurokamurane型seco-laurokamurone(1-25)、1个倍半萜二聚体isolaurebiphenyl(1-32)以及2个脂肪酸类(1-39、1-40)。
有意思的是,我们从中发现了1个新骨架类型倍半萜
seco-laurokamurone(1-25),该倍半萜骨架我们命名为seco-laurokamurane型。
在生源关系上,我们推测seco-laurokamurane型倍半萜骨架来源于laurokamurane型倍半萜骨架的氧化开环。
倍半萜laurokamurene D(1-24)的结构极不稳定,在NMR谱测试过程中发生了降解,部分转化成了化合物
seco-laurokamurone (1-25),而令人感兴趣的是,这一转化证实了我们的推断。
另外,laurokamurene D (1-24)是从自然界发现的第四个laurokamurane型倍半萜。
从复生凹顶藻(L. composite)中共发现了42个化合物,其中21个新化合物和1个新天然产物均为倍半萜类。
这些新倍半萜骨架类型包括:19个恰米烷型(2-3,2-5-2-7,2-9,2-11,2-14,2-18,2-21,2-24,2-26-2-33),2个没药烷型(2-34、2-35)和1个金合欢烷型(2-38)。
本次研究首次从天然界发现了4个C-10位羰基取代的恰米烷型倍半萜:laurencompositones A-C (2-26-2-28)和laurencompositone E(2-33)以及2个C-9位氯原子取代的恰米烷型倍半萜hemicompositol A (2-3)和dichloride pacifiene (2-4)。
有意思的是,我们还从该藻中首次发现了3个C-10位具有半缩酮结构的恰米烷型倍半萜hemicompositols A-C(2-3、2-7、2-9),其中倍半萜hemicompositol A (2-3)的结构得到了X-单晶衍射实验的证实;由于以往文献报道的同类恰米烷型倍半萜C-10位均为溴杂缩酮结构,因此该发现对今后该类
倍半萜的结构鉴定起着重要的启示作用。
此外,我们还从该藻中发现了1个金合欢烷型倍半萜2-38,这是首次从海藻中发现该类型倍半萜。
既往文献表明,凹顶藻属海藻中所发现的倍半萜类化合物具有显著的抗真菌、抗病毒及抗细菌活性。
因此,我们对从冈村凹顶藻(L. okamurai)中分离得到的化合物进行了抗细菌(金黄色葡萄球菌和铜绿假单孢菌)、抗真菌(新隐球菌,红色毛癣菌,烟曲霉菌和光滑假丝酵母菌)和抗肿瘤(人肺癌细胞A549和人白血病细胞
HL60)的活性筛选。
结果表明,化合物1-17对金黄色葡萄球菌具有显著的抑菌活性(MIC80 2.30μg/mL),而化合物1-18对金黄色葡萄球菌显示了中等强度的抑制作用(MIC80 10.50μg/mL);化合物1-2、1-9、1-17、1-22、1-27和1-32对光滑假丝酵母菌具有不同程度的抑制作用;化合物1-10、1-17、1-18、1-19和1-29对人白血病细胞株HL60具有细胞毒作用,化合物1-17、1-18、1-19和1-28对人肺癌细胞株A549显示了细胞毒作用。
从复生凹顶藻(L. composite)中分离得到的化合物的抗真菌、抗细菌和抗肿瘤活性测试正在进行中。
